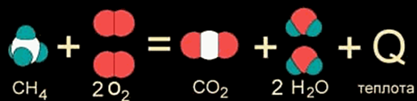
В уроке 21 «Теплота образования» из курса «Химия для чайников» рассмотрим что такое теплоты образования и откуда их брать; выясним, какие условия считаются стандартными, а также различия простых и сложных веществ; для закрепления полученных знаний решим пару задач, где используются теплоты образования и закон аддитивности теплот реакций. Будет неплохо, если перед прочтением данного урока, вы изучите материал про изменение энтальпии, а также про теплоты сгорания.
Благодаря закону Гесса (закону аддитивности теплот реакций) нам совсем не нужно считать теплоты всех реакций; достаточно иметь сведения о теплОтах лишь того минимума реакций, из которых можно получить все остальные. Подобный минимум, принятый всеми учеными и инженерами, представляет собой теплоты образования соединений из входящих в них чистых элементов в стандартных состояниях. А что же такое: стандартные состояния?
Стандартное состояние вещества
Для кристаллических и жидких веществ стандартное состояние определяется как наиболее распространенная форма элемента при 25°С (298 К*) и внешнем давлении 1 атмосфера (атм); стандартное состояние газов определяется аналогичным образом, но при парциальном** давлении 1 атм. Вот например, стандартным состоянием углерода считается графит, а не алмаз.
* Кельвин (обозначение «К») – еще один показатель измерения температуры, наряду с Цельсия. Пока вам просто следует запомнить, что 0°С = 273 К, соответственно 1°С = 274 К, -1°С = 272 К, а -273°С = 0 К. Самой низкой температурой считается 0 К и называется абсолютным нулем.
** Парциальное давление — это давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре.
Простые и сложные вещества
Все вещества можно разделить на две обширные группы — простые и сложные вещества.
Простые вещества — это вещества, образованные из атомов одного элемента. Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Сложные вещества (химические соединения) — это вещества, образованные атомами разных элементов. Так, оксид меди CuO образован атомами элементов меди Cu и кислорода O, вода H2O — атомами элементов водорода H и кислорода O.
Теперь вы понимаете различия простых веществ от сложных. Так вот, теплота образования простых веществ всегда равна нулю. Это, пожалуйста, запомните.
Стандартные теплоты образования
Вспомним прошлый урок, где мы пытались синтезировать алмаз. Теплоты образования всех веществ, участвующих в этом синтезе таковы:
- C(графит) + 2H2(г.) → CH4(г.) ΔH = -74,8 кДж (1)
- C(графит) → C(алмаз) ΔH = +1,9 кДж (2)
- H2(г.) + ½O2(г.) → H2O(ж.) ΔH = -285,8 кДж (3)
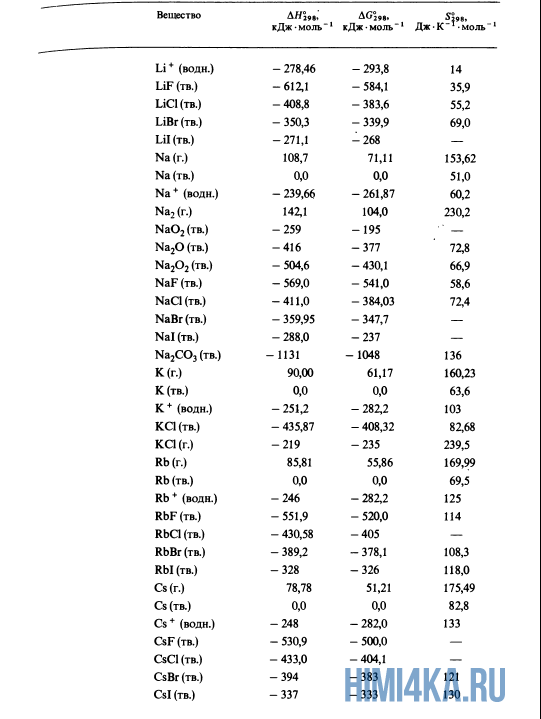
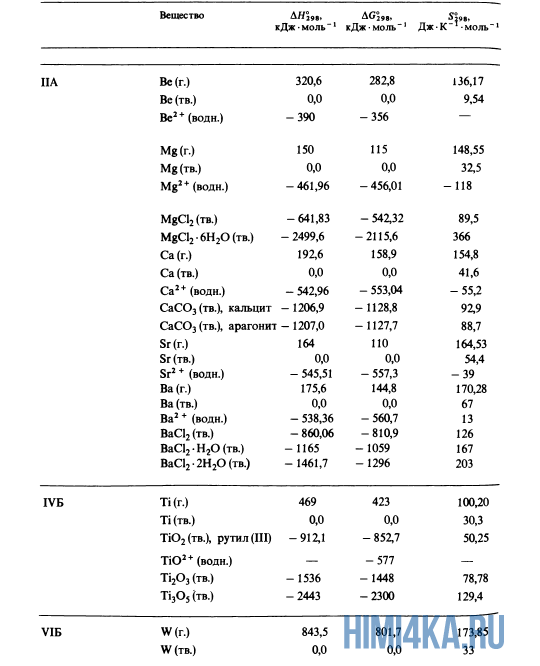
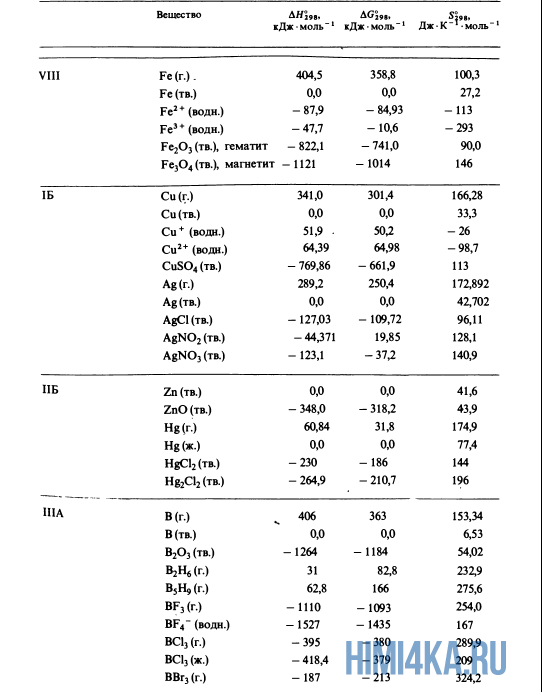
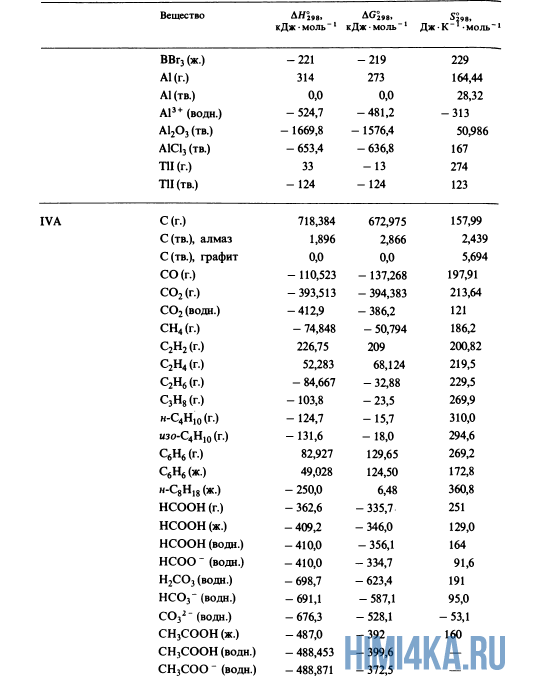
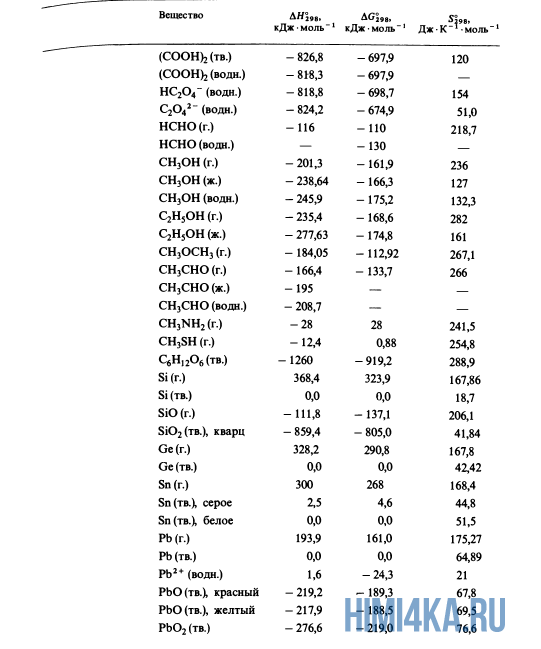
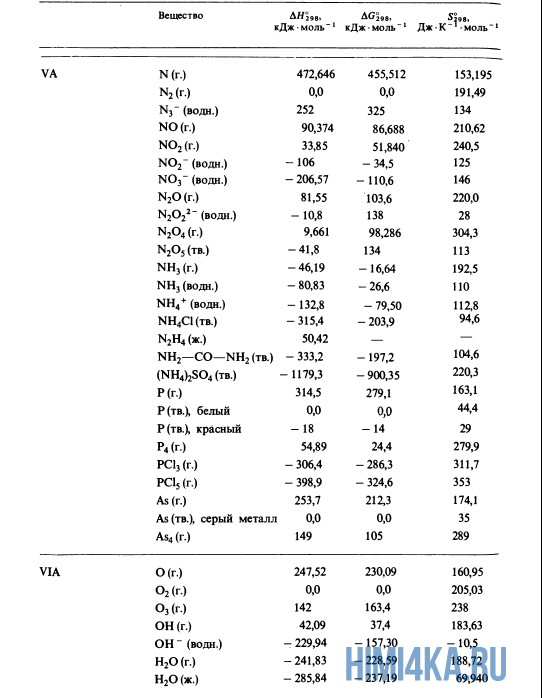
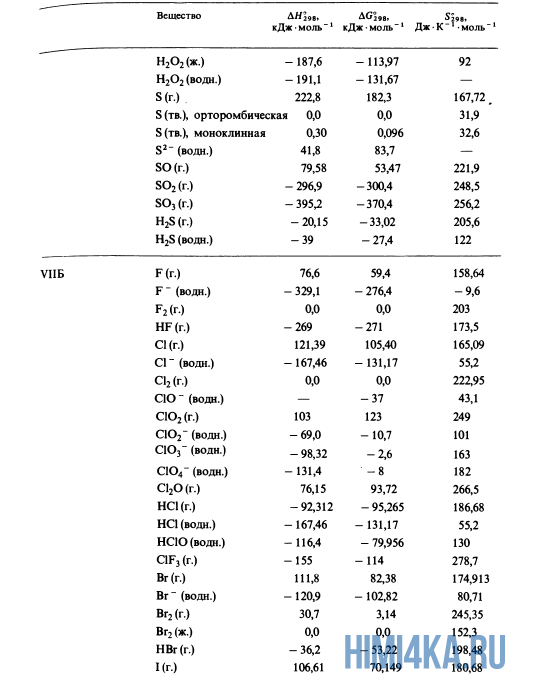
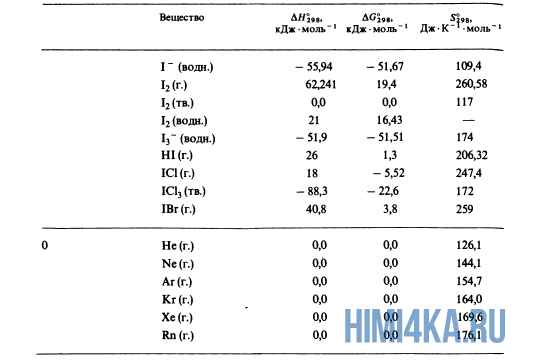
Как уже было отмечено выше, O2 относится к простым веществам, поэтому его теплота образования равна нулю. Таблицы стандартных теплот образования ΔH°298 соединений из чистых элементов приведена ниже под спойлером. В этой таблице нижний индекс 298 обозначает комнатную температуру (298 К = 25°С), а верхний индекс (знак градуса) означает, что реагенты и продукты находятся в своих стандартных состояниях. Однако не обязательно пользоваться записью ΔH°298, достаточно лишь написать ΔH.
Сейчас, на примере старой и доброй реакции (4) получения алмаза путем окисления метана, я покажу вам, как по теплотам образования веществ можно определить теплоту общей реакции. Это уравнение можно получить суммированием уравнения (2) с удвоенным уравнением (3) и обращенным уравнением (1):
- C(графит) → C(алмаз) ΔH = +1,9 кДж (2)
- 2H2(г.) + O2(г.) → 2H2O(ж.) ΔH = -571,6 кДж 2×(3)
- CH4(г.) → C(графит) + 2H2(г.) ΔH = +74,8 кДж -(1)
В итоге получаем:
- CH4(г.) + O2(г.) → C(алмаз) + 2H2O(ж.) ΔH = -494,9 кДж (4)
Теплота реакции вычисляется точно таким же способом, просто из теплот образования продуктов реакции вычитаем теплоты образования реагентов, учитывая все коэффициенты:
- ΔH = (+1,9) + 2(-285,8) — (-74,8) = -494,9 кДж
У кого возник вопрос, почему же мы не вычитаем теплоту образования кислорода, ответ ищите в таблице теплот образования.
Очевидно, что при таких вычислениях следует быть очень внимательным к знакам и коэффициентам. Чтобы не допустить ошибки, настоятельно рекомендую вам выписывать отдельно каждое уравнение с соответствующей теплотой реакции в таком виде, чтобы сумма всех индивидуальных уравнений давала требуемую реакцию. Если все коэффициенты какого-либо уравнения умножены на произвольное число n, на это же число n должна быть умножена соответствующая теплота образования, а если используется обращенное уравнение реакции образования, то следует изменить свой знак перед табличной величиной ΔH. Когда индивидуальные уравнения суммируются для получения требуемой реакции, сумма индивидуальных теплот образования дает искомую теплоту реакции. А теперь закрепим полученные знания примерами.
Пример 1. Чему равна стандартная теплота реакции восстановления оксида трехвалентного железа Fe2O3 углеродом С до железа Fe и моноксида углерода O, протекающей в доменной печи?
Решение:
Запишем уравнение реакции, указав под каждым веществом его стандартную теплоту образования:
- Fe2O3(тв.) + 3C(графит) → 2Fe(тв.) + 3CO(г.)
- -822,1 0,0 0,0 -110,5 ΔH, кДж·моль-1
Стандартная теплота образования простых элементов (С и Fe) по определению равна нулю. Стандартная теплота рассматриваемой реакции равна:
- ΔH° = 2(0,0) + 3(-110,5) — (-822,1) — 3(0,0) = +490,6 кДж
Как видите, изменение энтальпии положительно, а значит реакция эндотермическая (поглощается тепло). Полученный результат согласуется с известным фактом, что при восстановлении железной руды до свободного железа необходимо подводить к реакционной системе большое количество теплоты. Отметим, однако, что 490,6 кДж — это теплота, которая поглощалось бы, если бы реакция проводилась при 298 К, а не при 1800 К, как это происходит в доменной печи. Получается, что наше решение неверно? Нет, оно абсолютно верно, просто тепловой эффект (+490,6 кДж) следует рассматривать как телоту, поглощаемую при нагревании оксида железа (III) и углерода от 298 до 1800 К, последующей реакции между ними и охлаждением снова до комнатной температуры 298 К. Изменение энтальпии, или теплота реакции, зависит только от исходного и конечного состояний участников реакции, а нет от того, остается ли температура постоянной или поднимается до уровня, достигаемого в доменной печи, и затем опускается снова. Важно лишь то, что в конце процесса, как и в его начале, температура имеет значение 298 К. Еще раз повторяю, ибо это очень важный момент: Когда мы ссылаемся на теплоты реакции и утверждаем, что полученные значения относятся к процессу, проводимой «при давлении 1 атм и 298 К», требуется только, чтобы реакция начиналась при этих условиях и продукты были приведены к этим условиям (1 атм и 298 К).
Пример 2. Определите теплоту сгорания жидкого бензола.
Решение:
Запишем полное уравнение реакции с указанием теплот образования всех участвующих в нем веществ:
- 2C6H6(ж.) + 15O2(г.) → 12CO2(г.) + 6H2O(ж.)
- +49 0,0 -393,5 -285,8 ΔH, кДж·моль-1
Теплота этой реакции, как она записана (с 2 молями бензола), равна:
- ΔH = 12(-393,5) + 6(-285,8) — 2(+49,0) — 15(0,0) = -6540 кДж
Следовательно, теплота сгорания 1 моля бензола должна быть равна половине этой величины, т.е. -3270 кДж·моль-1.
Надеюсь урок 21 «Теплота образования» был не скучным. Если у вас возникли вопросы, пишите их в комментарии.
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
C + O2 = CO2 + Q
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
2KNO3 → 2KNO2 + O2 – Q
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
4NH3 + 3O2 → 2N2 + 6H2O + Q
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения. Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
2Аl + 3/2О2 → Аl2О3 + 1675 кДж
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
4Аl + 3О2 → 2Аl2О3 + 3350 кДж
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
СН4 + 2О2 → СО2 + 2Н2О + 802 кДж
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
N2 + O2 → 2NО – 180 кДж
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
m (H2O)=108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
S(ромб) + O2(г) = SO2(г) + 296 кДж,
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Q = 740 кДж.
Ответ: выделится 740 кДж теплоты.
ЭЛЕМЕНТЫ ТЕРМОХИМИИ
Термохимия – раздел химии, в котором рассматриваются тепловые явления, происходящие в процессе химических реакций.
Нужен репетитор по химии? Записывайтесь на занятия в каталоге TutorOnline!
Все химические реакции можно разделить на два типа: реакции, идущие с выделением теплоты, их называют экзотермические, и реакции, идущие с поглощением теплоты эндотермические. Критерием таких процессов является тепловой эффект реакции.
Как правило, к экзотермическим реакциям относятся реакции окисления, т.е. взаимодействия с кислородом, например сгорание метана
СН4 + 2O2 = СО2 + 2Н2О + Q (1)
а к эндотермическим реакциям – реакции разложения. Знак Q в конце уравнения указывает на то, выделяется ли теплота в процессе реакции (+ Q) или поглощается (- Q):
СаCO3 = СаO + CO2 -Q (2)
При химических процессах может выделяться или поглощаться не только тепловая, но и другие виды энергии: электрическая, световая, механическая и др.
Тепловые эффекты прямой и обратной реакций одинаковы по числу, но противоположны по знаку, например, оксид кальция (СаО) при взаимодействии с водой образует гидроксид кальция (Са(ОН)2). Процесс сопровождается выделением большого количества теплоты:
СаО + Н2О = Са(ОН) + 108 кДж (3)
А реакция разложения гидроксида кальция (Са(ОН)2) осуществляется с поглощением такого же количества теплоты извне
Са(ОН)2 = СаО + Н2О — 108 кДж (4)
Если тепловой эффект реакции определяется при постоянном давлении, температуре, то он будет соответствовать стандартной энтальпии реакции, обозначаемой ∆Н, которая противоположна по знаку величине теплового эффекта реакции. Например, если в процессе экзотермической реакции во взаимодействие вступают алюминий (Аl) и оксид железа (Fe2O3), то в конце уравнения это обозначится следующим образом:
2Аl + Fe2O3 = 2Fe + Al2O3 (+Q) или (-∆Н) (5)
А в случае эндотермической реакции значения этих тепловых величин будут иметь противоположные знаки:
С + СО2 = 2СО (-Q) или (+∆Н) (6)
Это объясняется тем, что выделяющаяся в процессе экзотермической реакции теплота как энергия, теряется системой (-∆Н), а при эндотермических процессах, наоборот – приобретается (+∆Н). Величина (Н) называется энтальпией системы. Часто её называют так же теплосодержанием или теплотой образования ∆Н данного вещества. В расчётах применяют справочные значения тепловых эффектов образования (или сгорания) одного моля вещества, отнесённые к 298К (250С) и Р = 101,325 кПа (1 атм). Эти условия считаются стандартными и поэтому используемые значения тепловых эффектов называют стандартными теплотами образования(или сгорания) вещества и обозначают как ∆Н0298. Например, тепловой эффект реакции взаимодействия графита с кислородом, выраженный через изменение энтальпии, следует записать как ∆Н0298 = — 393,6 кДж, а так как при этом из простых веществ образуется 1 моль СО2, то данный тепловой эффект является теплотой образования СО2, выраженной в кДж/моль. Главной характеристикой топлив являются их теплоты сгорания. Тепловой эффект реакции горения одного моля вещества называется теплотой сгорания данного вещества. Следовательно, исходя из вышеприведённых положений, теплота сгорания одного моля графита (12 г) составляет 393,6 кДж/моль.
Уравнение химической реакции, в котором указан тепловой эффект, называется термохимическим уравнением.
На практике это имеет большое значение. При строительстве тепловых трасс, доменных печей, котельных и т.п. теплотопотребляющих промышленных объектов, необходимо предусмотреть или приток энергии для поддержания процессов, или наоборот, отвод избытка теплоты, чтобы не было перегрева вплоть до взрыв
Расчёт теплового эффекта реакции между простыми веществами не предоставляется затруднительным. Например, для реакции образования хлористого водорода:
Н2 + Cl2 = 2НCl (7)
Энергия затрачивается на разрыв двух химических связей Н–Н и Cl — Cl. При этом энергия выделяется при образовании двух химических связей Н- Cl. Значения энергий этих связей можно найти в справочных таблицах и по разности между ними определить тепловой эффект (Q) реакции (7):
ЕН–Н = 436 кДж/моль, ЕCl–Cl = 240 кДж/моль,
ЕН–Cl = 240 кДж/моль,
Q = 2 х 430 — ( 1 х 436 — 1 х 240 ) = 184 кДж.
Приведённая в качестве примера термохимическая реакция (7) является экзотермической. Теплоты образования простых веществ при стандартных условиях приняты равными нулю.
Термохимические уравнения имеют особую форму записи. Они отличаются от обычных уравнений тем, что:
1). В термохимических уравнениях обязательно указывают агрегатные состояния веществ (жидкое, твёрдое, газообразное) Это связано с тем, что одна и та же реакция может иметь различный тепловой эффект в зависимости от фазового состояния вещества
2). Коэффициенты в термохимическом уравнении равны количеству веществ ( в молях), вступивших в реакцию. Например, дана реакция сгорания ацетилена:
2С2Н2(г) + 5О2(г) = 4СО2(г) + 2Н2О (+Q) (8)
При сгорании одного моль ацетилена С2Н2 выделяется 1257кДж теплоты. Поэтому, относительно одного моль С2Н2 необходимо все коэффициенты перед реагентами поделить на 2, тогда получим следующую запись термохимического уравнения:
С2Н2 + 5/2О2 = 2СО2 + Н2О + 1257 кДж (9)
Или другая тождественная запись:
С2Н2 + 2,5О2 = 2СО2 + Н2О + 1257 кДж (10)
Например, дано термохимическое уравнение сгорания метана:
СН4 + 2О2 = СО2 + 2Н2О + 802 кДж (11)
Необходимо вычислить, какое количество теплоты выделится при сгорании 20 г метана?
Поскольку 1 моль метана имеет массу 16 г, а 20 г метана соответственно составляют
n = m/Mr = 20:12 = 1,25 моль,
то, составив пропорцию: при сгорании
1 моль СН4 выделяется 802 кДж теплоты
1,25 СН4 ———«——-Х кДж теплоты
Определим, что на сгорание 20г метана потребуется
Х = 1,25 х 802 / 1 = 1002,5 кДж
Приведём другой пример . Дано уравнение реакции сгорания оксида азота(+4):
4NО2(г) + O2(г) + 2H2O(г) = 4НNО3(ж) + 448 кДж (12)
Необходимо составить термохимическое уравнение относительно сгорания одного моль оксида азота. Определить: какой объём оксида азота потребуется на образование 4258 кДж теплоты в процессе данной реакции?
Для составления термохимического уравнения относительно одного моль оксида азота(+4) необходимо все коэффициенты, стоящие перед реагентами, разделить на коэффициент, стоящий перед NО2, т.е. на «4», тогда уравнение примет вид:
NО2(г) + 1/4O2(г) + 1/2H2O(г) = НNО3(ж) +112 кДж (13)
В уравнении изменится количество выделяющейся теплоты, оно станет равным 112, т.е. в четыре раза меньше, чем в приведённом уравнении. В соответствии с уравнением (13) 1 моль оксида азота(NО2) или 22,4 л в данной реакции образует 112 кДж теплоты, а Х л соответственно 4258 кДж:
22,4 моль NО2 при сгорании образуют 112 кДж теплоты.
Х л —————-«————-4258 кДж теплоты.
Хг = 22,4 х 4258 / 112 = 851,6 кДж
Важнейшим законом термохимии является закон Г.И.Гесса (1840): тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса. При помощи закона Гесса можно рассчитывать такие тепловые эффекты реакции, которые измерить трудно или невозможно. Например, теплоту образования угарного газа(СО) можно вычислить, если полное сгорание углерода
С (графит) + О2 = СО2 (∆Н1) (14)
разбить на стадии:
С (графит) + 0,5О2 = СО (∆Н2) (15)
СО + 0,5О2 = СО2 (∆Н3) (16)
Зная, что ∆Н1 = -393,6 кДж/моль и ∆Н3 = — 283,1 кДж/моль, из равенства ∆Н1 = ∆Н2 + ∆Н3
находим, что ∆Н2 = — 110,5 кДж/моль.
В качестве другого примера можно привести образование сульфата алюминия при сгорании алюминия и серы ромбической согласно реакции:
2Al(к) + 3S(ромб) + 6О2(г) = Al2(SO4)3(к) (17)
∆Н может быть найдена по тепловым эффектам отдельных стадий:
2Al + 1,5О2 = Al2O3 ∆Н1= -1670,2 кДж/моль (18)
3S + 1,5О2 = SO3 ∆Н2= -395,3 кДж/моль (19)
Al2O3 + 3SO3 = Al2(SO4)3 ∆Н3= -579,7 кДж/моль (20)
Тогда ∆Н = ∆Н1 + 3∆Н2 + ∆Н3 = (- 1670,2) – 3х (-395,3) – (579,7) = — 3435,8 кДж/моль.
На основании закона Гесса термохимические уравнения можно разбивать на отдельные стадии независимо от того, осуществимы они на практике или нет. Из закона Гесса вытекает важное следствие: тепловой эффект химической реакции равен сумме теплот образования получающихся веществ за вычетом суммы теплот образования исходный веществ:
∆Н = ∑ (𝘮 ∆Н) продукты — ∑ (𝘯 ∆Н) реагенты,
где 𝘮 и 𝘯 – число молей каждого вещества в уравнении реакции. Например, теплоту сгорания ацетилена (10) можно рассчитать, зная теплоты образования С2Н2 , СО2 и Н2О (∆Н002 = 0), как ∆Н0 = 2 ∆Н СО2 + ∆НН2О — ∆НС2Н2 = -2 х 393,6 — 281 — (+226,8) = -1295 кДж/моль.
НАЧАЛА ТЕРМОДИНАМИКИ
Среди многообразия химических реакций, термохимические занимают особое положение. Если рассуждать с точки зрения эволюции жизни на Земле, то в конечном итоге, действительно, от этих процессов зависит жизнь на нашей планете. А что касается человеческой цивилизации в целом, то здесь мы имеем прямую зависимость её развития от термохимических явлений. Ведь благодаря именно данным процессам произошёл отрыв человечества в развитии от всех других видов живых организмов, населяющих нашу планету. С древнейших времён, начиная от пассивного использования огня в качестве средства для согревания и приготовления примитивной пищи, человечество пришло к активному использованию этого явления (изготовление гончарных изделий – плавка меди, железа и других металлов – паровые двигатели – двигатели внутреннего сгорания – управление ядерными реакциями)
Если можно было бы предложить создать проект монумента человеческому прогрессу, то на его фронтоне надо было бы начертать уравнение химической реакции
С + О2 = СО2
Именно со сгорания дров, угля, торфа начался отсчёт человеческой цивилизации. В настоящее время наше с вами существование просто немыслимо без тепловых процесов. Но кроме приведённой выше реакции существует великое множество других термодинамических процессов. Почему именно углероду дано такое предпочтение? Может быть его собрату по IV-й группе – кремнию более выгоден данный процесс?
Si + О2 = SiО2
Тем более, что кремний по массе составляет 27,6% земной коры. Это несравненно больше, чем запасы древесины и её ископаемых на нашей планете. Чего же проще? Кидай в топку кремнезём! Его ведь целая планета! Правда надо оговорить тот факт, что чистого кремния в природе не существует. В наличии только его оксид — SiО2. Но на то и химики, чтобы придумать что-нибудь? А может быть для более сильного окислителя, чем кислород – фтору окисление углерода более выгодно термодинамически?
C + 2F2 = СF4
Как во всём этом разобраться? И возможно ли вообще предсказать осуществления того или иного процесса, ведь на бумаге можно написать уравнение любой химической реакции, а возможна ли она практически? Придётся начинать всё по порядку.
Одним из самых важных и очевидных законов природы является закон сохранения энергии: энергия не возникает из ничего и не исчезает бесследно, она только переходит из одной формы в другую. Аналогичным является закон сохранения массы вещества: массы веществ вступивших в реакцию равны массам веществ, образовавшихся в процессе данной реакции.
Поэтому и при экзотермической и при эндотермической обратимых реакциях одного и того же процесса как количество затрачиваемой и расходуемой энергии равны, но противоположны по знаку, так и массы веществ распадающихся и вновь образующихся равны:
СаО + Н2О = Са(ОН)2 + 108 кДж
Mr=56 Mr=18 Mr=74
Са(ОН)2 = СаО + Н2О — 108 кДж
Mr=74 Mr=56 Mr=18
Но всё дело в том, что в приведённых выше двух реакциях уже указано, какая из них экзотермическая, а какая эндотермическая. А можно ли так, как говорится «на вскидку» по одному только уравнению реакции определить: какая это реакция? В принципе, в большинстве случаев, возможно. К экзотермическим реакциям, в основном, относятся реакции соединения и как их разновидность – реакции окисления.(8,11,12,14). А к реакциям эндотермическим, соответственно – реакции разложения (2,4). Ещё раз уточним: в большинстве случаев. Поскольку реакция окисления:
0,5N2 + 0,5O2 = NО — 90 кДж
требует расхода энергии и является эндотермической, а реакция разложения нитрата натрия
2NaNO3 = 2NaNO2 + O2 (+Q)
осуществляется с выделением большого количества теплоты и является экзотермической.
Значит, принцип «на вскидку» не годится. Но каким же принципом тогда следует руководствоваться в определении реакций данного типа? В приводимых выше примерах (10), (14-20) указывалось, что стандартные теплоты образования веществ (∆Н) являются справочными данными. Такие данные скрупулёзно составлялись на протяжении десятилетий для многочисленных термодинамических реакций. С этой целью использовался прибор калориметр. Именно по этим данным в настоящее время мы можем установить, какой является та или иная реакция: экзотермической или эндотермической.
Теперь попробуем заглянуть как бы внутрь термохимической реакции. Как она начинается? Что способствует её осуществлению? В качестве примера приведём ещё раз две реакции (14) и (2):
С(графит) + О2 = СО2 + 393,3 кДж
СаСО3 = СаО + СО2 (-Q)
Представим себе, что химическими символами (С) и (О2) будут обозначаться не элемент «углерод» и простое вещество «кислород», а дрова (или уголь, торф) и воздух (атмосфера). А в качестве соединения СаСО3 — не карбонат кальция, а известное всем вещество: мел (или известняк). Первую реакцию будем проводить для того, чтобы нагреть печь и вскипятить чайник, а вторую – чтобы получить негашёную известь (СаО) в дальнейшем используемую для побелки садовых деревьев. Для разжигания печи приготовим щепки и, поместив сверху них дрова, зажжём огонь спичками.
Во втором случае, поместим в металлическое ведро мелко накрошенный мел, поставим на плиту и такими же действиями, как в случае разжигания огня в печи, разведём костёр под ведром.
Стоп! Тут что-то не так! Ведь мы установили, что первая реакция экзотермическая, протекает с выделением теплоты, а вторая реакция – эндотермическая, протекает с поглощением теплоты. А мы в обоих случаях разводим огонь, т.е. передаём этим процессам извне тепловую энергию. Значит, обе реакции эндотермические – идут с поглощением теплоты! Да, идут с поглощением теплоты, но это только на первом этапе. Некоторым экзотермическим реакциям требуется небольшой «толчок» — первоначальная подача энергии, а спустя некоторое время, когда загорятся дрова, процесс будет сопровождаться с выделением энергии в окружающую среду и во многие сотни, тысячи раз превзойдёт по величине первоначальное значение этой энергии. А второй процесс ка был так и останется эндотермическим. Ведь с прекращением подачи тепловой энергии мел перестанет разлагаться: реакция остановится. И всё-таки, почему в одних случаях процесс окисления (горения) является экзотермическим, а в других – эндотермическим процессом? И что является движущей силой эндотермических реакций, в ходе которых тепловая энергия поступает из окружающей среды? Ни у кого не вызывает удивление такое явление, как остывание со временем горячего чайника. Это нормально. А почему бы этому же чайнику, уже остывшему, холодному, взять, да и нагреться самому по себе? Вот это уже вызовет удивление.
Так вот, эта самая сила связана со стремлением любой системы к наиболее вероятному состоянию, характеризующимся максимальным беспорядком, называемым энтропией. Это одно из важнейших понятий в термодинамике. Энтропия обозначается символом «S». К примеру, при экзотермических реакциях, при проведении процессов плавления, кипения, переходов из жидкостей к газообразному состоянию, энтропия приобретает максимальное значение, поскольку при тепловых явлениях кинетическая энергия атомов, молекул, ионов возрастает, усиливаются беспорядочные колебания этих частиц. И наоборот, самый большой порядок в химических системах – в идеальном кристалле при температуре абсолютного нуля. Энтропия в данном случае равна нулю
Энтропия имеет численные значения, единицей её измерения является Дж/(моль . К); К примеру энтропия алмаза равна 2,4 Дж/(моль . К), пропана – 269,9 Дж/(моль . К). Энтропия газов значительно превышает энтропию жидких и тем более твёрдых тел. Поскольку в газообразных веществах постоянно происходит беспорядочное распределение молекул по всему объёму.
Существуют экспериментальные и теоретические методы определения энтропий различных химических соединений. Используя их, можно количественно рассчитать изменения энтропии при протекании конкретной реакции аналогично тому, как это делается для теплового эффекта реакции. Составлены специальные справочные данные, которые включают сравнительную характеристику этих величин с учётом температуры.
Подтянуть знания по химии можно записавшись на урок к онлайн-репетиторам TutorOnline
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Расчет стандартных тепловых эффектов химических реакций по стандартным теплотам образования веществ, участвующих в реакции
Стандартной
теплотой образования (энтальпией
образования) вещества
называется энтальпия реакции образования
1 моля этого вещества из элементов
(простых веществ, то есть состоящих из
атомов одного вида), находящихся в
наиболее устойчивом стандартном
состоянии. Стандартные энтальпии
образования веществ
(кДж/моль) приводятся в справочниках.
При использовании справочных значений
необходимо обращать внимание на фазовое
состояние веществ, участвующих в реакции.
Энтальпия образования наиболее устойчивых
простых веществ равна 0.
Следствие
из закона Гесса о расчете тепловых
эффектов химических реакций по теплотам
образования:
стандартный
тепловой
эффект химической реакции равен разности
теплот образования продуктов реакции
и теплот образования исходных веществ
с учетом стехиометрических коэффициентов
(количества молей) реагентов:
.
(1.17)
П р и м
е р 1.2. Рассчитать стандартный тепловой
эффект и изменение внутренней энергии
при прохождении
следующей реакции при P
= const:
CH4
+ 2 CO = 3 C(графит)
+ 2 H2O.
газ газ
тв. газ
Теплоты образования веществ в указанных фазовых состояниях приведены в табл. 1.2.
Таблица 1.2
Теплоты образования веществ
|
Вещество |
CH4 |
CO |
C |
H2O |
|
Количество |
1 |
2 |
3 |
2 |
|
|
–74,85 |
–110,53 |
0 |
–241,81 |
Р е ш е
н и е
Так
как реакция проходит при P
= const,
то стандартный тепловой эффект находим
в виде изменения энтальпии по известным
теплотам образования по следствию из
закона Гесса (формула (1.17):
ΔНо298
= { 2 · (–241,81) + 3·0} – {–74,85 + 2 · (–110,53)} =
–187,71 кДж = = –187710 Дж.
ΔНо298
<
0,
реакция является экзотермической,
протекает с выделением теплоты.
Изменение
внутренней энергии находим на основании
уравнения (1.16):
ΔUо298
= ΔHо298
– Δν
· RT.
Для
данной реакции изменений числа молей
газообразных веществ за счет прохождения
химической реакции Δν
= 2 – (1 + 2) = –1; Т
= 298 К, тогда
ΔUо298
= –187710 –
(–1) ·
8,314·
298 = –185232 Дж.
Расчет стандартнвх тепловых эффектов химических реакций по стандартным теплотам сгорания веществ, участвующих в реакции
Стандартной
теплотой сгорания (энтальпией сгорания)
вещества называется
тепловой эффект полного окисления 1
моля данного вещества (до высших оксидов
или специально указываемых соединений)
кислородом при условии, что исходные и
конечные вещества имеют стандартную
температуру. Стандартные энтальпии
сгорания веществ
(кДж/моль) приводятся в справочниках.
При использовании справочной величины
необходимо обратить внимание на знак
величины энтальпии реакции сгорания,
которая всегда является экзотермической
(ΔH
<0 ), а в таблицах указаны величины
.
Энтальпии
сгорания высших оксидов (например, воды
и диоксида углерода) равны 0.
Следствие
из закона Гесса о расчете тепловых
эффектов химических реакций по теплотам
сгорания:
стандартный
тепловой эффект химической реакции
равен разности теплот сгорания исходных
веществ и теплот сгорания продуктов
реакции с учетом стехиометрических
коэффициентов (количества молей)
реагентов:
.
(1.18)
П р и м
е р 1.3. Рассчитать стандартный тепловой
эффект реакции получения этилового
спирта гидратацией этилена по теплотам
сгорания веществ, участвующих в данной
реакции (P=const):
C2H4
+ H2O
= С2Н5ОН.
газ ж
ж
Соседние файлы в папке физическая химия 1
- #
- #
- #
- #
- #
- #
- #
- #
- #
Теплота образования
Qобр.
— это тепловой эффект реакции синтеза (1) моль вещества из простых веществ.
Например, теплота образования оксида азота((II)) равна
−87,5кДж/моль
:
0,5N2(г)+0,5O2(г)=NO(г)−87,5кДж.
Теплота сгорания
Qсгор.
— это тепловой эффект реакции горения (1) моль вещества.
Например, теплота сгорания этана равна
1560кДж/моль
:
C2H6(г)+3,5O2(г)=2CO2(г)+3H2O(г)+1560кДж.
Теплота сгорания и теплота образования определяются при стандартных условиях, т. е. при температуре (25°C) и давлении
101,3кПа
.
Обрати внимание!
Используя теплоту сгорания или образования веществ, можно вычислить тепловой эффект реакции. Для этого от суммы теплоты сгорания (образования) реагентов нужно отнять сумму теплоты сгорания (образования) продуктов.
Определим тепловой эффект реакции дегидрирования этана:
C2H6(г)→C2H4(г)+H2(г).
Теплоту сгорания этана, этилена и водорода возьмём из справочной литературы:
Qсгор.(C2H6)=1560кДж/моль;
Qсгор.(C2H4)=1410кДж/моль;
Qсгор.(H2)=242кДж/моль.
Тепловой эффект дегидрирования этана можно найти, если от теплоты сгорания этана отнять теплоту сгорания этилена и водорода:
Q=Qсгор.(C2H6)−Qсгор.(C2H4)−Qсгор.(H2);
Q=1560−1411−242=−93кДж/моль.
Термохимическое уравнение реакции:
C2H6(г)→C2H4(г)+H2(г)−93кДж.
Понятие об энтальпии реакции
Иногда тепловой эффект реакции указывают, используя энтальпию реакции.
Энтальпия химической реакции
ΔH
— это изменение внутренней энергии участвующих в реакции веществ.
Энтальпия противоположна по знаку тепловому эффекту, т. е. если указано, что
ΔH
(< 0), значит, тепловой эффект реакции положительный ((+Q)), и наоборот, если
ΔH
(> 0), то тепловой эффект реакции отрицательный ((-Q)). Например, уравнение реакции оксида кальция с водой можно записать так:
( = — 65) (кДж/моль)
или так:
CaO(тв)+H2O(ж)=Ca(OH)2(тв)+65кДж.