Download Article
Calculate combustion heat experimentally & with Hess’ Law
Download Article
- Experimentally
- Hess’ Law
- Tips
- Warnings
- Things You’ll Need
|
|
|
|
Calculating the heat of combustion is a useful tool in analyzing fuels in terms of energy. The Heat of Combustion of a substance is defined as the amount of energy in the form of heat is liberated when an amount of the substance undergoes combustion.[1]
Things You Should Know
- Place a candle on a standing rod and secure 3 oz (100 ml) of water in a tin can 2 in (5 cm) above it. Light the candle.
- Measure the water temperature and candle weight. Then, use the formula q = Cp * m * (delta) t to calculate the heat liberated.
- Or, write the equation for combustion: 2NO + O2 = 2NO2. Add the enthalpies for the reactants and product and then subtract them.
-
1
Position the standing rod vertically. To begin setting up your experiment you will first place the rod on your work table.
-
2
Measure 100ml of water into the tin can.
Advertisement
-
3
Put the substance at the base of the standing rod.
-
4
At 5cm above the substance affix the tin can with a clamp to the rod.
-
5
Affix the thermometer so that it is in the tin can but not touching the bottom base.[2]
-
6
Experimentation
- Measure the temperature of the water and note it in degrees celsius.
- Measure the mass of the candle and note it in g.
- Light the substance.
- When the temperature of the water reaches 40 degrees Centigrade, blow out the substance.
- Measure the mass of the candle after burning and note it.
-
7
Calculation
- Use the formula q = Cp * m * (delta) t to calculate the heat liberated which heats the water.[3]
- The specific heat Cp of water is 4.18 J/g C
- Mass of the water is 100g
- Delta t is the difference between the initial starting temperature and 40 degrees centigrade.
- Subtract the initial temperature of the water from 40 C.
- Substitute it into the formula and you will get the answer q in J. Convert into kJ by dividing q by 1000.
- Find the amount of substance burned by subtracting the final mass from the initial mass of the substance in g.
- Divide q in kJ by the mass of the substance burned.
- The answer is the experimental heat of combustion in kJ/g.
- Use the formula q = Cp * m * (delta) t to calculate the heat liberated which heats the water.[3]
Advertisement
-
1
Write the balanced equation of combustion of the substance.[4]
-
2
Find the enthalpies of formation for the reactants and add them.
- Enthalpies of formation are usually found in a table from CRC Handbook of Chemistry and Physics.
-
3
Find the enthalpies of formation of the products and add them. Use the table
-
4
Subtract the enthalpies of the reactants from the product.
-
5
Switch the sign and that is the Heat of Combustion.
Advertisement
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
You will need to understand why it works..Hess Law states that the enthalpies of the products and the reactants are the same[5]
Thanks for submitting a tip for review!
Advertisement
-
The Experimental heat of combustion is inaccurate because it does not factor in heat loss to surrounding environment. It is only a rough estimate.
Advertisement
Things You’ll Need
- Gathering Materials
- A tin can
- A standing rod
- A thermometer
- Graduated Cylinder
- Ice cold water
- Two clamps
- The substance — which can be preferable burnt with a wick.
References
About This Article
Article SummaryX
The heat of combustion is a useful calculation for analyzing the amount of energy in a given fuel. To calculate the heat of combustion, use Hess’s law, which states that the enthalpies of the products and the reactants are the same. Start by writing the balanced equation of combustion of the substance. Then, add the enthalpies of formation for the reactions. You can find these in a table from the CRC Handbook of Chemistry and Physics. After that, add the enthalpies of formation of the products. Next, subtract the enthalpies of the reactants from the product. Finally, change the sign to kilojoules. For more tips, including how to calculate the heat of combustion with an experiment, read on.
Did this summary help you?
Thanks to all authors for creating a page that has been read 141,555 times.
Did this article help you?
Теплота образования
Qобр.
— это тепловой эффект реакции синтеза (1) моль вещества из простых веществ.
Например, теплота образования оксида азота((II)) равна
−87,5кДж/моль
:
0,5N2(г)+0,5O2(г)=NO(г)−87,5кДж.
Теплота сгорания
Qсгор.
— это тепловой эффект реакции горения (1) моль вещества.
Например, теплота сгорания этана равна
1560кДж/моль
:
C2H6(г)+3,5O2(г)=2CO2(г)+3H2O(г)+1560кДж.
Теплота сгорания и теплота образования определяются при стандартных условиях, т. е. при температуре (25°C) и давлении
101,3кПа
.
Обрати внимание!
Используя теплоту сгорания или образования веществ, можно вычислить тепловой эффект реакции. Для этого от суммы теплоты сгорания (образования) реагентов нужно отнять сумму теплоты сгорания (образования) продуктов.
Определим тепловой эффект реакции дегидрирования этана:
C2H6(г)→C2H4(г)+H2(г).
Теплоту сгорания этана, этилена и водорода возьмём из справочной литературы:
Qсгор.(C2H6)=1560кДж/моль;
Qсгор.(C2H4)=1410кДж/моль;
Qсгор.(H2)=242кДж/моль.
Тепловой эффект дегидрирования этана можно найти, если от теплоты сгорания этана отнять теплоту сгорания этилена и водорода:
Q=Qсгор.(C2H6)−Qсгор.(C2H4)−Qсгор.(H2);
Q=1560−1411−242=−93кДж/моль.
Термохимическое уравнение реакции:
C2H6(г)→C2H4(г)+H2(г)−93кДж.
Понятие об энтальпии реакции
Иногда тепловой эффект реакции указывают, используя энтальпию реакции.
Энтальпия химической реакции
ΔH
— это изменение внутренней энергии участвующих в реакции веществ.
Энтальпия противоположна по знаку тепловому эффекту, т. е. если указано, что
ΔH
(< 0), значит, тепловой эффект реакции положительный ((+Q)), и наоборот, если
ΔH
(> 0), то тепловой эффект реакции отрицательный ((-Q)). Например, уравнение реакции оксида кальция с водой можно записать так:
( = — 65) (кДж/моль)
или так:
CaO(тв)+H2O(ж)=Ca(OH)2(тв)+65кДж.
2.1. Расчет теплоты сгорания веществ Расчетные формулы
При
расчетах теплового баланса на пожаре
определяют низшую теплоту сгорания
(табл. 2.1).
Таблица 2.1
Расчет теплоты
сгорания
|
Тип горючего |
Расчет теплоты |
Размерность |
|
Индивидуальное |
(2.1) |
кДж/моль |
|
Вещество |
(2.2) |
кДж/кг |
|
Смесь газов |
(2.3) |
кДж/моль; кДж/м3 |
где
,
— соответственно теплота образования
одного моля i-го
конечного продукта горения и j-го
исходного вещества;
C,
H,
O,
N,
S,
W
– содержание (% масс.) углерода, водорода,
кислорода, азота, серы, влаги в составе
вещества;
—
низшая теплота сгорания i-го
горючего компонента газовой смеси
(кДж/моль, кДж/м3);
—
содержание i-го
горючего компонента в газовой смеси (%
об.).
Расчет теплоты
сгорания газо-воздушных смесей проводят
по формуле:
,
(2.4)
где
— теплота сгорания газо-воздушной смеси
(кДж/моль, кДж/м3);
—
низшая теплота сгорания горючего
вещества (кДж/моль, кДж/м3);
—
концентрация i-го
горючего в смеси (% об.).
Предельная скорость
(интенсивность) тепловыделения при
сгорании:
,
(2.5)
где
q
– удельная интенсивность тепловыделения
(кВт/м2);
—
низшая теплота сгорания горючего
вещества (кДж/моль, кДж/м3);
—
массовая скорость выгорания (кг/(м2·с)).
Скорость
тепловыделения при горении:
,
(2.6)
где
Q
– интенсивность тепловыделения, кВт;
S
– площадь горения, м2.
Низшая
теплота сгорания математически связана
с нижним концентрационным пределом
воспламенения вещества следующим
образом
,
где
— нижний концентрационный предел
воспламенения вещества;
—
предельная теплота сгорания, равная
1830 кДж/м3.
Примеры
Пример
1. Определить
низшую теплоту сгорания уксусной кислоты
(кДж/моль, кДж/кг), если теплота ее
образования составляет 485,6 кДж/моль.
Решение.
Для
расчета по формуле (2.1) запишем уравнение
реакции горения уксусной кислоты в
кислороде:
,
.
Для
расчета количества тепла, выделяющегося
при сгорании 1 кг горючего, необходимо
полученную величину разделить на его
молекулярную массу, равную 64:
Пример
2. Рассчитать
низшую теплоту сгорания органической
массы состава: C
– 62 %, H
– 8 %, O
– 28 %, S
– 2 %.
Решение.
По формуле Д.И.
Менделеева (2.2) находим:
Пример
3. Определить
низшую теплоту сгорания газовой смеси
состава, % об.: CH4
– 40, C4H10
– 20, O2
– 15, H2S
– 5, NH3
– 10, CO2
– 10.
Решение.
Для
каждого горючего компонента смеси по
формуле (2.1) находим теплоты сгорания
(табл. 2.2).
Таблица 2.2
Теплоты
сгорания некоторых горючих газов
|
Уравнение реакции горения |
Теплота |
Теплота .10-3, |
|
|
333,5 |
|
|
|
132,5 |
|
|
|
201,1 |
|
|
|
46,1 |
|
По формуле (2.3)
определим теплоту сгорания газовой
смеси:
Для
определения теплоты сгорания 1м3
газовой смеси необходимо полученное
значение разделить на объем, занимаемый
1 кмолем газа при стандартных условиях
(24,5 м3):
Пример
4. Рассчитать
теплоту сгорания 1 м3
стехиометрической гексано-воздушной
смеси.
Решение.
Находим
стехиометрический состав горючей смеси
по уравнению реакции горения:
Весь
объем вступивших в реакцию компонентов
(1 + 9,5 + 9,5.3,76)
примем за 100 %, а количество горючего (1
кмоль) будет соответствовать
стехиометрической концентрации:
Теплоту
сгорания 1 м3
гексана определим по формуле (2.1) или по
табл. 3 приложения:
Теплоту
сгорания 1 м3
стехиометрической гексано-воздушной
смеси определим по формуле (2.4):
Пример
5. Определить
низшую теплоту сгорания ацетона, если
неизвестна стандартная теплота его
образования.
Решение.
Представим
ацетон, как сложную смесь химических
элементов, и определим процентный состав
этой смеси:
Определяем
низшую теплоту сгорания ацетона по
формуле Д.И. Менделеева:
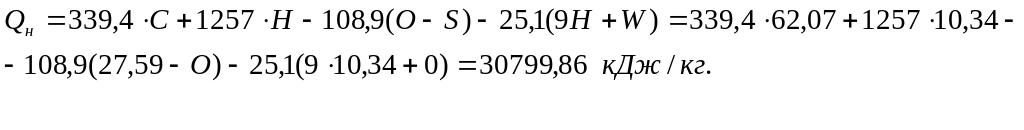
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #












