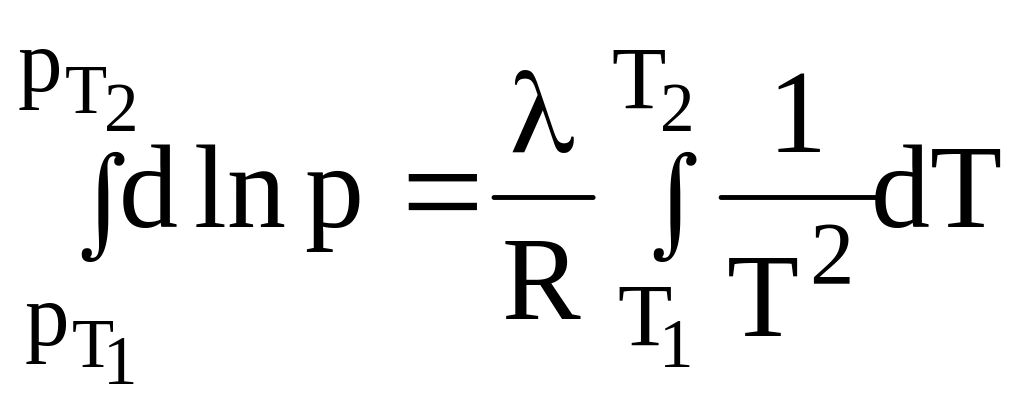Пример 1.
Плотности жидкого
и твердого олова при температуре
плавления (231,9С)
соответственно равны 6,988 и 7,184 г/см3.
Теплота плавления олова равна 1690
кал/моль. Определите температуру
плавления олова под давлением 100 атм.
Определяем изменение
температуры плавления при повышении
давления на 1 атм., т.е. величину
,
которая определяется из уравнения
Клаузиуса-Клайперона:
,
где
Т – температура
плавления под давлением 1 атм.
— разность
удельных объемов жидкого и твердого
олова.
Т = 231,9+273 = 504,9 К.
см3/г.
В каких единицах
должна выражаться теплота олова, чтобы
слева от знака равенства размерность
была [К/атм].
,
отсюда видно, что Q должна
измеряться в
.
Произведем пересчет.
Сначала переведем калории в литр-атмосферы.
1690 кал/моль —
1,987 кал/моль.К
Q
л-атм/моль — 0,082 л-атм/моль.К
л-атм/моль.
Разделим, найденное
число на атомную массу олова:
л-атм/г.
Получим удельную теплоту плавления.
Переведем литры
в см3, т.е. умножим на 1000: Q
= 0,588.1000 = 588 см3-атм/г.
К/атм.
Рассчитаем
температуру плавления олова при давлении
100 атм.
К.
Пример 2.
Давление пара
метилового спирта при 20С
равно 94 мм рт. ст., а при 40С
– 259,4 мм рт.ст. Определите среднее
значение теплоты испарения спирта в
указанном интервале температур.
Воспользуемся
уравнением
.
Проинтегрируем:
.
Получим:
или
.
Дж/моль.
Пример 3.
Зависимость
давления пара хлороформа от температуры
показана в таблице. Определите теплоту
испарения графическим методом.
|
Т, К |
293 |
303 |
313 |
323 |
333 |
|
р, атм. |
0,21 |
0,33 |
0,49 |
0,70 |
0,99 |
Преобразуем
уравнение Клаузиуса-Клайперона
.
Если построить
график рТ, то тангенс
угла наклона касательной в точке будет
производная
.
Зная давление и температуру в этой
точке, можно найти теплоту испарения.
Найдем
ее для температуры 313 К. Для этого
проведем касательную к точке на графике,
соответствующей данной температуре и
рассчитаем tg.
Для этого возьмем любой, удобный нам
треугольник, например, такой, как показан
на рисунке и возьмем отношение
противолежащего катета к прилежащему.
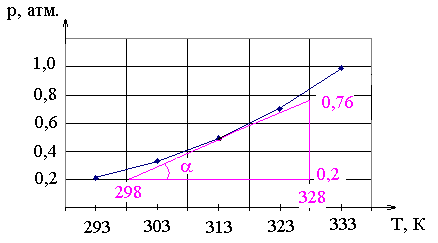
атм/К.
Дж/моль.
§22. III закон термодинамики.
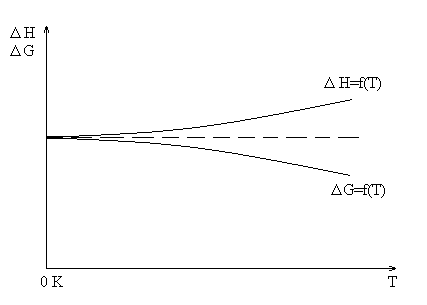
В 1906 году Вальтером
Нернстом было высказано простое и
довольно вероятное предположение, что
кривые Н=ƒ(Т) и
G=ƒ(T)
не только встречаются при Т=0 К, но и
касаются. Другими словами, обе кривые
вблизи абсолютного нуля имеют общую
касательную.
Кроме того при
очень низких температурах свойства
твердых и жидких тел перестают зависеть
от температуры, а это требует, чтобы
общая касательная шла параллельно оси
температур, т.е.
;
Таково основное
содержание высказанных Нернстом
положений, относящихся к свойствам
конденсированных систем и получивших
название тепловой теоремы Нернста.
Действительно, по
мере приближения к абсолютному нулю
свойства тел все менее зависят от
температуры. Это явление называется
вырождением. Тело, свойства которого
при данной точности опыта не зависит
от температуры, называется вырожденным.
Опыт показывает,
что вблизи абсолютного нуля вообще все
термические коэффициенты, выражающие
зависимость свойств тела от температуры,
стремятся к нулю. Область температур,
в которой наступает вырождение, различна
для различных тел. Так, для алмаза
состояние вырождения достигается при
довольно далекой от абсолютного нуля
температуре – около 90 К. Это означает,
что ниже 90 К при любой температуре,
например, при 10 или 70 К, свойства алмаза
(объем, энергия и др.), зависящие от
температуры, будут иметь в пределах
существующей точности измерений
одинаковые значения.
В зависимости от
кристаллической структуры и массы
частиц различные тела характеризуются
разными температурами перехода в
вырожденное состояние. Явление вырождения,
наблюдающееся у всех тел, отражает общее
всем телам свойство. Это позволяет
считать, что может быть выведен общий
новый принцип. Таким принципом является
третий закон термодинамики.
Первое утверждение
третьего закона термодинамики состоит
в том, что при приближении температуры
к абсолютному нулю величины теплоемкостей
(Ср и СV) всех
тел становятся равными нулю. Это
соответствует тому, что в вырожденном
состоянии внутренняя энергия и
теплосодержание тел не зависят от
температуры, т.к.
и
.
Это утверждение
основывается на многочисленных измерениях
теплоемкостей при низких температурах.
В рамках термодинамики оно принимается
как аксиоматическое.
При низких
температурах величины термодинамических
функций не зависят от температуры. В
частности это относится к свободной
энергии, откуда следует, что
.
Следовательно:
.
Второе утверждение
третьего закона термодинамики состоит
в том, что энтропия простых кристаллических
тел стремится к нулю при приближении
температуры к абсолютному нулю.
Эти два утверждения
и являются выражением третьего закона
термодинамики. Следует отметить, что
оба указанных утверждения не являются
независимыми друг от друга, т.к. из
второго может быть выведено первое.
Энтропия может достигнуть нулевого
значения лишь при условии, что теплоемкость
обращается в ноль, как это следует из
уравнения:
.
Если Ср при
Т0 не стремится к
нулю, то энтропия будет бесконечно
велика.
Обычно при изложении
третьего закона ограничиваются вторым
утверждением, известным как формулировка
Планка. Следует отметить, что первое
утверждение не имеет исключений и в
равной степени относится к газам, твердым
телам, жидкостям и растворам. Второе
утверждение относится к кристаллическим
телам и неприменимо к растворам,
переохлажденным жидкостям и некоторым
веществам в твердом состоянии, например,
Н2, СО, NO.
В соответствии с
постулатом Планка возможно определение
абсолютного значения энтропии. Поскольку
энтропия чистого кристаллического
вещества при абсолютном нуле S0K
равна нулю, то при любой другой температуре
ее значение может быть найдено из
уравнения:
.
Если имеются точные
данные о теплоемкостях при низких
температурах, а также тепловые эффекты
и температуры всех фазовых переходов,
если они имеют место в этом температурном
интервале.
Абсолютные значения
энтропии необходимы, в частности, для
расчета Sр-ции.
Например:
A+B=2D
Sр—ции=2SD-SA-SB.
Определение
абсолютных значений энтропий осуществляется
графическим способом.
С помощью калориметра
осуществляется измерение теплоемкостей.
В калориметр вводится точно измеряемое
количество тепла путем пропускания
электрического тока и при помощи
чувствительного термометра измеряется
соответствующее повышение температуры.
Графический метод
заключается в построении кривой в
координатах СрlnT.
Точка В соответствует
наиболее низкой температуре, при которой
для данного вещества возможны надежные
изменения теплоемкостей (обычно 10-15 К).
Теплоемкость при
температурах близких к абсолютному
нулю (отрезок АВ) можно вычислить по
уравнению Дебая, согласно которому
СТ3. Площадь,
ограниченная кривой АВС, осью lnT,
дает величину энтропии твердого тела
при этой температуре. Точка С соответствует
Тпл твердого тела, при которой
происходит резкое увеличение теплоемкости,
и отрезок DE представляет
теплоемкость жидкости. При плавлении
происходит поглощение тепла Нпл,
приводящее к увеличению энтропии на
величину
.
Точка Е соответствует
температуре кипения жидкости при
атмосферном давлении. Площадь, ограниченная
кривой DE и ординатами Тпл
и Ткип, дает увеличение энтропии
при нагревании жидкости между этими
температурами. При температуре кипения
происходит резкое уменьшение теплоемкости
до величины, соответствующей теплоемкости
газа (точка К). При испарении энтропия
возрастает на величину
.
Дальнейшее
увеличение энтропии газа определяется
величиной площади, лежащей под кривой
KL. В случае, если в твердом
состоянии тело претерпевает полиморфное
превращение, то так же необходимо учесть
соответствующее увеличение энтропии:
.
Таким образом,
если учесть все стадии, то можно записать
выражение для ST.
.
График можно также
строить в координатах
.
Понятно, что площадь
под графиком соответствует энтропии
при данной температуре Т за вычетом
изменений энтропий при фазовых переходах.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Температуру газа можно найти, зная его давление, с помощью уравнения состояния для идеального и реального газа. В модели идеального газа потенциальной энергией взаимодействия молекул газа пренебрегают, считая ее малой по сравнению с кинетической энергией молекул. Такая модель достаточно точно может описывать газ при низких давлениях и низких температурах. В остальных случаях рассматривают модель реального газа, учитывающую межмолекулярные взаимодействия.

Вам понадобится
- Уравнение Клапейрона-Менделеева, уравнение Ван-дер-Ваальса
Инструкция
Рассмотрим для начала идеальный газ с давлением p, занимающий объем V. Температуру, давление и объем газа связывает уравнение состояния идеального газа или уравнение Клапейрона-Менделеева. Оно выглядит следующим образом: pV = (m/M)RT, где m — масса газа, M — его молярная масса, R — универсальная газовая постоянная (R ~ 8,31 Дж/(моль*K)). Таким образом, m/M — это количество вещества газа.
Следовательно, уравнение Клапейрона-Менделеева можно также записать в виде: p(Vm)=RT, где Vm — молярный объем газа, Vm = V/(m/M)= VM/m. Тогда температуру газа T можно выразить из этого уравнения: T = p(Vm)/R.
Если масса газа постоянна, то можно записать: (pV)/T = const. Отсюда мы можем найти изменение температуры газа при изменении других параметров. Если p = const, то V/T = const — закон Гей-Люссака. Если V = const, то p/T = const — закон Шарля.
Рассмотрим теперь модель реального газа. Уравнение состояния реального газа называется уравнением Ван-дер-Ваальса. Оно записывается в виде: (p+a*(v^2)/(V^2))((V/v)-b) = RT. Здесь поправка учитывает силы притяжения между молекулами, а поправка b — силы отталкивания. v — это количество вещества газа в молях. Остальные обозначения величин соответствуют обознанчениям в уравнении состояния идеального газа.
Следовательно, из уравнения Ван-дер-Ваальса температуру T можно выразить: T = (p+a*(v^2)/(V^2))((V/v)-b)/R
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
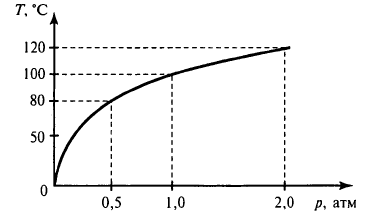
Данный калькулятор поможет Вам определить температуру кипения воды (°C), удельный объем насыщенного пара (м3/кг) и удельную теплоту парообразования (кДж/кг) при заданном давлении (мбар).
Кипение представляет собой внутреннее парообразование, которое происходит во всем объеме жидкости при температуре, когда давление насыщенного пара равно давлению в жидкости. Согласно исследованиям и уравнению Клапейрона — Клаузиуса, градус кипения напрямую зависит от атмосферного давления, так как кипение происходит, когда давление пара жидкости равно атмосферному давлению над этой жидкостью. Ниже представлен график зависимости температуры кипения воды от деления.
С ростом давления температура кипения увеличивается, а с уменьшением, наоборот, становится все ниже. При нормальном атмосферном давлении 760 мм рт. ст. вода кипит при + 100 °C.
В горной местности давление уменьшается, а под землей (в шахте) увеличивается. Так температура кипения воды на вершине самой высокой горы Эверест будет составлять примерно 69 °C.
Выберите способ ввода данных:
Температура кипения воды при этом давлении:
Удельный объем насыщенного пара:
Удельная теплота парообразования:
Испарение сопровождается остыванием жидкости. Чем она холоднее, тем менее интенсивно происходит образование пара. Но скорость процесса можно поддерживать, если жидкость подогревать, то есть подводить к ней тепло.
Так возникает понятие удельной теплоты парообразования. У каждого жидкости и даже твердого тела (ведь и его можно превратить в пар) эта величина своя. Рассмотрим, как найти удельную теплоту парообразования.
Содержание
- Единица измерения
- Формула для величины
- Какие данные нужны, чтобы рассчитать значение?
- Алгоритм и правила расчета
- Несколько примеров нахождения
- Таблица для ряда веществ
- Видео по теме статьи
- Заключение
Единица измерения
Удельная теплота парообразования – это величина, которая показывает, сколько теплоты необходимо сообщить веществу массой 1 кг, чтобы превратить его в пар. При этом температура вещества должна быть постоянной.
Обычно рассматриваемую величину обозначают латинскими буквами L, r или греческой λ (лямбда). Теплота в системе СИ измеряется в Джоулях (Дж), масса – в килограммах (кг). Таким образом, L измеряется в Дж/кг.
Так как теплота в джоулях принимает зачастую большие значения, может встречаться обозначения кДж (килоджоули) – Дж*1000, или МДж (мегаджоули) – Дж*1000 000.
Формула для величины

- Q – теплота,
- m – масса.
Ее часто используют для расчетов энергетических затрат на выпаривание воды из растворов: Q= L* m.
L определяют в лабораториях и заносят в таблицы, составляют справочники, которыми можно пользоваться любому желающему. При этом всегда указывают температуру и давление, при которых находилось L.
С ростом температуры L уменьшается, так как жидкость расширяется, взаимодействие между ее частицами уменьшается, и ее легче превратить в пар. Когда плотность пара и жидкости сравниваются, наступает критическое состояние.
Оно характеризуется определенным давлением и температурой. Для воды — это 374 ℃ и 218,5 атм. В таком состоянии L=0.
Какие данные нужны, чтобы рассчитать значение?
Чтобы вычислить искомую величину, применяют знания о том, что теплота испарения равна теплоте конденсации со знаком «минус». Это значит, что когда пар конденсируется (превращается в воду), он охлаждается и отдает свое тепло окружающей среде. Можно применить формулу: Q= L* m.
Для расчетов необходимы следующие данные:
- Q – теплота, отданная паром, Дж,
- m – масса образовавшейся в процессе конденсации воды, кг;
- L – удельная теплота парообразования, Дж/кг – собственно то, что нужно определить.
Применяют также закон сохранения энергии и понятие теплоемкости: Qв=С*Mв*(T2-T1), где:
- С – удельная теплоемкость воды, которая нагревается под действием сконденсированного пара, Дж/(кг*К), – считается известной и берется из таблицы,
- Mв – ее масса;
- T2-T1 – изменение температуры в Кельвинах или градусах Цельсия.
Алгоритм и правила расчета

- Анализируют, как проходит процесс, какое вещество отдает, а какое получает тепло.
- Переводят все единицы измерения в одну систему.
- Записывают необходимые формулы.
- Решают уравнение с одним неизвестным.
При проведении расчетов надо следить за размерностью величин. В системе СИ масса измеряется в кг, теплота в Дж, а температура в градусах Кельвина. Разность температур можно считать в градусах Цельсия.
Часто бывает нужно найти удельную теплоту парообразования при условиях кипения жидкости и нормальном атмосферном давлении (760 мм рт. ст.). В таких условиях получают чистую воду из растворов или выделяют из смеси веществ ее части.
Процесс используется в химической и пищевой промышленности и даже на бытовом уровне.
Несколько примеров нахождения
Задача №1. Сколько необходимо энергии для превращения в пар следующих кипящих веществ:
- 2 кг этилового спирта;
- 2 кг воды;
- 2 кг расплавленного свинца.
Необходимо воспользоваться формулой Q= L* m и взять значение L из таблицы. Получится:
- 0,84*МДж*2 кг = 1,68 МДж;
- 2,3 МДж*2 кг = 4,6 МДж;
- 8,6 МДж *2 кг = 17,2 МДж.
Как видно, превратить в пар воду сложнее, чем этанол, но легче, чем металл. На первый взгляд, это очевидно, но когда дело касается веществ, близких по температуре кипения, то разница становится менее заметна, ее невозможно угадать. Тем не менее, она имеет особое значение.
Задача №2. Как вычислить, сколько энергии необходимо, чтобы превратить 1 тонну воды при 20 ℃ в пар при 100 ℃?
Решение: 1 т = 1000 кг.

- Q1 – тепло, ушедшее на нагревание воды с 20 до 100 градусов,
- Q2 – тепло, необходимое для образования пара (процесс происходит без изменения температуры).
Q1 = С*M* (T2-T1), С воды = 4200 Дж/(кг*К), Q2 = L*M, L воды при обычном кипении = 2,3 МДж/кг, T2-T1 = 100-20 = 80.
Подставляя известные величины, находят искомую энергию: Q = 4200*1000*80+2,3 *106*1000 = 4,2*80*106+2300*106=2636 (МДж)
Задача №3. Сколько надо затратить электроэнергии, чтобы превратить 1 л воды в пар?
Решение: Q= Lводы*m. Масса 1 литра обычной водопроводной воды равна 1 кг. Q=2260 кДж/кг *1 кг=2260 кДж=2,3 МДж.
1 кВт*ч = 3,6 МДж. Из простой пропорции следует, что надо затратить 0,64 кВт*ч. Для 2-х литров величина возрастет в 2 раза, для 3-х – в три, и так далее.
Зная тарифы на электроэнергию, несложно посчитать стоимость, во сколько рублей обойдется такое кипячение. Надо также учитывать, что частично энергия уйдет в воздух и на нагрев сосуда, частей плиты, поэтому реальный расход будет выше.
Таблица для ряда веществ
Удельная теплота парообразования при нормальном атмосферном давлении (1 атм = 760 мм рт. ст.) и температуре кипения (для каждого вещества она своя).
| Вещество | L, МДж/кг | T кипения, ℃ |
| Вода | 2,3 | 100 |
| Этиловый спирт | 0,84 | 78,4 |
| Метиловый спирт | 1,1 | 64,1 |
| Ртуть | 0,28 | 357 |
| Жидкий азот | 0,2 | -195,8 |
| Аммиак | 1,4 | -33,4 |
| Фреон 12 | 0,16 | -24,9 |
| Расплавленный алюминий | 10,9 | 2450 |
Для воды при 20 ℃ L=2,45МДж/кг.
Видео по теме статьи
Об удельной теплоте парообразования расскажет видео:
Заключение
Единица измерения удельной теплоты парообразования – Дж/кг. Она показывает, сколько при заданной температуре надо подвести тепла, чтобы преобразовать 1 кг вещества в пар. Величина определяется путем проведения экспериментов.
Для воды при 100 ℃ ее значение 2260 кДж/кг. Эта величина довольно большая в сравнении с характеристиками других веществ. С ростом температуры значение удельной теплоты образования пара уменьшается.
|
||||||
|
||||||
|
||||||
|
||||||
|
||||||
|
||||||
|
||||||
|
||||||
|
||||||
|
||||||
Сейчас Вы — Гость на форумах «Проектант». Гости не могут писать сообщения и создавать новые темы.
Преодолейте несложную формальность — зарегистрируйтесь! И у Вас появится много больше возможностей на форумах «Проектант».
Последние сообщения на форуме «Теплоснабжение и Газоснабжение»
25 Апреля 2023 года, 16:01
04 Апреля 2023 года, 17:14
28 Марта 2023 года, 18:14
23 Марта 2023 года, 14:20
20 Марта 2023 года, 14:25
20 Марта 2023 года, 12:55
17 Марта 2023 года, 00:24
14 Марта 2023 года, 12:53
02 Марта 2023 года, 15:08
27 Февраля 2023 года, 11:47
12 Января 2023 года, 10:40
12 Января 2023 года, 10:20
08 Декабря 2022 года, 11:29