Количество теплоты
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: количество теплоты, удельная теплоёмкость вещества, уравнение теплового баланса.
Как мы знаем, одним из способов изменения внутренней энергии является теплопередача (теплообмен). Предположим, что тело участвует в теплообмене с другими телами, и при этом не совершается механическая работа — ни самим телом, ни другими телами над этим телом.
Если в процессе теплообмена внутренняя энергия тела изменилась на величину , то говорят, что тело получило соответствующее количество теплоты:
.
Если при этом величина отрицательна, т.е. тело отдавало энергию, то говорят также, что тело отдавало тепло. Например, вместо формально верной, но несколько нелепой фразы «тело получило —5 Дж тепла» мы скажем: «тело отдало 5 Дж тепла».
Удельная теплоёмкость вещества
Предположим, что в процессе теплообмена агрегатное состояние вещества тела не изменяется (не происходит плавление, кристаллизация, парообразование или конденсация). Начальную температуру тела обозначим , конечную температуру —
.
Опыт показывает, что количество теплоты, полученное телом, прямо пропорционально массе тела и разности конечной и начальной температур:
Коэффициент пропорциональности c называется удельной теплоёмкостью вещества тела. Удельная теплоёмкость не зависит от формы и размеров тела. Удельные теплоёмкости различных веществ можно найти в таблицах.
Введя обозначение , получим также:
Чтобы понять физический смысл удельной теплоёмкости, выразим её из последней формулы:
Мы видим, что удельная теплоёмкость численно равна количеству теплоты, которое необходимо для нагревания 1кг данного вещества на (или, что то же самое, на
). Измеряется удельная теплоёмкость в Дж/(кг·
C) или в Дж/(кг·K).
Чем больше удельная теплоёмкость вещества, тем большее количество теплоты требуется для нагревания тела данной массы на заданное количество градусов.
В задачах часто фигурируют вода и лёд. Их удельные теплоёмкости желательно помнить.
Вода: Дж/(кг·
C).
Лёд: Дж/(кг·
C).
Произведение удельной теплоёмкости вещества на массу тела называется теплоёмкостью тела и обозначается :
Соответственно, для количества теплоты имеем:
Уравнение теплового баланса
Рассмотрим два тела (обозначим их 1 и 2), которые образуют замкнутую систему. Это означает, что данные тела могут обмениваться энергией только друг с другом, но не с другими телами. Считаем также, что механическая работа не совершается — внутренняя энергия тел меняется только в процессе теплообмена.
Имеется фундаментальный закон природы, подтверждаемый всевозможными экспериментами — закон сохранения энергии. Он гласит, что полная энергия замкнутой системы тел не меняется со временем.
В данном случае закон сохранения энергии утверждает, что внутренняя энергия нашей системы будет оставаться одной и той же: . Если изменение внутренней энергии первого тела равно
, а изменение внутренней энергии второго тела равно
, то суммарное изменение внутренней энергии будет равно нулю:
Но — количество теплоты, полученное первым телом в процессе теплообмена; аналогично
— количество теплоты, полученное вторым телом в процессе теплообмена. Стало быть,
(1)
Попросту говоря, сколько джоулей тепла отдало одно тело, ровно столько же джоулей получило второе тело. Так как система замкнута, ни один джоуль наружу не вышел. Соотношение (1) называется уравнением теплового баланса. В общем случае, когда тел образуют замкнутую систему и обмениваются энергией только с помощью теплопередачи, из закона сохранения энергии с помощью тех же рассуждений получаем общее уравнение теплового баланса:
(2)
В качестве простого примера применения уравнения теплового баланса рассмотрим следующую задачу.
Смешали г воды при температуре
и
г воды при температуре
. Найти установившуюся температуру смеси.
Обозначим искомую установившуюся температуру через . Запишем уравнение теплового баланса (1):
где — удельная теплоёмкость воды. Раскрываем скобки и находим:
Благодарим за то, что пользуйтесь нашими материалами.
Информация на странице «Количество теплоты» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
08.05.2023
Вы познакомились с понятиями количества теплоты и удельной теплоемкости. В уроке «Расчет количества теплоты, необходимого для нагревании тела или выделяемого им при охлаждении» вы познакомились с основной формулой, которую мы будем использовать и в этом уроке:
$Q = cm(t_2 — t_1)$
В данном уроке мы рассмотрим задачи на нахождение различных величин, связанных с нагреванием и охлаждением тел. При их решении вам может понадобиться таблица значений удельной теплоемкости различных веществ из прошлого урока.
Задача №1 на расчет количества теплоты
Рассчитайте количество теплоты, необходимое для нагрева $15 space кг$ меди на $80 degree C$.
Дано:
$m = 15 space кг$
$c = 400 frac{Дж}{кг cdot degree C}$
$Delta t = 80 degree C$
$Q — ?$
Показать решение и ответ
Скрыть
Решение:
Для решения этой задачи мы будем использовать формулу для расчета количества теплоты, необходимого для нагревания тела:
$Q = cm(t_2 — t_1)$.
В данном случае нам не известны начальная и конечная температуры тела ($t_2$ и $t_1$). Нам известно изменение этой температуры: $Delta t = t_2 — t_1$. Тогда формула для расчета количества теплоты примет вид:
$Q = cm Delta t$.
Подставим значения всех величин и рассчитаем количество теплоты:
$Q = 400 frac{Дж}{кг cdot degree C} cdot 15 space кг cdot 80 degree C = 480 space 000 space Дж = 480 space кДж$.
Ответ: $Q = 480 space кДж$.
Задача №2 на расчет количества теплоты
Рассчитайте количество теплоты, необходимое, чтобы нагреть бассейн объемом $300 space м^3$ на $10 degree C$.
В задаче идет речь о бассейне, а значит, о пресной воде. Она имеет плотность, равную $1000 frac{кг}{м^3}$. Запишем условия задачи и решим ее.
Дано:
$V = 300 space м^3$
$Delta t = 10 degree C$
$c = 4200 frac{Дж}{кг cdot degree C}$
$rho = 1000 frac{кг}{м^3}$
$c = 4200 frac{Дж}{кг cdot degree C}$
$Q — ?$
Показать решение и ответ
Скрыть
Решение:
Формула для расчета количества теплоты, необходимого для нагревания тела:
$Q = cm(t_2 — t_1)$.
Нам неизвестна масса воды в бассейне, но известен ее объем и плотность. Плотность по определению:
$rho = frac{m}{V}$.
Тогда масса будет равна:
$m = rho V$.
Также нам неизвестны начальная и конечная температуры тела ($t_2$ и $t_1$). Нам известно изменение этой температуры: $Delta t = t_2 — t_1$. Тогда формула для расчета количества теплоты примет вид:
$Q = c rho V Delta t$.
Рассчитаем количество теплоты:
$Q = 4200 frac{Дж}{кг cdot degree C} cdot 1000 frac{кг}{м^3} cdot 300 space м^3 cdot 10 degree C = 12.6 cdot 10^9 space Дж = 12.6 space ГДж$.
Ответ: $Q = 12.6 space ГДж$.
Задача №3 на расчет массы
Найдите массу глицерина, если при нагревании от $10 degree C$ до $15 degree C$ он поглотил $12 space кДж$ теплоты. Удельная теплоемкость глицерина равна $2430 frac{Дж}{кг cdot degree C}$.
Дано:
$Q = 12 space кДж$
$t_1 = 10 degree C$
$t_2 = 15 degree C$
$c = 2430 frac{Дж}{кг cdot degree C}$
СИ:
$Q = 12 cdot 10^3 space Дж$
$m — ?$
Посмотреть решение и ответ
Скрыть
Решение:
Формула для расчета количества теплоты, необходимого для нагревания тела:
$Q = cm(t_2 — t_1)$.
Выразим отсюда массу глицерина:
$m = frac{Q}{c(t_2 — t_1)}$.
Рассчитаем:
$m = frac{12 cdot 10^3 space Дж}{2430 frac{Дж}{кг cdot degree C} cdot (15 degree C — 10 degree C)} approx 1 space кг$.
Ответ: $m approx 1 space кг$.
Задача №4 на расчет плотности
Определите плотность машинного масла объемом $1 space л$, если известно, что для увеличения температуры на $30 degree C$ ему требуется передать $45 space кДж$ теплоты. Удельная теплоемкость масла равна $1.67 frac{кДж}{кг cdot degree C}$.
Дано:
$V = 1 space л$
$Q = 45 space кДж$
$c = 1.67 frac{кДж}{кг cdot degree C}$
$Delta t = 30 degree C$
СИ:
$V = 10^{-3} space м^3$
$Q = 45 cdot 10^3 space Дж$
$c = 1.67 cdot 10^3 frac{Дж}{кг cdot degree C}$
$rho — ?$
Посмотреть решение и ответ
Скрыть
Решение:
Формула для расчета количества теплоты, необходимого для нагревания тела:
$Q = cm(t_2 — t_1)$.
Нам известны изменение температуры ($Delta t = t_2 — t_1$), количество теплоты и удельная теплоемкость машинного масла. Выразим массу и рассчитаем ее:
$m = frac{Q}{c Delta t} = frac{45 cdot 10^3 space Дж}{1.67 cdot 10^3 frac{Дж}{кг cdot degree C} cdot 30 degree C} approx 0.9 space кг$.
По определению плотности:
$rho = frac{m}{V}$.
Рассчитаем плотность машинного масла:
$rho = frac{0.9 space кг}{10^{-3} space м^3} = 0.9 cdot 10^3 frac{кг}{м^3} = 900 frac{кг}{м^3}$.
Ответ: $rho = 900 frac{кг}{м^3}$.
Задача №5 на расчет удельной теплоемкости
В калориметр было налито $450 space г$ воды, температура которой $20 degree C$. Когда в эту воду погрузили $200 space г$ железных опилок, нагретых до $100 degree C$, температура воды стала равна $24 degree C$. Определите удельную теплоемкость опилок.
Записывая условия задачи, используем индекс “в” для обозначения величин, связанных с водой, и индекс “ж” для обозначения величин, связанных с железными опилками.
Дано:
$m_в = 450 space г$
$m_ж = 200 space г$
$t_{в1} = 20 degree C$
$t_{в2} = 24 degree C$
$c_в = 4200 frac{Дж}{кг cdot degree C}$
$t_{ж1} = 100 degree C$
СИ:
$m_в = 0.45 space кг$
$m_ж = 0.2 space кг$
$с_ж — ?$
Посмотреть решение и ответ
Скрыть
Решение:
Формула для расчета количества теплоты, необходимого для нагревания тела и выделяемого при его охлаждении:
$Q = cm(t_2 — t_1)$.
Запишем эту формулу для воды:
$Q_в = c_в m_в (t_{в2} — t_{в1})$.
Запишем формулу количества теплоты для железных опилок:
$Q_ж = c_ж m_ж (t_{ж2} — t_{ж1})$.
Нагретые железные опилки помещают в воду для их охлаждения. Значит, вода будет нагреваться и поглотит некоторое количество теплоты, а опилки будут охлаждаться и выделят некоторое количество теплоты. Т.е., между этими телами будет происходить теплообмен, для которого действует уже известное вам правило:
Если между телами происходит теплообмен, то внутренняя энергия всех нагревающихся тел увеличивается на столько, на сколько уменьшается внутренняя энергия остывающих тел.
Это значит, что количество теплоты $Q_в$, полученное водой, будет равно количеству теплоту $Q_ж$, которое выделится при охлаждении железных опилок, но с обратным знаком: $Q_в = — Q_ж$.
Подставим выражения, которые дает формула для расчета количества теплоты:
$c_в m_в (t_{в2} — t_{в1}) = — c_ж m_ж (t_{ж2} — t_{ж1})$.
После завершения теплообмена температура воды и температура железных опилок будут равны друг другу: $t_в2 = t_ж2 = t_2$.
Подставим в наше равенство и выразим $c_ж$:
$c_ж = — frac{c_в m_в (t_2 — t_{в1})}{m_ж (t_2 — t_{ж1})}$.
Рассчитаем удельную теплоемкость железных опилок:
$c_ж = — frac{4200 frac{Дж}{кг cdot degree C} cdot 0.45 space кг cdot (24 degree C — 20 degree C)}{0.2 space кг cdot (24 degree C — 100 degree C)} = — frac{7560 space Дж}{- 15.2 space кг cdot degree C} approx 497 frac{Дж}{кг cdot degree C} approx 0.5 frac{кДж}{кг cdot degree C}$.
Ответ: $c_ж approx 0.5 frac{кДж}{кг cdot degree C}$.
Задача №6 на использование графика
Используя график зависимости температуры керосина от сообщенного ему количества теплоты (рисунок 1), определите массу керосина.
Для начала нам нужно записать условия задачи. Из графика мы видим, что начальная температура керосина $t_1$ была равна $0 degree C$. Теперь выберем удобную нам точку на графике. Например, когда керосину сообщили количество теплоты $Q$, равное $2 space кДж$, его температура $t_2$ стала равной $10 degree C$. Теперь мы можем записать условия задачи и решить ее. Удельная теплоемкость керосина известна нам из таблицы.
Дано:
$Q = 2 space кДж$
$t_1 = 0 degree C$
$t_2 = 10 degree C$
$c = 2100 frac{Дж}{кг cdot degree C}$
СИ:
$Q = 2 cdot 10^3 space Дж$
$m — ?$
Посмотреть решение и ответ
Скрыть
Решение:
Формула для расчета количества теплоты, необходимого для нагревания тела:
$Q = cm(t_2 — t_1)$.
Выразим отсюда массу:
$m = frac{Q}{c (t_2 — t_1)}$.
Рассчитаем ее:
$m = frac{2 cdot 10^3 space Дж}{2100 frac{Дж}{кг cdot degree C} cdot (10 degree C — 0 degree C)} approx 0.095 space кг approx 100 space г$.
Ответ: $m approx 100 space г$.
Задача №7 на расчет температуры нагрева
Стальной резец массой $2 space кг$ был нагрет до температуры $800 degree C$ и затем опущен в сосуд, содержащий $15 space л$ воды при температуре $10 degree C$. До какой температуры нагреется вода в сосуде?
Записывая условия задачи, используем индекс “в” для обозначения величин, связанных с водой, и индекс “р” для обозначения величин, связанных со стальным резцом.
Дано:
$V_в = 15 space л$
$m_р = 2 space кг$
$t_{р1} = 800 degree C$
$c_р = 500 frac{Дж}{кг cdot degree C}$
$rho_в = 1000 frac{кг}{м^3}$
$c_в = 4200 frac{Дж}{кг cdot degree C}$
$t_{в1} = 10 degree C$
СИ:
$V_в = 15 cdot 10^3 м^3$
$t_{в2} — ?$
Посмотреть решение и ответ
Скрыть
Решение:
Когда нагретый резец опускают в холодную воду, между этими двумя телами происходит теплообмен. Резец остывает и выделяет энергию, а вода получает эту энергию и нагревается. Соответственно, количество теплоты, которое выделится при остывании стального резца, численно будет равно количеству теплоту, которое получит вода.
Когда теплообмен завершится,температуры стального резца и воды будут одинаковы: $t_{в2} = t_{р2} = t_2$.
Запишем формулу для расчета количества теплоты, которое выделится при остывании резца:
$Q_р = с_р m_р (t_2 — t_{р1})$.
Запишем формулу для расчета количества теплоты, которое получила вода:
$Q_в = с_в m_в (t_2 — t_{в1})$.
Приравняем правые части этих уравнений, не забыв про знак “минус”, которые указывает на выделение энергии при охлаждении тела:
$с_р m_р (t_2 — t_{р1}) = — с_в m_в (t_2 — t_{в1})$.
Раскроем скобки:
$с_р m_р t_2 — с_р m_р t_{р1} = — с_в m_в t_2 + с_в m_в t_{в1}$.
Перенесем множители с $t_2$ на одну сторону уравнения и выразим эту температуру, до которой нагреется вода:
$с_р m_р t_2 + с_в m_в t_2 = с_в m_в t_{в1} + с_р m_р t_{р1}$,
$t_2 (с_р m_р + с_в m_в) = с_в m_в t_{в1} + с_р m_р t_{р1}$,
$t_2 = frac{с_в m_в t_{в1} + с_р m_р t_{р1}}{с_р m_р + с_в m_в}$.
Нам неизвестна масса воды, но известны ее плотность и объем. Выразим и рассчитаем массу через эти величины:
$m_в = rho_в V_в = 1000 frac{кг}{м^3} cdot 15 cdot 10^3 м^3 = 15 space кг$.
Теперь мы можем рассчитать температуру $t_2$:
$t_2 = frac{4200 frac{Дж}{кг cdot degree C} cdot 15 space кг cdot 10 degree C + 500 frac{Дж}{кг cdot degree C} cdot 2 space кг cdot 800 degree C}{500 frac{Дж}{кг cdot degree C} cdot 2 space кг + 4200 frac{Дж}{кг cdot degree C} cdot 15 space кг} = frac{630 cdot 10^3 space Дж + 800 cdot 10^3 space Дж}{1 cdot 10^3 frac{Дж}{degree C} + 63 cdot 10^3 frac{Дж}{degree C}} = frac{1430 cdot 10^3 space Дж}{64 cdot 10^3 frac{Дж}{degree C}} approx 22.3 degree C$.
Ответ: $t_2 approx 22.3 degree C$.
Какой температуры получится вода, если смешать $0.02 space кг$ воды при $15 degree C$, $0.03 space кг$ воды при $25 degree C$ и $0.01 space кг$ воды при $60 degree C$?
Дано:
$m_1 = 0.02 space кг$
$t_1 = 15 degree C$
$m_2 = 0.03 space кг$
$t_2 = 25 degree C$
$m_3 = 0.01 space кг$
$t_3 = 60 degree C$
$t — ?$
Посмотреть решение и ответ
Скрыть
Решение:
При смешивании жидкостей разных температур, мы знаем, что внутренняя энергия всех нагревающихся тел увеличивается на столько, на сколько уменьшается внутренняя энергия остывающих тел.
Для смешивания двух жидкостей мы можем записать, что $Q_1 = — Q_2$ или $Q_1 + Q_2 = 0$.
Сначала рассмотрим смешивание первых двух порций воды. Первая порция с температурой $15 degree C$ будет нагреваться (получать энергию), а вторая порция с температурой $25 degree C$ будет охлаждаться (выделять энергию). Эти энергии будут численно равны друг другу, но противоположны по знаку:
$cm_1(t_{1+2} — t_1) = — cm_2(t_{1+2} — t_2)$.
Найдем конечную температуру этой смеси:
$m_1(t_{1+2} — t_1) = — m_2 (t_{1+2} — t_2)$,
$m_1 t_{1+2} — m_1 t_1 = -m_2 t_{1+2} + m_2 t_2$,
$t_{1+2} (m_1 + m_2) = m_1 t_1 + m_2 t_2$,
$t_{1+2} = frac{m_1 t_1 + m_2 t_2}{m_1 + m_2} = frac{0.02 space кг cdot 15 degree C + 0.03 space кг cdot 25 degree }{0.02 space кг + 0.03 space кг} = frac{0.3 space кг cdot degree + 0.75 space кг cdot degree C}{0.05 space кг} = 21 degree C$.
Так мы получили смесь первой и второй порций воды массой $m_{1+2} = 0.05 space кг$ и температурой $t_{1+2} = 21 degree C$.
Теперь добавим третью порцию воды в полученную смесь. Смесь будет нагреваться (получать энергию), а третья порция воды будет охлаждаться (выделять энергию):
$Q_{1+2} = — Q_3$.
$cm_{1+2} (t — t_{1+2}) = — cm_3 (t — t_3)$,
$m_{1+2} (t — t_{1+2}) = — m_3 (t — t_3)$.
Выразим отсюда конечную температуру смеси из трех порций воды $t$:
$m_{1+2} t — m_{1+2} t_{1+2} = -m_3 t + m_3 t_3$,
$t (m_{1+2} + m_3) = m_{1+2} t_{1+2} + m_3 t_3$,
$t = frac{m_{1+2} t_{1+2} + m_3 t_3}{m_{1+2} + m_3}$.
Рассчитаем ее:
$t = frac{0.05 space кг cdot 21 degree C + 0.01 space кг cdot 60 degree}{0.05 space кг + 0.01 space кг} = frac{1.05 space кг cdot degree C + 0.6 space кг cdot degree C}{0.06 space кг} = 27.5 degree C$.
Ответ: $t = 27.5 degree C$.
Задача №9 на расчет количества теплоты, рассеиваемого в окружающую среду
Электрочайник с водой нагревается от температуры $70 degree C$ до температуры $80 degree C$ за $3 space мин$, а остывает от температуры $80 degree C$ до температуры $70 degree C$ за $9 space мин$. Какая часть количества теплоты, выделяемой спиралью чайника при нагревании воды, рассеивается в окружающую среду? Тепловые потери считать постоянными.
Внесем необходимые пояснения. Спираль чайника передает воде определенное количество теплоты $Q_2$. Часть ее ($Q_1$) рассеивается в окружающую среду. Т.е., количество теплоты $Q_2$, выделяемое спиралью, больше количества теплоты $Q$, необходимого для нагрева воды.
Дано:
$t_1 = 70 degree C$
$t_2 = 80 degree C$
$T_1 = 3 space мин$
$T_2 = 9 space мин$
$frac{Q_1}{Q_2} — ?$
Показать решение и ответ
Скрыть
Решение:
Сначала рассчитаем количество теплоты, которое необходимо сообщить воде в чайнике, чтобы ее температура увеличилась с $70 degree C$ до $80 degree C$:
$Q = cm(t_2 — t_1)$.
Масса воды в чайнике нам неизвестна, поэтому примем ее, равной $1 space кг$. Тогда,
$Q = 4200 frac{Дж}{кг cdot degree C} cdot 1 space кг cdot (80 degree C — 70 degree C) = 42 space 000 space Дж = 42 space кДж$.
Когда вода в чайнике остывает с температуры $80 degree C$ до температуры $70 degree C$, она выделяет в окружающую среду точно такое же количество энергии $Q$. Остывание происходит за $9 space мин$. Значит, количество теплоты, которое выделяется в окружающую среду за $1 space мин$ будет равно:
$Q_0 = frac{42 space кДж}{9 space мин} approx 4.7 frac{кДж}{мин}$.
В условиях задачи сказано, что тепловые потери постоянны. Это означает, что вода массой $1 space кг$ отдает $4.7 space кДж$ каждую минуту, в том числе, и при ее нагревании.
Нагревается вода за 3 минуты. За это время она отдает в окружающую среду следующее количество теплоты:
$Q_1 = 4.7 space кДж cdot 3 = 14.1 space кДж$.
Тем не менее, чайник нагрел воду до нужной температуры. Значит, он сообщил воде количество энергии, равное $Q_2 = Q + Q_1$.
$Q_2 = 42 space кДж + 14.1 space кДж = 56.1 space кДж$.
Теперь мы можем рассчитать отношение $frac{Q_1}{Q_2}$, и узнать какая часть теплоты, выделяемая спиралью чайника, рассеивается в окружающую среду:
$frac{Q_1}{Q_2} = frac{14.1 space кДж}{56.1 space кДж} approx 0.25$.
Т.е., в окружающую среду рассеивается $frac{1}{4}$ часть энергии, сообщаемая воде в чайнике.
Можно доказать, что это соотношение останется постоянным для воды любой массы в этой задаче. Чем больше будет масса воды, тем больше энергии ей будет нужно, чтобы нагреться до определенной температуры. Больше будут и тепловые потери. Искомое соотношение же останется неизменным.
Ответ: $frac{Q_1}{Q_2} approx 0.25$.
На практике часто приходится проводить различные тепловые расчёты. Для увеличения эргономичности тепловой системы жилых домов измеряют количество тепловой энергии, рассеиваемой через вентиляцию, окна, расщелины.
Для расчёта количества тепловой энергии нужно измерить массу (m), разность температуры в начале и в конце процесса
Δt=tкон−tнач
, а также знать теплоёмкость (c) данного вещества.
Чтобы нагреть некоторое вещество массой (1) кг на (1°C), необходимо затратить количество теплоты, равное удельной теплоёмкости (c) данного вещества.
Количество теплоты, получаемое веществом при нагревании, прямо пропорционально удельной теплоёмкости вещества, его массе и разности температур, то есть:
Q=cmΔt
или
Данная формула даёт возможность найти и выделяемую при охлаждении вещества теплоту.
Чтобы рассчитать количество теплоты, необходимое для нагревания вещества (или выделяемое им при охлаждении), следует удельную теплоёмкость вещества умножить на его массу и на разность между конечной и начальной температурой вещества.
Так как конечная температура остывающего вещества меньше его начальной температуры:
то изменение температуры оказывается отрицательным числом:
Значит, и выделяемое веществом количество теплоты выражается отрицательным числом:
Последний факт обозначает не рост, а убыль внутренней энергии вещества.
На
прошлых уроках мы с вами познакомились с понятием «внутренняя энергия тела» и
узнали, что изменить её можно двумя способами: либо путём совершения
механической работы, либо теплопередачей.
Также
мы с вами выяснили, что мерой изменения внутренней энергии тела при
теплопередаче является количество теплоты. Давайте вспомним, что количество
теплоты — это скалярная физическая величина, равная изменению внутренней
энергии тела в процессе теплопередачи без совершения механической работы.
А
ещё мы получили уравнение, по которому можно рассчитать количество теплоты,
которое необходимо подвести к телу для его нагревания, или выделяемое телом,
при его охлаждении:
Q
= cm(t
– t0).
Из
формулы видно, что количество теплоты зависит от массы тела, разности
температур в конечном и начальном состояниях, а также от удельной теплоёмкости
вещества, из которого это тело изготовлено.
Чтобы
вспомнить, же что же такое теплоёмкость, рассмотрим решение следующей задачи.
Задача
1.
В сосуд с горячей водой опустили алюминиевую и латунную болванки одинаковой
массы и температуры. Одинаковым ли будет изменение их температур?
В
жизненных ситуациях довольно часто возникает необходимость в тепловых расчётах.
Например, при строительстве жилых домов необходимо знать, какое количество
теплоты должна отдавать зданию система отопления. Или нужно определить
температуру после смешивания горячей и холодной воды. И на этом уроке мы
разберёмся, как проводятся такие расчёты.
Последовательность
действий при решении задач на расчёт теплообменных процессов:
Задача
2.
Для купания ребёнка температура воды в ванночке не должна превышать 38 оС.
Для этого родители смешали 40 кг холодной воды при температуре 12 оС
и 20 кг горячей воды при температуре 90 оС. Если потерями тепла
можно пренебречь, то какое количество теплоты получили холодная вода при
нагревании и отдала горячая вода при охлаждении?
Мы
получили, что количество теплоты, отданное горячей водой, равно количеству
теплоты, полученному водой холодной. И это не случайно. Вспомните: если
между телами происходит теплообмен, то внутренняя энергия всех нагревающихся
тел увеличивается ровно на столько, на сколько уменьшается внутренняя энергия
остывающих тел.
Конечно
в реальных условиях количество теплоты, отданное горячей водой, всегда будет
больше чем-то количество теплоты, которое получит холодная вода. Это
объясняется тем, что часть энергии идёт на нагревание сосуда, в котором
находилась вода, а ещё часть теряется на нагревание окружающего воздуха.
Теперь
мы можем внести дополнительный пункт в нашу последовательность действий при
решении задач — пункт о необходимости составления уравнения теплового
баланса.
Количество
теплоты, отданное или полученное телом, можно измерить с помощью прибора,
который называется калориметр.
Школьный калориметр
Школьный
калориметр состоит из двух стаканов, вставленных один в другой. Воздушная
прослойка и подставка между ними уменьшают теплопередачу между содержимым
внутреннего стакана и окружающим воздухом.
Задача
3.
Калориметр содержит 3 л воды при температуре 80 оС. В воду опускают
нагретый на плитке кирпич массой 1,5 кг. Определите начальную температуру
кирпича, если в результате теплообмена температура воды повысилась до 9 оС.
Теплопередачей калориметру и окружающему воздуху можно пренебречь.
Обратите
внимание на то, что в некоторых задачах теплоёмкостью калориметра пренебрегать
нельзя. В этом случае необходимо учитывать, что и вода, и калориметр будут
нагреваться или охлаждаться вместе. А их температуры можно считать одинаковыми.
О тепловой энергии простым языком!
Опубликовано 13 Окт 2013
Рубрика: Теплотехника | 117 комментариев

…энергию вакуума и еще существующую только в теории – темную энергию. В этой статье, первой в рубрике «Теплотехника», я попытаюсь на простом и доступном языке, используя практический пример, рассказать о важнейшем виде энергии в жизни людей — о тепловой энергии и о рождающей ее во времени тепловой мощности.
Несколько слов для понимания места теплотехники, как раздела науки о получении, передаче и применении тепловой энергии. Современная теплотехника выделилась из общей термодинамики, которая в свою очередь является одним из разделов физики. Термодинамика – это дословно «теплый» плюс «силовой». Таким образом, термодинамика – это наука об «изменении температуры» системы.
Воздействие на систему извне, при котором изменяется ее внутренняя энергия, может являться результатом теплообмена. Тепловая энергия, которая приобретается или теряется системой в результате такого взаимодействия с окружающей средой, называется количеством теплоты и измеряется в системе СИ в Джоулях.
Если вы не инженер-теплотехник, и ежедневно не занимаетесь теплотехническими вопросами, то вам, столкнувшись с ними, иногда без опыта бывает очень трудно быстро в них разобраться. Трудно без наличия опыта представить даже размерность искомых значений количества теплоты и тепловой мощности. Сколько Джоулей энергии необходимо чтобы нагреть 1000 метров кубических воздуха от температуры -37˚С до +18˚С?.. Какая нужна мощность источника тепла, чтобы сделать это за 1 час?.. На эти не самые сложные вопросы способны сегодня ответить «сходу» далеко не все инженеры. Иногда специалисты даже помнят формулы, но применить их на практике могут лишь единицы!
Прочитав до конца эту статью, вы сможете легко решать реальные производственные и бытовые задачи, связанные с нагревом и охлаждением различных материалов. Понимание физической сути процессов теплопередачи и знание простых основных формул – это главные блоки в фундаменте знаний по теплотехнике!
Количество теплоты при различных физических процессах.
Большинство известных веществ могут при разных температуре и давлении находиться в твердом, жидком, газообразном или плазменном состояниях. Переход из одного агрегатного состояния в другое происходит при постоянной температуре (при условии, что не меняются давление и другие параметры окружающей среды) и сопровождается поглощением или выделением тепловой энергии. Не смотря на то, что во Вселенной 99% вещества находится в состоянии плазмы, мы в этой статье не будем рассматривать это агрегатное состояние.
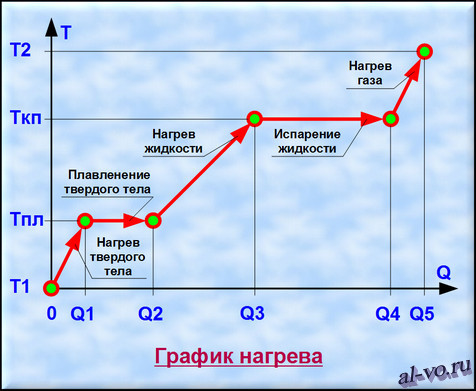
Рассмотрим график, представленный на рисунке. На нем изображена зависимость температуры вещества Т от количества теплоты Q, подведенного к некой закрытой системе, содержащей определенную массу какого-то конкретного вещества.
1. Твердое тело, имеющее температуру T1, нагреваем до температуры Tпл, затрачивая на этот процесс количество теплоты равное Q1.
2. Далее начинается процесс плавления, который происходит при постоянной температуре Тпл (температуре плавления). Для расплавления всей массы твердого тела необходимо затратить тепловой энергии в количестве Q2— Q1.
3. Далее жидкость, получившаяся в результате плавления твердого тела, нагреваем до температуры кипения (газообразования) Ткп, затрачивая на это количество теплоты равное Q3—Q2.
4. Теперь при неизменной температуре кипения Ткп жидкость кипит и испаряется, превращаясь в газ. Для перехода всей массы жидкости в газ необходимо затратить тепловую энергию в количестве Q4—Q3.
5. На последнем этапе происходит нагрев газа от температуры Ткп до некоторой температуры Т2. При этом затраты количества теплоты составят Q5—Q4. (Если нагреем газ до температуры ионизации, то газ превратится в плазму.)
Таким образом, нагревая исходное твердое тело от температуры Т1 до температуры Т2 мы затратили тепловую энергию в количестве Q5, переводя вещество через три агрегатных состояния.
Двигаясь в обратном направлении, мы отведем от вещества то же количество тепла Q5, пройдя этапы конденсации, кристаллизации и остывания от температуры Т2 до температуры Т1. Разумеется, мы рассматриваем замкнутую систему без потерь энергии во внешнюю среду.
Заметим, что возможен переход из твердого состояния в газообразное состояние, минуя жидкую фазу. Такой процесс именуется возгонкой, а обратный ему процесс – десублимацией.
Итак, уяснили, что процессы переходов между агрегатными состояниями вещества характеризуются потреблением энергии при неизменной температуре. При нагреве вещества, находящегося в одном неизменном агрегатном состоянии, повышается температура и также расходуется тепловая энергия.
Главные формулы теплопередачи.
Формулы очень просты.
Количество теплоты Q в Дж рассчитывается по формулам:
1. Со стороны потребления тепла, то есть со стороны нагрузки:
1.1. При нагревании (охлаждении):
Q=m*c*(Т2—Т1)
Здесь и далее:
m – масса вещества в кг
с – удельная теплоемкость вещества в Дж/(кг*К)
1.2. При плавлении (замерзании):
Q=m*λ
λ – удельная теплота плавления и кристаллизации вещества в Дж/кг
1.3. При кипении, испарении (конденсации):
Q=m*r
r – удельная теплота газообразования и конденсации вещества в Дж/кг
2. Со стороны производства тепла, то есть со стороны источника:
2.1. При сгорании топлива:
Q=m*q
q – удельная теплота сгорания топлива в Дж/кг
2.2. При превращении электроэнергии в тепловую энергию (закон Джоуля — Ленца):
Q=t*I*U=t*R*I^2=(t/R)*U^2
t – время в с
I – действующее значение тока в А
U – действующее значение напряжения в В
R – сопротивление нагрузки в Ом
Делаем вывод – количество теплоты прямо пропорционально массе вещества при всех фазовых превращениях и при нагреве дополнительно прямо пропорционально разности температур. Коэффициенты пропорциональности (c, λ, r, q) для каждого вещества имеют свои значения и определены опытным путем (берутся из справочников).
Тепловая мощность N в Вт – это количество теплоты переданное системе за определенное время:
N=Q/t
Чем быстрее мы хотим нагреть тело до определенной температуры, тем большей мощности должен быть источник тепловой энергии – все логично.
В жизни бывает часто необходимо сделать быстрый оценочный расчет, чтобы понять – имеет ли смысл продолжать изучение темы, делая проект и развернутые точные трудоемкие расчеты. Сделав за несколько минут расчет даже с точностью ±30%, можно принять важное управленческое решение, которое будет в 100 раз более дешевым и в 1000 раз более оперативным и в итоге в 100000 раз более эффективным, чем выполнение точного расчета в течение недели, а то и месяца, группой дорогостоящих специалистов…
Условия задачи:
В помещение цеха подготовки металлопроката размерами 24м х 15м х 7м завозим со склада на улице металлопрокат в количестве 3т. На металлопрокате есть лед общей массой 20кг. На улице -37˚С. Какое количество теплоты необходимо, чтобы нагреть металл до +18˚С; нагреть лед, растопить его и нагреть воду до +18˚С; нагреть весь объем воздуха в помещении, если предположить, что до этого отопление было полностью отключено? Какую мощность должна иметь система отопления, если все вышесказанное необходимо выполнить за 1час? (Очень жесткие и почти не реальные условия – особенно касающиеся воздуха!)
Расчет выполним в программе MS Excel или в программе OOo Calc.
С цветовым форматированием ячеек и шрифтов ознакомьтесь на странице «О блоге».
Исходные данные:
1. Названия веществ пишем:
в ячейку D3: Сталь
в ячейку E3: Лед
в ячейку F3: Лед/вода
в ячейку G3: Вода
в ячейку G3: Воздух
2. Названия процессов заносим:
в ячейки D4, E4, G4, G4: нагрев
в ячейку F4: таяние
3. Удельную теплоемкость веществ c в Дж/(кг*К) пишем для стали, льда, воды и воздуха соответственно
в ячейку D5: 460
в ячейку E5: 2110
в ячейку G5: 4190
в ячейку H5: 1005
4. Удельную теплоту плавления льда λ в Дж/кг вписываем
в ячейку F6: 330000
5. Массу веществ m в кг вписываем соответственно для стали и льда
в ячейку D7: 3000
в ячейку E7: 20
Так как при превращении льда в воду масса не изменяется, то
в ячейках F7 и G7: =E7=20
Массу воздуха находим произведением объема помещения на удельный вес
в ячейке H7: =24*15*7*1,23=3100
6. Время процессов t в мин пишем только один раз для стали
в ячейку D8: 60
Значения времени для нагрева льда, его плавления и нагрева получившейся воды рассчитываются из условия, что все эти три процесса должны уложиться в сумме за такое же время, какое отведено на нагрев металла. Считываем соответственно
в ячейке E8: =E12/(($E$12+$F$12+$G$12)/D8)=9,7
в ячейке F8: =F12/(($E$12+$F$12+$G$12)/D8)=41,0
в ячейке G8: =G12/(($E$12+$F$12+$G$12)/D8)=9,4
Воздух также должен прогреться за это же самое отведенное время, читаем
в ячейке H8: =D8=60,0
7. Начальную температуру всех веществ T1 в ˚C заносим
в ячейку D9: -37
в ячейку E9: -37
в ячейку F9: 0
в ячейку G9: 0
в ячейку H9: -37
8. Конечную температуру всех веществ T2 в ˚C заносим
в ячейку D10: 18
в ячейку E10: 0
в ячейку F10: 0
в ячейку G10: 18
в ячейку H10: 18
Думаю, вопросов по п.7 и п.8 быть недолжно.
Результаты расчетов:
9. Количество теплоты Q в КДж, необходимое для каждого из процессов рассчитываем
для нагрева стали в ячейке D12: =D7*D5*(D10-D9)/1000=75900
для нагрева льда в ячейке E12: =E7*E5*(E10-E9)/1000= 1561
для плавления льда в ячейке F12: =F7*F6/1000= 6600
для нагрева воды в ячейке G12: =G7*G5*(G10-G9)/1000= 1508
для нагрева воздуха в ячейке H12: =H7*H5*(H10-H9)/1000= 171330
Общее количество необходимой для всех процессов тепловой энергии считываем
в объединенной ячейке D13E13F13G13H13: =СУММ(D12:H12) = 256900
В ячейках D14, E14, F14, G14, H14, и объединенной ячейке D15E15F15G15H15 количество теплоты приведено в дугой единице измерения – в ГКал (в гигакалориях).
10. Тепловая мощность N в КВт, необходимая для каждого из процессов рассчитывается
для нагрева стали в ячейке D16: =D12/(D8*60)=21,083
для нагрева льда в ячейке E16: =E12/(E8*60)= 2,686
для плавления льда в ячейке F16: =F12/(F8*60)= 2,686
для нагрева воды в ячейке G16: =G12/(G8*60)= 2,686
для нагрева воздуха в ячейке H16: =H12/(H8*60)= 47,592
Суммарная тепловая мощность необходимая для выполнения всех процессов за время t рассчитывается
в объединенной ячейке D17E17F17G17H17: =D13/(D8*60) = 71,361
В ячейках D18, E18, F18, G18, H18, и объединенной ячейке D19E19F19G19H19 тепловая мощность приведена в дугой единице измерения – в Гкал/час.
На этом расчет в Excel завершен.
Выводы:
Обратите внимание, что для нагрева воздуха необходимо более чем в два раза больше затратить энергии, чем для нагрева такой же массы стали.
При нагреве воды затраты энергии в два раза больше, чем при нагреве льда. Процесс плавления многократно больше потребляет энергии, чем процесс нагрева (при небольшой разности температур).
Нагрев воды в десять раз затрачивает больше тепловой энергии, чем нагрев стали и в четыре раза больше, чем нагрев воздуха.
Мы вспомнили понятия «количество теплоты» и «тепловая мощность», рассмотрели фундаментальные формулы теплопередачи, разобрали практический пример. Надеюсь, что мой язык был прост и понятен.
Ссылка на скачивание файла: raschet-teplovoy-moshchnosti (xls 19,5KB).
Другие статьи автора блога
На главную