Have you ever wondered where the information about calories on food labels comes from? How is it possible to know how much energy food will provide without actually studying its path from the mouth to whatever cells wind up consuming the glucose molecules generated from the carbohydrates, fats and proteins making up the (non-water) portions of food you eat?
The calorie content, or the calorific value, of a substance is the amount of energy that is liberated when the substance is completely «burned,» or undergoes complete combustion. Combustion is one of the five basic types of chemical reactions, and it always occurs in the presence of oxygen gas (O2), with the other reactant being some kind of (usually carbon-based) fuel.
- The calorific value of a substance is usually given on a per-amount basis, that is, per mole (m) of substance burned.
How Is Calorific Fuel Energy Measured?
First, some terminology. A calorie (cal) is the amount of heat (energy) needed to raise the temperature of 1 g (gram) of water 1 degree Celsius (°C). The «calories» on nutrition labels are actually kilocalories, or kcal (1,000 cal). In chemistry, the standard unit of energy is the joule (J), equal to 4.18 cal. Thus, 1 food «calorie» is equal to (1.000)(4.18) J = 4.18 kJ.
The energy content of food is measured by putting a known mass of a specific substance (e.g., ethanol, an amino acid, glucose) into a device called a bomb calorimeter and measuring the amount of heat liberated when the reaction goes to completion. This is accomplished by measuring the temperature change of a known mass of water in the sealed calorimeter.
This sub-science, called calorimetry, allows for a theoretical calculation of calorific value. It depends on knowing how a given energy input changes a known mass of water. In fact, this quantity, called the specific heat of water, has been known for some time and is explained below. (Other substances have their own specific heats for use in different chemistry situations.)
How to Calculate the Calorific Value of Fuel
The formula for the heat of combustion (or enthalpy of combustion) is an equation:
H = m_C_ΔT
Here, H is the heat released by combustion, m is the mass in grams of the water used as a heat collector, C is the specific heat of water (4.184 J/g⋅°C) , and ΔT is the temperature change in °C.
The calorific value formula often looks different from this, because H and C are often represented by a different symbols. As long as the units all align so that you are left with units of energy (preferably J), the precise calorific value formula you use does not matter.
Calorific Value Calculation Example
A 15.5-gram sample of ethanol, C2H6O (the alcohol in «adult beverages») is burned in 2,000 g of H2O (2 liters at room temperature). This results in a temperature change of 55 °C. What is the molar heat of combustion (heat of combustion per mole) of ethanol? Refer to a periodic table (see the Resources) for molecular weights of elements.
First, use a periodic table to calculate the number of moles of ethanol present. 1 mol contains two C atoms (molecular weight, or MW, of 12.0 g; six H atoms (MW = 1.07 g); and one oxygen atom (MW = 16.0 g). Thus 1 mol = (2)(12) + (6)(1) + 16 = 46.0 g. You have 15.5 g, so you have 15.5/46.0 = 0.336 mol.
Now, refer to the equation above to figure out the energy liberated from the mass m, the known value of C, and the temperature change ΔT of the water:
H = (2,000 g)(4.184 J/g⋅°C)(55 °C) = 460,240 J = 460.24 kJ
Now, divide by the number of moles present to get the molar heat of combustion of ethanol:
(460.24 kJ)/(0.336 mol) = 1,369 kJ/mol.
This is a substantial number, what you would expect of something that can be used to power automobiles.
20 февраля 2008 в 00:42 , Обновлено 23 февраля 10:43
84944
Теплотворная способность является одной из наиболее значимых характеристик топлива
Теплотворная способность (удельная теплота сгорания, теплоспособность) — основной показатель топлива, характеризует количество теплоты, выделяемое при полном сгорании топлива массой 1 кг или объемом 1 м³ (1 л).
В общем случае — это общая энергия, выделяемая в виде тепла при полном сгорании вещества с кислородом в стандартных условиях.
- химическая реакция — реакция углеводорода или иной органической молекулы с кислородом:
- с образованием углекислого газа (CO2) и воды,
- выделением тепла;
- часто измеряется в Дж/кг (Дж/м³; Дж/л);
- сгорания определяется химическим составом горючего вещества.
- зависит от:
- горючих составляющих топлива (углерода, водорода, летучей горючей серы и т. д.);
- влажности и зольности топлива,
- чем выше удельная теплота сгорания топлива, тем меньше его расход.
Поэтому теплотворная способность является одной из наиболее значимых характеристик топлива.
Для сравнительных расчетов используется так называемое Условное топливо (УТ).
Удельная теплота сгорания УТ равна 29308 кДж/кг (7000 ккал/кг).
При анализе топлива и в теплотехнических расчетах используются понятия:
- Высшая теплотворная способность — количество теплоты, выделяемой при полном сгорании топлива, охлаждении продуктов сгорания до температуры топлива и конденсации водяного пара, образовавшегося при окислении водорода, входящего в состав топлива;
- Низшая теплотворная способность — количество теплоты, выделяемой при полном сгорании топлива без конденсации водяного пара.
Теплотворная способность топлива, Мдж/кг :
| водород | 120,9 |
| метан | 50,1 |
| пропан | 47,5 |
| бензин | 45,5 |
| керосин | 44,0 |
| дизельное топливо | 42,6 |
| бутанол | 36,0 |
| уголь | 29,3 |
| этанол | 22,2 |

Q = Qг = 882.6 = 55.16 кДж г = 55.16 ×103 кДж кг.
M 16
·Найдем объем 1 кг метана, зная его плотность ρ=0.717 кг/м3 при нормальных условиях:
|
V = |
1 |
= |
1 |
=1.395 м3 кг . |
|
|
r |
0.717 |
||||
· Определим теплотворную способность 1 м3 метана:
Q = 55.16 ×103 = 39.54 ×103 кДж м3 = 39.54 МДж м3 . 1.395
Аналогично определяется теплотворная способность любых горючих газов. Для многих распространенных веществ значения теплоты горения и теплотворной способности были измерены с высокой точностью и приведены в соответствующей справочной литературе. Приведем таблицу значений теплотворной способности некоторых газообразных веществ (табл. 5.1). Величина Q в этой таблице приведена в МДж/м3 и в ккал/м3, поскольку часто в качестве единицы теплоты используется 1 ккал = 4.1868 кДж.
|
Таблица 5.1 |
||||||
|
Теплотворная способность газообразных топлив |
||||||
|
Вещество |
Метан |
Ацетилен |
Этан |
Пропан |
Бутан |
|
|
Q |
МДж/м3 |
39.54 |
57.78 |
69.33 |
98.18 |
126.57 |
|
ккал/м3 |
9444 |
13800 |
16560 |
23450 |
30230 |
Горючее вещество – жидкость или твердое тело
В качестве примера проведем расчет теплотворной способности этилового спирта С2Н5ОН, для которого теплота горения Qг = 1373.3 кДж/моль.
·Определим молекулярную массу этилового спирта в соответствии с его химической формулой (С2Н5ОН):
М= 2·12 + 5·1 + 1·16 + 1·1 = 46 г/моль.
·Определим теплотворную способность 1 кг этилового спирта:
|
Q = |
Qг |
= |
1373.3 |
= 29.85 кДж/г = 29.85 ×103 кДж/кг = 29.85 МДж/кг . |
|
M |
||||
|
46 |
||||
|
61 |
Аналогично определяется теплотворная способность любых жидких и твердых горючих. В табл. 5.2 и 5.3 приведены значения теплотворной способности Q (МДж/кг и ккал/кг) для некоторых жидких и твердых веществ.
Таблица 5.2
Теплотворная способность жидких топлив
|
Вещество |
Метиловый |
Этиловый |
Ацетон |
Керосин |
Мазут, |
Бензин |
|||||||||
|
спирт |
спирт |
нефть |
|||||||||||||
|
Q |
МДж/кг |
23.85 |
29.85 |
30.98 |
41.87 |
43.96 |
46.89 |
||||||||
|
ккал/кг |
5700 |
7130 |
7400 |
10000 |
10500 |
11200 |
|||||||||
|
Таблица 5.3 |
|||||||||||||||
|
Теплотворная способность твердых топлив |
|||||||||||||||
|
Вещество |
Дерево |
Дерево |
Бурый |
Торф |
Антрацит, |
Парафин |
|||||||||
|
свежее |
сухое |
уголь |
сухой |
кокс |
|||||||||||
|
Q |
МДж/кг |
6.28 |
14.65 |
16.75 |
27.63 |
31.40 |
46.05 |
||||||||
|
ккал/кг |
1500 |
3500 |
4000 |
6600 |
7500 |
11000 |
|||||||||
Формула Менделеева
Если теплотворная способность топлива неизвестна, то ее можно рассчитать с помощью эмпирической формулы, предложенной Д.И. Менделеевым. Для этого необходимо знать элементарный состав топлива (эквивалентную формулу топлива), то есть процентное содержание в нем следующих элементов:
—кислорода (О);
—водорода (Н);
—углерода (С);
—серы (S);
—золы (А);
—воды (W).
Впродуктах сгорания топлив всегда содержатся пары воды, образующиеся как из-за наличия влаги в топливе, так и при сгорании водорода. Отработанные продукты сгорания покидают промышленную установку при температуре выше температуры точки росы. Поэтому тепло, которое выделяется при конденсации водяных паров, не может быть полезно использовано и не должно учитываться при тепловых расчетах.
Для расчета обычно применяется низшая теплотворная способность Qн топлива, которая учитывает тепловые потери с парами воды. Для твердых и
жидких топлив величина Qн (МДж/кг) приближенно определяется по формуле Менделеева:
|
Qн=0.339[C]+1.025[H]+0.1085[S] – 0.1085[O] – 0.025[W] , |
(5.1) |
|
62 |
где в скобках указано процентное (масс. %) содержание соответствующих элементов в составе топлива.
В этой формуле учитывается теплота экзотермических реакций горения углерода, водорода и серы (со знаком «плюс»). Кислород, входящий в состав топлива, частично замещает кислород воздуха, поэтому соответствующий член в формуле (5.1) берется со знаком «минус». При испарении влаги теплота расходуется, поэтому соответствующий член, содержащий W, берется также со знаком «минус».
Сравнение расчетных и опытных данных по теплотворной способности разных топлив (дерево, торф, уголь, нефть) показало, что расчет по формуле Менделеева (5.1) дает погрешность, не превышающую 10%.
Низшая теплотворная способность Qн (МДж/м3) сухих горючих газов с достаточной точностью может быть рассчитана как сумма произведений теплотворной способности отдельных компонентов и их процентного содержания в 1 м3 газообразного топлива.
Qн = 0.108[Н2] + 0.126[СО] + 0.358[СН4] + 0.5[С2Н2] + 0.234[Н2S]…, (5.2)
где в скобках указано процентное (объем. %) содержание соответствующих газов в составе смеси.
Всреднем теплотворная способность природного газа составляет примерно
53.6МДж/м3. В искусственно получаемых горючих газах содержание метана СН4 незначительно. Основными горючими составляющими являются водород Н2 и оксид углерода СО. В коксовальном газе, например, содержание Н2 доходит до
(55 ÷ 60)%, а низшая теплотворная способность такого газа достигает 17.6 МДж/м3. В генераторном газе содержание СО ~ 30% и Н2 ~15%, при этом низшая теплотворная способность генераторного газа Qн = (5.2÷6.5) МДж/м3. В доменном газе содержание СО и Н2 меньше; величина Qн = (4.0÷4.2) МДж/м3.
Рассмотрим примеры расчета теплотворной способности веществ по формуле Менделеева.
Пример 1.
Определим теплотворную способность угля, элементный состав которого приведен в табл. 5.4.
Таблица 5.4
Элементный состав угля
|
Элемент |
C |
H |
S |
N |
O |
W |
A |
|
Содержание, масс.% |
37.2 |
2.6 |
0.6 |
0.4 |
12 |
40 |
7.2 |
∙ Подставим приведенные в табл. 5.4 данные в формулу Менделеева (5.1) (азот N и зола A в эту формулу не входят, поскольку являются инертными веществами и не участвуют в реакции горения):
Qн=0.339·37.2+1.025·2.6+0.1085·0.6–0.1085 ·12–0.025 ·40=13.04 МДж/кг.
63

Пример 2.
Определим количество дров, необходимое для нагрева 50 литров воды от 10°С до 100°С, если на нагревание расходуется 5% теплоты, выделяемой при
|
горении, а теплоемкость воды |
с=1 ккал/(кг·град) или 4.1868 кДж/(кг·град). |
||||||
|
Элементный состав дров приведен в табл. 5.5: |
|||||||
|
Таблица 5.5 |
|||||||
|
Элементный состав дров |
|||||||
|
Элемент |
C |
H |
N |
O |
W |
||
|
Содержание, масс.% |
43 |
7 |
2 |
41 |
7 |
∙ Определим количество теплоты, необходимое для нагрева m=50 кг воды:
Q1= сmDT = 4.1868×50 ×(100 —10) = 18.84 МДж .
∙ Найдем теплотворную способность дров по формуле Менделеева (5.1):
Qн=0.339·43+1.025·7–0.1085 ·41–0.025 ·7= 17.12 МДж/кг.
∙Определим количество теплоты, расходуемое на нагрев воды, при сгорании 1 кг дров (с учетом того, что на ее нагрев расходуется 5% теплоты (α=0.05), выделяемой при горении):
Q2=αQн=0.05·17.12=0.86 МДж/кг.
∙Определим количество дров, необходимое для нагрева 50 литров воды от 10°С
до 100°С:
M= Q1 = 18.84 = 21.91 кг. Q2 0.86
Таким образом, для нагрева воды требуется около 22 кг дров.
5.2. ТЕОРЕТИЧЕСКАЯ ТЕМПЕРАТУРА ГОРЕНИЯ
Температура горения любого вещества не является постоянной величиной. Она зависит от условий горения (в замкнутом объеме или на открытом воздухе), от условий теплоотдачи, полноты сгорания топлива, коэффициента избытка воздуха и других факторов.
Для сравнения температуры горения Тг разных веществ расчет ведется при строго одинаковых следующих условиях.
∙Горючее и воздух вступают в реакцию горения при температуре Т = 0°С.
∙Количество воздуха равно теоретически необходимому, то есть коэффициент избытка воздуха α=1.
∙Горение происходит мгновенно до полного окисления (СО2, Н2О, SO2) без образования промежуточных продуктов неполного горения (например, угарного газа СО).
∙Вся выделенная теплота сообщается продуктам горения и расходуется
исключительно на их нагревание.
Рассчитанная при этих условиях температура называется теоретической. Практически реализуемая температура горения T (при пожарах, при горении в
64
печах, каминах, камерах сгорания и других технических устройствах) всегда ниже теоретической Tг. Это связано с тем, что реальный процесс горения происходит с избытком воздуха, в условиях неполного сгорания. Кроме того, теплота горения частично расходуется на нагрев окружающей среды, а при температурах выше 1700°С – на диссоциацию продуктов горения.
Например, при горении древесины, отличие Тг от практически реализуемой температуры горения может достигать более 500°С (табл. 5.6).
Таблица 5.6
Температура горения древесины
|
Древесина |
Q, МДж/кг |
Тг, °С |
Т, °С |
|
Береза |
13.25 |
1575 |
1069 |
|
Ель |
13.45 |
1590 |
1080 |
|
Сосна |
13.84 |
1605 |
1090 |
Расчет теоретической температуры горения
При определении теоретической температуры горения Тг предполагается, что вся выделившаяся теплота сообщается продуктам сгорания. Температура, до которой нагреются продукты сгорания, зависит от количества сообщаемой им теплоты, состава и количества продуктов сгорания и их удельной теплоемкости. Для расчета теоретической температуры горения Тг запишем уравнение теплового баланса.
|
Q = Vcp (Тг − Тн ) , |
(5.3) |
|||
|
где Q – |
теплотворная способность топлива, Дж/кг; |
|||
|
V – объем продуктов сгорания, образующихся при горении 1 кг топлива, |
||||
|
м3/кг; |
||||
|
сp – объемная удельная теплоемкость продуктов сгорания, Дж/(м3·град); |
||||
|
Тг – |
теоретическая температура горения, °С; |
|||
|
Тн – |
начальная температура воздуха, °С. |
|||
|
При горении в нормальных условиях (Тн=0°С) уравнение (5.3) примет вид: |
||||
|
Q = Vc pТг . |
(5.4) |
|||
|
Из (5.4) следует формула для расчета теоретической температуры горения: |
||||
|
T = |
Q |
(5.5) |
||
|
г |
Vc p . |
|||
Поскольку продукты сгорания реальных топлив, как правило, состоят из разных газов, теплоемкость и плотность которых различны, то эта формула (5.4) записывается в следующем виде:
|
Q = V1c1Tг +V2c2Tг + … +VncnTг |
= Tг ∑Vici |
(5.6) |
|
i |
. |
|
Соответственно, формула для расчета с учетом (5.6) примет вид
65
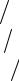
|
Тг |
= |
Q |
|||
|
∑Vici . |
(5.7) |
||||
i
Для повышения точности расчетов необходимо учитывать зависимость теплоемкости газов от температуры. Однако, для оценочных расчетов можно принять средние значения теплоемкости (табл. 5.7).
Таблица 5.7 Средняя теплоемкость (сp) газов в диапазоне температур (1000÷3000) °С
|
Газ |
СО2 |
SO2 |
H2O |
H2 |
N2 |
CO |
O2 |
|
кДж/(м3·град) |
2.13 |
2.13 |
2.09 |
1.42 |
1.42 |
1.42 |
1.42 |
Расчет теоретической температуры горения Тг проводится в следующем порядке.
∙Рассчитывается количество и состав продуктов горения, образующихся при сгорании 1 кг заданного топлива в соответствии с методикой, изложенной выше (раздел 4.4).
∙Рассчитывается по формулам (5.1) или (5.2), или определяется из таблиц теплотворная способность топлива Q.
∙Рассчитывается теоретическая температура горения Тг по формуле
(5.7).
В качестве примера определим теоретическую температуру горения каменного угля, элементный состав которого приведен в табл. 5.8., при коэффициенте избытка воздуха α=1.5.
|
Таблица 5.8 |
|||||||||
|
Элементный состав угля |
|||||||||
|
Элемент |
C |
H |
S |
N |
O |
W |
A |
||
|
Содержание, масс.% |
76 |
4.5 |
4.7 |
1.8 |
3.5 |
3.0 |
6.5 |
||
|
Массовая доля, z |
0.76 |
0.045 |
0.047 |
0.018 |
0.035 |
0.03 |
0.065 |
||
|
∙ |
Определим состав и количество газообразных продуктов сгорания 1 кг |
||||||||
|
рассматриваемого топлива в данных условиях по методике, приведенной в |
|
разделе 4. |
V1 = 1.46 м3 |
||||
|
Объем СО2 и SO2: |
кг ; |
сp=2.13·10-3 |
МДж/(м3·град). |
||
|
Объем H2O: |
V2 |
= 0.53 м3 |
кг; |
сp=2.09·10-3 |
МДж/(м3·град). |
|
Объем N2 и О2: |
V3 |
= 10.34 м3 кг ; |
сp=1.42·10-3 |
МДж/(м3·град). |
∙Проведем расчет теплотворной способности рассматриваемого топлива по формуле Менделеева (5.1):
Qн=0.339·76+1.025·4.5+0.1085·4.7–0.1085 ·3.5–0.025 ·3.0=29.92 МДж/кг.
∙Проведем расчет теоретической температуры горения по формуле
(5.7):
66
|
Тг |
= |
29.92 |
= 1583.0O С. |
|||
|
×2.13×10−3 |
+ 0.53× 2.09 ×10−3 |
+10.34 ×1.42 ×10−3 |
||||
|
1.46 |
Таким образом, теоретическая температура горения каменного угля при коэффициенте избытка воздуха α=1.5 в условиях постоянного давления (на открытом воздухе) составляет около 1600°С.
6.ВЗРЫВЧАТЫЕ ВЕЩЕСТВА
Взрыв – это процесс чрезвычайно быстрого физического или химического превращения вещества, сопровождающийся столь же быстрым превращением потенциальной энергии вещества в механическую работу. Самая существенная черта взрыва – внезапное и резкое повышение давления в среде, окружающей место взрыва. Обычный внешний признак взрыва – значительный звуковой эффект.
6.1. КЛАССИФИКАЦИЯ ВЗРЫВОВ
Примеры взрывов, вызванных физическими причинами, – это взрыв паровых котлов (перегрев пара или мгновенное испарение воды при подаче ее в перегретый котел; взрыв газовых баллонов при их нагреве). Эти взрывы, как правило, вызваны превышением допустимого давления расчетной прочности стенок баллона или котла.
Далее будем рассматривать взрывы при химическом превращении веществ. Пример – взрыв черного (дымного) пороха при выстреле из охотничьего ружья. При этом происходит быстрая химическая реакция, в результате которой образуются газообразные и твердые продукты сгорания и выделяется теплота. Образовавшиеся газы, обладающие высокой температурой и давлением, совершают механическую работу по разгону пули до необходимой скорости.
Взрывчатыми веществами называются такие вещества, при химическом превращении которых происходят взрывы.
Взрыв может быть вызван следующими причинами.
∙Нагревание.
∙Укол.
∙Удар.
∙Трение.
∙Детонация (передача энергии взрыва другого взрывчатого вещества). Явление взрыва всегда характеризуется следующими факторами.
∙Очень большая скорость химического превращения.
∙Выделение газов.
∙Выделение теплоты.
Только при наличии всех этих факторов будет происходить процесс взрывчатого превращения. Каждое из этих условий является необходимым, но недостаточным для того, чтобы та или иная химическая реакция могла быть
67
отнесена к категории взрыва. Например, при горении термитной смеси выделяется теплота (нагрев продуктов реакции до 30000С, реакция протекает очень быстро, но не выделяются газообразные продукты). Поэтому такая реакция не является взрывчатым превращением.
Наиболее характерным для взрыва является большая скорость химических превращений. Процесс взрыва длится в промежуток времени ~ (10-2÷10 -5) с. Например, боевой заряд в орудии среднего калибра сгорает за время ~ 0.008 с, шашка тола массой 400 г – за время ~ 10-5 с. Только за счет такого быстрого превращения у взрывчатых веществ получается огромная по сравнению с другими источниками энергии мощность, хотя общие запасы энергии у них не больше, а в некоторых случаях даже меньше, чем у обычных горючих веществ. При взрыве взрывчатого вещества образуется большое количество газов, обладающих высокой температурой и давлением. Количество выделяющихся при взрыве газов определяется по объему, который они занимали бы при нормальных условиях, то есть при температуре Т = 00С и давлении р = 760 мм ртутного столба. Например, при взрыве 1 кг пироксилинового пороха в таких условиях выделяется 0.845 м3 газов.
В зависимости от скорости взрывчатого превращения различают следующие его формы:
∙Быстрое сгорание.
∙Обыкновенный взрыв.
∙Детонация.
При быстром сгорании процесс взрывчатого превращения протекает в массе взрывчатого вещества со скоростью порядка нескольких метров в секунду, а на сам процесс большое влияние оказывают внешние условия. Если горение происходит на открытом воздухе, оно не сопровождается звуковым эффектом или механической работой разрушения или перемещения. Если горение происходит в замкнутом или полузамкнутом объеме, то процесс идет более энергично и сопровождается резким звуком. Для быстрого горения характерно относительно быстрое, но плавное нарастание давления газов (артиллерийский выстрел, газогенератор для вытеснения нефтяных пластов, пороховой газогенератор автомобильной подушки безопасности и т.д.).
При обыкновенном взрыве процесс превращения в массе взрывчатого вещества протекает со скоростями в несколько сотен метров в секунду. Обыкновенный взрыв характеризуется резким повышением давления в месте взрыва, ударом газов о преграду и разрушением (раскалыванием или дроблением) преграды, находящейся на небольшом расстоянии от места взрыва.
При детонации процесс превращения в массе взрывчатого вещества протекает с максимально возможной в данных условиях скоростью (обычно 5 ÷ 7 километров в секунду). Детонация характеризуется особенно резким скачком давления, сильным ударом газов о преграду и большим ее разрушением. Примеры детонации – все виды взрывов взрывчатых веществ, вызванных детонатором (разрыв снаряда, мины, гранаты, подрывной шашки и т.д.).
68
6.2. ХАРАКТЕРИСТИКИ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
Взрывчатые вещества представляют собой неустойчивые химические соединения или смеси, способные под влиянием незначительных внешних воздействий к очень быстрым химическим превращениям. Взрывчатые вещества отличаются от обычного горючего вещества тем, что процесс взрывчатого превращения в нем происходит за счет кислорода, содержащегося в самом взрывчатом веществе. При горении обычных горючих веществ кислород необходимо подводить извне (из атмосферы) с ограниченной скоростью. Взрывчатые вещества являются основными источниками энергии для выброса снаряда (пули) из канала ствола и для действия снаряда у цели (поражение и разрушение).
К взрывчатым веществам предъявляются следующие основные требования.
∙Достаточное содержание энергии и высокая мощность, обеспечивающие необходимое метательное действие или разрушительный эффект.
∙Жесткие границы чувствительности, обеспечивающие безопасность в обращении и одновременно легкость возбуждения взрыва.
∙Стойкость при хранении.
∙Низкая себестоимость производства.
Содержание энергии и мощность взрывчатого вещества определяется на основании совокупности их энергетических характеристик.
∙Теплота взрыва – это теплота, выделяющаяся, при взрыве 1 кг взрывчатого вещества Qв, Дж/кг.
∙Объем образующихся газообразных продуктов при взрыве 1 кг взрывчатого вещества Vв , м3/кг.
∙Температура взрывчатого превращения Тв , °С.
∙Скорость детонации (взрывчатого превращения) ив , км/с.
∙Потенциальная энергия Аmax , Дж/кг – это наибольшая теоретически возможная работа, которая может быть совершена при взрыве 1 кг данного взрывчатого вещества; численно она совпадает с теплотой взрыва:
|
Amax = Qв . |
|||
|
∙ Мощность взрыва Рв , Вт – работа, совершаемая при |
взрыве 1 кг |
||
|
взрывчатого вещества в единицу времени. |
|||
|
Рв = |
Аmax |
, |
(6.1) |
|
tв |
где tв – время действия взрыва.
Основные энергетические характеристики для наиболее распространенных взрывчатых веществ приведены в табл. 6.1.
69

Таблица 6.1 Энергетические характеристики некоторых взрывчатых веществ
|
Взрывчатое вещество |
Тв, 0С |
Qв, кДж/кг |
Vв, м3/кг |
ив, км/с |
|
Дымный порох |
2380 |
2784 |
0.280 |
– |
|
Пироксилиновый |
2400 |
3391 |
0.845 |
– |
|
порох |
||||
|
Нитроглицерин |
4500 |
6238 |
0.715 |
9.0 |
|
Тротил |
3200 |
4187 |
0.685 |
6.9 |
|
ТЭН |
3900 |
5862 |
0.780 |
8.4 |
|
Гексоген |
3400 |
5443 |
0.908 |
8.38 |
|
Аммонал |
3380 |
6134 |
0.836 |
5.3 |
|
Гремучая ртуть |
4500 |
1721 |
0.315 |
4.5 |
|
Азид свинца |
3500 |
1537 |
0.308 |
5.0 |
В качестве примера определим потенциальную энергию и мощность боевого заряда 85-мм танковой пушки. Заряд – пироксилиновый порох массой М = 2.6 кг (Qв = 3391 Дж/кг, коэффициент полезного действия α=0.3, время движения снаряда в стволе 0.01с). При сгорании заряда выделяется теплота, равная
Q = Qв × М = 3391× 2.6 = 8.817 МДж.
В соответствии с формулой (6.1), общая мощность равна
Рв = Q = 8.817 = 881.7 МВт . tв 0.01
С учетом коэффициента полезного действия мощность боевого заряда 85-мм танковой пушки равна
P = aРв = 0.3 ×881.7 = 264.5 МВт .
Для наглядности переведем мощность заряда пушки в лошадиные силы
(1 л.с. = 735.5 Вт):
|
P = |
264.5 ×106 |
= 0.36 ×106 л.с. |
|
735.5 |
Таким образом, при выстреле из 85-мм пушки развивается мощность, равная 360 тысяч лошадиных сил. Пока нет такой машины, которая была бы способна развить такую мощность.
Чувствительностью взрывчатого вещества называется его способность взрываться под влиянием внешних воздействий (нагревание, укол, удар, трение). Слишком чувствительные взрывчатые вещества опасны в обращении и в чистом виде применяются редко. Малочувствительные взрывчатые вещества невыгодны, так как для их инициирования требуется очень много энергии. Чувствительность взрывчатых веществ зависит, в первую очередь, от его состава, а также от других условий.
70
Возможность использования вещества в качестве альтернативного топлива
Как правильно рассчитать теплотворную способность топлива (топливно-воздушной смеси)
Сравнительные характеристики (QН, Lовозд., qН)бензина:
1. Низшая теплотворная способность QН = 43,3 – 44,0 МДж/кг;
2. Стехиометрическая потребность воздуха в процессе сгорания Lовозд. = 14,9;
3. Низшая теплота сгорания топливовоздушной смеси qН = 3439 – 3910 кДж/м3.
Теплота сгорания топлива – это тепловой эффект химической реакции сгорания топлива в воздухе. При составлении уравнения этой реакции необходимо учитывать не только кислород, принимающий участие в реакции окисления, но и азот, входящий в состав воздуха. Так как на 1 моль кислорода в воздухе приходится 3,75 моля азота, реакция сгорания топлива может быть выражена следующим уравнением:
CnHmOr + (n + m/4 — r/2)•(O2 + 3,75N2) → nCO2(г) + m/2H2O(ж) + (n + m/4 — r/2)•3,75N2(г), где
CnHmOr — органическое вещество (топливо);
n — число атомов углерода;
m — число атомов водорода;
r — число атомов кислорода.
Согласно первому закону термодинамики, высшая теплота сгорания топлива:
QB = ∆Носгор.топлива, где
∆Носгор.топлива — высшая энтальпия сгорания топлива при стандартных условиях.
∆Носгор.топлива = (∑∆Нокон.прод — ∑∆Ноисх.веществ).
Высшая удельная теплота сгорания топлива (теплотворная способность топлива) QВ (кДж/кг топлива) рассчитывается по уравнению:
QB = ΔНоВ/(M.10-3), где
ΔНоВ — высшая энтальпия сгорания топлива (ΔНоВ = ∆Носгор.топлива), кДж/моль;
М — масса моля топлива, г/моль.
Низшая энтальпия сгорания топлива ΔНоН (кДж/моль топлива) рассчитывается по уравнению реакции (1):
∆НоН = ∑∆Нокон.прод — ∑∆Ноисх.веществ
Низшая энтальпия сгорания топлива отличается от высшей на величину энтальпии конденсации водяного пара (∆Ноконд.(Н2О)пар = -44,01 кДж/моль:
∆НоН = ΔНоВ — ∆Ноконд.(Н2О)пар
Низшая удельная теплота сгорания топлива QН (кДж/кг топлива) составит:
QH = ΔНоН/(M.10-3), где
М — масса моля топлива, г/моль.
Для полного сгорания массовой или объемной единицы топлива необходимо вполне определенное количество воздуха, которое называется теоретически необходимым.
Теоретически необходимое количество воздуха для полного сгорания 1 кг топлива (кг воздуха/кг топлива) для реакции (1) рассчитывается по уравнению:
Lовозд. = (n + m/4 — r/2) • [М(O2) + 3,75M(N2)]/Мтоплива, где
М(O2), M(N2)], Мтоплива – масса моля кислорода, азота и топлива соответственно, г/моль.
Количество топливовоздушной смеси (М1, моль) для реакции (1) равно:
М1 = 1 моль топлива + (n + m/4 — r/2)•(O2 + 3,75N2).
Низшая теплота сгорания топливовоздушной смеси (калорийность стехиометрической смеси топлива с воздухом, qН, кДж/м3) рассчитывается как отношение низшей теплоты сгорания единицы топлива к общему количеству горючей смеси:
qH = ∆НоН/[M1.22,4.10-3)].
Полученные результаты сравниваются с характеристиками бензина (приведенными выше) и веществом, предлагаемого в качестве альтернативного топлива. Затем, делается вывод о возможности использования данного вещества в качестве топлива.
Примеры расчетных задач на возможность использования вешества в качестве альтернативного топлива
Задача 50.
На основании зависимости эксплуатационных свойств и от физико-химических характеристик и термодинамических расчетов рассмотреть возможность использования изопропилового спирта в качестве альтернативного топлива или добавки к традиционным видам топлив.
Решение:
М(С3Н7ОН) = 60,0952 г/моль;
∆Носгор.(С3Н7ОН) = –2003,8 кДж/моль.
1. Реакция горения в воздухе:
С3Н7ОН(ж) + 4,5(O2 + 3,75N2)(г) = 3CO2(г) + 4H2O(ж) + 16,8755N2(г).
2. Табличное значение стандартной энтальпии сгорания изопропилового спирта ΔНосгор. = –2003,8 кДж/моль.
Следовательно, высшая энтальпия сгорания топлива (ΔНоВ = ∆Носгор.топлива = –2003,8 кДж/моль С3Н7ОН.
3. Высшая теплота сгорания топлива QВ:
QB = 2003,8/(60.10-3) = 33,40 МДж/кг С3Н7ОН.
4. Низшая энтальпия сгорания (∆НоН, кДж /моль топлива) отличается от высшей на величину энтальпии конденсации водяного пара
∆Ноконд.Н2О(пара) = –44,01 кДж/моль. Поэтому
∆НоН = ∆Носгор.топлива — ∆Ноконд.Н2О(пара) = -2003,8 + 4.44,01 = -1827,76.
5. Низшая теплота сгорания топлива (МДж/кг топлива):
QH = ∆НоН/(M.10-3) = -1827,76/(60.10-3) = 30,46.
Теоретически необходимое количество воздуха для полного сгорания 1 кг топлива (кг воздуха/кг топлива):
Lовозд. = (n + m/4 — r/2) • [М(O2) + 3,75M(N2)]/Мтоплива, где
М(O2), M(N2)], Мтоплива – масса моля кислорода, азота и топлива соответственно, г/моль.
Тогда
Lовозд. = 4,5(32 + 3,75. 28)]/60 = 10,275
7. Количество топливовоздушной смеси (М1, моль):
М1 = 1 моль топлива + 4,5(1 + 3,75) = 22,375 моль.
8. Низшая теплота сгорания топливовоздушной смеси (qН, кДж/м3), она же калорийность стехиометрической смеси топлива с воздухом:
qH = ∆НоН/[M1.22,4.10-3)] = -1827,76/[22,375 . 22,4.10-3)] = 3817,37 кДж/м3.
Выводы:
1) Судя по калорийности стехиометрической смеси изопропилового спирта с воздухом, его вполне можно применять как альтернативное топливо.
Задача 51.
На основании зависимости эксплуатационных свойств и от физико-химических характеристик и термодинамических расчетов рассмотреть возможность использования метана в качестве альтернативного топлива или добавки к традиционным видам топлив.
Решение:
М(СН4) = 16 г/моль;
∆Носгор.(СН4) = –890,31 кДж/моль;
1. Реакция горения в воздухе:
СН4(г) + 2(O2 + 3,75N2)(г) = CO2(г) + 2H2O(ж) + 7,5N2(г).
2. Табличное значение стандартной энтальпии сгорания метана ΔНосгор. = –890,31 кДж/моль.
Следовательно, высшая энтальпия сгорания топлива (ΔНоВ = ∆Носгор.топлива = –890,31 кДж/моль С3Н7ОН.
3. Высшая теплота сгорания топлива QВ:
QB = 890,31/(16.10-3) = 55,64 МДж/кг СН4.
4. Низшая энтальпия сгорания (∆НоН, кДж /моль топлива) отличается от высшей на величину энтальпии конденсации водяного пара
∆Ноконд.Н2О(пара) = –44,01 кДж/моль. Поэтому
∆НоН = ∆Носгор.топлива — ∆Ноконд.Н2О(пара) = –890,31 + 2.44,01 = -802,29 кДж/моль.
5. Низшая теплота сгорания топлива (МДж/кг топлива):
QH = ∆НоН/(M.10-3) = -802,29/(16.10-3) = 50,14.
Теоретически необходимое количество воздуха для полного сгорания 1 кг топлива (кг воздуха/кг топлива):
Lовозд. = (n + m/4 — r/2) * [М(O2) + 3,75M(N2)]/Мтоплива, где
М(O2), M(N2)], Мтоплива – масса моля кислорода, азота и топлива соответственно, г/моль.
Тогда
Lовозд. = 2(32 + 3,75 . 28)]/16 = 17,125
7. Количество топливовоздушной смеси (М1, моль):
М1 = 1 мольтоплива + 2(1 + 3,75) = 10,5 моль.
8. Низшая теплота сгорания топливовоздушной смеси (qН, кДж/м3), она же калорийность стехиометрической смеси топлива с воздухом:
qH = -∆НоН/[M1. 22,4.10-3)] = 802,29/[10,5 . 22,4.10-3)] = 3411 кДж/м3.
Выводы:
1) Судя по калорийности стехиометрической смеси метана с воздухом, его вполне можно применять как альтернативное топливо.
Расчет теплотворной способности газзобразного топлива
Задача 52.
В печи сожгли смесь, в которой было 25% измельчённого угля, остальное – отходы древесины. Какова была теплотворная способность этой смеси?
Решение:
q1(уголь) = 30,0 мДж/кг;
q2(отходы древесины) = 10,0 мДж/кг.
Q = q1 . w%(уголь) + q2 . w%(дерево) = (30 . 0,25) + (10 . 0,75) = 15 мДж/кг = 15 000 000 Дж/кг, где
Q — теплотворная способность топлива;
q1 -удельная теплота сгорания угля;
q2 -удельная теплота сгорания древесных отходов;
w%(уголь) и w%(дерево) — соответственно, массовые доли угля и древесины в смеси для сжигания.
Как правильно рассчиать массу заправленного в бак топлива
Задача 53.
В топливный бак залили при температуре 15 оС 30 л бензина АИ-95 (р420 = 0,7650 г/мл). Исходя из уравнения Д.И. Менделеева (температурную поправку найти по таблице), рассчитайте массу заправленного в этих условиях бензина.
Решение:
Для рассчета используем формулу Менделеева:
р4(t) = p4(20) — a(t — 20), где
р4(t) — относительная плотность нефти (нефтепродукта) при температуре испытания t, оС;
p4(20) — плотность нефтепродукта при стандартных условиях (у нас 0,7650 г/мл = или 765 кг/м3;
а — средняя температурная поправка плотности (ее мы найдем по таблице, получим: 0,000818);
t — температура испытания, оС ( у нас 15 оС).
Тогда
р4(15) = p4(20) — a(t — 20) = 0,7650 — 0,000818(5 — 20) = 0,7650 — 0,0127 = 0,77727 г/л.
По формуле: m = р•V, рассчитаем массу бензина, получим:
mтоплива = р•V = р4(5) . V = 0,77727 г/л . 30 л = 23,3 кг.
Ответ: mтоплива = 23,3 кг.
Определение потери тепла с уходящими газами
Задача 54.
Определить по формуле: q2 = 0,01(t — tВ)Z,% потерю тепла с уходящими газами если СО2 = 9%, СО = 0,2%, СН4 = 0,1%, Н2 = 0,3%, О2 = 4,4%, N2 = 86% температура уходящих газов равна 320 °С, температура воздуха равна 20 °С, Z = 5,05.
Решение:
Таким образом, при снижении температуры продуктов сгорания с 300 до 20 °С экономия топлива в результате снижения потерь тепла составит:
q2 = 0,01(t — tВ)Z% = 0,01(320 °С — 20 °С)5,05% = 15,15%, где
q2 — потеря тепла с продуктами сгорания;
t — температура продуктов сгорания (уходящих газов), оС;
tВ — температура воздуха поступающего к горелкам, оС;
Z – табличная величина, зависящая от содержания СО2 в продуктах сгорания и их температуры, определяется по таблице Равича;
Теперь по формуле Д.И. Менделеева рассчитаем низшую теплотворность смеси газов, получим:
q1 = 0,126(CO) + 0,358(CH4) + 0,108(H2) = (0,126 . 0,2) + (0,358 . 0,1) + (0,108 . 0,3) = 0,0934 МДж/м3.
Тогда потеря теплоты составит:
Qпотери = (q2 . q1)/100% = (15,15% . 0,0934 МДж/м3)/100% = 0,01415 МДж/м3.
Таким образом, потеря тепла будет составлять 0,01415 МДж/м3.
теплотворная способность (или значение энергии или теплотворная способность ) вещества, обычно топлива или пищи (см. пищевая энергия ), представляет собой количество тепла высвобождается при сгорании определенного его количества.
Теплотворная способность — это общая энергия, выделяемая в виде тепла, когда вещество подвергается полному сгоранию с кислородом при стандартные условия. Химическая реакция обычно представляет собой реакцию углеводорода или другой органической молекулы с кислородом с образованием диоксида углерода и воды и выделения тепла. Это может быть выражено величинами:
- энергия / моль топлива
- энергия / масса топлива
- энергия / объем топлива
Есть два вида теплоты сгорания, называемые высшей и низшей теплотворной способностью, в зависимости от того, насколько продуктам позволено остыть, и от того, могут ли соединения, подобные H 574>O, конденсироваться. Значения обычно измеряются с помощью калориметра с бомбой . Их также можно рассчитать как разность между теплотой ΔH. fобразования продуктов и реагентов (хотя этот подход является несколько искусственным, поскольку большинство теплоты образования рассчитываются на основе измеренных теплот сгорания). Для топлива состава C cHhOoNn(более высокая) теплота сгорания составляет 418 кДж / моль (c + 0,3 ч — 0,5 o), как правило, с хорошим приближением (± 3%), хотя это может быть в корне неверным, если o + n>c (например, в случае нитроглицерина (C. 3H. 5N. 3O. 9) эта формула предсказывает теплоту сгорания равную 0). Значение соответствует экзотермической реакции (отрицательное изменение энтальпии ), поскольку двойная связь в молекулярном кислороде намного слабее, чем другие двойные связи или пары одинарных связующие, особенно содержащиеся в продуктах сгорания диоксида углерода и воды; преобразование слабых связей в кислороде в более сильные связи в диоксиде углерода и воде выделяет энергию в виде тепла.
По соглашению ( выше) теплота сгорания определяется как тепло, выделяемое для полного сгорания соединения в его стандартном состоянии с образованием стабильных продуктов в их стандартных состояниях: водород превращается в воду (в жидком состоянии), углерод превращается в диоксид углерода. газ, а азот превращается в газообразный азот. То есть теплота сгорания, ΔH ° comb, представляет собой теплоту реакции следующего процесса:
- CxHyNzOn(стандарт.) + O 2 (g, xs.) → xCO 2 (г) + ⁄ 2H2O (l) + ⁄ 2N2(г)
Хлор и сера не совсем стандартизированы; обычно предполагается, что они преобразуются в газообразный хлористый водород и газ SO 2 или SO 3, соответственно, или в разбавленные водные соляной и серной кислоты, соответственно, когда сжигание проводится в бомба, содержащая некоторое количество воды.
Содержание
- 1 Способы определения
- 1.1 Более высокая теплотворная способность
- 1.2 Нижняя теплотворная способность
- 2 Общая теплотворная способность
- 3 Измерение тепловой мощности
- 4 Связь между теплотворной способностью
- 5 Использование терминов
- 6 Учет влажности
- 7 Таблицы теплоты сгорания
- 8 Более высокие теплотворные способности природного газа из различных источников
- 9 См. Также
- 10 Ссылки
- 11 Внешние ссылки
Способы определения
Высшая теплотворная способность
Величина, известная как высшая теплотворная способность (HHV ) (или общая энергия или верхний нагрев значение или высшая теплотворная способность (GCV ) или более высокая теплотворная способность (HCV )) определяется путем приведения всех продуктов сгорания обратно к исходной температуре предварительного сжигания и, в частности, конденсация любого образующегося пара. Для таких измерений часто используется стандартная температура 25 ° C (77 ° F; 298 K). Это то же самое, что и термодинамическая теплота сгорания, поскольку изменение энтальпии для реакции предполагает общую температуру соединений до и после сгорания, и в этом случае вода, образующаяся при сгорании, конденсируется в жидкость. Более высокая теплотворная способность учитывает скрытую теплоту парообразования воды в продуктах сгорания и полезна при расчете теплотворной способности топлива, где конденсация продукты реакции (например, в газовом котле, используемом для обогрева помещений). Другими словами, HHV предполагает, что весь водный компонент в конце сгорания находится в жидком состоянии (в продукте сгорания) и что тепло, выделяемое при температурах ниже 150 ° C (302 ° F), может быть использовано.
Нижняя теплотворная способность
Величина, известная как нижняя теплотворная способность (LHV ) (низшая теплотворная способность (NCV ) или более низкая теплотворная способность (LCV )) не так однозначно определено. Одно определение состоит в том, чтобы просто вычесть теплоту парообразования воды из более высокой теплотворной способности. Это рассматривает любой образовавшийся H 2 O как пар. Таким образом, энергия, необходимая для испарения воды, не выделяется в виде тепла.
Расчет LHV предполагает, что водный компонент процесса сгорания находится в парообразном состоянии в конце сгорания, в отличие от более высокой теплотворной способности (HHV) (также известной как высшая теплотворная способность или общая теплотворная способность). CV), который предполагает, что вся вода в процессе сгорания находится в жидком состоянии после процесса сгорания.
Другое определение LHV — это количество тепла, выделяемого при охлаждении продуктов до 150 ° C (302 ° F). Это означает, что скрытая теплота парообразования воды и других продуктов реакции не восстанавливается. Это полезно при сравнении видов топлива, в которых конденсация продуктов сгорания нецелесообразна или тепло при температуре ниже 150 ° C (302 ° F) невозможно использовать.
Одно определение более низкой теплотворной способности, принятое Американским институтом нефти (API), использует эталонную температуру 60 ° F (15 ⁄ 9 ° C)..
Другое определение, используемое Ассоциацией поставщиков газоперерабатывающих предприятий (GPSA) и первоначально используемое API (данные, собранные для исследовательского проекта API 44), — это энтальпия всех продуктов сгорания за вычетом энтальпии топливо при эталонной температуре (в исследовательском проекте API 44 использовалось 25 ° C. GPSA в настоящее время использует 60 ° F) за вычетом энтальпии стехиометрического кислорода (O2) при эталонной температуре минус теплота испарения паросодержащих продуктов сгорания.
Определение, в котором все продукты сгорания возвращаются к эталонной температуре, легче рассчитать исходя из более высокой теплотворной способности, чем при использовании других определений, и фактически даст немного другой ответ.
Полная теплотворная способность
Полная теплотворная способность учитывает воду в выхлопе, выходящую в виде пара, и включает жидкую воду в топливе перед сгоранием. Это значение важно для таких видов топлива, как древесина или уголь, которые обычно содержат некоторое количество воды перед сжиганием.
Измерение значений нагрева
Более высокое значение нагрева экспериментально определяется в калориметре с бомбой. Горение стехиометрической смеси топлива и окислителя (например, два моля водорода и один моль кислорода) в стальном контейнере при 25 ° C (77 ° F) инициируется устройством зажигания, и реакции разрешено завершить. Когда водород и кислород вступают в реакцию во время горения, образуется водяной пар. Затем сосуд и его содержимое охлаждают до исходных 25 ° C, и более высокая теплотворная способность определяется как тепло, выделяющееся между идентичными начальной и конечной температурами.
Когда определяется нижняя теплотворная способность (LHV), охлаждение прекращается при 150 ° C, и тепло реакции восстанавливается только частично. Предел 150 ° C основан на точке росы кислого газа.
Примечание: более высокая теплотворная способность (HHV) рассчитывается с произведением воды, находящейся в жидкой форме, в то время как более низкая теплотворная способность (LHV) рассчитывается с продуктом воды, находящейся в Форма пара .
Соотношение между значениями нагрева
Разница между двумя значениями нагрева зависит от химического состава топлива. В случае чистого углерода или монооксида углерода две величины нагрева почти идентичны, разница заключается в содержании явного тепла в диоксиде углерода между 150 ° C и 25 ° C (теплообмен вызывает изменение Напротив, скрытая теплота добавляется или вычитается для фазовых переходов при постоянной температуре. Примеры: теплота испарения или теплота плавления ). Для водорода разница гораздо более значительна, поскольку она включает в себя явную теплоту водяного пара между 150 ° C и 100 ° C, скрытую теплоту конденсации при 100 ° C и явную теплоту конденсированной воды. от 100 ° C до 25 ° C. В целом, более высокая теплотворная способность водорода на 18,2% выше его более низкой теплотворной способности (142 МДж / кг против 120 МДж / кг). Для углеводородов разница зависит от содержания водорода в топливе. Для бензина и дизельного топлива более высокая теплотворная способность превышает более низкую теплотворную способность примерно на 10% и 7% соответственно, а для природного газа примерно на 11%.
Распространенный метод соотнесения HHV с LHV:
- HHV = LHV + H v (n H 2 O, вне топлива, дюйм) { displaystyle mathrm {HHV} = mathrm {LHV} + H _ { mathrm {v}} left ({ frac {n _ { mathrm {H_ {2} O, out}}} {n _ { mathrm {топливо, in}}}} right)}
где H v — теплота испарения воды, n H2O, out — количество моль испаренной воды, а n топлива, in — количество молей топливо сгорело.
- Большинство применений, сжигающих топливо, производят водяной пар, который не используется и, таким образом, расходует его теплосодержание. В таких приложениях необходимо использовать более низкую теплотворную способность, чтобы дать «эталон» для процесса.
- Однако для истинных расчетов энергии в некоторых конкретных случаях более высокая теплотворная способность является правильной. Это особенно актуально для природного газа, в котором высокое содержание водорода дает много воды, когда он сжигается в конденсационных котлах и электростанциях с конденсацией дымовых газов, которые конденсируют водяной пар, образующийся при сгорании, с рекуперацией тепла, которое в противном случае было бы потрачено впустую.
Использование терминов
Производители двигателей обычно оценивают потребление топлива своими двигателями по более низкие показатели нагрева, так как выхлопные газы никогда не конденсируются в двигателе. Американские потребители должны знать, что соответствующий показатель расхода топлива, основанный на более высокой теплотворной способности, будет несколько выше.
Разница между определениями HHV и LHV вызывает бесконечную путаницу, когда цитирующие не утруждают себя указанием используемого соглашения. поскольку обычно существует разница в 10% между двумя методами для электростанции, сжигающей природный газ. Для простого сравнительного анализа части реакции может быть подходящим LHV, но HHV следует использовать для общих расчетов энергоэффективности, хотя бы во избежание путаницы, и в любом случае значение или соглашение должны быть четко указаны.
Учет влажности
И HHV, и LHV могут быть выражены в единицах AR (учитывается вся влажность), MF и MAF (только вода от сжигания водорода). AR, MF и MAF обычно используются для обозначения теплотворной способности угля:
- AR(как получено) означает, что теплотворная способность топлива была измерена со всеми присутствующими минералами, образующими влагу и золу.
- MF(влажность- свободный) или сухой означает, что теплотворная способность топлива была измерена после того, как топливо было высушено от всей присущей ему влаги, но все еще сохраняло золообразующие минералы.
- MAF (влага и зола -безопасный) или DAF (сухой и беззольный) означает, что теплотворная способность топлива была измерена при отсутствии врожденных минералов, образующих влагу и золу.
Таблицы теплоты сгорания
| Топливо | HHV MJ /kg | HHV БТЕ / фунт | HHV kJ /моль | LHV МДж / кг |
|---|---|---|---|---|
| Водород | 141.80 | 61,000 | 286 | 119.96 |
| Метан | 55.50 | 23,900 | 889 | 50,00 |
| Этан | 51.90 | 22,400 | 1 560 | 47,62 |
| Пропан | 50,35 | 21,700 | 2,220 | 46,35 |
| Бутан | 49,50 | 20,900 | 2,877 | 45,75 |
| Пентан | 48,60 | 21,876 | 3,507 | 45,35 |
| Парафиновый воск | 46,00 | 19,900 | 41,50 | |
| Керосин | 46,20 | 19,862 | 43,00 | |
| Дизель | 44,80 | 19,300 | 43,4 | |
| Уголь (антрацит ) | 32,50 | 14000 | ||
| Уголь (лигнит — США ) | 15,00 | 6,500 | ||
| Древесина (MAF ) | 21,70 | 8,700 | ||
| Древесное топливо | 21,20 | 9,142 | 17,0 | |
| Торф ( сухой) | 15,00 | 6,500 | ||
| Торф (влажный) | 6,00 | 2,500 |
| Топливо | MJ / кг | BTU / фунт | kJ /моль |
|---|---|---|---|
| Метанол | 22,7 | 9,800 | 726,0 |
| Этанол | 29,7 | 12,800 | 1,300,0 |
| 1-пропанол | 33,6 | 14,500 | 2,020,0 |
| Ацетилен | 49,9 | 21,500 | 1,300,0 |
| Бензол | 41,8 | 18,000 | 3270,0 |
| Аммиак | 22,5 | 9,690 | 382,6 |
| Гидразин | 19,4 | 8,370 | 622,0 |
| Изучите | 30,0 | 12,900 | 4,200,0 |
| Углерод | 32,8 | 14,100 | 393,5 |
| Топливо | MJ / кг | MJ /L | БТЕ / фунт | kJ /моль |
|---|---|---|---|---|
| Алканы | ||||
| Метан | 50,009 | 6,9 | 21,504 | 802.34 |
| Этан | 47,794 | — | 20,551 | 1,437,2 |
| Пропан | 46,357 | 25,3 | 19,934 | 2,044,2 |
| Бутан | 45,752 | — | 19,673 | 2,659,3 |
| Пентан | 45,357 | 28,39 | 21,706 | 3,272,6 |
| Гексан | 44,752 | 29,30 | 19,504 | 3,856,7 |
| Гептан | 44,566 | 30,48 | 19,163 | 4,465,8 |
| Октан | 44,427 | — | 19,104 | 5,074,9 |
| Нонан | 44,311 | 31,82 | 19,054 | 5,683,3 |
| Декан | 44,240 | 33,29 | 19,023 | 6,2 94,5 |
| Ундекан | 44,194 | 32,70 | 19,003 | 6,908,0 |
| Додекан | 44,147 | 33,11 | 18 983 | 7 519,6 |
| Изопарафины | ||||
| Изобутан | 45,613 | — | 19 614 | 2 651,0 |
| Изопентан | 45,241 | 27,87 | 19,454 | 3,264,1 |
| 2-метилпентан | 44,682 | 29,18 | 19,213 | 6,850,7 |
| 2,3-диметилбутан | 44,659 | 29,56 | 19,203 | 3,848,7 |
| 2,3-диметилпентан | 44,496 | 30,92 | 19,133 | 4,458,5 |
| 2,2,4-Триметилпентан | 44,310 | 30,49 | 19,053 | 5,061,5 |
| Нафтены | ||||
| Циклопентан | 44,636 | 33,52 | 19,193 | 3,129,0 |
| Метилциклопентан | 44,636? | 33,43? | 19 193? | 3 756,6? |
| Циклогексан | 43,450 | 33,85 | 18,684 | 3,656,8 |
| Метилциклогексан | 43,380 | 33,40 | 18 653 | 4,259,5 |
| Моноолефины | ||||
| Этилен | 47,195 | — | — | — |
| Пропилен | 45,799 | — | — | — |
| 1-бутен | 45,334 | — | — | — |
| цис-2-бутен | 45,194 | — | — | — |
| транс-2-бутен | 45,124 | — | — | — |
| изобутен | 45,055 | — | — | — |
| 1-пентен | 45,031 | — | — | — |
| 44,799 | — | — | — | |
| 1-гексен | 44,426 | — | — | — |
| диолефины | ||||
| 1,3-Бутадиен | 44,613 | — | — | — |
| Изопрен | 44,078 | — | — | — |
| Азотистое производное | ||||
| Нитрометан | 10,513 | — | — | — |
| Нитропропан | 20,693 | — | — | — |
| Ацетилены | ||||
| Ацетилен | 48,241 | — | — | — |
| Метилацетилен | 46,194 | — | — | — |
| 1-бутин | 45,590 | — | — | — |
| 1-пентин | 45,217 | — | — | — |
| Ароматические углеводороды | ||||
| Бензол | 40,170 | — | — | — |
| Толуол | 40,589 | — | — | — |
| о-ксилол | 40,961 | — | — | — |
| м-ксилол | 40,961 | — | — | — |
| п-ксилол | 40,798 | — | — | — |
| этилбензол | 40,938 | — | — | — |
| 1,2,4-триметилбензол | 40,984 | — | — | — |
| н-пропилбензол | 41,193 | — | — | — |
| кумол | 41,217 | — | — | — |
| спирты | ||||
| метанол | 19,930 | 15,78 | 8, 570 | 638,55 |
| Этанол | 26,70 | 22,77 | 12,412 | 1329,8 |
| 1-пропанол | 30,680 | 24,65 | 13,192 | 1843,9 |
| Изопропанол | 30,447 | 23,93 | 13,092 | 1829,9 |
| н-бутанол | 33,075 | 26,79 | 14,222 | 2,501,6 |
| Изобутанол | 32,959 | 26,43 | 14,172 | 2442,9 |
| трет-бутанол | 32,587 | 25,45 | 14012 | 2415,3 |
| н-пентанол | 34,727 | 28,28 | 14,933 | 3,061,2 |
| Изоамиловый спирт | 31,416? | 35,64? | 13 509? | 2 769,3? |
| Простые эфиры | ||||
| Метоксиметан | 28,703 | — | 12,342 | 1,322,3 |
| Этоксиэтан | 33,867 | 24,16 | 14,563 | 2,510,2 |
| пропоксипропан | 36,355 | 26,76 | 15,633 | 3,568,0 |
| бутоксибутан | 37,798 | 28,88 | 16,253 | 4,922,4 |
| Альдегиды и кетоны | ||||
| Формальдегид | 17,259 | — | — | 570,78 |
| Ацетальдегид | 24,156 | — | — | — |
| Пропионовый альдегид | 28,889 | — | — | — |
| Бутиральдегид | 31,610 | — | — | — |
| Ацетон | 28,548 | 22,62 | — | — |
| Другие частицы | ||||
| Углерод (графит) | 32,808 | — | — | — |
| Водород | 120,971 | 1,8 | 52017 | 244 |
| Окись углерода | 10,112 | — | 4,348 | 283,24 |
| Аммиак | 18,646 | — | 8,018 | 317,56 |
| Сера (твердое вещество) | 9,163 | — | 3,940 | 293,82 |
- Примечание
- Нет разницы между более низкой и высокой теплотворной способностью для сжигания углерод, окись углерода и сера, так как при сгорании этих веществ не образуется вода. например.
- Значения БТЕ / фунт рассчитываются из МДж / кг (1 МДж / кг = 430 БТЕ / фунт).
Более высокая теплотворная способность природного газа из различных источников
Международное энергетическое агентство сообщает о следующих типичных более высоких значениях теплотворной способности:
- Алжир : 39,57 МДж / м
- Бангладеш : 36,00 МДж / м
- Канада : 39,00 МДж / м
- Китай : 38,93 МДж / м
- Индонезия : 40,60 МДж / м
- Иран : 39,36 МДж / м
- Нидерланды : 33,32 МДж / м
- Норвегия : 39,24 МДж / м
- Пакистан : 34,90 МДж / м
- Катар : 41,40 МДж / м
- Россия : 38,23 МДж / м
- Саудовская Аравия : 38,00 МДж / м
- Туркменистан : 37,89 МДж / м
- Соединенное Королевство : 39,71 МДж / м
- США : 38,42 МДж / м
- Узбекистан : 37,89 МДж / м
Низкая теплотворная способность природного газа обычно составляет около 90 процентов от его более высокой теплотворной способности.
См. Также
- Температура адиабатического пламени
- Плотность энергии
- Энергетическая ценность угля
- Экзотермическая реакция
- Пожар
- Эффективность использования топлива # Энергосодержание топлива
- Пищевая энергия
- Внутренняя энергия
- Тепловой КПД
- Индекс Воббе : плотность тепла
- ISO 15971
- Электрический КПД
- Механический КПД
- Рисунок качества
- Относительная стоимость электроэнергии, произведенной из различных источников
- Эффективность преобразования энергии
Ссылки
- Guibet, J.-C. (1997). Carburants et moteurs. Publication de l’Institut Français du Pétrole. ISBN 978-2-7108-0704-9 .
Внешние ссылки
- Электронная книга по химии NIST
- «Более низкие и высокие значения нагрева газа, жидкого и твердого топлива» (PDF). Книга данных по энергии биомассы. Министерство энергетики США. 2011.


