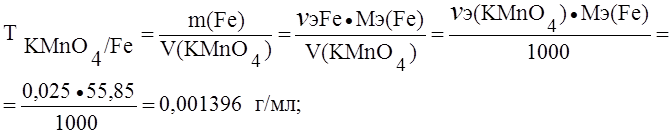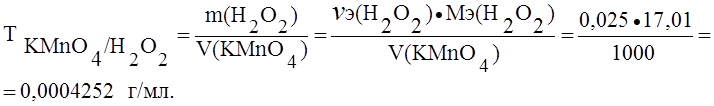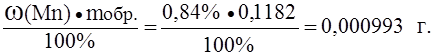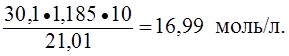Титр раствора. Формула для его расчета достаточно проста и чем-то напоминает формулу для расчета плотности раствора, так как выражается в тех же единицах.
Титр раствора: формула для расчета
Титр – один из способов выражения количественного состава раствора. Является основной концентрацией в титриметрическом анализе.
Титр (Т) – это масса вещества (в граммах), которая содержится в 1 мл (1 см3) раствора.
Например, титр раствора азотной кислоты равен 0,005672 г/мл. Это означает, что в каждом одном миллилитре раствора содержится 0,005672 г азотной кислоты.
Переход от титра раствора к другим видам концентраций
В титриметрическом анализе применяются и другие концентрации: молярная (См) и нормальная (Сн). Между ними и титром существует взаимосвязь: можно от одной концентрации перейти к другой. Например, взаимосвязь титра и молярной концентрации.
Для См объем измеряется в литрах (л) , для Т – в миллилитрах (мл), то есть в 1000 раз меньше. Учтем это и получим:
Аналогичные преобразования можно провести и с нормальной концентрацией (Сн). В результате получим:
Титр связан и с массовой долей растворенного вещества:
Титр раствора: формула и примеры расчетов
Приведем конкретные примеры вычисления титра раствора и других концентраций, связанных с ним.
Пример 1. Какая масса азотной кислоты содержится в 500 мл раствора, если его титр равен 0,00630 г/мл?
Пример 2. В 1 кг воды растворили 250 г NaOH. Плотность полученного раствора равна 1,219 г/мл. Какова массовая доля NaOH, титр, молярная и нормальная концентрации раствора щелочи.
Пример 3. Титр раствора HCl равен 0,003592 г/мл. Вычислите его нормальную концентрацию.
Пример 4. Нормальная концентрация раствора H2SO4 составляет 0,1205 н. Определите его титр.
Пример 5. Какова нормальная концентрация раствора H2C2O4·2H2O, полученного растворением 1,7334 г ее в мерной колбе вместимостью 250 мл?
Пример 6. Питьевую соду массой 4,2 г растворили в дистиллированной воде. Объем раствора составил 200 мл. Каковы титр и молярная концентрация полученного раствора?
Пример 7. В 100 г раствора (ρ = 1г/мл) хлорида цинка ZnCl2 содержится 5 г соли. Определите титр, массовую долю, молярную и нормальную концентрации раствора.
Таким образом, зная титр раствора, формулу для вычисления его значения, можно перейти к другим видам концентрации раствора, и наоборот.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
Концентрацию
растворов, применяемых в титриметрии,
выражают не только через моль-экв/л
(нормальность), но и через титр раствора
(
)
и титр по определяемому веществу
(
).
Эти концентрации более удобны, так как
непосредственно позволяют вычислять
массу определяемого компонента по
результатам титрования. Формулы,
приведенные в стандартных методиках
титриметрического анализа, предназначенных
для большого числа однотипных измерений,
содержат значение титра по определяемому
веществу
.
Титр вещества
или простой
Титр вещества
показывает содержание компонента
А, выраженное в граммах, в 1
мл его раствора и вычисляется по
формуле:
=
(4.8)
где
– масса вещества А (г) в растворе с
объемом
(мл),
– его титр в г/мл.
Иногда титр для
удобства в расчетах выражают в мг/мл.
Через простой титр легко рассчитать
молярную концентрацию (молярность) или
молярную концентрацию эквивалента
(нормальность) раствора, подставив туда
выражение массы вещества через титр.
и
(4.9)
Пример. Пусть
в растворе соли, объемом 250 см3
содержится 0,5 г
.
Определить титр и нормальность такого
раствора.
Исходя из формул
(4.8) и (4.9), Т(Na2CO3)
= 0,005/250 =
(г/мл),
а нормальность:
=
1000/53
=
(моль-экв/л), где 53 – молярная масса
эквивалента
(г-экв/моль).
Титр по
определяемому веществу
(условный)
Титр по определяемому
веществу
или условный показывает какое
количество вещества А (г)
эквивалентно массе титранта В,
которая содержится в 1 мл раствора
титранта В. Так как масса
титруемого вещества А и объем раствора
В относятся к разным веществам, то
размерность такого титра не указывается.
Титр по определяемому веществу
(условный) позволяет вычислить какое
количество вещества А в
граммах титруется 1-м миллилитром
титранта В.
=
(4.10)
Между титрами Т(В)
и
существует простая связь, вытекающая
из закона эквивалентов. Ее легко получить,
учитывая, что
m(В)
=
и m(А) =
,
где V(B)
в мл – объем раствора В, пошедший
на реакцию (титрование) с веществом А;
m(В) – масса вещества
реагента В (титранта), m(А)
– масса вещества А, эквивалентная
массе реагента В в его растворе
объемом V(B).
или
(4.11)
Тогда молярная
концентрация эквивалента (нормальность)
раствора В через значение
может быть определена как:
(4.12)
Если для рабочего
раствора В известно значение
,
то масса определяемого компонента А
(г) в пробе объемом
легко вычисляется по объему раствора
титранта
,
израсходованному на титрование аликвоты
:
(4.13)
4.4. Классификация растворов, применяемых для титрования и способы их приготовления.
В титриметрии
используют растворы, концентрация
которых установлена каким-либо способом
с высокой степенью точности. Такие
растворы называют стандартными
титрованными или просто
титрованными. Растворы
классифицируют по назначению и по
способу установления их концентрации.
По назначению
их условно делят на рабочие растворы
и растворы стандартов (первичные
и вторичные).
Рабочими
называют растворы, которые используются
непосредственно в анализе при определении
содержания вещества. Если рабочий
раствор не относится к стандартным, то
его необходимо отстандартизировать
непосредственно перед выполнением
анализа, так как концентрация в
процессе хранения могла существенно
измениться. Точную концентрацию рабочего
раствора находят путем титрования
стандартного раствора или установочных
веществ (метод точных навесок). Это
касается, например, таких рабочих
растворов, как: NaOH,
Na2S2O35H2O.
Под стандартным
раствором понимают такой титрованный
раствор, который устойчиво сохраняет
свою концентрацию при длительном
хранении. Основное назначение
стандартных растворов
определение точной концентрации рабочих
и иных растворов, применяемых в титровании.
Процесс установления
точной концентрации раствора путем его
титрования по стандарту называется
стандартизацией.
По способу
определения концентрации различают
первичные стандарты или
растворы с приготовленным титром и
стандартизированные растворы.
Стандартизированные
растворы это
такие растворы, концентрация которых
устанавливается по стандарту и заранее
не может быть точно определена. К ним
относятся растворы кислот, щелочей,
гидролизующихся и гигроскопичных солей,
а также веществ, которые могут реагировать
с атмосферным кислородом и углекислотой.
Известно множество способов
приготовления стандартизированных
растворов. Наиболее часто для этой цели
применяют: приготовление по приближенной
навеске (щелочи, соли), методы разбавления
или смешения растворов (кислоты, соли),
методы ионного обмена (растворы солей).
Стандартные
растворы классифицируют по
способу определения их концентрации.
Различают: первичные стандарты
или растворы с приготовленным титром
и вторичные стандарты
растворы с установленным титром.
Первичные
стандарты это
растворы, которые готовят либо по
точной навеске вещества (рис. 4.10),
либо путем разведения специально
приготовленных стандартизированных
реагентов – фиксаналов (рис. 4.11).
Фиксанал представляет собой стеклянную
запаянную ампулу, выпускаемую
промышленностью и содержащую строго
нормированное количество реагента,
обычно рассчитанного на 1 л 0,1 н. раствора.
Приготовление
раствора по точной навеске
начинают с расчета ее массы по заданной
концентрации (титру или нормальности)
и объему колбы. Навеску стандартного
вещества взвешивают на аналитических
весах с точностью до 1104
г и количественно переносят в мерную
колбу, где ее растворяют при перемешивании
(рис. 4.10).
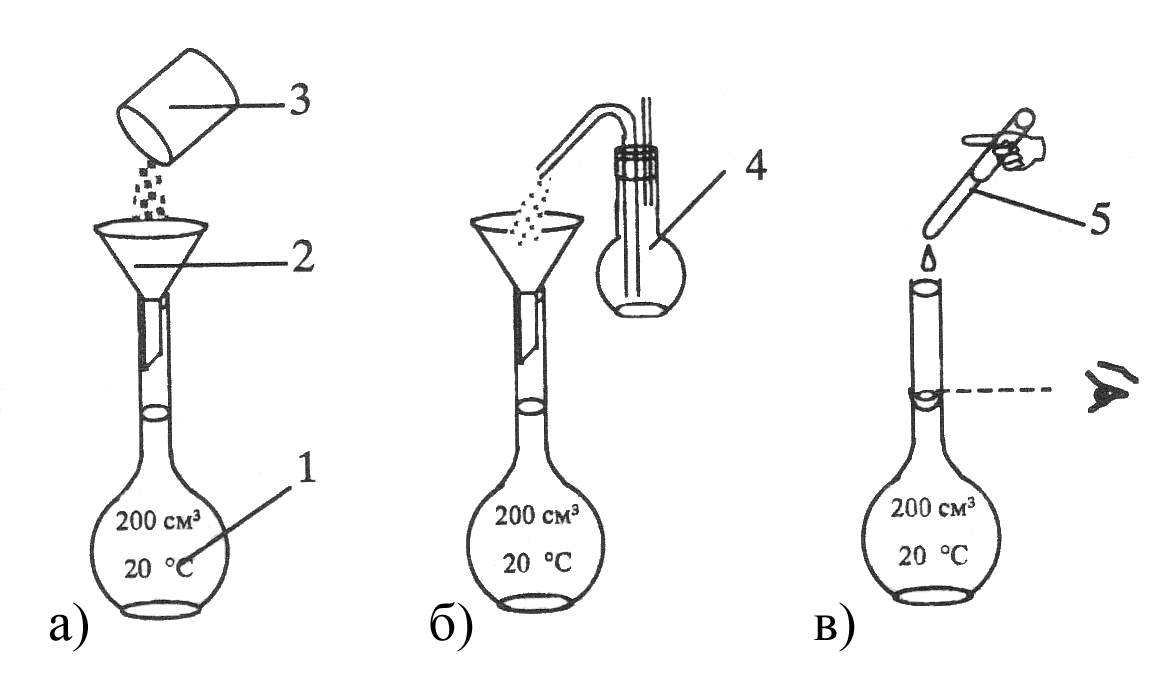
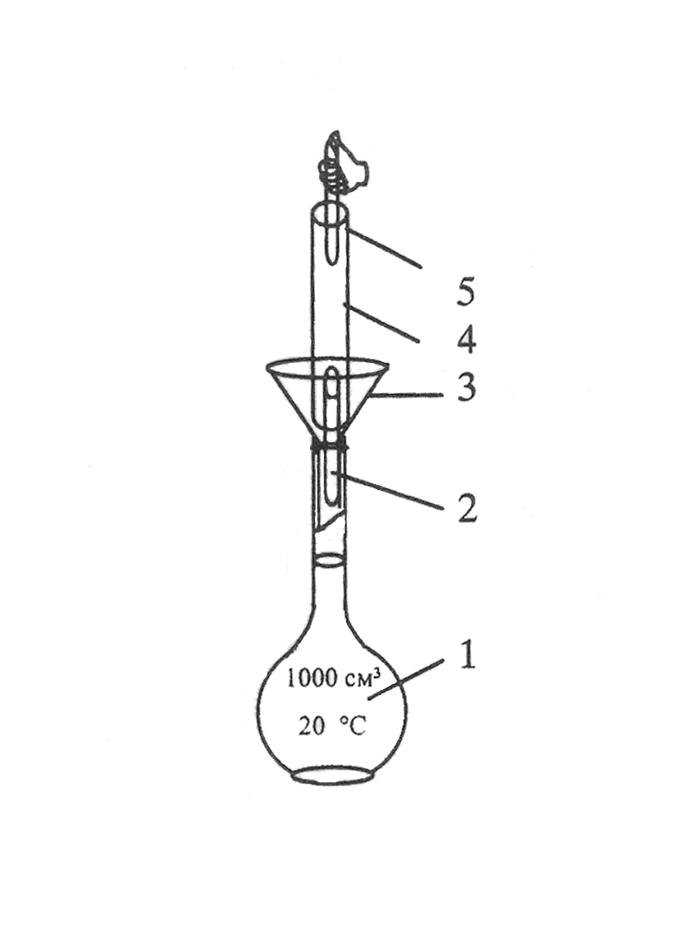
Рисунок 4.10 –
Порядок операций при приготовлении
раствора первичного
стандарта по точной
навеске: 1 – мерная колба Мора; 2 –
воронка;
3 – бюкс с навеской
вещества; 4 – промывалка с дистиллированной
водой;
5 – пипетка или
капельница.
а – перенос навески
вещества в мерную колбу; б – ополаскивание
воронки;
в – доведение
объема раствора стандарта до метки.
Этим методом обычно
готовят растворы солей, таких как бура
(Na2B4O710H2O),
K2Cr2O7.
Количество вещества в растворе находят
или по значению точно взятой массы
навески (при ее переносе необходимо
тщательно промыть бюкс), или рассчитывают
методом разности, определяя точную
массу бюкса сначала с навеской, а затем
– пустого, уже после переноса вещества
в колбу. В случае необходимости
концентрацию раствора заново пересчитывают
с учетом фактически взятой массы навески.
Порядок приготовления
раствора методом разведения из
фиксанала показан на рисунке 4.11. Чтобы
стандарт, полученный этим методом, был
качественным и отвечал всем требованиям,
необходимо исключить потери вещества
при вскрытии ампулы и переносе его в
колбу, а также следить, чтобы осколки
ампулы не попали в раствор. Это во многом
зависит от правильности обращения с
ампулой.
Рисунок 4.11 – Способ
приготовления растворов первичного
стандарта
методом разведения
из фиксанала: 1 – мерная колба Мора на
1л;
2 – нижний боек; 3
– воронка; 4 – ампула фиксанала; 5 –
верхний боек.
Перед использованием,
ампулу следует ополоснуть дистиллированной
водой и только затем ее вскрывать
специальным бойком. Сразу же после
переноса вещества в колбу, нужно тщательно
промыть ампулу дистиллированной водой,
не менее, чем 6-ти кратным ее объемом.
Этот метод приготовления первичного
стандарта проще, чем по точным навескам,
но уступает ему в точности. Его используют
не только для получения растворов солей,
но и различных кислот.
Так как для
приготовления раствора первичного
стандарта пригодны только точная
мерная посуда и аналитические весы,
то и к веществам, применяемым для этой
цели, предъявляют ряд обязательных
требований. В качестве первичного
стандарта можно использовать только
такие реактивы, которые характеризуются:
-
высокой чистотой
(обычно не хуже, чем 99,99 – 99,999%
квалификации ч.д.а. и о.с.ч.); -
точным соответствием
формульному составу и относительно
высокой молекулярной массой; -
устойчивостью
при хранении как в твердом виде,
так и в растворе (отсутствие процессов
гидратации, гидролиза, окисления и
карбонизации); -
простотой в
приготовлении и хорошей растворимостью; -
необратимостью
реакции при стандартизации, селективностью; -
возможностью
точной фиксации Т. Э. каким-либо методом.
Вторичным
стандартом называют такие
стандартизированные растворы,
которые устойчивы при хранении и могут
быть использованы для стандартизации
других растворов.
Вторичные стандарты
готовят как растворы приблизительной
концентрации любым известным методом,
а перед употреблением
определяют их точную концентрацию
путем стандартизации по
первичному стандарту. Поэтому при
приготовлении вторичных стандартов не
требуется высокая точность измерения
массы вещества или объема раствора, как
в случае первичных стандартов. Для этой
цели вполне пригодны технохимические
весы и неточная мерная посуда
(цилиндры, мензурки, градуированные
пробирки).
Примером раствора,
обладающего свойствами вторичного
стандарта, является соляная
кислота. Ее разбавленные растворы
могут храниться длительное время, до
1-го месяца и более, без заметного
изменения концентрации. Бура,
используемая в протолитометрии для
стандартизации HCl, относится
к первичным стандартам и готовится
по точной навеске. Тогда, как рабочий
раствор NaOH –
свойствами стандарта не обладает вообще
и его концентрацию приходится
устанавливать заново при каждом
использовании.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Определение титра, эквивалентной концентрации (нормальности) и титра раствора по определяемому веществу.
Титр раствора – отношение массы растворённого вещества к объёму раствора, T = 
Титр раствора по определяемому веществу – отношение массы определяемого вещества к объёму раствора, пошедшего на титрование данной массы, показывает массу вещества, титруемую 1 мл раствора. Например, титр раствора соляной кислоты по карбонату натрия равен:
T HCl/Na2CO3 = 
Эквивалентная концентрация раствора (Сэ), или нормальность (N) равна:
Сэ = N = 

См = 
(молярная концентрация)
Пример 1. Определить титр раствора перманганата калия по железу и пероксиду водорода, если нормальность (Сэ) этого раствора 0,025 моль/л.
Решение. При окислении железа и пероксида водорода перманганатом калия протекают реакции:
А) Fe2+ — e- ® Fe3+; Мэ(Fe) = М(Fe) = 55,85 г/моль.
Б) H2O2 — 2e — ® 2H+ + O2 ® Мэ(H2O2) = М(H2O2) = 17,01 г/моль.
(В точке эквивалентности nэ(KMnO4) = nэ(Fe));
Сэ(KMnO4) = 0,025 ® 0,025 моль содержится в 1000 мл раствора перманганата калия.
В точке эквивалентности nэ(H2O2) = nэ(KMnO4) = 0,025 моль в 1000 мл раствора перманганата калия.
Пример 2. Образец массой 0,1182 г с массовой долей марганца 0,84% растворили и оттитровали 22,27 мл раствора арсенита натрия. Определить титр раствора арсенита натрия по марганцу, если марганец присутствует в виде марганцовой кислоты (HMnO4).
Решение. Находим массу марганца в образце:
M(Mn) =
® Т NaAsO2/Mn = 
Пример 3. Определить нормальность (Сэ) раствора азотной кислоты с массовой долей азотной кислоты 30,1% и плотностью 1,185 г/мл в реакции:
NO3- + 4H+ + 3e — ® NO + 2H2O.
Решение.
Сэ = 
M(HNO3) = 

Мэ(HNO3) = М(HNO3) =
· 63 г/моль = 21,01 г/моль;
Сэ(HNO3) =
Определение титра, эквивалентной концентрации (нормальности) и титра раствора по определяемому веществу.
Титр раствора – отношение массы растворённого вещества к объёму раствора, T = 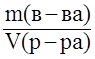
Титр раствора по определяемому веществу – отношение массы определяемого вещества к объёму раствора, пошедшего на титрование данной массы, показывает массу вещества, титруемую 1 мл раствора. Например, титр раствора соляной кислоты по карбонату натрия равен:
T HCl/Na2CO3 = 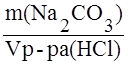
Эквивалентная концентрация раствора (Сэ), или нормальность (N) равна:
Сэ = N = 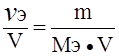
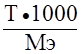
См = 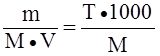
(молярная концентрация)
Пример 1. Определить титр раствора перманганата калия по железу и пероксиду водорода, если нормальность (Сэ) этого раствора 0,025 моль/л.
Решение. При окислении железа и пероксида водорода перманганатом калия протекают реакции:
А) Fe2+ — e- ® Fe3+; Мэ(Fe) = М(Fe) = 55,85 г/моль.
Б) H2O2 — 2e — ® 2H+ + O2 ® Мэ(H2O2) = М(H2O2) = 17,01 г/моль.
(В точке эквивалентности nэ(KMnO4) = nэ(Fe));
Сэ(KMnO4) = 0,025 ® 0,025 моль содержится в 1000 мл раствора перманганата калия.
В точке эквивалентности nэ(H2O2) = nэ(KMnO4) = 0,025 моль в 1000 мл раствора перманганата калия.
Пример 2. Образец массой 0,1182 г с массовой долей марганца 0,84% растворили и оттитровали 22,27 мл раствора арсенита натрия. Определить титр раствора арсенита натрия по марганцу, если марганец присутствует в виде марганцовой кислоты (HMnO4).
Решение. Находим массу марганца в образце:
M(Mn) =
® Т NaAsO2/Mn = 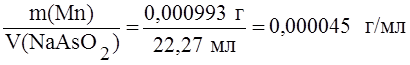
Пример 3. Определить нормальность (Сэ) раствора азотной кислоты с массовой долей азотной кислоты 30,1% и плотностью 1,185 г/мл в реакции:
NO3- + 4H+ + 3e — ® NO + 2H2O.
Решение.
Сэ = 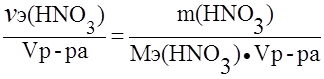
M(HNO3) = 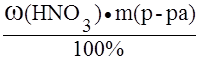
Vр-ра=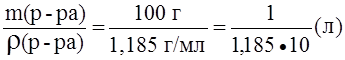
Мэ(HNO3) = М(HNO3) =
· 63 г/моль = 21,01 г/моль;
Сэ(HNO3) =