Если
система является однокомпонентной, т.
е. состоящей из химически однородного
вещества или его соединения, то понятие
фазы совпадает с понятием агрегатного
состояния. Согласно § 60, одно и то же
вещество в зависимости от соотношения
между удвоенной средней энергией,
приходящейся на одну степень свободы
хаотического теплового движения
молекул, и наименьшей потенциальной
энергией взаимодействия молекул
может находиться в одном из трех
агрегатных состояний: твердом, жидком
или газообразном. Это соотношение,
в свою очередь, определяется внешними
условиями — температурой и давлением.
Следовательно, фазовые превращения
также определяются изменениями
температуры и давления. Для наглядного
изображения фазовых превращений
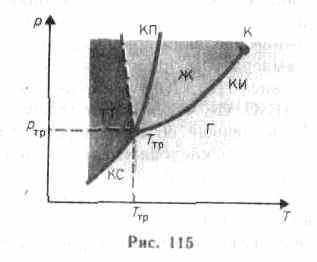
используется диаграмма
состояния (рис.
115), на которой в координатах р,
Т задается
зависимость между температурой фазового
перехода и давлением в виде кривых
испарения (КИ), плавления (КП) и сублимации
(КС), разделяющих поле диаграммы на
три области, соответствующие условиям
существования твердой (ТТ), жидкой
(Ж) и газообразной (Г) фаз. Кривые на
диаграмме называются кривыми
фазового равновесия, каждая
точка на них соответ-
126
ствует условиям
равновесия двух сосуществующих фаз:
КП — твердого тела и жидкости, КИ —
жидкости и газа, КС — твердого тела и
газа.
Точка,
в которой пересекаются эти кривые и
которая, следовательно, определяет
условия (температуру Tтр
и соответствующее ей равновесное
давление ртр)
одновременного равновесного
сосуществования трех фаз вещества,
называется тройной
точкой. Каждое
вещество имеет только одну тройную
точку. Тройная точка воды характеризуется
температурой 273,16 К (по шкале Цельсия ей
соответствует температура 0,01 °С) и
является основной реперной точкой
для построения термодинамической
температурной шкалы.
Термодинамика
дает метод расчета кривой равновесия
двух фаз одного и того же вещества.
Согласно уравнению
Клапейрона — Клаузиуса, производная
от равновесного давления по температуре
где L
—
теплота фазового перехода, (V2-V1)
—изменение
объема вещества при переходе его из
первой фазы во вторую, Т
—
температура перехода (процесс
изотермический).
Уравнение
Клапейрона — Клаузиуса позволяет
определить наклоны кривых равновесия.
Поскольку L
и
Т
положительны,
наклон задается знаком V2—V1.
При
испарении жидкостей и сублимации
твердых тел объем вещества всегда
возрастает, поэтому, согласно (76.1),
dp/dT>0;
следовательно,
в этих процессах повышение температуры
приводит к увеличению давления, и
наоборот. При плавлении большинства
веществ объем, как правило, возрастает,
т. е. dp/dT>0;
следовательно,
увеличение давления приводит к повышению
температуры плавления (сплошная КП на
рис. 115). Для некоторых же веществ
(H2O,
Ge,
чугун
и др.) объем жидкой фазы меньше объема
твердой фазы, т. е. dp/dT<0;
следовательно,
увеличение давления сопровождается
понижением температуры плавления
(штриховая линия на рис. 115).
Диаграмма состояния,
строящаяся на
основе
экспериментальных данных, позволяет
судить, в каком состоянии находится
данное вещество при определенных р
и
Т,
а
также какие фазовые переходы будут
происходить при том или ином процессе.
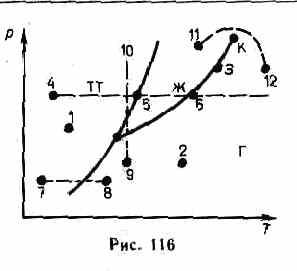
Например, при условиях, соответствующих
точке 1
(рис.
116), вещество находится в твердом
состоянии, точке 2 — в газообразном,
а точке 3 — одновременно в жидком и
газообразном состояниях. Допустим,
что вещество в твердом состоянии,
соответствующем точке 4,
подвергается
изобарному нагреванию, изображенному
на диаграмме состояния горизонтальной
штриховой прямой 4—5—6.
Из
рисунка видно, что при температуре,
соответствующей точке 5,
вещество
плавится, при более высокой температуре,
соответствующей точке 6,—
начинает превращаться в газ. Если же
вещество находится в твердом состоянии,
соответствующем точке 7, то при изобарном
нагревании (штриховая прямая 7— 
кристалл
превращается в газ минуя жидкую фазу.
Если вещество находится в состоянии,
соответствующем точке 9, то при
изотермическом сжатии (штриховая прямая
9—10)
оно
пройдет следующие три состояния: газ —
жидкость — кристаллическое состояние.
На
диаграмме состояний (см. рис. 115 и 116)
видно, что кривая испарения заканчивается
в критической точке К. Поэтому возможен
непрерывный
переход
вещества из жидкого состояния в
газообразное и обратно в обход
критической точки, без пересечения
кривой испарения (переход 11—12
на
рис. 116), т. е. такой переход, который
не сопровождается фазовыми
превращениями. Это возможно благодаря
тому, что различие между газом и жидкостью
является чисто количествен-
127
ным (оба эти
состояния, например, являются
изотропными). Переход же кристаллического
состояния (характеризуется анизотропией)
в жидкое или газообразное может быть
только скачкообразным (в результате
фазового перехода), поэтому
кривые
плавления и сублимации не могут
обрываться, как это имеет место для
кривой испарения в критической точке.
Кривая плавления уходит в бесконечность,
а кривая сублимации идет в точку, где
р=0
и Т=0.
Контрольные
вопросы
•Чем отличаются
реальные газы от идеальных? Каков смысл
поправок при выводе уравнения
Ван-дер-Ваальса?
• Почему
перегретая жидкость и пересыщенный пар
являются метастабильными состояниями?
При адиабатическом расширении газа в
вакуум его внутренняя энергия не
меняется. Как изменится температура,
если газ идеальный? реальный?
• Каковы
суть и причины эффекта Джоуля — Томсона?
Когда его называют положительным?
отрицательным?
• Почему
у всех веществ поверхностное натяжение
уменьшается с температурой? Что
представляют собой поверхностно-активные
вещества? При каком условии жидкость
смачивает твердое тело? не смачивает?
От чего зависит высота поднятия
смачивающей жидкости в капилляре? Чем
отличаются монокристаллы от поликристаллов?
Как можно классифицировать кристаллы?
• Как
получить закон Дюлонга и Пти исходя из
классической теории теплоемкости?
Некоторое количество твердого вещества
смешано с тем же веществом в жидком
состоянии. Почему при некотором нагреве
этой смеси ее температура не поднимается?
Чем отличается фазовый переход I
рода
от фазового перехода II
рола?
• Что
можно «вычитать» из диаграммы состояния,
используемой для изображения фазовых
превращений?
Задачи
10.1.
Углекислый
газ массой m=1
кг находится при температуре 290 К в
сосуде вместимостью 20 л. Определить
давление газа, если: 1) газ реальный; 2)
газ идеальный. Объяснить различие
в результатах. Поправки а
и
b
принять
равными соответственно 0,365 Н•м4/моль2
и
4,3•10-5
м3/моль.
[ 1) 2,44 МПа; 2) 2,76 МПа ]
10.2.
Кислород,
содержащий количество вещества v
= 2 моль,
занимает объем V1
= 1 л.
Определить
изменение T
температуры кислорода, если он
адиабатически расширяется в вакуум до
объема V2=10
л.
Поправку а
принять
равной 0,136 Н•м4/моль2.
[-11,8
К |
10.3.
Показать,
что эффект Джоуля — Томсона всегда
отрицателен, если дросселируется газ,
для которого силами притяжения молекул
можно пренебречь.
10.4.
Считая
процесс образования мыльного пузыря
изотермическим, определить работу А,
которую
надо совершить, чтобы увеличить его
диаметр от d1=2
см
до
d2=6
см. Поверхностное натяжение о мыльного
раствора принять равным 40 мН/м. [0,8 мДж
|
10.5.
Воздушный
пузырек диаметром d=0,02
мм
находится на глубине А=20 см под поверхностью
воды. Определить давление воздуха в
этом пузырьке. Атмосферное давление
принять нормальным. Поверхностное
натяжение воды =73
мН/м, а ее плотность =1
г/см3
[ 118 кПа |
10.6.
Вертикальный
открытый капилляр внутренним диаметром
d
= 3 мм
опущен в сосуд с ртутью. Определить
радиус кривизны ртутного мениска в
капилляре, если разность уровней ртути
в сосуде и в капилляре h=3,7
мм. Плотность ртути =
13,6 г/см3,
а поверхностное натяжение а = 0,5 Н/м.
[ 2 мм ]
10.7.
Для
нагревания металлического шарика массой
25 г от 10 до 30 °С затратили количество
теплоты, равное 117 Дж. Определить
теплоемкость шарика из закона Дюлонга
и Пти и материал шарика. [М107
кг/моль; серебро]
*П.
Лаплас (1749—1827)
—вранцузский ученый.
* К. Линде
(1842—1934) —немецкий физик и инженер.
Соседние файлы в папке Трофимова Курс физики
- #
16.03.2016155.65 Кб1141.doc
- #
16.03.2016662.53 Кб21210.doc
- #
16.03.2016592.38 Кб25111.doc
- #
- #
16.03.2016181.76 Кб16913.doc
- #
16.03.2016336.38 Кб13614.doc
- #
16.03.2016206.34 Кб14115.doc
| Определение |
Процессы качественных изменений свойств вещества, происходящие при (T=const), (V ne const), но с теплообменом, характеризуют фазовые переходы (I) рода. Процессы, при которых данные условия не выполняются, (V=const), но изменяется теплоёмкость, определяют фазовые переходы (II) рода. В случае однородной термодинамической системы термины «фаза» и «агрегатное состояние вещества» имеют одинаковый смысл |
| Диаграмма состояния |
Изменения давления (p) и температуры (T) определяют фазовые переходы. Обрати внимание! Функция (p=p(T)) — диаграмма состояния (рис. (1)) изображается в виде различных кривых (буква К), где обозначения указывают на названия процесса (И — испарение, П — плавление, С — сублимация) и фаз (Ж — жидкая, Г — газообразная, ТТ — твёрдое тело). Тройная точка, в которой соединяются на графике все кривые, характеризует одновременное равновесное нахождение всех трёх фаз вещества, а термодинамические параметры соответственно обозначаются (T_{тр}) и (p_{тр}). Рис. (1). Изображение фазовых переходов |
| Уравнение теплового баланса |
Тепловые процессы: |
From Wikipedia, the free encyclopedia
A typical phase diagram. The solid green line applies to most substances; the dashed green line gives the anomalous behavior of water
In thermodynamics, the triple point of a substance is the temperature and pressure at which the three phases (gas, liquid, and solid) of that substance coexist in thermodynamic equilibrium.[1] It is that temperature and pressure at which the sublimation, fusion, and vaporisation curves meet. For example, the triple point of mercury occurs at a temperature of −38.8 °C (−37.8 °F) and a pressure of 0.165 mPa.
In addition to the triple point for solid, liquid, and gas phases, a triple point may involve more than one solid phase, for substances with multiple polymorphs. Helium-4 is unusual in that it has no sublimation/deposition curve and therefore no triple points where its solid phase meets its gas phase. Instead, it has a vapor-liquid-superfluid point, a solid-liquid-superfluid point, a solid-solid-liquid point, and a solid-solid-superfluid point. None of these should be confused with the Lambda Point, which is not any kind of triple point.
The triple point of water was used to define the kelvin, the base unit of thermodynamic temperature in the International System of Units (SI).[2] The value of the triple point of water was fixed by definition, rather than by measurement, but that changed with the 2019 redefinition of SI base units. The triple points of several substances are used to define points in the ITS-90 international temperature scale, ranging from the triple point of hydrogen (13.8033 K) to the triple point of water (273.16 K, 0.01 °C, or 32.018 °F).
The term «triple point» was coined in 1873 by James Thomson, brother of Lord Kelvin.[3]
Triple point of water[edit]
Gas–liquid–solid triple point[edit]
|
|
This article needs to be updated. The reason given is: it needs to reflect the 2019 redefinition of the SI base units, which came into effect on May 20, 2019. Please help update this article to reflect recent events or newly available information. (January 2020) |
Water boiling at 0°C using a vacuum pump.
The single combination of pressure and temperature at which liquid water, solid ice, and water vapor can coexist in a stable equilibrium occurs at exactly 273.1600 K (0.0100 °C; 32.0180 °F) and a partial vapor pressure of 611.657 pascals (6.11657 mbar; 0.00603659 atm).[4][5] At that point, it is possible to change all of the substance to ice, water, or vapor by making arbitrarily small changes in pressure and temperature. Even if the total pressure of a system is well above the triple point of water, provided that the partial pressure of the water vapor is 611.657 pascals, then the system can still be brought to the triple point of water. Strictly speaking, the surfaces separating the different phases should also be perfectly flat, to negate the effects of surface tension.
The smallest pressure at which liquid water can exist is equal to the triple point of water, at which gas, liquid, and solid phases can coexist. At pressures below the triple point (as in outer space), solid ice when heated at constant pressure is converted directly into water vapor in a process known as sublimation. Above the triple point, solid ice when heated at constant pressure first melts to form liquid water, and then evaporates or boils to form vapor at a higher temperature.
For most substances the gas–liquid–solid triple point is also the minimum temperature at which the liquid can exist. For water, however, this is not true because the melting point of ordinary ice decreases as a function of pressure, as shown by the dashed green line in the phase diagram. At temperatures just below the triple point, compression at constant temperature transforms water vapor first to solid and then to liquid (water ice has lower density than liquid water, so increasing pressure leads to a liquefaction).
The triple point pressure of water was used during the Mariner 9 mission to Mars as a reference point to define «sea level». More recent missions use laser altimetry and gravity measurements instead of pressure to define elevation on Mars.[6]
High-pressure phases[edit]
At high pressures, water has a complex phase diagram with 15 known phases of ice and several triple points, including 10 whose coordinates are shown in the diagram. For example, the triple point at 251 K (−22 °C) and 210 MPa (2070 atm) corresponds to the conditions for the coexistence of ice Ih (ordinary ice), ice III and liquid water, all at equilibrium. There are also triple points for the coexistence of three solid phases, for example ice II, ice V and ice VI at 218 K (−55 °C) and 620 MPa (6120 atm).
For those high-pressure forms of ice which can exist in equilibrium with liquid, the diagram shows that melting points increase with pressure. At temperatures above 273 K (0 °C), increasing the pressure on water vapor results first in liquid water and then a high-pressure form of ice. In the range 251–273 K, ice I is formed first, followed by liquid water and then ice III or ice V, followed by other still denser high-pressure forms.
Phase diagram of water including high-pressure forms ice II, ice III, etc. The pressure axis is logarithmic. For detailed descriptions of these phases, see Ice.
| Phases in stable equilibrium | Pressure | Temperature |
|---|---|---|
| liquid water, ice Ih, and water vapor | 611.657 Pa[7] | 273.16 K (0.01 °C) |
| liquid water, ice Ih, and ice III | 209.9 MPa | 251 K (−22 °C) |
| liquid water, ice III, and ice V | 350.1 MPa | −17.0 °C |
| liquid water, ice V, and ice VI | 632.4 MPa | 0.16 °C |
| ice Ih, Ice II, and ice III | 213 MPa | −35 °C |
| ice II, ice III, and ice V | 344 MPa | −24 °C |
| ice II, ice V, and ice VI | 626 MPa | −70 °C |
Triple-point cells[edit]
Triple-point cells are used in the calibration of thermometers. For exacting work, triple-point cells are typically filled with a highly pure chemical substance such as hydrogen, argon, mercury, or water (depending on the desired temperature). The purity of these substances can be such that only one part in a million is a contaminant, called «six nines» because it is 99.9999% pure. A specific isotopic composition (for water, VSMOW) is used because variations in isotopic composition cause small changes in the triple point. Triple-point cells are so effective at achieving highly precise, reproducible temperatures, that an international calibration standard for thermometers called ITS–90 relies upon triple-point cells of hydrogen, neon, oxygen, argon, mercury, and water for delineating six of its defined temperature points.
Table of triple points[edit]
This table lists the gas–liquid–solid triple points of several substances. Unless otherwise noted, the data come from the U.S. National Bureau of Standards (now NIST, National Institute of Standards and Technology).[8]
| Substance | T [K] (°C) | p [kPa]* (atm) |
|---|---|---|
| Acetylene | 192.4 K (−80.7 °C) | 120 kPa (1.2 atm) |
| Ammonia | 195.40 K (−77.75 °C) | 6.060 kPa (0.05981 atm) |
| Argon | 83.8058 K (−189.3442 °C) | 68.9 kPa (0.680 atm) |
| Arsenic | 1,090 K (820 °C) | 3,628 kPa (35.81 atm) |
| Butane[9] | 134.6 K (−138.6 °C) | 7×10−4 kPa (6.9×10−6 atm) |
| Carbon (graphite) | 4,765 K (4,492 °C) | 10,132 kPa (100.00 atm) |
| Carbon dioxide | 216.55 K (−56.60 °C) | 517 kPa (5.10 atm) |
| Carbon monoxide | 68.10 K (−205.05 °C) | 15.37 kPa (0.1517 atm) |
| Chloroform | 175.43 K (−97.72 °C)[citation needed] | 0.870 kPa (0.00859 atm)[citation needed] |
| Deuterium | 18.63 K (−254.52 °C) | 17.1 kPa (0.169 atm) |
| Ethane | 89.89 K (−183.26 °C) | 1.1×10−3 kPa (1.1×10−5 atm) |
| Ethanol[10] | 150 K (−123 °C) | 4.3×10−7 kPa (4.2×10−9 atm) |
| Ethylene | 104.0 K (−169.2 °C) | 0.12 kPa (0.0012 atm) |
| Formic acid[11] | 281.40 K (8.25 °C) | 2.2 kPa (0.022 atm) |
| Helium-4 (vapor−He-I−He-II)[12] | 2.1768 K (−270.9732 °C) | 5.048 kPa (0.04982 atm) |
| Helium-4 (hcp−bcc−He-II)[13] | 1.463 K (−271.687 °C) | 26.036 kPa (0.25696 atm) |
| Helium-4 (bcc−He-I−He-II)[13] | 1.762 K (−271.388 °C) | 29.725 kPa (0.29336 atm) |
| Helium-4 (hcp−bcc−He-I)[13] | 1.772 K (−271.378 °C) | 30.016 kPa (0.29623 atm) |
| Hexafluoroethane[14] | 173.08 K (−100.07 °C) | 26.60 kPa (0.2625 atm) |
| Hydrogen | 13.8033 K (−259.3467 °C) | 7.04 kPa (0.0695 atm) |
| Hydrogen-1 (Protium)[15] | 13.96 K (−259.19 °C) | 7.18 kPa (0.0709 atm) |
| Hydrogen chloride | 158.96 K (−114.19 °C) | 13.9 kPa (0.137 atm) |
| Iodine[16] | 386.65 K (113.50 °C) | 12.07 kPa (0.1191 atm) |
| Isobutane[17] | 113.55 K (−159.60 °C) | 1.9481×10−5 kPa (1.9226×10−7 atm) |
| Krypton | 115.76 K (−157.39 °C) | 74.12 kPa (0.7315 atm) |
| Mercury | 234.3156 K (−38.8344 °C) | 1.65×10−7 kPa (1.63×10−9 atm) |
| Methane | 90.68 K (−182.47 °C) | 11.7 kPa (0.115 atm) |
| Neon | 24.5561 K (−248.5939 °C) | 43.332 kPa (0.42765 atm) |
| Nitric oxide | 109.50 K (−163.65 °C) | 21.92 kPa (0.2163 atm) |
| Nitrogen | 63.18 K (−209.97 °C) | 12.6 kPa (0.124 atm) |
| Nitrous oxide | 182.34 K (−90.81 °C) | 87.85 kPa (0.8670 atm) |
| Oxygen | 54.3584 K (−218.7916 °C) | 0.14625 kPa (0.0014434 atm) |
| Palladium | 1,825 K (1,552 °C) | 3.5×10−3 kPa (3.5×10−5 atm) |
| Platinum | 2,045 K (1,772 °C) | 2×10−4 kPa (2.0×10−6 atm) |
| Radon | 202 K (−71 °C) | 70 kPa (0.69 atm) |
| (mono)Silane[18] | 88.48 K (−184.67 °C) | 0.019644 kPa (0.00019387 atm) |
| Sulfur dioxide | 197.69 K (−75.46 °C) | 1.67 kPa (0.0165 atm) |
| Titanium | 1,941 K (1,668 °C) | 5.3×10−3 kPa (5.2×10−5 atm) |
| Uranium hexafluoride | 337.17 K (64.02 °C) | 151.7 kPa (1.497 atm) |
| Water[4][5] | 273.16 K (0.01 °C) | 0.611657 kPa (0.00603659 atm) |
| Xenon | 161.3 K (−111.8 °C) | 81.5 kPa (0.804 atm) |
| Zinc | 692.65 K (419.50 °C) | 0.065 kPa (0.00064 atm) |
Notes:
- For comparison, typical atmospheric pressure is 101.325 kPa (1 atm).
- Before the new definition of SI units, water’s triple point, 273.16 K, was an exact number.
See also[edit]
- Critical point (thermodynamics)
- Gibbs’ phase rule
References[edit]
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (1994) «Triple point». doi:10.1351/goldbook.T06502.
- ^ Definition of the kelvin at BIPM.
- ^ James Thomson (1873) «A quantitative investigation of certain relations between the gaseous, the liquid, and the solid states of water-substance», Proceedings of the Royal Society, 22 : 27–36. From a footnote on page 28: » … the three curves would meet or cross each other in one point, which I have called the triple point«.
- ^ a b International Equations for the Pressure along the Melting and along the Sublimation Curve of Ordinary Water Substance. W. Wagner, A. Saul and A. Pruss (1994), J. Phys. Chem. Ref. Data, 23, 515.
- ^ a b Murphy, D. M. (2005). «Review of the vapour pressures of ice and supercooled water for atmospheric applications». Quarterly Journal of the Royal Meteorological Society. 131 (608): 1539–1565. Bibcode:2005QJRMS.131.1539M. doi:10.1256/qj.04.94. S2CID 122365938.
- ^ Carr, Michael H. (2007). The Surface of Mars. Cambridge University Press. p. 5. ISBN 978-0-521-87201-0.
- ^ Murphy, D. M. (2005). «Review of the vapour pressures of ice and supercooled water for atmospheric applications». Quarterly Journal of the Royal Meteorological Society. 131 (608): 1539–1565. Bibcode:2005QJRMS.131.1539M. doi:10.1256/qj.04.94. S2CID 122365938.
- ^ Cengel, Yunus A.; Turner, Robert H. (2004). Fundamentals of thermal-fluid sciences. Boston: McGraw-Hill. p. 78. ISBN 0-07-297675-6.
- ^ See Butane (data page)
- ^ See Ethanol (data page)
- ^ See Formic acid (data page)
- ^ Donnelly, Russell J.; Barenghi, Carlo F. (1998). «The Observed Properties of Liquid Helium at the Saturated Vapor Pressure». Journal of Physical and Chemical Reference Data. 27 (6): 1217–1274. Bibcode:1998JPCRD..27.1217D. doi:10.1063/1.556028.
- ^ a b c Hoffer, J. K.; Gardner, W. R.; Waterfield, C. G.; Phillips, N. E. (April 1976). «Thermodynamic properties of 4He. II. The bcc phase and the P-T and VT phase diagrams below 2 K». Journal of Low Temperature Physics. 23 (1): 63–102. Bibcode:1976JLTP…23…63H. doi:10.1007/BF00117245. S2CID 120473493.
- ^ See Hexafluoroethane (data page)
- ^ «Protium | isotope | Britannica».
- ^ Walas, S. M. (1990). Chemical Process Equipment – Selection and Design. Amsterdam: Elsevier. p. 639. ISBN 0-7506-7510-1.
- ^ See Isobutane (data page)
- ^ «Silane-Gas Encyclopedia». Gas Encyclopedia. Air Liquide.
External links[edit]
Media related to Triple point at Wikimedia Commons
Допустим, что
число фаз химически однородного
вещества, находящихся в равновесии
друг с другом, равно трем. Примером
может служить система, состоящая из
твердой фазы, жидкости и ее пара. Для
равновесия необходимо соблюдение трех
условий:
j 1 (P,T)
=j 2 (P,T),
j 2 (P,T) =j 3 (P,T),
(2)
j 3 (P,T)
=j 1 (P,T).
Первое есть
условие равновесия между жидкостью и
ее паром; второе — между жидкостью и
твердой фазой; третье — между твердой
фазой и паром. Эти три условия не
независимы. Каждое из них является
следствием двух остальных. Первое
уравнение системы (2) изображает на
плоскости Т-Р кривую равновесия между
газом и жидкостью, т.е. кривую испарения
1-2 на рис. 2. Второе изображает кривую
равновесия твердой и жидкой фаз 2-3. Она
называется кривой плавления. Кривая
плавления пересекается с кривой
испарения в точке А, называемой тройной
точкой. Через тройную точку должна
проходить и кривая возгонки 3-1, т.е.
кривая равновесия между твердой и
газообразной фазами. Это непосредственно
следует из третьего уравнения системы
(2).
Таким образом,
три фазы могут находиться в равновесии
друг с другом в одной точке, а именно в
тройной точке, т.е. при вполне определенных
значениях температуры и давления.
Рис.2 Диаграмма
состояний трех фаз вещества
Для
воды тройная точка лежит примерно на
0.008 0 С
выше точки плавления при нормальном
атмосферном давлении. Давление в тройной
точке составляет около 4.58 мм. рт. ст.
Тройная точка воды является основной
реперной точкой при построении
абсолютной термодинамической шкалы
температур Кельвина, а также практической
международной шкалы температур Цельсия.
Кривые испарения,
плавления и возгонки делят плоскость
Т-Р на три области (рис. 2). Точкам области
1 соответствует газообразное, области
2 — жидкое, области 3 — твердое состояние
вещества. Плоскость Т-Р с указанными
тремя кривыми равновесия называется
диаграммой состояний.
Диаграмма
состояний позволяет судить, какие будут
происходить фазовые превращения при
том или ином процессе. Допустим, например,
что производится нагревание при
постоянном давлении. На диаграмме
состояний такой процесс представляется
горизонтальной прямой. Если эта прямая
проходит выше тройной точки, то в точке
B
(рис.2) она пересекает кривую плавления,
а в точке С — кривую испарения. Значит,
при нагревании твердое тело сначала
расплавится, а затем жидкость испарится.
В случае
четырех фаз для
равновесия необходимо выполнение шести
уравнений типа (2), из которых, однако,
независимы только три. Геометрически
задача сводится к нахождению общей
точки пересечения трех кривых равновесия
фаз. Но три кривые пересекаются, вообще
говоря, в трех, а не в одной точке.
Пересечение в одной точке является
исключительным случаем, с которым
практически можно не считаться. Физически
это означает, что четыре и большее число
фаз химически однородного вещества не
могут находиться в равновесии между
собой ни при каких давлениях и
температурах. Максимальное число фаз,
находящихся в равновесии друг с другом,
не может превышать трех.
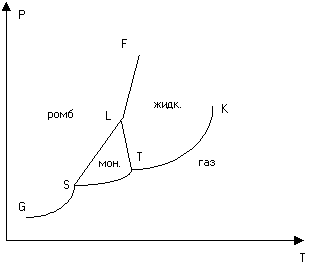
Рис.
3. Диаграмма
состояний серы
Если число фаз,
в которых может находиться химически
однородное вещество при всевозможных
значениях температуры и давления,
превышает три, то плоскость Т-Р разбивается
на ряд областей (рис. 3). Каждая точка
плоскости Т-Р, если она не лежит на
границе области, изображает однофазное
состояние вещества. Области граничат
между собой вдоль кривых, каждая из
которых является кривой равновесия
соответствующих двух фаз. Всякая точка,
лежащая на кривой равновесия, изображает
двухфазное состояние вещества, причем
в этом состоянии фазы могут быть
представлены в любых пропорциях. Кривые
равновесия фаз могут пересекаться по
три в отдельных точках. Это тройные
точки, в которых находятся в равновесии
три граничащие друг с другом фазы.
В
качестве примера на рис. 3 представлена
в упрощенном виде диаграмма состояний
серы. Сера может существовать в двух
кристаллических модификациях —
моноклинной и ромбической. В соответствии
с этим на диаграмме состояний имеются
три тройных точки S,
T
и L.
Область моноклинной модификации
ограничена треугольником STL.
Область ромбической модификации лежит
выше кривой GSLF.
КОНТРОЛЬНЫЕ
ВОПРОСЫ
1. Дайте определение
фазы вещества и фазового превращения.
2. Сформулируйте
условия равновесия нескольких фаз.
3. Как строится
диаграмма фазовых состояний вещества?
Рассмотрите фазовую диаграмму для
процесса испаарение-конденсация и
диаграмму состояний трех фаз вещества.
4. Какое максимальное
число фаз может находиться в равновесии
друг с другом?
Из предложенных
Вам ответов на данный вопрос выберите
правильный.
1. Сколько имеется
агрегатных состояний вещества?
г) четыре.
2. Какие
состояния вещества являются
конденсированными?
а) твердое и
газообразное,
б) жидкое и
газообразное,
в) твердое и
жидкое,
г) твердое, жидкое
и газообразное.
3.Какова
единица измерения термодинамического
потенциала в СИ?
а) джоуль,
— (для элемента, представляющего собой разновидность сосуда Дьюара) [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN triple point of waterTPW … Справочник технического переводчика
Тройная точка
— воды; p давление; t температура. ТРОЙНАЯ ТОЧКА, состояние равновесного сосуществования трех фаз вещества, обычно твердой, жидкой и газообразной. Температура тройной точки воды (точки сосуществования льда, воды и пара) 0,01°C (273,16 К) при… … Иллюстрированный энциклопедический словарь
Состояние равновесного сосуществования. Тройная точка воды трех фаз вещества, обычно твердой, жидкой и газообразной. Температура тройной точки воды (точки сосуществования льда, воды и пара, рис.) равна 0,01 .С (273,16 К) при давлении 6,1 гПа… … Большой Энциклопедический словарь
Тройная точка
— точка на термодинамической диаграмме состояния, соответствующая равновесию трех фаз рассматриваемой термодинамической системы. Например, тройная точка воды соответствует равновесию системы, состоящей из льда, воды и водяного пара. Температуpa… …
ТРОЙНАЯ ТОЧКА
— точка на термодинамической диаграмме состояния, соответствующая равновесию трех фаз рассматриваемой термодинамической системы. Например, тройная точка воды соответствует равновесию системы, состоящей из льда, воды и водяного пара. Темпеpaтура… … Металлургический словарь
Состояние равновесного сосуществования трёх фаз вещества, обычно твёрдой, жидкой и газообразной. Температура тройной точки воды (точки сосуществования льда, воды и пара, рис.) равна 0,01°C (273,16 К) при давлении 6,1 гПа (4,58 мм рт. ст.). * * * … Энциклопедический словарь
Типичные виды фазовых диаграмм. Зелёная линия из точек показывает аномальное поведение воды Тройная точка точка на фазовой диаграмме, где сходятся три линии фазовых … Википедия
тройная точка
— точка на диаграммы состояния, соответствующая сосуществованию трех фаз вещества. Из правила фаз следует, что у химически индивидуального вещества (однокомпонентная система) при равновесии не может быть больше трех фаз. Эти три… … Энциклопедический словарь по металлургии
В термодинамике, точка на диаграмме состояния, соответствующая равновесному сосуществованию трёх фаз в ва. Из Гиббса правила фаз следует, что химически индивидуальное в во (однокомпонентная система) в равновесии не может иметь больше трёх фаз.… … Физическая энциклопедия
ТРОЙНАЯ ТОЧКА, температура и давление, при которых все три состояния вещества (твердое, жидкое, газообразное) могут существовать одновременно. Для воды тройная точка находится при температуре 273,16 К и давлении 610 Ра … Научно-технический энциклопедический словарь
Точка соответствует самому низкому давлению, при котором еще возможно превращение вещества из твердого состояния в жидкое и обратно, т. е. равновесное состояние между твердой и жидкой фазами; при меньших давлениях жидкое состояние не существует. На этом же чертеже нанесена кривая зависимости давления насыщенного пара от температуры, о которой упоминалось в § 13 ч. II (см. рис. 11.25) и в § 17 (см. формулу (3.32)). Слева от этой кривой вещество находится при температурах, которые меньше температуры кипения, т. е. в жидком состоянии; точки, расположенные справа от этой кривой, соответствуют более высоким температурам и, следовательно, состояниям ненасыщенного пара. Вдоль самой кривой жидкость и насыщенный пар существуют одновременно, т. е. каждая точка этой кривой соответствует равновесному состоянию между кипящей жидкостью и ее насыщенным паром. Точка этой кривой соответствует самой низкой температуре и дамому низкому давлению, при которых еще может существовать жидкость в равновесии со своим насыщенным паром. Точка называется тройной точкой данного вещества. В этой точке одновременно существуют в равновесии друг с другом все три фазы или агрегатные состояния вещества: твердое, жйдкое и газообразное (насыщенный пар). Для каждого вещества имеются определенные
значения давления и температуры тройной точки. При меньших давлениях могут существовать только твердое и газообразное состояния. Кривая показывает зависимость между давлением и температурой насыщенного пара, находящегося в равновесии с твердой фазой.
Непосредственное испарение твердых тел (называемое «возгонкой», или сублимацией) происходит при температурах, меньших, чем температура тройной точки.
Для многих веществ (металлы и др.) нормальная температура (15° С) значительно ниже температуры их тройных точек. Согласно кривой эти вещества при нормальной температуре имеют очень маленькое давление насыщенных паров. Очевидно, чем больше давление насыщенного пара над поверхностью твердого тела, тем интенсивнее может протекать процесс испарения этих тел. Например, легко испаряется йод, который в своей тройной точке (114° С) имеет давление насыщенных паров, равное 90 мм рт. ст. Высыхание мокрого белья на морозе объясняется тем, что находящаяся в нем вода сначала замерзает, а образующийся лед затем испаряется, так как на морозе температура льда меньше, чем температура тройной точки воды а давление насыщенных водяных паров достигает нескольких миллиметров ртутного столба (при -10° С это давление равно
Заметим, что удельная теплота возгонки, т. е. теплота, необходимая для превращения вещества из твердого состояния непосредственно в газообразное, оказывается равной сумме удельных теплот плавления и парообразования.
Температура тройной точки воды используется как реперная температура термодинамической шкалы Кельвина. Допустим, что идеальное рабочее тело, совершая идеальный цикл Карно, получает теплоту при температуре и отдает теплоту при температуре Измеряя можно, согласно § найти отношение температур Для того чтобы построить температурную шкалу, необходимо придать определенные («реперные») значения. В качестве таких реперных температур можно взять температуры кипения воды и таяния льда при нормальных условиях, приняв их разность за 100° С. Тогда по измеренному отношению и выбранной разности можно определить всю температурную шкалу. Очевидно, реперные точки должны воспроизводиться с очень большой точностью, так как они определяют величину градуса. Поэтому В. Томсон (Кельвин) и независимо от него Д. И. Менделеев предложили создать шкалу с одной реперной температурой, в качестве которой выбрана очень точно воспроизводимая (с ошибкой, не превышающей градуса) тройная точка воды. В Международной системе единиц физических величин дано следующее определение градуса: кельвин — единица температуры по термодинамической температурной шкале, в которой для температуры тройной точки воды установлено значение 273,16° (точно).