Добавил:
Upload
Опубликованный материал нарушает ваши авторские права? Сообщите нам.
Вуз:
Предмет:
Файл:
Кириллин В.А., Сычев В.В., Шейндлин А.Е. Техническая термодинамика (2008).pdf
Скачиваний:
2152
Добавлен:
11.03.2016
Размер:
11.02 Mб
Скачать

поправочными уравнениями. Эта поправка весьма мала, поэтому в тех случаях, когда мы имеем дело с относительно (по сравнению со значением ) неточными экспериментальными данными (а таких случаев подавляющее большинство), можно не учитывать этой разницы между Т и Tмежд, поскольку ее значение будет лежать заведомо за пределами погрешности экспериментальных данных.
Однако в тех случаях, когда мы имеем дело с особо точными, прецизионными экспериментальными данными (такими, например, как наиболее точные данные по удельным объемам водяного пара, находящегося в равновесии с кипящей водой) и в особенности с точными термодинамическими расчетами, где фигурируют производные различных величин по температуре, пренебрежение разницей между Т и Tмежд в расчетах по термодинамическим уравнениям может привести к погрешностям, соизмеримым с погрешностью собственно экспериментальных данных. Это важное обстоятельство всегда следует учитывать в практике термодинамических исследований (особенно
вбудущем, по мере повышения точности экспериментальных исследований).
Взаключение следует отметить, что использование различных термодинамических закономерностей позволило разработать различные методы введения поправок к любым практическим температурным шкалам для приведения этих шкал к термодинамической шкале, т.е. для построения термодинамической шкалы по той или иной практической шкале (например, по шкале газового термометра).
3.6. Энтропия
Перейдем теперь к рассмотрению некоторых важных свойств обратимых циклов.
Термический КПД обратимого цикла Карно определяется соотношением
ηT1 – T2
=—————— ,
тT1
ав наиболее общем виде, по определению, термический КПД любого цикла
ηQ1 – Q2
=——————— .
тQ1
Отсюда следует, что для обратимого цикла Карно
|
T1 |
– T2 |
= |
Q1 |
– Q2 |
, |
|
——- |
T—-1——- |
——-Q——1——— |
|||
|
или, что то же самое, |
|||||
|
Q1 |
Q2 |
. |
|||
|
—— |
= —— |
||||
|
T1 |
T2 |
В общем виде это соотношение может быть записано так:
Q1 Q2
—— + —— = 0.
T1 T2
Следует напомнить, что, как было отмечено в § 3.1 (с. 52), знак минус перед величиной Q2 в соотношениях (3.8) и (3.9) был поставлен лишь «для наглядности». Вместе с тем и без этого понятно, что в соответствии с принятой нами системой знаков (с. 34) по отношению к рабочему телу величина Q2 в прямом цикле всегда отрицательна, поскольку Q2 — теплота, отводимая от рабочего тела (в обратном цикле знаки у Q1 и Q2 меняются местами). С учетом этого обстоятельства очевидно, что уравнение (3.109) записано в наиболее общей форме; при этом знаки у Q1 и Q2 всегда различны.
81

Глава 3 . ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Последнее соотношение можно записать в виде
Рассмотрим произвольный обратимый цикл. Напомним, что для его осуществления необходимо иметь бесконечно большое число источников теплоты. Напомним также, что, как показано в § 3.4, любой обратимый цикл можно представить себе состоящим из множества элементарных циклов Карно (см. рис. 3.9), каждый из которых связан со своим горячим источником, от которого он получает теплоту Q1, и своим холодным источником, которому он отдает
теплоту Q2. С учетом уравнения (3.109) для каждого из этих элементарных циклов (обозначим общее их число n) можно написать:
1-й цикл:
|
Q1(1) |
Q2(1) |
= 0 ; |
|
————- |
+ ————- |
|
|
T 1(1) |
T 2(1) |
|
|
2-й цикл: |
||
|
Q1(2) |
Q2(2) |
= 0 ; |
|
————- |
+ ————- |
|
|
(2) |
(2) |
|
|
T 1 |
T 2 |
. . . . . . . . . . . . . . . . . .
n-й цикл:
Q(1n)
————-
T (1n)
Q(2n)
+ ————- = 0 .
T (2n)
Суммируя эти соотношения, получаем:
n
∑
i = 1
или, по аналогии с (3.110),
Q(1i)
————
T (1i)
|
Q2(i) |
(3.111) |
|
———— = 0 , |
T (2i)
|
n |
Q(i) |
||||
|
∑ |
———— = 0 . |
(3.112) |
|||
|
i = 1 |
T (i) |
||||
|
В пределе, если рассматривать бесконечно малые циклы, |
|||||
|
n |
Q(i) |
dQ |
, |
(3.113) |
|
|
lim ∑ ———— = |
——- |
||||
|
n → ×i = 1 T (i) |
T |
||||
|
отсюда в соответствии с (3.112) получаем: |
|||||
|
dQ |
= 0 . |
(3.114) |
|||
|
——- |
|||||
|
T |
|||||
|
Интеграл уравнения (3.114) носит |
название |
и н т е г р а л а |
К л а у з и у с а . |
Уравнение (3.114) показывает, что для любого обратимого цикла интеграл Клаузиуса равен нулю.
Выясним свойства выражения, стоящего под интегралом. Введем для подынтегральной функции следующее обозначение:
|
dS = |
dQ |
(3.115) |
|
——- . |
||
|
T |
||
|
Тогда уравнение (3.114) примет вид: |
||
|
dS = 0. |
(3.116) |
82

3.6. Энтропия
Вспомним, что аналогичным свойством обладает круговой интеграл от величины dU (где U — внутренняя энергия), подробно рассмотренный в § 2.4, — он также равен нулю. Методом, аналогичным тому, который был использован в
§ 2.4, можно показать, что значение криволинейного интеграла ∫ dS , взятого по
( l )
любому пути между двумя произвольными состояниями А и В (рис. 3.13), не зависит от пути, по которому осуществляется процесс, а зависит только от конечных состояний, между которыми этот процесс осуществляется.
Рассмотрим для этого два цикла, изображенных на рис. 3.14: А-а-В-с-А и А-b-B-c-A. Очевидно, что для цикла А-а-В-с-А интеграл Клаузиуса можно представить в виде суммы двух криволинейных интегралов:
|
dS = ∫ dS + |
∫ dS, |
(3.117) |
|
(AaB) |
(BcA) |
аналогично для цикла А-b-В-с-А
|
dS = ∫ dS + |
∫ dS. |
(3.118) |
|
(AbB) |
(BcA) |
С учетом (3.116) можно записать:
|
∫ |
dS + |
∫ |
dS = 0 ; |
(3.119) |
|
(AaB) |
(BcA) |
|||
|
∫ |
dS + |
∫ |
dS = 0 . |
(3.120) |
|
(AbB) |
(BcA) |
|||
|
Вычитая (3.120) из (3.119), получаем: |
||||
|
∫ |
dS = |
∫ dS . |
||
|
(AaB) |
(AbB) |
Повторяя эти рассуждения для любого другого пути осуществления процесса изменения состояния системы между А и В, получаем, разумеется, тот же результат. Отсюда очевидно, что
|
B |
|||
|
∫ dS = |
∫ dS = … = ∫dS = SB – SA, |
(3.121) |
|
|
(AaB) |
(AbB) |
A |
|
т.е. интеграл ∫ dS зависит только от конечных состояний, между которыми осу-
( l )
ществляется процесс.
Таким образом, подынтегральная функция S, подобно внутренней энергии и энтальпии, является функцией состояния — она однозначно определяется параметрами состояния. Напомним также, что, как отмечено в § 2.4, дифференциал функции состояния является полным дифференциалом.
|
p |
p |
a |
||
|
a |
||||
|
A |
||||
|
c b |
b |
B |
||
|
A |
||||
|
d |
B |
c |
||
|
v |
v |
|||
|
Рис. 3.13 |
Рис. 3.14 |
83

Глава 3 . ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Теплота (так же как и работа) является функцией процесса — количество теплоты, подведенной к системе (или отведенной от нее) в процессе, осуществляемом между двумя произвольными состояниями, зависит от того, по какому пути осуществляется этот процесс. Как и у всякой функции процесса, дифференциал количества теплоты dQ не является полным дифференциалом1). Вместе с тем из сказанного следует, что этот же дифференциал dQ, будучи умноженным на 1/T, превращается в полный дифференциал dS = dQ / T. Таким образом, величина 1/T является интегрирующим множителем для дифференциала количества теплоты (напомним, что в математике интегрирующим множителем называют такую функцию μ, при умножении на которую величина dX, не являющаяся полным дифференциалом, обращается в полный дифференциал dY = μdX. Как известно из математики, в случае двух переменных для любого выражения, не являющегося полным дифференциалом, всегда может быть найден интегрирующий множитель).
Введенная Клаузиусом функция S носит название э н т р о п и и 2).
Энтропия является экстенсивным свойством и подобно другим экстенсивным величинам обладает свойством аддитивности. Величина
называемая удельной энтропией, представляет собой энтропию единицы массы вещества.
Подобно любой другой функции состояния удельная энтропия системы может быть представлена в виде функции любых двух параметров состояния х, у:
где в качестве х и у могут фигурировать р и v, р и Т и т.д.
Методы вычисления энтропии вещества с помощью других термических величин подробно рассмотрены в гл. 4 и 6.
Как видно из определения энтропии [уравнение (3.115)], она имеет размерность единицы теплоты, деленной на единицу температуры. Наиболее употребительная единица измерения энтропии — Дж/К. Единицы измерения удельной энтропии — Дж/(кгæК), кДж/ (кгæК), иногда еще используется ккал/(кгæК) и т.д. Таким образом, размерность энтропии совпадает с размерностью теплоемкости. Начало отсчета энтропии для чистого вещества и для смеси веществ, не вступающих между собой в химическую реакцию, может быть выбрано произвольно, подобно тому как произвольно выбирается начало отсчета внутренней энергии; при рассмотрении различных термодинамических процессов нас будет интересовать и з м е н е н и е э н т р о п и и в этих процессах, т.е. разность энтропии в точках начала и конца процесса, которая, естественно, никак не зависит от выбора начала отсчета энтропии.
Из соотношения (3.115) видно, что энтропия системы в различных обратимых процессах может и возрастать, и убывать: поскольку температура Т всегда положительна, то из (3.115) следует, что при подводе теплоты к системе (dQ > 0) энтропия последней возрастает (dS > 0), a при отводе теплоты (dQ < 0) — убывает (dS < 0).
Из (3.115) следует, что в обратимом процессе изменения состояния тела от начального состояния 1 до конечного состояния 2 энтропия тела изменяется на
|
2 |
||
|
S2 – S1 |
dQ |
|
|
= ∫ ——- . |
(3.124) |
|
|
T |
||
|
1 |
1)Это подробно рассматривается в § 4.1.
2)Термин энтропия (от греческого εντρεπειν — превращение) введен Клаузиусом в 1865 г.
84

3.6. Энтропия

dQ = GcpdT,
то из (3.124) получаем, вынося G и сp за знак интеграла:
|
S2 – S1 = Gcp ln (T2 / T1), |
|||||
|
или |
|||||
|
S2 |
– S1 |
= 10æ4,19 ln |
——————————60 + 273,15 |
= 5,40 |
кДж/К. |
|
20 + 273, 15 |
Таким образом, энтропия этого количества воды в процессе нагревания возросла на 5,40 кДж/К.
Если же рассмотреть обратную задачу, т.е. задачу об изменении энтропии этого количества воды при охлаждении от T1 = 60 °С до T2 = 20 °С, то очевидно, что в результате вычислений получим:
S2 – S1 = –5,40 кДж/К;
на это значение уменьшается [так как T2 < T1 и, следовательно, ln (T2 / T1) < 0] энтропия 10 кг воды в процессе охлаждения.
Следует подчеркнуть, что мы рассматриваем в данном случае изменение энтропии охлаждаемой или нагреваемой воды, не интересуясь пока, как изменяется энтропия того тела, от которого вода получает (или которому отдает) эту теплоту, и как в этой связи изменяется энтропия термодинамической системы, включающей в себя рассматриваемую воду и то тело, с которым она обменивается теплотой.
Следует особо подчеркнуть одно важное обстоятельство. Понятие об энтропии введено на основе рассмотрения обратимых циклов (т.е. циклов, состоящих из обратимых процессов). Отсюда очевидно, что соотношение (3.124) позволяет подсчитать изменение энтропии только для обратимого процесса. Казалось бы, это лишает нас возможности использовать соотношение (3.124) для подсчета изменения энтропии в необратимых процессах — ведь уравнение (3.124) неприменимо для необратимого процесса. Однако положение спасает то обстоятельство, что энтропия является функцией состояния: если в каком-либо процессе система проходит несколько состояний от начального состояния 1 (характеризуемого значением энтропии S1) до конечного состояния 2 (характеризуемого
значением S2), то независимо от того, какой — обратимый или необратимый — процесс осуществляется между этими состояниями, разность энтропий S2 – S1 одна
и та же: она может быть подсчитана по «обратимому» уравнению (3.124)1). Это важное обстоятельство будет неоднократно использоваться нами в дальнейшем.
Т, S-диаграмма. Понятие энтропии позволяет ввести чрезвычайно удобную для анализа циклов тепловых двигателей диаграмму состояний, в которой по оси абсцисс откладывают энтропию, а по оси ординат — абсолютную температуру (рис. 3.15). Изобразим в Т, S-диаграмме кривую произвольного процесса I-II.
Из уравнения (3.115) следует, что в обратимом процессе
1) При том условии, конечно, что между этими состояниями можно хотя бы мысленно осуществить («придумать») обратимый процесс. Именно поэтому в дальнейшем при рассмотрении различных необратимых процессов мы будем подбирать различные обратимые схемы осуществления процессов между теми же состояниями, между которыми осуществляется необратимый процесс. Следует подчеркнуть, что обратимый процесс, переводящий систему из исходного состояния в то же, что и в случае необратимого процесса, конечное состояние, — это, как будет показано в дальнейшем, совершенно иной по сравнению с необратимым процесс, осуществляемый между этими состояниями.
85

Глава 3 . ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Количество теплоты, подведенной к системе (или отведенной от нее) в обратимом процессе, осуществляемом между состояниями I и II, равно:
|
SI I |
|
|
QI-II = ∫ T dS . |
(3.126) |
SI
Очевидно, что в Т, S-диаграмме количество теплоты, полученной (отданной) системой в обратимом процессе, изображается площадью под кривой процесса. На рис. 3.16 в Т, S-диаграмме изображен обратимый цикл теплового двигателя. Количество теплоты Q1, подведенной к рабочему телу в цикле, изображается
площадью под кривой АВС, а количество теплоты Q2, отведенной от рабочего
тела, — площадью под кривой CDА. Работа, произведенная рабочим телом в цикле, Lц = Q1 – Q2 изображается площадью, ограниченной замкнутой кривой
ABCDA.
Т, S-диаграмма удобна тем, что в ней наглядно изображаются и количества теплоты, подводимой и отводимой в цикле, и работа, полученная в результате осуществления цикла (или затраченная, если цикл обратный). В Т, S-диаграмме видно также, на каких участках цикла к рабочему телу подводится теплота и на каких отводится: процессу обратимого подвода теплоты соответствует увеличение энтропии, а процессу отвода теплоты — уменьшение.
Очевидно, что изотермический процесс в Т, S-диаграмме изображается горизонтальной прямой.
Из (3.126) следует, что в изотермическом процессе I-II
QI-II = T (SII – SI).
Из уравнения dS = dQ / T очевидно, что в обратимом адиабатном процессе (dQ = 0)
|
dS = 0; |
(3.127) |
|
S = const. |
(3.128) |
Поэтому обратимые адиабатные процессы называют также изоэнтропными, а кривую этого процесса — изоэнтропой, изображаемой в Т, S-диаграмме вертикальной прямой.
Следует заметить, что в Т, S-диаграмме, как и в любой другой термодинамической диаграмме состояния, могут быть изображены лишь обратимые, равновесные процессы.
Обратимый цикл Карно изображается в Т, S-диаграмме прямоугольником 1-2-3-4-1 (рис. 3.17), ограниченным изотермами 1-2 (T1 = const) и 3-4 (T2 = const)
и обратимыми адиабатами 2-3 (S2 = const) и 4-1 (S1 = const).
Количество теплоты, подводимой в этом цикле к рабочему телу от горячего источника,
|
Q1 = T1(S2 – S1) |
(3.129) |
||||||||
|
T |
T |
B |
T |
||||||
|
1 |
2 |
||||||||
|
T1 |
|||||||||
|
II |
A |
||||||||
|
I |
|||||||||
|
C |
|||||||||
|
QI-II |
D |
T2 |
4 |
3 |
|||||
|
SI |
SII |
S |
a |
b |
S |
S1 |
S2 |
S |
|
|
Рис. 3.15 |
Рис. 3.16 |
Рис. 3.17 |
86

3.6. Энтропия
изображается прямоугольником 1-2-S2-S1-1; количество теплоты, отдаваемой холодному источнику,
— прямоугольником 3-S2— S1-4-3, а работа цикла Lц = Q1 – Q2 — прямоугольни-
ком 1-2-3-4-1.
Из общего выражения для термического КПД цикла
ηQ1 – Q2
=——————-
тQ1
получаем для обратимого цикла Карно с учетом (3.129) и (3.130):
|
о.ц.К |
T1 (S1 |
– S2 ) – T |
2 (S1 |
– S2 ) |
|
ηт |
= ————————————————————— |
T1 (S1 – S2 ) |
, |
|
|
или, что то же самое, |
||||
|
о.ц.К |
T1 – T |
2 |
||
|
ηт |
= —————— , |
|||
|
T1 |
||||
|
т.е. мы получили результат, который, как |
и следовало ожидать, совпадает |
|||
|
с (3.32). |
Использование Т, S-диаграммы позволяет легко доказать справедливость следующего утверждения: термический КПД любого обратимого цикла, осуществляемого при числе источников теплоты больше двух, меньше термического КПД обратимого цикла Карно, осуществляемого между заданными предельными температурами.
Сравним произвольный обратимый цикл I с циклом Карно II, протекающим в крайнем температурном интервале цикла I (рис. 3.18).
Опишем вокруг цикла I цикл Карно 1-2-3-4, назовем его циклом III; тогда
|
η |
II |
= η |
III |
T1 |
– T2 |
Q1 |
– Q2 |
b |
(3.131) |
|
|
т |
т |
= —————— |
= ——————— |
= 1 – —————————————————— ; |
||||||
|
T1 |
Q1 |
a + b + c + d + e + f |
||||||||
|
I |
Q1I – Q2I |
= |
1 |
b + e + f |
(3.132) |
|||||
|
ηт |
= ——————— |
– ——————————- , |
||||||||
|
I |
a + b + e + f |
|||||||||
|
Q1 |
||||||||||
|
отсюда следует, что |
||||||||||
|
ηII |
> ηI . |
(3.133) |
||||||||
|
т |
т |
Таким образом, в заданном температурном интервале обратимый цикл Карно имеет термический КПД более высокий, чем любой другой обратимый цикл. Следовательно, обратимый цикл Карно является своего рода эталоном, по сравнению с которым можно определять степень эффективности того или иного цикла, осуществляемого в том же, что и цикл Карно, интервале температур. В этом и заключается особое значение цикла Карно, выделяющее его среди любых других циклов тепловых двигателей.
Чем в большей мере любой произвольный цикл заполняет прямоугольную область осуществляемого в том же температурном интервале и том же интервале энтропий обратимого цикла Карно (или, как говорят, чем выше коэффициент заполнения цикла), тем выше термический КПД этого произвольного обратимого цикла. Цикл любого теплового двигателя следует стремиться организовать таким образом, чтобы коэффициент заполнения этого цикла был возможно бóльшим.
Далее, нетрудно показать, что термический КПД произвольного обратимого цикла всегда больше, чем КПД такого же необратимого цикла, осуществляе-
87
|
Глава 3 . ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ |
||||||||
|
T |
T |
1 |
2 |
|||||
|
T1 |
||||||||
|
T1 |
1 |
2 |
||||||
|
c |
d |
|||||||
|
I |
II |
|||||||
|
a |
||||||||
|
T |
2 |
e |
f |
T2 |
||||
|
4 |
3 |
4 |
3 |
|||||
|
+ |
– |
|||||||
|
b |
||||||||
|
S |
5 |
6 |
7 |
8 |
S |
|||
|
Рис. 3.18 |
Рис. 3.19 |
мого в том же интервале температур. Ранее (§ 3.4) это положение было доказано для цикла Карно. Доказательство этого положения для произвольного цикла можно провести, разбив последний на бесконечно большое число «микроциклов» Карно (подобно тому, как это сделано на рис. 3.9) и проведя для них аналогичные рассуждения.
Наконец, поскольку термический КПД любого обратимого цикла меньше термического КПД обратимого цикла Карно, осуществляемого между крайними температурами этого цикла, а термический КПД любого необратимого цикла меньше термического КПД такого же обратимого цикла, то, следовательно, термический КПД любого необратимого цикла заведомо меньше термического КПД обратимого цикла Карно, осуществляемого между теми же тепловыми источниками.
Перейдем к анализу еще одной важной разновидности циклов тепловых двигателей. Рассмотрим изображенный в Т, S-диаграмме на рис. 3.19 обратимый цикл, состоящий из двух изотерм и двух произвольных эквидистантных кривых.
Кривые 4-1 и 2-3 эквидистантны, и для осуществления обратимых процессов, соответствующих этим кривым, необходимо иметь бесконечно большое количество источников теплоты.
В процессе 2-3 от рабочего тела отбирается теплота (–), определяемая площадью 2-8-7-3-2 и равная теплоте, подводимой (+) к рабочему телу в процессе 4-1 и определяемой равновеликой площадью 1-6-5-4-1. Источники теплоты можно заменить так называемыми регенераторами, отдающими в процессе 4-1 ту же самую теплоту (и при тех же температурах), которая возвращается к ним от рабочего тела в процессе 2-3. В результате совершения цикла каждый из бесконечно большого числа регенераторов в итоге не отдает и не получает теплоту. Теплота, подводимая к рабочему телу за цикл, Q1 = T2(S3 – S4) изображается пло-
щадью 1-2-8-6-1, отводимая Q2 = T2(S3 – S4) — площадью 3-7-6-5-4-3. Вследствие эквидистантности кривых 4-1 и 3-2
S2 – S1 = S1 – S4.
Отсюда
|
T |
– T |
о.ц.К |
|||
|
η |
1 |
2 |
. |
||
|
т |
= —————— = η |
т |
|||
|
T1 |
|||||
Рассмотренный цикл называют циклом с полной регенерацией теплоты, или р е г е н е р а т и в н ы м ц и к л о м . Степень регенерации, определяемая отношением площади (+) к площади (–), в этом цикле равна единице; при степени регенерации, меньшей единицы, цикл называют циклом с неполной регенерацией. Увеличение степени регенерации приближает цикл к циклу Карно, и в пределе,
как это видно из рассмотренного случая, ηт = ηот.ц.К .
88
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
The entropy can be made into an intensive or specific, variable by dividing by the mass. Engineers use the specific entropy in thermodynamic analysis more than the entropy itself. The specific entropy (s) of a substance is its entropy per unit mass. It equals the total entropy (S) divided by the total mass (m).
s = S/m
where:
s = specific entropy (J/kg)
S = entropy (J)
m = mass (kg)
Entropy quantifies the energy of a substance that is no longer available to perform useful work. Because entropy tells so much about the usefulness of an amount of heat transferred in performing work, the steam tables include values of specific entropy (s = S/m) as part of the information tabulated.
In general, specific entropy is a property of a substance, like pressure, temperature, and volume, but it cannot be measured directly. Normally, the entropy of a substance is given for some reference value. For example, the specific entropy of water or steam is given using the reference that the specific entropy of water is zero at 0.01°C and normal atmospheric pressure, where s = 0.00 kJ/kg. The absolute value of specific entropy is unknown is not a problem, however, because it is the change in specific entropy (∆s) and not the absolute value that is important in practical problems.
Temperature-entropy Diagrams – T-s Diagrams
The phases of a substance and the relationships between its properties are most commonly shown on property diagrams. A large number of different properties have been defined, and there are some dependencies between properties.
A Temperature-entropy diagram (T-s diagram) is the type of diagram most frequently used to analyze energy transfer system cycles. It is used in thermodynamics to visualize changes to temperature and specific entropy during a thermodynamic process or cycle.
The work done by or on the system and the heat added to or removed from the system can be visualized on the T-s diagram. By the definition of entropy, the heat transferred to or from a system equals the area under the T-s curve of the process.
dQ = TdS
An isentropic process is depicted as a vertical line on a T-s diagram, whereas an isothermal process is horizontal. In an idealized state, compression is a pump, compression in a compressor, and expansion in a turbine is isentropic processes. Therefore it is very useful in power engineering, because these devices are used in thermodynamic cycles of power plants.
Note that, the isentropic assumptions are only applicable with ideal cycles. Real thermodynamic cycles have inherent energy losses due to inefficiency of compressors and turbines.
Specific Entropy of Wet Steam
The specific entropy is included in the steam tables for pure substances like steam, similar to a specific volume, specific internal energy, and specific enthalpy.
The specific entropy of saturated liquid water (x=0) and dry steam (x=1) can be picked from steam tables. In case of wet steam, the actual entropy can be calculated with the vapor quality, x, and the specific entropies of saturated liquid water and dry steam:
swet = ss x + (1 – x ) sl
where
swet = entropy of wet steam (J/kg K)
ss = entropy of “dry” steam (J/kg K)
sl = entropy of saturated liquid water (J/kg K)
References:
Nuclear and Reactor Physics:
- J. R. Lamarsh, Introduction to Nuclear Reactor Theory, 2nd ed., Addison-Wesley, Reading, MA (1983).
- J. R. Lamarsh, A. J. Baratta, Introduction to Nuclear Engineering, 3d ed., Prentice-Hall, 2001, ISBN: 0-201-82498-1.
- W. M. Stacey, Nuclear Reactor Physics, John Wiley & Sons, 2001, ISBN: 0- 471-39127-1.
- Glasstone, Sesonske. Nuclear Reactor Engineering: Reactor Systems Engineering, Springer; 4th edition, 1994, ISBN: 978-0412985317
- W.S.C. Williams. Nuclear and Particle Physics. Clarendon Press; 1 edition, 1991, ISBN: 978-0198520467
- G.R.Keepin. Physics of Nuclear Kinetics. Addison-Wesley Pub. Co; 1st edition, 1965
- Robert Reed Burn, Introduction to Nuclear Reactor Operation, 1988.
- U.S. Department of Energy, Nuclear Physics and Reactor Theory. DOE Fundamentals Handbook, Volume 1 and 2. January 1993.
Advanced Reactor Physics:
- K. O. Ott, W. A. Bezella, Introductory Nuclear Reactor Statics, American Nuclear Society, Revised edition (1989), 1989, ISBN: 0-894-48033-2.
- K. O. Ott, R. J. Neuhold, Introductory Nuclear Reactor Dynamics, American Nuclear Society, 1985, ISBN: 0-894-48029-4.
- D. L. Hetrick, Dynamics of Nuclear Reactors, American Nuclear Society, 1993, ISBN: 0-894-48453-2.
- E. E. Lewis, W. F. Miller, Computational Methods of Neutron Transport, American Nuclear Society, 1993, ISBN: 0-894-48452-4.
2-й закон термодинамики. Энтропия. Определение энтропии. Эффективность теплового двигателя. Тепловой цикл Карно. Неубывание энтропии. Вариант для печати.
Второй закон связан с понятием энтропии, являющейся мерой хаоса (или мерой порядка). Второй закон термодинамики гласит, что для вселенной в целом энтропия возрастает.
Существует два классических определения второго закона термодинамики :
- Кельвина и Планка: Не существует циклического процесса, который извлекает количество теплоты из резервуара при определенной температуре и полностью превращает эту теплоту в работу. (Невозможно построить периодически действующую машину, которая не производит ничего другого, кроме поднятия груза и охлаждения резервуара теплоты)
- Клаузиуса: Не существует процесса, единственным результатом которого является передача количества теплоты от менее нагретого тела к более нагретому. (Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара)
Оба определения второго закона термодинамики опираются на первый закон термодинамики, утверждающий, что энергия убывает. Второй закон связан с понятием энтропии (S).
Энтропия порождается всеми процессами, она связана с потерей системы способности совершать работу. Рост энтропии — стихийный процесс. Если объем и энергия системы постоянны, то любое измение в системе увеличивает энтропию. Если же объем или энергия системы меняются, энтропия системы уменьшается. Однако, энтропия вселенной при этом не уменьшается.
Для того, чтобы энергию можно было использовать, в системе должны быть области с высоким и низким уровнями энергии. Полезная работа производится в результате передачи энергии от области с высоким уровнем энергии к области с низким уровнем энергии.
- 100% энергии не может быть преобразовано в работу
- Энтропия может вырабатываться, но не может быть уничтожена
Эффективность теплового двигателя
Эффективность теплового двигателя, действующего между двумя энергетическими уровнями , определена в пересчете на абсолютные температуры
- η = ( Th — Tc ) / Th = 1 — Tc / Th
- где
- η = эффективность
- Th = верхняя граница температуры (K)
- Tc = нижняя граница температуры (K)
Для того, чтобы достичь максимальной эффективности Tc должна быть на столько низкой, на сколько это возможно. Чтобы эффект был 100% -м, Tc должна равнятся 0 по шкале Kельвина. Практически это невозможно, поэтому эффективность всегда меньше 1 (менее 100%).
- Изменение энтропии > 0 Необратимый процесс
- Изменение энтропии= 0 Двусторонний процесс (обратимый)
- Изменение энтропии < 0 Невозможный процесс (неосуществимый)
Энтропия определяет относительную способность одной системы влиять на другую. Когда энергия двигается к нижнему энергетическому уровню, где уменьшается возможность влияния на окружающую среду, энтропия увеличивается.
Определение энтропии
Энтропия в системе постоянного объема определяется как :
- dS = dH / T
- где
- S = энтропия (кДж/кг*К)
- H = энтальпия (кДж/кг) (иногда вместо dH записывают dQ = количество теплоты, сообщенное системе )
- T = абсолютная температура (K — градусы Кельвина)
Изменение энтропии системы вызвано изменением содержания тепла в ней. Изменение энтропии равно изменению тепла системы деленной на среднюю абсолютную температуру ( Ta):
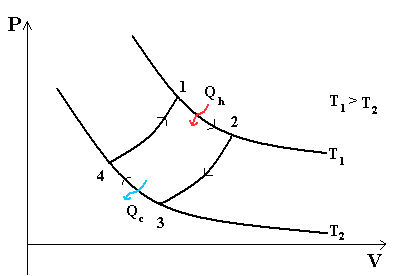
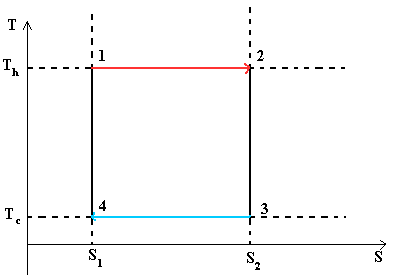
Тепловой цикл Карно. Цикл Карно— идеальный термодинамический цикл.
dS = dH / Ta Сумма значений (dH / T) для каждого полного цикла Карно равна 0. Это происходит из-за того, что каждому положительному H противостоит отрицательное значение H.
В тепловом двигателе, газ (реверсивно) нагревается (reversibly heated), а затем охлаждается. Модель цика следующая: Положение 1 —( изотермическое расширение) —> Положение 2 —( адиабатическое расширение) —> Положение 3 —(изотермическое сжатие) —> Положение 4 —(адиабатическое сжатие) —> Положение 1
- Положение 1 — Положение 2: Изотермическое расширение
- Изотермическое расширение. В начале процесса рабочее тело имеет температуру Th , то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты QH. При этом объём рабочего тела увеличивается. QH=∫Tds=Th (S2-S1) =Th ΔS
- Положение 2 — Положение 3: Адиабатическое расширение
- Адиабатическое (изоэнтропическое) расширение. Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
- Положение 3 — Положение 4: Изотермическое сжатие
- Изотермическое сжатие. Рабочее тело, имеющее к тому времени температуру Tc, приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты Qc. Qc=Tc(S2-S1)=Tc ΔS
- Положение 4 — Положение 1: Адиабатическое сжатие
- Адиабатическое (изоэнтропическое) сжатие. Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
При изотермических процессах температура остаётся постоянной, при адиабатических отсутствует теплообмен, а значит, сохраняется энтропия. Поэтому цикл Карно удобно представить в координатах T и S (температура и энтропия). Законы термодинамики были определены эмперическим путем (эксперементально). Второй закон термодинамики — это обощение экспериментов, связанных с энтропией. Известно, что dS системы плюс dS окружающей среды равно или больше 0 — закон неубывания энтропии. Энтропия адиабатически изолированной системы не меняется!
Пример — Энтропия при нагревании воды
- Процесс нагревания 1 кг воды от при нормальных условиях.C (273 до 373 K)o0 до 100
- C = 0 кДж/кг (удельная — на единицу массы)o при 0 см. удельная энтальпия для воды
- Удельная энтальпия для воды при 100oC = 419 кДж/кг
- Изменение удельной энтропии :
- dS = dH / Ta = ((419 кДж/кг) — (0 кДж/кг)) / ((273 К + 373 К)/2) = 1.297 кДж/кг*К
Пример — Энтропия при испарении воды
- Процесс превращения 1 кг воды при 100oC (373 K) в насыщенный пар при 100oC (373 K) при нормальных условиях.
- Удельная энтальпия пара при 100oC (373 K) до испарения = 0 кДж/кг
- Удельная теплота парообразования 100oC (373 K) при испарении = 2 258 кДж/кг
- Изменение удельной энтропии:
- dS = dH / Ta = (2 258 — 0) / ((373 + 373)/2) = 6.054 кДж/кг*К
Полное изменение удельной энтропии испарения воды — это сумма удельной энтропии воды (при 0oC) плюс удельная энтропия пара (при температуре 100oC).
Сергей Феликсович Савельев
Эксперт по предмету «Концепция современного естествознания»
Задать вопрос автору статьи
Замечание 1
Второе начало термодинамики (называется также вторым законом) устанавливает существование энтропии в формате функции состояния термодинамической системы и вводит при этом понятие абсолютной термотемпературы.
Задачи второго начала термодинамики
Второе начало, таким образом, представляет закон об энтропии, а также ее главных свойствах. Энтропия в изолированной системе или сохраняет свою неизменность или растет. Максимум достигается, когда устанавливается термодинамическое равновесие.
Разные формулировки второго начала термодинамики, встречающиеся в разных научных источниках, представляют частные следствия закона возрастания энтропии. Второй закон термодинамики способствует построению рациональной температурной шкалы, не зависимой от случайности в выборе термометрического свойства и его способа измерения.
В совокупности первое и второе начала представляют основу феноменологической термодинамики, которая может рассматриваться в качестве развитой системы следствий этих двух начал. Второе начало позволяет:
- выделить фактически возможные процессы, не противоречащие законам термодинамики;
- определить направление протекания самопроизвольных процессов;
- найти предельное (наименьшее или самое большое) значение энергии, которое можно использовать в термодинамическом процессе (с учетом ограничений, накладываемых термодинамическими законами);
- сформулировать критерии равновесия в термосистемах.
Открытие и становление второго начала термодинамики
Замечание 2
Возникновение второго начала термодинамики произошло в формате рабочей теории тепловых двигателей. Эта теория определила условия, согласно которым, превращение тепла в работу достигнет максимального эффекта.
Впервые теоретические исследования работы тепловых двигателей провел французский инженер С. Карно. Они показали, что малая величина этого эффекта (КПД) может быть обусловлена не техническим несовершенством теплового двигателя, а свойством теплоты как способа энергопередачи, накладывающей определенные ограничения на его величину.
«Второе начало термодинамики, энтропия и ее статистический смысл» 👇
Карно пришел к выводу о независимости КПД тепловых машин от природы рабочего тела и термодинамического цикла. Согласно теореме Карно, КПД тепловых машин может определяться в зависимости от температур таких внешних источников, как холодильник и нагреватель.
Работа Карно написана до того, как был открыт принцип эквивалентности теплоты и работы и был признан закон сохранения энергии. Свои выводы ученый основывал на двух противоречащих друг другу основаниях: теплородной теории и гидравлической аналогии. Позднее Р. Клаузиус и В. Томсон согласовали теорему Карно с законом сохранения энергии, заложив в основу того, что сейчас составляет второе начало классической (равновесной) термодинамики.
Второе начало термодинамики (как и первое) является обобщением общечеловеческого опыта. Опыт показывает неравноценность работы и теплоты, представляющими по определению определенные формы передачи энергии.
Если работа непосредственно может переходить в теплоту (например, при трении) и при этом будет изменяться состояние одного тела, то количество теплоты подобным свойством не обладает. Подвод тепла провоцирует только увеличение внутренней энергии системы (повышение ее параметров: давление, объем, температура).
Термодинамическая работа, которая произведена, благодаря переданному количеству теплоты может быть получена только путем изменения вышеуказанных параметров (например, работа расширения рабочих тел).
При этом, помимо охлаждения самого источника тепла, при незамкнутом процессе начинает изменяться термодинамическое состояние одного (рабочего) тела, а при замкнутом процессе — нескольких тел, которым это тело должно передавать часть полученного тепла.
Получателем теплоты в тепловом двигателе выступает холодильник. Компенсация представляет процесс отдачи другим телам части тепла. Согласно опытам, становится невозможным превращение теплоты в работу без компенсации.
Пример 1
В качестве примера можно рассмотреть работу в тепловых двигателях, которая производится посредством расширения рабочего тела. Чтобы работа машины стала непрерывной, рабочее тело требуется вернуть в исходное состояние. С этой целью его потребуется сжать, затратив при этом работу.
Если сжатие произведем при такой же температуре, что и расширение, будет затрачена вся работа, а эффективность двигателя будет нулевой. Чтобы работа сжатия оказалась меньше, чем работа расширения, требуется производить сжатие при температуре, более низкой.
С целью понижения температуры рабочего тела, часть теплоты нужно передать третьему телу – холодильнику. КПД теплового двигателя (по определению) характеризуется отношением количества теплоты, превращенной за один цикл в положительную работу, ко всему количеству теплоты, подведенному к рабочему телу. Это выражает формула:
Рисунок 1. Формула. Автор24 — интернет-биржа студенческих работ
Энтропия и ее статистический смысл
Среди величин, которые могут определять состояние термодинамической системы, энтропии отводится особая роль. Так, она отличается своей абстрактностью, ее физический смысл не вытекает непосредственно из математического выражения и не поддается при этом обычному интуитивному восприятию.
По этой причине неоднократно предпринимались попытки прояснить смысл энтропии. Одна из попыток заключалась в поиске аналогий энтропии с понятиями, более доступными для восприятия.
Если элементарная работа, например, представляет произведение силы и перемещения, то ее аналогом послужит количество теплоты. При этом аналог силы представляет собой абсолютную температуру, а перемещения – энтропию.
Аналогии такого рода носят исключительно искусственный характер, поэтому для интерпретации энтропии польза от них сомнительная. Также несостоятельной стала попытка ученых провести аналогию энтропии с теплоемкостью. Если сравнить выражение для удельной энтропии тела:
Рисунок 2. Формула удельной энтропии тела . Автор24 — интернет-биржа студенческих работ
с выражением удельной теплоемкости:
Рисунок 3. Формула удельной теплоемкости. Автор24 — интернет-биржа студенческих работ
Аналог этих выражений состоит в задействовании одинаковых величин и в равной размерности теплоемкости и энтропии.
В рамках статистической физики энтропия термодинамической системы рассматривается в виде функции вероятности ее состояния («принцип Больцмана»):
Рисунок 4. Принцип Больцмана. Автор24 — интернет-биржа студенческих работ
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме