Удельная газовая
постоянная однородного газа, заменяющего
смесь, называется газовой постоянной
смеси Rсм,
Дж / (кг·К):

или окончательно
.
Через мольные доли
газовая постоянная смеси вычисляется
следующим образом:
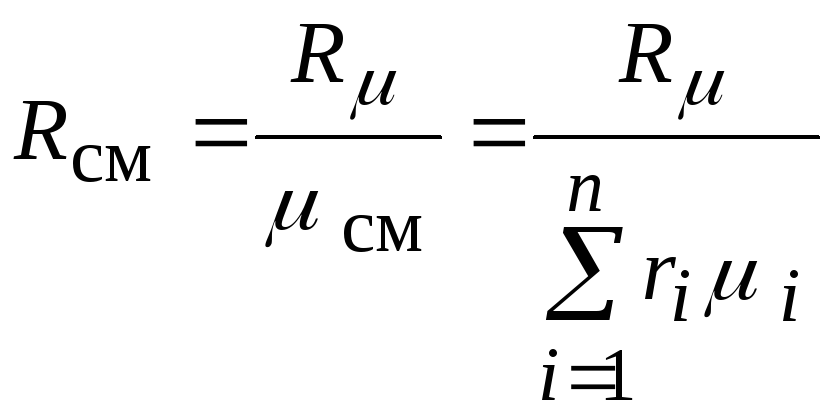
или окончательно

С использованием
можно получить формулу для вычисления
парциального давления идеального газа
через его массовую долю.
Т. к. и
,
то разделив эти
выражения друг на друга получим:
,
откуда
Из последнего
выражения можно получить удобную
формулу, связывающую мольные и массовые
доли идеального газа.
Т. к. ,
то
1.4.8. Плотность смеси газов
Плотность однородного
газа, заменяющего
смесь, называется плотностью смеси:
В справочниках
обычно приводится без объяснений
следующая формула для плотности смеси:
В то же время в
технической литературе встречаются
формулы вида
С вычислением
плотности смеси через плотности
компонентов связано наибольшее число
студенческих ошибок. Дело в том, что
значение плотности
-го
компонента можноформальнополучить из двух формул:
и
Т.
к.
,
то значенияи
заметно отличаются друг от друга.
Проясним вопрос
с вычислением плотности смеси.
По определению
и
,
тогда.
Но
и
Т.
о. в последней формуле плотность i-го
газавычисляется как плотность этого газа,
находящегося в количествекилограммовв объеме
(парциальном объеме) при давлении
смеси
и температуре смеси .
Такое толкование
плотности компонентов смеси используется,
в частности, при расчетеобъемов
продуктов сгорания топлива.
Если плотность
i-го газа в смеси
вычислять через его парциальное давление
,
то
Т.
о. в этой формуле плотность i-го
газа— это плотность газа массой
,
находящегося вобъеме (объем
смеси) при его парциальном давлении и температуре
(температуре смеси).
Такое толкование
плотности компонентов смеси, в частности,
используется при определении абсолютной
и относительной влажности воздуха.
1.4.9. Энтропия смеси идеальных газов
Как указано в
параграфе 1.4.1., энтропия 1 кг
—
компонентной смеси идеальных газов
(удельная энтропия смеси)Sсм
, Дж / (К · кг), определяется по
следующей формуле:
,
где: —
энтропия 1 кгi-го газа.
Из
курса общей термодинамики известно:
,
где: —
массовая изобарная теплоемкостьi-го
газа.
Окончательно
удельная энтропия
-компонентной
смеси может быть вычислена по следующей
формуле:
1.4.10. Теплоемкость газовой смеси
По определению,
теплоемкость — это количество теплоты,
которое необходимо для изменения
температуры единицы количества вещества
(
)
на один градус.
Т. к. температура
всех газов в смеси одинакова, то
теплоемкость смеси, складывается из
теплоемкостей всех компонентов, взятых
в долях, соответствующих способу задания
смеси:
— массовая (удельная)
теплоемкость, Дж / (кг·К);
— мольная теплоемкость,
Дж / (кмоль·К);
— объемная
теплоемкость, Дж / (м3·К).
где: — массовая, мольная и объемная теплоемкостиi-го компонента.
Уравнение состояния идеального газа
Уравнение состояния идеальногогаза устанавливает зависимость между основными термодинамическими параметрами (давление р, температура Т, удельный объем 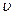
Идеальным газомназывается газ, в котором отсутствуют силы межмолекулярного взаимодействия, а объем молекул пренебрежимо мал. Важно, что при малом давлении (близком к атмосферному давлению) реальные газы с небольшой погрешностью можно считать идеальными газами.
Уравнение состояния идеального газа в 1834 г. установил французский физик Клапейрон.
Для 1 кг вещества уравнение Клапейрона имеет вид:
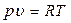
где R – удельная газовая постоянная, 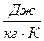
Удельная газовая постоянная R зависит от природы вещества и для разных газов она различна.
Для массы вещества М уравнение Клапейрона имеет вид:
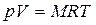
где V – объем вещества, м 3 , V = 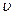
M – масса вещества, кг.
В 1874 г. русский ученный Менделеев применил уравнение Клапейрона к 1 киломолю вещества и получил универсальное уравнение состояния идеального газа, которое называется уравнением Менделеева-Клапейрона:
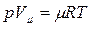
где 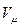
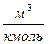
μR – универсальная газовая постоянная, 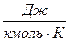
Универсальная газовая постоянная μR (в некоторых учебниках она обозначается Rμ) не зависит от природы вещества и для всех газов одинакова:
μR = 8314 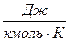
Существует однозначная взаимосвязь между универсальной газовой постоянной μR и удельной газовой постоянной вещества R, 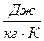
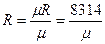
где 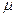
В технике широко применяется приведение газа или пара к определенным условиям. Для получения этих соотношений используем уравнение Клапейрона в виде
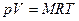
Разделим переменные и постоянные величины:
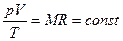
Следовательно, для любых состояний газа (при М=const) будет выполняться равенство соотношений:
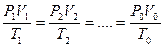
Пример. Определить во сколько раз измениться объем газа при нагреве от 20°C до 900°C, если давление и масса газа останутся неизменными.
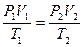
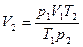
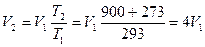
Ответ: объем газа при нагреве от 20°C до 900°C увеличится в 4 раза.
Уравнение состояния идеального газа — основные понятия, формулы и определение с примерами
Содержание:
Уравнение состояния идеального газа:
Уравнения Клапейрона и Менделеева — клапейрона; законы Шарля, Гей-Люссака, Бойля — Мариотта, Авогадро, Дальтона, — пожалуй, такого количества «именных» законов нет ни в одном разделе физики. за каждым из них — кропотливая работа в лабораториях, тщательные измерения, длительные аналитические размышления и точные расчеты. нам намного проще. Мы уже знаем основные положения теории, и «открыть» все вышеупомянутые законы нам не составит труда.
Уравнение состояния идеального газа
Давление газа полностью определяется его температурой и концентрацией молекул: p=nkT. Запишем данное уравнение в виде: pV = NkT. Если состав и масса газа известны, число молекул газа можно найти из соотношения
Произведение числа Авогадро 


Обратите внимание! Состояние данного газа некоторой массы однозначно определяется двумя его макроскопическими параметрами; третий параметр можно найти из уравнения Менделеева — Клапейрона.
Уравнение Клапейрона
С помощью уравнения Менделеева — Клапейрона можно установить связь между макроскопическими параметрами газа при его переходе из одного состояния в другое. Пусть газ, имеющий массу m и молярную массу М, переходит из состояния (

Для каждого состояния запишем уравнение Менделеева — Клапейрона: 



Для данного газа некоторой массы отношение произведения давления на объем к температуре газа является неизменным.
Изопроцессы
Процесс, при котором один из макроскопических параметров данного газа некоторой массы остается неизменным, называют изопроцессом. Поскольку состояние газа характеризуется тремя макроскопическими параметрами, возможных изопроцессов тоже три: происходящий при неизменной температуре; происходящий при неизменном давлении; происходящий при неизменном объеме. Рассмотрим их.
Какой процесс называют изотермическим. Закон Бойля — Мариотта
Пузырек воздуха, поднимаясь со дна глубокого водоема, может увеличиться в объеме в несколько раз, при этом давление внутри пузырька падает, поскольку вследствие дополнительного гидростатического давления воды (
Рис. 30.2. Изотермическое сжатие газа. Если медленно опускать поршень, температура газа под поршнем будет оставаться неизменной и равной температуре окружающей среды. Давление газа при этом будет увеличиваться
Изотермический процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменной температуре.
Пусть некий газ переходит из состояния (



Закон Бойля — Мариотта:
Для данного газа некоторой массы произведение давления газа на его объем остается постоянным, если температура газа не изменяется:
Графики изотермических процессов называют изотермами. Как следует из закона Бойля — Мариотта, при неизменной температуре давление газа данной массы обратно пропорционально его объему: 
Какой процесс называют изобарным. Закон Гей-Люссака
Изобарный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном давлении.
Пусть некий газ переходит из состояния (


Рис. 30.4. Изобарное расширение газа. Если газ находится под тяжелым поршнем массой M и площадью S, который может перемещаться практически без трения, то при увеличении температуры объем газа будет увеличиваться, а давление газа будет оставаться неизменным и равным p
Закон Гей-Люссака
Для данного газа некоторой массы отношение объема газа к температуре остается постоянным, если давление газа не изменяется:
Графики изобарных процессов называют изобарами. Как следует из закона Гей-Люссака, при неизменном давлении объем газа данной массы прямо пропорционален его температуре: V = const⋅T. График данной зависимости — прямая, проходящая через начало координат (рис. 30.5, а). По графику видно, что с приближением к абсолютному нулю объем идеального газа должен уменьшиться до нуля. Понятно, что это невозможно, поскольку реальные газы при низких температурах превращаются в жидкости. В координатах p, V и p, T изобары перпендикулярны оси давления (рис. 30.5, б, в).
Изохорный процесс. Закон Шарля
Если газовый баллон сильно нагреется на солнце, давление в нем повысится настолько, что баллон может взорваться. В данном случае имеем дело с изохорным нагреванием.
Изохорный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном объеме.
Пусть некий газ переходит из состояния (


Рис. 30.6. Изохорное нагревание газа. Если газ находится в цилиндре под закрепленным поршнем, то с увеличением температуры давление газа тоже будет увеличиваться. Опыт показывает, что в любой момент времени отношение давления газа к его температуре неизменно:
Закон Шарля
Для данного газа некоторой массы отношение давления газа к его температуре остается постоянным, если объем газа не изменяется:
Графики изохорных процессов называют изохорами. Из закона Шарля следует, что при неизменном объеме давление газа данной массы прямо пропорционально его температуре: p T = ⋅ const . График этой зависимости — прямая, проходящая через начало координат (рис. 30.7, а). В координатах p, V и V, T изохоры перпендикулярны оси объема (рис. 30.7, б, в).
Пример №1
В вертикальной цилиндрической емкости под легкоподвижным поршнем находится 2 моль гелия и 1 моль молекулярного водорода. Температуру смеси увеличили в 2 раза, и весь водород распался на атомы. Во сколько раз увеличился объем смеси газов?
Анализ физической проблемы. Смесь газов находится под легкоподвижным поршнем, поэтому давление смеси не изменяется:
Решение:
Воспользуемся уравнением состояния идеального газа: pV = νRT. Запишем это уравнение для состояний смеси газов до и после распада: 



Ответ: примерно в 2,7 раза.
Пример №2
На рис. 1 представлен график изменения состояния идеального газа неизменной массы в координатах V, T. Представьте график данного процесса в координатах p, V и p, T.
Решение:
1. Выясним, какой изопроцесс соответствует каждому участку графика (рис. 1).
Зная законы, которым подчиняются эти изопроцессы, определим, как изменяются макроскопические параметры газа. Участок 1–2: изотермическое расширение; T = const, V ↑, следовательно, по закону Бойля — Мариотта p ↓. Участок 2–3: изохорное нагревание; V = const, T ↑, следовательно, по закону Шарля p ↑ . Участок 3–1: изобарное охлаждение; p = const , T ↓, следовательно, по закону Гей-Люссака V ↓ .
2. Учитывая, что точки 1 и 2 лежат на одной изотерме, точки 1 и 3 — на одной изобаре, а точки 2 и 3 на одной изохоре, и используя результаты анализа, построим график процесса в координатах p, V и p, T (рис. 2)
- Из соотношения p=nkT можно получить ряд важных законов, большинство из которых установлены экспериментально.
- Уравнение состояния идеального газа (уравнение Менделеева — Клапейрона): — универсальная газовая постоянная.
- Уравнение Клапейрона:
- Законы, которым подчиняются изопроцессы, то есть процессы, при которых один из макроскопических параметров данного газа некоторой массы остается неизменным:
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Температура в физике
- Парообразование и конденсация
- Тепловое равновесие в физике
- Изопроцессы в физике
- Абсолютно упругие и неупругие столкновения тел
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
- Уравнение МКТ идеального газа
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Telegram и логотип telegram являются товарными знаками корпорации Telegram FZ-LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Основы теплотехники
Основные законы теплотехники
Идеальные и реальные газы
Превращение теплоты в механическую работу в тепловых установках происходит при участии рабочего тела, которым обычно является газ или пар. Газы, которые существуют в природе, называют реальными . Молекулы этих газов имеют конечный объем, между ними существуют силы притяжения, существенно влияющие на их энергетические параметры.
Молекулы реального газа находятся в непрерывном хаотическом движении, т. е. обладают кинетической энергией движения. А поскольку между молекулами существует гравитационная, а зачастую и электромагнитная силовая связь, то они обладают и потенциальной энергией взаимодействия, которая зависит от расстояния между молекулами.
Для простоты изучения свойств газообразного рабочего тела введено понятие идеального газа – воображаемого газа, в котором молекулы рассматриваются, как материальные точки, обладающие некоторой массой, но силы взаимодействия между этими точками при анализе состояния рабочего тела и происходящих в нем процессов не учитываются.
При больших объемах и малых давлениях, когда расстояние между молекулами во много раз больше собственных размеров молекул, а также при высоких температурах, когда интенсивность хаотического движения молекул велика, и поэтому они слабо взаимодействуют между собой, складываются условия, при которых реальный газ можно с некоторым приближением считать идеальным.
Это позволяет вести расчеты для реальных газов по уравнениям и зависимостям, выведенным для идеальных газов, что упрощает сами расчеты и понимание сущности процессов, происходящих в газах. В связи с этим изучение термодинамических свойств идеальных газов имеет не только теоретическое, но и большое практическое значение.
Газовые законы термодинамики
Основными законами для идеальных газов, применяемыми в термодинамике, являются закон Бойля — Мариотта, закон Гей-Люссака, закон Шарля и закон Авогадро. Эти законы устанавливают зависимости между основными параметрами газов – давлением, объемом, температурой и молекулярной массой.
Впоследствии газовые законы, описывающие процессы в термодинамических системах с одним неизменным и двумя переменными параметрами газа, были объединены учеными Клайпероном и Менделеевым в уравнениях, описывающей процессы системы при всех переменных параметрах рабочего тела.
Закон Бойля — Мариотта
Закон Бойля — Мариотта утверждает, что произведение абсолютного давления газа на его удельный объем в изотермическом процессе (при постоянной температуре) есть величина постоянная:
Чтобы понять смысловую суть этого закона следует представить термодинамическую систему, состоящую из цилиндра с подвижным поршнем, заполненного в надпоршневом пространстве газом (рис. 1) . Система термоизолирована — тепло к ней не подводится и не отводится.
Тогда при очень медленном перемещении поршня влево или вправо будет уменьшаться или увеличиваться объем газа в цилиндре, при этом изменение объема приведет к обратно пропорциональному изменению давления. Т. е. при уменьшении объема в два раза, давление возрастет в два раза и т. п.
Очень медленное перемещение поршня в этом случае необходимо для того, чтобы не вызывать изменение температуры газа в процессе сжатия или расширения.
Закон справедлив для термодинамических систем с идеальным рабочим телом, в которых неизменным параметром является температура, а переменными — давление и объем. Подобные процессы (протекающие при постоянной температуре) называют изотермическими — абсолютная температура рабочего тела в системе постоянна.
Это не означает, что исключен подвод (или отвод) тепла к термодинамической системе в целом, однако тепловая энергия в этом случае не должна оказывать влияние на температуру газа (рабочего тела), а использоваться, например, для выполнения работы путем преобразования в другой вид энергии. Процессы, при которых полностью исключается подвод и отвод тепла к термодинамической системе носят название адиабатных процессов .
Закон Бойля — Мариотта — один из основных газовых законов, открытый в 1662 году английским ученым Робертом Бойлем. В 1676 году, независимо от выводов Р. Бойля, закон был вторично описан французским физиком Эдмом Мариоттом, поэтому носит двойное название по фамилиям авторов.
Закономерность, установленная Р. Бойлем и Э. Мариоттом, справедлива для идеальных газов, но может быть с высокой степенью точности применима и для разреженных газов. Для сжатых газов применение закона Бойля — Мариотта приводит к большим погрешностям.
Следует отметить, что применение закона Бойля — Мариотта, связывающего начальные и конечные величины давления и объёма газа друг с другом, не ограничивается изотермическими процессами. Он с достаточной степенью точности справедлив и в тех случаях, когда в ходе термодинамического процесса температура изменяется, но начальная и конечная температура газа в результате процесса оказываются равными.
Закон Гей-Люссака
Закон Гей-Люссака гласит, что при постоянном давлении (изобарный процесс) удельный объем газообразного вещества (объем постоянной массы газа) изменяется прямо пропорционально изменению абсолютных температур:
Для простоты рассмотрим, опять же, термодинамическую систему, состоящую из цилиндра с абсолютно подвижным (трение между стенками цилиндра и поршнем отсутствует) и невесомым поршнем. Над поршнем в цилиндре поместим газ.
Очевидно, что при нагреве газа поршень переместится в сторону увеличения объема газа. При этом изменение объема газа будет прямо пропорционально изменению его абсолютной температуры, поскольку мы исключили изменение давления за счет отсутствия сил трения и тяжести, действующих на поршень.
Закон носит имя одного из своих первооткрывателей — французского физика и химика Жозефа Луи Гей-Люссака, описавшего его в 1802 году. В разных источниках (особенно, зарубежных) этот закон нередко упоминается под названием закон Шарля, по имени француза Жака Шарля, который описал его в неопубликованной работе, датируемой 1787 годом.
Авторство приписывают, также, таким видным ученым конца XVII — начала XVIII века, как английский физик Джон Дальтон и французский ученый Гийом Амонтон.
В русскоязычных учебниках этот закон обычно называют по имени Гей-Люссака, который первым продемонстрировал его применимость ко всем газам, а также к парам летучих жидкостей при температуре выше точки кипения.
Закономерность, описанная Ж. Л. Гей-Люссаком, справедлива в системах с одним неизменным параметром — давлением, и переменными параметрами — температура — удельный объем. Такие термодинамические процессы (протекающие при постоянном давлении) называют изобарными (иногда — изобарическими) .
Закон Шарля
Закон Шарля, который иногда называют вторым законом Гей-Люссака, заключается в том, что при неизменном удельном объеме абсолютные давления газа изменяются прямо пропорционально изменению абсолютных температур:
Смысловое содержание закона Шарля проще понять, представив герметичный абсолютно жесткий сосуд, заполненный газом. Тогда при нагреве газа его давление будет увеличиваться прямо пропорционально увеличению абсолютной температуры, т. е. при увеличении абсолютной температуры в три раза, давление газа тоже возрастет в три раза и т. п.
Экспериментальным путем зависимость давления газа от температуры при постоянном объёме установлена в 1787 году Жаком Шарлем, который исследовал термодинамические процессы имеющие место в идеальных газах.
Труды Шарля опубликованы не были, но его идеи были подхвачены видными физиками — Гей-Люссаком, Гильомом Амонтоном и другими, поэтому вопросы авторства некоторых основных законов термодинамики являются предметом спора между специалистами до сих пор.
Закономерность, открытая и описанная Ж. Шарлем, справедлива в системах с неизменным параметром — удельным объемом, и переменными параметрами — температура — давление. Такие термодинамические процессы (протекающие при постоянном объеме) называют изохорными (иногда — изохорическими) .
Закон Авогадро
Закон Авогадро утверждает, что все газы при одинаковом давлении и температуре содержат в равных объемах одинаковое число молекул. Из этого закона следует, что массы двух равных объемов различных газов с молекулярными массами μ1 и μ2 равны соответственно:
где: m1 и m2 – соответственно масса одной молекулы рассматриваемых газов; N – число молекул во взятом объеме.
Массы молекул пропорциональны молекулярным массам:
где z – коэффициент пропорциональности.
Тогда можно записать:
откуда получим пропорциональную зависимость:
Поскольку мы взяли равные объемы газов, то, разделив числитель и знаменатель левой части уравнения на объем, получим:
где: ρ1 и ρ2 – плотность рассматриваемых газов.
Так как удельный объем v является величиной, обратной плотности, т. е. v = 1/ρ , то можно записать полученную зависимость в следующем виде:
т. е. произведение удельного объема на молекулярную массу постоянно для любого газа при одинаковых условиях (давлении и температуре) .
Закон Авогадро можно сформулировать и так: объем киломоля различных газов при аналогичных физических условиях одинаков.
Этот закон был описан в 1811 году итальянским физиком Амедео Авогадро.
Закон Дальтона
Рабочее тело, используемое в термодинамических установках, обычно представляет собой смесь нескольких газов. Например, в двигателях внутреннего сгорания в состав продуктов сгорания, являющихся рабочим телом, входят водород, кислород, азот, окись углерода, углекислый газ, водяные пары воды и некоторые другие газообразные вещества.
В 1801 году английский физик Джон Дальтон установил закон, согласно которому давление, оказываемое смесью равно сумме парциальных давлений отдельных газов, входящих в состав смеси.
Парциальным давлением называют давление компонента смеси, которое он создавал бы, находясь один в занимаемой смесью объеме при температуре смеси.
Это утверждение легко доказать основываясь на выводах из закона Бойля — Маритта, рассматривая парциальные компоненты газовой по отдельности и в смеси.
Закон Дальтона применим для идеальных газов, и может быть использован для реальных газов, имеющих близкие к идеальным физические свойства и параметры.
Уравнение состояния газа
Газовые законы, описанные в начале статьи, справедливы для систем, в которых хотя бы один параметр рабочего тела в процессе остается неизменным. Такие процессы, в зависимости от того, какой из параметр постоянен, называют изотермическими, изобарными или изохорными.
На практике обычно приходится наблюдать термодинамические процессы, во время которых изменяются все основные параметры рабочего тела — политропные процессы .
Для описания политропных процессов учеными Клайпероном и Менделеевым были предложены уравнения состояния газа, полученные, на основе анализа рассмотренных ранее газовых законов Бойля-Мариотта, Гей-Люссака, Шарля и Авогадро.
Предположим, что 1 кг газа переходит из состояния, характеризующегося параметрами p1 , v1 , T1 в другое состояние – с параметрами p2 , v2 , T2 . Допустим, что этот переход происходит сначала при постоянной температуре Т1 до промежуточного удельного объема v’ , а затем при постоянном давлении р2 до конечного удельного объема v2 .
Тогда по закону Бойля — Мариотта имеем:
Следующая часть процесса протекает при постоянном давлении, начинается параметрами газа p2 , v’ , T1 и заканчивается параметрами газа v2 , T2 и p2 (последний параметр остался неизменным после первого перехода) . Тогда, в соответствии с законом Гей-Люссака, можно получить выражение при p = const:
Приравняв найденное выражение для v’ в первой и второй частях (переходах) процесса, получим:
Преобразовав это равенство, имеем:
На основании полученного в результате уравнения, можно сделать вывод, что отношение произведения абсолютного давления газа на его удельный объем к абсолютной температуре есть величина постоянная. Для 1 кг газа эту величину называют удельной газовой постоянной и обозначают R :
pv/T = R или pv = RT .
Полученное уравнение называют уравнением состояния идеального газа или уравнением Клайперона.
Впервые это уравнение предложил французский физик и инженер Бенуа Поль Эмиль Клайперон, который долгое время жил и работал в России. Исследуя известный термодинамический цикл Карно, Клайперон в 1834 году вывел уравнение состояния идеального газа, которое носит его имя.
Так как R – величина постоянная для каждого газа, можно определить любой основной параметр газа, если известны два других его параметра.
Удельные газовые постоянные для большинства известных газов приведены в соответствующих справочных таблицах. Так, например, удельная газовая постоянная кислорода равна 259,8 Дж/(кг×К), углекислого газа — 188,9 Дж/(кг×К) и т. п.
Уравнение Менделеева — Клайперона
Если обе части уравнения состояния идеального газа (уравнения Клайперона) умножить на массу газа М , получим следующее выражение:
или, учитывая, что произведение массы на удельный объем это полный объем газа: Mv = V , получим:
Заменив в полученном уравнении объем газа его молекулярным объемом Vμ , а массу газа – молекулярной массой μ , получим уравнение состояния для 1 киломоля газа:
Уравнение состояния идеального газа в таком виде предложил в 1874 году Д. И. Менделеев, и, поскольку оно является частным случаем уравнения Клайперона, то носит название уравнения Менделеева — Клайперона для идеального газа (иногда его называют уравнением Клайперона — Менделеева) .
Из уравнения Менделеева — Клайперона можно определить универсальную газовую постоянную:
При нормальных физических условиях величина универсальной газовой постоянной равна
Используя универсальную газовую постоянную, легко определить величину удельной газовой постоянной для любого газа по формуле:
Скачать теоретические вопросы к экзаменационным билетам
по учебной дисциплине «Основы гидравлики и теплотехники»
(в формате Word, размер файла 68 кБ)
Скачать рабочую программу
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
Скачать календарно-тематический план
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
http://www.evkova.org/uravnenie-sostoyaniya-idealnogo-gaza
http://k-a-t.ru/teplotexnika/2_gaz_zakony/
From Wikipedia, the free encyclopedia
| Value of R[1] | Unit |
|---|---|
| SI units | |
| 8.31446261815324 | J⋅K−1⋅mol−1 |
| 8.31446261815324 | m3⋅Pa⋅K−1⋅mol−1 |
| 8.31446261815324 | kg⋅m2⋅s−2⋅K−1⋅mol−1 |
| Other common units | |
| 8314.46261815324 | L⋅Pa⋅K−1⋅mol−1 |
| 8.31446261815324 | L⋅kPa⋅K−1⋅mol−1 |
| 0.0831446261815324 | L⋅bar⋅K−1⋅mol−1 |
| 8.31446261815324×107 | erg⋅K−1⋅mol−1 |
| 0.730240507295273 | atm⋅ft3⋅lbmol−1⋅°R−1 |
| 10.731577089016 | psi⋅ft3⋅lbmol−1⋅°R−1 |
| 1.985875279009 | BTU⋅lbmol−1⋅°R−1 |
| 297.031214 | inH2O⋅ft3⋅lbmol−1⋅°R−1 |
| 554.984319180 | torr⋅ft3⋅lbmol−1⋅°R−1 |
| 0.082057366080960 | L⋅atm⋅K−1⋅mol−1 |
| 62.363598221529 | L⋅Torr⋅K−1⋅mol−1 |
| 1.98720425864083… | cal⋅K−1⋅mol−1 |
| 8.20573660809596…×10−5 | m3⋅atm⋅K−1⋅mol−1 |
The molar gas constant (also known as the gas constant, universal gas constant, or ideal gas constant) is denoted by the symbol R or R. It is the molar equivalent to the Boltzmann constant, expressed in units of energy per temperature increment per amount of substance, i.e. the pressure–volume product, rather than energy per temperature increment per particle. The constant is also a combination of the constants from Boyle’s law, Charles’s law, Avogadro’s law, and Gay-Lussac’s law. It is a physical constant that is featured in many fundamental equations in the physical sciences, such as the ideal gas law, the Arrhenius equation, and the Nernst equation.
The gas constant is the constant of proportionality that relates the energy scale in physics to the temperature scale and the scale used for amount of substance. Thus, the value of the gas constant ultimately derives from historical decisions and accidents in the setting of units of energy, temperature and amount of substance. The Boltzmann constant and the Avogadro constant were similarly determined, which separately relate energy to temperature and particle count to amount of substance.
The gas constant R is defined as the Avogadro constant NA multiplied by the Boltzmann constant k (or kB):
Since the 2019 redefinition of SI base units, both NA and k are defined with exact numerical values when expressed in SI units.[2] As a consequence, the SI value of the molar gas constant is exactly 8.31446261815324 J⋅K−1⋅mol−1.
Some have suggested that it might be appropriate to name the symbol R the Regnault constant in honour of the French chemist Henri Victor Regnault, whose accurate experimental data were used to calculate the early value of the constant. However, the origin of the letter R to represent the constant is elusive. The universal gas constant was apparently introduced independently by Clausius’ student, A.F. Horstmann (1873)[3][4]
and Dmitri Mendeleev who reported it first on Sep. 12, 1874.[5]
Using his extensive measurements of the properties of gases,[6][7]
Mendeleev also calculated it with high precision, within 0.3% of its modern value.[8]
The gas constant occurs in the ideal gas law:
where P is the absolute pressure, V is the volume of gas, n is the amount of substance, m is the mass, and T is the thermodynamic temperature. Rspecific is the mass-specific gas constant. The gas constant is expressed in the same unit as are molar entropy and molar heat.
Dimensions[edit]
From the ideal gas law PV = nRT we get:
where P is pressure, V is volume, n is number of moles of a given substance, and T is temperature.
As pressure is defined as force per area of measurement, the gas equation can also be written as:
Area and volume are (length)2 and (length)3 respectively. Therefore:
Since force × length = work:
The physical significance of R is work per degree per mole. It may be expressed in any set of units representing work or energy (such as joules), units representing degrees of temperature on an absolute scale (such as kelvin or rankine), and any system of units designating a mole or a similar pure number that allows an equation of macroscopic mass and fundamental particle numbers in a system, such as an ideal gas (see Avogadro constant).
Instead of a mole the constant can be expressed by considering the normal cubic meter.
Otherwise, we can also say that:
Therefore, we can write R as:
And so, in terms of SI base units:
- R = 8.314462618… kg⋅m2⋅s−2⋅K−1⋅mol−1.
Relationship with the Boltzmann constant[edit]
The Boltzmann constant kB (alternatively k) may be used in place of the molar gas constant by working in pure particle count, N, rather than amount of substance, n, since
where NA is the Avogadro constant.
For example, the ideal gas law in terms of the Boltzmann constant is
where N is the number of particles (molecules in this case), or to generalize to an inhomogeneous system the local form holds:
where ρN = N/V is the number density.
Measurement and replacement with defined value[edit]
As of 2006, the most precise measurement of R had been obtained by measuring the speed of sound ca(P, T) in argon at the temperature T of the triple point of water at different pressures P, and extrapolating to the zero-pressure limit ca(0, T). The value of R is then obtained from the relation
where:
- γ0 is the heat capacity ratio (5/3 for monatomic gases such as argon);
- T is the temperature, TTPW = 273.16 K by the definition of the kelvin at that time;
- Ar(Ar) is the relative atomic mass of argon and Mu = 10−3 kg⋅mol−1 as defined at the time.
However, following the 2019 redefinition of the SI base units, R now has an exact value defined in terms of other exactly defined physical constants.
Specific gas constant[edit]
| Rspecific for dry air |
Unit |
|---|---|
| 287.052874 | J⋅kg−1⋅K−1 |
| 53.3523 | ft⋅lbf⋅lb−1⋅°R−1 |
| 1,716.46 | ft⋅lbf⋅slug−1⋅°R−1 |
| Based on a mean molar mass for dry air of 28.964917 g/mol. |
The specific gas constant of a gas or a mixture of gases (Rspecific) is given by the molar gas constant divided by the molar mass (M) of the gas or mixture.
Just as the molar gas constant can be related to the Boltzmann constant, so can the specific gas constant by dividing the Boltzmann constant by the molecular mass of the gas.
Another important relationship comes from thermodynamics. Mayer’s relation relates the specific gas constant to the specific heat capacities for a calorically perfect gas and a thermally perfect gas.
where cp is the specific heat capacity for a constant pressure and cv is the specific heat capacity for a constant volume.[9]
It is common, especially in engineering applications, to represent the specific gas constant by the symbol R. In such cases, the universal gas constant is usually given a different symbol such as R to distinguish it. In any case, the context and/or unit of the gas constant should make it clear as to whether the universal or specific gas constant is being referred to. [10]
In case of air, using the perfect gas law and the standard sea-level conditions (SSL) (air density ρ0 = 1.225 kg/m3, temperature T0 = 288.15 K and pressure p0 = 101325 Pa), we have that Rair = P0/(ρ0T0) = 287.052874247 J·kg−1·K−1. Then the molar mass of air is computed by M0 = R/Rair = 28.964917 g/mol.[11]
U.S. Standard Atmosphere[edit]
The U.S. Standard Atmosphere, 1976 (USSA1976) defines the gas constant R∗ as:[12][13]
- R∗ = 8.31432×103 N⋅m⋅kmol−1⋅K−1 = 8.31432 J⋅K−1⋅mol−1.
Note the use of kilomoles, with the resulting factor of 1000 in the constant. The USSA1976 acknowledges that this value is not consistent with the cited values for the Avogadro constant and the Boltzmann constant.[13] This disparity is not a significant departure from accuracy, and USSA1976 uses this value of R∗ for all the calculations of the standard atmosphere. When using the ISO value of R, the calculated pressure increases by only 0.62 pascal at 11 kilometers (the equivalent of a difference of only 17.4 centimeters or 6.8 inches) and 0.292 Pa at 20 km (the equivalent of a difference of only 33.8 cm or 13.2 in).
Also note that this was well before the 2019 SI redefinition, through which the constant was given an exact value.
References[edit]
- ^ «2018 CODATA Value: molar gas constant». The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2019-05-20.
- ^ «Proceedings of the 106th meeting» (PDF). 16–20 October 2017.
- ^ Jensen, William B. (July 2003). «The Universal Gas Constant R«. J. Chem. Educ. 80 (7): 731. Bibcode:2003JChEd..80..731J. doi:10.1021/ed080p731.
- ^ «Ask the Historian: The Universal Gas Constant — Why is it represented by the letter R?» (PDF).
- ^ Mendeleev, Dmitri I. (September 12, 1874). «An exert from the Proceedings of the Chemical Society’s Meeting on Sept. 12, 1874». Journal of Russian Chemical-Physical Society, Chemical Part. VI (7): 208–209.
- ^ Mendeleev, Dmitri I. (1875). On the elasticity of gases [Объ упругости газовъ]. A.M. Kotomin, St.-Petersburg.
- ^ D. Mendeleev. On the elasticity of gases. 1875 (in Russian)
- ^ Mendeleev, Dmitri I. (March 22, 1877). «Mendeleef’s researches on Mariotte’s law 1». Nature. 15 (388): 498–500. Bibcode:1877Natur..15..498D. doi:10.1038/015498a0.
- ^ Anderson, Hypersonic and High-Temperature Gas Dynamics, AIAA Education Series, 2nd Ed, 2006
- ^ Moran and Shapiro, Fundamentals of Engineering Thermodynamics, Wiley, 4th Ed, 2000
- ^ Manual of the US Standard Atmosphere (PDF) (3 ed.). National Aeronautics and Space Administration. 1962. pp. 7–11.
- ^ «Standard Atmospheres». Retrieved 2007-01-07.
- ^ a b NOAA, NASA, USAF (1976). U.S. Standard Atmosphere, 1976 (PDF). U.S. Government Printing Office, Washington, D.C. NOAA-S/T 76-1562.
{{cite book}}: CS1 maint: multiple names: authors list (link) Part 1, p. 3, (Linked file is 17 Meg)
External links[edit]
- Ideal gas calculator Archived 2012-07-15 at the Wayback Machine – Ideal gas calculator provides the correct information for the moles of gas involved.
- Individual Gas Constants and the Universal Gas Constant – Engineering Toolbox
Определение газовой постоянной смеси из азота и кислорода, ее массы и начального объема, конечных параметров смеси
Страницы работы
Содержание работы
задача 1:
Смесь, состоящая из М1=0,8
кмоль азота и М2=0,2 кмоль кислорода с начальными параметрами р1=1
МПа и Т1=1000 К расширяется до давления р2=0,57 МПа.
Расширение может осуществляться по изотерме, адиабате и политропе с показателем
n =0,8. Определить газовую постоянную смеси, ее массу и начальный объем,
конечные параметры смеси, работу расширения и теплоту, участвующую в процессе.
Решение:
1. Определяем удельную газовую постоянную смеси газов R
из формулы универсальной (молярной) газовой постоянной
М R= R0,
где М — молярная масса смеси,
R0=8314,3 кДж/(кмоль*К) — универсальная газовая постоянная.
Молярная масса смеси М равна
сумме произведений молярных масс компонентов на их молярные доли:
М=М1*х1+М2*х2
Поскольку масса смеси равна 1
кмолю, то молярные доли:
х1=0,8; х2=0,2
Подставляя значения молярных
масс азота и кислорода, получим величину молярной массы смеси:
М=0,8*28+0,2*32=28,8 кг/кмоль
Теперь можно определить
удельную газовую постоянную смеси R:
R=8314,3/28,8=288,69
Дж/(кг*К)
Массу смеси можно определить
по формуле:
m=М*n, где n — количества
вещества смеси в молях, для нашей задачи n=0,8+0,2=1 кмоль
m=28,8*1=28,8кг
2. Начальный объем, определим по формуле Менделеева
p1V1=mRT1;
V1=mRT1/p1=28,8*288,69*1000/(1*106)=8,314
м3
3. Изотермический процесс, Т=const
Определим конечный объем при
расширении газа по уравнению изотермического процесса
p1V1= p2V2,
V2= p1V1/р2=1*106*8,314/(0,57*106)=14,586
м3
Поскольку процесс
изотермический, то Т1=Т2=1000 К.
Определим работу расширения L12
по формуле:
L12= mRTln(p1/p2)=28,8*288,69*1000*lg(1/0,57)=4,67
МДж.
При изотермическом расширении
газа к нему подводится теплота Q12 в количестве эквивалентном работе
расширения L12, поэтому Q12=L12=4,67 МДж.
Изменение энтальпии в
изотермическом процессе равно нулю, т. к. T2-T1=0
Изменение энтропии S12=Q12/T:
S12=4,67*106/1000=4,67
кДж/К.
Изменение внутренней энергии
в изотермическом процессе отсутствует, так как (U2-U1)=Cv(T2-T1);
(T2-T1)=0, значит и (U2-U1)=0.
4. Адиабатный процесс pVk=const:
Конечный объем V2
найдем из соотношения параметров в адиабатном процессе V2=V1(p1/p2)1/k,
откуда , k — показатель адиабаты, для двухатомных газов k=1,4, поэтому
V2=8.3141/4√1/0.57=12.4 м3
Температуру Т2
определяем по уравнению Менделеева:
Т2= p2V2/(mR)=0,57*106*12,42/(28.8*288.69)=850 К.
В адиабатном процессе
количество подводимой или отводимой теплоты равно нулю, то есть Q12=0.
Работу расширения можно
определить по формуле:
L12=mR(T1-T2)/(k-1)=28.8*288.69*(1000-850)/(1,4-1)=3,12 МДж.
Изменение внутренней энергии
можно определить из уравнения первого начала термодинамики:
Q12=(U2-U1)+L12,
так как Q12=0, то (U2-U1)=-L12
(U2-U1)=-4.67
МДж. Знак минус указывает на то, что внутренняя энергия уменьшается. Значит
положительная работа в адиабатном процессе осуществляется за счет уменьшения
внутренней энергии.
Изменение энтальпии
Y=mCp(T2-T1), где Cp — средняя изобарная теплоемкость смеси, которая равна
сумме произведений массовых долей компонентов на их удельные теплоемкости.
, где CpN2 u Cp O2— средние удельные изобарные теплоемкости, которые находятся
по таблицам при средней температуре процесса Тср=(Т1+Т2)/2=(1000+850)/2=925К.
W — массовые доли N2 и O2
Cp=1,1507*0,8+1,077*0,2=1,136
кДж/(кг*К).
Теперь можно определить
энтальпию:
Y=28.8*1,136*(850-1000)=-4905
кДж.
5. Политропный процесс pVn=const
Конечный объем V2
найдем из соотношения параметров в политропном процессе V2=V1(p1/p2)1/n=8.34(1/0.57)1/0.8
=16.8 м3
Температуру Т2
определяем по уравнению Менделеева:
Т2= p2V2/(mR)=0,57*106*16,8/(28.8*288.69)=1151,8 К.
Теплоту, участвующую в
процессе можно определить по формуле:
Q=m[Cv-R/n-1](T2-T1)
где Cv — средняя
удельная объемная теплоемкость смеси, которая находится следующим образом.
Известно, что k= Cp /Cv , поэтому объемная удельная теплоемкость смеси Cv=Cp /
k=1,136/1,4=0, 8 кДж/(кг*К).
Подставляем значение мольной
теплоемкости в формулу, получаем:
Q=28.8[800-288.69/(0.8-1)](1151.8-1000)=9.5 МДж.
Изменение внутренней энергии,
как для любого процесса, определяется по формуле:
U2-U1=mCv(T2-T1)=28.8
*800*(1151,8-1000)=3,5МДж.
Работу расширения
политропного процесса вычисляем по формуле:
L12 = mR(T1-T2)/(n-1)=28.8*288.69*(1000-1151,8)/(0,8-1)=6,3
МДж.
Изменение энтальпии Y
находим по формуле:
Y=mCp(T2-T1)=28.8*1,136*(1151,8-1000)=4966kДж.
Сводная таблица результатов:
Величина Изотермический Адиабатический
Политропный
V2, м3 14,586
12,42 16
T2, К 1000
850 1151,8
L12, МДж 4,67
-4.67 6.3
Q12, МДж 4,67
0 9.5
Похожие материалы
- Оптимальный диаметр трубопровода для перекачивания органической смеси бензол-толуол
- Расчет и проектирование абсорбционной установки непрерывного действия для улавливания паров метанола из газовой смеси (воздушной) водой
- Расчет колонны. Расчет массовых расходов дистиллята и кубового остатка
Информация о работе
| Значения R | Единицы |
|---|---|
| Единицы СИ | |
| 8,314 462 618 153 24 | Дж ⋅ К −1 ⋅ моль −1 |
| 8,314 462 618 153 24 | м 3 ⋅ Па ⋅ K −1 ⋅ моль −1 |
| 8,314 462 618 153 24 | кг ⋅ м 2 ⋅ с -2 ⋅ K -1 ⋅ моль -1 |
| Другие общие единицы | |
| 0,730 240 507 295 273 | атм ⋅ фут 3 ⋅ фунт-моль −1 ⋅ ° R −1 |
| 10,731 557 089 016 | пси ⋅ фут 3 ⋅ фунт — моль -1 ⋅ ° R -1 |
| 1,985 875 279 009 | БТЕ ⋅ фунтмоль −1 ⋅ ° R −1 |
| 297.031 214 | в Н 2 O ⋅ фут 3 ⋅ фунт — моль -1 ⋅ ° R -1 |
| 554,984 319 180 | торр ⋅ фут 3 ⋅ фунт — моль -1 ⋅ ° R -1 |
| 8 314, 462 618 153 24 | L ⋅ Па ⋅ K −1 ⋅ моль −1 |
| 0,083 144 626 181 5324 | L ⋅ бар ⋅ K −1 ⋅ моль −1 |
| 0,082 057 366 080 960 | L ⋅ атм ⋅ K −1 ⋅ моль −1 |
| 62,363 598 221 529 | L ⋅ Торр ⋅ K −1 ⋅ моль −1 |
| 1,987 204 258 640 83 … | кал ⋅ K −1 ⋅ моль −1 |
| 8,205 736 608 095 96 … × 10 −5 | м 3 ⋅ атм ⋅ K -1 ⋅ моль -1 |
| 8,314 462 618 153 24 × 10 7 | эрг ⋅ K -1 ⋅ моль -1 |
Молярная газовая постоянная (также известный как газовая постоянная , универсальная газовая постоянная , или идеальной газовой постоянной ) обозначается символом R или R . Это молярный эквивалент постоянной Больцмана , выраженный в единицах энергии на приращение температуры на моль , то есть произведение давление-объем, а не энергия на приращение температуры на частицу . Константа также комбинацией констант из закона Бойля , закон Шарля , закон Авогадро и закон Гей-Люссака . Это физическая константа, которая присутствует во многих фундаментальных уравнениях в физических науках, таких как закон идеального газа , уравнение Аррениуса и уравнение Нернста .
Газовая постоянная — это константа пропорциональности, которая связывает шкалу энергии в физике с температурной шкалой и шкалой, используемой для количества вещества . Таким образом, значение газовой постоянной в конечном итоге определяется историческими решениями и случайностями при установке единиц энергии, температуры и количества вещества. Постоянная Больцмана и Авогадро были также определены, которые по отдельности связана энергия для температуры и частиц считать до количества вещества.
Газовая постоянная R определяется как постоянная Авогадро N A, умноженная на постоянную Больцмана k (или k B ):
После переопределения базовых единиц СИ в 2019 году как N A, так и k определяются с точными числовыми значениями, выраженными в единицах СИ. Как следствие, значение SI молярной газовой постоянной точно равно8,314 462 618 153 24 Дж⋅K −1 мкмоль −1 .
Некоторые полагают , что это может быть уместно назвать символ R постоянной Реим в честь французского химика Анри Виктора Реньо , чей точный экспериментальных данные были использованы для расчета раннего значения константы. Однако происхождение буквы R, обозначающей константу, неуловимо. Универсальная газовая постоянная была, по-видимому, введена независимо учеником Клаузиуса А. Ф. Хорстманном (1873 г.) и Дмитрием Менделеевым, которые впервые сообщили о ней 12 сентября 1874 г. Используя свои обширные измерения свойств газов,
он также вычислил ее с высокой точностью. в пределах 0,3% от современного значения.
Газовая постоянная входит в закон идеального газа :
где P — абсолютное давление (единица СИ паскали), V — объем газа (единица СИ, кубические метры), n — количество газа (единица СИ, моль), m — масса (единица СИ, килограммы), содержащаяся в V , и T — термодинамическая температура (единица СИ, кельвины). R specific — удельная газовая постоянная. Газовая постоянная выражается в тех же единицах, что и молярная энтропия и молярная теплоемкость .
Габаритные размеры
Из закона идеального газа PV = nRT получаем:
где P — давление, V — объем, n — количество молей данного вещества, а T — температура .
Поскольку давление определяется как сила, приходящаяся на область измерения, уравнение газа также можно записать как:
Площадь и объем равны (длина) 2 и (длина) 3 соответственно. Следовательно:
Поскольку сила × длина = работа:
Физическое значение R — работа на градус на моль. Он может быть выражен в любом наборе единиц, представляющих работу или энергию (например, джоули ), единицах, представляющих градусы температуры по абсолютной шкале (например, Кельвина или Ранкина ), и любой системе единиц, обозначающей моль или подобное чистое число, которое позволяет уравнение макроскопической массы и чисел фундаментальных частиц в системе, такой как идеальный газ (см. постоянную Авогадро ).
Вместо моля постоянную можно выразить, рассматривая нормальный кубический метр .
В противном случае мы также можем сказать, что:
Следовательно, мы можем записать R как:
Итак, в базовых единицах СИ :
- R =8,314 462 618 … кг⋅м 2 с −2 K −1 моль −1 .
Связь с постоянной Больцмана
Константу Больцмана k B (альтернативно k ) можно использовать вместо молярной газовой постоянной, работая с подсчетом чистых частиц N , а не с количеством вещества n , поскольку
где N A — постоянная Авогадро . Например, закон идеального газа с точки зрения постоянной Больцмана имеет вид
где N — число частиц (в данном случае молекул), или, если обобщить на неоднородную систему, имеет место локальная форма:
где ρ N — плотность числа .
Измерение и замена на определенное значение
В 2006 году , наиболее точное измерение R были получены путем измерения скорости звука с в ( Р , Т ) в атмосфере аргона при температуре Т в тройной точке воды при различных давлениях Р , и экстраполяцией до нулевого давления предел c a (0, T ). Тогда значение R получается из соотношения
куда:
-
γ 0 — коэффициент теплоемкости (
5/3 для одноатомных газов, таких как аргон); - T — температура, T TPW = 273,16 K по определению кельвина в то время;
- A r (Ar) — относительная атомная масса аргона, M u = 10 -3 кг⋅моль -1, как было определено в то время.
Однако после переопределения базовых единиц СИ в 2019 году R теперь имеет точное значение, определенное в терминах других точно определенных физических констант.
Удельная газовая постоянная
|
R удельная для сухого воздуха |
Единицы |
|---|---|
| 287,058 | Дж⋅кг −1 ⋅K −1 |
| 53,3533 | фут⋅ фунт-сила ⋅ фунт −1 ⋅ ° R −1 |
| 1 716,49 | ft⋅ фунт — сила ⋅ пробкового -1 ⋅ ° R -1 |
|
Исходя из средней молярной массы сухого воздуха 28,9645 г / моль. |
Удельная газовая постоянная газа или смеси газов ( R удельная ) задается молярной газовой постоянной , деленной на молярную массу ( М ) газа или смеси.
Точно так же, как постоянная идеального газа может быть связана с постоянной Больцмана, то же самое можно сделать и с постоянной газом путем деления постоянной Больцмана на молекулярную массу газа.
Еще одно важное соотношение исходит из термодинамики. Соотношение Майера связывает удельную газовую постоянную с удельной теплоемкостью для калорийно совершенного газа и термически совершенного газа.
где c p — удельная теплоемкость при постоянном давлении, а c v — удельная теплоемкость при постоянном объеме.
Это распространено, особенно в инженерных приложениях, чтобы представлять конкретную константу газа символа R . В таких случаях, универсальная газовая постоянная обычно дается другой символ , такой как R , чтобы отличить его. В любом случае контекст и / или единицы газовой постоянной должны давать понять, идет ли речь о универсальной или конкретной газовой постоянной.
Стандартная атмосфера США
Стандарт США Атмосфера , 1976 (USSA1976) определяет газовая постоянная R * , как:
- R ∗ =8.314 32 × 10 3 Н⋅м⋅кмоль −1 K −1 .
Обратите внимание на использование единиц измерения в киломолях, что дает коэффициент 1000 в константе. USSA1976 признает, что это значение не согласуется с приведенными значениями для постоянной Авогадро и постоянной Больцмана. Это несоответствие не является значительным отклонением от точности, и USSA1976 использует это значение R * для всех расчетов стандартной атмосферы. При использовании значения R по ISO расчетное давление увеличивается всего на 0,62 паскаль на 11 км (эквивалент разницы всего в 17,4 сантиметра или 6,8 дюйма) и на 0,292 Па на 20 км (эквивалент разницы всего в 33,8 см или 13,2 дюйма).
Также обратите внимание, что это было задолго до переопределения SI 2019 года, благодаря которому константе было присвоено точное значение.
использованная литература
внешние ссылки
- Калькулятор идеального газа — Калькулятор идеального газа предоставляет правильную информацию о молях газа.
- Индивидуальные газовые постоянные и универсальная газовая постоянная — Engineering Toolbox








































