Удельная газовая
постоянная однородного газа, заменяющего
смесь, называется газовой постоянной
смеси Rсм,
Дж / (кг·К):

или окончательно
.
Через мольные доли
газовая постоянная смеси вычисляется
следующим образом:
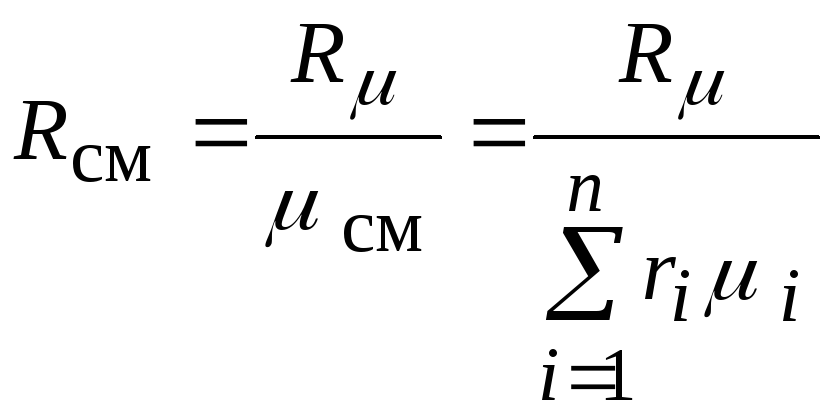
или окончательно

С использованием
можно получить формулу для вычисления
парциального давления идеального газа
через его массовую долю.
Т. к. и
,
то разделив эти
выражения друг на друга получим:
,
откуда
Из последнего
выражения можно получить удобную
формулу, связывающую мольные и массовые
доли идеального газа.
Т. к. ,
то
1.4.8. Плотность смеси газов
Плотность однородного
газа, заменяющего
смесь, называется плотностью смеси:
В справочниках
обычно приводится без объяснений
следующая формула для плотности смеси:
В то же время в
технической литературе встречаются
формулы вида
С вычислением
плотности смеси через плотности
компонентов связано наибольшее число
студенческих ошибок. Дело в том, что
значение плотности
-го
компонента можноформальнополучить из двух формул:
и
Т.
к.
,
то значенияи
заметно отличаются друг от друга.
Проясним вопрос
с вычислением плотности смеси.
По определению
и
,
тогда.
Но
и
Т.
о. в последней формуле плотность i-го
газавычисляется как плотность этого газа,
находящегося в количествекилограммовв объеме
(парциальном объеме) при давлении
смеси
и температуре смеси .
Такое толкование
плотности компонентов смеси используется,
в частности, при расчетеобъемов
продуктов сгорания топлива.
Если плотность
i-го газа в смеси
вычислять через его парциальное давление
,
то
Т.
о. в этой формуле плотность i-го
газа— это плотность газа массой
,
находящегося вобъеме (объем
смеси) при его парциальном давлении и температуре
(температуре смеси).
Такое толкование
плотности компонентов смеси, в частности,
используется при определении абсолютной
и относительной влажности воздуха.
1.4.9. Энтропия смеси идеальных газов
Как указано в
параграфе 1.4.1., энтропия 1 кг
—
компонентной смеси идеальных газов
(удельная энтропия смеси)Sсм
, Дж / (К · кг), определяется по
следующей формуле:
,
где: —
энтропия 1 кгi-го газа.
Из
курса общей термодинамики известно:
,
где: —
массовая изобарная теплоемкостьi-го
газа.
Окончательно
удельная энтропия
-компонентной
смеси может быть вычислена по следующей
формуле:
1.4.10. Теплоемкость газовой смеси
По определению,
теплоемкость — это количество теплоты,
которое необходимо для изменения
температуры единицы количества вещества
(
)
на один градус.
Т. к. температура
всех газов в смеси одинакова, то
теплоемкость смеси, складывается из
теплоемкостей всех компонентов, взятых
в долях, соответствующих способу задания
смеси:
— массовая (удельная)
теплоемкость, Дж / (кг·К);
— мольная теплоемкость,
Дж / (кмоль·К);
— объемная
теплоемкость, Дж / (м3·К).
где: — массовая, мольная и объемная теплоемкостиi-го компонента.
Определение газовой постоянной смеси из азота и кислорода, ее массы и начального объема, конечных параметров смеси
Страницы работы
Содержание работы
задача 1:
Смесь, состоящая из М1=0,8
кмоль азота и М2=0,2 кмоль кислорода с начальными параметрами р1=1
МПа и Т1=1000 К расширяется до давления р2=0,57 МПа.
Расширение может осуществляться по изотерме, адиабате и политропе с показателем
n =0,8. Определить газовую постоянную смеси, ее массу и начальный объем,
конечные параметры смеси, работу расширения и теплоту, участвующую в процессе.
Решение:
1. Определяем удельную газовую постоянную смеси газов R
из формулы универсальной (молярной) газовой постоянной
М R= R0,
где М — молярная масса смеси,
R0=8314,3 кДж/(кмоль*К) — универсальная газовая постоянная.
Молярная масса смеси М равна
сумме произведений молярных масс компонентов на их молярные доли:
М=М1*х1+М2*х2
Поскольку масса смеси равна 1
кмолю, то молярные доли:
х1=0,8; х2=0,2
Подставляя значения молярных
масс азота и кислорода, получим величину молярной массы смеси:
М=0,8*28+0,2*32=28,8 кг/кмоль
Теперь можно определить
удельную газовую постоянную смеси R:
R=8314,3/28,8=288,69
Дж/(кг*К)
Массу смеси можно определить
по формуле:
m=М*n, где n — количества
вещества смеси в молях, для нашей задачи n=0,8+0,2=1 кмоль
m=28,8*1=28,8кг
2. Начальный объем, определим по формуле Менделеева
p1V1=mRT1;
V1=mRT1/p1=28,8*288,69*1000/(1*106)=8,314
м3
3. Изотермический процесс, Т=const
Определим конечный объем при
расширении газа по уравнению изотермического процесса
p1V1= p2V2,
V2= p1V1/р2=1*106*8,314/(0,57*106)=14,586
м3
Поскольку процесс
изотермический, то Т1=Т2=1000 К.
Определим работу расширения L12
по формуле:
L12= mRTln(p1/p2)=28,8*288,69*1000*lg(1/0,57)=4,67
МДж.
При изотермическом расширении
газа к нему подводится теплота Q12 в количестве эквивалентном работе
расширения L12, поэтому Q12=L12=4,67 МДж.
Изменение энтальпии в
изотермическом процессе равно нулю, т. к. T2-T1=0
Изменение энтропии S12=Q12/T:
S12=4,67*106/1000=4,67
кДж/К.
Изменение внутренней энергии
в изотермическом процессе отсутствует, так как (U2-U1)=Cv(T2-T1);
(T2-T1)=0, значит и (U2-U1)=0.
4. Адиабатный процесс pVk=const:
Конечный объем V2
найдем из соотношения параметров в адиабатном процессе V2=V1(p1/p2)1/k,
откуда , k — показатель адиабаты, для двухатомных газов k=1,4, поэтому
V2=8.3141/4√1/0.57=12.4 м3
Температуру Т2
определяем по уравнению Менделеева:
Т2= p2V2/(mR)=0,57*106*12,42/(28.8*288.69)=850 К.
В адиабатном процессе
количество подводимой или отводимой теплоты равно нулю, то есть Q12=0.
Работу расширения можно
определить по формуле:
L12=mR(T1-T2)/(k-1)=28.8*288.69*(1000-850)/(1,4-1)=3,12 МДж.
Изменение внутренней энергии
можно определить из уравнения первого начала термодинамики:
Q12=(U2-U1)+L12,
так как Q12=0, то (U2-U1)=-L12
(U2-U1)=-4.67
МДж. Знак минус указывает на то, что внутренняя энергия уменьшается. Значит
положительная работа в адиабатном процессе осуществляется за счет уменьшения
внутренней энергии.
Изменение энтальпии
Y=mCp(T2-T1), где Cp — средняя изобарная теплоемкость смеси, которая равна
сумме произведений массовых долей компонентов на их удельные теплоемкости.
, где CpN2 u Cp O2— средние удельные изобарные теплоемкости, которые находятся
по таблицам при средней температуре процесса Тср=(Т1+Т2)/2=(1000+850)/2=925К.
W — массовые доли N2 и O2
Cp=1,1507*0,8+1,077*0,2=1,136
кДж/(кг*К).
Теперь можно определить
энтальпию:
Y=28.8*1,136*(850-1000)=-4905
кДж.
5. Политропный процесс pVn=const
Конечный объем V2
найдем из соотношения параметров в политропном процессе V2=V1(p1/p2)1/n=8.34(1/0.57)1/0.8
=16.8 м3
Температуру Т2
определяем по уравнению Менделеева:
Т2= p2V2/(mR)=0,57*106*16,8/(28.8*288.69)=1151,8 К.
Теплоту, участвующую в
процессе можно определить по формуле:
Q=m[Cv-R/n-1](T2-T1)
где Cv — средняя
удельная объемная теплоемкость смеси, которая находится следующим образом.
Известно, что k= Cp /Cv , поэтому объемная удельная теплоемкость смеси Cv=Cp /
k=1,136/1,4=0, 8 кДж/(кг*К).
Подставляем значение мольной
теплоемкости в формулу, получаем:
Q=28.8[800-288.69/(0.8-1)](1151.8-1000)=9.5 МДж.
Изменение внутренней энергии,
как для любого процесса, определяется по формуле:
U2-U1=mCv(T2-T1)=28.8
*800*(1151,8-1000)=3,5МДж.
Работу расширения
политропного процесса вычисляем по формуле:
L12 = mR(T1-T2)/(n-1)=28.8*288.69*(1000-1151,8)/(0,8-1)=6,3
МДж.
Изменение энтальпии Y
находим по формуле:
Y=mCp(T2-T1)=28.8*1,136*(1151,8-1000)=4966kДж.
Сводная таблица результатов:
Величина Изотермический Адиабатический
Политропный
V2, м3 14,586
12,42 16
T2, К 1000
850 1151,8
L12, МДж 4,67
-4.67 6.3
Q12, МДж 4,67
0 9.5
Похожие материалы
- Оптимальный диаметр трубопровода для перекачивания органической смеси бензол-толуол
- Расчет и проектирование абсорбционной установки непрерывного действия для улавливания паров метанола из газовой смеси (воздушной) водой
- Расчет колонны. Расчет массовых расходов дистиллята и кубового остатка
Информация о работе
From Wikipedia, the free encyclopedia
| Value of R[1] | Unit |
|---|---|
| SI units | |
| 8.31446261815324 | J⋅K−1⋅mol−1 |
| 8.31446261815324 | m3⋅Pa⋅K−1⋅mol−1 |
| 8.31446261815324 | kg⋅m2⋅s−2⋅K−1⋅mol−1 |
| Other common units | |
| 8314.46261815324 | L⋅Pa⋅K−1⋅mol−1 |
| 8.31446261815324 | L⋅kPa⋅K−1⋅mol−1 |
| 0.0831446261815324 | L⋅bar⋅K−1⋅mol−1 |
| 8.31446261815324×107 | erg⋅K−1⋅mol−1 |
| 0.730240507295273 | atm⋅ft3⋅lbmol−1⋅°R−1 |
| 10.731577089016 | psi⋅ft3⋅lbmol−1⋅°R−1 |
| 1.985875279009 | BTU⋅lbmol−1⋅°R−1 |
| 297.031214 | inH2O⋅ft3⋅lbmol−1⋅°R−1 |
| 554.984319180 | torr⋅ft3⋅lbmol−1⋅°R−1 |
| 0.082057366080960 | L⋅atm⋅K−1⋅mol−1 |
| 62.363598221529 | L⋅Torr⋅K−1⋅mol−1 |
| 1.98720425864083… | cal⋅K−1⋅mol−1 |
| 8.20573660809596…×10−5 | m3⋅atm⋅K−1⋅mol−1 |
The molar gas constant (also known as the gas constant, universal gas constant, or ideal gas constant) is denoted by the symbol R or R. It is the molar equivalent to the Boltzmann constant, expressed in units of energy per temperature increment per amount of substance, i.e. the pressure–volume product, rather than energy per temperature increment per particle. The constant is also a combination of the constants from Boyle’s law, Charles’s law, Avogadro’s law, and Gay-Lussac’s law. It is a physical constant that is featured in many fundamental equations in the physical sciences, such as the ideal gas law, the Arrhenius equation, and the Nernst equation.
The gas constant is the constant of proportionality that relates the energy scale in physics to the temperature scale and the scale used for amount of substance. Thus, the value of the gas constant ultimately derives from historical decisions and accidents in the setting of units of energy, temperature and amount of substance. The Boltzmann constant and the Avogadro constant were similarly determined, which separately relate energy to temperature and particle count to amount of substance.
The gas constant R is defined as the Avogadro constant NA multiplied by the Boltzmann constant k (or kB):
Since the 2019 redefinition of SI base units, both NA and k are defined with exact numerical values when expressed in SI units.[2] As a consequence, the SI value of the molar gas constant is exactly 8.31446261815324 J⋅K−1⋅mol−1.
Some have suggested that it might be appropriate to name the symbol R the Regnault constant in honour of the French chemist Henri Victor Regnault, whose accurate experimental data were used to calculate the early value of the constant. However, the origin of the letter R to represent the constant is elusive. The universal gas constant was apparently introduced independently by Clausius’ student, A.F. Horstmann (1873)[3][4]
and Dmitri Mendeleev who reported it first on Sep. 12, 1874.[5]
Using his extensive measurements of the properties of gases,[6][7]
Mendeleev also calculated it with high precision, within 0.3% of its modern value.[8]
The gas constant occurs in the ideal gas law:
where P is the absolute pressure, V is the volume of gas, n is the amount of substance, m is the mass, and T is the thermodynamic temperature. Rspecific is the mass-specific gas constant. The gas constant is expressed in the same unit as are molar entropy and molar heat.
Dimensions[edit]
From the ideal gas law PV = nRT we get:
where P is pressure, V is volume, n is number of moles of a given substance, and T is temperature.
As pressure is defined as force per area of measurement, the gas equation can also be written as:
Area and volume are (length)2 and (length)3 respectively. Therefore:
Since force × length = work:
The physical significance of R is work per degree per mole. It may be expressed in any set of units representing work or energy (such as joules), units representing degrees of temperature on an absolute scale (such as kelvin or rankine), and any system of units designating a mole or a similar pure number that allows an equation of macroscopic mass and fundamental particle numbers in a system, such as an ideal gas (see Avogadro constant).
Instead of a mole the constant can be expressed by considering the normal cubic meter.
Otherwise, we can also say that:
Therefore, we can write R as:
And so, in terms of SI base units:
- R = 8.314462618… kg⋅m2⋅s−2⋅K−1⋅mol−1.
Relationship with the Boltzmann constant[edit]
The Boltzmann constant kB (alternatively k) may be used in place of the molar gas constant by working in pure particle count, N, rather than amount of substance, n, since
where NA is the Avogadro constant.
For example, the ideal gas law in terms of the Boltzmann constant is
where N is the number of particles (molecules in this case), or to generalize to an inhomogeneous system the local form holds:
where ρN = N/V is the number density.
Measurement and replacement with defined value[edit]
As of 2006, the most precise measurement of R had been obtained by measuring the speed of sound ca(P, T) in argon at the temperature T of the triple point of water at different pressures P, and extrapolating to the zero-pressure limit ca(0, T). The value of R is then obtained from the relation
where:
- γ0 is the heat capacity ratio (5/3 for monatomic gases such as argon);
- T is the temperature, TTPW = 273.16 K by the definition of the kelvin at that time;
- Ar(Ar) is the relative atomic mass of argon and Mu = 10−3 kg⋅mol−1 as defined at the time.
However, following the 2019 redefinition of the SI base units, R now has an exact value defined in terms of other exactly defined physical constants.
Specific gas constant[edit]
| Rspecific for dry air |
Unit |
|---|---|
| 287.052874 | J⋅kg−1⋅K−1 |
| 53.3523 | ft⋅lbf⋅lb−1⋅°R−1 |
| 1,716.46 | ft⋅lbf⋅slug−1⋅°R−1 |
| Based on a mean molar mass for dry air of 28.964917 g/mol. |
The specific gas constant of a gas or a mixture of gases (Rspecific) is given by the molar gas constant divided by the molar mass (M) of the gas or mixture.
Just as the molar gas constant can be related to the Boltzmann constant, so can the specific gas constant by dividing the Boltzmann constant by the molecular mass of the gas.
Another important relationship comes from thermodynamics. Mayer’s relation relates the specific gas constant to the specific heat capacities for a calorically perfect gas and a thermally perfect gas.
where cp is the specific heat capacity for a constant pressure and cv is the specific heat capacity for a constant volume.[9]
It is common, especially in engineering applications, to represent the specific gas constant by the symbol R. In such cases, the universal gas constant is usually given a different symbol such as R to distinguish it. In any case, the context and/or unit of the gas constant should make it clear as to whether the universal or specific gas constant is being referred to. [10]
In case of air, using the perfect gas law and the standard sea-level conditions (SSL) (air density ρ0 = 1.225 kg/m3, temperature T0 = 288.15 K and pressure p0 = 101325 Pa), we have that Rair = P0/(ρ0T0) = 287.052874247 J·kg−1·K−1. Then the molar mass of air is computed by M0 = R/Rair = 28.964917 g/mol.[11]
U.S. Standard Atmosphere[edit]
The U.S. Standard Atmosphere, 1976 (USSA1976) defines the gas constant R∗ as:[12][13]
- R∗ = 8.31432×103 N⋅m⋅kmol−1⋅K−1 = 8.31432 J⋅K−1⋅mol−1.
Note the use of kilomoles, with the resulting factor of 1000 in the constant. The USSA1976 acknowledges that this value is not consistent with the cited values for the Avogadro constant and the Boltzmann constant.[13] This disparity is not a significant departure from accuracy, and USSA1976 uses this value of R∗ for all the calculations of the standard atmosphere. When using the ISO value of R, the calculated pressure increases by only 0.62 pascal at 11 kilometers (the equivalent of a difference of only 17.4 centimeters or 6.8 inches) and 0.292 Pa at 20 km (the equivalent of a difference of only 33.8 cm or 13.2 in).
Also note that this was well before the 2019 SI redefinition, through which the constant was given an exact value.
References[edit]
- ^ «2018 CODATA Value: molar gas constant». The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2019-05-20.
- ^ «Proceedings of the 106th meeting» (PDF). 16–20 October 2017.
- ^ Jensen, William B. (July 2003). «The Universal Gas Constant R«. J. Chem. Educ. 80 (7): 731. Bibcode:2003JChEd..80..731J. doi:10.1021/ed080p731.
- ^ «Ask the Historian: The Universal Gas Constant — Why is it represented by the letter R?» (PDF).
- ^ Mendeleev, Dmitri I. (September 12, 1874). «An exert from the Proceedings of the Chemical Society’s Meeting on Sept. 12, 1874». Journal of Russian Chemical-Physical Society, Chemical Part. VI (7): 208–209.
- ^ Mendeleev, Dmitri I. (1875). On the elasticity of gases [Объ упругости газовъ]. A.M. Kotomin, St.-Petersburg.
- ^ D. Mendeleev. On the elasticity of gases. 1875 (in Russian)
- ^ Mendeleev, Dmitri I. (March 22, 1877). «Mendeleef’s researches on Mariotte’s law 1». Nature. 15 (388): 498–500. Bibcode:1877Natur..15..498D. doi:10.1038/015498a0.
- ^ Anderson, Hypersonic and High-Temperature Gas Dynamics, AIAA Education Series, 2nd Ed, 2006
- ^ Moran and Shapiro, Fundamentals of Engineering Thermodynamics, Wiley, 4th Ed, 2000
- ^ Manual of the US Standard Atmosphere (PDF) (3 ed.). National Aeronautics and Space Administration. 1962. pp. 7–11.
- ^ «Standard Atmospheres». Retrieved 2007-01-07.
- ^ a b NOAA, NASA, USAF (1976). U.S. Standard Atmosphere, 1976 (PDF). U.S. Government Printing Office, Washington, D.C. NOAA-S/T 76-1562.
{{cite book}}: CS1 maint: multiple names: authors list (link) Part 1, p. 3, (Linked file is 17 Meg)
External links[edit]
- Ideal gas calculator Archived 2012-07-15 at the Wayback Machine – Ideal gas calculator provides the correct information for the moles of gas involved.
- Individual Gas Constants and the Universal Gas Constant – Engineering Toolbox
Газовая постоянная смеси газов.
- Газовая постоянная смешанного газа Смешанный газ следует уравнению состояния-pV = mRT и R = pV / mT. Из Формулы (3-2″) n = gtRi / R и 2G / = ZgiRi / R = 1, из которых^ Р = организации стандартов Ирана ’= ^ + g2R2 + … + гнрн. ■(3-3)) Газовая постоянная смешанного газа равна сумме массовой доли каждого газа и произведения этой
газовой постоянной. Еще одно уравнение, определяющее газовую постоянную смеси Р = 2giRi-Ф 8314.2(г,/ ^ + ГДж {он + … + г меня. по известной средней молекулярной массе смеси. <Р = 8314.2 / С.%(3-5) Таким образом, газовая постоянная смеси определяется уравнением, по которому вводится средняя молекулярная масса, а газовая постоянная
Газовая постоянная смеси может быть определена
Людмила Фирмаль
отдельных газов определяется тем же уравнением, но там вводится фактическая молекулярная масса каждого газа. Если указан объемный состав смеси, (3-2 ’) gi =(RiRiYi и Xg,= RZn / Rt = 1. И затем… R—V = 1 KrJR, + rJR,+; • • + rn! Дипломированная медсестра.) •(3-6))Средняя молекулярная масса газовой смеси Средняя молекулярная масса является условной величиной, которая относится
к однородному газу, в котором число молекул и общая масса равны числу молекул и массе смешанного газа. Если известна газовая постоянная смеси、 С-8314.2 / Р•. (3-7) И. Я — = 8314.2%/?+ 2 + … + gntfn). Газовая постоянная Rlt R2t …Заменив Rn величиной из уравнения Клапейрона, получим формулу средней молекулярной массы, если смесь задана массовой долей. х = л / (&//ИИ + gjpt + … + W-(3: 8) Если
- смесь указана в объемной доле, то из Формулы (3-6): Р = H2rJRi = 8314.2 / 2rf | если. С / ? ’8 314,2 / Форекс ’ И затем… •[Л= Srijij = rjfij +Г2[Л2+ … +Гпсп. (3-9) Средняя молекулярная масса газовой смеси равна сумме продуктов объемной доли по молекулярной массе отдельных газов, входящих в состав смеси.Парциальное давление Если известны основные параметры газа, то парциальное давление
газа можно определить по массовой доле уравнения Клапейрона. Л = п =(3-10) В. г-н р. Привет.. чтобы найти парциальное давление каждого газа при определении смеси по объемной доле. ПТВ = ПВЛ и Pi = Р ^ = РТП. (3-11) Парциальное давление каждого газа равно произведению полного давления смешанного газа на объемную долю. Формула (3-
Вы можете использовать закон Бойля-Марриотта
Людмила Фирмаль
11)обычно используется при техническом расчете и испытаниях теплового оборудования. Объемная доля газа определяется специальным прибором — газоанализатором. Управление вопросами и примерами в главе 3 1.Что такое смешанный газ? 2.Дайте Далтону формулировку закона. • * 3.Что называется парциальным давлением?
4.Что называется массой, объемом и молярной долей? 5.Так называемая частичная, или. Ты убавил громкость? Какова связь между удельным объемом, плотностью, молекулярной массой и постоянной газа? 7.Почему молекулярная масса смеси называется средней молекулярной массой? * 8.Как. Пересчет массового состава в объем и пересчет объема в объем? 9., Как определяется газовая
постоянная смеси по массовой доле и объемной доле? — В J0.Как парциальное давление газа в смеси определяется массовой долей и объемной долей? 11.Как определяется средняя молекулярная масса смеси газов? Пример 3-1.Если мы предположим, что объем сухого воздуха составляет 21% 02 и 79% N2, мы получим среднюю молекулярную массу сухого воздуха. По Формуле (3-9)、 = РЛ іх +
r2fx3= 32-0.210 + 28.016-0.79 = 28.93 Пример 3-2 определяет газовую постоянную, плотность и парциальное давление смеси, состоящей из 20 массовых долей воздуха и 1 массовой доли легкого газа. Плотность легкого газа при температуре 273°К и давлении 101325 ″ Li2 ″ равна 0,52 кг Газовая постоянная легкого газа определяется по формуле Клапейрона. U1325 = 7и Джей!(Кг-град). J 0,52-273 В и’
Газовая постоянная воздуха составляет 287.04 Дж! Это хорошая идея. Газовая постоянная смешанного газа определяется по формуле (3-3): R = + g2R2= 287.04-20 / 21 + 714-1 / 21 = 306.3 j /(кг> град). Плотность смеси определяется уравнением Клапейрона: p = p / RT = 101325:306,30-273 = 1,21 кг / М9.Парциальное давление определяется по формуле (3-11). = 101325 — = 90100 nCl Ри Р. 21,306. 3 ′ Парциальное давление газа лампы = = — — — — ^- =11225 Н(м G2 G62 I 21 306.30
Смотрите также:
Решение задач по термодинамике
3.11 Определить газовую постоянную, плотность при нормальных условиях и объемный состав смеси, если: H2=8,4%; CH4=48,7%; C2H4=6,9%; CO=17%; O2=4,7%; N2=6,7%
Ответ: Rсм=717 Дж/(кг·К), rH2=0,484, rCH4=0,351, rC2H4=0,028, rCO=0,072, rCO2=0,02, rO2=0,017, rN2=0,028, ρн=0,518 кг/м³.
3.12 Найти газовую постоянную, удельный объем газовой смеси и парциальные давления ее составляющих, если объемный состав смеси следующий: CO2=12%; CO=1%; H2O=6%; O2=7%; N2=74%, а общее давление ее р=100 кПа.
Ответ: Rсм=281 Дж/(кг·К), υсм=0,76 м³/кг, рСО2=12 кПа, рСО=1 кПа, рН2О=6 кПа, рО2=7 кПа, рN2=74 кПа.
3.13 Массовый состав смеси следующий: CO2=18 %; O2=12 % и N2=70 %. До какого давления нужно сжать эту смесь, чтобы при t=180ºC 8 кг ее занимали объем, равный 4 м³.
Ответ: р=0,24 МПа.
3.14 Определить массовый состав газовой смеси, состоящей из углекислого газа и азота, если известно, что парциальное давление углекислого газа рСО2=120 кПа, а давление смеси рсм=300 кПа.
Ответ: mCO2=0,512, mN2=0,488.
3.15 Генераторный газ состоит из следующих объемных долей: H2=3%; CO2=17%; CO=27%; N2=53%.
Определить газовую постоянную смеси, массовые доли, кажущуюся молекулярную массу, удельный объем, плотность и парциальные давления если известна температура смеси 19ºC и давление смеси 116 кПа.
Ответ: mH2=0,002, mCO2=0,250, mCO=0,252, mN2=0,496, μсм=29,96, Rсм=277,5 Дж/(кг·К),υ=0,699 м³/кг , ρ=1,431 кг/м³, рН2=3,48 кПа, рСО2=19,72 кПа, рСО=31,32 кПа, рN2=61,48 кПа.
3.16 Смесь, состоящая из М1 киломолей азота и М2 киломолей кислорода с начальными параметрами р1=1 МПа и Т1=1000 К, расширяется до давления р2. Расширение может осуществляться по изотерме, адиабате и политропе с показателем n. Определить газовую постоянную смеси, ее массу и начальный объем, конечные параметры смеси, работу расширения, теплоту, участвующую в процессе, изменение внутренней энергии, энтальпии и энтропии. Дать сводную таблицу результатов и анализ ее. Показать процессы в pυ и Ts — диаграммах. Данные необходимые для решения задачи, выбрать из табл. 26.
Таблица 26
| Вариант | М1 | М2 | р2, МПа | n |
| кмоль | ||||
| 00 | 0,1 | 0,9 | 0,43 | 1,2 |
Указание. Показатель адиабаты, а следовательно, и теплоемкости ср и сυ следует принять постоянным, не зависящим от температуры
Ответить на вопрос: как зависит работа расширения от показателя политропы n и почему?
Варианты задачи: 01, 02, 03, 04, 05, 06, 07, 08, 09, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99.
Методические указания.pdf
3.17 Расчет газовой смеси
Газовая смесь состоит из нескольких компонентов, содержание которых в смеси задано в процентах по объему (табл.1.1).
Определить:
1) кажущуюся молекулярную массу смеси;
2) газовую постоянную смеси;
3) средние мольную, объемную и массовую теплоемкости смеси при постоянном давлении в пределах температур от t1 до t2 (табл.1.2).
1. Что называется удельной газовой постоянной? Единица ее измерения в системе СИ. Чем она отличается от универсальной газовой постоянной?
2. Что представляют собой массовая, объемная и мольная теплоемкости. Каковы единицы их измерения в системе СИ. Какова связь между указанными теплоемкостями.
3. Какие факторы влияют на величину теплоемкости.
Таблицы 1 и 2 — Исходные данные
| Вариант 00 | |||||
| Компоненты смеси по объему, % | Температура смеси | ||||
| CO2 | O2 | N2 | СО | — начальная t1, ºC | — конечная t2, ºC |
| 32 | — | 50 | 18 | 1342 | 2143 |
Пример оформления
Варианты задачи: 01, 02, 03, 04, 05, 06, 07, 08, 09, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99.
Методичка: Техническая термодинамика.pdf
Методичка: Техническая термодинамика и теплопередача.pdf
3.18 (Вариант 02) В пищеварочный котел типа КПП (котел пищеварочный паровой) емкостью V, м³, загружены продукты, состав которых задан массовыми долями gi. Коэффициент загрузки котла равен Кз. В пароводяную рубашку котла пар массой mп подводится из производственной котельной по паропроводу через редукционный (понижающий) клапан. Давление пара в паропроводе равно р0. После редукционного клапана давление пара устанавливается равным р1, степень сухости — х1. Вследствие затраты теплоты на процесс варки продукта пар конденсируется, и конденсат удаляется из пароводяной рубашки.
Определить:ρсм и ссм — среднюю плотность и среднюю массовую теплоемкость рабочей смеси;
mi — массу загружаемых продуктов в отдельности;
ri — объемные доли загружаемых продуктов;
υi, Ti — параметры состояния пара в пароводяной рубашке котла;
ii — энтальпию пара в пароводяной рубашке;
Qn — количество теплоты, отдаваемой на варку продукта;
Qk — долю теплоты, теряемую с конденсатом, %.
Исходные данные взять из табл.3 и 4 по последней и предпоследней цифрам шифра зачетной книжки.
Таблица 3
| Наименование продуктов | Массовые доли gi продуктов | Значение |
| Вода | g1 | 0,44 |
| Мясо | g2 | 0,2 |
| Кости | g3 | 0,12 |
| Овощи | g4 | 0,16 |
| Специи | g5 | 0,02 |
Таблица 4
| V, м3 | Кз | p0, Па | x1 | p1, Па | mn |
| 0,06 | 0,76 | 20·105 | 0,8 | 1,4·105 | 100 |
Варианты задачи: 27, 36, 25, 82, 33, 40, 10, 07, 34.
3.19 Газовая смесь массой m, имеющая начальную плотность 0,9 м³/кг, в ходе политропного процесса сжимается от давления 0,1 МПа до давления рк. При этом её температура достигает значения Тк.
Определить:
— удельную газовую постоянную смеси;
— показатель политропы сжатия;
— подводимую теплоту, изменение внутренней энергии и энтальпии, а также работу, совершенную газом;
— изобразить процесс сжатия на обобщенных p-υ и T-s диаграммах.
Принимаемые допущения:
— температурной зависимостью теплоемкости пренебречь;
— смесь считать идеальным двухатомным газом;
— контроль вычислений энергетических характеристик процесса выполнить по первому закону термодинамики.
Данные для расчета выбрать из таблицы 1.
Таблица 1
| Вариант | m, кг | рк, кПа | Состав смеси | tk, ºC | |||
| доли | Н2 | N2 | O2 | ||||
| 00 | 0,3 | 465 | массовые | 0,06 | 0,1 | 0,84 | 115 |
Варианты задачи: 01, 11, 12, 13, 16, 21, 22, 24, 33, 34, 36, 37, 41, 44, 50, 56, 61, 64, 74, 84, 86, 87, 88.
Методические указания.pdf
3.20 (Вариант 68) Состав газовой смеси, представляющей собой продукты сгорания топлива, задан (табл.1) объемными долями компонентов в процентах.
Определить:
1 Молекулярную массу и газовую постоянную смеси.
2 Удельный объем и плотность смеси при нормальных условиях.
3 Среднюю мольную, массовую и объемную теплоемкости смеси при постоянном давлении в интервале температур от 0 до t1,ºC и от 0 до t2,ºC.
4 Энтальпию 1 смеси при температуре t1 и t2,ºC.
5 Теплоту, отданную 1 кг смеси при изобарном охлаждении ее от t1 до t2,ºC.
Состав газовой смеси взять из табл.1 по последней цифре шифра, начальную и конечную температуру смеси — по предпоследней.
Таблица 1
| CO2, % | H2O, % | N2, % | O2, % | t1,ºC | t2,ºC |
| 12,4 | 9,6 | 72,2 | 5,8 | 800 | 300 |


























