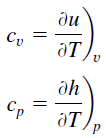MashaPutnaj
9 лет назад
Светило науки — 15179 ответов — 183972 помощи
Для одноатомного газа молярные теплоемкости вычисляются по формуле
Cp =5*R/2=5*8,31/2=20,775 Дж/К*моль
Сv= 3*R/2=3*8,31/2=12,465 ДжК*моль
Удельные теплоемкости можно найти по формуле с=С/M M=0,039948 кг/моль
cp=20,775/0,04=520 Дж/кг*К
cv=12,465/0,04=312 Дж/кг*К
(3 оценки)
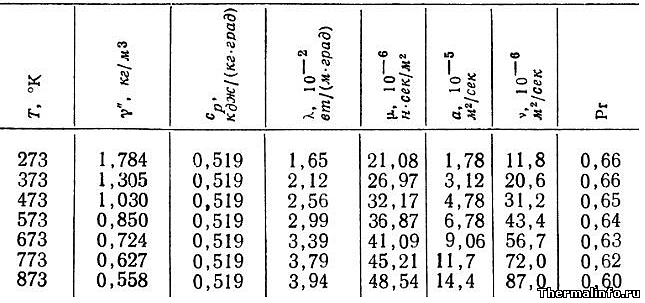
Свойства аргона (газ) при различных температурах
В таблице представлены теплофизические свойства аргона в газообразном состоянии при нормальном атмосферном давлении в зависимости от температуры.
Свойства аргона в таблице указаны при температуре от 0 до 600 °С.
Как видно по данным таблицы, с ростом температуры значения таких свойств аргона, как плотность и число Прандтля снижаются, а теплопроводность, вязкость и температуропроводность, напротив, растут.
Например, при температуре 273К (0°С) теплопроводность аргона составляет величину 0,0165 Вт/(м·град), а при температуре 600°С теплопроводность аргона увеличивается до значения 0,0394 Вт/(м·град).
В таблице приведены следующие свойства газа:
- плотность аргона, кг/м3;
- удельная (массовая) теплоемкость, кДж/(кг·град);
- коэффициент теплопроводности, Вт/(м·град);
- динамическая вязкость, Па·с;
- температуропроводность, м2/с;
- кинематическая вязкость, м2/с;
- число Прандтля.
Примечание: Будьте внимательны! Теплопроводность газа в таблице указана в степени 102. Не забудьте разделить на 100!
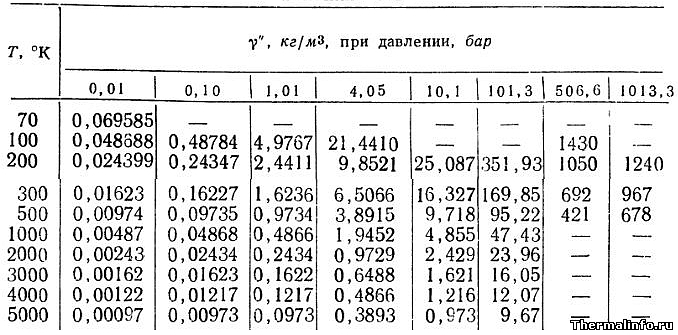
Плотность аргона при различных температурах и давлениях
В таблице указаны значения плотности аргона в газообразном состоянии при различных температурах и давлениях.
Плотность аргона в таблице указана при температуре от -203 до 4727 °С и давлении от 0,01 до 1013 атмосфер.
По данным таблицы при давлении 507 атмосфер и температуре -173 °С газообразный аргон имеет максимальную плотность 1430 кг/м3.
Минимум плотности аргона достигается при разряжении 0,01 атм. и температуре 4727 °С (плотность составляет 0,00097 кг/м3).
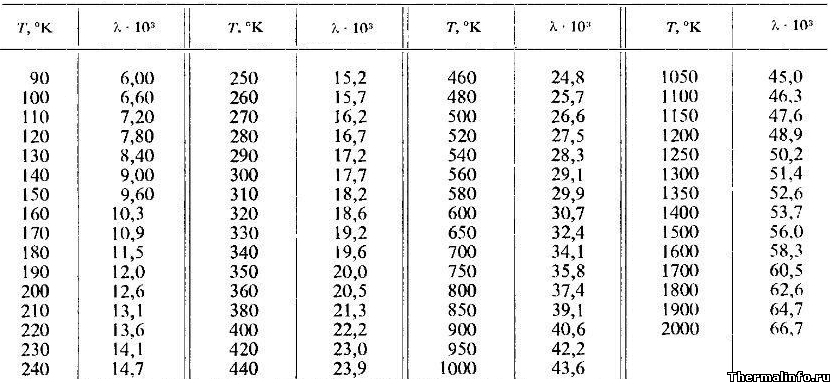
Теплопроводность аргона при различных температурах
В таблице указаны значения теплопроводности аргона в газообразном состоянии при нормальном атмосферном давлении в зависимости от температуры.
Теплопроводность в таблице указана при температуре от 90 до 2000 К.
Из таблицы следует, что теплопроводность аргона в газообразном состоянии при нормальном атмосферном давлении (1 бар) с ростом температуры также растет и достигает при 2000 К значения 0,0667 Вт/(м·град).
Примечание: Будьте внимательны! Теплопроводность аргона указана в степени 103. Не забудьте разделить на 1000!
Теплопроводность аргона в газообразном состоянии при высоких температурах
В таблице приведены значения теплопроводности аргона в газообразном состоянии при нормальном атмосферном давлении при высоких температурах.
Теплопроводность в таблице дана при температуре от 1500 до 5000 К (от 1227 до 4727 °С).
Из таблицы видно, что теплопроводность аргона при высоких температурах с ростом температуры также увеличивается и равна при 5000 К значению 0,131 Вт/(м·град).
Примечание: Будьте внимательны! Теплопроводность указана в степени 103. Не забудьте разделить на 1000!
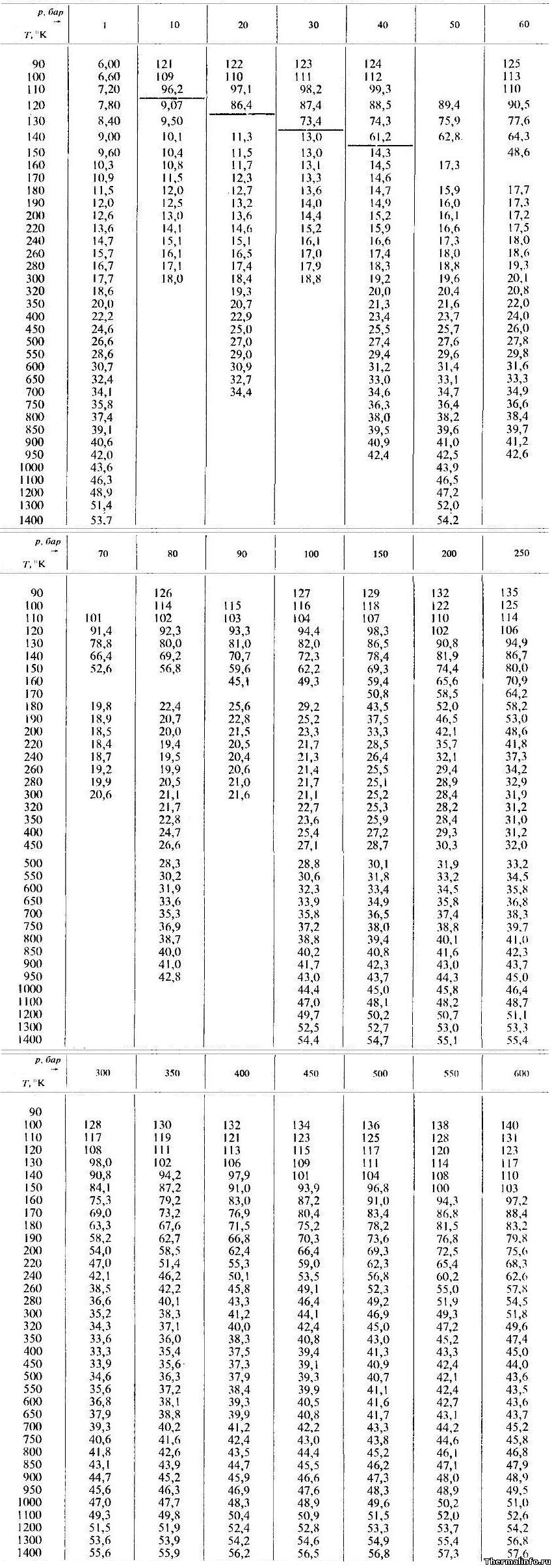
Теплопроводность аргона при различных температурах и давлениях
В таблице даны значения теплопроводности аргона в жидком и газообразном состояниях при различных температурах и давлениях.
Теплопроводность указана при температуре от 90 до 1400 К и давлении от 1 до 600 атмосфер.
По данным таблицы максимальная теплопроводность аргона достигается при давлении 600 бар и температуре 100 К (теплопроводность равна 0,14 Вт/(м·град)).
Примечание: Будьте внимательны! Теплопроводность указана в степени 103. Не забудьте разделить на 1000!
Теплопроводность жидкого аргона на линии насыщения
В таблице представлены значения теплопроводности аргона в жидком состоянии на линии насыщения.
Теплопроводность аргона в таблице указана при температуре от 90 до 150 К.
Значение теплопроводности жидкого аргона на линии насыщения с повышением температуры снижается.
Примечание: Будьте внимательны! Теплопроводность в таблице указана в степени 103. Не забудьте разделить на 1000!
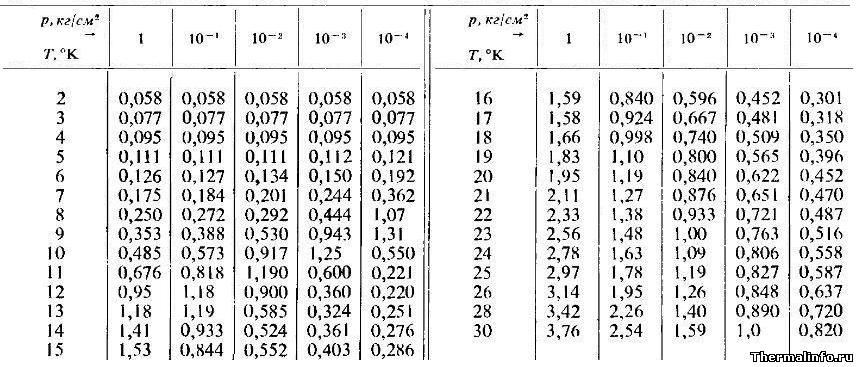
Теплопроводность аргона при низких температурах и давлениях
В таблице представлены значения теплопроводности аргона в ионизированном состоянии при сверхнизкой температуре и давлении (разряжении)
Теплопроводность в таблице дана в размерности ккал/(м·час·град) при температуре от 2 до 30 К и разряжении до 0,0004 атмосферы.
По данным таблицы видно, что максимальная теплопроводность ионизированного аргона равна 3,76 ккал/(м·час·град).
1. Варгафтик Н.Б. Справочник по теплофизическим свойствам газов и жидкостей.
2. Чиркин В.С. Теплофизические свойства материалов ядерной техники.
2023-05-08
В баллоне находятся аргон и азот. Определить удельную теплоемкость $C_{V}^{уд}$ смеси этих газов, если массовые доли аргона и азота одинаковы и равны $alpha = 0,5$. Молярная масса аргона $mu_{1} = 0,04 кг/моль$, молярная масса азота $mu_{2} = 0,028 кг/моль$.
Решение:
Пусть при изохорическом процессе смеси газов сообщена теплота $delta Q_{см}$, тогда:
$delta Q_{см} = delta Q_{1} + delta Q_{2}$,
где $delta Q_{1}$ — теплота, сообщенная аргону, $delta Q_{2}$ — теплота, сообщенная азоту.
Исходя из определения удельной и молярной теплоёмкостей:
$delta Q = m c^{уд} dT$
$delta Q = nu c^{мол} dT$
Запишем: $m_{см} c_{ V_{см}}^{уд} dT = frac{m_{1}}{ mu_{1}} c_{C_{1}}^{мол} dT + frac{m_{2}}{ mu_{2}} c_{V_{2}}^{мол} dT$,
где $m_{1} = m_{2} = alpha m_{см}$ — массы apгoнa и азота $m_{см}$ — масса смеси газов. $c_{V}^{мол} = frac{i}{2} R$ — молярная теплоемкость при $V = const$. $i$ — число степеней свободы молекулы, для аргона $i_{1} =3$, для азота $i_{2} = 5$.
$m_{см} c_{V_{см}}^{уд} = frac{ alpha m_{см}}{ mu{1} } frac{ i_{1}}{2} R + frac{ alpha m_{см} }{ mu_{2} } frac{i_{2}}{2}R$
$c_{V_{см}}^{уд} = frac{ alpha R}{2} left [ frac{ i_{1}}{ mu_{1}} + frac{i_{2}}{ mu_{2} } right ]$.
$c_{V_{см}}^{уд} = frac{0,5 cdot 8,31}{2} left [ frac{3}{0,04} + frac{5}{0,028} right ] = 2,11 cdot 10^{3} frac{Дж}{кг}$.
Найти молярные и удельные теплоемкости аргона при постоянном давлении и объеме.
Найди верный ответ на вопрос ✅ «Найти молярные и удельные теплоемкости аргона при постоянном давлении и объеме. …» по предмету 📙 Физика, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Физика » Найти молярные и удельные теплоемкости аргона при постоянном давлении и объеме.
Specific heat of Argon is 0.52 J/g K.
Latent Heat of Fusion of Argon is 1.188 kJ/mol.
Latent Heat of Vaporization of Argon is 6.447 kJ/mol.

Specific Heat
Specific heat, or specific heat capacity, is a property related to internal energy that is very important in thermodynamics. The intensive properties cv and cp are defined for pure, simple compressible substances as partial derivatives of the internal energy u(T, v) and enthalpy h(T, p), respectively:
where the subscripts v and p denote the variables held fixed during differentiation. The properties cv and cp are referred to as specific heats(or heat capacities) because under certain special conditions, they relate the temperature change of a system to the amount of energy added by heat transfer. Their SI units are J/kg.K or J/mol K.
Different substances are affected to different magnitudes by the addition of heat. When a given amount of heat is added to different substances, their temperatures increase by different amounts.
Heat capacity is an extensive property of matter, meaning it is proportional to the size of the system. Heat capacity C has the unit of energy per degree or energy per kelvin. When expressing the same phenomenon as an intensive property, the heat capacity is divided by the amount of substance, mass, or volume. Thus the quantity is independent of the size or extent of the sample.
Latent Heat of Vaporization
In general, when a material changes phase from solid to liquid or from liquid to gas, a certain amount of energy is involved in this change of phase. In the case of liquid to gas phase change, this amount of energy is known as the enthalpy of vaporization (symbol ∆Hvap; unit: J), also known as the (latent) heat of vaporization or heat of evaporation. As an example, see the figure, which describes the phase transitions of water.
Latent heat is the amount of heat added to or removed from a substance to produce a phase change. This energy breaks down the attractive intermolecular forces and must provide the energy necessary to expand the gas (the pΔV work). When latent heat is added, no temperature change occurs. The enthalpy of vaporization is a function of the pressure at which that transformation takes place.
Latent Heat of Fusion
In the case of solid to liquid phase change, the change in enthalpy required to change its state is known as the enthalpy of fusion (symbol ∆Hfus; unit: J), also known as the (latent) heat of fusion. Latent heat is the amount of heat added to or removed from a substance to produce a phase change. This energy breaks down the attractive intermolecular forces and must provide the energy necessary to expand the system (the pΔV work).
The liquid phase has higher internal energy than the solid phase. This means energy must be supplied to a solid to melt it. Energy is released from a liquid when it freezes because the molecules in the liquid experience weaker intermolecular forces and have higher potential energy (a kind of bond-dissociation energy for intermolecular forces).
The temperature at which the phase transition occurs is the melting point.
When latent heat is added, no temperature change occurs. The enthalpy of fusion is a function of the pressure at which that transformation takes place. By convention, the pressure is assumed to be 1 atm (101.325 kPa) unless otherwise specified.
Argon – Properties
| Element | Argon |
|---|---|
| Atomic Number | 18 |
| Symbol | Ar |
| Element Category | Noble Gas |
| Phase at STP | Gas |
| Atomic Mass [amu] | 39.948 |
| Density at STP [g/cm3] | 1.784 |
| Electron Configuration | [Ne] 3s2 3p6 |
| Possible Oxidation States | 0 |
| Electron Affinity [kJ/mol] | — |
| Electronegativity [Pauling scale] | — |
| 1st Ionization Energy [eV] | 15.7596 |
| Year of Discovery | 1894 |
| Discoverer | Ramsay, Sir William & Strutt, John (Lord Rayleigh) |
| Thermal properties | |
| Melting Point [Celsius scale] | -189.2 |
| Boiling Point [Celsius scale] | -185.7 |
| Thermal Conductivity [W/m K] | 0.01772 |
| Specific Heat [J/g K] | 0.52 |
| Heat of Fusion [kJ/mol] | 1.188 |
| Heat of Vaporization [kJ/mol] | 6.447 |
Argon in Periodic Table
| Hydrogen1H | Helium2He | ||||||||||||||||||
| Lithium3Li | Beryllium4Be | Boron5B | Carbon6C | Nitrogen7N | Oxygen8O | Fluorine9F | Neon10Ne | ||||||||||||
| Sodium11Na | Magnesium12Mg | Aluminium13Al | Silicon14Si | Phosphorus15P | Sulfur16S | Chlorine17Cl | Argon18Ar | ||||||||||||
| Potassium19K | Calcium20Ca | Scandium21Sc | Titanium22Ti | Vanadium23V | Chromium24Cr | Manganese25Mn | Iron26Fe | Cobalt27Co | Nickel28Ni | Copper29Cu | Zinc30Zn | Gallium31Ga | Germanium32Ge | Arsenic33As | Selenium34Se | Bromine35Br | Krypton36Kr | ||
| Rubidium37Rb | Strontium38Sr | Yttrium39Y | Zirconium40Zr | Niobium41Nb | Molybdenum42Mo | Technetium43Tc | Ruthenium44Ru | Rhodium45Rh | Palladium46Pd | Silver47Ag | Cadmium48Cd | Indium49In | Tin50Sn | Antimony51Sb | Tellurium52Te | Iodine53I | Xenon54Xe | ||
| Caesium55Cs | Barium56Ba | Lanthanum57La | Hafnium72Hf | Tantalum73Ta | Tungsten74W | Rhenium75Re | Osmium76Os | Iridium77Ir | Platinum78Pt | Gold79Au | Mercury80Hg | Thallium81Tl | Lead82Pb | Bismuth83Bi | Polonium84Po | Astatine85At | Radon86Rn | ||
| Francium87Fr | Radium88Ra | Actinium89Ac | Rutherfordium104Rf | Dubnium105Db | Seaborgium106Sg | Bohrium107Bh | Hassium108Hs | Meitnerium109Mt | Darmstadtium110Ds | Roentgenium111Rg | Copernicium112Cn | Nihonium113Nh | Flerovium114Fl | Moscovium115Mc | Livermorium116Lv | Tennessine117Ts | Oganesson118Og | ||
| Cerium58Ce | Praseodymium59Pr | Neodymium60Nd | Promethium61Pm | Samarium62Sm | Europium63Eu | Gadolinium64Gd | Terbium65Tb | Dysprosium66Dy | Holmium67Ho | Erbium68Er | Thulium69Tm | Ytterbium70Yb | Lutetium71Lu | ||||||
| Thorium90Th | Protactinium91Pa | Uranium92U | Neptunium93Np | Plutonium94Pu | Americium95Am | Curium96Cm | Berkelium97Bk | Californium98Cf | Einsteinium99Es | Fermium100Fm | Mendelevium101Md | Nobelium102No | Lawrencium103Lr | ||||||
–
–
–