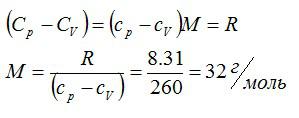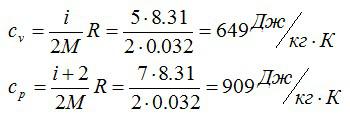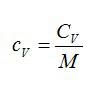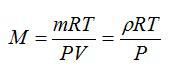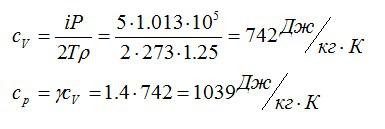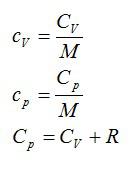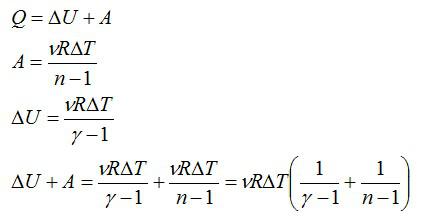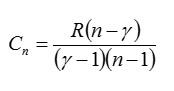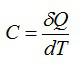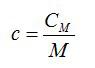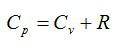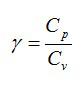Решение задач дело полезное, но не всегда интересное. Чтобы вы справлялись с решением задач по теме «Теплоемкость идеального газа» быстрее, приведем здесь несколько примеров и вопросов с объяснениями.
Подписывайтесь на наш телеграм-канал, чтобы получать полезную и интересную рассылку.
Задачи по теме «Теплоемкость идеального газа» с решениями
Повторение и практика – залог успеха в любом деле. И решение задач не исключение. Поэтому не забываем держать под рукой памятку по задачам и полезные формулы
Задача №1. Определить удельную теплоемкость идеального газа
Условие
Определить молярную массу M двухатомного газа и его удельные теплоемкости, если известно, что разность cр — cv удельных теплоемкостей этого газа равна 260 Дж/(кг*К)
Решение
По определению:
Значит, газ из задачи – кислород. Если кто не понял, как это определяется, учитесь пользоваться таблицей Менделеева.
Считаем удельные теплоемкости:
Ответ: 32 г/моль; 649 Дж/кг*К; 909 Дж/кг*К.
Задача №2. Удельная теплоемкость
Условие
Плотность некоторого газа при нормальных условиях ρ = 1,25 кг/м3. Отношение удельных теплоемкостей γ = 1,4. Определить удельные теплоемкости cv и сp этого газа.
Решение
Исходя из отношения удельных теплоемкостей, можно сделать вывод, что газ – двухатомный, i=5. При постоянном объеме удельная теплоемкость равна:
Молярную массу можно найти из уравнения Клапейрона-Менделеева:
Отсюда:
Ответ: 742 Дж/кг*К; 1039 Дж/кг*К.
Задача №3. Молярная теплоемкость
Условие
Вычислить молярные теплоемкости газа, зная, что его молярная масса М = 4∙10 3 кг/моль и отношение удельных теплоемкостей ср/сv = 1,67.
Решение
Удельные теплоемкости равны:
Можно найти:
Ответ: 12,4 Дж/моль*К; 20,71 Дж/моль*К
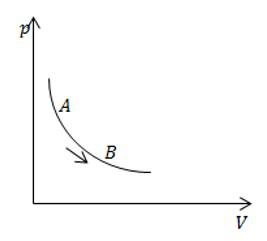
Задача №4. Теплоемкость при изопроцессах
Условие
На рисунке изображен изотермический процесс с газом постоянной массы. Сравните теплоемкость в процессе АВ с теплоемкостью этой же массы газа в изохорном процессе.
Решение
Теплоемкость при изохорном процессе является постоянной величиной. При изотермическом процесса она равна бесконечности. Значит, теплоемкость в процессе АВ больше.
Ответ: Теплоемкость в процессе АВ больше.
Задача №5. Теплоемкость при политропическом процессе
Условие
Найдите молярную теплоемкость идеального газа при политропическом процессе pVn = const, если показатель адиабаты газа равен γ. При каких значениях показателя политропы n теплоемкость газа будет отрицательной?
Решение
Запишем первое начало термодинамики, выражения для работы и изменения внутренней энергии в политропическом процессе соответственно:
Если количество вещества и изменение температуры принять равными единице, это выражение будет равно молярной теплоемкости (по определению теплоемкости):
Ответ: см. выражение выше.
Вопросы по теме «Теплоемкость идеального газа»
Вопрос 1. Что такое теплоемкость идеального газа?
Ответ. Когда газу сообщается определенное количество теплоты, меняется его температура.
Отношение количества теплоты, сообщенного газу, к изменению его температуры, называется теплоемкостью идеального газа.
Вопрос 2. Что такое молярная и удельная теплоемкость идеального газа?
Ответ. Молярная и удельная теплоемкости активно используются в термодинамике. Молярная теплоемкость – это теплоемкость одного моля вещества.
Удельная теплоемкость – теплоемкость единичной массы вещества.
Вопрос 3. Как определяется теплоемкость газа при изопроцессах?
Ответ.
При изотермическом процессе T=const. Теплоемкость равна плюс/минус бесконечности.
При адиабатном процессе нет теплообмена с окружающей средой, теплоемкость равна нулю.
При изохорном процессе газ не совершает работы, а теплоемкость равна:
Здесь i – количество степеней свободы молекул газа. Для одноатомных газов i=3, для двухатомных i=5.
При изобарном процессе теплоемкость определяется соотношением Мейера:
Вопрос 4. Как еще связаны теплоемкости при постоянном давлении и постоянном объеме?
Ответ. Отношение теплоемкостей при постоянном давлении и постоянном объеме обозначается греческой буквой «гамма» и называется показателем адиабаты.
Вопрос 5. Как называются процессы, в которых теплоемкость газа остается неизменной?
Ответ. Такие процессы называются политропными. Адиабатный процесс – частный случай политропного процесса.
Теплоемкость реального газа не равна теплоемкости идеального газа и может сильно отличаться.
Нужна помощь в решении задач и выполнении других заданий? Специальный студенческий сервис готов оказать ее!
Молярная и удельная теплоемкость газа.
Молярная
теплоемкость
Молярная
теплоемкость — теплоемкость 1 моля
идеального газа.
Теплоемкость
идеального газа в изопроцессах
Адиабатический
В
адиабатическом процессе теплообмена
с окружающей средой не происходит, то
есть
.
При изменении объема температура и
давление меняются, то есть
.
Следовательно, теплоемкость идеального
газа в адиабатическом процессе также
равна нулю: Садиаб=0.
Изотермический
В
изотермическом процессе постоянна
температура, то есть
.
При изменении объема газу передается
(или отбирается) некоторое количество
тепла. Следовательно, теплоемкость
идеального газа стремится к бесконечности:
Изохорный
В
изохорическом процессе постоянен объем,
то есть
.
Элементарная работа газа равна
произведению изменения объема на
давление, при котором происходит
изменение (δA =
δVP).
Первое Начало Термодинамики для
изохорического процесса имеет вид:
А
для идеального газа
Таким
образом,
где i —
число степеней свободы частиц газа.
Изобарный
В
изобарном процессе (
):
CP=δQ/νΔT=CV+R=((i+2)/2)*R
Уде́льная
теплоёмкость (Удельная
теплота нагревания на один градус,
обозначается как c)
вещества определяется как
количество тепловой энергии,
необходимой для
повышениятемпературы одного килограмма вещества
на один градус.
Единицей СИ для
удельной теплоёмкости
является Джоуль на килограмм—Кельвин.
Следовательно, удельную теплоёмкость
можно рассматривать
как теплоёмкость единицы массывещества.
На значение удельной теплоёмкости
влияет температура вещества. К примеру,
измерение удельной теплоёмкости воды
даст разные результаты при 20 °C и
60 °C.
Формула
расчёта удельной теплоёмкости:
,
где
—
удельная теплоёмкость,
— количество
теплоты,
полученное веществом при нагреве (или
выделившееся при охлаждении),
—
масса нагреваемого (охлаждающегося)
вещества,
—
разность конечной и начальной температур
вещества.
Связь
Cv
и Cp:
т.
е. молярная теплоемкость газа при
постоянном объеме СV равна
изменению внутренней энергии одного
моль газа при повышении его температуры
на 1 К. Поскольку Um=(i/2)RT
, то
(5)
Если
газ нагревается при постоянном давлении,
то выражение (3) можно представить в
виде
Учитывая,
что (Um/dT)
не зависит от вида процесса (внутренняя
энергия идеального газа не зависит ни
от p, ни от V, а определяется лишь
температурой Т) и всегда равна СV (см.
(4)), и дифференцируя уравнение Клапейрона
— Менделеева pVm=RT
(42.4) по T (p=const), получаем
(6)
Выражение
(6) называется уравнением
Майера;
оно говорит о том, что Сp всегда
больше СV ровно
на величину молярной газовой постоянной.
Это объясняется тем, чтобы осуществить
нагревание газа при постоянном давлении
требуется еще дополнительное количество
теплоты на совершение работы расширения
газа, так как постоянство давления
обеспечивается увеличением объема
газа. Использовав (5), формулу (6) можно
записать в виде
(7)
При
исследовании термодинамических процессов
важно знать характерное для каждого
газа отношение Сp к
СV :
(8)
Из
формул (5) и (7) следует, что молярные
теплоемкости зависят лишь от числа
степеней свободы и не зависят от
температуры. Это утверждение
молекулярно-кинетической теории
справедливо в довольно широком интервале
температур лишь для одноатомных газов.
Уже у двухатомных газов число степеней
свободы, которое проявляется в
теплоемкости, зависит от температуры.
Молекула двухатомного газа обладает
тремя поступательными, двумя вращательными
и одной колебательной степенями
свободы.
По
закону равномерного распределения
энергии по степеням свободы, для комнатных
температур СV =
(7/2)R. Из качественной экспериментальной
зависимости молярной теплоемкости
СV водорода
(рис. 1) следует, что СV следующим
образом зависит от температуры: при
низкой температуре (≈50 К) СV =
(3/2)R, при комнатной — CV =
(5/2)R (вместо расчетных (7/2)R) и при очень
высокой — СV=
(7/2)R. Это можно объяснить, сделав
предположение, что при низких температурах
наблюдается только поступательное
движение молекул, при комнатных —
добавляется их вращение, а при высоких
— к данным двум видам движения добавляются
еще колебания молекул.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Теплоемкости при постоянном давлении и постоянном объеме
При сообщении телу некоторого количества теплоты изменяется его температура (за исключением агрегатных превращений и вообще изотермических процессов). Характеристиками такого изменения являются различные теплоемкости: теплоемкость тела CT, удельная теплоемкость вещества c, молярная теплоемкость C.
Понятия теплоемкости тела и удельной теплоемкости рассмотрены тут.
Молярная теплоемкость C — величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
(~C = frac{Q}{nu Delta T} . qquad (1))
Единицей молярной теплоемкости в СИ является джоуль на моль-Кельвин (Дж/моль·К).
Удельная теплоемкость связана с молярной соотношением
(~C = cM. )
В отличие от такой, например, характеристики вещества, как его молекулярная масса Mr удельная теплоемкость вещества не является неизменным параметром. Удельная теплоемкость может резко изменяться при переходе вещества из одного агрегатного состояния в другое. Так, вода в газообразном состоянии имеет удельную теплоемкость 2,2·103 Дж/кг·К а в жидком 4,19·103 Дж/кг·К .
Теплоемкость зависит и от условий, при которых происходит передача теплоты телу. Последнее особенно относится к газам. Например, при изотермическом расширении газа ему передается некоторое количество теплоты Q > 0, а ΔΤ = 0. Следовательно, удельная теплоемкость газа при изотермическом процессе
(~c = frac{Q}{m Delta T} to infty .)
При адиабатном сжатии (расширении) газ не получает теплоты и не передает ее окружающим телам (Q = 0), а температура газа изменяется (ΔΤ ≠ 0). Следовательно, удельная теплоемкость газа при адиабатном процессе
(~c = frac{Q}{m Delta T} = 0 .)
Наибольший интерес представляет теплоемкость для случаев, когда нагревание происходит при постоянном объеме или при постоянном давлении. В первом случае теплоемкость называется теплоемкостью при постоянном объеме или изохорной теплоемкостью (cV, CV), во втором — теплоемкостью при постоянном давлении или изобарной теплоемкостью (cp, Cp).
Если объем не изменяется (ΔV = 0), то работа, совершенная газом, так же равна нулю (А = 0). Согласно первому закону термодинамики
(~Q = Delta U) и (~C_{TV} = frac{Delta U}{Delta T},)
Откуда
(~Delta U = C_{TV} cdot Delta T = c_V m Delta T . qquad (2))
Следовательно, теплоемкость при постоянном объеме равна изменению внутренней энергии газа при изменении температуры на 1 К.
Если газ идеальный, то в формуле (2)
(~Delta U = frac i2 frac mM R Delta T .)
Тогда молярная теплоемкость при постоянном объеме (~C_V = frac{Delta U_M}{Delta T}), где (~Delta U_M = frac i2 R Delta T) — изменение внутренней энергии 1 моль газа. Из этих равенств теплоемкость газа при постоянном объеме — (~C_{TV} = frac i2 frac mM R); молярная теплоемкость газа при постоянном объеме — (~C_V = frac i2 R).
Если газ нагревается при постоянном давлении, то согласно первому закону термодинамики
(~Q = Delta U + A,)
где (~A = p Delta V = frac mM R Delta T).
Тогда теплоемкость газа при постоянном давлении
(~C_{Tp} = frac{Q}{Delta T} = frac{Delta U}{Delta T} + frac mM R = C_{TV} + frac mM R = frac{i + 2}{i} frac mM R .)
Молярная теплоемкость при постоянном давлении:
(~C_p = C_V + R) — уравнение Майера;
(~C_p = frac i2 R + R = frac{i + 2}{i} R .)
Таким образом, теплоемкость при постоянном давлении всегда больше теплоемкости при постоянном объеме. Их отношение равно
(~gamma = frac{C_p}{C_V} = frac{i + 2}{i} .)
где γ — показатель адиабаты (коэффициент Пуассона).
Из-за малости величины коэффициента объемного расширения твердых и жидких тел работой, совершаемой ими при нагревании при постоянном давлении, можно пренебречь и считать, что теплоемкости при постоянном объеме и постоянном давлении практически совпадают. Поэтому теплоемкость твердых и жидких тел при заданной температуре может считаться вполне определенной величиной.
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 159-161.
Download Article
Download Article
Specific heat is the amount of energy required to raise one gram of a pure substance by one degree Centigrade. The specific heat of a substance is dependent on both its molecular structure and its phase. The discovery of specific heat sparked the studies of thermodynamics, the study of energy conversion involving heat and the work of a system. Specific heat and thermodynamics are used extensively in chemistry, nuclear engineering, and aerodynamics, as well as in everyday life in the radiator and cooling system of a car. If you want to know how to calculate specific heat, just follow these steps.
Calculation Help
-
1
Become familiar with the terms that are used for calculating specific heat. It’s important to be familiar with the terms that are used for calculating specific heat before you learn the formula for specific heat. You’ll need to know how to recognize the symbol for each term and to understand what it means. Here are the terms that are commonly used in the equation for calculating the specific heat of a substance:[1]
- Delta, or the «Δ» symbol, represents the change in a variable.
- For example, if your first temperature (T1) is 150ºC, and your second temperature (T2) is 20ºC, then ΔT, or the change in temperature, represents 150ºC — 20ºC, or 130ºC.
- The mass of the sample is represented by «m».
- The amount of heat is represented by «Q». The amount of heat is represented by «J», or Joules.
- «T» is the temperature of the substance.
- Specific heat is represented by «Cp«.
- Delta, or the «Δ» symbol, represents the change in a variable.
-
2
Learn the equation for specific heat. Once you become familiar with the terms used for calculating specific heat, you should learn the equation for finding the specific heat of a substance.[2]
The formula is: Cp = Q/mΔT.- You can manipulate this formula if you want to find the change in the amount of heat instead of the specific heat. Here’s what it would look like:
- ΔQ = mCpΔT
- You can manipulate this formula if you want to find the change in the amount of heat instead of the specific heat. Here’s what it would look like:
Advertisement
-
1
Study the equation. First, you should look at the equation to get a sense of what you need to do to find the specific heat. Let’s look at this problem: Find the specific heat of 350 g of an unknown material when 34,700 Joules of heat are applied, and the temperature rises from 22ºC to 173ºC with no phase change.
-
2
List the known and unknown factors. Once you’re comfortable with the problem, you can write down each known and unknown variable to have a better sense of what you’re working with. Here’s how you do it:[3]
- m = 350 g
- Q = 34,700 Joules
- ΔT = 173ºC — 22ºC = 151ºC
- Cp = unknown
-
3
Plug the known factors into the equation. You know the value of everything except «Cpc», so you should plug the rest of the factors into the original equation and solve for «Cp«, Here’s how you do it:[4]
- Original equation: Cp = Q/mΔT
- c = 34,700 J/(350 g x 151ºC)
-
4
Solve the equation. Now that you’ve plugged the known factors into the equation, just do simple arithmetic to solve it.[5]
The specific heat, or final answer, is 0.65657521286 J/(g x ºC).- Cp = 34,700 J/(350 g x 151ºC)
- Cp = 34,700 J/(52850 g x ºC)
- Cp = 0.65657521286 J/(g x ºC)
Advertisement
Add New Question
-
Question
How do I calculate specific heat when no temperature is given?
That’s not possible. Q=mass × specific heat capacity x temperature is the formula, temperature cannot be removed from the equation.
-
Question
How do I find the heat of a spice?
Look your spice up on the Scoville scale — it measures the pungency of spicy foods. A bell pepper is 0 on the scale. A mild jalapeno is about 3000, and a hot one is ~10000. Tabasco is around 30000, and a habanero can reach 350000.
-
Question
If 200 grams of water is to be heated from 24.0 degrees to 100.0 degrees to make a cup of tea, how much heat must be added?
Q = C x m x dT
Q = 4.18 x 0.2 x (100 — 24)
Q = 73.112 J/g.C
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Video
-
A calorimeter may sometimes be used with a heat transfer during a physical or chemical change.
-
When solving for specific heat, cross out units when possible.
-
Temperature changes are greater in materials with low specific heat when all other things are equal.
Show More Tips
Thanks for submitting a tip for review!
Advertisement
About This Article
Article SummaryX
To calculate specific heat, start by reading the problem carefully, then write down each known and unknown variable to get a better sense of what you’re working with. Next, plug the known factors into the specific heat equation, then solve the equation as you normally would to get your answer! To learn more about the fundamentals of specific heat, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 916,433 times.