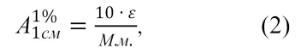Спектроскопические
методы анализа основаны на избирательном
поглощении (абсорбции) электромагнитного
излучения анализируемым веществом. В
фармацевтическом анализе они используются
для установления структуры, идентификации,
оценки чистоты, количественного
определения светопоглощающих веществ.
Существующая в
настоящее время аппаратура позволяет
использовать для аналитических целей
следующие диапазоны длин волн:
ультрафиолетовый (190–380 нм), видимый
(380–780 нм), инфракрасный (780–40000 нм или
0,78–400 мкм).
В зависимости от
используемой аппаратуры, регистрируемого
физико-химического эффекта (поглощение
или испускание электромагнитного
излучения) и области спектра различаются
следующие спектроскопические методы:
♦ спектрофотометрия
в ультрафиолетовой (УФ) и видимой области;
♦ спектрофотометрия
в инфракрасной (ИК) области;
♦ атомно-эмиссионная
и атомно-адсорбционная спектроскопия
(АЭС и ААС);
♦ флуориметрия;
♦ спектроскопия
ядерного магнитного резонанса (ЯМР).
Каждый из указанных
методов имеет свои варианты использования
в фармацевтическом анализе.
В данном разделе
будут рассмотрены варианты использования
в фармацевтическом анализе методов
спектрофотометрии в ультрафиолетовой
(УФ) и видимой области, так называемые
фотометрические методы.
Фотометрические
методы базируются на измерении
собственного поглощения фармацевтических
субстанций (ЛВ), обусловленного наличием
в них хромофорных групп, или поглощения
продуктов реакции фармацевтических
субстанций с определенными реактивами,
связанного с возникновением хромофорных
групп в результате различных химических
превращений.
В группе
фотометрических методов различаются:
– спектрофотометрия
(анализ по поглощению монохроматического
излучения) в ультрафиолетовой (УФ) и
видимой области;
– колориметрия и
фотоколориметрия (анализ по поглощению
немонохроматического излучения) в
видимой области.
Поглощение света
раствором того или иного ЛВ зависит от
многих факторов: природы вещества,
природы растворителя, концентрации
вещества в растворе, длины волны падающего
света. В то же время влияние всех этих
факторов может быть упорядочено, сведено
к ряду отдельных зависимостей и выражено
определенной математической
зависимостью:
(3.18)
где I
– интенсивность светового потока после
прохождения через раствор; I0
– интенсивность
падающего светового потока; l
– толщина
слоя, см; С
– концентрация (% или моль/л); κ
– показатель светопоглощения раствора
при концентрации растворенного вещества,
равной единице.
Это
соотношение известно как основой закон
светопоглощения Бугера-Ламберта-Бера.
Он лежит в основе большинства
фотометрических методов анализа и
формулируется следующим образом:
«Интенсивность
монохроматического светового потока,
прошедшего через раствор, пропорциональна
интенсивности падающего светового
потока и зависит от концентрации
окрашенного вещества и толщины слоя
раствора».
После
преобразований и логарифмирования
уравнение 3.19 выражается следующей
математической зависимостью:
(3.19)
где А
– оптическая плотность раствора; l
– толщина поглощающего слоя, см; С
– концентрация раствора, % или моль/л.
При соблюдении
основного закона светопоглощения
оптическая плотность раствора
пропорциональна коэффициенту
светопоглощения, концентрации поглощающего
вещества и толщине слоя раствора.
Отклонения от
закона Бугера-Ламберта-Бера вызывают:
• нелинейная
зависимость показаний прибора от
интенсивности светового потока;
• немонохроматичность
используемого светового потока;
• непостоянство
температуры в процессе измерений;
• кислотно-основное
взаимодействие, диссоциация, ассоциация,
полимеризация, изменение рН среды с
изменением концентрации определяемой
фармацевтической субстанции и другие
процессы, происходящие в анализируемой
системе.
Графически закон
Бугера-Ламберта-Бера выражается прямой
линией (рис.1,
кривая 1), проходящей через начало
координат при отсутствии светопоглощения
растворителем и систематических ошибок.
Графическая зависимость позволяет
выявить пределы подчинения светопоглощения
растворов исследуемых веществ закону
Бугера-Ламберта-Бера. При несоблюдении
закона прямолинейность нарушается на
каком-либо участке или на всей прямой
(рис. 1,
кривые 2,3).
Рисунок 1 –
Зависимость оптической плотности от
концентрации раствора (градуировочный
график) при соблюдении закона
Бугера–Ламберта–Бера (1); при положительном
(2) и отрицательном (3) отклонении от него
Согласно данным
литературы, относительная погрешность
определения индивидуальных соединений
методом спектрофотометрии не превышает
2%, фотоколориметрии – 3%. Более высокая
точность спектрофотомерии по сравнению
с фотоколориметрией обусловлена, в
основном, монохроматичностью используемого
электромагнитного излучения.
Преобразования
уравнения основного закона (3.19) позволяют
вывести значение некоторых фотометрических
величин.
Отношение
интенсивности светового потока,
прошедшего через раствор, к интенсивности
падающего светового потока называется
пропусканием
и обозначается Т
(%):
(3.20)
Величину
Т, отнесенную к толщине слоя в 1 см,
называют коэффициентом
пропускания
(1/Т).
Логарифм величины,
обратной пропусканию, называют погашением
или оптической
плотностью и
обозначают буквой А
(Аbsorbtion):
(3.21)
где
– коэффициент поглощения, физический
смысл которого может быть выведен из
уравнения:
(3.22)
где
– специфическая
физическая константа для каждого
индивидуального вещества при строго
определенных условиях; используется
для идентификации, оценки степени
чистоты и количественного определения.
Если
концентрация исследуемого раствора
(С) равна 1 М/л, а толщина поглощающего
слоя (l) – 1 см, то:
(3.23)
где
– молярный коэффициент поглощения –
оптическая плотность 1 молярного
раствора, помещенного в кювету с толщиной
слоя 1 см.
Если концентрация
исследуемого раствора (С) равна 1%,
толщина поглощающего слоя (l) – 1 см, то:
(3.24)
где
– удельный показатель поглощения –
оптическая плотность 1% раствора,
помещенного в кювету с толщиной слоя 1
см.
Молярный и
удельный показатели поглощения
зависят от природы вещества, природы
растворителя, длины волны проходящего
света, температуры раствора. Удельный
и молярный показатели поглощения
определяют экспериментально.
Оптическая
плотность раствора
зависит, наряду с указанными выше
факторами, от концентрации раствора и
толщины слоя растворенного вещества
(толщины кюветы). Согласно указаниям ГФ
оптическую плотность растворов следует
измерять при температуре (20±1)0С.
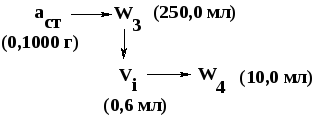
ПРИМЕР:
Рассчитайте значение удельного показателя
поглощения фурадонина (нитрофурантоина),
если 0,1000 г субстанции растворили в 2,5
мл 1 М раствора натрия гидроксида в
мерной колбе вместимостью 100 мл, довели
водой до метки, перемешали (стандартный
раствор).
Из полученного
раствора приготовили серию стандартных
разведений: в мерную колбу вместимостью
100 мл вносили последовательно 0,6 мл
стандартного раствора, доводили водой
до метки, перемешивали.
Оптические плотности
(Аi)
полученных растворов, измеренные на
спектрофотометре (фотоколориметре)
относительно воды при длине волны 445 нм
в кювете с толщиной слоя 1,0 см, составили:
0,280; 0,276; 0,284; 0,282; 0,280; 0,278.
РЕШЕНИЕ:
Предварительно рассчитывают концентрацию
(С,%) стандартного разведения. Для этого
пользуются схемой приготовления
стандартного разведения:
Удельный показатель
поглощения рассчитывают по формуле
3.24. Значения удельного показателя
поглощения для каждого стандартного
разведения приведены в таблице 3.3.
Таблица 3.3 —
Значения удельного показателя поглощения
фурадонина
|
V, |
С,% |
А |
|
|
|
0,6 |
6∙10-4 |
0,280 |
466,67 |
466,666 = 466,7 |
|
0,6 |
6∙10-4 |
0,276 |
460,00 |
|
|
0,6 |
6∙10-4 |
0,284 |
473,33 |
|
|
0,6 |
6∙10-4 |
0,282 |
470,00 |
|
|
0,6 |
6∙10-4 |
0,280 |
466,67 |
|
|
0,6 |
6∙10-4 |
0,278 |
463,33 |
ОТВЕТ:
Удельный
показатель поглощения фурадонина
(нитрофурантоина) равен 466,7.
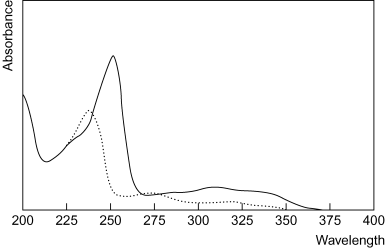
Вещество поглощает
электромагнитное излучение избирательно.
Зависимость оптической плотности
раствора или значений показателя
поглощения (молярного или удельного)
растворенного вещества от длины волны
называют спектром
поглощения (рис.
2).
Рисунок 2 – Спектры
поглощения 0,001% раствора папаверина
гидрохлорида в 0,1М растворе хлористоводородной
кислоты (сплошная линия) и 0,1М растворе
гидроксида натрия (пунктирная линия)
Спектр поглощения
характеризуется областями экстремального
поглощения (максимумы) при определенных
длинах волн.
Спектры поглощения
применяют для идентификации, оценки
чистоты (содержание примесей) и
количественного анализа (выбор
аналитических длин волн) лекарственных
средств.
Идентификацию
(установление подлинности) фармацевтических
субстанций индивидуально и в
однокомпонентных лекарственных формах
согласно российской и международным
НД (ГФ, МФ, ФС, ФСП) осуществляют:
♦ путем сравнения
спектров поглощения испытуемого и
стандартного (ГСО) образцов, полученных
в одних и тех же условиях (фуразолидон
и др.);
♦ по известным
параметрам спектров поглощения:
– по положению
максимумов при определенных длинах
волн: анальгин (метамизол-натрия),
аскорбиновая кислота, ацетилсалициловая
кислота, гидрокортизона ацетат, кодеин,
кофеин, парацетамол и др. Положение
максимума поглощения анализируемой
фармацевтической субстанции может
отличаться от указанного в частной ФС
на ± 2 нм. Этот способ идентификации
наиболее прост, но недостаточно
достоверен, поэтому применяется в
качестве дополнительного
критерия;
– по положению
максимумов и минимумов при определенных
длинах волн: ацетилсалициловая кислота,
верапамила гидрохлорид, димедрол
(дифенгидрамина гидрохлорид), дротаверина
гидрохлорид, изониазид, карбамазепин,
левомицетин (хлорамфеникол), метилурацил,
метронидазол и др.;
– по положению
максимумов, минимумов, плеч и точек
перегиба при определенных длинах волн:
клонидина гидрохлорид (клофелин),
нитразепам, фенпивериния бромид и др.;
– по
положению максимумов и минимумов на
дифференциальных спектрах поглощения,
полученных измерением спектров кислотных
растворов относительно щелочных и
наоборот: сульфадиметоксин и др.;
– по положению максимумов и минимумов
и величине оптических плотностей в
максимумах: тетрациклина гидрохлорид,
окситетрациклина дигидрат, резерпин и
др.. Этот способ идентификации надежнее
предыдущих;
– по положению
максимумов при определенных длинах
волн и отношению оптических плотностей
в указанных максимумах: атенолол и др.;
– по
величине удельного показателя поглощения
в максимуме поглощения: бензилпенициллина
натриевая, калиевая, новокаиновая соль
и др.. Применяется наиболее часто;
– по
величине отношения оптических плотностей
при двух или более длинах волн: фолиевая
кислота, метициллина натриевая соль,
натрия пара-аминосалицилат и др.;
– по разности
оптических плотностей при двух длинах
волн: феноксиметилпенициллин,
бензилпенициллина натриевая соль и
др.;
– по отсутствию
в определенной области спектра выраженных
максимумов поглощения: пирацетам.
При установлении
подлинности (качественный анализ)
некоторых фармацевтических субстанций
перечисленные способы применяют в
разных комбинациях.
Эти же характеристики
позволяют оценивать чистоту фармацевтических
субстанций, т.к. при наличии примесей
на спектре поглощения основного вещества
могут смещаться или появляться
дополнительные максимумы, перегибы,
плечи, увеличиваться или уменьшаться
значения удельного или молярного
показателей поглощения и т.д.
Чистоту
(наличие поглощающих примесей) ряда
фармацевтических субстанций определяют
по величине отношения оптических
плотностей в максимумах поглощения при
двух или более длинах волн (атенолол,
цианокобаламин, ретинола ацетат, рутин
и др.).
Методом
спектрофотометрии в фармацевтическом
анализе устанавливают подлинность
фармацевтических субстанций индивидуально
и в лекарственных формах, степень
чистоты и количественное содержание,
методом фотоколориметрии – количественное
содержание.
Количественное
содержание фармацевтических субстанций
при анализе методами спектрофотометрии
и фотоколориметрии рассчитывают разными
способами в зависимости от состава
анализируемого объекта (индивидуально
или в лекарственных формах: одно-, двух-,
многокомпонентных).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Спектрофотометрия в ультрафиолетовой (УФ) и видимой областях (ОФС.1.2.1.1.0003.15)
Государственная фармакопея 13 издание (ГФ XIII)
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Взамен ОФС ГФ X, ОФС ГФ XI, ОФС 42-0042-07 ГФ XII, ч.1
Спектроскопические методы анализа основаны на избирательном поглощении электромагнитного излучения анализируемым веществом и служат для исследования строения, идентификации и количественного определения светопоглощающих соединений.
В зависимости or используемой аппаратуры в фармацевтическом анализе различают следующие методы анализа, основанные на поглощении электромагнитного излучения и испускании света:
- спектрофотометрия в ультрафиолетовой (УФ) и видимой областях;
- спектрометрия в инфракрасной (ИК) области;
- атомно-эмиссионная спектрометрия (АЭС);
- атомно-абсорбционная спектроскопия (ААС);
- флуоримегрия;
- спектроскопия ядерного магнитного резонанса (ЯМР);
- масс-спектрометрия;
- рамановская спектрометрия;
- рентгеновская флуоресцентная спектрометрия;
- рентгеновская порошковая дифрактометрия.
Ряд длин волн, для которых проводятся измерения методами абсорбционной спектрофотометрии, охватывает спектральную область от коротких длин волн в УФ-области до ИК-области. Для удобства отнесений этот спектральный ряд делится на следующие диапазоны длин волн: УФ (от 190 до 380 нм), видимый (от 380 до 780 нм), ИК (от 0,78 до 400 мкм).
СПЕКТРОФОТОМЕТРИЯ В УЛЬТРАФИОЛЕТОВОЙ И ВИДИМОЙ ОБЛАСТЯХ
Уменьшение интенсивности монохроматического излучения, проходящего через гомогенную поглощающую среду, количественно описывается законом Бугера-Ламберта-Бера:
где:
Т – пропускание, отношение интенсивности светового потока, прошедшего через вещество, к интенсивности падающего на вещество светового потока: Т = I/I0;
I – интенсивность прошедшего монохроматического излучения;
I0 – интенсивность падающего монохроматического излучения;
ε – молярный показатель поглощения;
с – молярная концентрация вещества в растворе;
b – длина оптического пути или толщина слоя, в сантиметрах.
Величина log10(1/Т) носит название оптической плотности, обозначается буквой А и является измеряемой величиной. В отсутствии других физико-химических факторов измеренная оптическая плотность (А) пропорциональна концентрации вещества в растворе (с) и толщине слоя (b).
Величина представляет собой удельный показатель поглощения, т.е. оптическую плотность раствора вещества с концентрацией 10 г/л (1 г/100 мл) в кювете с толщиной слоя 1 см. Величины
и ε связаны соотношением:
где:
М.м. – молекулярная масса исследуемого вещества.
Измерение оптической плотности
Если нет других указаний в фармакопейной статье, измерение оптической плотности проводят при указанной длине волны с использованием кювет с толщиной слоя 1 см и при температуре (20 ± 1) °С по сравнению с тем же растворителем или той же смесью растворителей, в которой растворено вещество. При измерении оптической плотности раствора при данной длине волны оптическая плотность кюветы с растворителем, измеренная против воздуха при той же длине волны, не должна превышать 0,9 и, желательно, чтобы она была не менее 0,2.
Спектр поглощения представляют таким образом, чтобы оптическая плотность или ее некоторая функция были приведены по оси ординат, а длина волны или некоторая функция длины волны – по оси абсцисс.
Если в фармакопейной статье для максимума поглощения указывается только одна длина волны, то это означает, что полученное значение максимума не должно отличаться от указанного более чем на ± 2 нм.
Приборы
Спектрофотометры, предназначенные для измерений в ультрафиолетовой и видимой областях спектра, состоят из оптической системы, выделяющей монохроматическое излучение в области от 190 до 800 нм и обеспечивающей его прохождение через образец, и устройства для измерения оптической плотности.
Основными частями этих приборов являются: источник излучения, диспергирующий прибор (призма или решетка), щель для выделения полосы длин волн, кюветы для образцов, детектор излучаемой энергии, встроенные усилители и измерительные приборы.
Проверка шкалы длин волн в ультрафиолетовой и видимой области. Точность калибровки прибора по шкале длин волн в спектральном ряду проверяют по приведенным в табл. 1 спектральным линиям водородной (Hβ) или дейтериевой (Dβ) разрядной лампы, линиям паров ртути (Hg) кварцево-ртутной дуговой лампы, а также по максимумам поглощения раствора гольмия перхлората (Ho) (готовый реактив для калибровки спектрофотометра представляет собой 4 % раствор гольмия оксида в 14,1% растворе хлорной кислоты). Допустимое отклонение составляет ± 1 нм для ультрафиолетовой и ± 3 нм для видимой области.
Таблица 1. Максимумы поглощения для проверки шкалы длин волн
| 241,15 нм (Но) | 404,66 нм (Hg) |
| 253,7 нм (Hg) | 435,83 нм (Hg) |
| 287,15 нм (Но) | 486,0 нм (Dв) |
| 302,25 нм (Hg) | 486,1 нм (Нв) |
| 313,16 нм (Hg) | 536,3 нм (Но) |
| 334,15 нм (Hg) | 546,07 нм (Hg) |
| 361,5 нм (Но) | 576,96 нм (Hg) |
| З65,48 нм (Hg) | 579,07 нм (Hg) |
Шкала длин волн может быть калибрована также при помощи подходящих стеклянных фильтров, которые имеют фиксированные полосы поглощения в видимой и ультрафиолетовой областях, а также стандартных стекол, содержащих дидим (смесь празеодима и неодима), и стекол, содержащих гольмий.
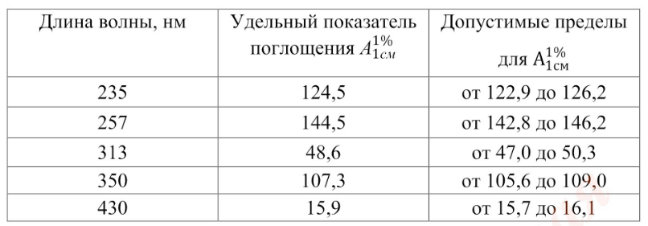
Проверка шкалы оптической плотности. Для проверки шкалы оптической плотности используют стандартные неорганические стеклянные фильтры или раствор калия дихромата при длинах волн, указанных в табл. 2, где для каждой длины волны приведено точное значение удельного показателя поглощения и допустимые пределы.
Раствор калия дихромата для проверки шкалы оптической плотности при 235, 257, 313 и 350 нм готовят следующим образом: от 57,0 до 63,0 мг (точная навеска) калия дихромата, предварительно высушенного до постоянной массы при температуре 130 °С, растворяют в 0,005 М растворе серной кислоты и доводят объем раствора тем же растворителем до 1000 мл. Для проверки оптической плотности при 430 нм, растворяют 57,0-63,0 мг (точная навеска) калия дихромата в 0,005 М растворе серной кислоты и доводят объём раствора тем же растворителем до метки.
Таблица 2. Удельный показатель поглощения стандартов при различных длинах волн
Предельный уровень рассеянного света. Рассеянный свет может быть обнаружен при данной длине волны с использованием соответствующих фильтров или растворов: например, оптическая плотность раствора 12 г/л калия хлорида в кювете с толщиной слоя 1 см резко увеличивается между 220 и 200 нм и должна быть больше 2 при 198 нм при использовании воды в качестве раствора сравнения.
Разрешающая способность (для качественного анализа). Если есть указание в фармакопейной статье, определяют разрешающую способность спектрофотометра следующим образом. Записывают спектр 0,02 % (об/об) раствора толуола в гексане. Минимально допустимое значение отношения оптической плотности в максимуме поглощения при 269 нм к оптической плотности в минимуме поглощения при 266 нм указывают в фармакопейной статье.
Ширина спектральной щели (для количественного анализа). В случае использования спектрофотометра с изменяемой шириной спектральной щели при выбранной длине волны возможны погрешности, связанные с шириной этой щели. Для их исключения ширина щели должна быть малой по сравнению с полушириной полосы поглощения (шириной на половине оптической плотности) и в то же время должна быть максимально велика для получения высокого значения интенсивности падающего монохроматического излучения (I0). Таким образом, ширина щели должна быть такой, чтобы дальнейшее ее уменьшение не изменяло величину измеряемой оптической плотности.
Кюветы. Допустимые отклонения в толщине слоя используемых кювет должны быть не более ±0,005 см. Кюветы, предназначенные для испытуемого раствора и раствора сравнения, должны иметь одинаковое пропускание (или оптическую плотность) при заполнении одним и тем же растворителем. В противном случае это различие следует учитывать.
Требования к растворителям. Для определений, производимых в ультрафиолетовой и видимой областях, образец анализируемого вещества растворяют в соответствующем растворителе, который должен быть оптически прозрачным в используемой области длин волн. Для этих областей длин волн пригодны многие растворители, в том числе вода, спирты, хлороформ, низшие углеводороды, эфиры и разбавленные растворы сильных кислот и щелочей.
Идентификация
Абсорбционную спектрофотометрию в ультрафиолетовой и видимой областях спектра применяют для определения подлинности лекарственных средств путем:
- сравнения спектров поглощения испытуемого раствора и раствора стандартного образца; в указанной области спектра должно наблюдаться совпадение положений максимумов, минимумов, плеч и точек перегиба;
- указания положений максимумов, минимумов, плеч и точек перегиба спектра поглощения испытуемого раствора; расхождение между наблюдаемыми и указанными длинами волн в максимумах и минимумах поглощения не должно обычно превышать ± 2 нм.
Возможны и другие варианты применения, оговоренные в фармакопейных статьях.
Количественное определение
Определение концентрации веществ спектрофотометрическим методом основано на использовании закона Бугера-Ламберта-Бера:
В ряде случаев, даже при использовании монохроматического излучения могут наблюдаться отклонения от закона Бугера-Ламберта-Бера, обусловленные процессами диссоциации, ассоциации и комплексообразования. Поэтому предварительно следует проверить линейность зависимости оптической плотности раствора от концентрации в аналитической области. При наличии отклонений от линейной зависимости следует пользоваться не формулой (3), а экспериментально найденной зависимостью.
Обычно определение концентрации спектрофотометрическим методом проводят с использованием стандартного образца. Расчет концентрации основан на использовании уравнения:
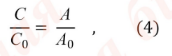
С и С0 – концентрации испытуемого раствора и раствора стандартного образца, соответственно;
А и А0 – оптические плотности испытуемого раствора и раствора стандартного образца, соответственно.
Концентрации испытуемого и стандартного раствора должны быть близки.
Вначале измеряют оптическую плотность раствора стандартного образца, приготовленного, как указано в фармакопейной статье, затем проводят измерение оптической плотности испытуемого раствора. Второе измерение проводят сразу после первого, с использованием той же кюветы, в тех же экспериментальных условиях.
Метод с использованием стандартного образца является более точным и надежным. Возможность применения значения удельного показателя поглощения в каждом конкретном случае следует обосновывать. Обычно метод с использованием значения удельного показателя поглощения применим при допусках содержания анализируемого вещества не менее ±10 % от номинального содержания.
Многокомпонентный спектрофотометрический анализ
Многокомпонентный спектрофотометрический анализ (анализ смесей) применяют для одновременного количественного определения нескольких компонентов лекарственных средств, каждое из которых подчиняется закону Бугера-Ламберта-Бера.
Количественное определение в многокомпонентном спектрофотометрическом анализе основывается обычно на использовании уравнения:
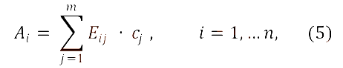
Аi – оптическая плотность испытуемого раствора при i-ой длине волны;
Еij – показатели поглощения (зависящие от способа выражения концентрации) j-го компонента образца при i-ой аналитической длине волны;
cj – концентрация j-го компонента образца.
Соответствующие методики проведения анализа и расчетные формулы указываются в фармакопейных статьях.
Производная спектрофотометрия
В производной спектрофотометрии исходные спектры поглощения (нулевого порядка) преобразуются в спектры производных первого, второго и более высокого порядков.
Спектр первой производной представляет собой график зависимости градиента кривой поглощения (скорость изменения оптической плотности от длины волны, dA/dλ) от длины волны.
Спектр второй производной представляет собой график зависимости кривизны спектра поглощения (d2A/dλ2) от длины волны. Вторая производная при любой длине волны связана с концентрацией следующим соотношением:
Производная спектрофотометрия может быть использована как для целей идентификации веществ, так и для их количественного определения в многокомпонентных смесях, а также в тех случаях, когда имеется фоновое поглощение, вызванное присутствием веществ, содержание которых не регламентируется.
Приборы
Используют спектрофотометры, отвечающие указанным выше требованиям и оснащенные аналоговым резистивно-емкостным дифференцирующим модулем или цифровым дифференциатором, или другими средствами получения производных спектров, в соответствии с инструкцией к прибору. Некоторые методы получения спектров второй производной приводят к смещению длин волн относительно исходного спектра, что следует учитывать там, где это необходимо.
Разрешающая способность
Если указано в фармакопейных статьях, записывают спектр второй производной для раствора 0,2 г/л толуола в метаноле, используя метанол в качестве раствора сравнения. На спектре должен присутствовать небольшой отрицательный экстремум, расположенный между двумя большими отрицательными экстремумами при 261 нм и 268 нм, в соответствии с рис. 1. Если нет других указаний в фармакопейных статьях, отношение А/B должно быть не менее 0,2.
Методика
Процедура анализа аналогична применяемой в обычной спектрофотометрии, но вместо оптических плотностей используют производные. Готовят раствор испытуемого образца, настраивают прибор в соответствии с инструкцией производителя и рассчитывают количество определяемого вещества, как указано в фармакопейной статье.
Рисунок 1. Спектр второй производной раствора толуола (0,2 г/л) в метаноле
Здравствуйте, какая размерность концентрации вещества в формулах расчёта молярного и удельного показателя погашения раствора в фотоколориметрических и спектрофотометрических исследованиях: г/мл, или моль/л, или %?
У меня пот по этой задаче значения удельного и молярного коэффициентов экстикции что-то большие. Где здесь неправильно посчитано.
Не пропечатались нарисованные в хемдроу удельный коэффициент погашения раствора
Измерение спектра поглощения субстанции рибофлавина (витамина В2) в видимой области спектра. Рибофлавин обладает характерным спектром поглощения в видимой области спектра при 445 нм и в ультрафиолетовой области спектра при следующих длинах волн: 347, 268 и 223 нм. При этих длинах волн субстанция рибофлавина имеет следующие молярные показатели погашения раствора субстанции рибофлавина в 0,05 моль/л раствора натрия гидроксида: 12300 л/моль•см, 10800 л/моль•см, 31400 л/моль•см, 30100 л/моль•см соответственно. Молярная масса рибофлавина составляет 376,4 г/моль.
Ход работы следующий:
1) приготовление раствора натрия гидроксида с концентрацией 0,05 моль/л.
2) приготовление исходного раствора рибофлавина с концентрацией 0,004 г/мл в растворе натрия гидроксида с концентрацией 0,05 моль/л.
3) приготовление серии растворов рибофлавина с различными концентрациями (таблица 7).
Таблица 7
Параметры приготовления растворов субстанции рибофлавина
с различными концентрациями
|
№ пробы |
Концентрации растворов рибофлавина, г/мл |
Объём воды очищенной, мл |
Объёмы внесённого раствора рибофлавина, мл |
Оптическая плотность растворов при длине волны 445 нм |
|
1 |
0 |
2 |
0 |
0 |
|
2 |
0,000016 |
2 |
0,4 |
0,469 |
|
3 |
0,000020 |
2 |
0,5 |
0,533 |
|
4 |
0,000024 |
2 |
0,6 |
0,720 |
|
5 |
0,000028 |
2 |
0,7 |
0,713 |
|
6 |
0,000032 |
2 |
0,8 |
0,864 |
4) регистрируют спектр поглощения рибофлавина с концентрацией 0,0001 моль/л в видимом диапазоне в области от 300 до 500 нм, определяя оптическую плотность через каждые 10 нм. Отображается график зависимости оптической плотности от длины волны.
Для расчёта удельного и молярного коэффициентов погашения (поглощения) растворов рибофлавина необходимо пересчитать концентрацию растворов из г/мл в моль/л. Так как знаменатель в обеих формулах разный, то итоговую формулу надо умножить на 1000, что значит 1000 мл или 1 л для перевода мл в л.
C = (m × 1000) / (М.м. × V) = (0,000016 г × 1000 мл) / (376,4 г/моль × 1 л) = 0,0000425 моль/л.
C = (m × 1000) / (М.м. × V) = (0,000020 г × 1000 мл) / (376,4 г/моль × 1 л) = 0,0000531 моль/л.
C = (m × 1000) / (М.м. × V) = (0,000024 г × 1000 мл) / (376,4 г/моль × 1 л) = 0,0000638 моль/л.
C = (m × 1000) / (М.м. × V) = (0,000028 г × 1000 мл) / (376,4 г/моль × 1 л) = 0,0000744 моль/л.
C = (m × 1000) / (М.м. × V) = (0,000032 г × 1000 мл) / (376,4 г/моль × 1 л) = 0,0000850 моль/л.
5) рассчитывают коэффициент экстикции – удельный коэффициент погашения раствора при длине волны 445 нм.
= Dиссл. / (C × L) = 0,469 / (0,0000425 моль/л × 1 см) = 11035,29 (100 мл/г•см).
= Dиссл. / (C × L) = 0,533 / (0,0000531 моль/л × 1 см) = 10037,66 (100 мл/г•см).
= Dиссл. / (C × L) = 0,720 / (0,0000638 моль/л × 1 см) = 11285,27 (100 мл/г•см).
= Dиссл. / (C × L) = 0,713 / (0,0000744 моль/л × 1 см) = 9583,33 (100 мл/г•см).
= Dиссл. / (C × L) = 0,864 / (0,0000850 моль/л × 1 см) = 10164,71 (100 мл/г•см).
6) рассчитывают коэффициент экстикции – молярный коэффициент погашения раствора при длине волны 445 нм.
Молярный показатель поглощения (погашения) – оптическая плотность раствора вещества с концентрацией вещества 1 моль/л и толщиной поглощающего слоя в 1 см (л/моль•см)
ε = (М.м. × ) / 10 = (376,4 г/моль × 11035,29) / 10 = 415368,32 (л/моль•см).
ε = (М.м. × ) / 10 = (376,4 г/моль × 10037,66) / 10 = 377817,52 (л/моль•см).
ε = (М.м. × ) / 10 = (376,4 г/моль × 11285,27) / 10 = 424777,56 (л/моль•см).
ε = (М.м. × ) / 10 = (376,4 г/моль × 9583,33) / 10 = 360716,54 (л/моль•см).
ε = (М.м. × ) / 10 = (376,4 г/моль × 10164,71) / 10 = 382599,68 (л/моль•см).
Изменено 11 Июля, 2019 в 20:46 пользователем docanton