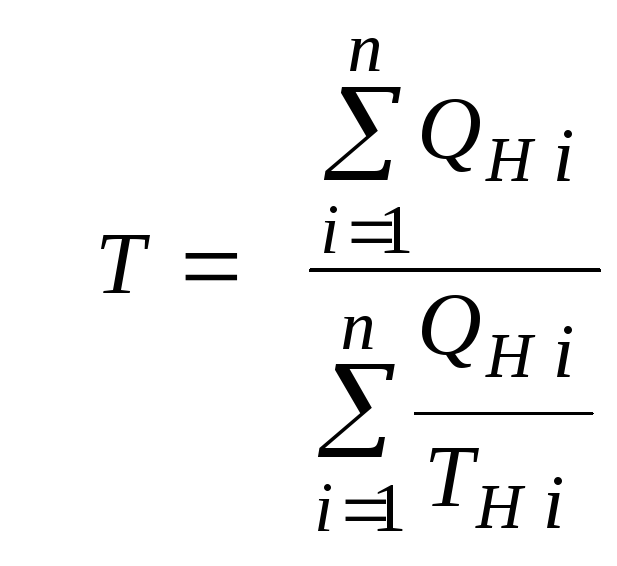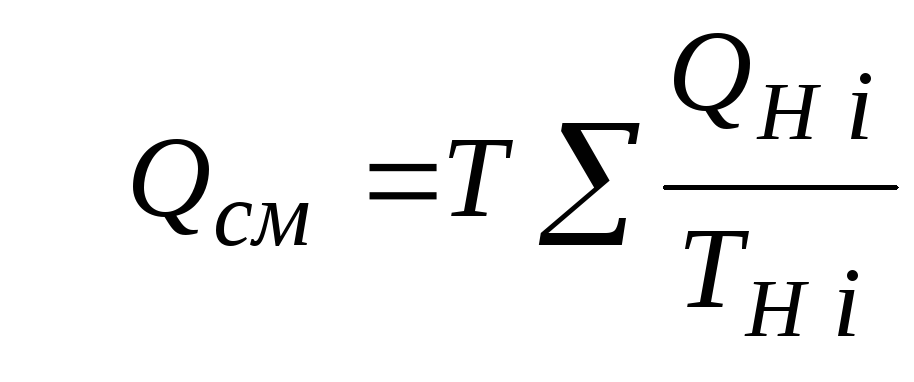О, боже, неужели я настолько глуп? Помогите решить такую задачу:
Теплоизолированный сосуд разделен теплоизолирующей перегородкой на 2 равные части. В одной части находится 40 г газа аргона при температуре 300 К, а в другой — столько же газа неона при температуре 600 К. Найдите температуру смеси газов после удаления перегородки.
Что за бред, но я не могу составить дельное уравнение. То одно неизвестное, то другое тут вылазивает.
Записываю уравнение Менд.-Кл. для аргона:
1)[ p_1V=frac{m}{mu_1}RT_1; ]
Записываю уравнение Менд.-Кл. для неона:
2)[ p_2V=frac{m}{mu_2}RT_2; ]
Если поделить ур-ния друг на друга, то можно найти отношение давлений (1/4). Оно нам надо?
Затем если записать объединенный газовый закон для 1-го и для 2-го газа:
[ frac{p_1V}{T_1}=frac{2p^,_1V}{T^,} ] и [ frac{p_2V}{T_2}=frac{2p^,_2V}{T^,} ]
можно найти отношение установленных давлений каждым из газов (1/2).
И записав ур-ние Менд.-Кл. для смеси газов
[ p2V=frac{2m}{mu_c}RT^, ] где [ p=p_1^,+p_2^,=3p_1^,; ]
окончательно приходим в тупик
Помогите!
Определение температуры смеси.
В технике часто приходится иметь дело с объектами или процессами, в которых смешиваются два или более потоков. Потоки могут состоять из разных веществ в разных агрегатных состояниях, иметь разные давления и температуры (например, смешивание воды и пара). Для лучшего перемешивания иногда используется перемешивающее устройство. В частности, для системы, изображенной на рис. 3.15, балансы массы и энергии можно записать так:
Рис. 3.15. Перемешивающее устройство
Пренебрегая изменением кинетической и потенциальной энергии, запишем
Если перемешивание происходит без теплообмена с окружающей средой и без совершения работы, то это выражение упрощается:
Это соотношение можно представить в виде
или, полагая, что теплоемкости постоянны,
Таким образом, зная температуры и потоки масс компонентов на входе, можно определить стационарную температуру потока на выходе.
Например, если два вещества с температурами tx и t2, с потоками масс щ, т2 и удельными теплоемкостями ср ср2 соответственно смешиваются при постоянном давлении, то приближенное значение температуры смеси можно найти по формуле
Если система состоит из нескольких таких фрагментов, то ее равновесную температуру приближенно можно рассчитать по формуле
Если выравнивание температур происходит при постоянном объеме, без теплообмена и совершения работы, то баланс энергии в стационарном режиме можно представить в виде равенства
где Е— энергия компонентов до смешения; Е2 — энергия после смешения,
В общем случае выполняется равенство
Если известны теплоемкости, температуры и массы компонентов, можно найти приближенное значение равновесной температуры смеси, полагая, что теплоемкости всех компонентов постоянны или используя средние значения теплоемкостей. Расчет температуры смеси в этом случае производится по формуле
В калориметре с адиабатными стенками находится mw = 800 г воды при температуре tw = 15°С, теплоемкость воды cw = 4,19 кДж/ (кг-К). Вода находится в серебряном стакане массой ms = 250 г, теплоемкость серебра cs = 0,23 кДж/ (кг-К). В воду бросают кусок алюминия массой тА = 200 г с температурой tA = 100°С. После выравнивания температур температура системы равна tm = 19,2°С. Чему равна теплоемкость алюминия?
Рассмотрим еще один пример.
Охлаждаемый объект находится в холодильнике, при этом из окружающей среды в холодильник за счет градиента температур направлен тепловой поток =50 Вт. Мощность, потребляемая холодильником, составляет W3J1 = -110 Вт. Чему равен тепловой поток, отводимый из холодильника в окружающую среду Qc q? Насколько изменится температура воздуха в помещении в течение часа работы холодильника, если объем помещения — 40 м 3 , плотность воздуха — 1,2 кг/м 3 , cv = 0,717 кДж/ (кг-К) и помещение полностью изолировано?
Баланс энергии для стационарного режима работы
В стационарном режиме суммарный поток энергии из холодильника в окружающую среду равен потребляемой мощности. При этом изменение внутренней энергии воздуха в единицу времени равно
Как найти температуру смеси газов
Простейшей моделью, рассматриваемой молекулярно-кинетической теорией, является модель идеального газа . В кинетической модели идеального газа молекулы рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений. Суммарный объем всех молекул предполагается малым по сравнению с объемом сосуда, в котором находится газ. Модель идеального газа достаточно хорошо описывает поведение реальных газов в широком диапазоне давлений и температур. Задача молекулярно-кинетической теории состоит в том, чтобы установить связь между микроскопическими (масса, скорость, кинетическая энергия молекул) и макроскопическими параметрами (давление, объем, температура).
В результате каждого столкновения между молекулами и молекул со стенками скорости молекул могут изменяться по модулю и по направлению; на интервалах времени между последовательными столкновениями молекулы движутся равномерно и прямолинейно. В модели идеального газа предполагается, что все столкновения происходят по законам упругого удара, т. е. подчиняются законам механики Ньютона.
Используя модель идеального газа, вычислим давление газа на стенку сосуда . В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция скорости, параллельная стенке, остается неизменной (рис. 3.2.1).
Поэтому изменение импульса молекулы будет равно , где – масса молекулы.
Выделим на стенке некоторую площадку (рис. 3.2.2). За время с этой площадкой столкнутся все молекулы, имеющие проекцию скорости , направленную в сторону стенки, и находящиеся в цилиндре с основанием площади и высотой .
Пусть в единице объема сосуда содержатся молекул; тогда число молекул в объеме цилиндра равно . Но из этого числа лишь половина движется в сторону стенки, а другая половина движется в противоположном направлении и со стенкой не сталкивается. Следовательно, число ударов молекул о площадку за время равно Поскольку каждая молекула при столкновении со стенкой изменяет свой импульс на величину , то полное изменение импульса всех молекул, столкнувшихся за время с площадкой , равно По законам механики это изменение импульса всех столкнувшихся со стенкой молекул происходит под действием импульса силы , где – некоторая средняя сила, действующая на молекулы со стороны стенки на площадке . Но по 3-му закону Ньютона такая же по модулю сила действует со стороны молекул на площадку . Поэтому можно записать:
Разделив обе части на , получим:
где – давление газа на стенку сосуда.
При выводе этого соотношения предполагалось, что все молекул, содержащихся в единице объема газа, имеют одинаковые проекции скоростей на ось . На самом деле это не так.
В результате многочисленных соударений молекул газа между собой и со стенками в сосуде, содержащем большое число молекул, устанавливается некоторое статистическое распределение молекул по скоростям. При этом все направления векторов скоростей молекул оказываются равноправными (равновероятными), а модули скоростей и их проекции на координатные оси подчиняются определенным закономерностям. Распределение молекул газа по модулю скоростей называется распределением Максвелла . Дж. Максвелл в 1860 г. вывел закон распределения молекул газа по скоростям, исходя из основных положений молекулярно-кинетической теории. На рис. 3.2.3 представлены типичные кривые распределения молекул по скоростям. По оси абсцисс отложен модуль скорости, а по оси ординат – относительное число молекул, скорости которых лежат в интервале от до . Это число равно площади выделенного на рис. 3.2.3 столбика.
Характерными параметрами распределения Максвелла являются наиболее вероятная скорость , соответствующая максимуму кривой распределения, и среднеквадратичная скорость где – среднее значение квадрата скорости.
С ростом температуры максимум кривой распределения смещается в сторону больших скоростей, при этом и увеличиваются.
Чтобы уточнить формулу для давления газа на стенку сосуда, предположим, что все молекулы, содержащиеся в единице объема, разбиты на группы, содержащие , , и т. д. молекул с проекциями скоростей , , и т. д. соответственно. При этом Каждая группа молекул вносит свой вклад в давление газа. В результате соударений со стенкой молекул с различными значениями проекций скоростей возникает суммарное давление
Входящая в это выражение сумма – это сумма квадратов проекций всех молекул в единичном объеме газа. Если эту сумму разделить на , то мы получим среднее значение квадрата проекции скорости молекул:
Теперь формулу для давления газа можно записать в виде
Так как все направления для векторов скоростей молекул равновероятны, среднее значение квадратов их проекций на координатные оси равны между собой:
Последнее равенство вытекает из формулы:
Формула для среднего давления газа на стенку сосуда запишется в виде
Это уравнение устанавливает связь между давлением идеального газа, массой молекулы , концентрацией молекул , средним значением квадрата скорости и средней кинетической энергией поступательного движения молекул. Его называют основным уравнением молекулярно-кинетической теории газов.
Таким образом, давление газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема .
В основное уравнение молекулярно-кинетической теории газов входит произведение концентрации молекул на среднюю кинетическую энергию поступательного движения. Если предположить, что газ находится в сосуде неизменного объема , то ( – число молекул в сосуде). В этом случае изменение давления пропорционально изменению средней кинетической энергии.
Возникают вопросы: каким образом можно на опыте изменять среднюю кинетическую энергию движения молекул в сосуде неизменного объема? Какую физическую величину нужно изменить, чтобы изменилась средняя кинетическая энергия Опыт показывает, что такой величиной является температура .
Понятие температуры тесно связано с понятием теплового равновесия . Тела, находящиеся в контакте друг с другом, могут обмениваться энергией. Энергия, передаваемая одним телом другому при тепловом контакте, называется количеством теплоты .
Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными. Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии. Возможность введения понятия температуры следует из опыта и носит название нулевого закона термодинамики .
Для измерения температуры используются физические приборы – термометры , в которых о величине температуры судят по изменению какого-либо физического параметра. Для создания термометра необходимо выбрать термометрическое вещество (например, ртуть, спирт) и термометрическую величину , характеризующую свойство вещества (например, длина ртутного или спиртового столбика). В различных конструкциях термометров используются разнообразные физические свойства вещества (например, изменение линейных размеров твердых тел или изменение электрического сопротивления проводников при нагревании).
Термометры должны быть откалиброваны. Для этого их приводят в тепловой контакт с телами, температуры которых считаются заданными. Чаще всего используют простые природные системы, в которых температура остается неизменной, несмотря на теплообмен с окружающей средой – это смесь льда и воды и смесь воды и пара при кипении при нормальном атмосферном давлении. По температурной шкале Цельсия точке плавления льда приписывается температура , а точке кипения воды – . Изменение длины столба жидкости в капиллярах термометра на одну сотую длины между отметками и принимается равным . В ряде стран (США) широко используется шкала Фаренгейта (F), в которой температура замерзающей воды принимается равной 32 °F, а температура кипения воды равной 212 °F. Следовательно,
Особое место в физике занимают газовые термометры (рис. 3.2.4), в которых термометрическим веществом является разреженный газ (гелий, воздух) в сосуде неизменного объема (), а термометрической величиной – давление газа . Опыт показывает, что давление газа (при ) растет с ростом температуры, измеренной по шкале Цельсия.
Чтобы проградуировать газовый термометр постоянного объема, можно измерить давление при двух значениях температуры (например, 0 °C и 100 °C), нанести точки и на график, а затем провести между ними прямую линию (рис. 3.2.5). Используя полученный таким образом калибровочный график, можно определять температуры, соответствующие другим значениям давления. Экстраполируя график в область низких давлений, можно определить некоторую «гипотетическую» температуру, при которой давление газа стало бы равным нулю. Опыт показывает, что эта температура равна и не зависит от свойств газа . На опыте получить путем охлаждения газ в состоянии с нулевым давлением невозможно, так как при очень низких температурах все газы переходят в жидкое или твердое состояние.
Английский физик У. Кельвин (Томсон) в 1848 г. предложил использовать точку нулевого давления газа для построения новой температурной шкалы ( шкала Кельвина ). В этой шкале единица измерения температуры такая же, как и в шкале Цельсия, но нулевая точка сдвинута:
В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой K. Например, комнатная температура по шкале Кельвина равна .
Температурная шкала Кельвина называется абсолютной шкалой температур . Она оказывается наиболее удобной при построении физических теорий.
Нет необходимости привязывать шкалу Кельвина к двум фиксированным точкам – точке плавления льда и точке кипения воды при нормальном атмосферном давлении, как это принято в шкале Цельсия.
Кроме точки нулевого давления газа, которая называется абсолютным нулем температуры , достаточно принять еще одну фиксированную опорную точку. В шкале Кельвина в качестве такой точки используется температура тройной точки воды ), в которой в тепловом равновесии находятся все три фазы – лед, вода и пар. По шкале Кельвина температура тройной точки принимается равной .
Газовые термометры громоздки и неудобны для практического применения: они используются в качестве прецизионного стандарта для калибровки других термометров.
Сравнивая соотношения с основным уравнением молекулярно-кинетической теории газов, можно получить:
Средняя кинетическая энергия хаотического движения молекул газа прямо пропорциональна абсолютной температуре.
Таким образом, температура есть мера средней кинетической энергии поступательного движения молекул .
В этом соотношении , , , … – концентрации молекул различных газов в смеси. Это соотношение выражает на языке молекулярно-кинетической теории экспериментально установленный в начале XIX столетия закон Дальтона : давление в смеси химически невзаимодействующих газов равно сумме их парциальных давлений .
1.5. Смеси газов
Возникает естественный вопрос: какими уравнениями описываются смеси идеальных газов? Ведь с чистыми газами нам редко приходится встречаться в природе. Например, наша естественная среда обитания — воздух — состоит из азота N2 (78,08 %), кислорода O2 (20,95 %), инертных газов (0,94 %), углекислого газа СO2 (0,03 %).
Пусть в некотором объеме V при некоторой температуре Т содержится смесь газов (которые мы будем нумеровать
индексом i ). Роль каждого компонента смеси будем характеризовать массовой долей:
где mi — масса i-го компонента. Наша задача — написать уравнение, подобное уравнению Клапейрона — Менделеева, и разобраться с эффективным числом степеней свободы смеси, где могут содержаться и одноатомные, и многоатомные молекулы.
Прежде всего, заметим, что мы рассматриваем идеальные газы. Молекулы не взаимодействуют друг с другом, и потому каждый компонент не мешает любому другому «жить» в том же общем сосуде. Различные газы в сосуде, в силу их предполагаемой идеальности, просто «не замечают» друг друга. Поэтому для каждого из компонентов справедливо одно и то же уравнение Клапейрона — Менделеева:
где ni — число молей вещества в i -м компоненте. Полное число n молей в смеси равно сумме числа молей ni в каждом из компонентов:
Аналогично, полная масса смеси равна сумме масс каждого из компонентов
и естественно определить молярную массу смеси m как массу одного моля смеси:
Введем величину, называемую парциальным давлением.
Парциальное давление pi — это давление, оказываемое i-м компонентом газовой смеси.
Имеет место закон Дальтона для газовой смеси:
Полное давление газовой смеси равно сумме всех парциальных давлений
Суммируя левые и правые части (1.21), приходим к стандартной форме уравнения Клапейрона — Менделеева
где m, μ, n определяются из условия конкретной задачи. Например, если заданы массовые доли компонентов, то молярную массу смеси находим из соотношения
Внутренняя энергия Ui i-го компонента смеси определяется в соответствии с формулами (1.16) и (1.19):
С одной стороны, полная внутренняя энергия смеси равна сумме энергий каждого компонента:
С другой стороны, запишем стандартное выражение вида (1.25)
Сравнивая (1.26) и (1.27), получаем формулу для показателя адиабаты смеси
Найдя массу моля и показатель адиабаты смеси, мы можем пользоваться всеми формулами, полученными ранее для «чистых» идеальных газов.
Пример. Дана смесь кислорода O2 (компонент 1) и аргона Ar (компонент 2), причем количества вещества обоих компонентов одинаковы n1 = n2. Найдем показатель адиабаты смеси.
-
Смешение газовых потоков
-
Температура смеси газовых потоков
Пусть в проточной
смесительной камере смешиваются n
потоков, массовые расходы которых
равныGH1
,GH
2,…,GH
n
, объемные расходы —QH1,QH
2,… ,QH
n
, а начальные температуры и
давления —ТH
1,ТH
2,…,ТH
nи
РH
1,РH
2,…,РH
n
.
Давление газов в
смесителе Pсмявляется величиной задаваемой из
каких-либо соображений и устанавливаемой
за счет дросселерования газовых потоков
с помощью регулирующей арматуры
(задвижек, клапанов и т. п.), установленной
перед входом в смеситель. Это давление
не должно быть больше минимального изPH
i
, т. е. должно выполняться
условие:
Pсм
(PH
i) min
.
Здесь: i
= 1, 2, 3, …, n.
Если газы при
смешении не совершают технической
работы, то, полагая процесс смешенияадиабатным, т. е. идущим без
теплообмена с окружающей средой, ипренебрегая кинетической энергии
потока, первое начало термодинамикидля газового потока можно
записать в следующем виде:
Здесь: iсм– удельная энтальпия смеси газов;
iH
i— удельная энтальпияi-го
газа с начальной температуройТH
i
;
Gсм– массовый расход потока после смесителя.
Но, как известно,
di = Cp
dT, откуда:
и
Здесь: — средняя в диапазоне0 -Т0Кмассовая изобарная
теплоемкость
смеси газов;
— средняя в диапазоне0 -ТH
iмассовая изобарная
теплоемкость
i-го газа.
Дальнейший вывод
формул для температуры смеси потоков
газа аналогичен выводу для случая
смешения газов при сохранении постоянного
объема, но вместо изохорной теплоемкости
Сv
в уравнения подставляется изобарнаяСp.
Тогда по аналогии
с формулами предыдущего параграфа 2.1
можно сразу записать:

или
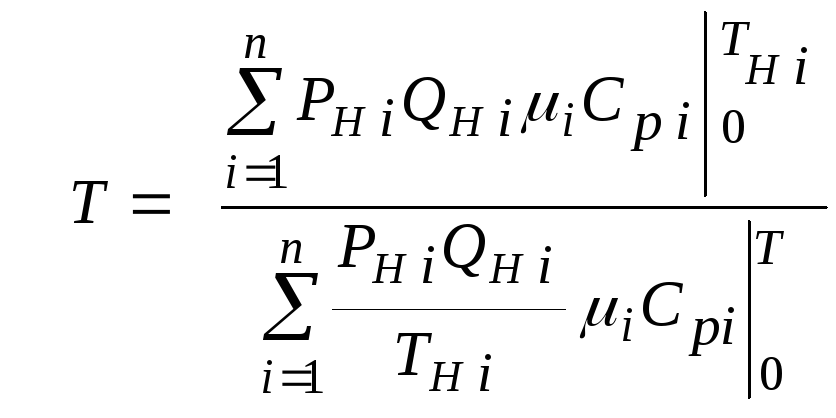
В тех случаях,
когда эмпирическая зависимость
теплоемкости от температуры дается для
температуры в градусах Цельсия,
формулы (2.2.1) и (2.2.2) приобретают
соответственно следующий вид:
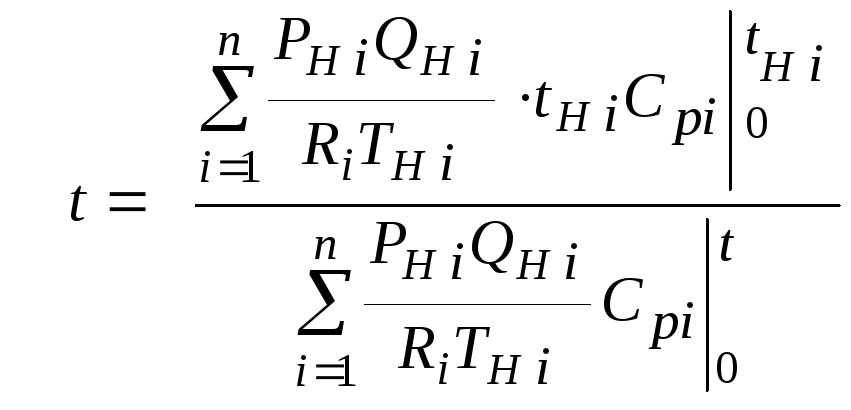
или
(2.2.6)
Значения температуры
смеси в формулах (2.2.1), (2.2.2), (2.2.5), (2.2.6)
определяются методом последовательных
приближений.
-
Объемный расход смеси газовых потоков
В отличие от
массового расхода Gсм
величина объемного расхода смесиQсмв общем случаене равна сумме
объемных расходов компонентов и
определяется из уравнения состояния
идеального газа, записанного для единицы
времени:
.
Т.
к..
, то
(2.2.3)
Если выразить Giчерез параметры начального состоянияi-го потока

то получим еще
одну формулу для объемного расхода
смеси:
(2.2.4)
2.2.3. Частные случаи смешения газовых потоков
Рассмотрим несколько
частных случаев формул (2.2.1) и (2.2.2).
-
Если приближенно
принять, что
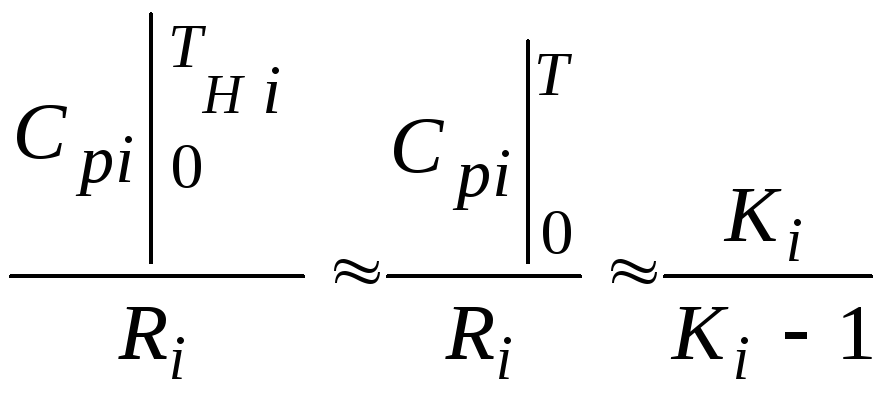
т. е. пренебречь
зависимостью показателей адиабаты Кiот температуры,
то формула (2.2.1)
запишется в следующем виде:

Эта формула может
быть использована в качестве первого
приближения для температуры смеси Т
в формулах (2.2.1) и (2.2.2).
-
Если все газы,
образующие смесь, имеют одинаковые и
постоянные (или близкие) во всем диапазоне
температур мольные теплоемкости, т.е.
,
то формула (2.2.2)
упрощается:

-
Если помимо
одинаковых мольных теплоемкостей (как
в частном случае 2) все газы имеют
одинаковое начальное давление, т. е.
,
то формула (2.2.8)
принимает следующий вид:
(2.2.9)
Формула 2.2.4 для
случая одинаковых начальных давлений
()
запишется как:
(2.2.10)
Если, кроме PH
i
равны между собой еще и начальные
температурыТH
i
, то
(2.2.11)
Литература.
1.
Берд Р., Стьюарт В., Лайтфут Е. Явления
переноса. Перевод с англ. – М.: Химия;
1974. —
2.
Розловский А. И. Научные основы техники
взрывобезопасности при работе с горючими
газами и парами. М.: Химия; 1972. – 90 с.
3.
Гиршфельдер Дж., Кертисс Ч., Берд Р.
Молекулярная теория газов и жидкостей.
– М.: ИИЛ; 1961. – 929 с.
4.
Рид Д., Праусниц, Шервуд. Свойства газов
и жидкости. – М.: Мир; 1984. – с.
5.
Стаскевич Н. Л., Северинец Г. Н., Вигдорчик
Д. Я. Справочник по газоснабжению и
использованию газа. – Л.: Недра, 1990. –
762 с.
Ижевский
государственный технический университет
Институт городского
хозяйства
Диденко В. Н.
Газовые смеси.
Смешение газов.
Ижевск 2002
Газовые смеси.
Смешение газов. Методическое пособие
к дисциплинам «Термодинамика»,
«Теплотехника», «Газоснабжение»,
«Химическая термодинамика и энергетика
топлива», «Физико-химические основы
горения топлива» специальностей 29.07.00
«Теплогазоснабжение и вентиляция» и
29.08.00 «Водоснабжение и водоотведение»
Составитель:
проф., д. т. н.
Диденко Валерий
Николаевич
Методическое
пособие содержит систематизированные
теоретические сведения, необходимые
для осознанного и грамотного использования
зависимостей, приводимых в технической
литературе, для расчета термодинамических
параметров и функций, а также теплофизических
характеристик газовых смесей.
Целью методического
пособия является устранение существующего
пробела в доказательной части содержания
разделов «газовые смеси» современных
учебников и справочников по термодинамике,
теплотехнике и газоснабжению.
Методическое
пособие предназначено для студентов
технических специальностей,
инженеров-теплотехников и аспирантов.
© Ижевский
государственный технический университет,
2002
© Институт городского
хозяйства, 2002
© Диденко Валерий
Николаевич, 2002.
После расширения газа и занятия всего объема между газами произойдет теплообмен. Считая молярную теплоемкость газов при постоянном объеме равной (i/2 + 1) R = cM, запишем уравнение теплового баланса (в конечном состоянии газ работу не совершает):
с1m (T − T1) + с2m (T − T2) = 0.
Умножим все уравнение на M1M2, получим:
с1M1M2(T − T1) + с2M1M2(T − T2) = 0.
Сократим одинаковую молярную теплоемкость при постоянном объеме:
с1M1 = с2M2 = (i/2 + 1) R,
M2(T − T1) + M1(T − T2) = 0.
Выразим искомую температуру:
T = (M2T1 + M1T2) / (M1 + M2).
Основные соотношения и зависимости для газовых смесей приведены в табл. 1 Давление и температура газов после смешения. Смешение при [c.45]
Давление и температура газов после смешения. Смешение при [c.59]
При смешении газов с различной температурой и давлением часто необходимо найти давление и температуру смеси, устанавливающиеся после смешения. Вывод расчетных формул для давления и температуры смеси проведем при следующих предположениях [c.72]
Чаще состав газовой смеси задают на 1 тогда значения каждого газа показывают его объемную долю в 1 м . Состав смеси, заданный таким образом, называется относительным объемным составом. Этот состав следует понимать так. Возьмем несколько разных газов, имеющих одни и те же давление и температуру. Если теперь эти газы смещать в их суммарном объеме, т. е. в объеме, равном сумме объемов, ранее занятых каждым газом в отдельности, то получится смесь того же давления и той же температуры, что каждый из газов имел до смещения. Частное от деления объема каждого газа до смешения на суммарный объем после смешения представляет собой объемную долю этого газа в смеси. [c.122]
Давление и температура газов после смешения [c.533]
Смешение газов при постоянном объеме. Первый способ образования смеси состоит в том, что несколько газов с давлением pi, ра, рз, и температурами Tj, Тз,. .. занимают различные объемы Vi, V2, Уз, (рис. 14-4). После удаления разделяющих перегородок объем образовавшейся смеси будет равен сум- [c.226]
Приближенные формулы (42) и (44) позволяют установить простую зависимость между температурой газа и полным давлением потока после смешения. Здесь надо различать два случая вычисления полного давления смеси [c.547]
Как было показано выше, для смеси идеальных газов температура и давление до и после смешения одинаковы. Это позволяет записать [c.142]
Очевидно, что Vj + К, = «Де V — общий об1,ем сосуда, который считается неизменным. Предположим, что после смешения, которое происходит без отвода пли подвода теплоты и без совершения работы над внешним объектом, каждый из газов распространится по всему оГ-ъ-(му V и будет иметь температуру и давления, равные соответственно и Так как Q = О и L = О, то [c.82]
Закрытая система. Обозначим объемы смешиваемых газов до смешения через Vi, V ,. .., Vn- Температуру и давление газов обозначим соответственно через Ti, Т ,. .., и pi, р ,. .., рп-, После смешения объем смеси газов будет V == Ki-f Ка + — += [c.85]
Зная определенную таким образом температуру Т газа и величину давления р газа в камере смешения, с помощью уравнения Клапейрона нетрудно определить удельный объем газа после смешения [c.255]
После смешения или объединения потоков в общей камере полученная смесь газов, характеризуемая определенной степенью неравномерности полей скоростей, полных давлений и полных температур, поступает либо в общую форсажную камеру, либо в общее реактивное сопло. [c.123]
В другом варианте реактора для парциального окисления метана кислородом под давлением, метан и кислород, нагретые до 400 °С при давлении 0,4 МПа, после смешения в камере I проходят через распределитель 2 и попадают в камеру сгорания 5, в которой температура повышается более чем до 1500 °С и происходит образование ацетилена и алкенов (рис. 6.2.6). Вторичный подогретый углеводород вводится через сопла и 5 в камеру сгорания, в которой путем крекинга снова получают ацетилен и алкены. В конце процесса газы охлаждаются водой до 130… 140 °С и выходят из реактора. [c.623]
Исходными данными для расчета деаэратора смешения являются давление и энтальпия греющего пара расход Ог и энтальпия г г (или температура г) Для каждого из потоков воды, поступающих в деаэратор. Эти данные берутся из расчета тепловой схемы паротурбинной установки. Кроме того, нужно знать количество газов, в основном кислорода, растворенных в потоках воды. При проектировании необходимо задаться предельно допустимым содержанием газов в воде после деаэратора. [c.380]
В следующем параграфе Смешение газов обычным методом определяются температура, давление и удельный объем образовавшейся смеси. Дальше рассматривается процесс перетекания газа из одного сосуда в другой. После этого в двух параграфах очень подробно говорится об экспериментальных методах определения значения коэффициента = ср/с,-. [c.133]
Формулы (71) и (75) позволяют установить важную зависимость между температурой газов и полным давлением потока после смешения. Здесь надо различать два случая, в которых полное давление смеси отыскивается соответственно [c.343]
Температура воздуха при входе в цилиндр при высоком наддуве гораздо выше, чем в нормальных двигателях, поэтому подвода тепла за счет соприкосновения воздуха с нагретыми поверхностями в начальный период может и не быть. Если принять давление наддува р =4 ата, то температура воздуха перед цилиндром при адиабатном сжатии в нагнетателе будет 155° С, а температура заряда в цилиндре двигателя в конце закрытия продувочных и выпускных клапанов (или окон в двухтактных двигателях) после смешения с остаточными газами будет около 180° С при р =6 ата получим соответственно 206°С и 230° С. В то время как для предохранения деталей двигателя от коробления максимальная температура нагрева головки цилиндра при современных материалах не должна превышать 240—270° С, допустимая температура внутренних поверхностей гильзы цилиндра во избежание разложения масла и залипания поршневых колец не должна быть выше 140—170° С. Отсюда видно, что уже при давлении наддува р >4 ата, если нет глубокого промежуточного охлаждения воздуха перед цилиндром двигателя, температура заряда может превышать температуру стенок гильзы, приближаясь к температуре головки. [c.102]
Схема постоянного давления — это схема смешения потоков газа в трубопроводах (рис. 2,1,6), К коллекторному трубопроводу отдельными потоками подводятся компоненты смеси со своими давлениями р,, температурой Т , массой О и т, п,, причем поступление каждого компонента регулируется заслонкой. Давление компонентов после прохождения заслонки (до смещения компонентов) снижается до уровня давления смеси в общем коллекторе рт. [c.27]
Парогенератор производительностью 430 т/ч работает на природном газе,, под давлением 5—6 ат. Уходящие газы парогенератора после смешения с продуктами горения, образующимися в специальной камере, поступают в газовую турбину с температурой 750° С. Отработавшие в турбине газы охлаждаются последовательно в двух ступенях экономайзера и удаляются из установки с температурой 140° С. Газовая турбина мощностью 50 Мвт приводит электрический генератор и воздушный компрессор с давлением нагнетания 6,77 ат. Из парогенератора пар поступает к серийной турбине 150 Мвт, 130 ат, 565° С. В схему этой турбоустановки включен деаэратор 1,2 ат и пять регенеративных подогревателей высокого давления. Часть питательной воды из деаэратора отводится в первую ступень экономайзера, обогреваемого уходящими газами газовой турбины. После первой ступени [c.374]
Для определения величины перетока этим методом необходимо измерить температуру газа со стороны низкого давления до смешения с газом перетока (11) и после смешения (11 ), а также температуру газа высокого давления (12). [c.103]
Схема постоянного давления — эта схема смешения потоков газа в трубопроводах (рис. 1.12,6). Давление компонентов после прохождения ими заслонки (до смешения компонентов) снижается до уровня давления смеси в общем коллекторе рт-В условиях невысокого давления газовая смесь и компоненты этой смеси обычно рассматриваются как идеальные газы. Считается, что такая газовая смесь подчиняется закону диффузного равновесия, или, как обычно говорят, закону Дальтона, характеризующему установившееся состояние газовой смеси каждый компонент газовой смеси распространен во всем объеме смеси V и развивает в этом объеме такое парциальное (т. е. свое) давление р1, какое он развивал бы в нем при температуре смеси Т без участия других компонентов. [c.25]
Для полетов со сверхзвуковой скоростью могут применяться прямоточные воздушно-реактивные двигатели несколько иной конструктивной схемы (рис. 15.48). При движении летательного аппарата со сверхзвуковой скоростью с такой же скоростью воздушный поток входит в диффузор, представляющий собой сопло Лаваля . Сверхзвуковой поток сначала будет тормозиться в сужающейся части канала. Скорость потока воздуха в самой узкой части диффузора равна местной скорости звука. При торможении давление воздуха повышается. В расширяющейся части диффузора происходит дальнейшее торможение газового потока, в результате чего его давление продолжает увеличиваться, а скорость становится дозвуковой. После диффузора воздушный поток поступает в камеру сгорания. В камере сгорания происходит смешение топлива с воздухом и его сгорание. Температура и внутренняя энергия газа увеличиваются. Из камеры сгорания газовый поток направляется в комбинированный канал (сопло Лаваля). В сужающейся части сопла газовый поток в результате расширения ускоряется и в минимальном сечении его скорость становится равной местной скорости звука. В дальнейшем расширение газа происходит уже в расширяющейся [c.459]
Горючие газы подаются в топку концентратора под давлением 1500— 1600 мм вод. ст. Топочные газы из камеры смешения но футерованным газоходам и барботажным трубам вначале поступают во вторую по ходу кислоты камеру, концентратора. Здесь, барботируя через кислоту, газы интенсивно нагревают ее, одновременно насыщаясь парами воды.- Далее газы поступают в первую по ходу кислоты камеру, где дополнительно насыщаются парами воды, и при температуре 155—160 °С. через электрофильтр направляются в выхлопную трубу. Выходящие из концентратора газы содержат 30—40 г/м — серной кислоты, а после очистки в электрофильтре — до 0,8 г/л НаЗО . [c.108]
Газификация 249 Газовая постоянная 58 Газовые процессы 72 Газовые стабилизаторы напряжения 579 Газогенераторный процесс горения 249 Газогенераторы 249 Газодинамика 690—700 Газообразное топливо — см. Топливо газообразное Г азопроводы — Расчет 631 Газы — Давление и температура после смешения 59 [c.706]
В аждой из этих частей находится тот или иной идеальный газ. Например, в i-й части газ i содержится в количестве Ni молей. Предположим, что температуры и давления до смешения во всех частях одинаковые. Если теперь удалить все внутренние перегородки и обеспечить адиабатность всего сосуда, то в соответствии с законом Джоуля, утверждающим, что виупренияя энергия идеального газа не зависит от объем а, температура после смешения останется неизменной И -рав- [c.141]
Давление и температура газов после смешения. Смешение при /= onst. Химически недействующие друг на друга газы до смешения имеют объёмы V,, V ,. , Vn, веса G,, G , при давлениях р,, р ,. . р и температурах. ….объём смеси [c.458]
Смешение газов при V = onst. Если суммарный объем, занимаемый газами до и после смешения, остается неизменным и газы до смешения занимают объемы Vi, Vч,. , Vn м при давлениях р , р ,. , , , и температурах ТI, Т2, , Т , а отношения теплоемкостей этих газов Ср/б о равны ki, k ,. . ., /г , то параметры смеси определяют по формулам температура [c.55]
Левая стенка А праного сосуда проницаема только для первого газа, правая стенка левого сосуда только для второго. Когда сосуды сдвинуты, в них находится смесь обоих газов. При раздвижении сосудов в части I давление pi, в части 1 + 2 давление Pi+Рг и в части 2 давление pj- На левую и правую стенки левого сосуда действует давление р . Следовательно, на весь левый сосуд действует сила, равная нулю, и поэтому работа при перемещении сосуда также равна нулю. Количество теплоты Sg = dL — -5 получаемое при этом от термос1ага, тоже равно нулю, поскольку внутренняя энергия идеального газа при постоянной темпера уре не зависит от объема и 5И =(). Смешение газов одинаковой температуры, проведенное подобным образом, также будет обратимым, но при этом объем смеси и объем каждой компоненты смеси до смешения и после смешения один и тот же. [c.313]
Температуры водяных паров и газообразных продуктов сгорания после смешения одинаковы ty = t ). Из-за необратимости процессов 61 и 3 3 теряется полезная внешняя работа, равная соответственно Asei и Asra—Для подсчета ее допустим, что процессы теплообмена и смешения происходят не одновременно, а последовательно, т, е. водяной пар сначала нагревается до температуры ty без смешения вдоль изобары 6 5 7, а затем смешивается с газообразными продуктами сгорания при неизменной температуре ty. Такое рассмотрение допустимо, если энтальпии смешивающихся тел суть функции только температуры, но не давления, т. е. если перегретый водяной пар и газообразные продукты сгорания можно считать идеальными газами кстати, только при этом условии и справедливо равенство р сумме ру -f рз . [c.589]
Смешение потокоь газов. Потоки газов имеют расходы к единицу времени по весу G,. Q i,. . , G , по объёму 1/,, Vj,. . . , V , их давления н температуры р . Pi. , Рп, iv h . давление р после смешения не должно превышать давления того потока, у которого оно было наименьшим. Отсутствие при смешении теплообмена с окружающей средой и отдачи внешней работы приводит поставленную задачу к условию (по уравнению первого начала для движущихся сред), что энтальпия системы остаётся неизменной. [c.458]
Двуокись углерода компрессором 1 и аммиак насосом 2 сжимаются до давления синтеза (140—420 ат) и смеши-, ваются с рециркулирующрм горячим газовым потоком, имеющим температуру 315—535 °С. После смешения поток газа при температуре 300—260 С поступаем в колонну синтеза — теплообменник 4, где происходит образование карбамида реакционное тепло расходуется на получение пара. Плав, выходящий и теплообменника, дросселируется до давления 15—30 ат и направляется в сепаратор 7, газовая фаза из сепаратора входит в нагнетательную линию турбокомпрессора 3, раствор направляется в колонну 8 дистилляции первой ступени. [c.222]
Особенностью парогазового цикла является необратимый характер процессов 41 и 3″3 из-за теплообмена при конечной разности температур между водяными парами и газообразными продуктами сгорания и их смешения. Линия 34 в пароводяном цикле изображает регенеративный подогрев питательной воды теплотой отработанных газов, выделяющейся на участке 4 Г. Вода поступает в регенеративный теплообменник после сжатия в насосе. Если давление, до которого сжимается вода, превышает давление в камере сгорания, то при впрыске воды в парогазогенератор давление ее резко уменьшается от рз до р, равного давлению в камере сгорания. Этот процесс, происходящий без совершения полезной внешней работы и теплообмена (из-за скоротечности процесса) с горячими газами, можно рассматривать как адиабатическое дросселирование, вследствие чего /4 = ц (из этого условия легко определить положение точки 6 на Т—а-диаграмме). Вследствие необратимости процесса 46 теряется полезная работа А/ , равная Гз (а — а4), если температура окружающей среды Т = Т2. [c.588]
Отсюда вытекает, что работа пара и газа в контактной установке будет примерно соответствовать работе, которую они производили бы при раздельном расширении от начальной температуры Т1 ъ интервале давлений — р — Из выражения (3-30) следует, что температуру смеси после расширения можно определить, еели рассмотреть смешение компонентов после их условного самостоятельного расширения. [c.82]