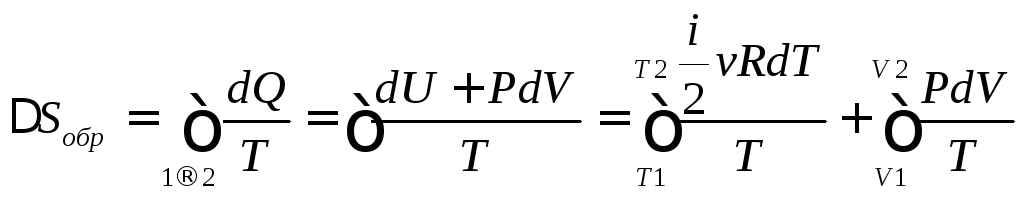Андрей Геннадьевич Блохин
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Энтропия – это фундаментальная физическая величина. Введение этого понятия завершило этап становления понятийного аппарата термодинамики. Следующим этапом развития этой науки было выяснение физического смысла энтропии.
Установление принципа Больцмана (формулы Больцмана) и таким образом связи между термодинамикой и статистической физикой, позволило энтропии покинуть пределы физики и войти в другие области знаний.
Энтропия – это общезначимое понятие, применяемое во множестве наук, например, в:
- физике;
- химии;
- билогии;
- космологии;
- теории информации.
Введено это понятие было Р. Клаузиусом. Важные работы посвятил энтропии Л. Больцман, М. Планк.
Определение 1
Функция состояния полным дифференциалом которой является δQ/T называется энтропией ($S$):
$dS=frac{delta Q}{T}left( 1 right)$,
где $delta Q$ – элементарное тело, получаемое термодинамической системой; $T$- термодинамическая температура.
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
Замечание 1
Отметим, что формула (1) справедлива только для обратимых процессов. Например, для процессов, проводимых в идеальном газе.
Важно, что выражение (1) определяет не саму энтропию, а ее изменение, или разность энтропий. При помощи данной формулы можно вычислить, каково изменение энтропии, если термодинамическая система переходит из одного состояния в другое, но нельзя понять, какова энтропия каждого из этих состояний.
Напомним формулу Больцмана для энтропии, так как она нам поможет понять физический смысл, процессов, которые происходят с энтропией:
$S=klnW, left( 2 right)$
где ($W$) – термодинамическая вероятность (статистический вес состояния), то есть количество способов, реализации данного состояния термодинамической системы. $W$ ≥1; $k$- постоянная Больцмана.
Изменение энтропии, исходя из статистической формулы Больцмана, найдем как:
$S_{2}-S_{1}=klnfrac{W_{2}}{W_{1}}left( 2.1 right)$).
«Изменение энтропии» 👇
Вычисление изменения энтропии в изотермическом процессе
Вычислим изменение энтропии в одном моле идеального газа при изотермическом процессе ($T=const$). Оттолкнемся от первого начала термодинамики в дифференциальной форме:
$delta Q=dU+pdV, left( 3 right)$,
где $dU$ — изменение внутренней энергии идеального газа; $pdV$=$delta A$ – работа, совершаемая газом.
Найдем отношение всех слагаемых выражения (3) и температуры:
$frac{delta Q}{T}=C_{V}frac{dT}{T}+frac{p}{T}dVleft( 4 right)$.
где $C_V$ – теплоемкость газа при $V=const$.
Для идеального газа справедливо уравнение Менделеева – Клапейрона, учитывая, что у нас 1 моль газа:
$pV=RTto frac{p}{T}=frac{R}{V}left( 5 right)$.
Учтем:
$frac{dT}{T}=dleft( ln T right),, frac{dV}{V}=dleft( ln V right)left( 6 right)$.
в этом случае мы можем записать для уравнения (4):
$frac{delta Q}{T}=dleft( C_{V}lnT+RlnV right)left( 7 right)$.
По определению (1), и принимая во внимание (7), запишем:
$dS=dleft( C_{V}lnT+RlnV right)left( 8 right)$.
Формула (8) показывает нам, что в изотермическом процессе изменяется только второе слагаемое правой части:
- при увеличении объема энтропия увеличивается,
- с уменьшением объема энтропия уменьшается.
Данный результат очевиден, так как если увеличивается объем, то возрастает количество мест, которое смогут занять частицы при неизменяющемся их количестве. Следовательно, растет число разных возможностей расположения на этих местах (увеличивается количество пространственных микросостояний). Увеличение числа микросостояний означает увеличение энтропии (см формулу (2)).
Изменение энтропии в изохорическом процессе
Рассмотрим изохорный процесс в идеальном газе ($V=const$ или $dV=0$). Из формулы (7) для изохорного процесса следует:
$dS=dleft( C_{V}lnT+RlnV right)=d(C_{V}lnT)left( 9 right)$.
После интегрирования (9), получим:
$S_{2}-S_{1}=C_{V}ln left( frac{T_{2}}{T_{1}} right)left( 10 right)$.
Формула (10) показывает, что в изохорическом процессе при увеличении температуры происходит рост энтропии. Данный результат можно пояснить так:
- при увеличении температуры растет средняя энергия частиц газа;
- увеличивается количество возможных энергетических состояний.
Изменение энтропии в адиабатном процессе
Адиабатный процесс характеризуется тем, что он происходит без теплообмена (δQ=0). Исследуя адиабатный процесс в идеальном газе, за основу для вычисления энтропии примем выражение (8). Найдем интеграл правой и левой частей этого выражения, получим:
$S_{2}-S_{1}=C_{V}ln left( frac{T_{2}}{T_{1}} right)+Rln {left( frac{V_{2}}{V_{1}} right)left( 11 right).}$
Запишем уравнение адиабатного процесса в параметрах $T,V$:
$T_{1}V_{1}^{gamma -1}=T_{2}V_{2}^{gamma -1}left( 12 right)$.,
где $gamma =frac{C_{p}}{C_{V}}-$ показатель адиабаты. Возьмем натуральные логарифмы от обеих частей выражения (12), имеем:
$ln left( frac{T_{2}}{T_{1}} right)=left( gamma -1 right)ln left( frac{V_{1}}{V_{2}} right)=-left( gamma -1 right)ln left( frac{V_{2}}{V_{1}} right)left( 13 right)$.
Преобразуем выражение (11), приняв во внимание формулу (13):
$S_{2}-S_{1}=C_{V}left[ -left( gamma -1 right)ln left(frac{V_{2}}{V_{1}} right) right]+Rln left( frac{V_{2}}{V_{1}} right)=-C_{V}left( frac{C_{p}}{C_{V}}-1 right)ln left( frac{V_{2}}{V_{1}}right)$
$+Rln {left( frac{V_{2}}{V_{1}} right)=left[ -C_{V}left(frac{C_{p}}{C_{V}}-1 right)+R right]ln {left( frac{V_{2}}{V_{1}}right)=left[ C_{V}-C_{p}+R right]ln left( frac{V_{2}}{V_{1}} right)}}left( 14 right)$.
Вспомним соотношение Майера:
$R=C_{p}-C_{V}left( 15 right)$
и сделаем вывод о том, что изменение энтропии в адиабатном процессе нет:
$S_{2}-S_{1}=0.$
Адиабатный процесс является изоэнтропийным ($S=const$).
При адиабатном расширении газа увеличение энтропии может идти только за счет увеличения объема, но при этом происходит уменьшение температуры, и энтропия уменьшается из-за уменьшения температуры. Данные тенденции взаимно компенсируют друг друга.
Рассмотрим пример. Два сосуда разного объема содержат по $nu$ молей одинакового идеального газа. Температуры газов равны $ T_1$ и $ T_2$. Сосуды соединяют, газы перемешиваются. Система приходит в состояние равновесия. Определим изменение энтропии в этом процессе.
Рисунок 1. Изменение энтропии в адиабатном процессе. Автор24 — интернет-биржа студенческих работ
Будем считать, что изобарное расширение каждого из газов до конечного объема является обратимым. В этом процессе температура каждой из газовых компонент изменяется до конечной температуры $frac{T_{1}+T_{2}}{2}$. Найдем изменение энтропии каждого из газов по отдельности:
$Delta S_{1}=intlimits_a^b frac{dT}{T} =nu c_{p}ln left(frac{T_{1}+T_{2}}{2T_{1}} right)left( 16 right)$,
где $a=T_{1};b=frac{T_{1}+T_{2}}{2}$ $c_p$ – молярная теплоемкость газа при постоянном давлении.
Изменение энтропии второго газа запишем аналогично:
$Delta S_{2}=nu c_{p}ln left( frac{T_{1}+T_{2}}{2T_{2}} right)left( 17right)$.
Поскольку энтропия является аддитивной величиной, то полное изменение энтропии найдем как сумму:
$Delta S_{2}=Delta S_{1}+Delta S_{2}=nu c_{p}ln left( frac{T_{1}+T_{2}}{2T_{1}} right)+c_{p}ln left(frac{T_{1}+T_{2}}{2T_{2}} right)=nu c_{p}ln frac{left( T_{1}+T_{2} right)^{2}}{4T_{1}T_{2}}=2nu$ $c_{p}lnleft( frac{T_{1}+T_{2}}{2sqrt {T_{1}T_{2}} } right)$.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Итак,
,
как мера изменения беспорядка или
неупорядоченности системы, определяемое
в ТД через
для обратимых процессов, может быть
вычислена в некоторых процессах через
указанную формулу.
-
Приращение энтропии при нагреве твердого
тел и жидкостей.
Следует учитывать. Что выше приведенная
формула справедлива лишь для обратимых
процессов, а, значит, процесс нагрева
должен быть равновесным или достаточно
медленным, тогда температура тела в
любой момент нагрева можно считать
определенной и равной по всему объему.
Учитывая, что
,
получим
т.к.
.
В процессе охлаждения
.
2) Приращение энтропии при фазовых
переходах
а) плавление
-удельная
теплота плавления
б) кристаллизация
в) парообразование
—
удельная теплота парообразования
г) конденсация
-
Приращение энтропии идеального газа.
Рассмотрим
при
изопроцессах
а) Изохорный
б) Изотермический
в) Изобарный
г) Адиабатный
§34. Закон увеличения энтропии (II начало тд).
Теорема Нернста
(III
начало ТД)
Из самого определения энтропии, как
величины, характеризующей вероятность
термодинамического состояния, определяемую
числом микросостояний, следует, что в
состоянии равновесия вероятность или
число микросостояний наибольшее, в
противном случае система стремилась
бы к равновесию. Стремление изолированной
термодинамической системы к равновесию,
как фундаментальное свойство природы,
и является вторым началом термодинамики.
Энтропия теплоизолированной или
замкнутой системы не может убывать. Она
увеличивается при необратимых процессах
и остается постоянной при обратимых
(равновесных) процессах в замкнутой
системе, т.е.
для замкнутых систем (
),
гдепри
равновесных процессах или в состоянии
равновесия.
Таким образом, изолированная система
с течением времени приходит в состояние
термодинамического равновесия, чему
отвечает рост энтропии до максимального
значения при равновесии.
Эта формулировка касается замкнутых
термодинамических систем, т.е.
самопроизвольно из хаоса не может
возникнуть порядок, т.к. энтропия в
теплоизолированных системах может
только возрастать.
Для замкнутых или теплоизолированных
систем имеет место возрастание энтропии,
при этом
при обратимых процессах и
при необратимых процессах. Если
термодинамическая система не является
изолированной, топри равновесных процессах и
при
неравновесных процессах, т.к. знак
неравенства связан с необратимостью
процессов.
Термодинамическая система, не являющаяся
замкнутой, именуется еще открытой
термодинамической системой. Отметим,
что в незамкнутых термодинамических
системах энтропия может как возрастать,
так и убывать, что связано с
.
При этом если(тепло сообщается), то
,
если,
то энтропия может как возрастать, так
и убывать. При этом увеличиваться она
может только при необратимых процессах.
Таким образом, упорядоченность системы
может увеличиваться только при наличии
незамкнутости системы, при отдаче
системой тепла другим телам. Кроме
приведенной формулировки второго начала
термодинамики имеются и другие
эквивалентные формулировки:
-
Формулировка Клаузиса
Невозможны такие процессы, единственным
конечным результатом которых был бы
переход тепла от менее нагретого тела
к телу, более нагретому. Иными словами
теплота не может самопроизвольно
переходить от менее нагретых тел к более
нагретым. Важным моментом термодинамики
является исследование процессов при
низких температурах. Исследование
процессов в криогенной области привели
к следующему обобщению. Абсолютный ноль
температур не достижим, а при стремлении
температуры к абсолютному нулю энтропия
любого тела также стремится к нулю ().
Т.е. статистический весединственному микросостоянию.
Соответствующему температуре абсолютного
нуля. Это утверждение носит название
тепловой теоремы Нернста (илиIII-го
начала термодинамики).
Из теоремы Нернста следует, что при
,
следовательно энтропия тела при
температуреTравна
количеству приведенной теплоты,
полученной телом при его обратимом
переходе из состояния св указанное состояние.
Соседние файлы в папке Лекции
- #
- #
- #
From Wikipedia, the free encyclopedia
In classical thermodynamics, entropy (from Greek τρoπή (tropḗ) ‘transformation’) is a property of a thermodynamic system that expresses the direction or outcome of spontaneous changes in the system. The term was introduced by Rudolf Clausius in the mid-19th century to explain the relationship of the internal energy that is available or unavailable for transformations in form of heat and work. Entropy predicts that certain processes are irreversible or impossible, despite not violating the conservation of energy.[1] The definition of entropy is central to the establishment of the second law of thermodynamics, which states that the entropy of isolated systems cannot decrease with time, as they always tend to arrive at a state of thermodynamic equilibrium, where the entropy is highest. Entropy is therefore also considered to be a measure of disorder in the system.
Ludwig Boltzmann explained the entropy as a measure of the number of possible microscopic configurations Ω of the individual atoms and molecules of the system (microstates) which correspond to the macroscopic state (macrostate) of the system. He showed that the thermodynamic entropy is k ln Ω, where the factor k has since been known as the Boltzmann constant.
Concept[edit]
Figure 1. A thermodynamic model system
Differences in pressure, density, and temperature of a thermodynamic system tend to equalize over time. For example, in a room containing a glass of melting ice, the difference in temperature between the warm room and the cold glass of ice and water is equalized by energy flowing as heat from the room to the cooler ice and water mixture. Over time, the temperature of the glass and its contents and the temperature of the room achieve a balance. The entropy of the room has decreased. However, the entropy of the glass of ice and water has increased more than the entropy of the room has decreased. In an isolated system, such as the room and ice water taken together, the dispersal of energy from warmer to cooler regions always results in a net increase in entropy. Thus, when the system of the room and ice water system has reached thermal equilibrium, the entropy change from the initial state is at its maximum. The entropy of the thermodynamic system is a measure of the progress of the equalization.
Many irreversible processes result in an increase of entropy. One of them is mixing of two or more different substances, occasioned by bringing them together by removing a wall that separates them, keeping the temperature and pressure constant. The mixing is accompanied by the entropy of mixing. In the important case of mixing of ideal gases, the combined system does not change its internal energy by work or heat transfer; the entropy increase is then entirely due to the spreading of the different substances into their new common volume.[2]
From a macroscopic perspective, in classical thermodynamics, the entropy is a state function of a thermodynamic system: that is, a property depending only on the current state of the system, independent of how that state came to be achieved. Entropy is a key ingredient of the Second law of thermodynamics, which has important consequences e.g. for the performance of heat engines, refrigerators, and heat pumps.
Definition[edit]
According to the Clausius equality, for a closed homogeneous system, in which only reversible processes take place,
With T being the uniform temperature of the closed system and delta Q the incremental reversible transfer of heat energy into that system.
That means the line integral 
A state function S, called entropy, may be defined which satisfies
Entropy measurement[edit]
The thermodynamic state of a uniform closed system is determined by its temperature T and pressure P. A change in entropy can be written as
The first contribution depends on the heat capacity at constant pressure CP through
This is the result of the definition of the heat capacity by δQ = CP dT and T dS = δQ. The second term may be rewritten with one of the Maxwell relations
and the definition of the volumetric thermal-expansion coefficient
so that
With this expression the entropy S at arbitrary P and T can be related to the entropy S0 at some reference state at P0 and T0 according to
In classical thermodynamics, the entropy of the reference state can be put equal to zero at any convenient temperature and pressure. For example, for pure substances, one can take the entropy of the solid at the melting point at 1 bar equal to zero. From a more fundamental point of view, the third law of thermodynamics suggests that there is a preference to take S = 0 at T = 0 (absolute zero) for perfectly ordered materials such as crystals.
S(P, T) is determined by followed a specific path in the P-T diagram: integration over T at constant pressure P0, so that dP = 0, and in the second integral one integrates over P at constant temperature T, so that dT = 0. As the entropy is a function of state the result is independent of the path.
The above relation shows that the determination of the entropy requires knowledge of the heat capacity and the equation of state (which is the relation between P,V, and T of the substance involved). Normally these are complicated functions and numerical integration is needed. In simple cases it is possible to get analytical expressions for the entropy. In the case of an ideal gas, the heat capacity is constant and the ideal gas law PV = nRT gives that αVV = V/T = nR/p, with n the number of moles and R the molar ideal-gas constant. So, the molar entropy of an ideal gas is given by
In this expression CP now is the molar heat capacity.
The entropy of inhomogeneous systems is the sum of the entropies of the various subsystems. The laws of thermodynamics hold rigorously for inhomogeneous systems even though they may be far from internal equilibrium. The only condition is that the thermodynamic parameters of the composing subsystems are (reasonably) well-defined.
Temperature-entropy diagrams[edit]
Fig.2 Temperature–entropy diagram of nitrogen. The red curve at the left is the melting curve. The red dome represents the two-phase region with the low-entropy side the saturated liquid and the high-entropy side the saturated gas. The black curves give the TS relation along isobars. The pressures are indicated in bar. The blue curves are isenthalps (curves of constant enthalpy). The values are indicated in blue in kJ/kg.
Entropy values of important substances may be obtained from reference works or with commercial software in tabular form or as diagrams. One of the most common diagrams is the temperature-entropy diagram (TS-diagram). For example, Fig.2 shows the TS-diagram of nitrogen,[3] depicting the melting curve and saturated liquid and vapor values with isobars and isenthalps.
Entropy change in irreversible transformations[edit]
We now consider inhomogeneous systems in which internal transformations (processes) can take place. If we calculate the entropy S1 before and S2 after such an internal process the Second Law of Thermodynamics demands that S2 ≥ S1 where the equality sign holds if the process is reversible. The difference Si = S2 − S1 is the entropy production due to the irreversible process. The Second law demands that the entropy of an isolated system cannot decrease.
Suppose a system is thermally and mechanically isolated from the environment (isolated system). For example, consider an insulating rigid box divided by a movable partition into two volumes, each filled with gas. If the pressure of one gas is higher, it will expand by moving the partition, thus performing work on the other gas. Also, if the gases are at different temperatures, heat can flow from one gas to the other provided the partition allows heat conduction. Our above result indicates that the entropy of the system as a whole will increase during these processes. There exists a maximum amount of entropy the system may possess under the circumstances. This entropy corresponds to a state of stable equilibrium, since a transformation to any other equilibrium state would cause the entropy to decrease, which is forbidden. Once the system reaches this maximum-entropy state, no part of the system can perform work on any other part. It is in this sense that entropy is a measure of the energy in a system that cannot be used to do work.
An irreversible process degrades the performance of a thermodynamic system, designed to do work or produce cooling, and results in entropy production. The entropy generation during a reversible process is zero. Thus entropy production is a measure of the irreversibility and may be used to compare engineering processes and machines.
Thermal machines[edit]
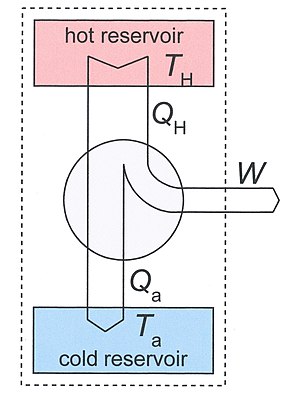
Figure 3: Heat engine diagram. The system, discussed in the text, is indicated by the dotted rectangle. It contains the two reservoirs and the heat engine. The arrows define the positive directions of the flows of heat and work.
Clausius’ identification of S as a significant quantity was motivated by the study of reversible and irreversible thermodynamic transformations. A heat engine is a thermodynamic system that can undergo a sequence of transformations which ultimately return it to its original state. Such a sequence is called a cyclic process, or simply a cycle. During some transformations, the engine may exchange energy with its environment. The net result of a cycle is
- mechanical work done by the system (which can be positive or negative, the latter meaning that work is done on the engine),
- heat transferred from one part of the environment to another. In the steady state, by the conservation of energy, the net energy lost by the environment is equal to the work done by the engine.
If every transformation in the cycle is reversible, the cycle is reversible, and it can be run in reverse, so that the heat transfers occur in the opposite directions and the amount of work done switches sign.
Heat engines[edit]
Consider a heat engine working between two temperatures TH and Ta. With Ta we have ambient temperature in mind, but, in principle it may also be some other low temperature. The heat engine is in thermal contact with two heat reservoirs which are supposed to have a very large heat capacity so that their temperatures do not change significantly if heat QH is removed from the hot reservoir and Qa is added to the lower reservoir. Under normal operation TH > Ta and QH, Qa, and W are all positive.
As our thermodynamical system we take a big system which includes the engine and the two reservoirs. It is indicated in Fig.3 by the dotted rectangle. It is inhomogeneous, closed (no exchange of matter with its surroundings), and adiabatic (no exchange of heat with its surroundings). It is not isolated since per cycle a certain amount of work W is produced by the system given by the first law of thermodynamics
We used the fact that the engine itself is periodic, so its internal energy has not changed after one cycle. The same is true for its entropy, so the entropy increase S2 − S1 of our system after one cycle is given by the reduction of entropy of the hot source and the increase of the cold sink. The entropy increase of the total system S2 — S1 is equal to the entropy production Si due to irreversible processes in the engine so
The Second law demands that Si ≥ 0. Eliminating Qa from the two relations gives
The first term is the maximum possible work for a heat engine, given by a reversible engine, as one operating along a Carnot cycle. Finally
This equation tells us that the production of work is reduced by the generation of entropy. The term TaSi gives the lost work, or dissipated energy, by the machine.
Correspondingly, the amount of heat, discarded to the cold sink, is increased by the entropy generation
These important relations can also be obtained without the inclusion of the heat reservoirs. See the article on entropy production.
Refrigerators[edit]
The same principle can be applied to a refrigerator working between a low temperature TL and ambient temperature. The schematic drawing is exactly the same as Fig.3 with TH replaced by TL, QH by QL, and the sign of W reversed. In this case the entropy production is
and the work needed to extract heat QL from the cold source is
The first term is the minimum required work, which corresponds to a reversible refrigerator, so we have
i.e., the refrigerator compressor has to perform extra work to compensate for the dissipated energy due to irreversible processes which lead to entropy production.
See also[edit]
- Entropy
- Enthalpy
- Entropy production
- Fundamental thermodynamic relation
- Thermodynamic free energy
- History of entropy
- Entropy (statistical views)
References[edit]
- ^ Lieb, E. H.; Yngvason, J. (1999). «The Physics and Mathematics of the Second Law of Thermodynamics». Physics Reports. 310 (1): 1–96. arXiv:cond-mat/9708200. Bibcode:1999PhR…310….1L. doi:10.1016/S0370-1573(98)00082-9. S2CID 119620408.
- ^ Notes for a «Conversation About Entropy»
- ^ Figure composed with data obtained with RefProp, NIST Standard Reference Database 23
Further reading[edit]
- E.A. Guggenheim Thermodynamics, an advanced treatment for chemists and physicists North-Holland Publishing Company, Amsterdam, 1959.
- C. Kittel and H. Kroemer Thermal Physics W.H. Freeman and Company, New York, 1980.
- Goldstein, Martin, and Inge F., 1993. The Refrigerator and the Universe. Harvard Univ. Press. A gentle introduction at a lower level than this entry.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Понятие энтропии
Абсолютная энтропия веществ и изменение энтропии в процессах
Стандартная энтропия
Стандартная энтропия образования
Энергия Гиббса
Стандартная энергия Гиббса образования
Энтальпийный, энтропийный фактор и направление процесса
Примеры решения задач
Задачи для самостоятельного решения
Понятие энтропии
Энтропия S – функция состояния системы. Энтропия характеризует меру неупорядоченности (хаотичности) состояния системы. Единицами измерения энтропии являются Дж/(моль·К).
Абсолютная энтропия веществ и изменение энтропии в процессах
При абсолютном нуле температур (Т = 0 К) энтропия идеального кристалла любого чистого простого вещества или соединения равна нулю. Равенство нулю S при 0 К позволяет вычислить абсолютные величины энтропий веществ на основе экспериментальных данных о температурной зависимости теплоемкости.
Изменение энтропии в процессе выражается уравнением:
ΔS = S(прод.) – S(исх.)
где S(прод.) и S(исх.) – соответственно абсолютные энтропии продуктов реакции и исходных веществ.
На качественном уровне знак S реакции можно оценить по изменению объема системы ΔV в результате процесса. Знак ΔV определяется по изменению количества вещества газообразных реагентов Δnг. Так, для реакции
CaCO3(к) = CaO(к) + CO2(г)
(Δnг = 1) ΔV > 0, значит, ΔS > 0.
Для реакции:
С(графит) + 2Н2(г) = СН4(г)
(Δnг = -1) ΔV < 0, следовательно и ΔS < 0.
Стандартная энтропия
Величины энтропии принято относить к стандартному состоянию. Чаще всего значения S рассматриваются при Р = 101,325 кПа (1 атм) и температуре Т = 298,15 К (25оС). Энтропия в этом случае обозначается Sо298 и называется стандартной энтропией при Т = 298,15 К. Следует подчеркнуть, что энтропия вещества S (Sо) увеличивается при повышении температуры.
Стандартная энтропия образования
Стандартная энтропия образования ΔSоf,298 (или ΔSообр,298) – это изменение энтропии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии.
Энергия Гиббса
Энергия Гиббса G – функция состояния системы. Энергия Гиббса равна:
G = Н – ТS.
Абсолютное значение энергии Гиббса определить невозможно, однако можно вычислить изменение δG в результате протекания процесса.
Критерий самопроизвольного протекания процесса: в системах, находящихся при Р, Т = const, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением энергии Гиббса (ΔG < 0). При достижении равновесия в системе ΔG = 0.
Стандартная энергия Гиббса образования
Стандартная энергия Гиббса образования δGоf,298 (или δGообр,298) – это изменение энергии Гиббса в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества пристутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Для простых веществ, находящихся в термодинамически наиболее устойчивой форме, δGоf,298 = 0.
Энтальпийный, энтропийный фактор и направление процесса
Проанализируем уравнение ΔGоТ = ΔНоТ — ΔТSоТ. При низких температурах ТΔSоТ мало. Поэтому знак ΔGоТ определяется в основном значением ΔНоТ (энтальпийный фактор). При высоких температурах ТΔSоТ – большая величина, знак Δ GоТ определяется и энтропийным фактором. В зависимости от соотношения энтальпийного (ΔНоТ) и энтропийного (ТΔSоТ) факторов существует четыре варианта процессов.
-
-
- Если ΔНоТ < 0, ΔSоТ > 0, то ΔGоТ < 0 всегда (процесс может протекать самопроизвольно при любой температуре).
- Если ΔНоТ > 0, ΔSоТ < 0, то ΔGоТ > 0 всегда (процесс не протекает ни при какой температуре).
- Если ΔНоТ < 0, ΔSоТ < 0, то ΔGоТ < 0 при Т < ΔНо/ΔSо (процесс идет при низкой температуре за счет энтальпийного фактора).
- Если ΔНоТ > 0, ΔSоТ > 0, то ΔGоТ < 0 при Т > ΔНо/ ΔSо (процесс идет при высокой температуре за счет энтропийного фактора).
-
Примеры решения задач
Задача 1. Используя термодинамические справочные данные, вычислить при 298,15 К изменение энтропии в реакции:
4NH3(г) + 5O2(г) = 4NО(г) + 6H2O(ж)
Объяснить знак и величину ΔSо.
Решение. Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | NH3(г) | O2(г) | NО(г) | H2O(ж) |
| Sо298,
Дж/(моль·К) |
192,66 | 205,04 | 210,64 | 69,95 |
ΔSох.р.,298 = 4Sо298(NО(г) ) + 6Sо298(H2O(ж)) — 4Sо298(NH3(г)) — 5Sо298(O2(г)) = 4× 210,64 + 6× 69,95 — 4× 192,66 — 5× 205,04 = — 533,58 Дж/К
В данной реакции ΔV < 0 (Δnг = — 5), следовательно и ΔSoх.р.,298 < 0, что и подтверждено расчетом.
Задача 2. Используя справочные термодинамические данные, рассчитать стандартную энтропию образования NH4NO3(к). Отличается ли стандартная энтропия образования NH4NO3(к) от стандартной энтропии этого соединения?
Решение. Стандартной энтропии образования NH4NO3 отвечает изменение энтропии в процессе:
N(г) + 2H2(г) + 3/2O2(г) = NH4NO3(к); δSоf,298(NH4NO3(к)) = ?
Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2(г) | H2(г) | O2(г) | NH4NO3(к) |
| Sо298,
Дж/(моль·К) |
191,50 | 130,52 | 205,04 | 151,04 |
ΔSох.р.,298 = ΔSоf,298(NH4NO3(к)) = Sо298(NH4NO3(к)) — Sо298(N2(г)) — 2Sо298(H2(г)) – 3/2Sо298(O2(г)) = 151,04–191,50 —— 2× 130,52–3/2× 205,04 = — 609,06 Дж/(моль·К).
Стандартная энтропия образования NH4NO3(к), равная — 609,06 Дж/(моль·К), отличается от стандартной энтропии нитрата аммония Sо298(NH4NO3(к)) = +151,04 Дж/(моль·К) и по величине, и по знаку. Следует помнить, что стандартные энтропии веществ Sо298 всегда больше нуля, в то время как величины ΔS0f,298, как правило, знакопеременны.
Задача 3. Изменение энергии Гиббса реакции:
2Н2(г) + О2(г) = 2 Н2О(ж)
равно δGо298= –474,46 кДж. Не проводя термодинамические расчеты, определить, за счет какого фактора (энтальпийного или энтропийного) протекает эта реакция при 298 К и как будет влиять повышение температуры на протекание этой реакции.
Решение. Поскольку протекание рассматриваемой реакции сопровождается существенным уменьшением объема (из 67,2 л (н.у.) исходных веществ образуется 36 мл жидкой воды), изменение энтропии реакции ΔSо<0. Поскольку ΔGо298 реакции меньше нуля, то она может протекать при температуре 298 К только за счет энтальпийного фактора. Повышение температуры уменьшает равновесный выход воды, поскольку ТΔSо<0.
Задача 4. Используя справочные термодинамические данные, определить может ли при 298,15 К самопроизвольно протекать реакция:
С4Н10(г) = 2С2Н4(г) + Н2(г)
Если реакция не будет самопроизвольно протекать при 298,15 К, оценить возможность ее протекания при более высоких температурах.
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | С4Н10(г) | С2Н4(г) | Н2(г) |
| ΔGоf,298× , кДж/моль | — 17,19 | 68,14 | 0 |
| Sо298, Дж/(моль·К) | 310,12 | 219,45 | 130,52 |
ΔGох.р.,298 = 2ΔGоf,298(С2Н4(г)) + ΔGоf,298(Н2(г)) — ΔGоf,298(С4Н10(г)) = 2× 68,14 + 17,19 = 153,47 кДж.
ΔGох.р.,298 > 0, следовательно, при Т = 298,15 К реакция самопроизвольно протекать не будет.
ΔSох.р.,298 = 2Sо298(С2Н4(г)) + Sо298(Н2(г)) — Sо298(С4Н10(г)) = 2× 219,45 + 130,52 – 310,12 = +259,30 Дж/К.
Поскольку ΔSох.р.,298 > 0, то при температуре Т>ΔНо/ΔSо величина ΔGох.р.,298 станет величиной отрицательной и процесс сможет протекать самопроизвольно.
Задача 5. Пользуясь справочными данными по ΔGоf,298 и Sо298, определите ΔHо298 реакции:
N2O(г) + 3H2(г) = N2H4(г) + H2O(ж)
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2O(г) | H2(г) | N2H4(г) | H2O(ж) |
| ΔGоf,298, кДж/моль | 104,12 | 0 | 159,10 | -237,23 |
| Sо298, Дж/(моль·К) | 219,83 | 130,52 | 238,50 | 69,95 |
ΔGох.р.,298 = ΔGоf,298(N2H4(г)) + ΔGоf,298(H2O(ж)) – ΔGоf,298(N2O(г)) – 3ΔGоf,298(H2(г)) = 159,10 + (–237,23) – 104,12 – 0 = –182,25 кДж.
ΔSох.р.,298 = Sо298(N2H4(г)) + Sо298(H2O(ж)) – Sо298(N2O(г)) — 3Sо298(H2(г)) = 238,50 + 69,95 – 219,83 –3× 130,52 = –302,94 Дж/К.
ΔGо298 = ΔНо298 – ТΔSо298. Подставляя в это уравнение величины ΔНо298 и ТΔSо298, получаем:
ΔНо298 = –182,25× 103 + 298·(–302,94) = –272526,12 Дж = – 272,53 кДж.
Следует подчеркнуть, что поскольку ΔSо298 выражена в Дж/(моль× К), то при проведении расчетов ΔG0298 необходимо также выразить в Дж или величину ΔS0298 представить в кДж/(мольK).
Задачи для самостоятельного решения
1. Используя справочные данные, определите стандартную энтропию образования ΔSоf,298 NaHCO3(к).
2. Выберите процесс, изменение энергии Гиббса которого соответствует стандартной энергии Гиббса образования NO2(г):
а) NO(г) + 1/2O2(г) = NO2(г);
б) N2(г) + 2O2(г) = 2NO2(г);
в) 1/2N2(г) + O2(г) = NO2(г);
г) N(г) + O2(г) = NO2(г).
3. Используя справочные данные, вычислите при 298,15 К изменение энтропии в реакции:
2NH4NO3(к) = 2N2(г) + 4H2O(г) + О2(г).
Объясните знак и величину ΔSº реакции.
-
- .
|
δSох.р.,298 =1040,84 Дж/К. В данной реакции δV > 0 (D nг = 7), |
4. Используя справочные данные, определите принципиальную возможность протекания реакции при 298,15 К:
NiO(к) + C(графит) = Ni(к) + CO(г)
Если реакция не будет самопроизвольно протекать при 298,15 К, оценить возможность ее протекания при более высоких температурах.
|
ΔGох.р.,298 = 74,45 кДж > 0, следовательно, при Т = 298,15 К |
5. Рассчитайте стандартную энергию Гиббса образования ΔGоf,298 C2H5OH(ж), используя справочные данные о величинах ΔНоf,298 и Sо298.
6. Используя справочные данные, определите стандартную энтропию образования ΔSоf,298 K2Cr2O7(к).
7. На основе расчетов термодинамических величин покажите, чем эффективнее восстанавливать при 298 К Cr2O3(к) до металла — алюминием или магнием:
1) Cr2O3(к) + 3Mg(к) = 3MgO(к) + 2Cr(к); ΔGо1;
2) Cr2O3(к) + 2Al(к) = Al2O3(к) + 2Cr(к); ΔGо2.
|
ΔGо1=-648,9 кДж; ΔGо2=-523,3 кДж. |
8. Используя справочными данными по величинам Sо298, определите возможность самопроизвольного протекания в изолированной системе при 298 К процесса:
KClO3(к) = KCl(к) + 3/2O2(к)
|
ΔSо298=247,1 Дж/К. |
9. Используя справочные данные, вычислите при 298 К изменение энтропии в процессе:
Н2(г) + 1/2О2(г) = Н2О(г)
10. На основе справочных данных оценить температуру восстановления WO3(к) водородом:
WO3(к) + 3H2(г) = W(к) + 3H2O(г).