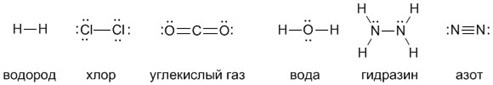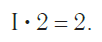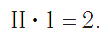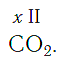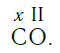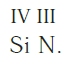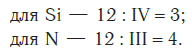Загрузить PDF
Загрузить PDF
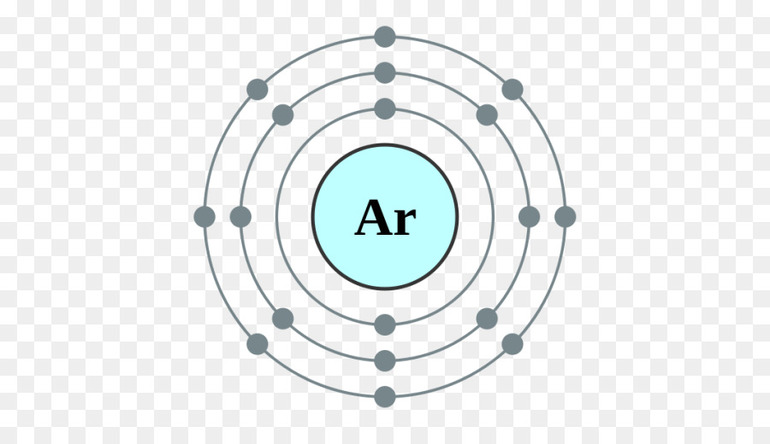
Валентные электроны находятся на внешней оболочке атома. Их количество определяет число возможных химических соединений, которые атом может образовать. Лучший способ определить количество валентных электронов — воспользоваться периодической таблицей Менделеева.
Непереходные металлы
-
1
Используйте периодическую таблицу химических элементов (таблицу Менделеева). Это определенным образом раскрашенная таблица, каждая ячейка которой содержит название химического элемента и другую важную информацию, которую можно использовать для определения количества валентных электронов в конкретном атоме. Таблицу Менделеева можно найти в учебнике по химии или здесь.
-
2
Пронумеруйте каждый столбец периодической таблицы с 1 по 18 (начиная с первого столбца слева). Как правило, все элементы одного столбца таблицы Менделеева имеют одинаковое число валентных электронов. Столбцы — это группы, на которые делятся химические элементы.[1]
- Например, над водородом (Н) напишите цифру 1, так как с него начинается первый столбец, а над гелием (He) напишите цифру 18, так как с него начинается восемнадцатый столбец.
-
3
Теперь в таблице Менделеева найдите элемент, число валентных электронов которого вы хотите найти. Вы можете сделать это по символу элемента (буквы в каждой ячейке), по его атомному номеру (число в левом верхнем углу каждой ячейки) или любой другой доступной вам информации.
- Например, определим число валентных электронов углерода (С). Его атомный номер 6 и с него начинается четырнадцатая группа.
- В этом подразделе мы не рассматриваем переходные металлы, которые расположены в группах с 3 по 12. Эти элементы немного отличаются от остальных, поэтому описанные здесь методы на них не распространяются. Переходные металлы будут рассмотрены в следующем подразделе.
-
4
Используйте номера групп, чтобы определить количество валентных электронов в непереходных металлах. Цифра, стоящая в номере группы в разряде единиц, определяет число валентных электронов в атомах элементов. Другими словами:
- Группа 1: 1 валентный электрон
- Группа 2: 2 валентных электрона
- Группа 13: 3 валентных электрона
- Группа 14: 4 валентных электрона
- Группа 15: 5 валентных электрона
- Группа 16: 6 валентных электрона
- Группа 17: 7 валентных электрона
- Группа 18: 8 валентных электрона (за исключением гелия, у которого 2 валентных электрона)
- В нашем примере, так как углерод находится в группе 14, можно заключить, что один атом углерода имеет четыре валентных электрона.
Реклама
Переходные металлы
-
1
Найдите элемент в группах с 3 по 12. В этих группах расположены переходные металлы. В этом подразделе мы расскажем, как определить число валентных электронов в атомах таких элементов. Заметьте, что в некоторых элементах число валентных электронов определить нельзя.
- Например, рассмотрим тантал (Ta); его атомный номер 73. Далее мы найдем число его валентных электронов (или, по крайней мере, попробуем это сделать).
- Обратите внимание, что переходные металлы включают лантаноиды и актиноиды (они также называются редкоземельными металлами) — два ряда элементов, которые, как правило, расположены ниже основной таблицы и которые начинаются с лантана и актиния. Все эти элементы относятся к группы 3 периодической таблицы.
-
2
Чтобы понять, почему сложно определить число валентных электронов у переходных металлов, необходимо дать небольшое пояснение о расположении электронов в атомах.[2]
- В атоме электроны расположены на электронных орбиталях. Каждая электронная орбиталь может содержать только какое-то определенное число электронов, причем заполняются орбитали, начиная с ближайшей к ядру атома и заканчивая наиболее далекой.
- При заполнении электронами внешней орбитали атома переходного металла они становятся валентными электронами, но на какое-то время, после чего в роль валентных электронов вступают электроны с других орбиталей. Это означает, что число валентных электронов может меняться.
- Для получения детальной информации о валентных электронах прочитайте эту статью.[3]
-
3
Используйте номера групп, чтобы определить количество валентных электронов в переходных металлах. Здесь номер группы, как правило, соответствует диапазону возможного числа валентных электронов.[4]
- Группа 3: 3 валентных электрона
- Группа 4: 2–4 валентных электрона
- Группа 5: 2–5 валентных электронов
- Группа 6: 2–6 валентных электронов
- Группа 7: 2–7 валентных электронов
- Группа 8: 2 или 3 валентных электрона
- Группа 9: 2 или 3 валентных электрона
- Группа 10: 2 или 3 валентных электрона
- Группа 11: 1 или 2 валентных электрона
- Группа 12: 2 валентных электрона
- В нашем примере тантал расположен в группе 5, поэтому можно заключить, что его атом имеет от двух до пяти валентных электрона (в зависимости от ситуации).
Реклама
-
1
Электронная конфигурация — это формула расположения электронов по электронным орбиталям атома химического элемента. Другими словами, это простой и наглядный способ представления электронных орбиталей атома с использованием букв и цифр.
- Например, рассмотрим электронную конфигурацию натрия (Na):
-
- 1s22s22p63s1
-
- Обратите внимание, что электронная конфигурация строится по формуле:
-
- (цифра)(буква)(надстрочная цифра)(цифра)(буква)(надстрочная цифра)…
-
- … и так далее. Здесь (цифра)(буква) — это обозначение электронной орбитали, а (надстрочная цифра) — это число электронов на этой орбитали.
- В нашем примере в атоме натрия 2 электрона на 1s-орбитали плюс 2 электрона на 2s-орбитали плюс 6 электронов на 2р-орбитали плюс 1 электрон на 3s-орбитали. Всего 11 электронов, что верно, так как атомный номер натрия 11.
- Учтите, что подуровни электронных оболочек имеют определенное число электронов. Максимальное количество электронов для орбиталей следующее:
- s: 2 электрона
- p: 6 электронов
- d: 10 электронов
- f: 14 электронов
- Например, рассмотрим электронную конфигурацию натрия (Na):
-
2
Теперь вы знаете, как расшифровывать электронную конфигурацию, и сможете найти число валентных электронов определенного элемента (за исключением, конечно, переходных металлов). Если электронная конфигурация дана в задаче, перейдите к следующему шагу. Если нет, читайте дальше.
- Вот полная электронная конфигурация оганесона (Og; атомный номер 118):
-
- 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p6
-
- Теперь, чтобы определить электронную конфигурацию любого элемента, вам просто нужно заполнить этот шаблон (до тех пор, пока у вас не останется электронов). Это проще, чем кажется. Например, определите электронную конфигурацию хлора (Cl; атомный номер 17), атом которого имеет 17 электронов:
-
- 1s22s22p63s23p5
-
- Обратите внимание, что общее число электронов равно 17: 2 + 2 + 6 + 2 + 5 = 17. Вам нужно изменить количество электронов на последней орбитали, так как предыдущие орбитали такие же, как в шаблоне (ибо полностью заполнены электронами).
- Для получения подробной информации об электронных конфигурациях прочитайте эту статью.
- Вот полная электронная конфигурация оганесона (Og; атомный номер 118):
-
3
Орбитали заполняются электронами по правилу октета: первые два электрона заполняют 1s-орбиталь, следующие два электрона заполняют 2s-орбиталь, следующие шесть электронов заполняют 2р-орбиталь (и так далее). Когда мы имеем дело с атомами непереходных металлов, мы говорим, что эти орбитали образуют вокруг атома «орбитальные оболочки», причем каждая следующая оболочка расположена дальше, чем предыдущая. Два электрона содержит только первая оболочка, а все остальные оболочки содержат по восемь электронов (кроме, опять же, атомов переходных металлов). Это называется правилом октета.
- Например, рассмотрим бор (B). Его атомный номер 5, то есть атом бора включает пять электронов, а его электронная конфигурация выглядит следующим образом: 1s22s22p1. Так как первая орбитальная оболочка имеет только два электрона, то можно заключить, что у бора только две оболочки: первая с двумя электронами (на 1s-орбитали), а вторая с тремя (на 2s- и 2р-орбиталях).
- В качестве другого примера рассмотрим хлор (Cl), у которого три орбитальные оболочки: первая с двумя электронами на 1s-орбитали, вторая с двумя электронами на 2s-орбитали и шестью электронами на 2р-орбитали, третья с двумя электронами на 3s-орбитали и пятью электронами на 3p-орбитали.
-
4
Найдите число электронов на внешней оболочке. Это и будет число валентных электронов определенного элемента. Если внешняя оболочка полностью заполнена (другими словами, если она имеет восемь электронов или два электрона в случае первой оболочки), то элемент является инертным и не будет легко вступать в реакцию с другими элементами. Опять же, данные правила не распространяются на переходные металлы.
- Например, рассмотрим бор. Так как на внешней оболочке бора находятся три электрона, то можно заключить, что у бора три валентных электрона.
-
5
Используйте строки таблицы Менделеева для определения числа орбитальных оболочек. Строки периодической таблицы химических элементов называются периодами. Каждый период соответствует количеству электронных оболочек атомов. Вы можете использовать это для определения числа валентных электронов элемента — просто посчитайте порядковый номер элемента в периоде, начиная слева. Учтите, что данный метод не распространяется на переходные металлы.
- Например, мы знаем, что у селена четыре орбитальные оболочки, потому что этот элемент расположен в четвертом периоде. Так как это шестой элемент (слева) четвертого периода (без учета переходных металлов), можно заключить, что внешняя четвертая оболочка содержит шесть электронов, и, таким образом, у селена шесть валентных электрона.
Реклама
Советы
- Обратите внимание, что электронные конфигурации могут быть записаны в сокращенном виде с использованием благородных газов (элементы группы 18). Например, электронную конфигурацию натрия можно записать так: [Ne]3s1 — по сути, она напоминает электронную конфигурацию неона, но с одним дополнительным электроном на 3s-орбитали.[5]
- У переходных металлов есть валентные подуровни, незаполненные полностью. Определение точного числа валентных электронов в переходных металлах включает в себя принципы квантовой теории и не рассматривается в данной статье.
- Обратите внимание, что форма (вид) периодической таблицы химических элементов может отличаться в разных странах. Поэтому убедитесь, что вы пользуетесь формой периодической таблицы химических элементов, которая принята в вашей стране (чтобы избежать ошибок).
- Следите за действиями (вычитание или сложение) при нахождении валентных электронов.
Реклама
Что вам понадобится
- Периодическая таблица химических элементов (таблица Менделеева)
- Карандаш
- Бумага
Об этой статье
Эту страницу просматривали 214 621 раз.
Была ли эта статья полезной?
Download Article
Download Article
In chemistry, valence electrons are the electrons that are located in the outermost electron shell of an element. Knowing how to find the number of valence electrons in a particular atom is an important skill for chemists because this information determines the kinds of chemical bonds that it can form and, therefore, the element’s reactivity. Luckily, all you need to find an element’s valence electrons is a standard periodic table of the elements.
Non-Transition Metals
-
1
Find a periodic table of elements. This is a color-coded table made up of many different squares that lists all of the chemical elements known to humankind. The periodic table reveals lots of information about the elements — we’ll use some of this information to determine the number of valence electrons in the atom we’re investigating. You can usually find these inside the cover of chemistry textbooks. There is also an excellent interactive table available online here.[1]
-
2
Label each column on the periodic table of elements from 1 to 18. Generally, on a periodic table, all of the elements in a single vertical column will have the same number of valence electrons. If your periodic table doesn’t already have each column numbered, give each a number starting with 1 for the far left end and 18 for the far right end. In scientific terms, these columns are called the element «groups.»[2]
- For example, if we were working with a periodic table where the groups aren’t numbered, we would write a 1 above Hydrogen (H), a 2 above Beryllium (Be), and so on until writing an 18 above Helium (He).
Advertisement
-
3
Find your element on the table. Now, locate the element that you want to find the valence electrons for on the table. You can do this with its chemical symbol (the letters in each box), its atomic number (the number in the top left of each box), or any of the other pieces of information available to you on the table.[3]
- For example purposes, let’s find the valence electrons for a very common element: carbon (C). This element has an atomic number of 6. It is located at the top of group 14. In the next step, we’ll find its valence electrons.
- In this subsection, we’re going to be ignoring the Transitional metals, which are the elements in the rectangle-shaped block made by Groups 3 to 12. These elements are a little different from the rest, so the steps in this subsection won’t work on them. See how to deal with these in the subsection below.
-
4
Use the group numbers to determine the number of valence electrons. The Group number of a non-transition metal can be used to find the number of valence electrons in an atom of that element. The ones place of the group number is the number of valence electrons in an atom of these elements.[4]
In other words:- Group 1: 1 valence electron
- Group 2: 2 valence electrons
- Group 13: 3 valence electrons
- Group 14: 4 valence electrons
- Group 15: 5 valence electrons
- Group 16: 6 valence electrons
- Group 17: 7 valence electrons
- Group 18: 8 valence electrons (except for helium, which has 2)
- In our example, since carbon is in group 14, we can say that one atom of carbon has four valence electrons.
Advertisement
Transition Metals
-
1
Find an element from Groups 3 to 12. As noted above, the elements in groups 3 to 12 are called «transition metals» and behave differently than the rest of the elements when it comes to valence electrons. In this section, we’ll explain how, to a certain extent, it’s often not possible to assign valence electrons to these atoms.[5]
- For example purposes, let’s pick Tantalum (Ta), element 73. In the next few steps, we’ll find its valence electrons (or, at least, try to.)
- Note that the transition metals include the lanthanide and actinide series (also called the «rare earth metals») — the two rows of elements that are usually positioned below the rest of the table that start with lanthanum and actinium. These elements all belong to group 3 of the periodic table.
-
2
Understand that transition metals don’t have «traditional» valence electrons. Understanding why transition metals don’t really «work» like the rest of the periodic table requires a little explanation of the way electrons behave in atoms. See below for a quick run-through or skip this step to get right to the answers.
- As electrons are added to an atom, they are sorted into different «orbitals» — basically different areas around the nucleus that the electrons congregate in. Generally, the valence electrons are the electrons in the outermost shell — in other words, the last electrons added.
- For reasons that are a little too complex to explain here, when electrons are added to the outermost d shell of a transition metal (more on this below), the first electrons that go into the shell tend to act like normal valence electrons, but after that, they don’t, and electrons from other orbital layers sometimes act as valence electrons instead. This means that an atom can have multiple numbers of valence electrons depending on how it is manipulated.
-
3
Determine the number of valence electrons based on the group number. Once again, the group number of the element you are examining can tell you its valence electrons. However, for the transition metals, there isn’t a pattern you can follow — group number will usually correspond to a range of possible numbers of valence electrons. These are:[6]
- Group 3: 3 valence electrons
- Group 4: 2 to 4 valence electrons
- Group 5: 2 to 5 valence electrons
- Group 6: 2 to 6 valence electrons
- Group 7: 2 to 7 valence electrons
- Group 8: 2 or 3 valence electrons
- Group 9: 2 or 3 valence electrons
- Group 10: 2 or 3 valence electrons
- Group 11: 1 or 2 valence electrons
- Group 12: 2 valence electrons
- In our example, since Tantalum is in group 5, we can say that it has between two and five valence electrons, depending on the situation.
Advertisement
-
1
Learn how to read an electron configuration. Another way to find an element’s valence electrons is with something called an electron configuration. These may at first look complicated, but they’re just a way to represent the electron orbitals in an atom with letters and numbers and they’re easy once you know what you’re looking at.[7]
- Let’s look at an example configuration for the element sodium (Na):
-
- 1s22s22p63s1
-
- Notice that this electron configuration is just a repeating string that goes like this:
-
- (number)(letter)(raised number)(number)(letter)(raised number)…
-
- …and so on. The (number)(letter) chunk is the name of the electron orbital and the (raised number) is the number of electrons in that orbital — that’s it!
- So, for our example, we would say that sodium has 2 electrons in the 1s orbital plus 2 electrons in the 2s orbital plus 6 electrons in the 2p orbital plus 1 electron in the 3s orbital. That’s 11 electrons total — sodium is element number 11, so this makes sense.
- Keep in mind that each subshell has a certain electron capacity. Their electron capacities are as follows:
- s: 2 electron capacity
- p: 6 electron capacity
- d:10 electron capacity
- f: 14 electron capacity
- Let’s look at an example configuration for the element sodium (Na):
-
2
Find the electron configuration for the element you are examining. Once you know an element’s electron configuration, finding its number of valence electrons is quite simple (except, of course, for the transition metals.) If you’re given the configuration from the get-go, you can skip to the next step. If you have to find it yourself, see below:[8]
- Examine complete electron configuration for oganesson (Og), element 118, which is the last element on the periodic table. It has the most electrons of any element, so its electron configuration demonstrates all of the possibilities you could encounter in other elements:
-
- 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p6
-
- Now that you have this, all you need to do to find another atom’s electron configuration is just fill in this pattern from the beginning until you run out of electrons. This is easier than it sounds. For example, if we want to make the orbital diagram for chlorine (Cl), element 17, which has 17 electrons, we would do it like this:
-
- 1s22s22p63s23p5
-
- Notice that the number of electrons adds up to 17: 2 + 2 + 6 + 2 + 5 = 17. You only need to change the number in the final orbital — the rest is the same since the orbitals before the final one are completely full.
- For more on electron configurations, see also this article.
- Examine complete electron configuration for oganesson (Og), element 118, which is the last element on the periodic table. It has the most electrons of any element, so its electron configuration demonstrates all of the possibilities you could encounter in other elements:
-
3
Assign electrons to orbital shells with the Octet Rule. As electrons are added to an atom, they fall into various orbitals according to the order given above — the first two go into the 1s orbital, the two after that go into the 2s orbital, the six after that go into the 2p orbital, and so on. When we’re dealing with atoms outside of the transition metals, we say that these orbitals form «orbital shells» around the nucleus, with each successive shell being further out than the ones before. Besides the very first shell, which can hold only two electrons, each shell can have eight electrons (except, again, when dealing with transition metals.) This is called the Octet Rule.[9]
- For example, let’s say we’re looking at the element Boron (B). Since its atomic number is five, we know it has five electrons and its electron configuration looks like this: 1s22s22p1. Since the first orbital shell has only two electrons, we know that Boron has two shells: one with two 1s electrons and one with three electrons from the 2s and 2p orbitals.
- As another example, an element like chlorine (1s22s22p63s23p5) will have three orbital shells: one with two 1s electrons, one with two 2s electrons and six 2p electrons, and one with two 3s electrons and five 3p electrons.
-
4
Find the number of electrons in the outermost shell. Now that you know your element’s electron shells, finding the valence electrons is easy: just use the number of electrons in the outermost shell. If the outer shell is full (in other words, if it has eight electrons or, for the first shell, two), the element is inert and will not react easily with other elements. Again, however, things don’t quite follow these rules for transition metals.[10]
- For example, if we’re working with Boron, since there are three electrons in the second shell, we can say that Boron has three valence electrons.
-
5
Use the rows of the table as orbital shell shortcuts. The horizontal rows of the periodic table are called the element «periods.» Starting from the top of the table, each period corresponds to the number of electron shells the atoms in the period possess. You can use this as a shortcut to determine how many valence electrons an element has — just start from the left side of its period when counting electrons. Once again, you’ll want to ignore the transition metals with this method, which includes groups 3-12.
- For example, we know the element selenium has four orbital shells because it is in the fourth period. Since it is the sixth element from the left in the fourth period (ignoring the transition metals), we know that the outer fourth shell has six electrons, and, thus, that Selenium has six valence electrons.
Advertisement
Add New Question
-
Question
How do we compute valence electron?
saksham jain
Community Answer
Valence electrons can be found by determining the electronic configurations of elements. Thereafter the number of electrons in the outermost shell gives the total number of valence electrons in that element.
-
Question
If an atom has 33 electrons, how many valence electrons are there?
If the atom is not an ion, then we can say that the atom has 33 protons. This means it is element 33, which is arsenic. Then we know that it is not a transition metal, so we look and find the unit digit of its group number is 5, which means it has 5 valence electrons.
-
Question
How do I determine the atomic number of helium?
The number of protons equals the atomic number.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Video
-
Note that electron configurations can be written in a sort of shorthand by using noble gasses (the elements in group 18) to stand in for the orbitals at the start of the configuration. For instance, sodium’s electron configuration can be written [Ne]3s1 — essentially, it’s the same as neon, but with one more electron in the 3s orbital.
-
Transition metals may have valence subshells that aren’t completely filled. Determining the exact number of valence electrons in transition metals involves principles of quantum theory that are beyond the scope of this article.
-
Be sure to know when to add or subtract from the last orbital for finding valence electrons.
Show More Tips
Advertisement
Things You’ll Need
- Periodic table of elements
- Pencil
- Paper
References
About This Article
Article SummaryX
To find valence electrons using a period table, first see if your atom is a transitional metal, which are the elements in the middle rectangle of the table. If the atom is outside this block, locate its group number along the top of the table. The ones digit in the group number is the number of valence electrons. To solve without a periodic table, find the electron configuration of the element and count the electrons into 1 group of 2, and then into shells of 8. The number in the last group is the amount of valence electrons. Read on for in-depth explanations and examples.
Did this summary help you?
Thanks to all authors for creating a page that has been read 2,607,488 times.
Reader Success Stories
-
Temsalet Yohannes
Dec 12, 2022
«Indeed helpful! I had problems with finding valence electrons, but it all became clear now.»
Did this article help you?
Электроны и валентность
Международный союз теоретической и прикладной химии определил валентность как максимальное число одновалентных атомов (первоначально — водорода или хлора), которые могут объединяться с атомом или фрагментом рассматриваемого элемента.
Современная альтернативная трактовка звучит несколько иначе: валентность — это число атомов водорода, которые могут объединяться с элементом в бинарном гидриде, или удвоенное количество атомов кислорода, объединяющихся с элементом в его оксиде или оксидах. Это определение отличается от формулировки МСТПХ, поскольку большинство веществ имеет более чем одну валентность.
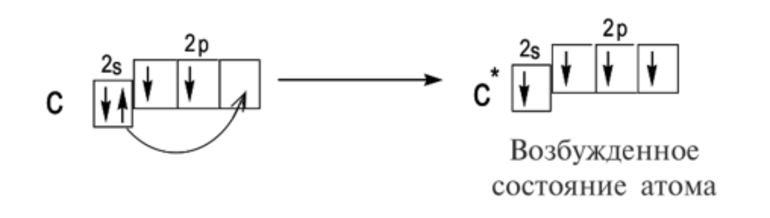
Модель ядерного атома Резерфорда (1911) показала, что внешнюю оболочку атома занимают заряженные частицы, это свидетельствует о том, что электроны ответственны за взаимодействие атомов и образование химических связей.
В 1916 году Гилберт Н. Льюис объяснил валентность и химическую связь с точки зрения тенденции атомов достигать стабильного октета из 8 электронов в валентной оболочке.
Согласно Льюису, ковалентная связь приводит к октетам при совместном использовании электронов, а ионная связь — при передаче электронов от одного атома к другому. Термин ковалентность приписывается Ирвингу Лэнгмюру. Префикс ко— означает «вместе», то есть атомы разделяют валентность. Поэтому определение валентности по формуле соединения стало возможным.
В 1930-х годах Линус Полинг предположил, что существуют также полярные ковалентные связи, которые являются промежуточными, а степень ионного характера зависит от разницы электроотрицательности двух связанных атомов.
Полинг также рассматривал гипервалентные молекулы, в которых элементы имеют кажущиеся валентности, например, в молекуле гексафторида серы (SF6). Учёный считал, что сера образует 6 истинных двух электронных связей с использованием sp3 d2 гибридных атомных орбиталей, которые объединяют одну s, три p и две d орбитали.
Для основных элементов в периодической таблице Менделеева валентность может варьироваться от 1 до 7. Многие вещества имеют общую валентность, связанную с их положением в таблице. Для описания ионов в зарядовых состояниях 1, 2, 3 и т. д. (соответственно) используются греческие/латинские цифровые префиксы (моно- / уни- / би- / три-).
Виды с одним зарядом являются одновалентными. Например, Cs+ — одновалентный катион, тогда как Ca2+ является двухвалентным, а Fe3+ — трёхвалентным. Существуют также поливалентные катионы, которые не ограничены определённым количеством валентных связей.
В отличие от Cs и Ca, Fe может существовать в других зарядовых состояниях, особенно 2+ и 4+, и поэтому известен как многовалентный (поливалентный) ион.
Переходные металлы и металлы, как правило, многовалентны, но, к сожалению, не существует простой схемы, предсказывающей их валентность.
Определение количества
Можно определить количество электронов с помощью специального онлайн-калькулятора. Однако его нахождение под рукой не всегда возможно. Поэтому следующий вариант — обратиться к атомной конфигурации элемента и просто сосчитать число заряженных частиц в самой внешней оболочке атома. Однако это чрезвычайно утомительное занятие, так как, возможно, придётся пролистать много учебников, чтобы найти конфигурации, с которыми исследователь не знаком.
Количество ВЭ элемента и его валентность определить по таблице Менделеева проще всего. Нужно обратить внимание на вертикальный столбец, в котором указана классификация.
Исключением являются переходные металлы — 3−12 группы.
Цифра в порядковом номере группы показывает, сколько валентных электронов связано с нейтральным атомом вещества, указанного в этом конкретном столбце.
Пример в таблице:
| Группа | ВЭ |
|---|---|
| 1 (I) (щелочные металлы) | 1 |
| 2 (II) (щёлочноземельные металлы) | 2 |
| 3−12 (переходные металлы) | 3−12 |
| 13 (III) (борная группа) | 3 |
| 14 (IV) (углеродная) | 4 |
| 15 (V) (группа азота) | 5 |
| 16 (VI) (кислородная группа) | 6 |
| 17 (VII) (галогены) | 7 |
| 18 (VIII или 0) (благородные газы) | 8 |
Надо сказать, что периодическая таблица — это аккуратное расположение всех элементов, которые известны науке на данный момент.
Они располагаются слева направо в порядке возрастания их атомарных номеров или числа протонов (электронов), которые они содержат.
Все вещества в таблице Менделеева делятся на четыре категории:
- элементы основной группы;
- переходные элементы;
- лантаноиды;
- актиниды.
Последние два — это внутренние переходные элементы, образующие мост в группах 2 и 13. Таблица содержит строки — периоды — и 18 столбцов, известных как группы. Есть ещё подтаблица, которая содержит 7 строк и 2 столбца с более редкими веществами.
Номер строки (периода) элемента показывает количество оболочек, окружающих его ядро.
Химические реакции
Число электронов, содержащихся во внешней оболочке атома, которая ещё называется валентной, определяет его способность образовывать связи. Поэтому элементы с одинаковым количеством валентных электронов в атоме группируются в периодическую таблицу. Обычно вещества главной группы, исключая гелий и водород, имеют тенденцию вступать в реакцию с образованием замкнутой оболочки, которая соответствует конфигурации электронов s2 p6. Это называется правилом октетов, поскольку у каждого связанного атома будет восемь ВЭ, учитывая общие электроны.
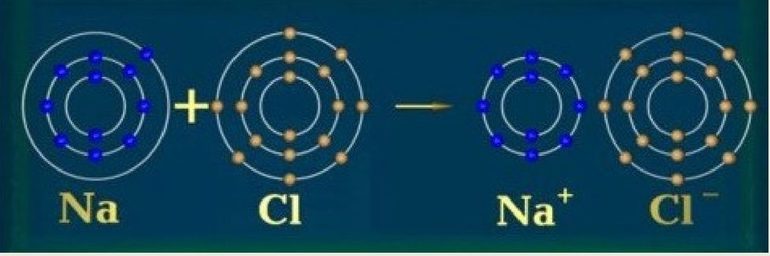
Из металлических элементов наиболее реакционноспособными являются щелочные металлы первой группы, например, калий и натрий. Такой атом имеет только один ВЭ. Эта единственная заряженная частица с лёгкостью теряется во время образования ионной связи, после чего образуется катион (положительный ион), например, K+ или Na+, оболочка которого будет закрыта.
Вторая группа — щёлочноземельные металлы, например, магний, — менее реактивны. Чтобы получить положительный ион (Mg2+), каждому их атому нужно отдать два ВЭ.
В любой группе (в столбце таблицы Менделеева) металлов реакционная способность становится больше, если двигаться от лёгкого вещества к более тяжёлому, то есть увеличивается с каждым нижним рядом таблицы. Происходит это просто потому, что у тяжёлых элементов больше оболочек. Их ВЭ приходится существовать в условиях более высоких главных квантовых чисел.
Они находятся дальше от атомного ядра и, следовательно, обладают более высокой потенциальной энергией, это означает, что связь между ними менее тесная.
Атом неметалла настроен привлекать дополнительные ВЭ, чтобы образовать полную валентную оболочку. Это может быть достигнуто одним из двух способов:
- посредством ковалентной связи, то есть атом поделится электронами с соседом;
- будет использована ионная связь, то есть электроны возьмут из другого атома.
Наиболее реактивными видами неметаллических элементов являются галогены. К ним можно отнести хлор (Cl) или, например, фтор (F).
Если двигаться от лёгкого элемента к тяжёлому, в пределах каждой группы неметаллов их реакционная способность будет уменьшаться. Это потому, что ВЭ будут терять тесную связь, поскольку приобретают более высокую энергию. По факту, самый лёгкий элемент в группе 16 — кислород — наиболее реакционноспособный неметалл, после фтора, конечно.
В таких простых случаях, когда соблюдается правило октета, валентность атома равна количеству разделённых электронов, потерянных или полученных для того, чтобы сформировался стабильный октет. Однако есть также много молекул, для которых валентность менее чётко определена, но это скорее исключения.
Электронная конфигурация
Заряженные частицы, определяющие химическую реакцию атома, — это те, чьё среднее расстояние от ядра самое большое, то есть они обладают самой высокой энергией. Для элемента основной группы ВЭ определяются как те, что находятся в электронной оболочке с наибольшим главным квантовым числом n.
Следовательно, число валентных электронов, которое может быть у вещества, зависит от конфигурации самих частиц. Например, чтобы определить валентные электроны фосфора, нужно записать его конфигурацию: 1s 2 2s 2 2p 6 3s 2 3p 3. Итак, получается 5 ВЭ (3s 2 3p 3), что соответствует максимальной валентности для P, равной 5.
Однако переходные элементы имеют частично заполненные (n — 1) d энергетические уровни, к слову, довольно близкие по энергии к уровню ns. Поэтому, в отличие от веществ основной группы, ВЭ для переходного металла определяется как частица, которая находится вне ядра благородного газа.
Как правило, d-электроны в переходных металлах ведут себя как валентные, хотя они не находятся в оболочке. Например, марганец (Mn) имеет конфигурацию 1s2 2s2 2p6 3s2 3p6 4s2 3d5, это сокращённо — [Ar] 4s2 3d5, где [Ar] — обозначение конфигурации ядра, идентичной благородному газу — аргону. Электрон 3d этого атома имеет энергию, аналогичную 4s, но превышающую 3s или 3p.
Вне аргоноподобного ядра, возможно, есть семь валентных электронов (4s2 3d5), это вполне согласуется с тем фактом, что, например, степень окисления марганца может достигать +7 (в перманганатном ионе MnO — 4).
Чем правее вещество расположено в ряду переходных металлов, тем энергия его заряженной частицы в субоболочке ниже, и тем меньше валентных свойств у такого электрона.
Например, хотя обычно у атома никеля десятая валентность (4s2 3d8), его степень окисления никогда не превышает четырёх. Для цинка 3d-оболочка является полной и ведёт себя подобно электронам ядра.
Поскольку количество ВЭ, участвующих в химических реакциях фактически, предсказать сложно, концепция этой частицы несёт мало пользы для переходных металлов, если сравнивать с элементами из основной группы. Однако подсчёт электронов для понимания химии переходных металлов является альтернативным инструментом.
Электрическая проводимость
Ответственность за электрическую проводимость вещества в том числе лежит и на электронах. Вследствие чего элементы классифицируются следующим образом:
- металлоиды (полупроводники);
- неметаллы;
- металлы.
В твёрдом состоянии металлические элементы обычно имеют высокую электропроводность. Поскольку валентный электрон металла обладает небольшой энергией ионизации, находясь в твёрдом состоянии, он относительно свободно покидает атом, чтобы связываться с другими.
Когда электрон свободный, он может перемещаться под воздействием электрического поля, то есть создавать электрический ток, отвечая за электропроводность металла. Примером хороших проводников могут служить серебро, равно как и золото, алюминий и, конечно, медь.
Как изолятор действует неметаллический элемент, поскольку имеет низкую электропроводность. В таблице Менделеева такие вещества находятся справа. Их валентная оболочка заполнена наполовину (исключение составляет бор). Когда на атом воздействует некоторое электрическое поле, заряженная частица не может его легко покинуть, поэтому такой элемент может проводить слабый постоянный или переменный электрический ток. Например, сера и алмаз — одни из таких веществ.
Изолятором также может быть твёрдое соединение, которое содержит металлы, если для образования ионных связей используются ВЭ атомов металла. К примеру, натрий, хоть он и представляет собой мягкий металл, однако твёрдый хлорид натрия является изолятором.
Поскольку для образования ионной связи ВЭ натрия переносятся в хлор, электроны не имеют возможности легко перемещаться.
Полупроводники обладают промежуточной между металлами и неметаллами электрической проводимостью. Интересно, что при увеличении температуры у этих веществ улучшается проводимость. Германий и кремний можно отнести к типичным элементарным полупроводникам, каждый их атом имеет 4 ВЭ. Надо сказать, что лучше всего свойства полупроводников объясняются с помощью теории зон.
На уроках химии вы уже познакомились с понятием валентности химических элементов. Мы собрали в одном месте всю полезную информацию по этому вопросу. Используйте ее, когда будете готовиться к ГИА и ЕГЭ.
Валентность и химический анализ
Валентность – способность атомов химических элементов вступать в химические соединения с атомами других элементов. Другими словами, это способность атома образовывать определенное число химических связей с другими атомами.
С латыни слово «валентность» переводится как «сила, способность». Очень верное название, правда?
Понятие «валентность» — одно из основных в химии. Было введено еще до того, как ученым стало известно строение атома (в далеком 1853 году). Поэтому по мере изучения строения атома пережило некоторые изменения.
Так, с точки зрения электронной теории валентность напрямую связана с числом внешних электронов атома элемента. Это значит, что под «валентностью» подразумевают число электронных пар, которыми атом связан с другими атомами.
Зная это, ученые смогли описать природу химической связи. Она заключается в том, что пара атомов вещества делит между собой пару валентных электронов.
Вы спросите, как же химики 19 века смогли описать валентность еще тогда, когда считали, что мельче атома частиц не бывает? Нельзя сказать, что это было так уж просто – они опирались на химический анализ.
Путем химического анализа ученые прошлого определяли состав химического соединения: сколько атомов различных элементов содержится в молекуле рассматриваемого вещества. Для этого нужно было определить, какова точная масса каждого элемента в образце чистого (без примесей) вещества.
Правда, метод этот не без изъянов. Потому что определить подобным образом валентность элемента можно только в его простом соединении со всегда одновалентным водородом (гидрид) или всегда двухвалентным кислородом (оксид). К примеру, валентность азота в NH3 – III, поскольку один атом водорода связан с тремя атомами азота. А валентность углерода в метане (СН4), по тому же принципу, – IV.
Этот метод для определения валентности годится только для простых веществ. А вот в кислотах таким образом мы можем только определить валентность соединений вроде кислотных остатков, но не всех элементов (кроме известной нам валентности водорода) по отдельности.
Как вы уже обратили внимание, обозначается валентность римскими цифрами.
Валентность и кислоты
Поскольку валентность водорода остается неизменной и хорошо вам известна, вы легко сможете определить и валентность кислотного остатка. Так, к примеру, в H2SO3 валентность SO3 – I, в HСlO3 валентность СlO3 – I.
Аналогчиным образом, если известна валентность кислотного остатка, несложно записать правильную формулу кислоты: NO2(I) – HNO2, S4O6 (II) – H2 S4O6.
Валентность и формулы
Понятие валентности имеет смысл только для веществ молекулярной природы и не слишком подходит для описания химических связей в соединениях кластерной, ионной, кристаллической природы и т.п.
Индексы в молекулярных формулах веществ отражают количество атомов элементов, которые входят в их состав. Правильно расставить индексы помогает знание валентности элементов. Таким же образом, глядя на молекулярную формулу и индексы, вы можете назвать валентности входящих в состав элементов.
Вы выполняете такие задания на уроках химии в школе. Например, имея химическую формулу вещества, в котором известна валентность одного из элементов, можно легко определить валентность другого элемента.
Для этого нужно только запомнить, что в веществе молекулярной природы число валентностей обоих элементов равны. Поэтому используйте наименьшее общее кратное (соответсвует числу свободных валентностей, необходимых для соединения), чтобы определить неизвестную вам валентность элемента.
Чтобы было понятно, возьмем формулу оксида железа Fe2O3. Здесь в образовании химической связи участвуют два атома железа с валентностью III и 3 атома кислорода с валентностью II. Наименьшим общим кратным для них является 6.
- Пример: у вас есть формулы Mn2O7. Вам известна валентность кислорода, легко вычислить, что наименьше общее кратное – 14, откуда валентность Mn – VII.
Аналогичным образом можно поступить и наоборот: записать правильную химическую формулу вещества, зная валентности входящих в него элементов.
- Пример: чтобы правильно записать формулу оксида фосфора, учтем валентность кислорода (II) и фосфора (V). Значит, наименьшее общее кратное для Р и О – 10. Следовательно, формула имеет следующий вид: Р2О5.
Хорошо зная свойства элементов, которые они проявляют в различных соединениях, можно определить их валентность даже по внешнему виду таких соединений.
Например: оксиды меди имеют красную (Cu2O) и черную (CuО) окраску. Гидроксиды меди окрашены в желтый (CuОН) и синий (Cu(ОН)2) цвета.
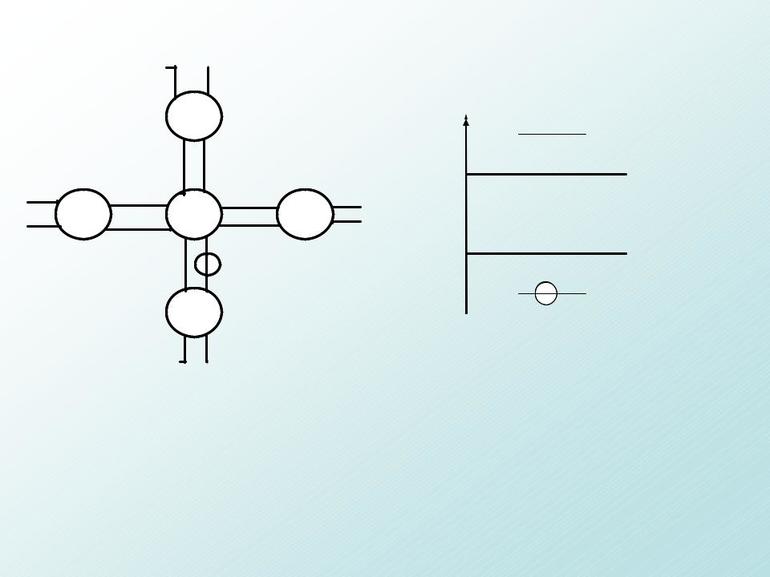
А чтобы ковалентные связи в веществах стали для вас более наглядными и понятными, напишите их структурные формулы. Черточки между элементами изображают возникающие между их атомами связи (валентности):
Характеристики валентности
Сегодня определение валентности элементов базируется на знаниях о строении внешних электронных оболочек их атомов.
Валентность может быть:
- постоянной (металлы главных подгрупп);
- переменной (неметаллы и металлы побочных групп):
- высшая валентность;
- низшая валентность.
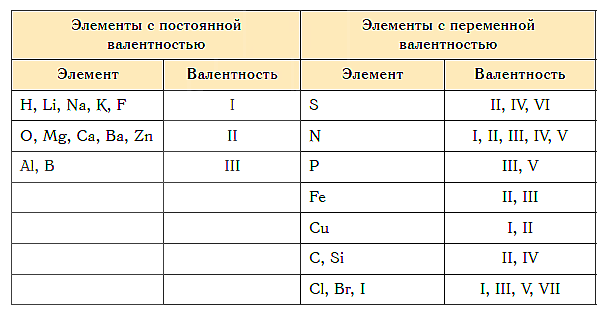
Постоянной в различных химических соединениях остается:
- валентность водорода, натрия, калия, фтора (I);
- валентность кислорода, магния, кальция, цинка (II);
- валентность алюминия (III).
А вот валентность железа и меди, брома и хлора, а также многих других элементов изменяется, когда они образуют различные химические соедения.
Валентность и электронная теория
В рамках электронной теории валентность атома определеяется на основании числа непарных электронов, которые участвуют в образовании электронных пар с электронами других атомов.
В образовании химических связей участвуют только электроны, находящиеся на внешней оболочке атома. Поэтому максимальная валентность химического элемента – это число электронов во внешней электронной оболочке его атома.
Понятие валентности тесно связано с Периодическим законом, открытым Д. И. Менделеевым. Если вы внимательно посмотрите на таблицу Менделеева, легко сможете заметить: положение элемента в перодической системе и его валентность неравзрывно связаны. Высшая валентность элементов, которые относятся к одной и тоже группе, соответсвует порядковому номеру группы в периодичнеской системе.
Низшую валентность вы узнаете, когда от числа групп в таблице Менделеева (их восемь) отнимете номер группы элемента, который вас интересует.
Например, валентность многих металлов совпадает с номерами групп в таблице периодических элементов, к которым они относятся.
Таблица валентности химических элементов
|
Порядковый номер хим. элемента (атомный номер)
|
Наименование |
Химический символ |
Валентность |
| 1
2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 |
Водород / Hydrogen
Гелий / Helium Литий / Lithium Бериллий / Beryllium Бор / Boron Углерод / Carbon Азот / Nitrogen Кислород / Oxygen Фтор / Fluorine Неон / Neon Натрий / Sodium Магний / Magnesium Алюминий / Aluminum Кремний / Silicon Фосфор / Phosphorus Сера / Sulfur Хлор / Chlorine Аргон / Argon Калий / Potassium Кальций / Calcium Скандий / Scandium Титан / Titanium Ванадий / Vanadium Хром / Chromium Марганец / Manganese Железо / Iron Кобальт / Cobalt Никель / Nickel Медь / Copper Цинк / Zinc Галлий / Gallium Германий /Germanium Мышьяк / Arsenic Селен / Selenium Бром / Bromine Криптон / Krypton Рубидий / Rubidium Стронций / Strontium Иттрий / Yttrium Цирконий / Zirconium Ниобий / Niobium Молибден / Molybdenum Технеций / Technetium Рутений / Ruthenium Родий / Rhodium Палладий / Palladium Серебро / Silver Кадмий / Cadmium Индий / Indium Олово / Tin Сурьма / Antimony Теллур / Tellurium Иод / Iodine Ксенон / Xenon Цезий / Cesium Барий / Barium Лантан / Lanthanum Церий / Cerium Празеодим / Praseodymium Неодим / Neodymium Прометий / Promethium Самарий / Samarium Европий / Europium Гадолиний / Gadolinium Тербий / Terbium Диспрозий / Dysprosium Гольмий / Holmium Эрбий / Erbium Тулий / Thulium Иттербий / Ytterbium Лютеций / Lutetium Гафний / Hafnium Тантал / Tantalum Вольфрам / Tungsten Рений / Rhenium Осмий / Osmium Иридий / Iridium Платина / Platinum Золото / Gold Ртуть / Mercury Талий / Thallium Свинец / Lead Висмут / Bismuth Полоний / Polonium Астат / Astatine Радон / Radon Франций / Francium Радий / Radium Актиний / Actinium Торий / Thorium Проактиний / Protactinium Уран / Uranium |
H
He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Сu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Ac Th Pa U |
I
0 I II III (II), IV (I), II, III, IV, V II I 0 I II III (II), IV I, III, V II, IV, VI I, (II), III, (IV), V, VII 0 I II III II, III, IV II, III, IV, V II, III, VI II, (III), IV, VI, VII II, III, (IV), VI II, III, (IV) (I), II, (III), (IV) I, II, (III) II (II), III II, IV (II), III, V (II), IV, VI I, (III), (IV), V 0 I II III (II), (III), IV (II), III, (IV), V (II), III, (IV), (V), VI VI (II), III, IV, (VI), (VII), VIII (II), (III), IV, (VI) II, IV, (VI) I, (II), (III) (I), II (I), (II), III II, IV III, (IV), V (II), IV, VI I, (III), (IV), V, VII 0 I II III III, IV III III, IV III (II), III (II), III III III, IV III III III (II), III (II), III III IV (III), (IV), V (II), (III), (IV), (V), VI (I), II, (III), IV, (V), VI, VII (II), III, IV, VI, VIII (I), (II), III, IV, VI (I), II, (III), IV, VI I, (II), III I, II I, (II), III II, IV (II), III, (IV), (V) II, IV, (VI) нет данных 0 нет данных II III IV V (II), III, IV, (V), VI |
В скобках даны те валентности, которые обладающие ими элементы проявляют редко.
Валентность и степень окисления
Понятие валентности можно считать родственным такой характеристике, как степень окисления. Тем не менее, обе эти характеристики не тождественным друг другу.
Так, говоря о степени окисления, подразумевают, что атом в веществе ионной (что важно) природы имеет некий условный заряд. И если валентность – это нейтральная характеристика, то степень окисления может быть отрицательной, положительной или равной нулю.
Интересно, что для атома одного и того же элемента, в зависимости от элементов, с которыми он образует химическое соединение, валентность и степень окисления могут совпадать (Н2О, СН4 и др.) и различаться (Н2О2, HNO3).
Заключение
Углубляя свои знания о строении атомов, вы глубже и подробнее узнаете и валентность. Эта характеристика химических элементов не является исчерпывающей. Но у нее большое прикладное значение. В чем вы сами не раз убедились, решая задачи и проводя химические опыты на уроках.
Эта статья создана, чтобы помочь вам систематизировать свои знания о валентности. А также напомнить, как можно ее определить и где валентность находит применение.
Надеемся, этот материал окажется для вас полезным при подготовке домашних заданий и самоподготовке к контрольным и экзаменам.
Не забудьте поделиться ссылкой с друзьями в социальных сетях, чтобы они тоже могли воспользоваться этой полезной информацией.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
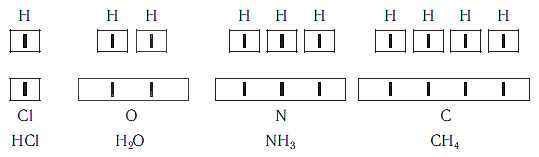
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Содержание
- Определение валентности
- Постоянная и переменная валентность
- Составление химических формул по валентности
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
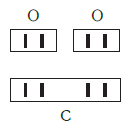
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х·1 = II·2, откуда х = IV.
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II, так как х·1 = II·1, откуда х = II:
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV, а азота — III.
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 (IV·III).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.