Содержание:
- § 1 Валентность химических элементов
- § 2 Определение валентности по формулам соединений
- § 3 Составление химических формул по валентности
- § 4 Определение названия вещества по химической формуле
§ 1 Валентность химических элементов
В свое время, состав всех веществ был установлен на основании данных эксперимента. Однако можно составлять химические формулы, не прибегая к предварительному выполнению сложных опытов, требующих длительной, кропотливой работы.
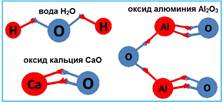
Если сравнить между собой формулы таких веществ, как вода H2O, оксид кальция СаО, оксид алюминия Al2O3, оксид углерода СО2, оксид фосфора Р2О5, оксид серы SО3 и оксид хлора Cl2О7, то можно заметить, что кислород во всех этих соединениях присоединяет к себе неодинаковое число атомов других химических элементов.
Для определения состава бинарных или двухэлементных, то есть состоящих из атомов двух химических элементов соединений, и составления их формул, достаточно знать валентность химических элементов.
Валентность (от латинского слова Valentia – «сила») – свойство атома химического элемента присоединять или замещать определённое число атомов другого химического элемента
Поскольку атомы в молекуле соединены между собой химическими связями, валентность определяется числом простых (одинарных) химических связей, которые данный атом образует с другими атомами.
§ 2 Определение валентности по формулам соединений
Как это можно представить себе, если не прибегать к теории строения атома? Каждый атом имеет определенное число потенциальных химических связей – валентных возможностей.
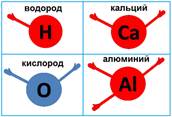
Например, водород – одну, кислород и кальций – по две, алюминий – три, углерод – четыре, фосфор – пять, сера – шесть, хлор – семь. Соединяться друг с другом эти атомы могут, только используя эти самые валентные возможности.
Поэтому атомы химических элементов и образуют соединения, подчиняясь закону постоянства состава.
Закон постоянства состава утверждает, что вещества, независимо от нахождения в природе или способа получения их в лаборатории, всегда имеют один и тот же состав.
Способность элементов проявлять то или иное значение валентности определяется строением их атомов. Поскольку строение атомов обычно изучается позднее, научимся определять валентность, исходя из положения элементов в периодической системе.
Для этого следует учитывать, что каждая группа (вертикальный столбец) элементов состоит из двух подгрупп: главной А и побочной В.
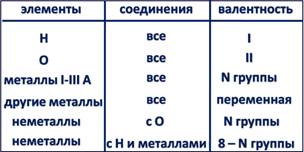
Элементы-металлы, располагающиеся в главных подгруппах I и II групп, проявляют постоянную валентность, равную номеру группы. Это же относится и к алюминию (III группа). А вот металлические элементы IV группы (главная подгруппа) олово и свинец служат исключением и проявляют переменную валентность, численно равную 2 и 4. Длямногих металлов побочных подгрупп также характерно наличие переменной валентности, однако высшее значение валентности обычно равно номеру группы!
Большая часть неметаллов, располагающихся в главных подгруппах групп с четвёртой по седьмую, проявляет переменную валентность. В ряду возможных значений валентностей неметаллов следует выделять высшую и низшую. Высшая валентность равна номеру группы, низшая – разности, полученной вычитанием числа, равного номеру группы, из числа 8. Например: высшая валентность элемента фосфора, стоящего в V группе, равна 5,
низшая: 8-5=3. Следовательно, валентность фосфора переменная – 3 и 5. Следует помнить, что высшая валентность неметаллов проявляется только в соединениях с кислородом, а низшая – в соединениях с металлами и водородом. Валентность водорода всегда во всех соединениях равна 1, валентность кислорода всегда 2.
§ 3 Составление химических формул по валентности
Для составления формул сложных веществ, состоящих из атомов двух неметаллов, следует учитывать, что высшую валентность проявит тот элемент, который стоит в периодической системе левее или ниже, а низшую – соответственно тот, который стоит правее или выше.
Составляем формулы и названия веществ по валентности, используя следующий алгоритм:
1. записываем знаки элементов (по наличию) в порядке: металл, водород, неметалл, кислород;
2. расставляем значения валентностей элементов по периодической системе химических элементов;
3. находим наименьшее общее кратное значений валентностей (наименьшее число, которое делится на оба значения валентностей), делим его на валентность каждого элемента, получаем и записываем индекс;
4. называем вещество. К латинскому корню второго элемента прибавляем суффикс ид, указываем русское название первого элемента и его валентность, если она не постоянная.
Составим формулу и название для вещества, состоящего из атомов фосфора и кислорода:
1. записываем знаки Р и О;
2. валентность фосфора высшая, равна 5, валентность кислорода, как и во всех соединениях равна 2;
3. наименьшее общее кратное 10
10/5=2, пишем индекс у знака Р
10/2=5, пишем индекс у знака О
получилось Р2О5;
4. назовем вещество: корень латинского названия кислорода «оксигениум» окс, к нему прибавляем суффикс ид, получаем оксид. Русское название первого элемента – фосфор, валентность его переменная, равная 5. Получилось название «оксид фосфора 5».
§ 4 Определение названия вещества по химической формуле
Таким образом, при составлении названия вещества, имеющего определенную химическую формулу, необходимо указывать валентность, а чтобы ее указать, необходимо определить. По периодической системе это получается не всегда. Определить валентность и составить название веществаможно, используя алгоритм:
1. указать валентность известного элемента;
2. умножить указанную валентность на соответствующий индекс;
3. полученный результат делим на индекс элемента с неизвестной валентностью;
4. называем вещество. К латинскому корню второго элемента прибавляем суффикс ид, указываем русское название первого элемента и его валентность.
Определим валентность и составим название вещества, имеющего формулу CrO3:
1. валентность кислорода постоянна и равна 2;
2. 2×3=6;
3. 6/1=6. Валентность хрома равна 6;
4. название вещества – оксид хрома 6.
Теперь научимся составлять формулу по названию вещества
1. записываем знаки химических элементов в нужном порядке;
2. указываем валентности, обращая внимание на название. Если валентность первого элемента переменная, она будет указана. Валентность второго элемента – низшая;
3. находим наименьшее общее кратное значений валентностей (наименьшее число, которое делится на оба значения валентностей), делим его на валентность каждого элемента, получаем и записываем индекс.
Определим формулу оксида серы:
1. записываем знаки S и О.
2. валентность серы равна 4, валентность кислорода, как и во всех соединениях – два.
3. наименьшее общее кратное 4
4/2=2, пишем индекс у знака О
4/4=1, пишем индекс у знака S;
4. получилось SО2.
Список использованной литературы:
- Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
Использованные изображения:
Главная > Химия 8 класс > Валентность элементов
Валентность элементов — видеоурок
На этом видео уроке по химии для 8 класса по учебнику Габриеляна объясняется как находить валентность химического элемента в любом химическом веществе.
Цель урока: повторить и углубить знания учащихся о валентности и степени окисления атомов, познакомить с понятием валентные возможности атомов.
Задачи урока:
- дать понятия «валентность», «валентные электроны»;
- научить определять валентность атома в основном состоянии;
- закрепить знания о возбужденном состоянии атома и научить определять его валентные возможности;
- закрепить знание понятия «степень окисления», научить определять С.О. в бинарных соединениях и более сложного состава;
- убедиться в существенном различии понятий «степень окисления» и «валентность атома»;
- дать представление об атомах-донорах и атомах-акцепторах.
Скачать видеоурок «Валентные возможности атомов. Степень окисления»
Данный материал будет полезен учащимся 11 классов при подготовке к ЕГЭ, при закреплении и повторении изученного материала в предыдущих классах.
Как вы знаете, атомы большинства химических элементов взаимодействуют с другими атомами и образуют множество соединений. Но почему так происходит? Ответ на этот вопрос долгое время оставался неизвестен.
Первой попыткой объяснить химическое взаимодействие была теория Бертолле. Атомы должны притягиваться друг к другу тем сильнее, чем больше их массы. А по электрохимической теории Берцелиуса, каждый атом имеет два противоположно заряженных полюса. Теория делила все элементы на два класса — металлы с преобладанием положительного заряженного полюса и металлоиды с отрицательным заряженным полюсом. Причём считалось, что соединяться друг с другом могли лишь атомы противоположной электрической природы.
Эта теория была отвергнута, когда выяснилось, что элементы одного и того же класса также могут соединяться друг с другом. И только лишь в 20 столетии возникли два направления теории химического взаимодействия на основе электронных представлений, основные положения которых были сформулированы Косселем и Льюисом. С точки зрения Косселя, движущей причиной химического взаимодействия является «стремление» атомов к достижению наиболее устойчивых электронных конфигураций. Основной недостаток теории Косселя в том, что не все соединения могут рассматриваться с ионной точки зрения. Между тем идея Льюиса об образовании электронной пары позволяет охватить самые разнообразные случаи валентной связи и сохраняет свое значение до сих пор.
Впервые понятие «валентности» как соединительной силы ввел Э. Франкланд. Он считал, что взаимодействие разнообразных атомов происходит благодаря валентным силам.
Из всего вышесказанного приходим к выводу, валентность — это мера способности атомов притягиваться друг к другу посредством общих электронных пар. Валентность, как правило, обозначается римской цифрой. Рассмотрим электронные конфигурации атомов, чтобы разобраться, как возникают валентные взаимодействия между атомами.
В основном состоянии на внешних энергетических уровнях, а иногда и на предвнешних уровнях атомов, могут находиться спаренные и неспаренные электроны. Валентность атома определяется числом неспаренных электронов, принимающих участие в образовании химической связи.
У s- и p-элементов валентные электроны расположены на s- и p-подуровнях внешнего энергетического уровня.
Например, литий, у которого заряд ядра +3, 3 электрона, это s-элемент, атом имеет один неспаренный s-электрон, значит валентность лития I.
Рассмотрим другой пример, азот. Заряд его атома +7, у него 7 электронов. Это p-элемент. Соответственно, азот имеет 5 валентных электронов — два спаренных s- электрона и 3 неспаренных p-электрона.
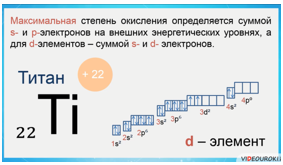
У d-элементов валентные электроны находятся на s-подуровне последнего энергетического уровня и d-подуровне предвнешнего энергического уровня.
Например, у атома титана заряд ядра +22, соответственно столько же электронов — 22. Титан имеет 4 валентных электрона, 2 спаренных s-электронов и два неспаренных d-электронов.
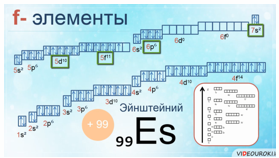
У f-элементов валентные электроны располагаются на s-подуровне последнего энергетического уровня и d-подуровне предпоследнего энергетического уровня и f- подуровня, третьего с края энергетического уровня.
Например, у атома эйнштейния заряд ядра +99, столько же у него и электронов. Эйнштейний имеет 13 валентных электронов, 12 спаренных и 1 неспаренный на 5f-подуровне. Этому элементу было присвоено название эйнштейний в честь выдающегося ученого двадцатого столетия Альберта Эйнштейна, внесшего большой вклад в науку об атоме и атомном ядре.
Следует усвоить, что основные свойства элементов определяются валентными электронами, а уровни, подуровни, на которых располагаются валентные электроны, называются валентными. Самыми первыми вступают в реакцию неспаренные электроны, расположенные на внешнем энергетическом уровне. Количеством этих неспаренных электронов и определяет валентность. Если на спаренные электроны, при имеющейся свободной орбитали в атоме, подействует энергия извне, эти электроны распариваются и атом переходит из основного состояния в возбужденное. Энергия, затраченная на переход электронов, компенсируется при образовании новых связей.
Валентные возможности атомов также определяются числом пустых орбиталей и числом неподеленных электронных пар. Атом-донор предоставляет неподеленную электронную пару атому-акцептору, который имеет свободные орбитали.
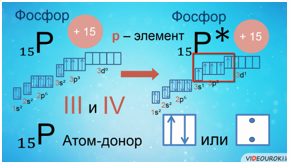
Например, заряд ядра атома фосфора +15, число электронов 15. В основном состоянии атом фосфора, который относится к p-элементам, на внешнем уровне содержит 1 пару спаренных электронов и 3 неспаренных электрона. Поэтому, он проявляет валентность III, так как у него 3 неспаренных p-электрона. Валентность азота IV, так как атом фосфора это атом-донор, который может предоставить пару электронов для образования химической связи.
При имеющихся вакантных орбиталях на 3d-подуровне и паре спаренных электронов на 3s-подуровне атом фосфора может переходить в возбужденное состояние. Это происходит за счёт распаривания и перехода электрона на свободную орбиталь другого подуровня. В атоме появляется 5 неспаренных электронов, что и обеспечивает возможность существования валентности атома фосфора — V.
Поэтому, если у элементов на внешнем энергетическом уровне есть неспаренные электроны, то они являются активными элементами или реакционноспособными. А если на внешнем уровне электроны находятся только в спаренном состоянии, тогда эти элементы относят к малоактивным.
Например, к малоактивным химическим элементам относят VIIIA группу химических элементов Периодической системы. Их так и называют — благородные или инертные (малоактивные) химические элементы — так как на внешнем слое этих элементов все электроны находятся в спаренном состоянии. Нет свободных или неспаренных электронов, которые образовывали связи с электронами других химических элементов.
Следует запомнить, что s-, d-, f-элементы — это металлические элементы, кроме некоторых исключений. Так как на последнем уровне у них электронов меньше, чем 3; у неметаллических элементов, наоборот, на последнем уровне электронов больше, чем 4.
P-элементы могут быть металлические и неметаллические. Рассмотрим Периодическую систему химических элементов. По диагонали от бора к астату все p-элементы выше диагонали — неметаллические, ниже — металлические. По строению элементы, у которых на внешнем энергетическом уровне 3 или 4 электрона, считаются переходными элементами; многие d-элементы — металлические с переходными свойствами.
У элементов в соединении можно определить не только валентность, но и степень окисления. Степень окисления — это условный заряд атома — положительный или отрицательный, в зависимости от смещения электронов от атома или к нему, если считать все связи в веществе ионными. Степень окисления и валентность это не одно и тоже понятие. Например, атом углерода в органических соединениях четырёхвалентен, однако степени окисления имеет различные.
Запомним, если в соединении атом не проявляет валентность как донор, то степень окисления численно совпадает с валентностью. Например, в молекуле аммиака валентность азота равна III и степень окисления равна тоже -3. И наоборот, если в соединении атом проявляет валентность как донор, то степень окисления численно не совпадает с валентностью. У катиона аммония атом азота проявляет валентность IV, а степень окисления -3.
Степень окисления может быть минимальной, промежуточной и максимальной.
Минимальная степень окисления для неметаллических элементов определяется числом валентных мест в незавершенном энергетическом уровне. У атома углерода она равна -4, так как до устойчивости внешнего энергетического уровня атома углерода (до 8 электронов) число валентных мест — 4. Соответственно, у атома азота минимальная степень окисления -3, у кислорода — -2.
Максимальная степень окисления определяется суммой s- и p-электронов на внешних энергетических уровнях, а для d-элементов — суммой s- и d-электронов.
Например, атом титана — это d-элемент, металлический. На внешнем электронном слое у него находится 4 электрона. Значит, максимальная степень окисления титана +4.
Промежуточными степенями окисления считаются значения между минимальной и максимальной степенями окисления в атомах химических элементов.
Определим степень окисления в бинарных соединениях на примере оксидов азота. Более электроотрицательным элементом, к которому смещаются электроны во всех оксидах, является кислород. Как мы помним, минимальная степень окисления кислорода равнa -2, а молекула всегда электронейтральна. Следовательно, произведение степени окисления электроотрицательного элемента на количество атомов по абсолютной величине равно произведению его электроположительного элемента на количество атомов. Таким образом, определяется валентность в соединениях, состоящих из двух элементов, то есть бинарных.
В соединениях более сложного состава необходимо расставить известные степени окисления химических элементов, а неизвестную степень окисления обозначить, например, за «x». Далее так же, как и в бинарных соединениях решаем уравнение с одной неизвестной и получаем ответ по абсолютной величине.
В простых веществах с неполярной ковалентной связью степень окисления равна 0. Степень окисления углерода в органических соединениях определяется у каждого в отдельности, учитывая степень окисления элементов, связанных с ним.