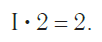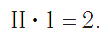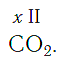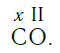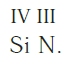Валентность хлора.
О валентности
Валентность хлора
Молярная масса хлора
Плотность хлора
Степень окисления хлора
Температура плавления хлора
Температура кипения хлора
Теплопроводность хлора
Удельная теплоемкость хлора
Удельная теплота сгорания хлора
Электрическое сопротивление хлора
Электропроводность хлора
Все свойства атома хлора
О валентности:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
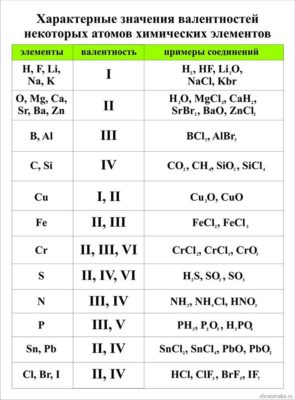
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
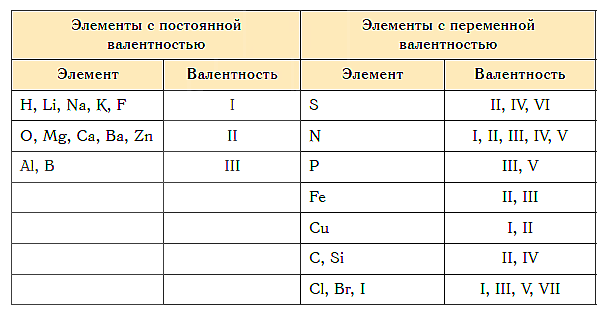
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Валентность хлора:
Валентность хлора равна I, III, IV, V, VI, VII. Хлор проявляет переменную валентность.
| Валентность хлора в соединениях | |
| I | NaCl, NaClO, Cl2O |
| III | NaClO2 |
| IV | ClO2 |
| V | KClO3 |
| VI | Cl2O6 |
| VII | KClO4, Cl2O7 |
Все свойства атома хлора
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности
2 546
Определение валентности химического элемента по формуле его соединения
Суммы единиц валентности каждого элемента в формуле бинарного соединения равны.
Пример:
определим валентность хлора в его соединении с кислородом —
Cl2O7
.
1. Записываем известную валентность кислорода над формулой. Неизвестную валентность обозначаем буквой (x):
2. Находим сумму единиц валентности каждого элемента. Для этого его валентность умножаем на число атомов:
3. Вычисляем (x):
2x=14,x=14:2=7.
Валентность хлора равна
VII
:
Составление формулы бинарного соединения по валентностям химических элементов
Если известны валентности двух элементов, то можно составить формулу их соединения.
Пример:
составим формулу соединения алюминия с углеродом, валентность которого равна
IV
.
1. Записываем символы химических элементов рядом. Указываем над ними валентности. Валентность алюминия постоянная и равна
III
.
2. Находим наименьшее общее кратное валентностей, записываем его над формулой.
Наименьшее общее кратное равно
3⋅4=12
.
3. Делим НОК на валентность каждого элемента:
12:3=4,12:4=3.
Получаем индексы в формуле соединения:
Валентность химических элементов

4.5
Средняя оценка: 4.5
Всего получено оценок: 5197.
4.5
Средняя оценка: 4.5
Всего получено оценок: 5197.
При рассмотрении химических элементов можно заметить, что количество атомов у одного и того же элемента в разных веществах разнится. Каким же образом правильно записать формулу и не ошибиться в индексе химического элемента? Это легко сделать, если иметь представление, что такое валентность.
Для чего нужна валентность?
Валентность химических элементов – это способность атомов элемента образовывать химические связи, то есть присоединять к себе другие атомы. Количественной мерой валентности является число связей, которые образует данный атом с другими атомами или атомными группами.
В настоящее время валентность представляет собой число ковалентных связей (в том числе возникших и по донорно-акцепторному механизму), которыми данный атом соединен с другими. При этом не учитывается полярность связей, а значит, валентность не имеет знака и не может быть равной нулю.
Ковалентная химическая связь – это связь, осуществляемая за счет образования общих (связывающих) электронных пар. Если между двумя атомами имеется одна общая электронная пара, то такая связь называется одинарной, если две – двойной, если три – тройной.
Как находить валентность?
Первый вопрос, который волнует учеников 8 класса, начавших изучать химию – как определить валентность химических элементов? Валентность химического элемента можно посмотреть в специальной таблице валентности химических элементов
Валентность водорода принята за единицу, так как атом водорода может образовывать с другими атомами одну связь. Валентность других элементов выражаем числом, которое показывает, сколько атомов водорода может присоединить к себе атом данного элемента. Например, валентность хлора в молекуле хлористого водорода равна единице. Следовательно формула хлористого водорода будет выглядеть так: HCl. Так как и у хлора и у водорода валентность равна единице, никакой индекс не используется. И хлор и водород являются одновалентными, так как одному атому водорода соответствует один атом хлора.
Рассмотрим другой пример: валентность углерода в метане равна четырем, валентность водорода – всегда единица. Следовательно, рядом с водородом следует поставить индекс 4. Таким образом формула метана выглядит так: CH4 .
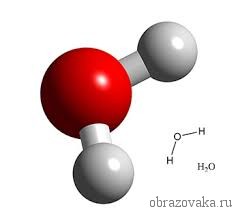
Очень многие элементы образуют соединения с кислородом. Кислород всегда является двухвалентным. Поэтому в формуле воды H2O, где встречаются всегда одновалентный водород и двухвалентный кислород, рядом с водородом ставится индекс 2. Это значит, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
Не все химические элементы имеют постоянную валентность, у некоторых она может изменяться в зависимости от соединений, где используется данный элемент. К элементам с постоянной валентностью относятся водород и кислород, к элементам с переменной валентностью относятся, например, железо, сера, углерод.
Как определить валентность по формуле?
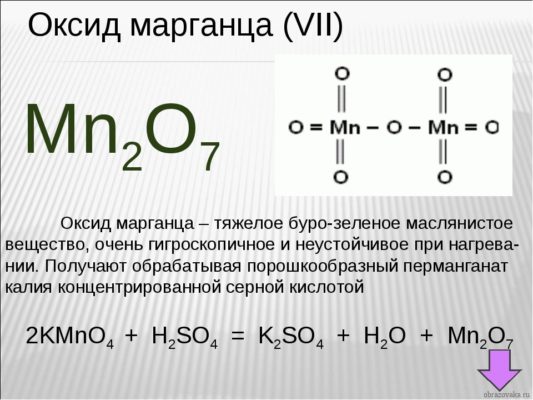
Если у вас перед глазами нет таблицы валентности, но есть формула химического соединения, то возможно определение валентности по формуле. Возьмем для примера формулу оксид марганца – Mn2O7
Как известно, кислород является двухвалентным. Чтобы выяснить, какой валентностью обладает марганец, необходимо валентность кислорода умножить на число атомов газа в этом соединении:
2*7=14
Получившееся число делим на количество атомов марганца в соединении. Получается:
14:2=7
7 (VII) – валентность марганца в данном соединении
Что мы узнали?
В данной теме раскрывается информация о том, что такое валентность. Валентность – способность образовывать химические соединения посредством присоединения к атомам одного элемента атомов другого элемента. Валентность бывает постоянная и переменная. Зная валентность того или иного элемента, можно легко научиться записывать формулы соединений.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Дмитрий Кравцов
10/10
-
Радмир Курманаев
10/10
-
Татьяна Никонова
7/10
-
Алёна Солдатова
8/10
-
Александр Котков
10/10
-
Вадим Квасов
10/10
-
Юлиана Сороко
9/10
-
Оксана Данилова
10/10
-
Василиса Трибунская
10/10
-
Елена Кудинова
7/10
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 5197.
А какая ваша оценка?
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
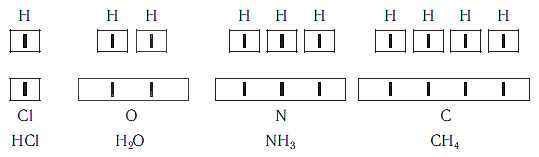
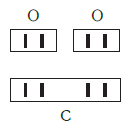
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Содержание
- Определение валентности
- Постоянная и переменная валентность
- Составление химических формул по валентности
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
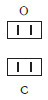
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х·1 = II·2, откуда х = IV.
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II, так как х·1 = II·1, откуда х = II:
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV, а азота — III.
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 (IV·III).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Валентность определяет способность хлора присоединять к себе атомы других химических элементов.
Хлор, валентность которого имеет различные значения, располагается в седьмой группе, в главной подгруппе таблицы элементов. Выясним особенности строения атома этого галогена.
Хлор в нормальном состоянии
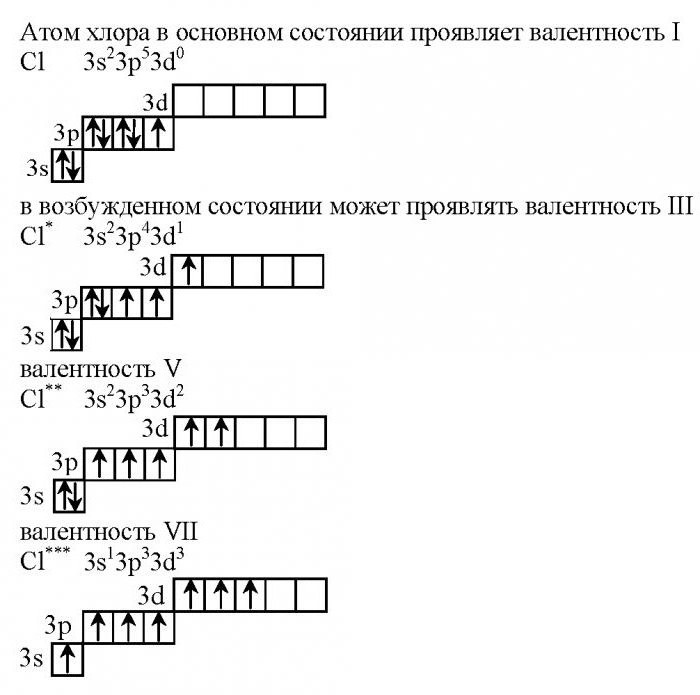
Валентность атомов хлора определяется особенностями строения его внешнего уровня. Данный элемент находится в 7(А) группе, имеет семнадцатый порядковый номер. Учитывая, что элемент является представителем четвертого периода, он имеет не только s-, p-, но и d-орбитали.
Электронная конфигурация атома
Какую электронную формулу имеет хлор? Валентность связана с особенностями внешнего энергетического уровня, поэтому запишем конфигурацию данного элемента.
В невозбужденном состоянии на первом уровне у хлора располагаются всего два электрона, второй занимают восемь, на третьем уровне их 10 штук. Отметим, что на последнем уровне есть незаполненная d-орбиталь, которая и характеризует валентные возможности данного галогена.
- 1s22s22p63s23p53d0.
В данном случае валентность хлора равна I. Это характерно при взаимодействии с металлами (образуются хлориды). Высшую валентность VII хлор имеет в соединениях с неметаллами, например, в оксиде хлора (7), а также в хлорной кислоте.
Приведем в качестве примеров формулы соединений хлора, в которых он проявляет такую валентность: HClO4, Cl2O7.
Последний электронный уровень называют в неорганической химии валентным, так как именно он объясняет способность элемента вступать в химические взаимодействия с другими атомами.
Возбужденное состояние
Как ведет себя при нагревании хлор? Валентность его будет меняться в том случае, если атом будет находиться в возбужденном состоянии.
Учитывая тот факт, что у каждого энергетического уровня есть определенный запас энергии, электроны двух первых уровней не изменяют своего первоначального положения. Наблюдается переход одного p-электрона с 3p энергетического уровня на 3d-подуровень. Как будет при этом менять свое участие в химических реакциях хлор? Валентность его изменится, она будет равна трем.
Рассмотрим электронную конфигурацию, которую приобретет в этом случае хлор.
- 1s22s22p63s23p43d1.
Такая конфигурация не является устойчивой, поэтому соединения хлора, в которых он проявляет степень окисления +3, быстро разлагаются.
Так как на 3d-орбитали есть еще четыре свободные квантовые ячейки, возможен последующий переход электрона с 3p-подуровня, который приводит к образованию еще одной конфигурации атома хлора.
- 1s22s22p63s23p33d2.
В этом случае существует пять неспаренных электронов, поэтому хлор способен проявлять валентность V, степень окисления +5.
При максимальном разогревании атома хлора происходит переход электрона с 3s-подуровня на 3d-орбиталь. В этом случае хлор имеет максимальную валентность, равную семи.
- 1s22s22p63s13p33d3.
На внешнем энергетическом уровне у него располагается семь неспаренных электронов, поэтому валентность хлора в соединениях равна 7.
Распределение электронов по уровням, подуровням, их переход осуществляются в соответствии с правилом Хунда и принципом Паули.
Как в этом случае обозначается хлор? Валентность элемента принято указывать римскими цифрами, а возбужденное состояние атома отмечают звездочкой.
Заключение
Все затраты внутренней энергии, которые идут на процесс возбуждения атома хлора, полностью компенсируются той энергией, которая выделяется при образовании ковалентных связей. Это объясняет повышенную химическую активность хлора, находящегося в возбужденном состоянии. В своей максимальной степени окисления (+7) он проявляет свойства сильного окислителя.
Валентные возможности атома химического элемента не ограничиваются только количеством неспаренных электронов в стационарном и возбужденном виде. Например, при образовании связей в молекулах посредством донорно-акцепторного механизма, предполагают использование и свободных орбиталей.
Какие факторы влияют на валентные возможности атома хлора? Подводя итог, скажем, что в первую очередь необходимо отметить количество неспаренных электронов (незаполненные орбитали). Кроме того, в атоме должна быть свободная орбиталь, на которую будут при нагревании переходить электроны.