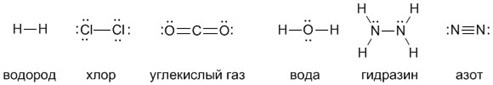Рассмотрим наиболее часто встречающиеся в учебной литературе формулы кислот:
Легко заметить, что объединяет все формулы кислот наличие атомов водорода (H), стоящего на первом месте в формуле.
Определение валентности кислотного остатка
Из приведённого списка видно, что количество этих атомов может отличаться. Кислоты, в составе которых есть всего один атом водорода, называют одноосновными (азотная, соляная и другие). Серная, угольная, кремниевая кислоты — двухосновные, так как в их формулах по два атома H. Молекула трёхосновной фосфорной кислоты содержит три водородных атома.
Таким образом, количество H в формуле характеризует основность кислоты.
Тот атом, или группа атомов, которые записаны после водорода, называют кислотными остатками. Например, в сероводородной кислоте остаток состоит из одного атома — S, а в фосфорной, сернистой и многих других — из двух, причём один из них обязательно кислород (O). По этому признаку все кислоты делят на кислородсодержащие и бескислородные.
Каждый кислотный остаток обладает определённой валентностью. Она равна количеству атомов Н в молекуле этой кислоты. Валентность остатка HCl равна единице, так как это одноосновная кислота. Такую же валентность имеют остатки азотной, хлорной, азотистой кислот. Валентность остатка серной кислоты (SO4) равна двум, так как атомов водорода в ее формуле два. Трехвалентен остаток фосфорной кислоты.
Кислотные остатки — анионы
Помимо валентности, кислотные остатки обладают зарядами и являются анионами. Их заряды указаны в таблице растворимости: CO32−, S2−, Cl− и так далее. Обратите внимание: заряд кислотного остатка численно совпадает с его валентностью. Например, в кремниевой кислоте, формула которой H2SiO3, кислотный остаток SiO3 имеет валентность, равную II, и заряд 2-. Таким образом, зная заряд кислотного остатка, легко определить его валентность и наоборот.
Подведём итог. Кислотами — соединения, образованные атомами водорода и кислотными остатками. С точки зрения теории электролитической диссоциации можно дать другое определение: кислоты — электролиты, в растворах и расплавах которых присутствуют катионы водорода и анионы кислотных остатков.
Подсказки
Химические формулы кислот, как правило, заучивают наизусть, как и их названия. Если вы забыли, сколько атомов водорода в той или иной формуле, но знаете, как выглядит ее кислотный остаток, на помощь вам придёт таблица растворимости. Заряд остатка совпадает по модулю с валентностью, а та — с количеством H. К примеру, вы помните, что остаток угольной кислоты — CO3. По таблице растворимости определяете, что его заряд 2-, значит, он двухвалентен, то есть угольная кислота имеет формулу H2CO3.
Часто возникает путаница с формулами серной и сернистой, а также азотной и азотистой кислот. Здесь тоже есть один момент, облегчающий запоминание: название той кислоты из пары, в которой атомов кислорода больше, заканчивается на -ная (серная, азотная). Кислота с меньшим количеством атомов кислорода в формуле, имеет название, заканчивающееся на -истая (сернистая, азотистая).
Однако эти подсказки помогут лишь в том случае, если формулы кислот вам знакомы. Повторим их ещё раз:
| HClO4 — хлорная HNO3 — азотная HNO2 — азотистая H2SO4 — серная H2SO3 — сернистая |
H2CO3 — угольная H2SiO3 — кремниевая H3PO4 — фосфорная HCl — хлороводородная (соляная) H2S — сероводородная |
На уроках химии вы уже познакомились с понятием валентности химических элементов. Мы собрали в одном месте всю полезную информацию по этому вопросу. Используйте ее, когда будете готовиться к ГИА и ЕГЭ.
Валентность и химический анализ
Валентность – способность атомов химических элементов вступать в химические соединения с атомами других элементов. Другими словами, это способность атома образовывать определенное число химических связей с другими атомами.
С латыни слово «валентность» переводится как «сила, способность». Очень верное название, правда?
Понятие «валентность» — одно из основных в химии. Было введено еще до того, как ученым стало известно строение атома (в далеком 1853 году). Поэтому по мере изучения строения атома пережило некоторые изменения.
Так, с точки зрения электронной теории валентность напрямую связана с числом внешних электронов атома элемента. Это значит, что под «валентностью» подразумевают число электронных пар, которыми атом связан с другими атомами.
Зная это, ученые смогли описать природу химической связи. Она заключается в том, что пара атомов вещества делит между собой пару валентных электронов.
Вы спросите, как же химики 19 века смогли описать валентность еще тогда, когда считали, что мельче атома частиц не бывает? Нельзя сказать, что это было так уж просто – они опирались на химический анализ.
Путем химического анализа ученые прошлого определяли состав химического соединения: сколько атомов различных элементов содержится в молекуле рассматриваемого вещества. Для этого нужно было определить, какова точная масса каждого элемента в образце чистого (без примесей) вещества.
Правда, метод этот не без изъянов. Потому что определить подобным образом валентность элемента можно только в его простом соединении со всегда одновалентным водородом (гидрид) или всегда двухвалентным кислородом (оксид). К примеру, валентность азота в NH3 – III, поскольку один атом водорода связан с тремя атомами азота. А валентность углерода в метане (СН4), по тому же принципу, – IV.
Этот метод для определения валентности годится только для простых веществ. А вот в кислотах таким образом мы можем только определить валентность соединений вроде кислотных остатков, но не всех элементов (кроме известной нам валентности водорода) по отдельности.
Как вы уже обратили внимание, обозначается валентность римскими цифрами.
Валентность и кислоты
Поскольку валентность водорода остается неизменной и хорошо вам известна, вы легко сможете определить и валентность кислотного остатка. Так, к примеру, в H2SO3 валентность SO3 – I, в HСlO3 валентность СlO3 – I.
Аналогчиным образом, если известна валентность кислотного остатка, несложно записать правильную формулу кислоты: NO2(I) – HNO2, S4O6 (II) – H2 S4O6.
Валентность и формулы
Понятие валентности имеет смысл только для веществ молекулярной природы и не слишком подходит для описания химических связей в соединениях кластерной, ионной, кристаллической природы и т.п.
Индексы в молекулярных формулах веществ отражают количество атомов элементов, которые входят в их состав. Правильно расставить индексы помогает знание валентности элементов. Таким же образом, глядя на молекулярную формулу и индексы, вы можете назвать валентности входящих в состав элементов.
Вы выполняете такие задания на уроках химии в школе. Например, имея химическую формулу вещества, в котором известна валентность одного из элементов, можно легко определить валентность другого элемента.
Для этого нужно только запомнить, что в веществе молекулярной природы число валентностей обоих элементов равны. Поэтому используйте наименьшее общее кратное (соответсвует числу свободных валентностей, необходимых для соединения), чтобы определить неизвестную вам валентность элемента.
Чтобы было понятно, возьмем формулу оксида железа Fe2O3. Здесь в образовании химической связи участвуют два атома железа с валентностью III и 3 атома кислорода с валентностью II. Наименьшим общим кратным для них является 6.
- Пример: у вас есть формулы Mn2O7. Вам известна валентность кислорода, легко вычислить, что наименьше общее кратное – 14, откуда валентность Mn – VII.
Аналогичным образом можно поступить и наоборот: записать правильную химическую формулу вещества, зная валентности входящих в него элементов.
- Пример: чтобы правильно записать формулу оксида фосфора, учтем валентность кислорода (II) и фосфора (V). Значит, наименьшее общее кратное для Р и О – 10. Следовательно, формула имеет следующий вид: Р2О5.
Хорошо зная свойства элементов, которые они проявляют в различных соединениях, можно определить их валентность даже по внешнему виду таких соединений.
Например: оксиды меди имеют красную (Cu2O) и черную (CuО) окраску. Гидроксиды меди окрашены в желтый (CuОН) и синий (Cu(ОН)2) цвета.
А чтобы ковалентные связи в веществах стали для вас более наглядными и понятными, напишите их структурные формулы. Черточки между элементами изображают возникающие между их атомами связи (валентности):
Характеристики валентности
Сегодня определение валентности элементов базируется на знаниях о строении внешних электронных оболочек их атомов.
Валентность может быть:
- постоянной (металлы главных подгрупп);
- переменной (неметаллы и металлы побочных групп):
- высшая валентность;
- низшая валентность.
Постоянной в различных химических соединениях остается:
- валентность водорода, натрия, калия, фтора (I);
- валентность кислорода, магния, кальция, цинка (II);
- валентность алюминия (III).
А вот валентность железа и меди, брома и хлора, а также многих других элементов изменяется, когда они образуют различные химические соедения.
Валентность и электронная теория
В рамках электронной теории валентность атома определеяется на основании числа непарных электронов, которые участвуют в образовании электронных пар с электронами других атомов.
В образовании химических связей участвуют только электроны, находящиеся на внешней оболочке атома. Поэтому максимальная валентность химического элемента – это число электронов во внешней электронной оболочке его атома.
Понятие валентности тесно связано с Периодическим законом, открытым Д. И. Менделеевым. Если вы внимательно посмотрите на таблицу Менделеева, легко сможете заметить: положение элемента в перодической системе и его валентность неравзрывно связаны. Высшая валентность элементов, которые относятся к одной и тоже группе, соответсвует порядковому номеру группы в периодичнеской системе.
Низшую валентность вы узнаете, когда от числа групп в таблице Менделеева (их восемь) отнимете номер группы элемента, который вас интересует.
Например, валентность многих металлов совпадает с номерами групп в таблице периодических элементов, к которым они относятся.
Таблица валентности химических элементов
|
Порядковый номер хим. элемента (атомный номер)
|
Наименование |
Химический символ |
Валентность |
| 1
2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 |
Водород / Hydrogen
Гелий / Helium Литий / Lithium Бериллий / Beryllium Бор / Boron Углерод / Carbon Азот / Nitrogen Кислород / Oxygen Фтор / Fluorine Неон / Neon Натрий / Sodium Магний / Magnesium Алюминий / Aluminum Кремний / Silicon Фосфор / Phosphorus Сера / Sulfur Хлор / Chlorine Аргон / Argon Калий / Potassium Кальций / Calcium Скандий / Scandium Титан / Titanium Ванадий / Vanadium Хром / Chromium Марганец / Manganese Железо / Iron Кобальт / Cobalt Никель / Nickel Медь / Copper Цинк / Zinc Галлий / Gallium Германий /Germanium Мышьяк / Arsenic Селен / Selenium Бром / Bromine Криптон / Krypton Рубидий / Rubidium Стронций / Strontium Иттрий / Yttrium Цирконий / Zirconium Ниобий / Niobium Молибден / Molybdenum Технеций / Technetium Рутений / Ruthenium Родий / Rhodium Палладий / Palladium Серебро / Silver Кадмий / Cadmium Индий / Indium Олово / Tin Сурьма / Antimony Теллур / Tellurium Иод / Iodine Ксенон / Xenon Цезий / Cesium Барий / Barium Лантан / Lanthanum Церий / Cerium Празеодим / Praseodymium Неодим / Neodymium Прометий / Promethium Самарий / Samarium Европий / Europium Гадолиний / Gadolinium Тербий / Terbium Диспрозий / Dysprosium Гольмий / Holmium Эрбий / Erbium Тулий / Thulium Иттербий / Ytterbium Лютеций / Lutetium Гафний / Hafnium Тантал / Tantalum Вольфрам / Tungsten Рений / Rhenium Осмий / Osmium Иридий / Iridium Платина / Platinum Золото / Gold Ртуть / Mercury Талий / Thallium Свинец / Lead Висмут / Bismuth Полоний / Polonium Астат / Astatine Радон / Radon Франций / Francium Радий / Radium Актиний / Actinium Торий / Thorium Проактиний / Protactinium Уран / Uranium |
H
He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Сu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Ac Th Pa U |
I
0 I II III (II), IV (I), II, III, IV, V II I 0 I II III (II), IV I, III, V II, IV, VI I, (II), III, (IV), V, VII 0 I II III II, III, IV II, III, IV, V II, III, VI II, (III), IV, VI, VII II, III, (IV), VI II, III, (IV) (I), II, (III), (IV) I, II, (III) II (II), III II, IV (II), III, V (II), IV, VI I, (III), (IV), V 0 I II III (II), (III), IV (II), III, (IV), V (II), III, (IV), (V), VI VI (II), III, IV, (VI), (VII), VIII (II), (III), IV, (VI) II, IV, (VI) I, (II), (III) (I), II (I), (II), III II, IV III, (IV), V (II), IV, VI I, (III), (IV), V, VII 0 I II III III, IV III III, IV III (II), III (II), III III III, IV III III III (II), III (II), III III IV (III), (IV), V (II), (III), (IV), (V), VI (I), II, (III), IV, (V), VI, VII (II), III, IV, VI, VIII (I), (II), III, IV, VI (I), II, (III), IV, VI I, (II), III I, II I, (II), III II, IV (II), III, (IV), (V) II, IV, (VI) нет данных 0 нет данных II III IV V (II), III, IV, (V), VI |
В скобках даны те валентности, которые обладающие ими элементы проявляют редко.
Валентность и степень окисления
Понятие валентности можно считать родственным такой характеристике, как степень окисления. Тем не менее, обе эти характеристики не тождественным друг другу.
Так, говоря о степени окисления, подразумевают, что атом в веществе ионной (что важно) природы имеет некий условный заряд. И если валентность – это нейтральная характеристика, то степень окисления может быть отрицательной, положительной или равной нулю.
Интересно, что для атома одного и того же элемента, в зависимости от элементов, с которыми он образует химическое соединение, валентность и степень окисления могут совпадать (Н2О, СН4 и др.) и различаться (Н2О2, HNO3).
Заключение
Углубляя свои знания о строении атомов, вы глубже и подробнее узнаете и валентность. Эта характеристика химических элементов не является исчерпывающей. Но у нее большое прикладное значение. В чем вы сами не раз убедились, решая задачи и проводя химические опыты на уроках.
Эта статья создана, чтобы помочь вам систематизировать свои знания о валентности. А также напомнить, как можно ее определить и где валентность находит применение.
Надеемся, этот материал окажется для вас полезным при подготовке домашних заданий и самоподготовке к контрольным и экзаменам.
Не забудьте поделиться ссылкой с друзьями в социальных сетях, чтобы они тоже могли воспользоваться этой полезной информацией.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
План урока:
Валентность
Причины постоянной и переменной валентности
Правила определения степени окисления
Валентность
Представьте на минуточку, что атомы не могли бы соединяться между собой, какой вид имела бы планета, а вопрос: «Существовала ли вообще Солнечная система?» Именно благодаря тому, что атомы соединяются между собой, существуют вещества, а также и мы.
Вернёмся к деталям, мы их будем сравнивать с атомами, а их внешний вид, с количеством связей, которые они могут образовать.
Представим, что в нашем распоряжении есть вот такие детали.
Валентность элементов обусловлена количеством неспаренных электронов на внешнем уровне.
Рассмотрим металлы, расположенные в I группе. Их объединили в одно семейство щелочных металлов, поскольку реагируя с водою, они все образуют щёлочи, состава МеОН. Формула внешнего уровня имеет вид ns1. Если провести параллель с элементами конструктора, то они будут выглядеть следующим образом.
Они могут отличаться цветом, формой, однако их объединяет количество связей, которые они способны образовать. Иначе говоря, что щелочные металлы одновалентны.
Это правило срабатывает и для элементов II группы, только они будут иметь вид двойных деталей.
Вспоминаем, что элементы этой группы имеют формулу ns2, приходим к тому, что валентность атомов численно равна II.
Как возможно Вы заметили, или вспомнили с темы строение атома, что высшая валентность определяется номером группы, но не всегда ей равна. Исключением с данного правила являются атомы элементов таких как азот, фтор и кислород.
Почему фтор, находясь в VII группе, имеет валентность постоянную равную единице. В то время, для других его родственников, она будет равнять I, III, V или даже VII.
Источник
Поиграем с Вами в старую добрую игру «Найди … отличий». Несмотря на то, что они находятся в одной группе, имеют общую формулу внешнего слоя ns2np5, валентность их будет отличаться. Атомы хлора выигрывают за счёт свободного 3d уровня, на который при определённых условиях могут мигрировать электроны с наружного слоя, образуя при этом 3 возбуждённых состояния. Атом фтора в этом плане бедный, в распоряжении его электронов нет d-орбитали, его электронам некуда мигрировать.Поэтому имея только 1 неспаренный электрон, может образовать только единственную связь.
Причины постоянной и переменной валентности
Для большинства элементов характерно иметь переменную валентность. Но для некоторых она будет постоянной. Некоторые элементы Вам уже известны, пополнит этот список кислород и цинк, которые всегда двухвалентны, алюминий имеет число связей III.
Расположение элементов в периодической таблице подсказывает, о количестве связей, которые могут они образовать.
Источник
Определение валентности элементов по формулам
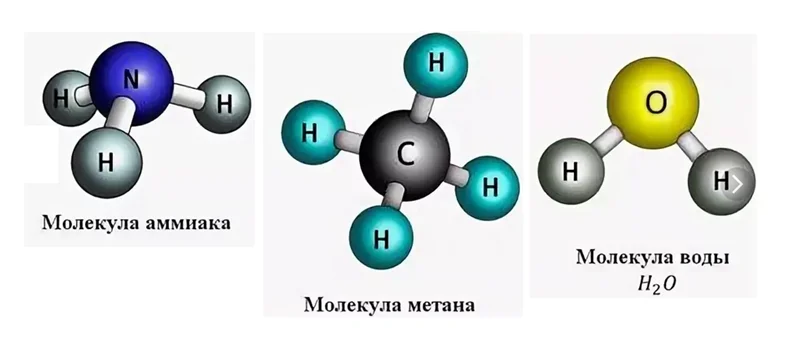
На рисунке изображены молекулы известных Вам веществ: это аммиак NH3, запах этого газа очень резкий и его трудно забыть, если хоть раз ощущали запах нашатырного спирта, с помощью его приводят людей в чувство после обморока.
Источник
С молекулой метана СН4 Вы встречаетесь на кухне, когда открываете газовый кран, чтобы приготовить пищу. На самом деле, метан не имеет запаха, но поскольку он относится к взрывоопасным веществам, то к нему прибавляют специальные соединения, имеющие запах, чтобы в случае утечки, его можно было обнаружить.
Молекула Н2О окружает нас повсюду. Во всех этих соединениях имеются атомы водорода, только в разных количествах. Давайте попробуем определить валентность по формуле вещества. Вспомним, что водород одновалентен. Если в аммиаке водорода насчитываем 3 атома, значит азот, условно, можем изобразить в виде такой детали.
Как видно с рисунка, он имеет валентность III. Поэтому принципу определим валентность углерода, приходим к выводу, что он четырёхвалентен.
Но не всегда мы видим структурные формулы, которые отображают связи между атомами, и не всегда имеем дело с одновалентными элементами. Возьмём, к примеру, вещество состава Р2О5. На два атома фосфора приходится 5 атомов кислорода. Постоянную валентность имеет кислород, которая равняется II. Чтобы определить, какую валентность будет иметь фосфор, необходимо выполнить следующие математические действия.
Встречаются такие соединения, где необходимо определить валентность остатков, входящих в состав кислот. Например, вещество состава Mg3(PO4)2.
Выполним согласно алгоритму. Магний всегда двухвалентен.
Искомая валентность кислотного остатка равна III. Следует заметить, что в веществе всегда находиться элемент, который проявляет постоянную валентность.
При написании уравнений реакций возникает необходимость составления формул веществ. Рассмотрим реакцию обмена между оксидом алюминия и соляной кислотой.
В результате обмена образуется два вещества состава AlCl и НО. Чтобы определить количественный состав в веществах, воспользуемся следующим алгоритмом.
Составление химических формул по валентности
Уравнение приобретает вид
Обратите внимание, что количество атомов отличается в реагентах и продуктах, его необходимо уравнять.
Составим формулы веществ по валентности элементов.
Немаловажную роль наравне с валентностью играет такое понятие как степень окисления (СО).
Термин валентность применим для соединений, имеющих молекулярное строение. Но, как известно, ещё существуют вещества ионного строения, которые образуются за счёт электростатического притяжения между разноимёнными зарядами. Каким образом они образуются? Чтобы ответить на данный вопрос, вспомним об электроотрицательности.
При образовании вещества, одни атомы будут отдавать свои электроны, другие – принимать. Рассмотрим на примере соединений молекулярного строения Cl2, HCl и ионного NaCl.
Обратите внимание, что вещества молекулярного строения, имеют структурную формулу, соединение атомов между собой показывается в виде черты – между ними. Для веществ имеющих строение, отличающее от молекулярного, более применимо понятие степени окисления, которое имеет универсальное применение для всех типов веществ.
Каким образом получается молекула вещества HCl? У водорода имеется один-единственный электрон, который располагается на 1s уровне, у хлора целых 7, занимающих уровни 3s2 и 3р5. Как Вы считаете, какой атом будет отдавать, а какой принимать электроны? При всём своём желании, атом водорода никак не сможет принять электроны хлора, ему просто некуда. Как он сможет расположить в своей 1s ячейке целых 7 электронов хлора. Логично предположить, что принимать будет хлор. Ему как раз не хватает одного электрона, чтобы завершить свой уровень. Поэтому водород будет иметь заряд +, а хлор -. Степень окисления указывается в правом верхнем углу элемента, арабскими цифрами, знак + или – ставим перед цифрой H+Cl−.
А вот какую степень окисления имеет простое вещество. Атомы равноценные партнёры, поэтому она будет нулевая.
При образовании ионного соединения NaCl натрий, как элемент имеющий малое число электронов на внешнем слое, а именно 1, подобно водороду, отдаёт его хлору, образуя при этом катион Na+, хлор при этом становится отрицательным анионом Cl−.
Правила определения степени окисления
Подобно валентности, для определённых элементов свойственна постоянная степень окисления. Это металлы, которые отличаются малым количеством электронов внешнего слоя. Отличительной характеристикой их будет невозможность иметь отрицательный заряд, поскольку они ВСЕГДА отдают электроны.
В противовес металлам существует один-единственный элемент, который абсолютно ни с кем не хочет делиться своими электронами.Ни при каких условиях он не отдаст их, это фтор, который всегда отрицателен F−.
Такой элемент, как кислород, обычно имеет отрицательный заряд, это -2. И только с фтором, он будет положительным +2.
Аналогичная ситуация с водородом, характерная СО (степень окисления) +1, однако исключения составляют соединения с металлами, где его степень окисления будет отрицательная и равняется -1.
Все эти значения вытекают с периодической системы, которая помогает определить степени окисления элементов.
Источник
С таблицы видно, что для большинства элементов эта величина не постоянная.
Чтобы вычислить степень окисления элементов в соединениях, будем руководствоваться следующими правилами.
Как бы то ни было, природа не ограничивается бинарными соединениями. Существует множество веществ состоящих из 2 и более элемента. Впрочем вычисление совсем не отличается, первоначально определяем элементы, имеющие постоянную степень окисления, а дальше проделав нехитрые математические действия находим СО для остальных. Главное правило, чтобы вещество было нейтральным, количество плюсов должно равняться количеству минусов.
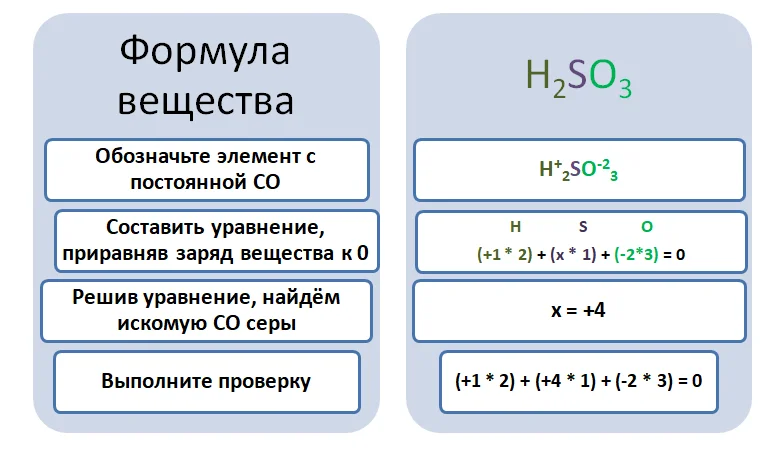
К примеру, в веществе H2SO3 самым электроотрицательным является кислород, он заберёт электроны как в водороде, так и в серы, вследствие этого имеет отрицательную СО, а Hи Sстанут положительными. В этом соединение имеются 2 элемента, имеющих известную СО – это Н и О.
Обратите внимание, на нахождение СО в кислотном остатке. В данном случае, мы приравниваем не к 0, а к заряду аниона.
Здесь у серы х внизу
Как правило, валентность и степень окисления совпадают по абсолютной величине. Но исключения составляют простые вещества, например, в простом веществе азот, формула которого N2, степень окисления равняется 0, в тоже время, валентность атомов азота равна III. N0 ≡ N0.
Либо в катионе аммония NH4+. Азот имеет СО -3, а валентность IV.
Кислотами называют сложные вещества, состоящие из атомов водорода, способных замещаться металлами, и кислотных остатков.
Кислотным остатком называют часть молекулы кислоты, соединённую с атомами водорода.
При замещении водорода в кислотах металлами в состав образующихся солей кислотные остатки переходят в неизменном виде. Если кислотный остаток в кислоте соединён с одним атомом водорода, то он одновалентен, если с двумя — двухвалентен, если с тремя — трёхвалентен и т. д.
Валентность кислотного остатка определяется количеством атомов водорода, способных замещаться металлами.
Формулы и названия некоторых кислот приведены в таблице.
Важнейшие неорганические кислоты
|
Название кислоты |
Формула кислоты |
Формула кислотного остатка |
Название соли этой кислоты |
| Фтороводородная (плавиковая) |
HF |
−F |
Фторид |
| Хлороводородная (соляная) |
HCl |
−Cl |
Хлорид |
| Бромоводородная |
HBr |
−Br |
Бромид |
| Угольная |
H2CO3 |
=CO3 |
Карбонат |
| Кремниевая |
H2SiO3 |
=SiO3 |
Силикат |
| Азотная |
HNO3 |
−NO3 |
Нитрат |
|
Ортофосфорная (фосфорная) |
H3PO4 |
≡PO4 |
Ортофосфат (фосфат) |
| Серная |
H2SO4 |
=SO4 |
Сульфат |
| Сернистая |
H2SO3 |
=SO3 |
Сульфит |
| Сероводородная |
H2S |
=S |
Сульфид |
Представителем органических кислот является уксусная кислота
CH3COOH.
Хотя в молекуле этой кислоты — четыре атома водорода, только один из них (входящий в состав группы СООН) может быть замещён металлом. Поэтому кислотный остаток уксусной кислоты является одновалентным.
ГДЗ (готовое домашние задание из решебника) на Вопрос №3, § 44 по учебнику Химия. 8 класс: учебник для общеобразовательных учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. 4 издание. Просвещение, 2016-2021г.
Условие
3. Определите валентность кислотных остатков следующих кислот: H2S, HBr, HNo3, Н2СO3, НМnO4, Н3РO4, H2SO4.
Водород H в кислотах проявляет валентность I. Это означает, что 1 атом водорода может образовать только одну связь с кислотным остатком. Следовательно, валентность кислотного остатка будет соответствовать числу атомов водорода в кислоте:
Кислота Число атомов водорода (в одной молекуле кислоты) Валентность кислотного остатка
H2S 2 II
HBr 1 I
HNO3 1 I
H2CO3 2 II
HMnO4 1 I
H3PO4 3 III
H2SO4 2 II
Решение 1
Подробное решение

Белый фонпереписывать в тетрадь
Цветной фонтеория и пояснения
Популярные решебники
Ваше сообщение отправлено
и скоро будет рассмотрено