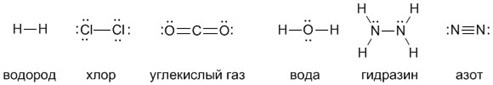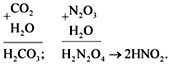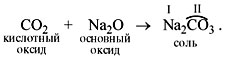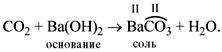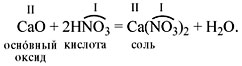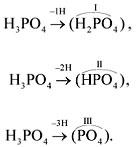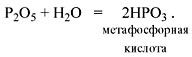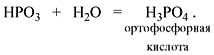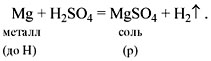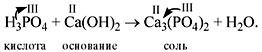Рассмотрим наиболее часто встречающиеся в учебной литературе формулы кислот:
Легко заметить, что объединяет все формулы кислот наличие атомов водорода (H), стоящего на первом месте в формуле.
Определение валентности кислотного остатка
Из приведённого списка видно, что количество этих атомов может отличаться. Кислоты, в составе которых есть всего один атом водорода, называют одноосновными (азотная, соляная и другие). Серная, угольная, кремниевая кислоты — двухосновные, так как в их формулах по два атома H. Молекула трёхосновной фосфорной кислоты содержит три водородных атома.
Таким образом, количество H в формуле характеризует основность кислоты.
Тот атом, или группа атомов, которые записаны после водорода, называют кислотными остатками. Например, в сероводородной кислоте остаток состоит из одного атома — S, а в фосфорной, сернистой и многих других — из двух, причём один из них обязательно кислород (O). По этому признаку все кислоты делят на кислородсодержащие и бескислородные.
Каждый кислотный остаток обладает определённой валентностью. Она равна количеству атомов Н в молекуле этой кислоты. Валентность остатка HCl равна единице, так как это одноосновная кислота. Такую же валентность имеют остатки азотной, хлорной, азотистой кислот. Валентность остатка серной кислоты (SO4) равна двум, так как атомов водорода в ее формуле два. Трехвалентен остаток фосфорной кислоты.
Кислотные остатки — анионы
Помимо валентности, кислотные остатки обладают зарядами и являются анионами. Их заряды указаны в таблице растворимости: CO32−, S2−, Cl− и так далее. Обратите внимание: заряд кислотного остатка численно совпадает с его валентностью. Например, в кремниевой кислоте, формула которой H2SiO3, кислотный остаток SiO3 имеет валентность, равную II, и заряд 2-. Таким образом, зная заряд кислотного остатка, легко определить его валентность и наоборот.
Подведём итог. Кислотами — соединения, образованные атомами водорода и кислотными остатками. С точки зрения теории электролитической диссоциации можно дать другое определение: кислоты — электролиты, в растворах и расплавах которых присутствуют катионы водорода и анионы кислотных остатков.
Подсказки
Химические формулы кислот, как правило, заучивают наизусть, как и их названия. Если вы забыли, сколько атомов водорода в той или иной формуле, но знаете, как выглядит ее кислотный остаток, на помощь вам придёт таблица растворимости. Заряд остатка совпадает по модулю с валентностью, а та — с количеством H. К примеру, вы помните, что остаток угольной кислоты — CO3. По таблице растворимости определяете, что его заряд 2-, значит, он двухвалентен, то есть угольная кислота имеет формулу H2CO3.
Часто возникает путаница с формулами серной и сернистой, а также азотной и азотистой кислот. Здесь тоже есть один момент, облегчающий запоминание: название той кислоты из пары, в которой атомов кислорода больше, заканчивается на -ная (серная, азотная). Кислота с меньшим количеством атомов кислорода в формуле, имеет название, заканчивающееся на -истая (сернистая, азотистая).
Однако эти подсказки помогут лишь в том случае, если формулы кислот вам знакомы. Повторим их ещё раз:
| HClO4 — хлорная HNO3 — азотная HNO2 — азотистая H2SO4 — серная H2SO3 — сернистая |
H2CO3 — угольная H2SiO3 — кремниевая H3PO4 — фосфорная HCl — хлороводородная (соляная) H2S — сероводородная |
План урока:
Валентность
Причины постоянной и переменной валентности
Правила определения степени окисления
Валентность
Представьте на минуточку, что атомы не могли бы соединяться между собой, какой вид имела бы планета, а вопрос: «Существовала ли вообще Солнечная система?» Именно благодаря тому, что атомы соединяются между собой, существуют вещества, а также и мы.
Вернёмся к деталям, мы их будем сравнивать с атомами, а их внешний вид, с количеством связей, которые они могут образовать.
Представим, что в нашем распоряжении есть вот такие детали.
Валентность элементов обусловлена количеством неспаренных электронов на внешнем уровне.
Рассмотрим металлы, расположенные в I группе. Их объединили в одно семейство щелочных металлов, поскольку реагируя с водою, они все образуют щёлочи, состава МеОН. Формула внешнего уровня имеет вид ns1. Если провести параллель с элементами конструктора, то они будут выглядеть следующим образом.
Они могут отличаться цветом, формой, однако их объединяет количество связей, которые они способны образовать. Иначе говоря, что щелочные металлы одновалентны.
Это правило срабатывает и для элементов II группы, только они будут иметь вид двойных деталей.
Вспоминаем, что элементы этой группы имеют формулу ns2, приходим к тому, что валентность атомов численно равна II.
Как возможно Вы заметили, или вспомнили с темы строение атома, что высшая валентность определяется номером группы, но не всегда ей равна. Исключением с данного правила являются атомы элементов таких как азот, фтор и кислород.
Почему фтор, находясь в VII группе, имеет валентность постоянную равную единице. В то время, для других его родственников, она будет равнять I, III, V или даже VII.
Источник
Поиграем с Вами в старую добрую игру «Найди … отличий». Несмотря на то, что они находятся в одной группе, имеют общую формулу внешнего слоя ns2np5, валентность их будет отличаться. Атомы хлора выигрывают за счёт свободного 3d уровня, на который при определённых условиях могут мигрировать электроны с наружного слоя, образуя при этом 3 возбуждённых состояния. Атом фтора в этом плане бедный, в распоряжении его электронов нет d-орбитали, его электронам некуда мигрировать.Поэтому имея только 1 неспаренный электрон, может образовать только единственную связь.
Причины постоянной и переменной валентности
Для большинства элементов характерно иметь переменную валентность. Но для некоторых она будет постоянной. Некоторые элементы Вам уже известны, пополнит этот список кислород и цинк, которые всегда двухвалентны, алюминий имеет число связей III.
Расположение элементов в периодической таблице подсказывает, о количестве связей, которые могут они образовать.
Источник
Определение валентности элементов по формулам
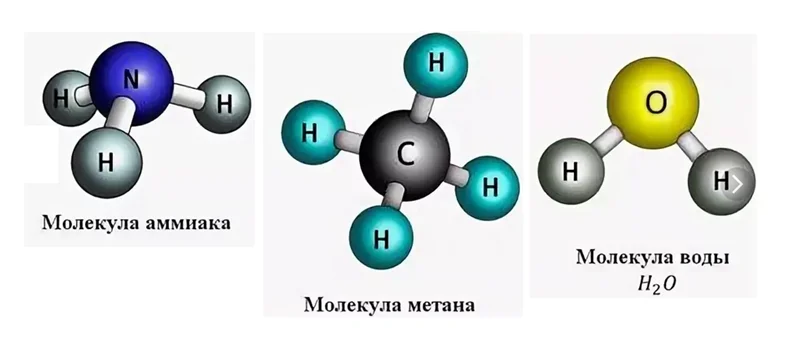
На рисунке изображены молекулы известных Вам веществ: это аммиак NH3, запах этого газа очень резкий и его трудно забыть, если хоть раз ощущали запах нашатырного спирта, с помощью его приводят людей в чувство после обморока.
Источник
С молекулой метана СН4 Вы встречаетесь на кухне, когда открываете газовый кран, чтобы приготовить пищу. На самом деле, метан не имеет запаха, но поскольку он относится к взрывоопасным веществам, то к нему прибавляют специальные соединения, имеющие запах, чтобы в случае утечки, его можно было обнаружить.
Молекула Н2О окружает нас повсюду. Во всех этих соединениях имеются атомы водорода, только в разных количествах. Давайте попробуем определить валентность по формуле вещества. Вспомним, что водород одновалентен. Если в аммиаке водорода насчитываем 3 атома, значит азот, условно, можем изобразить в виде такой детали.
Как видно с рисунка, он имеет валентность III. Поэтому принципу определим валентность углерода, приходим к выводу, что он четырёхвалентен.
Но не всегда мы видим структурные формулы, которые отображают связи между атомами, и не всегда имеем дело с одновалентными элементами. Возьмём, к примеру, вещество состава Р2О5. На два атома фосфора приходится 5 атомов кислорода. Постоянную валентность имеет кислород, которая равняется II. Чтобы определить, какую валентность будет иметь фосфор, необходимо выполнить следующие математические действия.
Встречаются такие соединения, где необходимо определить валентность остатков, входящих в состав кислот. Например, вещество состава Mg3(PO4)2.
Выполним согласно алгоритму. Магний всегда двухвалентен.
Искомая валентность кислотного остатка равна III. Следует заметить, что в веществе всегда находиться элемент, который проявляет постоянную валентность.
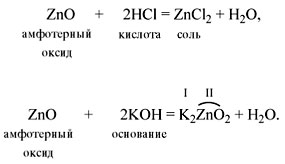
При написании уравнений реакций возникает необходимость составления формул веществ. Рассмотрим реакцию обмена между оксидом алюминия и соляной кислотой.
В результате обмена образуется два вещества состава AlCl и НО. Чтобы определить количественный состав в веществах, воспользуемся следующим алгоритмом.
Составление химических формул по валентности
Уравнение приобретает вид
Обратите внимание, что количество атомов отличается в реагентах и продуктах, его необходимо уравнять.
Составим формулы веществ по валентности элементов.
Немаловажную роль наравне с валентностью играет такое понятие как степень окисления (СО).
Термин валентность применим для соединений, имеющих молекулярное строение. Но, как известно, ещё существуют вещества ионного строения, которые образуются за счёт электростатического притяжения между разноимёнными зарядами. Каким образом они образуются? Чтобы ответить на данный вопрос, вспомним об электроотрицательности.
При образовании вещества, одни атомы будут отдавать свои электроны, другие – принимать. Рассмотрим на примере соединений молекулярного строения Cl2, HCl и ионного NaCl.
Обратите внимание, что вещества молекулярного строения, имеют структурную формулу, соединение атомов между собой показывается в виде черты – между ними. Для веществ имеющих строение, отличающее от молекулярного, более применимо понятие степени окисления, которое имеет универсальное применение для всех типов веществ.
Каким образом получается молекула вещества HCl? У водорода имеется один-единственный электрон, который располагается на 1s уровне, у хлора целых 7, занимающих уровни 3s2 и 3р5. Как Вы считаете, какой атом будет отдавать, а какой принимать электроны? При всём своём желании, атом водорода никак не сможет принять электроны хлора, ему просто некуда. Как он сможет расположить в своей 1s ячейке целых 7 электронов хлора. Логично предположить, что принимать будет хлор. Ему как раз не хватает одного электрона, чтобы завершить свой уровень. Поэтому водород будет иметь заряд +, а хлор -. Степень окисления указывается в правом верхнем углу элемента, арабскими цифрами, знак + или – ставим перед цифрой H+Cl−.
А вот какую степень окисления имеет простое вещество. Атомы равноценные партнёры, поэтому она будет нулевая.
При образовании ионного соединения NaCl натрий, как элемент имеющий малое число электронов на внешнем слое, а именно 1, подобно водороду, отдаёт его хлору, образуя при этом катион Na+, хлор при этом становится отрицательным анионом Cl−.
Правила определения степени окисления
Подобно валентности, для определённых элементов свойственна постоянная степень окисления. Это металлы, которые отличаются малым количеством электронов внешнего слоя. Отличительной характеристикой их будет невозможность иметь отрицательный заряд, поскольку они ВСЕГДА отдают электроны.
В противовес металлам существует один-единственный элемент, который абсолютно ни с кем не хочет делиться своими электронами.Ни при каких условиях он не отдаст их, это фтор, который всегда отрицателен F−.
Такой элемент, как кислород, обычно имеет отрицательный заряд, это -2. И только с фтором, он будет положительным +2.
Аналогичная ситуация с водородом, характерная СО (степень окисления) +1, однако исключения составляют соединения с металлами, где его степень окисления будет отрицательная и равняется -1.
Все эти значения вытекают с периодической системы, которая помогает определить степени окисления элементов.
Источник
С таблицы видно, что для большинства элементов эта величина не постоянная.
Чтобы вычислить степень окисления элементов в соединениях, будем руководствоваться следующими правилами.
Как бы то ни было, природа не ограничивается бинарными соединениями. Существует множество веществ состоящих из 2 и более элемента. Впрочем вычисление совсем не отличается, первоначально определяем элементы, имеющие постоянную степень окисления, а дальше проделав нехитрые математические действия находим СО для остальных. Главное правило, чтобы вещество было нейтральным, количество плюсов должно равняться количеству минусов.
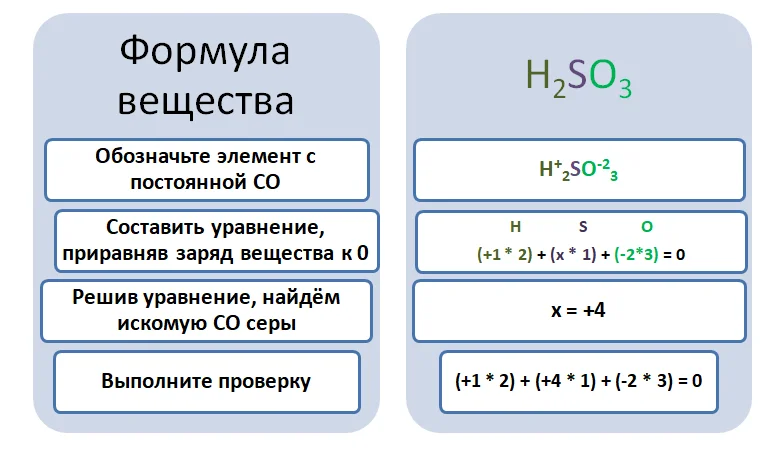
К примеру, в веществе H2SO3 самым электроотрицательным является кислород, он заберёт электроны как в водороде, так и в серы, вследствие этого имеет отрицательную СО, а Hи Sстанут положительными. В этом соединение имеются 2 элемента, имеющих известную СО – это Н и О.
Обратите внимание, на нахождение СО в кислотном остатке. В данном случае, мы приравниваем не к 0, а к заряду аниона.
Здесь у серы х внизу
Как правило, валентность и степень окисления совпадают по абсолютной величине. Но исключения составляют простые вещества, например, в простом веществе азот, формула которого N2, степень окисления равняется 0, в тоже время, валентность атомов азота равна III. N0 ≡ N0.
Либо в катионе аммония NH4+. Азот имеет СО -3, а валентность IV.
На уроках химии вы уже познакомились с понятием валентности химических элементов. Мы собрали в одном месте всю полезную информацию по этому вопросу. Используйте ее, когда будете готовиться к ГИА и ЕГЭ.
Валентность и химический анализ
Валентность – способность атомов химических элементов вступать в химические соединения с атомами других элементов. Другими словами, это способность атома образовывать определенное число химических связей с другими атомами.
С латыни слово «валентность» переводится как «сила, способность». Очень верное название, правда?
Понятие «валентность» — одно из основных в химии. Было введено еще до того, как ученым стало известно строение атома (в далеком 1853 году). Поэтому по мере изучения строения атома пережило некоторые изменения.
Так, с точки зрения электронной теории валентность напрямую связана с числом внешних электронов атома элемента. Это значит, что под «валентностью» подразумевают число электронных пар, которыми атом связан с другими атомами.
Зная это, ученые смогли описать природу химической связи. Она заключается в том, что пара атомов вещества делит между собой пару валентных электронов.
Вы спросите, как же химики 19 века смогли описать валентность еще тогда, когда считали, что мельче атома частиц не бывает? Нельзя сказать, что это было так уж просто – они опирались на химический анализ.
Путем химического анализа ученые прошлого определяли состав химического соединения: сколько атомов различных элементов содержится в молекуле рассматриваемого вещества. Для этого нужно было определить, какова точная масса каждого элемента в образце чистого (без примесей) вещества.
Правда, метод этот не без изъянов. Потому что определить подобным образом валентность элемента можно только в его простом соединении со всегда одновалентным водородом (гидрид) или всегда двухвалентным кислородом (оксид). К примеру, валентность азота в NH3 – III, поскольку один атом водорода связан с тремя атомами азота. А валентность углерода в метане (СН4), по тому же принципу, – IV.
Этот метод для определения валентности годится только для простых веществ. А вот в кислотах таким образом мы можем только определить валентность соединений вроде кислотных остатков, но не всех элементов (кроме известной нам валентности водорода) по отдельности.
Как вы уже обратили внимание, обозначается валентность римскими цифрами.
Валентность и кислоты
Поскольку валентность водорода остается неизменной и хорошо вам известна, вы легко сможете определить и валентность кислотного остатка. Так, к примеру, в H2SO3 валентность SO3 – I, в HСlO3 валентность СlO3 – I.
Аналогчиным образом, если известна валентность кислотного остатка, несложно записать правильную формулу кислоты: NO2(I) – HNO2, S4O6 (II) – H2 S4O6.
Валентность и формулы
Понятие валентности имеет смысл только для веществ молекулярной природы и не слишком подходит для описания химических связей в соединениях кластерной, ионной, кристаллической природы и т.п.
Индексы в молекулярных формулах веществ отражают количество атомов элементов, которые входят в их состав. Правильно расставить индексы помогает знание валентности элементов. Таким же образом, глядя на молекулярную формулу и индексы, вы можете назвать валентности входящих в состав элементов.
Вы выполняете такие задания на уроках химии в школе. Например, имея химическую формулу вещества, в котором известна валентность одного из элементов, можно легко определить валентность другого элемента.
Для этого нужно только запомнить, что в веществе молекулярной природы число валентностей обоих элементов равны. Поэтому используйте наименьшее общее кратное (соответсвует числу свободных валентностей, необходимых для соединения), чтобы определить неизвестную вам валентность элемента.
Чтобы было понятно, возьмем формулу оксида железа Fe2O3. Здесь в образовании химической связи участвуют два атома железа с валентностью III и 3 атома кислорода с валентностью II. Наименьшим общим кратным для них является 6.
- Пример: у вас есть формулы Mn2O7. Вам известна валентность кислорода, легко вычислить, что наименьше общее кратное – 14, откуда валентность Mn – VII.
Аналогичным образом можно поступить и наоборот: записать правильную химическую формулу вещества, зная валентности входящих в него элементов.
- Пример: чтобы правильно записать формулу оксида фосфора, учтем валентность кислорода (II) и фосфора (V). Значит, наименьшее общее кратное для Р и О – 10. Следовательно, формула имеет следующий вид: Р2О5.
Хорошо зная свойства элементов, которые они проявляют в различных соединениях, можно определить их валентность даже по внешнему виду таких соединений.
Например: оксиды меди имеют красную (Cu2O) и черную (CuО) окраску. Гидроксиды меди окрашены в желтый (CuОН) и синий (Cu(ОН)2) цвета.
А чтобы ковалентные связи в веществах стали для вас более наглядными и понятными, напишите их структурные формулы. Черточки между элементами изображают возникающие между их атомами связи (валентности):
Характеристики валентности
Сегодня определение валентности элементов базируется на знаниях о строении внешних электронных оболочек их атомов.
Валентность может быть:
- постоянной (металлы главных подгрупп);
- переменной (неметаллы и металлы побочных групп):
- высшая валентность;
- низшая валентность.
Постоянной в различных химических соединениях остается:
- валентность водорода, натрия, калия, фтора (I);
- валентность кислорода, магния, кальция, цинка (II);
- валентность алюминия (III).
А вот валентность железа и меди, брома и хлора, а также многих других элементов изменяется, когда они образуют различные химические соедения.
Валентность и электронная теория
В рамках электронной теории валентность атома определеяется на основании числа непарных электронов, которые участвуют в образовании электронных пар с электронами других атомов.
В образовании химических связей участвуют только электроны, находящиеся на внешней оболочке атома. Поэтому максимальная валентность химического элемента – это число электронов во внешней электронной оболочке его атома.
Понятие валентности тесно связано с Периодическим законом, открытым Д. И. Менделеевым. Если вы внимательно посмотрите на таблицу Менделеева, легко сможете заметить: положение элемента в перодической системе и его валентность неравзрывно связаны. Высшая валентность элементов, которые относятся к одной и тоже группе, соответсвует порядковому номеру группы в периодичнеской системе.
Низшую валентность вы узнаете, когда от числа групп в таблице Менделеева (их восемь) отнимете номер группы элемента, который вас интересует.
Например, валентность многих металлов совпадает с номерами групп в таблице периодических элементов, к которым они относятся.
Таблица валентности химических элементов
|
Порядковый номер хим. элемента (атомный номер)
|
Наименование |
Химический символ |
Валентность |
| 1
2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 |
Водород / Hydrogen
Гелий / Helium Литий / Lithium Бериллий / Beryllium Бор / Boron Углерод / Carbon Азот / Nitrogen Кислород / Oxygen Фтор / Fluorine Неон / Neon Натрий / Sodium Магний / Magnesium Алюминий / Aluminum Кремний / Silicon Фосфор / Phosphorus Сера / Sulfur Хлор / Chlorine Аргон / Argon Калий / Potassium Кальций / Calcium Скандий / Scandium Титан / Titanium Ванадий / Vanadium Хром / Chromium Марганец / Manganese Железо / Iron Кобальт / Cobalt Никель / Nickel Медь / Copper Цинк / Zinc Галлий / Gallium Германий /Germanium Мышьяк / Arsenic Селен / Selenium Бром / Bromine Криптон / Krypton Рубидий / Rubidium Стронций / Strontium Иттрий / Yttrium Цирконий / Zirconium Ниобий / Niobium Молибден / Molybdenum Технеций / Technetium Рутений / Ruthenium Родий / Rhodium Палладий / Palladium Серебро / Silver Кадмий / Cadmium Индий / Indium Олово / Tin Сурьма / Antimony Теллур / Tellurium Иод / Iodine Ксенон / Xenon Цезий / Cesium Барий / Barium Лантан / Lanthanum Церий / Cerium Празеодим / Praseodymium Неодим / Neodymium Прометий / Promethium Самарий / Samarium Европий / Europium Гадолиний / Gadolinium Тербий / Terbium Диспрозий / Dysprosium Гольмий / Holmium Эрбий / Erbium Тулий / Thulium Иттербий / Ytterbium Лютеций / Lutetium Гафний / Hafnium Тантал / Tantalum Вольфрам / Tungsten Рений / Rhenium Осмий / Osmium Иридий / Iridium Платина / Platinum Золото / Gold Ртуть / Mercury Талий / Thallium Свинец / Lead Висмут / Bismuth Полоний / Polonium Астат / Astatine Радон / Radon Франций / Francium Радий / Radium Актиний / Actinium Торий / Thorium Проактиний / Protactinium Уран / Uranium |
H
He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Сu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Ac Th Pa U |
I
0 I II III (II), IV (I), II, III, IV, V II I 0 I II III (II), IV I, III, V II, IV, VI I, (II), III, (IV), V, VII 0 I II III II, III, IV II, III, IV, V II, III, VI II, (III), IV, VI, VII II, III, (IV), VI II, III, (IV) (I), II, (III), (IV) I, II, (III) II (II), III II, IV (II), III, V (II), IV, VI I, (III), (IV), V 0 I II III (II), (III), IV (II), III, (IV), V (II), III, (IV), (V), VI VI (II), III, IV, (VI), (VII), VIII (II), (III), IV, (VI) II, IV, (VI) I, (II), (III) (I), II (I), (II), III II, IV III, (IV), V (II), IV, VI I, (III), (IV), V, VII 0 I II III III, IV III III, IV III (II), III (II), III III III, IV III III III (II), III (II), III III IV (III), (IV), V (II), (III), (IV), (V), VI (I), II, (III), IV, (V), VI, VII (II), III, IV, VI, VIII (I), (II), III, IV, VI (I), II, (III), IV, VI I, (II), III I, II I, (II), III II, IV (II), III, (IV), (V) II, IV, (VI) нет данных 0 нет данных II III IV V (II), III, IV, (V), VI |
В скобках даны те валентности, которые обладающие ими элементы проявляют редко.
Валентность и степень окисления
Понятие валентности можно считать родственным такой характеристике, как степень окисления. Тем не менее, обе эти характеристики не тождественным друг другу.
Так, говоря о степени окисления, подразумевают, что атом в веществе ионной (что важно) природы имеет некий условный заряд. И если валентность – это нейтральная характеристика, то степень окисления может быть отрицательной, положительной или равной нулю.
Интересно, что для атома одного и того же элемента, в зависимости от элементов, с которыми он образует химическое соединение, валентность и степень окисления могут совпадать (Н2О, СН4 и др.) и различаться (Н2О2, HNO3).
Заключение
Углубляя свои знания о строении атомов, вы глубже и подробнее узнаете и валентность. Эта характеристика химических элементов не является исчерпывающей. Но у нее большое прикладное значение. В чем вы сами не раз убедились, решая задачи и проводя химические опыты на уроках.
Эта статья создана, чтобы помочь вам систематизировать свои знания о валентности. А также напомнить, как можно ее определить и где валентность находит применение.
Надеемся, этот материал окажется для вас полезным при подготовке домашних заданий и самоподготовке к контрольным и экзаменам.
Не забудьте поделиться ссылкой с друзьями в социальных сетях, чтобы они тоже могли воспользоваться этой полезной информацией.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет
узнать и понять химию
Продолжение. Начало см. в № 13/2007
Глава 2. Важнейшие классы
неорганических соединений
2.1. Оксиды
Оксиды – сложные вещества, которые состоят из
атомов двух химических элементов, один из
которых кислород.
Определим, какое из следующих соединений оксид:
PH3, H3PO4, P2O5.
К оксидам относят соединение P2O5.
Два других вещества – не оксиды: в состав РН3
не входит атом кислорода, а в состав H3PO4 входят
атомы трех химических элементов – H, Р, O.
Названия оксидов складываются из двух слов:
первое слово – «оксид», второе слово – название
химического элемента, образующего данный оксид,
в родительном падеже. Например: СаО – оксид
кальция.
Если оксид образован химическим элементом с
переменной валентностью, то после названия
элемента нужно указать его валентность.
Например: Fe2О3 – оксид железа(III), FеО –
оксид железа(II).
Задание 2.1. Среди следующих соединений
найдите оксиды и назовите их:
N2O3, NH3, MnO2, H2O,
HCl, NaOH, Na2O, P2O5, H2SO4.
Задание 2.2. Составьте формулы следующих
оксидов:
оксид хрома(III), оксид углерода(IV), оксид магния,
оксид серы(VI), оксид азота(V), оксид калия, оксид
марганца(VI).
Многие оксиды могут реагировать с кислотами
или основаниями. В таких реакциях получаются
соли. Поэтому такие оксиды называются солеобразующими.
Однако существует небольшая группа оксидов,
которые к таким реакциям не способны. Такие
оксиды называют несолеобразующими.
Задание 2.3. Назовите несолеобразующие оксиды:
H2O, CO, N2O, NO, F2O.
Некоторые оксиды имеют особые (тривиальные)
названия: Н2О – вода, СО – угарный газ, СО2
– углекислый газ и др.
Солеобразующие оксиды подразделяют на три
группы: основные, кислотные, амфотерные.
Точно установить характер оксида можно, только
изучая его химические свойства. Например,
кислотные оксиды реагируют с основаниями и не
реагируют с кислотами. Основные оксиды реагируют
с кислотами и не реагируют с основаниями.
Амфотерные оксиды могут реагировать и с
кислотами, и с основаниями.
По формуле оксида можно определить, какими
свойствами он обладает. Правда, иногда эта оценка
будет приблизительной.
• Неметаллы образуют только кислотные и
безразличные оксиды.
• Металлы в зависимости от валентности могут
образовывать разные оксиды – основные, амфотерные
и кислотные.
Предсказать свойства оксида металла может
помочь эта схема:
Основные оксиды металлов от кислотных оксидов
металлов отличить легко: малая валентность
металла – основный оксид, большая – кислотный.
Как быть с амфотерными оксидами? «Любимая»
валентность металлов в этих оксидах III, но есть и
исключения. Поэтому желательно запомнить
формулы наиболее часто встречающихся амфотерных
оксидов: ZnO, Al2O3, SnO, PbO, Cr2O3.
Задание 2.4. Назовите амфотерные оксиды:
ZnO, SnO, PbO, Al2O3, Cr2O3.
Задание 2.5. Классифицируйте приведенные
ниже оксиды:
V2O5, SO2, ZnO, Fe2O3,
SO3, CO2, Li2O, FeO, Al2O3, H2O,
BaO.
Задание рекомендуется выполнить по следующей
схеме.
1) Определить, какой это оксид – солеобразующий
или несолеобразующий.
2) Определить, какой элемент входит в состав
солеобразующего оксида – металл или неметалл.
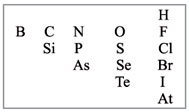
Для этого надо выписать из таблицы
Д.И.Менделеева символы элементов-неметаллов. Они
расположены в главных подгруппах на линии бор –
астат и выше этой линии (рис. 1).
|
|
Рис. 1. Элементы-неметаллы
|
3) Если в состав оксида входит атом
неметалла, то оксид кислотный.
4) Если в состав оксида входит атом металла, то
следует определить его валентность и по ней
выяснить характер оксида – основный, амфотерный
или кислотный.
Например: Cr2O3 – амфотерный, т.к. хром
– металл с валентностью III;
N2O3 – кислотный оксид, т.к. азот –
неметалл;
CrO3 – кислотный оксид, т.к. хром – металл с
высокой валентностью VI.
Зная характер оксида, можно описать его
свойства.
Свойства кислотных оксидов
• Кислотные оксиды реагируют c водой, образуя
кислоты. Например:
CO2 + H2O = H2CO3.
Чтобы составить формулу кислоты, нужно сложить
все атомы исходных веществ, записывая на первом
месте атом водорода, на втором – элемент,
образующий оксид, и на последнем – кислород. Если
индексы получились четными, то их можно
сократить:
N2O3 + H2O = H2N2O4
(2HNO2).
Эти же реакции можно записать в виде
арифметического примера:
Задание 2.6. Составьте уравнения реакций
кислотных оксидов из задания 2.5 с водой.
• Кислотные оксиды реагируют с осно?вными
оксидами, образуя соли соответствующей кислоты,
т.е. соль той кислоты, которая образуется при
взаимодействии этого оксида с водой. Например:
Чтобы составить такое уравнение, нужно
действовать по следующей схеме.
1) Составить формулу кислоты (прибавив к
молекуле оксида молекулу воды):
CO2 + H2O = H2CO3.
2) Определить валентность кислотного остатка
(это часть молекулы кислоты без атомов водорода).
В данном случае кислотный остаток имеет
состав СО3, его валентность равна числу
атомов водорода в кислоте, т.е. II.
3) Cоставить формулу соли, записав вместо атомов
водорода атом металла из основного оксида с его
валентностью (в данном случае натрий).
4) Составить формулу соли по валентности
металла и кислотного остатка: Na2CO3.
Задание 2.7. Составьте уравнения реакций
кислотных оксидов из задания 2.5 с оксидом
кальция.
• Кислотные оксиды реагируют с основаниями,
образуя соль соответствующей кислоты и воду.
Например:
Принципы составления уравнений реакций с
основаниями те же, что и для реакций с
осно?вными оксидами (см. выше).
Задание 2.8. Составьте уравнения реакций
кислотных оксидов из задания 2.5 с гидроксидом
натрия NаОН.
З а п о м н и т е! Кислотные оксиды ни с кислотами,
ни c кислотными оксидами не реагируют.
Свойства основных оксидов
• Основные оксиды реагируют с водой,
образуя основания. Реакция протекает, если
получающееся основание растворимо в воде.
Общая формула оснований – М(ОН)х, где х
– число ОН-групп, равное валентности металла М.
Например:
СаО + Н2О = Са(ОН)2,
Fe2O3 + Н2О нет реакции.
Последняя реакция не идет, т.к. основание Fe(ОН)3
нерастворимо в воде. Растворимость веществ в
воде можно определить по таблице растворимости
(рис. 2).
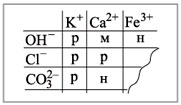 |
Рис. 2.
|
Условные обозначения: р – растворимо в воде, м
– малорастворимо в воде,
н – нерастворимо в воде.
При определении возможности протекания данной
реакции можно использовать и другое правило.
Основный оксид реагирует с водой, если он
образован активным металлом. Эти металлы стоят в
ряду напряжений до магния: Li, K, Ba, Ca, Na, Mg…
Задание 2.9. Составьте уравнения реакций основных
оксидов из задания 2.5 с водой.
• Основные оксиды реагируют с
кислотами, образуя соль и воду:
Обратите внимание: при составлении формулы
соли нужно вместо атомов водорода в формуле
кислоты написать символ металла, а затем
расставить индексы согласно валентности.
Задание 2.10. Составьте уравнения реакций
осно?вных оксидов из задания 2.5 с Н2SО4.
• Основные оксиды реагируют с
кислотными оксидами, образуя соли.
• Некоторые основные оксиды
реагируют при нагревании с водородом, при этом
образуются металл и вода:
CuO + H2 = Cu + H2O.
З а п о м н и т е! Основные оксиды с
основаниями и основными оксидами не
реагируют!
В ы в о д. В реакцию легче всего вступают
вещества с противоположными свойствами и не
вступают в реакцию вещества со сходными
свойствами.
Свойства амфотерных оксидов
Амфотерные оксиды (от греч. amphi – двойной)
проявляют двойственные свойства: они могут
реагировать и с кислотами, и с основаниями
(точнее, со щелочами). При этом образуются соль и
вода. Например:
Задание 2.11. Составьте уравнения реакций
амфотерных оксидов из задания 2.5 с КОН и НNО3.
Задание 2.12. С какими из веществ – Н2О,
NаОН, НСl – могут реагировать следующие оксиды:
Cr2O3, CrO, SO3, V2O5?
Составьте уравнения возможных реакций.
Способы получения оксидов
Оксиды могут быть получены при разложении
некоторых кислот, оснований, солей:
H2SO3 = SO2 + H2O,
Cu(OH)2 = CuO + H2O,
Са(НСО3)2 = Н2О + СО2
+ СаСО3.
Оксиды обычно получают сжиганием в кислороде
простых и сложных веществ:
2Mg + O2 = 2MgO,
C + O2 = CO2,
2H2 + O2 = 2H2O,
CH4 + 2O2 = CO2 + 2H2O.
Обратите внимание: при сгорании сложного
вещества образуются оксиды элементов, которые
входят в его состав. Исключение составляют
только азот и галогены, которые выделяются в виде
простых веществ.
В ы в о д ы по главе 2.1
Молекулы оксидов состоят из атомов двух
элементов. Один из этих элементов – кислород.
Оксиды, образующие соли, бывают кислотными,
амфотерными и основными.
Оксиды реагируют с веществами, которые
проявляют противоположные свойства.
Основные оксиды реагируют с
кислотными оксидами или кислотами, кислотные
оксиды – с основными оксидами или
основаниями, амфотерные оксиды – и с кислотами, и
с основаниями (щелочами).
2.2. Кислоты
Кислоты – это сложные вещества, в состав
молекул которых входят активные атомы водорода и
кислотные остатки. Активный атом водорода в
химических реакциях способен замещаться на атом
металла, в результате чего всегда получается
соль.
В формулах неорганических кислот атом водорода
записывается на первом месте*.
Например:
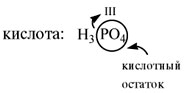
В состав молекулы любой кислоты кроме атомов
водорода входит кислотный остаток. Кислотный
остаток – это часть молекулы кислоты без атомов
водорода (которые могут быть замещены на атом
металла). Валентность кислотного остатка равна
числу таких атомов водорода:
При определении валентности кислотного
остатка учитываются те атомы водорода, которые
участвовали в реакции или могут участвовать в
ней. Так, фосфорной кислоте Н3РО4 в
зависимости от условий могут соответствовать
кислотные остатки разного состава:
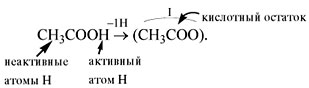
У органических кислот не все атомы водорода в
молекуле способны замещаться на атом металла:
Задание 2.13. Определите состав и валентность
кислотных остатков для кислот, учитывая, что все
атомы водорода кислот активные:
HNO3, H2S, NaHCO3, H2SO3,
KOH, HMnO4.
По числу атомов водорода в молекулах кислоты
делят на одноосновные и многоосновные.
Например:
HCl – одноосновная кислота, т. к. в ее молекуле
один атом водорода;
Н2СО3 – двухосновная кислота, т. к. в
ее молекуле два атома водорода.
По составу кислоты делят на бескислородные
(НСl, Н2S) и кислородсодержащие (НСlO, Н2SO4).
Бескислородные кислоты представляют собой
растворы некоторых газов в воде, при этом и
растворенному газу, и полученному раствору
приписывают одинаковые свойства, хотя это не так.
Например, из простых веществ водорода и хлора
получается газ хлороводород:
H2 + Cl2 = 2HCl.
Этот газ не проявляет кислотных свойств, если
он сухой: его можно перевозить в металлических
емкостях, и никакой реакции не происходит.
Но при растворении хлороводорода в воде
получается раствор, который проявляет свойства
сильной кислоты. Такую кислоту перевозить в
металлических емкостях нельзя.
Названия бескислородных кислот составляют по
схеме:
элемент + водород + «ная» кислота.
Например: H2S – сероводородная кислота
(раствор газа сероводорода в воде).
Некоторые бескислородные кислоты имеют особые
(тривиальные) названия: НСl – соляная кислота
(раствор газа хлороводорода в воде), НF –
плавиковая кислота (раствор газа фтороводорода в
воде).
Задание 2.14. Дайте химические названия
соляной и плавиковой кислотам.
Кислородсодержащие кислоты могут быть
получены при действии воды на кислотные оксиды
(см. выше). Исходные кислотные оксиды называют
«ангидриды кислот»:
Метафосфорная кислота неустойчива и,
присоединяя воду, превращается в более
устойчивую ортофосфорную кислоту:
Или в суммарном виде:
Р2О5 + 3Н2О = 2Н3РО4
.
Таким образом, Р2O5 – ангидрид
фосфорной кислоты, а также некоторых других,
менее устойчивых кислот.
Обратите внимание: название
кислородсодержащей кислоты содержит в виде
корня название элемента, входящего в состав
ангидрида: фосфор Р
фосфорный ангидрид Р2О5 фосфорная кислота Н3РО4.
Если элементу соответствует несколько кислот,
то для кислоты с большей валентностью
элемента, входящего в состав ангидрида, в
названии употребляют суффиксы «н» или «в».
Для кислот с меньшей валентностью элемента в
название кислоты добавляют суффикс «ист».
Валентность элемента проще всего определять по
формуле ангидрида:
В названии сернистой кислоты основной суффикс
«ист», а суффикс «н» введен дополнительно для
благозвучия.
Сведения о названиях некоторых кислот обобщены
в табл. 3.
Таблица 3
Названия кислот
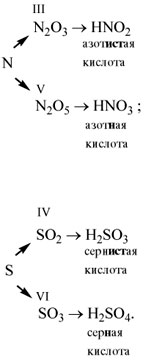
| Ангидрид | Кислота | Название |
| Нет | НС1 | Соляная, хлороводородная |
| CO2 | Н2СО3 | Угольная |
| SiO2 | …………… | Кремниевая |
| N2O3 | …………… | Азотистая |
| N2O5 | …………… | Азотная |
| SO2 | …………… | …………………….. |
| SO3 | …………… | …………………….. |
| P2O5 | …………… | …………………….. |
| CrO3 | …………… | Хромовая |
| Нет | H2S | Сероводородная |
Задание 2.15. Вместо пропусков в табл.
3 напишите формулы и названия соответствующих
кислот.
Задание 2.16. Напишите на память (никуда не
заглядывая) формулы кислот: кремниевой,
сернистой, серной, сероводородной, азотистой,
азотной, соляной, фосфорной, угольной. Укажите
ангидриды этих кислот (там, где они существуют).
Свойства кислот
Главным свойством всех кислот является их
способность образовывать соли. Соль образуется в
любой реакции, в которой участвует кислота, при
этом замещаются активные атомы водорода (один
или несколько).
• Кислоты реагируют с металлами. При этом атомы
водорода кислоты замещаются на атомы металла с
образованием растворимой соли и водорода.
Например:
Не все металлы способны вытеснять водород из
растворов кислот. Этот процесс возможен только
для тех металлов, которые стоят в ряду напряжений
(ряд активности) до водорода (рис. 3, см. с. 20):
 |
Рис. 3. Ряд напряжений металлов |
Задание 2.17. Составьте уравнения
возможных реакций:
серная кислота + алюминий,
соляная кислота + серебро,
бромоводородная кислота + цинк.
При составлении уравнений пользуйтесь рядом
напряжений. Не забывайте, составляя формулы
солей, учитывать валентности металла и
кислотного остатка.
Некоторые кислоты могут растворять металлы,
которые стоят в ряду напряжения после водорода,
но водород при этом не выделяется:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
• Кислоты реагируют с основаниями, образуя
соль и воду**. Это реакция
обмена, и поэтому валентность составных частей в
результате реакции не меняется:
Расставим коэффициенты:
2Н3РО4 + 3Са(ОН)2 = Са3(РО4)2
+ 6Н2О.
Задание 2.18. Составьте уравнения реакций:
серной кислоты и Fe(ОН)3,
соляной кислоты и Ва(ОН)2,
сернистой кислоты и NаОН.
Не забудьте порядок действий: составить
формулу соли по валентности металла и кислотного
остатка; расставить коэффициенты.
• Кислоты могут реагировать с солями. При этом
сильная кислота вытесняет более слабую из ее
соли.
К сильным кислотам относятся серная, азотная,
соляная и др.
К слабым кислотам относятся угольная,
кремниевая, сероводородная, азотистая.
В реакции обмена кислоты с солью образуются
новая соль и новая кислота. Например:
2HNO3 + CaCO3 = Ca(NO3)2 + H2CO3.
Более подробно о подобных реакциях см. главу 6.
Задание 2.19. Составьте, не обращаясь к
учебнику и пособиям, формулы: а) сильных кислот;
б) слабых кислот.
Задание 2.20. Составьте уравнения реакций:
соляная кислота + FeS,
азотная кислота + Na2SiO3,
серная кислота + K2CO3.
• Как обнаружить кислоту в растворе? Например,
в одном стакане налита вода, а в другом – раствор
кислоты. Как определить, где кислота? Хотя все
кислоты кислые на вкус, пробовать их нельзя, это
опасно. Выручают особые вещества – индикаторы.
Это соединения, которые изменяют цвет в
присутствии кислот.
Синий лакмус в кислоте становится красным;
оранжевый метилоранж тоже становится красным в
присутствии кислот.
В ы в о д ы по главе 2.2
Кислоты классифицируют:
по числу атомов водорода – на одноосновные,
двухосновные и т.д.;по наличию атома кислорода в составе
молекулы – на бескислородные и
кислородсодержащие;по силе – на сильные и слабые;
по устойчивости – на устойчивые и
неустойчивые.
Кислоты реагируют:
с активными металлами (стоящими в ряду
активности до Н),с основаниями,
с основными и амфотерными оксидами,
с солями более слабых кислот.
Кислоты обнаруживаются индикаторами в кислой
(«красной») области.
* В химических формулах
органических кислот атом водорода стоит в конце,
например CH3COOH – уксусная кислота.
** Реакция между кислотой и
основанием называется реакцией нейтрализации.
Продолжение следует
Кислотами называют сложные вещества, состоящие из атомов водорода, способных замещаться металлами, и кислотных остатков.
Кислотным остатком называют часть молекулы кислоты, соединённую с атомами водорода.
При замещении водорода в кислотах металлами в состав образующихся солей кислотные остатки переходят в неизменном виде. Если кислотный остаток в кислоте соединён с одним атомом водорода, то он одновалентен, если с двумя — двухвалентен, если с тремя — трёхвалентен и т. д.
Валентность кислотного остатка определяется количеством атомов водорода, способных замещаться металлами.
Формулы и названия некоторых кислот приведены в таблице.
Важнейшие неорганические кислоты
|
Название кислоты |
Формула кислоты |
Формула кислотного остатка |
Название соли этой кислоты |
| Фтороводородная (плавиковая) |
HF |
−F |
Фторид |
| Хлороводородная (соляная) |
HCl |
−Cl |
Хлорид |
| Бромоводородная |
HBr |
−Br |
Бромид |
| Угольная |
H2CO3 |
=CO3 |
Карбонат |
| Кремниевая |
H2SiO3 |
=SiO3 |
Силикат |
| Азотная |
HNO3 |
−NO3 |
Нитрат |
|
Ортофосфорная (фосфорная) |
H3PO4 |
≡PO4 |
Ортофосфат (фосфат) |
| Серная |
H2SO4 |
=SO4 |
Сульфат |
| Сернистая |
H2SO3 |
=SO3 |
Сульфит |
| Сероводородная |
H2S |
=S |
Сульфид |
Представителем органических кислот является уксусная кислота
CH3COOH.
Хотя в молекуле этой кислоты — четыре атома водорода, только один из них (входящий в состав группы СООН) может быть замещён металлом. Поэтому кислотный остаток уксусной кислоты является одновалентным.