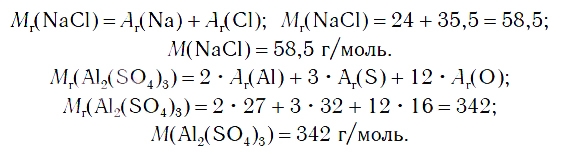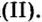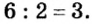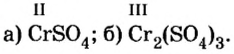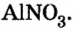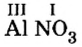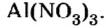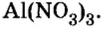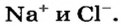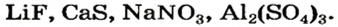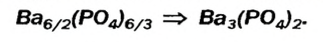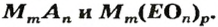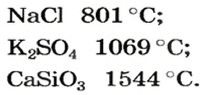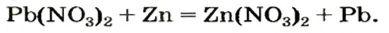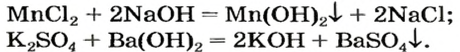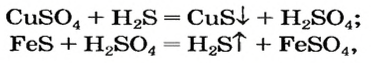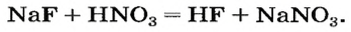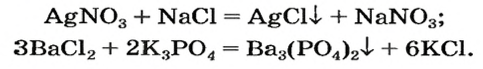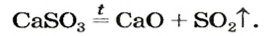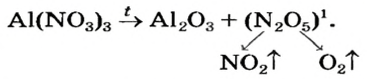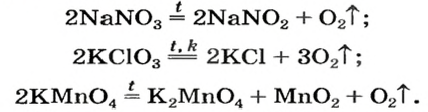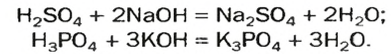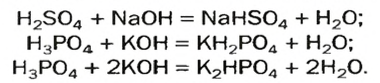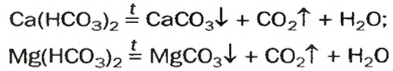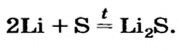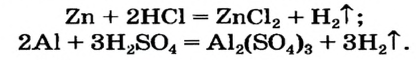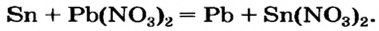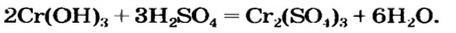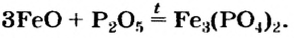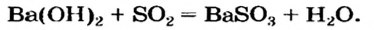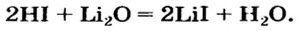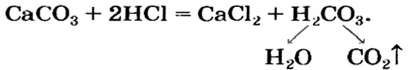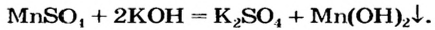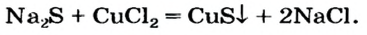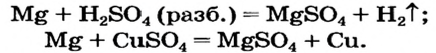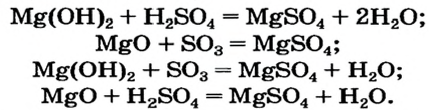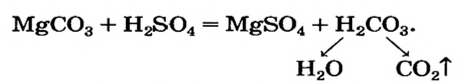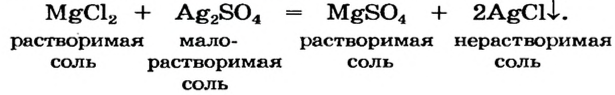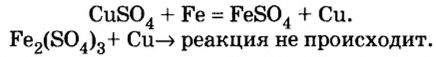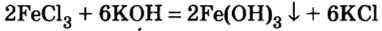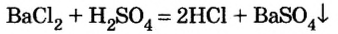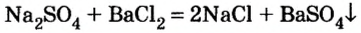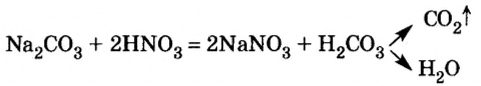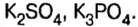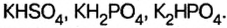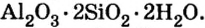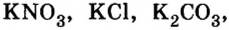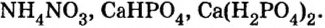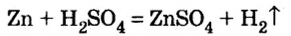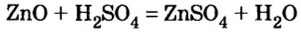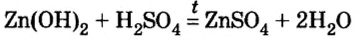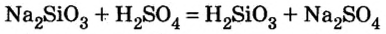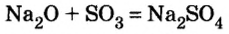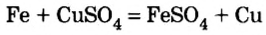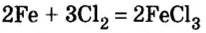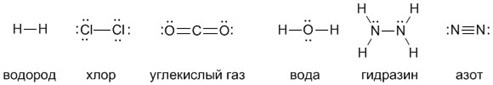| 01 |
Соли — самый разнообразный и многочисленный класс неорганических соединений. Они бывают средними, кислыми, основными, двойными, смешанными и комплексными. При н. у. все соли являются твердыми кристаллическими веществами, часто имеющими красивую окраску, причудливую форму кристаллов и самые разнообразные свойства. |
||||||||
Средние соли |
|||||||||
| 02 | Наиболее простые среди прочих видов солей — средние:
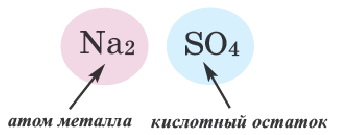
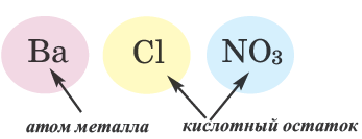
средние соли — это соединения, состоящие из атомов металлов и кислотных остатков Свое название эти соли получили именно потому, что представляют собой нечто среднее между основанием и кислотой: |
||||||||
| 03 |
Согласно правилам систематической номенклатуры название средней соли состоит из названия кислотного остатка, названия металла и валентности металла, если она не постоянна:
|
| 04 | Чтобы определить неизвестную валентность металла по формуле соли, необходимо:
|
||||||
| 05 | Можно воспользоваться альтернативным способом определения валентности металла:
|
||||||
| 06 | Чтобы написать формулу средней соли по ее названию, например:
необходимо, как и в любых подобных ситуациях:
|
||||||
| 07 |
К средним солям относится и хорошо знакомая нам поваренная соль — это хлорид натрия NaCl. Обычно ее добывают в солончаках, к числу которых относятся, например, высохшие соляные озера (рис. 1). |
Кислые соли |
|||||
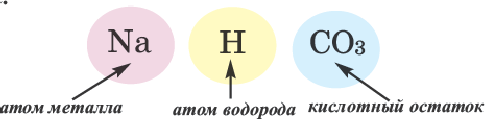
| 10 | Кислые соли называются так потому, что при их образовании не все атомы водорода в кислоте были замещены атомами металлов:
кислые соли — это соединения, состоящие из атомов металлов, кислотных остатков и не замещенных металлами атомов водорода Например, серная кислота может образовывать как средние, так и кислые соли:
В то же время бромистоводородная кислота HBr, не может образовывать кислых солей вообще, поскольку имеет лишь один атом водорода: либо он есть, либо его нет. А вот фосфорная кислота способна давать две кислых соли, отщепляя поочередно по одному атому водорода: LiH2PO4, Li2HPO4. |
||||
| 11 |
Каждый атом водорода уменьшает валентность кислотного остатка на единицу. Так, если для образования средней соли одному атому двухвалентного кальция требовался один сульфат, то в случае кислой соли их потребуется уже два:
|
||||
| 12 |
Название кислой соли состоит из названия кислотного остатка, к которому добавляется префикс гидро- или дигидро-, в зависимости от того, сколько атомов водорода — один или два, — с ним связано, а также названия металла и его валентности, если она не постоянна:
|
||||
| 13 | Валентность металла в кислой соли, например Cr(HSO3)3, определяется по известному алгоритму: | ||||
| 14 | Теперь попробуем вывести формулу кислой соли по ее названию, например:
Для этого:
|
||||
Основные соли |
|||||
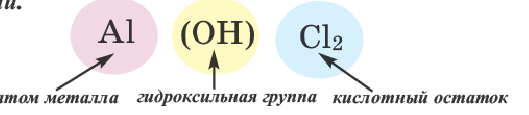
| 15 | Осно́вные соли называются так потому, что при их образовании не все гидроксилы в соответствующем основании были замещены кислотными остатками:
основные соли — это соединения, состоящие из атомов металлов, незамещенных гидроксилов и кислотных остатков. Так, кальций может образовывать одну основную соль:
а трехвалентное железо — две: Гидроксиды же одновалентных металлов, очевидно, вообще не могут образовывать основных солей. |
||||
| 16 |
Каждый гидроксил уменьшает валентность металла на единицу: в средней соли на один карбонат приходится один атом кальция, а в основной соли — уже два:
|
||||
| 17 |
Название основной соли состоит из названия кислотного остатка, названия металла, к которому добавляется префикс гидроксо-, дигидроксо- или тригидроксо-, в зависимости от того, сколько гидроксилов — один, два или три, — связано с одним атомом металла, а также валентности металла, если она не постоянна:
|
||||
| 18 | Валентность металла в основной соли, например Sn(OH)3NO3, определяется таким же способом, как и в других типах солей: | ||||
| 19 | Чтобы вывести формулу основной соли по ее названию, например
силикат гидроксомеди (II), сделаем следующее:
|
||||
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
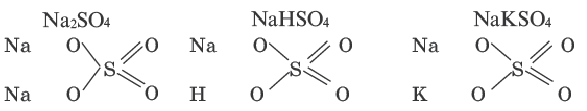
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
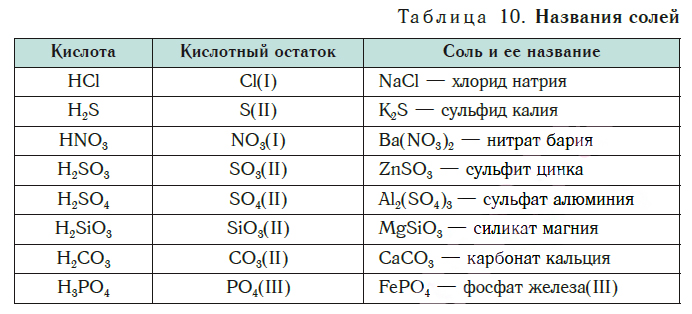
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Содержание:
Понятие о солях:
В предыдущем параграфе продукты замещения атомов водорода атомами металла имели формулы
Для этого разделим каждую формулу черточкой на две части:
Легко заметить, что первая составная часть формулы представлена металлическими элементами, а вторая — кислотными остатками. Кроме рассмотренных примеров, существует много веществ, формулы которых содержат металлические и кислотные остатки. Все они относятся к классу соединений, который получил название соли.
Соли — это сложные вещества, образованные атомами металлов и кислотными остатками
В отличие от кислот, представители класса солей имеют немолекулярное строение, их структурными частями являются ионы — катионы металлов и анионы кислотных остатков.
Формулу солей в общем виде можно записать так:
Номенклатура солей
Номенклатура солей (речь пойдет о так называемых средних солях, которые соответствуют приведенной общей формуле и являются продуктами полного замещения атомов водорода в кислоте). Название солей состоит из двух слов: названия металлического элемента и названия кислотного остатка в именительном падеже, например 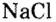
Если металл имеет переменную валентность, ее указывают в круглых скобках после его символа без интервала, например: 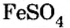
Кроме современных названий солей, которые отвечают указанным правилам, за некоторыми солями сохранились исторические названия, например: 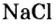
Определение валентности металлов в формулах солей и составление формул солей по валентности. Определяя валентность металла в формуле соли или составляя формулы солей, придерживаются общего правила, как при определении валентности элементов в бинарных соединениях и составлении их формул.
Сумма единиц валентности одной части формулы соли (атомов металла) равна сумме единиц валентности второй ее части (кислотного остатка).
Пример №
Определить валентность хрома в солях, формулы которых: 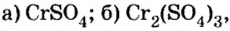
Решение
Обе соли содержат двухвалентный кислотный остаток серной кислоты.
Сумма единиц валентности кислотного остатка в первой формуле равна 2. Такой же должна быть и сумма валентностей атомов хрома. Поскольку атом хрома в этой формуле один, то обе валентности принадлежат ему. Следовательно, хром в формуле 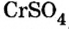
Во второй формуле кислотных остатков — три. Поэтому сумма единиц их валентностей составляет 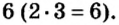
Ответ:
Пример №
Составить формулу нитрата алюминия.
Решение
1. Записываем символы металла и кислотного остатка:
2. Над металлом и кислотным остатком проставляем валентность:
3. Для единиц валентности металла и кислотного остатка находим наименьшее общее кратное: это число 3.
4. Делением общего кратного 3 на валентность металла и кислотного остатка находим индексы:
а) 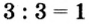
б) 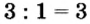
Полученные индексы вписываем в формулу нитрата алюминия:
Ответ:
Из общей формулы солей следует, что индекс металла совпадает с валентностью кислотного остатка, а индекс кислотного остатка — с валентностью металла. Однако, как и у оксидов, в формулах кислот четных индексов нет. Поэтому при составлении формул кислот по валентности проводят сокращение четных индексов.
Физические свойства солей
При нормальных условиях соли находятся только в твердом состоянии. Это тугоплавкие кристаллические вещества, поэтому, чтобы перевести их в жидкое состояние, а тем более в парообразное, нужны высокие температуры. Так, температура плавления сульфида бария равна
По способности растворяться в воде соли делят на растворимые (хлорид натрия, нитрат калия), малорастворимые (сульфит магния, хлорид свинца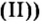
Соли — это вещества без запаха, разного вкуса. Может показаться, что класс веществ «Соли» получил такое название благодаря соленому вкусу его соединений. В действительности же с «чистым» соленым вкусом существует лишь одна соль, и вам она хорошо известна, это — хлорид натрия. Врачи предостерегают от избыточного употребления поваренной соли, однако в жизненно необходимых порциях хлорида натрия нуждается организм и человека, и животных. Она нужна для поддержания состава крови, а также вырабатывания желудочного сока. Физраствор, который используется для лечения больных,— ничто иное, как раствор хлорида натрия.
Соли бериллия — сладкие на вкус, соли магния — горькие, карбонат кальция (мел) — безвкусный. В большинстве своем соли имеют смешанный вкус — кисло-сладкий, горько-соленый.
Помните! В химическом кабинете соли ни в коем случае не пробуют на вкус!
Большинство солей белого цвета. Цвет перманганата калия 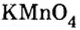
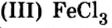
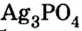
Внимательно рассмотрите образцы солей, которые учитель демонстрирует вам на урюке, и определите цвет и растворимость каждой из них.
Итоги:
- К классу солей относятся сложные вещества, образованные атомами металлов и кислотными остатками.
- В формулах солей сумма единиц валентности металла равна сумме единиц валентности кислотного остатка.
- Составляя формулу соли, необходимо знать валентность металла и кислотного остатка.
- По современной номенклатуре, названия солей образуют из названия металла и названия кислотного остатка и проставляют валентность металлов, у которых она имеет несколько значений.
Наиболее распространенной из солей угольной кислоты является карбонат кальция 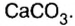
Жемчужина формируется в раковине моллюска вокруг раздражителей — чаще всего песчинок — и приблизительно за 12 лет вырастает величиной с горошину. Большие жемчужины правильной формы — чрезвычайная редкость.
Жемчуг издавна используют в качестве украшений. Особенно ценятся жемчужины правильной шарообразной формы. Они очень дорогостоящие: жемчужина диаметром 1 см стоит около 4000 долларов.
Средняя продолжительность хранения жемчужин составляет от 250 до 500 лет, после чего они теряют блеск и их легко измельчить в порошок.
Скелет других водных обитателей — коралловых полипов — по составу близок к жемчугу. Большие скопления коралловых полипов образуют коралловые рифы. В результате археологических раскопок обнаружилось, что люди издавна изготавливают украшения из кораллов (так называется скелет коралловых полипов). Благодаря несколько иному составу, чем у жемчужин, такие изделия сохраняются дольше. В зависимости от содержания органических веществ, кораллы бывают разного цвета: розовые, красные и даже черные. Изготовленные из таких кораллов украшения — ожерелья, серьги, кольца — считаются самыми дорогими. Владельцам кораллов нужно знать, что даже при легком нагревании эти драгоценности теряют свой цвет.
Что такое соли
К классу солей принадлежит соединение, которое мы употребляем ежедневно вместе с пищей. Это — поваренная соль 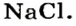
Соль — соединение, в состав которого входят катионы металлического элемента и анионы кислотного остатка.
Ион кислотного остатка имеет отрицательный заряд; его значение совпадает со значением валентности этого остатка:
Формулы солей. Для солей, как и кислот, существуют две общие формулы — 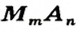
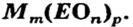
Примеры формул солей
Для того чтобы составить формулу соли, необходимо знать заряды катиона и аниона, а также учитывать то, что соединение электро-нейтрально. Для выяснения значений зарядов ионов можно использовать таблицу, размещенную на форзаце 2 (так называемая таблица растворимости).
Составим формулу соли, которая содержит катионы 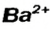
Графические формулы для солей, как и для других ионных соединений, не составляют.
Названия солей
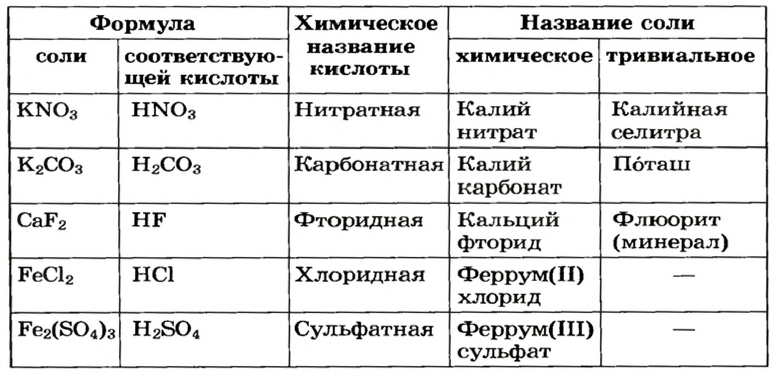
Для каждой соли существует химическое название, а для некоторых солей — еще и тривиальные названия (табл. 2). Химическое название соли состоит из двух слов. Первое слово — название металлического элемента, а второе происходит от химического названия соответствующей кислоты.
Формулы и названия некоторых солей
Если элемент имеет переменную валентность, то ее значение указывают после названия элемента (табл. 2, рис. 12). Склоняется только второе слово химического названия соли.
Существуют соли, образованные только неметаллическими элементами. В их состав входят катионы аммония 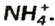
Два последних соединения применяют в качестве азотных удобрений.
Соли аммония происходят от основания 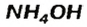
Распространенность в природе
В земной коре содержится много солей (рис. 13). В основном, это силикаты. Среди них встречаются и драгоценные камни: голубой топаз (алюминий силикат), золотистый циркон (цирконий силикат), бесцветный фенакит (бериллий силикат) и др.
Существует много залежей натрий хлорида NaCl (каменная соль), калий хлорида КС1, кальций карбоната СаС03 (мел, мрамор, известняк). Последнее соединение составляет основу ракушек, яичной скорлупы (рис. 14). Сульфиды 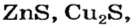
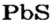
Различные соли находятся в растворенном состоянии в гидросфере. В морской воде преобладают хлориды Натрия и Магния, а в пресной — соли Кальция и Магния (в основном карбонатной и сульфатной кислот).
Выводы:
Соль — ионное соединение, в состав которого входят катионы металлического элемента и анионы кислотного остатка. Для солей существуют общие формулы
Каждая соль имеет химическое название, а некоторые соли — еще и тривиальные названия. Соли очень распространены в природе.
Свойства и применение солей
Физические свойства солей: Соли, как и другие ионные соединения, при обычных условиях являются кристаллическими веществами. Они обычно имеют высокие температуры плавления:
Часть солей растворяется в воде, некоторые являются малорастворимыми (рис. 31), а остальные — нерастворимые. Соответствующая информация помещена в таблице растворимости (форзац 2).
Образование растворов солей часто сопровождается тепловыми эффектами. Например, при растворении натрий карбоната выделяется небольшое количество теплоты и раствор немного нагревается. А во время приготовления раствора натрий нитрата можно зафиксировать незначительное понижение температуры.
Лишь одна соль — натрий хлорид — имеет соленый вкус. Многие другие растворимые соли горькие, а соли Плюмбума и Бериллия сладкие, но чрезвычайно ядовитые. Определяя вкус различных солей, некоторые алхимики, вероятно, поплатились за это жизнью.
Соли по-разному влияют на растения, животных, человека. Среди них есть соединения, которые содержат необходимые для растений элементы; их применяют в качестве удобрений. А поваренную соль мы ежедневно употребляем вместе с пищей, чтобы пополнить ее запасы в организме (это соединение постоянно выводится из организма вместе с потом и мочой).
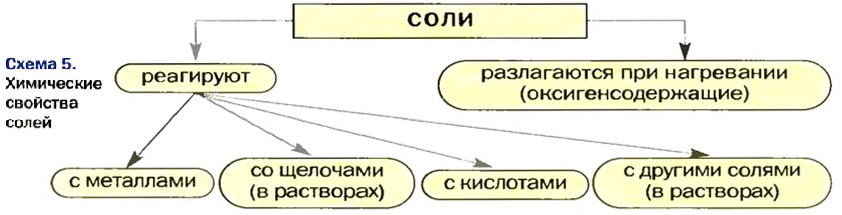
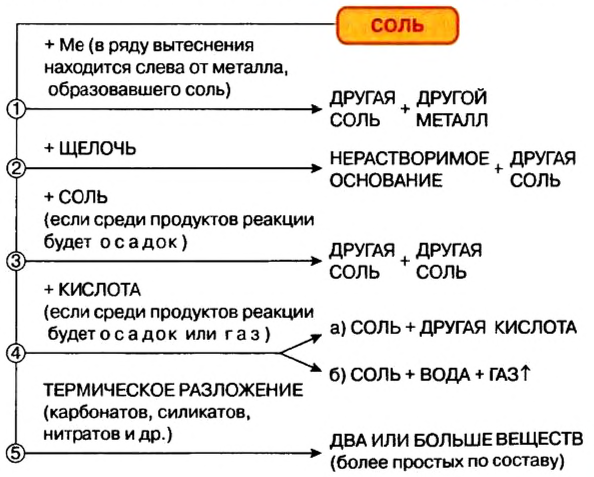
Химические свойства солей: Соли вступают в разнообразные реакции с простыми и сложными веществами.
Реакции с металлами
Соль в водном растворе может реагировать с металлом с образованием новой соли и другого металла (рис. 32). Часто говорят, что один металл «вытесняет» другой из раствора соли. Реакция происходит, если металл-реагент активнее, чем металл-продукт, т. е. находится в ряду активности слева от него (форзац 2):
Изучая основания и кислоты, вы узнали о реакциях этих соединений с солями. Кроме того, соли также могут взаимодействовать друг с другом. Все упомянутые реакции относят к реакциям обмена.
Реакции со щелочами
Реакция между солью и щелочью происходит лишь в растворе (нерастворимые соли со щелочами не взаимодействуют). Она возможна, если один из ее продуктов — основание или соль — выпадает в осадок (рис. 33):
Для прогнозирования возможности таких реакций используют таблицу растворимости (форзац 2).
Если к раствору купрум(II) сульфата добавить столько раствора щелочи, сколько необходимо для полного превращения соли в купрум(II) гидроксид, то после отстаивания над осадком увидим бесцветный раствор. Он будет содержать лишь натрий сульфат (ионы 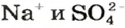
Реакции с кислотами
Соль (как растворимая, так и нерастворимая) может взаимодействовать с кислотой с образованием новой соли и новой кислоты. Такие реакции часто сопровождаются выделением осадка (рис. 34) или газа
но иногда остаются незаметными:
Случаи, в которых реакция между солью и кислотой возможна, указаны в §12(с. 81).
Реакции с другими солями
Взаимодействие между двумя солями происходит лишь в растворе (реагенты должны быть растворимыми в воде) с образованием двух новых солей. Реакция возможна, если один из ее продуктов выпадает в осадок (рис. 35), т. е. является нерастворимым или малорастворимым соединением.
Примеры реакций между двумя солями:
Термическое разложение солей
Оксиген-содержащие соли, образованные газообразными, летучими или неустойчивыми оксидами, при нагревании разлагаются. Продуктами этих реакций, как правило, являются два соответствующих оксида:
Нитраты, как и нитратная кислота, происходят от нитроген(V) оксида 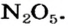
Соли щелочных элементов либо не разлагаются (карбонаты, сульфаты), либо их разложение происходит своеобразно. Некоторые из таких реакций используют в лаборатории для получения кислорода:
Изложенный материал обобщен в схеме 5.
1 — Так разлагаются нитраты металлических элементов от Магния до Купрума включительно (см. ряд активности металлов).
Применение солей
Многие соли применяются на практике. Натрий хлорид является сырьем для промышленного получения хлора, хлоридной кислоты, натрий гидроксида, соды. Это соединение незаменимо для приготовления пищи, консервирования. Хлорид, сульфат, нитрат Калия, фосфаты Кальция, некоторые другие соли применяют в качестве минеральных удобрений (рис. 36). Кальций карбонат в виде камня известняка используют в строительстве, а на заводах из него производят известь.
На основе искусственно полученной соли изготовляют зубную пасту. В школе пишут на доске мелом, а это — также кальций карбонат. Кальций сульфат (гипс) применяют в строительстве и медицине. Простым средством для мытья и чистки посуды, предметов домашнего обихода, смягчения воды перед стиркой является кальцинированная сода, или натрий карбонат. Кальцинированную соду вместе с мелом или известняком используют в производстве стекла.
Выводы:
Соли — ионные вещества. Они имеют высокие температуры плавления, различную растворимость в воде.
Соли взаимодействуют с металлами с образованием другой соли и другого металла. Такие реакции происходят, если металл-реагент более активный, чем металл-продукт (это определяют с помощью ряда активности металлов).
Соли вступают в реакции обмена со щелочами, кислотами, другими солями. Некоторые оксигенсодержащие соли при нагревании разлагаются на соответствующие оксиды. Многие соли используются на практике.
Кислые соли
Вы знаете, что при реакции кислоты со щелочью атомы Гидрогена каждой молекулы кислоты «заменяются» атомами (точнее — ионами) металлического элемента:
А возможна ли замена только части атомов Гидрогена в молекуле многоосновной кислоты? Да. В результате соответствующих реакций образуются так называемые кислые соли:
Кислые соли 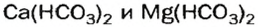
и на стенках сосуда образуется накипь — смесь карбонатов 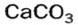
Кислые соли Кальция и ортофосфатной кислоты
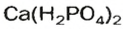

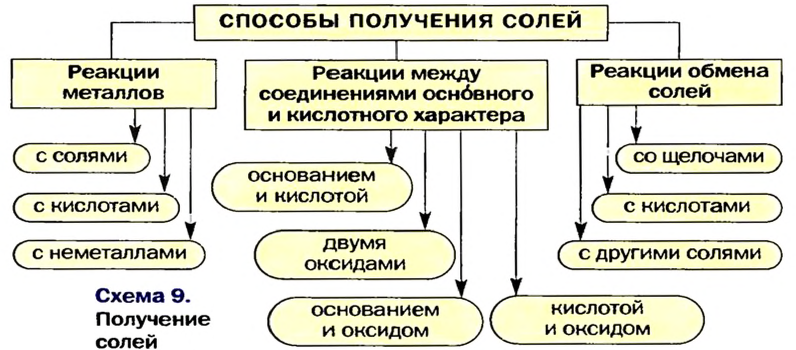
Способы получения солей
Соли можно получать значительно большим количеством способов, чем оксиды, основания или кислоты.
Три способа получения солей предполагают проведение химических реакций с участием металлов.
Способ 1: металл + неметалл 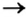
Способ 2: металл + кислота (раствор) 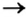
В такие реакции вступают сульфатная (в разбавленном растворе), хлоридная, некоторые другие кислоты и металлы, находящиеся в ряду активности слева от водорода:
Способ 3: металл 1 + соль 1 (в растворе) 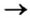
Вам известно, что такая реакция возможна, если металл 1 активнее металла 2, т. е. металл 1 находится в ряду активности слева от металла 2:
Несколько других способов получения солей предусматривают использование реакций между соединениями, которые проявляют основные и кислотные свойства (§ 9, 11 —13).
Способ 4: основание (амфотерный гидроксид) + кислота (амфотерный гидроксид) 
Способ 5: основный (амфотерный) оксид + кислотный (амфотерный) оксид 
Способ 6: основание + кислотный (амфотерный) оксид 
Способ 7: кислота + основный (амфотерный) оксид 
Соли также получают с помощью реакций обмена с участием солей (§ 14).
Способ 8: соль 1 + кислота 1 
Способ 9: соль 1 + щелочь 
Способ 10: соль 1 -I- соль 2 —> соль 3 + соль 4 (рис. 43):
Это интересно. Солис 
Способы 5 и 6 непригодны для получения солей безоксигеновых кислот, поскольку эти кислоты не имеют кислотных оксидов.
Выбирая способы 8—10, учитывают то, что реакция обмена возможна в случае образования осадка, газа или слабой кислоты (§11, 12, 14).
Вышеизложенное обобщено в схеме 9.
Пример №
Предложить максимальное количество способов получения магний сульфата
Решение
Магний сульфат — оксигенсодержащая соль. Поэтому способ 1 для получения соединения не подходит.
Эту соль можно получить, исходя из металла (способы 2 и 3):
Магний сульфат может образоваться в результате реакций между соответствующими соединениями основного и кислотного характера (способы 4—7):
Для реакции соли с кислотой (способ 
Реакция соли со щелочью (способ 9) для получения магний сульфата не подходит, поскольку одним из реагентов должен быть гидроксид 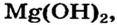
Магний сульфат растворяется в воде. Учитывая это, выберем для реакции между двумя солями (способ 10) такие реагенты:
Выводы:
Соли получают несколькими способами. Часть способов основана на реакциях металлов с неметаллами, кислотами, солями. Другие способы предусматривают осуществление реакций между соединениями с основными и кислотными свойствами, а также реакций обмена с участием солей.
Химические свойства солей
Соли, как и другие классы неорганических соединений, способны участвовать в химических реакциях.
Взаимодействие солей с металлами
Соли (в растворе) взаимодействуют с металлами, расположенными в вытесни-тельном ряду до того металла, из атомов которого они образовались. В результате реакции образуются новая соль и металл.
Опыт 1. Четыре химических стакана наполним растворами солей: два — сульфатом меди
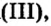
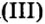
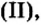
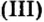
В реакции, которая состоялась, атомы простого вещества замещают атомы металлического элемента в сложном веществе. Поэтому эта реакция относится к реакциям замещения. Результаты опыта согласовываются с местом в вытеснительном ряду металлов, взятых для проведения опыта.
Взаимодействие солей с основаниями (щелочами)
В предыдущем параграфе вы узнали о том, что единственный способ, которым можно получить нерастворимое основание определенного металлического элемента,— это взаимодействие его растворенной в воде соли со щелочью. Такое взаимодействие мы рассматривали и при изучении свойств щелочей. Поэтому вспомним, что для протекания реакции вещества должны находиться в растворенном состоянии, а один из образовавшихся продуктов реакции — выпадать в осадок, например:
Взаимодействие солей с кислотами
Соли вступают в реакцию обмена с кислотами при условии, что среди продуктов реакции есть осадок или газ. (Вспомните взаимодействие соляной кислоты с нитратом серебра или питьевой соды — с уксусной кислотой.) Проведем соответствующие опыты.
Опыт 2. К раствору хлорида бария 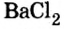
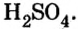
Среди образовавшихся продуктов нерастворимым веществом является сульфат бария.
Взаимодействие солей с солями
Повторим опыт 2, заменив серную кислоту на одну из ее растворимых солей.
Опыт 3. К раствору сульфата натрия 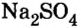
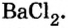
С помощью раствора хлорид бария или другого растворенного в воде соединения бария можно обнаружить в растворе серную кислоту и ее соли.
Опыт 4. К раствору карбоната натрия добавим раствор азотной кислоты. Наблюдается выделение газообразного вещества. Поднесенная к отверстию пробирки зажженная спичка гаснет. Следовательно, выделяется углекислый газ:
Для формулировки окончательного обоснованного вывода о химических свойствах солей проведите химический эксперимент, предусмотренный лабораторными опытами 7, 8, 9.
Итоги:
- Взаимодействие солей с другими веществами происходит в растворе.
- Одним из продуктов взаимодействия солей с другими веществами всегда является соль.
- Соли проявляют такие типичные химические свойства:
- Соли серной кислоты можно обнаружить в растворе с помощью растворов солей бария.
Соли, при образовании которых в молекуле кислоты все атомы водорода замещаются атомами металла, получили название средних солей. Средние соли не содержат ни атомов водорода, ни гидроксильных групп, а в их состав входят атомы одного металлического элемента, например:
Кроме средних, существуют еще и другие соли, в частности кислые, основные, двойные.
Кислые соли являются продуктом неполного замещения атомов водорода в молекуле кислоты на металл. Поэтому кислотные остатки таких солей содержат атомы водорода, например:
В молекулах серной и ортофосфорной кислот замещен на металл 1 атом водорода, поэтому остатки 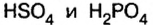



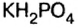
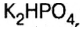
Основными называют соли, полученные частичной нейтрализацией основания кислотой (например, 
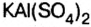
Какая образуется соль — средняя, кислая или основная — зависит от количества взятых для проведения реакции реагентов.
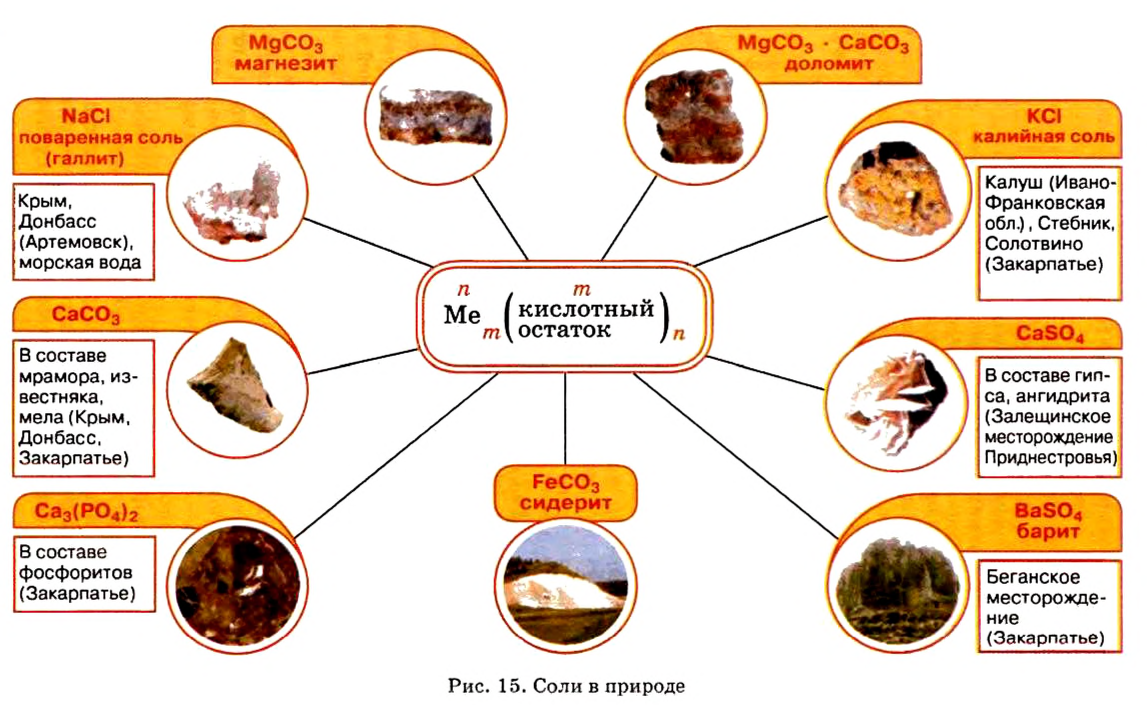
Соли в природе
По распространенности неорганических соединений в природе соли занимают второе место после оксидов. Так, горные породы и глина состоят из солей кремниевой кислоты, которые имеют сложное строение. Их формулы записывают с помощью формул оксидов, например формула полевого шпата — 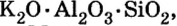
Местонахождение залежей солей в Украине представлено на рисунке 15.
Наиболее известная вам соль — хлорид натрия 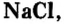
Как сырье хлорид натрия используется для производства гидроксида натрия, натрия, хлора, соляной кислоты, мыла, синтетических моющих средств. В пищевой, кондитерской и фармацевтической промышленности используют такие соли: хлорид натрия, карбонат натрия, нитрат натрия, сульфат магния и другие.
Карбонат кальция 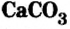
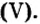
Кости позвоночных животных и человека содержат ортофосфат кальция 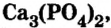
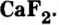
Соли входят также в состав крови, клеточного сока, нервной и мускульной тканей.
Из курсов природоведения и ботаники вам известно, что для полноценного роста и развития растениям нужны химические элементы калий, азот, фосфор. Их вносят в почву в виде минеральных удобрений. По своему составу почти все минеральные удобрения — это соли, в частности
Широко применяется и соль сульфата кальция 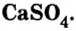
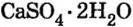
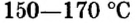
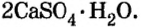
Карбонат натрия 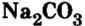
В плавательных бассейнах цвет воды обусловлен наличием в ней сульфата меди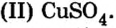
Хлорид калия 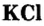
Из ортофосфата кальция 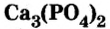
Сульфат бария 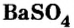
Ознакомившись с рисунком 16, вы пополните знания о применении солей новыми сведениями.
Приведенные здесь примеры — лишь небольшая часть того, как используются соли.
Итоги:
- Соли относятся к распространенным в природе сложным неорганическим веществам, среди которых больше всего хлоридов, силикатов, карбонатов, сульфатов, ортофосфатов.
- Часть солей используется непосредственно после добычи, а часть поддается химической переработке с целью получения новых веществ.
- Соли находят самое разнообразное применение в химической промышленности и многих других отраслях народного хозяйства, а также в быту.
Вода морей и океанов из-за содержащихся в ней различных солей на вкус солено-горькая. 100 г морской воды в среднем содержат 3,5 г солей, среди которых хлорида натрия почти 78 %. Моря и океаны имеют разную соленость — YaK называют содержание солей в единице объема морской воды. Однако состав солей в морской воде практически одинаков. Поэтому ученые считают, что Мировой океан в давние времена был единым.
Морские растения и животные приспособились к жизни в соленой воде. Более того, в их организмах накапливаются ионы, которые входят в состав солей морей и океанов. Морепродукты богаты кальцием, кремнием, иодом, медью, магнием, фосфором и другими элементами.
Используя сведения из географии и различных информационных источников, подготовьте рассказ (сообщение, реферат) о распространении какой-либо соли в природе и ее использовании.
Поработайте самостоятельно с дополнительной литературой, Интернетом и выясните, на каких химических свойствах солей основывается производство из них других веществ. Рассказ подтвердите примерами.
Справочный материал по солям
Соли можно получить многими способами:
1) взаимодействием металла с кислотой:
(Какой это тип реакции?)
Вспомните особенности взаимодействия кислот с металлами. Для получения солей каких металлов можно применить этот способ?
2) взаимодействием оксида металла с кислотой:
3) взаимодействием гидроксида металла с кислотой:
4) взаимодействием соли с кислотой:
5) взаимодействием основного или амфотерного оксида с кислотным оксидом:
6) взаимодействием металла с раствором соли другого металла:
7) взаимодействием металла с неметаллом (получают соли бескислородных кислот):
Итоги:
- В результате химических реакций образуются различные соединения. Это позволяет из соответствующих реагентов получать необходимые вещества.
- К общим способам получения оксидов относятся: окисление простых и сложных веществ, разложение нерастворимых гидроксидов при нагревании и др.
- К общим способам получения растворимых оснований (щелочей) относятся: взаимодействие металлов с водой, взаимодействие оксидов с водой и электролиз (разложение) растворов солей бескислородных кислот.
- Нерастворимые основания получают взаимодействием раствора их соли с раствором щелочи.
- Соли получают взаимодействием простого вещества (металла), сложных веществ (оксида металла, гидроксида металла, соли) с веществами, в состав которых входит кислотный остаток (кислота, соль), а также взаимодействием кислотных оксидов с основными оксидами или щелочами.
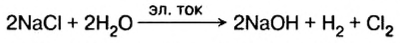
В лаборатории щелочь можно получить из металла и из оксида. Но чистых металлов натрия, калия, кальция, бария и их оксидов в природе не существует. Поэтому этими способами получают щелочи лишь в лабораториях. Чтобы обеспечить щелочами различные производства, нужны другие способы их получения из природного сырья. Впервые щелочь была получена электролизом (разложением постоянным электрическим током) раствора соли хлорида натрия. Электролиз стал основным промышленным способом производства щелочей гидроксида натрия и гидроксида калия.
Как происходит электролиз, вы будете изучать позже. А пока запишем суммарное уравнение электролиза водного раствора хлорида натрия:
Из записи уравнения видно, что из доступных природных веществ — поваренной соли и воды — получают три новых вещества, которых в природе нет, но каждое из них используется в промышленности, а значит есть потребность в их получении.
Классификация
Заполните таблицу.
| Химическая формула | Название | Тип соли |
| (CuOH)2CO3 | ? | ? |
| Fe2(SO4)3 | ? | ? |
| (NH4)2Cr2O7 | ? | ? |
| BaClNO3 | ? | ? |
| NaKSO4 | ? | ? |
Какие соли вам известны ? Как можно отличить соли друг от друга?
Соли получаются в результате замещения атомов водорода в молекуле кислоты атомами металла, а в основаниях гидроксильной группы (ОН.) кислотными остатками.
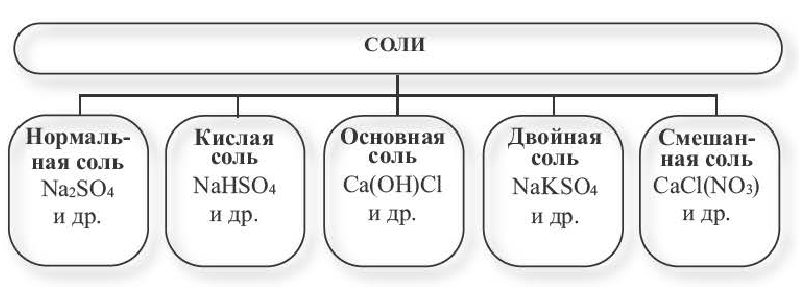
Солями называются вещества, в составе которых содержатся атомы металла (или аммония) и кислотный остаток. Соли классифицируют по их составу.
Графические формулы
Нормальные, кислые и двойные соли рассматриваются как продукты замещения атомов водорода в молекуле кислоты атомами металла.
Основные же соли рассматриваются как продукты замещения гидроксильной группы кислотным остатком.
Номенклатура
Нормальные соли. Соли, полученные в результате полного замещения атомов водорода, относящихся к основности кислот, атомами металлов, называются нормальными солями.
При наименовании нормальных солей, если металл обладает постоянной валентностью, то вначале дается название кислотного остатка, а затем название металла. Если же металл имеет переменную валентность, то вначале дается название кислотного остатка, следом название металла и его валентность (в скобках римскими цифрами).
| Нормальная соль | Название | Нормальная соль | Название | |
| Ah(SO4)3 | Сульфат алюминия | FeSO4 | Сульфат железа (II) |
Кислые соли
Соли, полученные в результате частичного замещения атомов водорода, относящихся к основности кислоты, атомами металлов (или же сложными ионами, например, ионами аммония), называются кислыми солями.
При наименовании кислых солей вначале дается название кислотного остатка с указанием на греческом количества атомов водорода, относящихся к основности кислоты и не замещенных металлом, с приставкой «гидро». При одном атоме водорода приставка «моно» не употребляется.
| Кислые соли | ||||
| Гидросоли | Дигидросоли | |||
| Формула | Название | Формула | Название | |
| CaHPO4 | гидроортофосфат кальция | NH4H2PO4 | дигидроортофосфат аммония |
Основные соли
Соли, полученные в результате частичного замещения гидроксильных групп оснований кислотными остатками, называются основными солями.
Как и нормальные соли, при наименовании основных солей к кислотным остаткам здесь добавляется приставка «гидроксо» с указанием на греческом количества гидроксильных групп (ОН), не замещенных кислотным остатком. Если гидроксильная группа одна, то приставка «моно» не употребляется.
| Основные соли | ||||
| Гидросоли | Дигидросоли | |||
| Формула | Название | Формула | Название | |
| Al(OH)Cl2 | гидроксохлорид алюминия | Al(OH)2Cl | дигидроксохлорид алюминия |
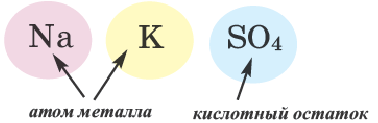
Двойные соли. Соли, полученные в результате замещения атомами двух разных металлов атомов водорода, относящихся к основности кислот в многоосновных кислотах, называются двойными солями.
При наименовании двойных солей после названия кислотного остатка даются оба названия металлов.
| Двойная соль | Название | Двойная соль | Название |
| NaKCO3 | карбонат натрия-калия | Na2KPO4 | ортофосфат динатрия-калия |
Смешанные соли
Соли, полученные в результате замещения гидроксильных групп в многокислотных основаниях двумя различными кислотными остатками, называются смешанными солями.
Если в составе смешанных солей содержатся бескислородные и кислородсодержащие кислотные остатки, то вначале даются названия бескислородных, а затем кислородсодержащих кислотных остатков.
| Смешанная соль | Название | Смешанная соль | Название |
| CaCl(OCl) (или CaOC2) | Хлорид гипохлорит кальция | BaClNO3 | хлорид нитрат бария |
Получение
При взаимодействии металлов с неметаллами
2Fe + ЗСЕ 
2Na + Cl2 
При взаимодействии металлов с солями. Начиная с элемента Mg в ряду активности металлов, каждый металл вытесняет последующие металлы из растворов их солей.
Zn + CuSO4 → ZnSO4 + Cu
При взаимодействии солей с солями. Такие реакции протекают в растворе в том случае, если обе исходные соли растворимы в воде и при их взаимодействии получится нерастворимая в воде соль.
Ca(NO3)2 + Na2CO3 → CaCO3↓ + 2NaNO3
Соли не вступают в реакцию с нерастворимыми в воде солями и основаниями.
Ca(NO3)2 + Cu(OH)2 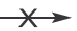
При взаимодействии однокислотных оснований с одноосновными кислотами, независимо от количества их молей, всегда получится нормальная соль.
KOH + HCI → KCl + H2O
При взаимодействии многоосновных кислот с многокислотными основаниями, в зависимости от количества молей веществ, получаются нормальная соль, кислая соль или основная соль. Для этого следует сравнить количество атомов водорода, показывающих основность кислоты, с количеством гидроксильных групп (ОН), выражающих кислотность основания.
При добавлении многоосновной кислоты к смеси двух различных оснований получится двойная соль.
NaOH + KOH + H2SO4 → 2H2O + NaKSO4
При нейтрализации одного многокислогного основания двумя различными кислотами получится смешанная соль.
Ca(OH)2+ HCl + HBr → CaClBr+ 2H2O
Физические и химические свойства солей
Определите вещества в соответствии с вопросительными знаками. Какие из представленных солей нерастворимы в воде?
Физические свойства:
Соли это твердые вещества с разной способностью к растворению и цветом. Все соли натрия (Na), калия (К) и аммония (NH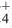
Ca3(PO4)2 → CaHPO4 → Ca(H2PQ4)2
увеличивается растворимость
Солям в основном присуща высокая температура плавления и кипения.
| Растворимость солей в воде | |
| Нерастворимые и малорастворимые | Растворимые |
| СaS04, BaS04, SrS04, PbS04, Ag2S04 | Остальные сульфаты растворяются в воде |
| AgCl, PbCl2, Hg2Cl2 | Другие хлориды растворяются в воде |
| FeS, CuS, PbS, ZnS и др. | Na2S, K2S, (NH4)2S |
| Другие ортофосфаты не растворяются вводе | Na3PO4, K3PO4, (NH4)3PO4 |
| Другие силикаты не растворяются в воде | Na2SiO3, K2SiO3 |
| Другие карбонаты не растворяются в воде | Na2CO3, K2CO3, (NH4)2CO3 |
| Все соли азотной кислоты, Na, К, NH4 растворяются в воде |
Химические свойства:
C химическими свойствами солей вы ознакомились при изучении свойств щелочей и кислот, способов получения оксидов и солей.
Кислые, основные, в том числе и двойные соли могут проявлять многие химические свойства нормальных солей. Кроме того, кислые соли легко нейтрализуются щелочами, а основные соли кислотами.
NaHSO4 + NaOH 
Mg(OH)Cl + HCl → MgCl2 + H2O
Основные соли могут взаимодействовать с щелочами.
Al(OH)2Cl+ NaOH → Al(OH)3↓ +NaCl
При нагревании большинства кислых солей (кроме солей аммония) они разлагаются с образованием нормальной соли.
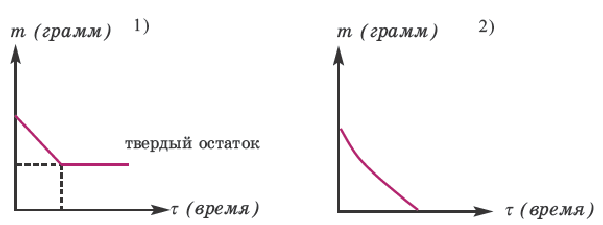
При разложении солей металлов (кроме Hg(NO3)2) всегда выделяется твердый остаток (или оксид металла, или же полученная новая соль в твердом виде). Поэтому разложение этих солей происходит как в 1-ом графике. При разложении большинства аммонийных солей твердый остаток не выделяется. Вот почему их разложение происходит как во 2-ом графике.
Некоторые соли при взаимодействии с водой образуют вещества кристаллогидраты.
Na2CO3 +10H2O → Na2CO3 . 10H2O
кристаллическая сода
При нагревании кристаллогидраты вновь обезвоживаются.
CuSO4 . 5H2O 
синий кристалл белый кристалл
Вода, входящая в состав кристаллов в виде химических соединений, называется кристаллизационной водой. Кристаллогидрат это не просто набор из воды и соли, а вещество. Вода и соль лишь условно разделены точкой.
Многоосновные кислоты, вступая в реакцию соединения с нормальными солями, образуют кислую соль.
Применение солей
Большинство солей широко применяются в промышленности и быту. Так, например, всем хорошо известно применение поваренной соли (NaCl) в быту. В промышленности ее используют при получении гидроксида натрия, соды, хлора, натрия и др. Соли азотной и оргофосфорной кислот в основном считаются минеральными удобрениями.
Многие средства защиты растений от болезнетворных микробов и вредителей, ряд лекарственных препаратов также относятся к классу солей. Более подробные сведения о применении отдельных солей будут представлены при изучении химических элементов.
Генетическая связь между классами неорганических соединений
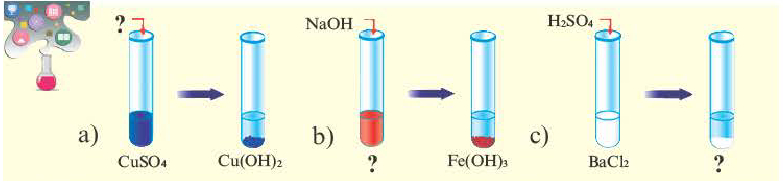
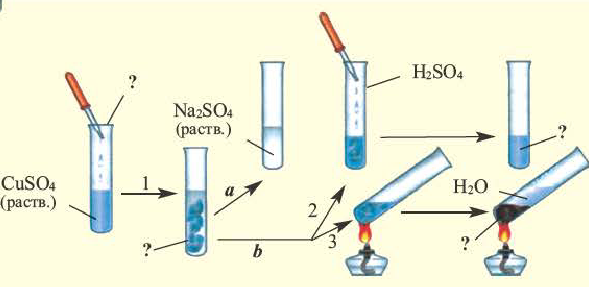
Обратите внимание на пробирки и содержащиеся в них вещества. Определите генетическую связь между этими веществами и запишите уравнения реакций.
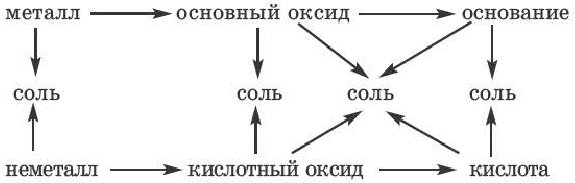
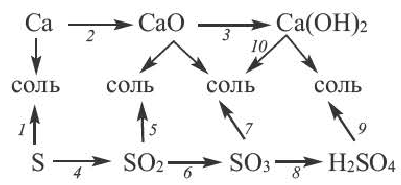
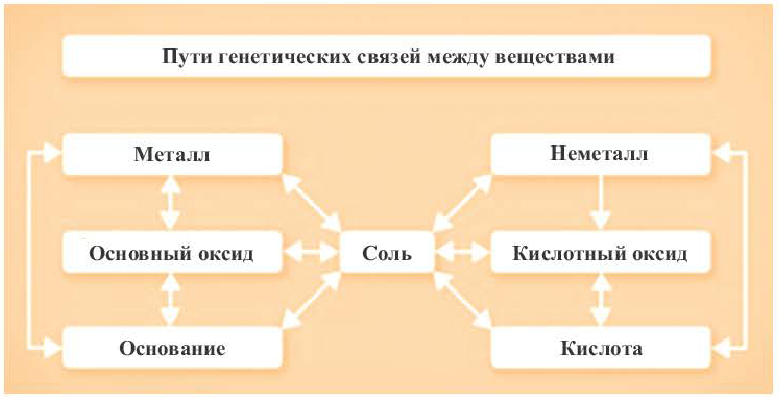
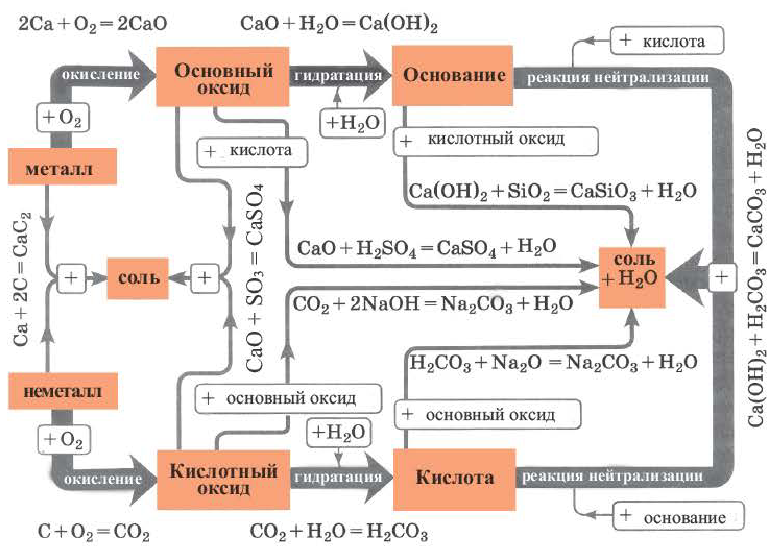
Возможность получения из представителей одного класса неорганических соединений представителей другого класса свидетельствует о наличии между ними генетической связи. Взаимосвязь между веществами отдельных классов можно проследить по нижеприведенной схеме:
Получение одного представителя неорганических соединений из другого основывается на их химических свойствах. Приведем один пример относительно генетических связей неорганических соединений.
В качестве примера генетической связи между неорганическими веществами можно привести следующие схемы.
Задача:
Какие вещества взаимодействуют и с Na2CO3, и с Zn(OH)2?
1) HCl 2) MgSO4 3)K0H 4) Ca(OH)2 5) H2SO4
Решение: Na2CO3, вступая в реакцию с сильными кислотами (HC1, HBr, HI, HNO2, H2SO4, H2PO4), выделяет соль и CO2.
В таком случае:
1) Na2CO3+ 2HC1 → 2NaCl + C02↑ + H2O
2) Na2CO3+ H2SO4 → Na2SO4+ CO2↑ + H2O
Поскольку Zn(OH)2 является амфотерным основанием, оно вступает в реакцию как с сильными кислотами (HC1, HBr, HI, HNO3, H3PO4, H2SO4), так и с щелочами (NaOH, КОН, Ca(OH)2, Ba(OH)2). В таком случае:
1) Zn(OH)2+ 2HC1 → ZnCl2+ 2H2O
2) Ca(OH)2 + Zn(OH)2 → CaZnO + 2H2O
3) Zn(OH)2+ H2SO4→ ZnSO4+ 2H2O
В то время как Zn(OH)2 вступает в реакцию с КОН, Na2CO3 в эту реакцию не вступает.
C другой стороны, основание Zn(OH)2, находящееся в виде осадка, не вступает в реакцию ни с одной солью.
Ответ: 1, 4, 5
- Хлор в химии
- Сера в химии
- Азот в химии
- Фосфор в химии
- Озон как химический элемент
- Оксиды в химии
- Основания в химии
- Кислоты в химии
Как определить валентность химического элемента в соединении?
В разных учебниках и учебных пособиях описывается способ определения валентности химического элемента в соединении. Из опыта работы, предлагаю научиться, определять валентность, как показано в учебнике. Но есть «хороший помошник» «Гимназия на дому». В несколько строк упоминается: что такое валентность, чему она равна, какими цифрами записывается. В учебниках дается таблица постоянные и переменные валентности элементов.
Обычно учащиеся не могут сразу запомнить постоянные валентности. В «Гимназии на дому» есть правила. Они просты и доступны ученикам. Их легко распечатать и раздать каждому обучающемуся, а можно просто распечатать на доску информации.
-
Правило. Постояннаявалентность у атомов элементов 1 – 3 групп главных подгрупп периодической системы химических элементов Д.И. Менделеева. Она равна номеру группы.
-
Правило. Переменную валентность имеют атомы элементов главных подгрупп 4 -7 групп периодической системы химических элементов Д.И. Менделеева, а также элементы побочных подгрупп. Валентность этих элементов в формуле определяется по другому элементу, валентность которого известна.
-
Правило. Произведение валентности химического элемента на его индекс в формуле для каждого элемента, входящего в нее, имеет одинаковое значение. Это правило справедливо только для соединений из двух химических элементов.
-
Правило. Валентность кислотного остатка в формуле соли равна числу атомов водорода в кислоте, которой образована соль.
-
Правило. Произведение валентности металла наего индекс в формуле соли (или основания) равно произведению числа кислотных остатков (или групп ОН) на валентность кислотного остатка (или группы ОН). Валентность группы ОН всегда равна 1.
Алгоритм выполнения упражнений можно использовать из учебника.
После оъяснения учителем, можно поработать у доски индивидуально с каждым учеником класса.
Затем дать 3 -5 минутное задание, выяснить, кто из обучающихся не усвоил правил определения валентности. Можно поработать у доски, но объяснять могу ребята, которые усвоили материал. В конце урока можно дать задания для работы в парах для проверки знаний или индивидульно. Формулировка заданий: фрмула , в которой валентность определена правильно; определите валентность химических элементов и кислотных остатков в соединениях. И т. д. Можно предложить учащимся самим составить задания для соседа по парте. Можно поработать в группах.
Литература
-
А.Е.Савельев «Гимназия на дому» 8-9 классы. Москва, Дрофа, 2008.
-
Н.И. Берман «Решение типовых задач». «Слово» 1996.
-
О.С. Габриелян учебник «Химия» 8 класс. Москва. «Дрофа» 2018.
На уроках химии вы уже познакомились с понятием валентности химических элементов. Мы собрали в одном месте всю полезную информацию по этому вопросу. Используйте ее, когда будете готовиться к ГИА и ЕГЭ.
Валентность и химический анализ
Валентность – способность атомов химических элементов вступать в химические соединения с атомами других элементов. Другими словами, это способность атома образовывать определенное число химических связей с другими атомами.
С латыни слово «валентность» переводится как «сила, способность». Очень верное название, правда?
Понятие «валентность» — одно из основных в химии. Было введено еще до того, как ученым стало известно строение атома (в далеком 1853 году). Поэтому по мере изучения строения атома пережило некоторые изменения.
Так, с точки зрения электронной теории валентность напрямую связана с числом внешних электронов атома элемента. Это значит, что под «валентностью» подразумевают число электронных пар, которыми атом связан с другими атомами.
Зная это, ученые смогли описать природу химической связи. Она заключается в том, что пара атомов вещества делит между собой пару валентных электронов.
Вы спросите, как же химики 19 века смогли описать валентность еще тогда, когда считали, что мельче атома частиц не бывает? Нельзя сказать, что это было так уж просто – они опирались на химический анализ.
Путем химического анализа ученые прошлого определяли состав химического соединения: сколько атомов различных элементов содержится в молекуле рассматриваемого вещества. Для этого нужно было определить, какова точная масса каждого элемента в образце чистого (без примесей) вещества.
Правда, метод этот не без изъянов. Потому что определить подобным образом валентность элемента можно только в его простом соединении со всегда одновалентным водородом (гидрид) или всегда двухвалентным кислородом (оксид). К примеру, валентность азота в NH3 – III, поскольку один атом водорода связан с тремя атомами азота. А валентность углерода в метане (СН4), по тому же принципу, – IV.
Этот метод для определения валентности годится только для простых веществ. А вот в кислотах таким образом мы можем только определить валентность соединений вроде кислотных остатков, но не всех элементов (кроме известной нам валентности водорода) по отдельности.
Как вы уже обратили внимание, обозначается валентность римскими цифрами.
Валентность и кислоты
Поскольку валентность водорода остается неизменной и хорошо вам известна, вы легко сможете определить и валентность кислотного остатка. Так, к примеру, в H2SO3 валентность SO3 – I, в HСlO3 валентность СlO3 – I.
Аналогчиным образом, если известна валентность кислотного остатка, несложно записать правильную формулу кислоты: NO2(I) – HNO2, S4O6 (II) – H2 S4O6.
Валентность и формулы
Понятие валентности имеет смысл только для веществ молекулярной природы и не слишком подходит для описания химических связей в соединениях кластерной, ионной, кристаллической природы и т.п.
Индексы в молекулярных формулах веществ отражают количество атомов элементов, которые входят в их состав. Правильно расставить индексы помогает знание валентности элементов. Таким же образом, глядя на молекулярную формулу и индексы, вы можете назвать валентности входящих в состав элементов.
Вы выполняете такие задания на уроках химии в школе. Например, имея химическую формулу вещества, в котором известна валентность одного из элементов, можно легко определить валентность другого элемента.
Для этого нужно только запомнить, что в веществе молекулярной природы число валентностей обоих элементов равны. Поэтому используйте наименьшее общее кратное (соответсвует числу свободных валентностей, необходимых для соединения), чтобы определить неизвестную вам валентность элемента.
Чтобы было понятно, возьмем формулу оксида железа Fe2O3. Здесь в образовании химической связи участвуют два атома железа с валентностью III и 3 атома кислорода с валентностью II. Наименьшим общим кратным для них является 6.
- Пример: у вас есть формулы Mn2O7. Вам известна валентность кислорода, легко вычислить, что наименьше общее кратное – 14, откуда валентность Mn – VII.
Аналогичным образом можно поступить и наоборот: записать правильную химическую формулу вещества, зная валентности входящих в него элементов.
- Пример: чтобы правильно записать формулу оксида фосфора, учтем валентность кислорода (II) и фосфора (V). Значит, наименьшее общее кратное для Р и О – 10. Следовательно, формула имеет следующий вид: Р2О5.
Хорошо зная свойства элементов, которые они проявляют в различных соединениях, можно определить их валентность даже по внешнему виду таких соединений.
Например: оксиды меди имеют красную (Cu2O) и черную (CuО) окраску. Гидроксиды меди окрашены в желтый (CuОН) и синий (Cu(ОН)2) цвета.
А чтобы ковалентные связи в веществах стали для вас более наглядными и понятными, напишите их структурные формулы. Черточки между элементами изображают возникающие между их атомами связи (валентности):
Характеристики валентности
Сегодня определение валентности элементов базируется на знаниях о строении внешних электронных оболочек их атомов.
Валентность может быть:
- постоянной (металлы главных подгрупп);
- переменной (неметаллы и металлы побочных групп):
- высшая валентность;
- низшая валентность.
Постоянной в различных химических соединениях остается:
- валентность водорода, натрия, калия, фтора (I);
- валентность кислорода, магния, кальция, цинка (II);
- валентность алюминия (III).
А вот валентность железа и меди, брома и хлора, а также многих других элементов изменяется, когда они образуют различные химические соедения.
Валентность и электронная теория
В рамках электронной теории валентность атома определеяется на основании числа непарных электронов, которые участвуют в образовании электронных пар с электронами других атомов.
В образовании химических связей участвуют только электроны, находящиеся на внешней оболочке атома. Поэтому максимальная валентность химического элемента – это число электронов во внешней электронной оболочке его атома.
Понятие валентности тесно связано с Периодическим законом, открытым Д. И. Менделеевым. Если вы внимательно посмотрите на таблицу Менделеева, легко сможете заметить: положение элемента в перодической системе и его валентность неравзрывно связаны. Высшая валентность элементов, которые относятся к одной и тоже группе, соответсвует порядковому номеру группы в периодичнеской системе.
Низшую валентность вы узнаете, когда от числа групп в таблице Менделеева (их восемь) отнимете номер группы элемента, который вас интересует.
Например, валентность многих металлов совпадает с номерами групп в таблице периодических элементов, к которым они относятся.
Таблица валентности химических элементов
|
Порядковый номер хим. элемента (атомный номер)
|
Наименование |
Химический символ |
Валентность |
| 1
2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 |
Водород / Hydrogen
Гелий / Helium Литий / Lithium Бериллий / Beryllium Бор / Boron Углерод / Carbon Азот / Nitrogen Кислород / Oxygen Фтор / Fluorine Неон / Neon Натрий / Sodium Магний / Magnesium Алюминий / Aluminum Кремний / Silicon Фосфор / Phosphorus Сера / Sulfur Хлор / Chlorine Аргон / Argon Калий / Potassium Кальций / Calcium Скандий / Scandium Титан / Titanium Ванадий / Vanadium Хром / Chromium Марганец / Manganese Железо / Iron Кобальт / Cobalt Никель / Nickel Медь / Copper Цинк / Zinc Галлий / Gallium Германий /Germanium Мышьяк / Arsenic Селен / Selenium Бром / Bromine Криптон / Krypton Рубидий / Rubidium Стронций / Strontium Иттрий / Yttrium Цирконий / Zirconium Ниобий / Niobium Молибден / Molybdenum Технеций / Technetium Рутений / Ruthenium Родий / Rhodium Палладий / Palladium Серебро / Silver Кадмий / Cadmium Индий / Indium Олово / Tin Сурьма / Antimony Теллур / Tellurium Иод / Iodine Ксенон / Xenon Цезий / Cesium Барий / Barium Лантан / Lanthanum Церий / Cerium Празеодим / Praseodymium Неодим / Neodymium Прометий / Promethium Самарий / Samarium Европий / Europium Гадолиний / Gadolinium Тербий / Terbium Диспрозий / Dysprosium Гольмий / Holmium Эрбий / Erbium Тулий / Thulium Иттербий / Ytterbium Лютеций / Lutetium Гафний / Hafnium Тантал / Tantalum Вольфрам / Tungsten Рений / Rhenium Осмий / Osmium Иридий / Iridium Платина / Platinum Золото / Gold Ртуть / Mercury Талий / Thallium Свинец / Lead Висмут / Bismuth Полоний / Polonium Астат / Astatine Радон / Radon Франций / Francium Радий / Radium Актиний / Actinium Торий / Thorium Проактиний / Protactinium Уран / Uranium |
H
He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Сu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Ac Th Pa U |
I
0 I II III (II), IV (I), II, III, IV, V II I 0 I II III (II), IV I, III, V II, IV, VI I, (II), III, (IV), V, VII 0 I II III II, III, IV II, III, IV, V II, III, VI II, (III), IV, VI, VII II, III, (IV), VI II, III, (IV) (I), II, (III), (IV) I, II, (III) II (II), III II, IV (II), III, V (II), IV, VI I, (III), (IV), V 0 I II III (II), (III), IV (II), III, (IV), V (II), III, (IV), (V), VI VI (II), III, IV, (VI), (VII), VIII (II), (III), IV, (VI) II, IV, (VI) I, (II), (III) (I), II (I), (II), III II, IV III, (IV), V (II), IV, VI I, (III), (IV), V, VII 0 I II III III, IV III III, IV III (II), III (II), III III III, IV III III III (II), III (II), III III IV (III), (IV), V (II), (III), (IV), (V), VI (I), II, (III), IV, (V), VI, VII (II), III, IV, VI, VIII (I), (II), III, IV, VI (I), II, (III), IV, VI I, (II), III I, II I, (II), III II, IV (II), III, (IV), (V) II, IV, (VI) нет данных 0 нет данных II III IV V (II), III, IV, (V), VI |
В скобках даны те валентности, которые обладающие ими элементы проявляют редко.
Валентность и степень окисления
Понятие валентности можно считать родственным такой характеристике, как степень окисления. Тем не менее, обе эти характеристики не тождественным друг другу.
Так, говоря о степени окисления, подразумевают, что атом в веществе ионной (что важно) природы имеет некий условный заряд. И если валентность – это нейтральная характеристика, то степень окисления может быть отрицательной, положительной или равной нулю.
Интересно, что для атома одного и того же элемента, в зависимости от элементов, с которыми он образует химическое соединение, валентность и степень окисления могут совпадать (Н2О, СН4 и др.) и различаться (Н2О2, HNO3).
Заключение
Углубляя свои знания о строении атомов, вы глубже и подробнее узнаете и валентность. Эта характеристика химических элементов не является исчерпывающей. Но у нее большое прикладное значение. В чем вы сами не раз убедились, решая задачи и проводя химические опыты на уроках.
Эта статья создана, чтобы помочь вам систематизировать свои знания о валентности. А также напомнить, как можно ее определить и где валентность находит применение.
Надеемся, этот материал окажется для вас полезным при подготовке домашних заданий и самоподготовке к контрольным и экзаменам.
Не забудьте поделиться ссылкой с друзьями в социальных сетях, чтобы они тоже могли воспользоваться этой полезной информацией.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.



2.jpg)
3.jpg)



2.jpg)

2.jpg)

2CO3.jpg)
2Br.jpg)