На чтение 11 мин Просмотров 3.2к. Опубликовано 28.04.2022
Никель — 28-й элемент периодической таблицы. Никель является элементом группы 10. Его символ « Ni » является его символом. Никель является транзитным элементом. Никель является переходным элементом. Поэтому его валентные электроны различны. Хотя последняя оболочка никелевого элемента имеет только два электрона, валентные элементы его более чем 2. Наряду с железом в метеоритах встречается и никель. В небольших количествах никель содержится даже в растениях, животных и морской воде. В земной коре содержится 80 частей на миллион никеля, но ядро планеты в основном состоит из никель-железный сплав.
Содержание
- Влияние никеля на окружающую среду
- История и использование
- Химические свойства
- Приложения
- Биологическая роль
- Место никеля (Ni) в периодической таблице
- Каковы валентные нейтроны никеля?
- Сколько протонов и электронов содержит никель?
- Как рассчитать количество валентных электронов в атоме никеля
- Как определить общее количество электронов в никеле
- Нужно ли проводить электронное образование никеля?
- Рассчитайте общее количество электронов и определите валентную оболочку
- Как определить валентность никеля?
- Сколько валентных элементов имеет ион никеля (Ni 2+ и Ni 3+)?
- Никель Факты
- Рекомендации:
Влияние никеля на окружающую среду
Электростанции и мусоросжигательные заводы выбрасывают никель в атмосферу. После реакции с каплями дождя он осядет на землю или опустится на землю. Никелю может потребоваться некоторое время, чтобы выйти из воздуха. Никель также может представлять опасность для поверхностных вод, если он является частью сточных вод.
Все соединения никеля, выбрасываемые в окружающую среду, будут выделяться в большем процентном соотношении. Это потому, что они будут адсорбировать частицы почвы или отложения и станут неподвижными. Никель будет более подвижен в кислых грунтах и, скорее всего, повторно проникнет в грунтовые воды.
У нас мало информации о воздействии никеля на другие организмы, кроме человека. Высокий уровень никеля в песчаных почвах может нанести вред растениям. Кроме того, высокий уровень никеля в поверхностных водах может снизить скорость роста водорослей. Никель также может вызывать замедление роста микроорганизмов, но эти организмы обычно через некоторое время становятся к нему устойчивыми.
| атомный номер | 28 |
|---|---|
| атомный вес | 58.69 |
| точка кипения | 2732 ° С (4950 ° F) |
| температура плавления | 1453 ° С (2647 ° F) |
| плотность | 8,902 (25 °С) |
| степени окисления | 0, +1, +2, +3 |
| электронная конфигурация | [Ar]3 д 8 4 с 2 |
История и использование
Аксель Фредрик Кронштедт, шведский химик, обнаружил никель в минерале NiAs в 1751 году . Сегодня большая часть никеля содержится в минерале пентландите, NiS*2FeS. Район Садбери в Онтарио, Канада, является местом, где находится большая часть мировых запасов никеля. Считается, что это крупное месторождение никелевой руды образовалось в результате удара древнего метеорита.
Никель – твердый металл, устойчивый к коррозии. Чтобы защитить его, никель можно гальванически наносить на другие металлы. Мелкоизмельченный никель можно использовать в качестве катализатора гидрогенизации растительных масел. Стекло приобретает зеленый оттенок за счет добавления в него никеля. Один килограмм никеля можно втянуть в 300-километровую проволоку. Никель также может использоваться в производстве некоторых типов монет или батареек.
Химические свойства
Никель химически неактивен. Никель образует поверхностный оксидный слой, что делает его инертным в воде, щелочах и многих кислотах. Он не подвергается коррозии. Он образует два оксида (NiO3 и Ni2O3), а также два гидроксида (NiOH2 и NiOH3).
Четыре растворимые соли – это хлорид, нитрат и сульфат никеля. Они имеют желтоватый или желто-коричневый цвет, окрашиваются в зеленый цвет. К нерастворимым солям относятся фосфат никеля, оксалат и сульфиды (черно-зеленый, бронзовый и зеленый). Он поглощает углерод, водород и другие газы, которые могут повредить его механические свойства. При температуре выше 500 0С взаимодействует с кислородом.
Никель самовозгорается в мелкодисперсной форме. При нагревании реагирует с галогенами. При сжигании в сере образуется сульфид. Если оксид NiO нагреть с серой, образуется моносульфид. Он реагирует с азотными кислотами с образованием нитрата никеля или оксида азота. По своим химическим свойствам он похож на кобальт и железо, но в меньшей степени на медь и благородные металлы. Он представляет собой порошкообразный металл и имеет в соединениях переменную валентность, чаще всего двухвалентную. Он может образовывать сложные и координированные соединения.
Приложения
Изготовление сплавов с другими металлами является наиболее распространенным применением никеля. Его также можно использовать в сплавах со сталью.
- Стали. Это улучшает химическую стойкость сплава: все нержавеющие стали содержат никель.
- Железо. Этот сплав имеет низкое тепловое расширение и может использоваться для изготовления деталей электроприборов.
- Кобальт и магний. Этот жаропрочный сплав выдерживает температуру до 500°C и устойчив к коррозии.
- С серебром и золотом. Это «белое золото», которое является прочным сплавом для ювелирных изделий.
- Хром. Это создает нихром, который является жаростойким и криогенным пластичным сплавом, который хорошо сохраняет свою форму.
- Железо, медь и хром. Этот сплав обладает высокой магнитной восприимчивостью.
- Никелевые сплавы можно использовать для изготовления брони, потому что они чрезвычайно пластичны. Многие сплавы используются для изготовления ядерных реакторов и газовых турбин. Их также можно использовать для изготовления нагревательных элементов и монет.
- Аккумуляторы часто изготавливаются из сплавов. Он также полезен в чистом виде. Никель можно использовать для изготовления листов, труб и других материалов, а также он действует как катализатор многих реакций в химических лабораториях. Этот металл также может быть использован для изготовления специализированного химического оборудования. Оксид никеля используется для изготовления стекла, керамики, глазури. Многие металлы можно защитить от коррозии никелированием. Никель используется в производстве спиралей для электронных сигарет и для обмотки струн музыкальных инструментов. Этот элемент используется в медицине для изготовления зубных протезов и брекетов.
Биологическая роль
Неясно, какова биологическая функция никеля. Никель может изменить рост определенных видов и необходим для некоторых. Соединения никеля могут вызывать рак при вдыхании. У некоторых людей также есть аллергия на металл.
Никеля нельзя полностью избежать. Соединения никеля входят в наш ежедневный рацион. Это важно для некоторых бобов, таких как морская фасоль, используемая для приготовления печеных бобов.
Каковы валентные нейтроны никеля?
Число электронов, найденных на последней орбите, является валентным элементом. Никель является первым элементом в группе 10. Это также элемент d-блока. Элементы, находящиеся в группах 3-12, можно назвать переходными элементами. Однако переходные элементы сохраняют валентные электроны внутри внутренней оболочки (орбиты).
Электронные конфигурации переходных элементов показывают, что последние электроны находятся на d-орбитали. Конфигурация электронов никеля показывает, что на последней оболочке два электрона. Однако электронная конфигурация с использованием метода Ауфбау показывает, что его последние электроны (3d 8 ) вышли на орбиталь.
Свойства элемента определяются валентными электронами. Эти электроны также играют роль в образовании связей. Электроны с d-орбитали участвуют в образовании связей. D-орбитальные электроны используются для расчета валентности переходных элементов.
Сколько протонов и электронов содержит никель?
Ядро расположено в центре атома. В ядре находятся протоны и нейтроны. Атомное количество никеля равно 28. Число протонов в данном атоме называется атомным номером. Количество протонов, найденных в никеле, равно 28. Круглая оболочка — это место, где электроны равны протонам. Это означает, что атом никеля содержит всего двадцать восемь электронов.
Валентность – это способность атома химического элемента образовывать определенное количество химических связей с другими атомами. Он принимает значения от 1 до 8 и не может быть равен 0. Он определяется количеством электронов атома, потраченных на образование химических связей с другим атомом. Валентность является реальной ценностью. Числовые значения валентности обозначены римскими цифрами (I,II,III,IV,V,VI,VII,VIII).
Как рассчитать количество валентных электронов в атоме никеля
Выполнив несколько шагов, вы сможете определить валентность электронов. Электронная конфигурация одна. Без электронной конфигурации невозможно определить валентные электроны. Легко определить электронную конфигурацию всех элементов.
Модель атома Бора не может идентифицировать валентные электроны в переходном элементе. Поскольку валентные электроны переходного элемента находятся на внутренней оболочке, то его невозможно определить. Принцип Ауфбау может помочь вам определить элементы валентности переходного элемента. Вот как мы можем определить валентность никеля.
Как определить общее количество электронов в никеле
Сначала нам нужно определить общее число электронов в атоме никеля. Чтобы определить количество и тип электронов в никеле, необходимо знать количество протонов. Вам также необходимо знать атомные номера никелевых элементов, чтобы определить количество электронов.
Периодическую таблицу можно использовать для расчета атомных номеров. Очень важно определить атомный номер для никелевых элементов, используя периодическую таблицу. Количество протонов в атомном номере известно как атомный номер. Кроме того, электроны, равные протонам, могут быть найдены вне ядра.
Таким образом, мы можем окончательно заключить, что атомные номера в атоме никеля имеют равные им электроны. Мы можем видеть из периодической таблицы, что атомное количество никеля равно 28. Атом никеля содержит 28 электронов.
Термины « степень окисления » и « валентность » могут не совпадать, но численно они почти идентичны. Условный заряд атома атома называется степенью окисления. Он может быть как положительным, так и отрицательным. Валентность относится к способности атома образовывать связи. Он не может иметь отрицательное значение.
Нужно ли проводить электронное образование никеля?
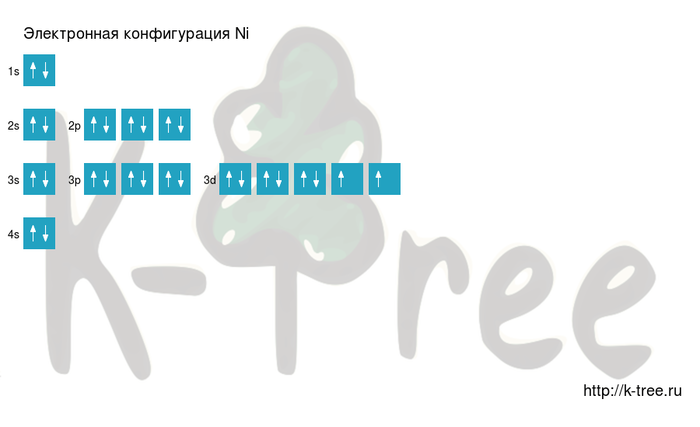
Шаг 2 имеет решающее значение. Для этого шага требуется расположение электронов в никеле. Общее количество электронов, обнаруженных в атомах никеля, можно рассчитать как двадцать восемь. 1s-орбиталь получает первые два электрона, а 2s-орбиталь — следующие два. Следующие шесть электронов перейдут на 2р-орбиталь. На p-орбитали допускается шесть электронов. На 2p-орбитали может быть шесть электронов.
Затем 8-й и 9-й электроны переходят на 3s-, 3p-орбитали. 3p-орбиталь заполнена, поэтому два оставшихся электрона могут перейти на 4s-орбиталь. Мы знаем, что орбиталь с максимум десятью частицами можно назвать d-орбиталью. Таким образом, восемь из оставшихся электронов перейдут на d’орбиталь. Таким образом, электронная конфигурация никеля имеет вид 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 .
Рассчитайте общее количество электронов и определите валентную оболочку
Третий шаг включает диагностику валентной оболочки. Валентная оболочка — это оболочка, соответствующая электронной конфигурации. Общее количество электронов внутри валентной оболочки называется валентной электроникой. Однако на внутренней орбите находятся валентные элементы переходных элементов.
Чтобы определить валентность элемента, вы должны добавить общее количество электронов с d-орбитали к электрону в последней оболочке атома. На д’орбитали восемь электронов, а на никелевой оболочке два электрона. Соответственно, валентных электронов никеля (Ni) десять.
- Валентность — числовая характеристика способности атомов данного элемента связываться с другими атомами.
- Валентность водорода постоянна и равна единице.
- Валентность кислорода также постоянна и равна двум.
- Валентность большинства других элементов непостоянна. Его можно определить по формулам их бинарных соединений с водородом или кислородом.
Как определить валентность никеля?
Валентность относится к способности атома одного элемента присоединяться к другому во время образования молекулы. Существуют некоторые рекомендации по диагностике валентности. Валентность представляет собой сумму всех неспаренных электронов на конечной орбитали электронной конфигурации после электронной конфигурации.
Никель имеет две степени окисления: +2 или +3. Никель (II) или NiO имеет степень окисления никеля +2. Валентность никеля в этом соединении равна 2. С другой стороны, оксид никеля (III) (Ni 2 O 3 ) использует степень окисления никеля +3. Валентность никеля в этом соединении равна 3. Образование связи определяет, какие степени окисления никеля возможны.
Сколько валентных элементов имеет ион никеля (Ni 2+ и Ni 3+ )?
При образовании связи элементы, которые имеют 1 или 2 электрона в своих оболочках, отдают эти электроны. Катионы – это элементы, которые отдают электроны для образования связей. Есть два типа. Ионы Ni 2+ и Ni 3+ находятся в составе атома никеля. Два электрона отдаются атомом никеля на 4s-орбитали для создания иона никеля (Ni 2+ ).
Вот электронная конфигурация никеля (Ni2+): 1s 2 2s 2 2p 6 3s 2 3p 6 3d 8 . Эта электронная конфигурация показывает, что никель (Ni) имеет три оболочки. Последняя оболочка содержит шестнадцать электронов. Ион никеля (Ni 2+ ), который имеет 16 валентных электронов, используется для иллюстрации этого. Атом никеля также отдает электроны на 4s- и 3d-орбиталях для превращения никеля в ион (Ni 3+ ).
Здесь. Вот электронная конфигурация никеля (Ni3+). Это 1s 2 2s 2 2p 6 3s 2 3p 6 3d 7 . Эта электронная конфигурация показывает, что ионы никеля имеют три оболочки. Последняя оболочка состоит из пятнадцати электронов (3s 2 3p 6 3d 7 ). Следовательно, валентных электронов в ионе никеля (Ni 3+ ) пятнадцать.
Никель Факты
- Никель встречается в изобилии в количестве 85 частей на миллион.
- Немецкие горняки, ищущие медь, могли иногда находить красную руду с небольшими зелеными вкраплениями. Они считали, что обнаружили медную руду и будут добывать ее для плавки. Руда не будет производить медь, которую они обнаружили. Руда была названа «купферникель» или Дьявольская медь, потому что Дьявол подменил полезный металл, чтобы запутать горняков.
- Никель ферромагнитен при комнатной температуре.
- Металлический никель является аллергеном для многих людей. Американское общество контактного дерматита назвало никель контактным аллергеном 2008 года.
- Аксель Кронштедт, шведский химик, в 1750-х годах обнаружил, что купферникель содержит мышьяк и неизвестный элемент. Теперь мы знаем, что купферникель (NiAs) — это арсенид никеля.
- Никель является элементом нержавеющей стали.
- Считается, что никель является вторым наиболее распространенным элементом в ядре Земли после железа.
- Никель содержится в изобилии в количестве 5,6 x 10 -4 мг/л морской воды.
- Большая часть производимого сегодня никеля используется для изготовления сплавов с другими металлами.
Рекомендации:
- https://en.wikipedia.org/wiki/Nickel
- https://www.rsc.org/periodic-table/element/28/nickel
- Virginia Bartow, Axel Fredrick Cronstedt., J. Chem. Образ., 1953 г.
Валентность никеля.
Валентность никеля:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Валентность никеля равна II, III. Никель проявляет переменную валентность.
| Валентность никеля в соединениях | |
| II | NiO, Ni(OH)2, NiCl2, NiBr2 |
| III | Ni2O3, NiOOH |
Все свойства атома никеля
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности
493
Валентность химических элементов (Таблица)
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0. Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Как можно определить валентность в соединениях:
— Валентность водорода (H) постоянна всегда 1. Отсюда в соединении H2O валентность O равна 2.
— Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
— Высшая валентность всегда равна № группы.
— Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.
— У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
— У неметаллов обычно две валентности: высшая и низшая.

Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
|
Атомный № |
Химический элемент |
Символ |
Валентность химических элементов |
Примеры соединений |
|
1 |
Водород / Hydrogen |
H |
I |
HF |
|
2 |
Гелий / Helium |
He |
отсутствует |
— |
|
3 |
Литий / Lithium |
Li |
I |
Li2O |
|
4 |
Бериллий / Beryllium |
Be |
II |
BeH2 |
|
5 |
Бор / Boron |
B |
III |
BCl3 |
|
6 |
Углерод / Carbon |
C |
IV, II |
CO2, CH4 |
|
7 |
Азот / Nitrogen |
N |
I, II, III, IV |
NH3 |
|
8 |
Кислород / Oxygen |
O |
II |
H2O, BaO |
|
9 |
Фтор / Fluorine |
F |
I |
HF |
|
10 |
Неон / Neon |
Ne |
отсутствует |
— |
|
11 |
Натрий / Sodium |
Na |
I |
Na2O |
|
12 |
Магний / Magnesium |
Mg |
II |
MgCl2 |
|
13 |
Алюминий / Aluminum |
Al |
III |
Al2O3 |
|
14 |
Кремний / Silicon |
Si |
IV |
SiO2, SiCl4 |
|
15 |
Фосфор / Phosphorus |
P |
III, V |
PH3, P2O5 |
|
16 |
Сера / Sulfur |
S |
VI, IV, II |
H2S, SO3 |
|
17 |
Хлор / Chlorine |
Cl |
I, III, V, VII |
HCl, ClF3 |
|
18 |
Аргон / Argon |
Ar |
отсутствует |
— |
|
19 |
Калий / Potassium |
K |
I |
KBr |
|
20 |
Кальций / Calcium |
Ca |
II |
CaH2 |
|
21 |
Скандий / Scandium |
Sc |
III |
Sc2S3 |
|
22 |
Титан / Titanium |
Ti |
II, III, IV |
Ti2O3, TiH4 |
|
23 |
Ванадий / Vanadium |
V |
II, III, IV, V |
VF5, V2O3 |
|
24 |
Хром / Chromium |
Cr |
II, III, VI |
CrCl2, CrO3 |
|
25 |
Марганец / Manganese |
Mn |
II, III, IV, VI, VII |
Mn2O7, Mn2(SO4)3 |
|
26 |
Железо / Iron |
Fe |
II, III |
FeSO4, FeBr3 |
|
27 |
Кобальт / Cobalt |
Co |
II, III |
CoI2, Co2S3 |
|
28 |
Никель / Nickel |
Ni |
II, III, IV |
NiS, Ni(CO)4 |
|
29 |
Медь / Copper |
Сu |
I, II |
CuS, Cu2O |
|
30 |
Цинк / Zinc |
Zn |
II |
ZnCl2 |
|
31 |
Галлий / Gallium |
Ga |
III |
Ga(OH)3 |
|
32 |
Германий / Germanium |
Ge |
II, IV |
GeBr4, Ge(OH)2 |
|
33 |
Мышьяк / Arsenic |
As |
III, V |
As2S5, H3AsO4 |
|
34 |
Селен / Selenium |
Se |
II, IV, VI, |
H2SeO3 |
|
35 |
Бром / Bromine |
Br |
I, III, V, VII |
HBrO3 |
|
36 |
Криптон / Krypton |
Kr |
VI, IV, II |
KrF2, BaKrO4 |
|
37 |
Рубидий / Rubidium |
Rb |
I |
RbH |
|
38 |
Стронций / Strontium |
Sr |
II |
SrSO4 |
|
39 |
Иттрий / Yttrium |
Y |
III |
Y2O3 |
|
40 |
Цирконий / Zirconium |
Zr |
II, III, IV |
ZrI4, ZrCl2 |
|
41 |
Ниобий / Niobium |
Nb |
I, II, III, IV, V |
NbBr5 |
|
42 |
Молибден / Molybdenum |
Mo |
II, III, IV, V, VI |
Mo2O5, MoF6 |
|
43 |
Технеций / Technetium |
Tc |
I — VII |
Tc2S7 |
|
44 |
Рутений / Ruthenium |
Ru |
II — VIII |
RuO4, RuF5, RuBr3 |
|
45 |
Родий / Rhodium |
Rh |
I, II, III, IV, V |
RhS, RhF3 |
|
46 |
Палладий / Palladium |
Pd |
I, II, III, IV |
Pd2S, PdS2 |
|
47 |
Серебро / Silver |
Ag |
I, II, III |
AgO, AgF2, AgNO3 |
|
48 |
Кадмий / Cadmium |
Cd |
II |
CdCl2 |
|
49 |
Индий / Indium |
In |
III |
In2O3 |
|
50 |
Олово / Tin |
Sn |
II, IV |
SnBr4, SnF2 |
|
51 |
Сурьма / Antimony |
Sb |
III, V |
SbF5, SbH3 |
|
52 |
Теллур / Tellurium |
Te |
VI, IV, II |
TeH2, H6TeO6 |
|
53 |
Иод / Iodine |
I |
I, III, V, VII |
HIO3, HI |
|
54 |
Ксенон / Xenon |
Xe |
II, IV, VI, VIII |
XeF6, XeO4, XeF2 |
|
55 |
Цезий / Cesium |
Cs |
I |
CsCl |
|
56 |
Барий / Barium |
Ba |
II |
Ba(OH)2 |
|
57 |
Лантан / Lanthanum |
La |
III |
LaH3 |
|
58 |
Церий / Cerium |
Ce |
III, IV |
CeO2 , CeF3 |
|
59 |
Празеодим / Praseodymium |
Pr |
III, IV |
PrF4, PrO2 |
|
60 |
Неодим / Neodymium |
Nd |
III |
Nd2O3 |
|
61 |
Прометий / Promethium |
Pm |
III |
Pm2O3 |
|
62 |
Самарий / Samarium |
Sm |
II, III |
SmO |
|
63 |
Европий / Europium |
Eu |
II, III |
EuSO4 |
|
64 |
Гадолиний / Gadolinium |
Gd |
III |
GdCl3 |
|
65 |
Тербий / Terbium |
Tb |
III, IV |
TbF4, TbCl3 |
|
66 |
Диспрозий / Dysprosium |
Dy |
III |
Dy2O3 |
|
67 |
Гольмий / Holmium |
Ho |
III |
Ho2O3 |
|
68 |
Эрбий / Erbium |
Er |
III |
Er2O3 |
|
69 |
Тулий / Thulium |
Tm |
II, III |
Tm2O3 |
|
70 |
Иттербий / Ytterbium |
Yb |
II, III |
YO |
|
71 |
Лютеций / Lutetium |
Lu |
III |
LuF3 |
|
72 |
Гафний / Hafnium |
Hf |
II, III, IV |
HfBr3, HfCl4 |
|
73 |
Тантал / Tantalum |
Ta |
I — V |
TaCl5, TaBr2, TaCl4 |
|
74 |
Вольфрам / Tungsten |
W |
II — VI |
WBr6, Na2WO4 |
|
75 |
Рений / Rhenium |
Re |
I — VII |
Re2S7, Re2O5 |
|
76 |
Осмий / Osmium |
Os |
II — VI, VIII |
OsF8, OsI2, Os2O3 |
|
77 |
Иридий / Iridium |
Ir |
I — VI |
IrS3, IrF4 |
|
78 |
Платина / Platinum |
Pt |
I, II, III, IV, V |
Pt(SO4)3, PtBr4 |
|
79 |
Золото / Gold |
Au |
I, II, III |
AuH, Au2O3, Au2Cl6 |
|
80 |
Ртуть / Mercury |
Hg |
II |
HgF2, HgBr2 |
|
81 |
Талий / Thallium |
Tl |
I, III |
TlCl3, TlF |
|
82 |
Свинец / Lead |
Pb |
II, IV |
PbS, PbH4 |
|
83 |
Висмут / Bismuth |
Bi |
III, V |
BiF5, Bi2S3 |
|
84 |
Полоний / Polonium |
Po |
VI, IV, II |
PoCl4, PoO3 |
|
85 |
Астат / Astatine |
At |
нет данных |
— |
|
86 |
Радон / Radon |
Rn |
отсутствует |
— |
|
87 |
Франций / Francium |
Fr |
I |
— |
|
88 |
Радий / Radium |
Ra |
II |
RaBr2 |
|
89 |
Актиний / Actinium |
Ac |
III |
AcCl3 |
|
90 |
Торий / Thorium |
Th |
II, III, IV |
ThO2, ThF4 |
|
91 |
Проактиний / Protactinium |
Pa |
IV, V |
PaCl5, PaF4 |
|
92 |
Уран / Uranium |
U |
III, IV |
UF4, UO3 |
|
93 |
Нептуний |
Np |
III — VI |
NpF6, NpCl4 |
|
94 |
Плутоний |
Pu |
II, III, IV |
PuO2, PuF3, PuF4 |
|
95 |
Америций |
Am |
III — VI |
AmF3, AmO2 |
|
96 |
Кюрий |
Cm |
III, IV |
CmO2, Cm2O3 |
|
97 |
Берклий |
Bk |
III, IV |
BkF3, BkO2 |
|
98 |
Калифорний |
Cf |
II, III, IV |
Cf2O3 |
|
99 |
Эйнштейний |
Es |
II, III |
EsF3 |
|
100 |
Фермий |
Fm |
II, III |
— |
|
101 |
Менделевий |
Md |
II, III |
— |
|
102 |
Нобелий |
No |
II, III |
— |
|
103 |
Лоуренсий |
Lr |
III |
— |
|
Номер |
Элемент |
Символ |
Валентность химических элементов |
Пример |
Поделитесь ссылкой с друзьями:
Похожие таблицы
Комментарии:
Никель в таблице менделеева занимает 28 место, в 4 периоде.
| Символ | Ni |
| Номер | 28 |
| Атомный вес | 58.6934000 |
| Латинское название | Niccolum |
| Русское название | Никель |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема никеля
Ni: 1s2 2s2 2p6 3s2 3p6 4s2 3d8
Короткая запись:
Ni: [Ar]4s2 3d8
Одинаковую электронную конфигурацию имеют
атом никеля и
Mn-3, Fe-2, Co-1, Zn+2, Ga+3, Ge+4, As+5, Se+6, Br+7
Порядок заполнения оболочек атома никеля (Ni) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Никель имеет 28 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
8 электронов на 3d-подуровне
Степень окисления никеля
Атомы никеля в соединениях имеют степени окисления 6, 4, 3, 2, 1, 0, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы никеля
Валентность Ni
Атомы никеля в соединениях проявляют валентность VI, IV, III, II, I.
Валентность никеля характеризует способность атома Ni к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Ni
Квантовые числа определяются последним электроном в конфигурации,
для атома Ni эти числа имеют значение N = 3, L = 2, Ml = 0, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Ni:
Eo = 737 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Ni в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Таблица валентности химических элементов.
Выберите химический элемент
Ниже приводится таблица валентности химических элементов с примерами соединений.
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Таблица валентности химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Валентность | Примеры соединений | Примечание |
| 1 | Водород | H | I | HCl, H2O2 | |
| 2 | Гелий | He | отсутствует | ||
| 3 | Литий | Li | I | LiOH, Li2O | |
| 4 | Бериллий | Be | I, II |
|
|
| 5 | Бор | B | III | B2O3 | |
| 6 | Углерод | C | II, IV |
|
|
| 7 | Азот | N | I, II, III, IV |
|
В азотной кислоте (HNO3) и своем высшем оксиде (N2O5) атом азота образует только четыре ковалентные связи, являясь четырехвалентным |
| 8 | Кислород | O | II | (NO)F, CaO, O2, H2O2,Cl2O, H2O | |
| 9 | Фтор | F | I | HF, (NO)F | |
| 10 | Неон | Ne | отсутствует | ||
| 11 | Натрий | Na | I | Na2S, Na2O | |
| 12 | Магний | Mg | II | Mg(NO3)2 | |
| 13 | Алюминий | Al | III | Al2O3, Al2S3, AlCl3 | |
| 14 | Кремний | Si | II, IV |
|
|
| 15 | Фосфор | P | III, V |
|
|
| 16 | Сера | S | II, IV, VI |
|
|
| 17 | Хлор | Cl | I, III, IV, V, VI, VII |
|
|
| 18 | Аргон | Ar | отсутствует | ||
| 19 | Калий | K | I | KOH, K2O, K2S | |
| 20 | Кальций | Ca | II | Ca(OH)2 | |
| 21 | Скандий | Sc | III | Sc2O3 | |
| 22 | Титан | Ti | II, III, IV |
|
|
| 23 | Ванадий | V | II, III, IV, V |
|
|
| 24 | Хром | Cr | II, III, VI |
|
|
| 25 | Марганец | Mn | II, III, IV, VI, VII |
|
|
| 26 | Железо | Fe | II, III |
|
|
| 27 | Кобальт | Co | II, III |
|
|
| 28 | Никель | Ni | II, III |
|
|
| 29 | Медь | Cu | I, II |
|
|
| 30 | Цинк | Zn | II | ZnSO4, ZnO, ZnS |
Таблица валентности химических элементов (2 часть):
| 31 | Галлий | Ga | I, II, III |
|
|
| 32 | Германий | Ge | II, IV |
|
|
| 33 | Мышьяк | As | III, V |
|
|
| 34 | Селен | Se | II, IV, VI |
|
|
| 35 | Бром | Br | I, III, V, VII |
|
|
| 36 | Криптон | Kr | отсутствует | ||
| 37 | Рубидий | Rb | I | RbOH | |
| 38 | Стронций | Sr | II | SrO | |
| 39 | Иттрий | Y | III | Y(NO3)3 | |
| 40 | Цирконий | Zr | II, III, IV |
|
|
| 41 | Ниобий | Nb | I, II, III, IV, V |
|
|
| 42 | Молибден | Mo | II, III, IV, V, VI |
|
|
| 43 | Технеций | Tc | II, III, IV, V, VI, VII |
|
|
| 44 | Рутений | Ru | II, III, IV, V, VI, VII, VIII |
|
|
| 45 | Родий | Rh | II, III, IV, V, VI |
|
|
| 46 | Палладий | Pd | II, IV |
|
|
| 47 | Серебро | Ag | I, II, III |
|
|
| 48 | Кадмий | Cd | I, II |
|
|
| 49 | Индий | In | I, II, III |
|
|
| 50 | Олово | Sn | II, IV |
|
|
| 51 | Сурьма | Sb | III, V |
|
|
| 52 | Теллур | Te | II, IV, VI |
|
|
| 53 | Йод | I | I, III, V, VII |
|
|
| 54 | Ксенон | Xe | отсутствует | ||
| 55 | Цезий | Cs | I | Cs2O | |
| 56 | Барий | Ba | II | Ba(OH)2 | |
| 57 | Лантан | La | III | La2(SO4)3 | |
| 58 | Церий | Ce | III, IV |
|
|
| 59 | Празеодим | Pr | II, III, IV |
|
|
| 60 | Неодим | Nd | II, III |
|
Таблица валентности химических элементов (3 часть):
| 61 | Прометий | Pm | III | PmBr3 | |
| 62 | Самарий | Sm | II, III |
|
|
| 63 | Европий | Eu | II, III |
|
|
| 64 | Гадолиний | Gd | II, III |
|
|
| 65 | Тербий | Tb | II, III, IV |
|
|
| 66 | Диспрозий | Dy | II, III |
|
|
| 67 | Гольмий | Ho | III | Ho2(SO4)3 | |
| 68 | Эрбий | Er | III | Er2O3 | |
| 69 | Тулий | Tm | II, III |
|
|
| 70 | Иттербий | Yb | II, III |
|
|
| 71 | Лютеций | Lu | III | LuBr3 | |
| 72 | Гафний | Hf | I, II, III, IV |
|
|
| 73 | Тантал | Ta | I, II, III, IV, V |
|
|
| 74 | Вольфрам | W | II, III, IV, V, VI |
|
|
| 75 | Рений | Re | I, II, III, IV, V, VI, VII |
|
|
| 76 | Осмий | Os | I, II, III, IV, V, VI, VII, VIII |
|
|
| 77 | Иридий | Ir | I, II, III, IV, V, VI |
|
|
| 78 | Платина | Pt | II, III, IV, V, VI |
|
|
| 79 | Золото | Au | I, II, III, V |
|
|
| 80 | Ртуть | Hg | I, II |
|
|
| 81 | Таллий | Tl | I, II, III |
|
|
| 82 | Свинец | Pb | II, IV |
|
|
| 83 | Висмут | Bi | III, V |
|
|
| 84 | Полоний | Po | II, IV, VI | ||
| 85 | Астат | At | нет данных | ||
| 86 | Радон | Rn | отсутствует | ||
| 87 | Франций | Fr | I | FrOH | |
| 88 | Радий | Ra | II | Ra(OH)2 | |
| 89 | Актиний | Ac | III | Ac2O3 | |
| 90 | Торий | Th | II, III, IV |
|
|
| 91 | Протактиний | Pa | II, III, IV, V |
|
|
| 92 | Уран | U | III, IV, V, VI | ||
| 93 | Нептуний | Np | III, IV, V, VI, VII | ||
| 94 | Плутоний | Pu | III, IV, V, VI, VII | ||
| 95 | Америций | Am | II, III, IV, V, VI | ||
| 96 | Кюрий | Cm | II, III, IV | ||
| 97 | Берклий | Bk | III, IV | ||
| 98 | Калифорний | Cf | II, III, IV | ||
| 99 | Эйнштейний | Es | II, III | ||
| 100 | Фермий | Fm | II, III |
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Коэффициент востребованности
21 748