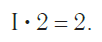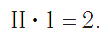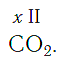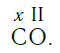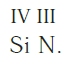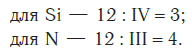Валентность
Слово «валентность» звучит красиво и одновременно загадочно. В этой статье вместе с экспертом разберемся, что скрывается за этим словом: что такое валентность, как ее определить и какова ее роль в химии
Термин «валентность» появился еще в Средние века, где в научных трудах он имел значение «препарат», «экстракт». И только в конце ХIХ столетия его стали использовать для обозначения связей между мельчайшими частицами вещества.
В 1852 году английский химик Э. Франкленд ввел в химию понятие «соединительная сила», которое положило начало учению о валентности. В 1857 году немецкий ученый Ф. А. Кекуле, изучая свойства углерода в метане, пришел к выводу о существовании «основности» атомов – таком же важном и постоянном свойстве, как атомный вес. Спустя три года российский химик А. М. Бутлеров усовершенствовал учение о валентности, распространив его на органические соединения.
Что такое валентность в химии
Валентность – это способность атома образовывать химические связи с другими атомами. Такие связи создаются за счет электронов, расположенных на внешнем электронном слое. Поэтому количественной мерой валентности становится число совместных связей между атомами.
Химические соединения предполагают формирование общих электронных пар. Этот процесс получил наименование «ковалентная химическая связь». В зависимости от числа общих электронных пар выделяют одинарную, двойную и тройную ковалентную связь.
Большим достижением в химии стало наглядное изображение молекул, с помощью которого легко представить себе понятие валентности и ковалентной связи. К примеру, водород имеет сокращенную химическую формулу H₂ и структурную формулу: Н – Н. Во втором случае видно, что водород обладает одновалентностью, поскольку связан в молекуле только с одним своим собратом.
Формула воды H₂O и Н – О – Н наглядно свидетельствует о двухвалентности кислорода, так как он способен создавать две ковалентные связи с атомами водорода.
Углекислый газ CO₂ и О = С = О состоит из двух атомов кислорода и атома углерода, у которого валентность равна четырем. Он может присоединять 2 двухвалентных атома кислорода либо 4 одновалентных атома водорода, как в метане СН₄.
Таблица Менделеева
Рассказываем, как пользоваться таблицей, а также даем советы, как ее быстро выучить
подробнее
Как определить валентность химических элементов
Существуют разные способы определения валентности химических элементов. Самый простой заключается в том, чтобы обратиться к специальной таблице валентности химических элементов.
Другой способ связан с расчетом валентности по химической формуле. За единицу валентности принимается валентность атома водорода, так как он способен образовывать с другими атомами только одну связь. Химические элементы, взаимодействуя с водородом, показывают собственную валентность. Например, в молекуле хлористого водорода (HCl) хлор имеет валентность I. В молекуле аммиака (NН₃) азот соединен с тремя атомами водорода, следовательно, его валентность – III.
Кроме водорода, валентность химических элементов можно определять по кислороду, который во всех своих соединениях двухвалентен. Так, в оксиде серы (IV) SO₂ валентность серы равна IV (валентность кислорода умножаем на 2). А в соединении SO₃ валентность серы уже VI (два умножаем на три).
Когда речь идет о сложных соединениях, где присутствует более двух химических элементов, определить валентность каждого из них становится сложнее. О молекуле HClO₄ можно только сказать, что остаток ClO₄ одновалентен, а в соединении H₂SO₄ остаток SO₄ двухвалентен.
Таблица валентности химических элементов
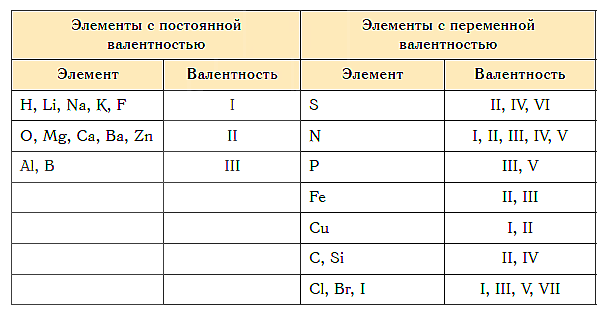
Приведем в качестве примера таблицу валентности наиболее распространенных химических элементов. Звездочкой отмечены элементы с постоянной валентностью.
| Элемент | Валентность | Элемент | Валентность |
|---|---|---|---|
| Водород (H)* | I | Барий (Ba)* | II |
| Натрий (Na)* | I | Кислород (O)* | II |
| Калий (K)* | I | Цинк (Zn) | II |
| Серебро (Ag)* | I | Олово (Sn) | II (IV) |
| Фтор (F)* | I | Свинец (Pb) | II (IV) |
| Хлор (Cl) | I (III, V, VII) | Железо (Fe) | II, III |
| Бром (Br) | I (III, V, VII) | Сера (S) | II, IV, VI |
| Йод (I) | I (III, V, VII) | Марганец (Mn) | II, IV, VII |
| Ртуть (Hg) | I, II | Хром (Cr) | III, VI |
| Медь (Cu) | I, II | Алюминий (Al)* | III |
| Бериллий (Be)* | II | Азот (N) | III (и другие) |
| Магний (Mg)* | II | Фосфор (P) | III, V |
| Кальций (Ca)* | II | Углерод (C) | IV |
| Кремний (Si) | IV (II) | Цирконий (Zr) | II, III, IV |
Популярные вопросы и ответы
Отвечает Анастасия Чистякова, старший методист по естественно-научному направлению Домашней школы «ИнтернетУрок».
Что такое постоянная валентность?
В таблице Менделеева существуют так называемые элементы с постоянной валентностью. Свое название они получили из-за способности образовывать строго определенное количество химических связей. Постоянная валентность чаще всего совпадает с номером группы, где находится элемент. Таких элементов сравнительно немного, поэтому их можно легко запомнить.
Постоянную валентность I (могут присоединять или замещать только один атом другого элемента) имеют щелочные металлы (Li, Na, K, Rb, Cs, Fr) и фтор (F).
Постоянную валентность II (способность присоединить или заместить только два атома других элементов) имеют металлы второй группы, главной подгруппы (Be, Mg, Ca, Sr, Ba, Ra) и кислород (O).
Постоянную валентность III имеет всего лишь один элемент – алюминий (Al), так как только он способен присоединить либо заместить три атома других химических элементов.
Как определить валентность по таблице Менделеева?
Большинство химических элементов обладают переменной валентностью, и ее можно определить по таблице Менделеева. В этой таблице номер группы соответствует высшей валентности элемента. Если от восьми отнять номер группы, где находится элемент, мы узнаем его низшую валентность. Например, высшая валентность серы (S) – 6, так как она находится в шестой группе, а низшая – 2 (8 — 6 = 2).
Правда, бывают и исключения, которые нужно запомнить. Кремний (Si) находится в IV группе, и можно сделать предположение, что его низшая валентность – IV. Однако это не так. Низшая валентность кремния – II. Азот (N) расположен в V группе, но его низшая валентность также II.
Чем валентность отличается от степени окисления?
Понятия «валентность» и «степень окисления» являются близкими по своему значению, но далеко не тождественными. Валентность определяет количество химических связей, которыми атом элемента связан с другими атомами в молекуле. Степень окисления используется для описания тех реакций, которые сопровождаются присоединением либо отдачей электронов.
Валентность нейтральна, а степень окисления может быть положительной, отрицательной или нулевой. Положительная степень окисления соответствует количеству отданных электронов, отрицательная – числу присоединенных. Нулевая степень окисления говорит о том, что данный элемент находится или в состоянии простого вещества, или был восстановлен до нуля после окисления, или окислен до нуля после предшествующего восстановления.
Чаще всего валентность и степень окисления количественно равны, однако бывают и исключения, которые необходимо запомнить. Например, в азотной кислоте (HNO₃) валентность атома N равна IV, а степень окисления +5. В молекуле CO углерод имеет валентность II, а степень окисления +2
Какая валентность может быть у серы?
Таким образом, сера может проявлять валентность IV и VI только в соединениях с более электроотрицательными элементами, чем она сама.
Какая валентность у SO3?
Вы удивитесь, но это и есть правильный ответ: SO3 – это формула оксида серы (VI). Сера здесь имеет валентность VI.
Как определить валентность у серы?
Кроме водорода, валентность химических элементов можно определять по кислороду, который во всех своих соединениях двухвалентен. Так, в оксиде серы (IV) SO₂ валентность серы равна IV (валентность кислорода умножаем на 2). А в соединении SO₃ валентность серы уже VI (два умножаем на три).
Какая валентность у FE?
Обычно образует соединения в степенях окисления +3 (валентность III) и +2 (валентность II). Известны также соединения с атомами железа в степенях окисления +4, +6 и некоторых других. В периодической системе Менделеева железо входит в группу VIIIВ.
Какие валентности у селена?
| Селен | |
|---|---|
| Электродный потенциал | 0 |
| Степени окисления | −2, 0, +4, +6 |
| Энергия ионизации (первый электрон) | 940,4 (9,75) кДж/моль (эВ) |
| Термодинамические свойства простого вещества |
Почему сера может проявлять степень окисления 0 2 4 6?
На внешнем слое атома серы содержатся шесть валентных электронов. До завершения внешнего слоя не хватает двух электронов. Поэтому в соединениях с металлами и водородом сера проявляет степень окисления –2.
Чему равна валентность серы в соединении SO3?
В молекуле SO3 сера связана с тремя двухвалентными атомами кислорода, поэтому в молекуле SO3 сера шестивалентна.
Какую валентность проявляет азот в аммиаке?
В составе аммиака атом азота проявляет валентность III.
Как определить валентность по формуле?
2. Определение валентности по формуле. Составление формулы по валентностям элементов
- Записываем известную валентность кислорода над формулой. Неизвестную валентность обозначаем буквой x: Cl x 2 O II 7 .
- Находим сумму единиц валентности каждого элемента. Для этого его валентность умножаем на число атомов: …
- Вычисляем x:
Какая валентность у марганца?
В периодической системе Д. И. Менделеева марганец входит в группу VIIВ, к которой относятся также технеций и рений, и располагается в 4-м периоде. Образует соединения в степенях окисления от +2 (валентность II) до +7 (валентность VII), наиболее устойчивы степени окисления +2 и +7.
Сколько валентных электронов у FE?
Внешние орбитали атома железа – все орбитали с n = 4, а внешние подуровни – все подуровни, образуемые этими орбиталями, то есть 4s-, 4p-, 4d- и 4f-ЭПУ. Внешние электроны – всегда валентные, следовательно, 4s-электроны атома железа – валентные электроны.
Чему равна валентность водорода?
Молекулярная формула показывает, сколько атомов каждого элемента входит в состав молекулы вещества.
| Элемент | Валентность |
|---|---|
| * Водород (H) | I |
| * Натрий (Na) | I |
| * Калий (K) | I |
| * Серебро (Ag) | I |
Какие валентности у серебра?
| Серебро | |
|---|---|
| Электродный потенциал | +0,799 |
| Степени окисления | +1, +2 |
| Энергия ионизации | 1‑я: 730,5 кДж/моль (эВ) 2‑я: 2070 кДж/моль (эВ) 3‑я: 3361 кДж/моль (эВ) |
| Термодинамические свойства простого вещества |
Почему сера может проявлять степень окисления?
На внешнем слое атома серы содержатся шесть валентных электронов. До завершения внешнего слоя не хватает двух электронов. Поэтому в соединениях с металлами и водородом сера проявляет степень окисления –2.
Какие степени окисления проявляет сера в своих соединениях?
Список степеней окисления элементов
| H | +1 | |
|---|---|---|
| Al | ||
| Si | +1 | +4 |
| P | +1 | +4 |
| S | +1 | +4 |
Какая валентность у P2O5?
1)Формула ондного из оксидов фосфора P2O5. Валентность фосфора в этом соединение равна:2,3,4,5,2) Установите…
Какую валентность может проявлять хлор?
Химические свойства Также известны соединения хлора, в которых атом хлора формально проявляет валентности IV и VI, например, ClO2 и Cl2O6. Однако оксид хлора(IV) является стабильным радикалом, то есть имеет неспаренный электрон, а оксид хлора(VI) содержит два атома хлора, имеющих степени окисления +5 и +7.
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
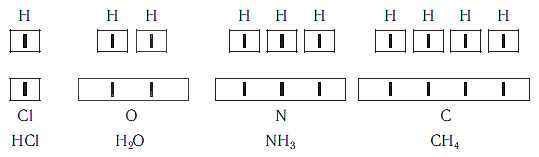
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
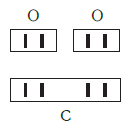
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Содержание
- Определение валентности
- Постоянная и переменная валентность
- Составление химических формул по валентности
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
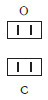
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х·1 = II·2, откуда х = IV.
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II, так как х·1 = II·1, откуда х = II:
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV, а азота — III.
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 (IV·III).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.