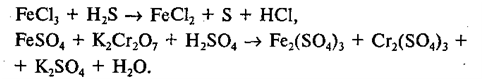Железо (Fe) — это один из наиболее распространенных химических элементов. Соединения железа массово используются в химической промышленности, народном хозяйстве. Сплавы железа с другими элементами стали основой большинства строительных материалов или деталей автомобилей и другой техники.
Но о применении железа поговорим позже. Сначала обозначим характеристики этого необыкновенного элемента.
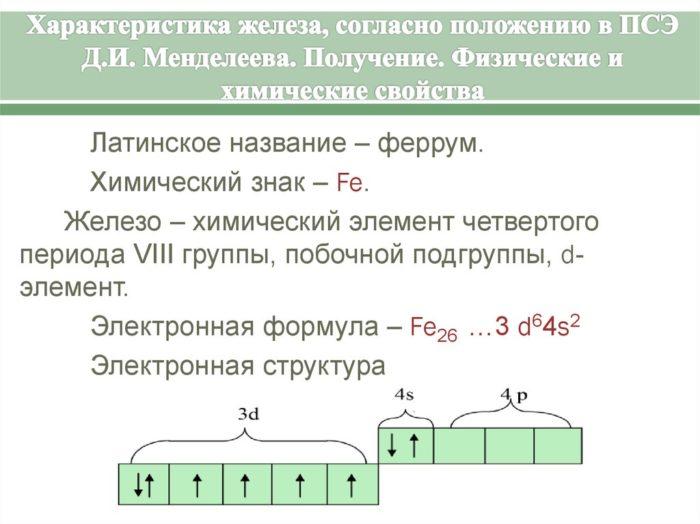
Fe — строение, признаки, расположение в таблице Менделеева
Железо (Fe) — элемент 8б группы 4 периода. Порядковый номер в периодической системе — 26. Отметим, что кобальт (Co) и никель (Ni), входящие в 8б группу таблицы Менделеева, включены в семейство железа. Строение электронной оболочки атома Fe таково:
1s22s22p63s23p63d64s2
Электронное строение атома данного элемента обусловливает характерные степени окисления: +2 и + 3. Железо также может находиться в степени +6. О некоторых исключениях и интересных веществах, где этот элемент проявляет необычные свойства, поговорим чуть позже.
Рис. 1. Характеристика железа
Свойства Fe
Перед тем, как начать ознакомление со всеми соединениями железа, необходимо иметь представление о его физических и химических свойствах. Нельзя сказать, чтобы химические способности данного элемента выделялись среди ему подобных, но физические свойства обусловливают его ценность и уникальность.
Важно! Этот химический элемент в немалом количестве содержится в горах. Огромные залежи располагаются на Урале, в Сибири и других регионах России. Богаты железными рудами Украина, Прибалтика и т.д.
Физические свойства
Железо — ковкий и довольно прочный металл серебристо-белого цвета. На воздухе поддается коррозии с появлением желто-оранжевого налета — ржавчины. В чистом кислороде железо горит, а в обычных условиях кристаллизуется. Если брать только чистое железо, то оно является мягким и пластичным.
Химические свойства
Fe является химически активным элементом и чаще всего играет роль восстановителя. Итак, рассмотрим основные химические взаимодействия различных веществ с данным элементом:
- Железо с легкостью вступает в реакции с соляной и разбавленной серной кислотами, образуя на выходе водород и соответствующие соли.
- Также взаимодействует с концентрированной серной кислотой, но по иному механизму. Здесь происходит образование кислотного оксида, соли и воды.
- Удачно реагирует с разбавленной азотной кислотой, а в аналогичной кислоте высокой концентрации железо пассивируется. Оксидная пленка покрывает поверхность металла, вследствие чего замедляется процесс коррозии.
Теперь перейдем к детальному изучению способностей соединений железа.
Соединения Fe (+2)
Начнем с тех веществ, где железо проявляет наименьшую окислительную степень после нуля — + 2. Данную степень этот химический элемент способен проявлять в различных бинарных соединениях, а также в сложных и комплексных солях.
Оксид железа II — FeO
Получить его возможно, если восстанавливать с помощью водорода оксид железа III. В целом FeO можно считать амфотерным оксидом, но в нем больше преобладают основные свойства. Представляет собой черный порошок, который невозможно растворить в воде. Ценится за свое быстрое окисление и восстановление до изначального вещества.
Гидроксид железа II — Fe(OH)2
Данный гидроксид также имеет основный характер и легко растворяется в кислотах. Это соединение является белым осадком, получаемым при взаимодействиях солей железа и щелочей. Такие реакции должны проходить в бескислородной среде, иначе может образоваться другой гидроксид, о котором будем говорить далее. Fe(OH)2 способен к активному окислению на воздухе с получением соединений, где Fe находится в степени окисления +3.
Соли Fe (+2): FeSO4, FeCl2
Соли данного элемента можно получить путем большого количества реакций. Большинство из них будут иметь светло-зеленоватую окраску в растворах. Превращаются в соли железа III, окисляясь на воздухе. При этом они имеют коричнево-бурую окраску. Также благодаря солям можно получить оксиды и гидроксиды, содержащие Fe.
Соль Мора — FeSO4*(NH4)2SO4*6H2O
Это вещество широко распространено в фармацевтике и медицине. Применяется для поставки недостающего железа в организм человека. Также противодействует гниению в дереве и деревянных изделиях. Участвует в обнаружении соединений хрома и ванадия.
Соединения Fe (+3)
Крупная группа веществ, в которой содержится трехвалентное железо. Эти соединения отличаются по своим свойствам по сравнению с предыдущими. Рассмотрим их подробнее.
Оксид железа III — Fe2O3
Проявляет амфотерные качества, соответственно — реагирует с кислотами и щелочами, образуя при этом средние, комплексные и другие соли. В обычных условиях является кристаллическим порошком коричнево-красного цвета, нерастворимым в воде.
Гидроксид железа III — Fe(OH)3
Так же, как и соответствующий ему оксид, проявляет амфотерные свойства. Имеет темно-коричневый цвет. Получают вещество в ходе реакций щелочей с солями трехвалентного железа. В результате образуется бурый, темноватый осадок — Fe(OH)3. Если это основание прокалить, то получим Fe2O3.
Соли Fe (+3): FeCl3, Fe2(SO4)3
Растворы солей трехвалентного железа имеют желтый окрас и являются слабыми окислителями. При воздействии восстановителей переходят в те вещества, где железо имеет степень окисления +2.
Важно! Солей данного типа открыто достаточно много, и все они используются в промышленных, медицинских отраслях, а также в повседневной жизни.
Соединения Fe (+2, +3)
В некоторых веществах этот химический элемент имеет целых две степени окисления. Подробнее изучим сами соединения и их свойства.
Оксид железа II, III — Fe3O4, железная окалина.
Данное вещество является смесью двух оксидов железа: II и III. Железо не может быть в степени +4, поэтому такое соединение записывается как: FeO*Fe2O3. Получают данный оксид путем взаимодействия железа с водой и кислородом, которое проходит при наличии высокой температуры.
Турнбулева синь или берлинская лазурь — KFe{Fe(CN)6}
Это необычное соединение является осадком темного и чуть синеватого цвета, получаемым в ходе реакции между FeSO4 и красной кровяной солью. Здесь один атом Fe имеет степень окисления +2, а другой — +3. Чтобы обнаружить ионы трехвалентного железа, применяют желтую кровяную соль K4{Fe(CN)6}.
Рис. 2. Железо и его соединения
Соединения Fe (+6)
Химические вещества, где окислительная степень железа равна +6, называются ферратами.
Ферраты: K2FeO4, Na2FeO4
Ферраты являются мощными восстановителями и сходными по всем остальным способностям. Немаловажным является наличие в них бактерицидных способностей. Это обусловливает их ценность в качестве средств, обеззараживающих воду в крупных количествах.
Органические вещества, содержащие Fe
Железо и его свойства крайне важны и полезны в повседневной жизни людей, хозяйственной и промышленной деятельности. Но еще соединения железа выполняют значимые функции в теле человека. Чаще всего биологическую роль выполняют именно органические вещества, содержащие Fe. Пожалуй, самым важным веществом в теле человека, содержащим железо, является гемоглобин. Гемоглобин является белком, который осуществляет транспортировку кислорода по крови и обеспечивает постоянный газообмен. Fe входит в состав многих ферментов и белков нашего тела. Этот элемент также влияет и на наш иммунитет. Не зря при нехватке железа человек чувствует себя уставшим и сонным. При снижении концентрации Fe повышается вероятность заражения инфекционными заболеваниями. Поэтому важно следить за тем, чтобы в рационе было достаточно продуктов, содержащих железо — бобы, крупы, орехи, сухофрукты, морская капуста.
Применение Fe и его соединений
В конце стоит сказать и о неизмеримом вкладе Fe в современную жизнь и ее сферы. В статье уже встречались строки об использовании железа в различных областях, но разберемся в этом вопросе подробнее:
- Вещества, включающие в себя Fe, широко применяются в хозяйственной деятельности. Повсеместно в качестве строительных материалов используются сплавы железа — чугун, стали и т.д. Ковкость и прочность делают Fe незаменимой деталью в громоздких и массивных сооружениях.
- Часто этот элемент применяют и в химической промышленности. Железо играет роль катализатора во многих реакциях органического и неорганического синтеза. Пириты (соединения железа и серы) применяют для выделения серы и ее производных.
- С помощью Fe2O3 производят краски, цемент, материалы, обладающие магнитными свойствами.
- Железный купорос используется в качестве защиты урожая от вредных насекомых, также он нашел применение и в гальванотехнике.
Итак, мы рассказали об основных соединениях железа, их свойствах, характеристиках, способах получения и областях применения. Стоит отметить, что данный элемент заметно выделяется на фоне остальных, рядом своих качеств и способностей. Как мы выяснили, он является незаменимым для жизни человека, значит, необходимо иметь представление о его строении, физических и химических свойствах. Для закрепления изученного материала рекомендуем пройти тест и посмотреть видео с интересными фактами.
Но о применении железа поговорим позже. Сначала обозначим характеристики этого необыкновенного элемента.
Fe — строение, признаки, расположение в таблице Менделеева
Железо (Fe) — элемент 8б группы 4 периода. Порядковый номер в периодической системе — 26. Отметим, что кобальт (Co) и никель (Ni), входящие в 8б группу таблицы Менделеева, включены в семейство железа. Строение электронной оболочки атома Fe таково:
1s22s22p63s23p63d64s2
Электронное строение атома данного элемента обусловливает характерные степени окисления: +2 и + 3. Железо также может находиться в степени +6. О некоторых исключениях и интересных веществах, где этот элемент проявляет необычные свойства, поговорим чуть позже.
Свойства Fe
Перед тем, как начать ознакомление со всеми соединениями железа, необходимо иметь представление о его физических и химических свойствах. Нельзя сказать, чтобы химические способности данного элемента выделялись среди ему подобных, но физические свойства обусловливают его ценность и уникальность.
Важно! Этот химический элемент в немалом количестве содержится в горах. Огромные залежи располагаются на Урале, в Сибири и других регионах России. Богаты железными рудами Украина, Прибалтика и т.д.
Физические свойства
Железо — ковкий и довольно прочный металл серебристо-белого цвета. На воздухе поддается коррозии с появлением желто-оранжевого налета — ржавчины. В чистом кислороде железо горит, а в обычных условиях кристаллизуется. Если брать только чистое железо, то оно является мягким и пластичным.
Химические свойства
Fe является химически активным элементом и чаще всего играет роль восстановителя. Итак, рассмотрим основные химические взаимодействия различных веществ с данным элементом:
- Реакции с неметаллами. При термическом воздействии вступает в реакции с кислородом, углеродом и галогенами, участвует в гидролизе (с температурой свыше 700 градусов).
- Реакции с солями. Железо вытесняет из солей слабые металлы, то есть те, у которых меньше значение электронного потенциала.
- Реакция с угарным газом. В ходе взаимодействия получаем пентакарбонил железа.
- Реакции с кислотами. Уделим особое внимание:
- Железо с легкостью вступает в реакции с соляной и разбавленной серной кислотами, образуя на выходе водород и соответствующие соли.
- Также взаимодействует с концентрированной серной кислотой, но по иному механизму. Здесь происходит образование кислотного оксида, соли и воды.
- Удачно реагирует с разбавленной азотной кислотой, а в аналогичной кислоте высокой концентрации железо пассивируется. Оксидная пленка покрывает поверхность металла, вследствие чего замедляется процесс коррозии.
Теперь перейдем к детальному изучению способностей соединений железа.
Соединения Fe (+2)
Начнем с тех веществ, где железо проявляет наименьшую окислительную степень после нуля — + 2. Данную степень этот химический элемент способен проявлять в различных бинарных соединениях, а также в сложных и комплексных солях.
Оксид железа II — FeO
Получить его возможно, если восстанавливать с помощью водорода оксид железа III. В целом FeO можно считать амфотерным оксидом, но в нем больше преобладают основные свойства. Представляет собой черный порошок, который невозможно растворить в воде. Ценится за свое быстрое окисление и восстановление до изначального вещества.
Гидроксид железа II — Fe(OH)2
Данный гидроксид также имеет основный характер и легко растворяется в кислотах. Это соединение является белым осадком, получаемым при взаимодействиях солей железа и щелочей. Такие реакции должны проходить в бескислородной среде, иначе может образоваться другой гидроксид, о котором будем говорить далее. Fe(OH)2 способен к активному окислению на воздухе с получением соединений, где Fe находится в степени окисления +3.
Соли Fe (+2): FeSO4, FeCl2
Соли данного элемента можно получить путем большого количества реакций. Большинство из них будут иметь светло-зеленоватую окраску в растворах. Превращаются в соли железа III, окисляясь на воздухе. При этом они имеют коричнево-бурую окраску. Также благодаря солям можно получить оксиды и гидроксиды, содержащие Fe.
Соль Мора — FeSO4*(NH4)2SO4*6H2O
Это вещество широко распространено в фармацевтике и медицине. Применяется для поставки недостающего железа в организм человека. Также противодействует гниению в дереве и деревянных изделиях. Участвует в обнаружении соединений хрома и ванадия.
Соединения Fe (+3)
Крупная группа веществ, в которой содержится трехвалентное железо. Эти соединения отличаются по своим свойствам по сравнению с предыдущими. Рассмотрим их подробнее.
Оксид железа III — Fe2O3
Проявляет амфотерные качества, соответственно — реагирует с кислотами и щелочами, образуя при этом средние, комплексные и другие соли. В обычных условиях является кристаллическим порошком коричнево-красного цвета, нерастворимым в воде.
Гидроксид железа III — Fe(OH)3
Так же, как и соответствующий ему оксид, проявляет амфотерные свойства. Имеет темно-коричневый цвет. Получают вещество в ходе реакций щелочей с солями трехвалентного железа. В результате образуется бурый, темноватый осадок — Fe(OH)3. Если это основание прокалить, то получим Fe2O3.
Соли Fe (+3): FeCl3, Fe2(SO4)3
Растворы солей трехвалентного железа имеют желтый окрас и являются слабыми окислителями. При воздействии восстановителей переходят в те вещества, где железо имеет степень окисления +2.
Важно! Солей данного типа открыто достаточно много, и все они используются в промышленных, медицинских отраслях, а также в повседневной жизни.
Соединения Fe (+2, +3)
В некоторых веществах этот химический элемент имеет целых две степени окисления. Подробнее изучим сами соединения и их свойства.
Оксид железа II, III — Fe3O4, железная окалина.
Данное вещество является смесью двух оксидов железа: II и III. Железо не может быть в степени +4, поэтому такое соединение записывается как: FeO*Fe2O3. Получают данный оксид путем взаимодействия железа с водой и кислородом, которое проходит при наличии высокой температуры.
Турнбулева синь или берлинская лазурь — KFe{Fe(CN)6}
Это необычное соединение является осадком темного и чуть синеватого цвета, получаемым в ходе реакции между FeSO4 и красной кровяной солью. Здесь один атом Fe имеет степень окисления +2, а другой — +3. Чтобы обнаружить ионы трехвалентного железа, применяют желтую кровяную соль K4{Fe(CN)6}.
Соединения Fe (+6)
Химические вещества, где окислительная степень железа равна +6, называются ферратами.
Ферраты: K2FeO4, Na2FeO4
Ферраты являются мощными восстановителями и сходными по всем остальным способностям. Немаловажным является наличие в них бактерицидных способностей. Это обусловливает их ценность в качестве средств, обеззараживающих воду в крупных количествах.
Органические вещества, содержащие Fe
Железо и его свойства крайне важны и полезны в повседневной жизни людей, хозяйственной и промышленной деятельности. Но еще соединения железа выполняют значимые функции в теле человека. Чаще всего биологическую роль выполняют именно органические вещества, содержащие Fe. Пожалуй, самым важным веществом в теле человека, содержащим железо, является гемоглобин. Гемоглобин является белком, который осуществляет транспортировку кислорода по крови и обеспечивает постоянный газообмен. Fe входит в состав многих ферментов и белков нашего тела. Этот элемент также влияет и на наш иммунитет. Не зря при нехватке железа человек чувствует себя уставшим и сонным. При снижении концентрации Fe повышается вероятность заражения инфекционными заболеваниями. Поэтому важно следить за тем, чтобы в рационе было достаточно продуктов, содержащих железо — бобы, крупы, орехи, сухофрукты, морская капуста.
Применение Fe и его соединений
В конце стоит сказать и о неизмеримом вкладе Fe в современную жизнь и ее сферы. В статье уже встречались строки об использовании железа в различных областях, но разберемся в этом вопросе подробнее:
- Вещества, включающие в себя Fe, широко применяются в хозяйственной деятельности. Повсеместно в качестве строительных материалов используются сплавы железа — чугун, стали и т.д. Ковкость и прочность делают Fe незаменимой деталью в громоздких и массивных сооружениях.
- Часто этот элемент применяют и в химической промышленности. Железо играет роль катализатора во многих реакциях органического и неорганического синтеза. Пириты (соединения железа и серы) применяют для выделения серы и ее производных.
- С помощью Fe2O3 производят краски, цемент, материалы, обладающие магнитными свойствами.
- Железный купорос используется в качестве защиты урожая от вредных насекомых, также он нашел применение и в гальванотехнике.
Итак, мы рассказали об основных соединениях железа, их свойствах, характеристиках, способах получения и областях применения. Стоит отметить, что данный элемент заметно выделяется на фоне остальных, рядом своих качеств и способностей. Как мы выяснили, он является незаменимым для жизни человека, значит, необходимо иметь представление о его строении, физических и химических свойствах. Для закрепления изученного материала рекомендуем пройти тест и посмотреть видео с интересными фактами.
Трудно переоценить роль железа для человеческого организма, ведь именно оно способствует «творению» крови, его содержание влияет на уровень гемоглобина и миоглобина, железо нормализует работу ферментной системы. Но что это за элемент с точки зрения химии? Какая валентность железа? Об этом будет рассказано в данной статье.
Немного истории
Человечество знало об этом химическом элементе и даже владело изделиями из него еще в IV веке до нашей эры. Это были народы Древнего Египта и Шумеры. Именно они первые начали изготавливать украшения, оружие из сплава железа и никеля, которые были найдены при археологических раскопках и тщательно исследованы химиками.
Немного позже, племена арийцев, переселившиеся в Азию, научилось добывать твердое железо из руды. Оно было настолько ценным для людей того времени, что изделия покрывали золотом!
Характеристика железа
Железо (Fe) стоит на четвертом месте по содержанию его в недрах земной коры. Оно занимает место в 7 группе 4 периода и имеет номер 26 в химической таблице элементов Менделеева. Валентность железа имеет прямую зависимость от своего положения в таблице. Но об этом позже.
Данный металл наиболее всего распространен в природе в виде руды, встречается в воде как минерал, а также в различных соединениях.
Наибольшее количество запасов железа в виде руды, находится в России, Австралии, Украине, Бразилии, США, Индии, Канаде.
Физические свойства
Прежде чем переходить к валентности железа, необходимо подробнее рассмотреть его физические свойства, так сказать, приглядеться к нему поближе.
Этот металл имеет серебристый цвет, достаточно пластичный, но способен к увеличению твердости путем его взаимодействия с другими элементами (например, с углеродом). Также он обладает магнитными свойствами.
Во влажной среде железо может корродировать, то есть ржаветь. Хотя абсолютно чистый металл устойчивее к влаге, но если в нем есть примеси, именно они провоцируют коррозию.
Железо хорошо взаимодействует с кислотной средой, даже может образовывать соли железной кислоты (при условии сильного окислителя).
В воздушной среде быстро покрывается оксидной пленкой, которая защищает его от взаимодействий.
Химические свойства
Также этот элемент обладает рядом химических свойств. Железо, как и остальные элементы таблицы Менделеева, имеет заряд атомного ядра, который соответствует порядковому номеру +26. А возле ядра вращается 26 электронов.
А вообще, если рассматривать свойства железа – химического элемента, то он является металлом с невысокой активной способностью.
Взаимодействуя с окислителями более слабыми, железо образует соединения, где оно двухвалентно (то есть его степень окисления +2). А если с сильными окислителями, то степень окисления железа достигает +3 (то есть валентность его становится равной 3).
При взаимодействии с химическими элементами, которые не являются металлами, Fe выступает по отношению к ним восстановителем, при этом степень окисления его становиться, кроме +2 и +3, даже +4, +5, +6. Такие соединения имеют очень сильные окислительные свойства.
Как уже отмечалось выше, железо в воздушной среде покрывается оксидной пленкой. А при нагревании скорость реакции повышается и может образоваться оксид железа с валентностью 2 (температура менее 570 градусов по Цельсию) или оксид с валентностью 3 (температурный показатель более 570 градусов).
Взаимодействие Fe с галогенами, приводит к образованию солей. Элементы фтор и хлор окисляют его до +3. Бром же – до +2 или +3 (все зависит от того, какие условия осуществления химического превращения при взаимодействии с железом).
Вступая во взаимодействия с йодом, элемент окисляется до +2.
Нагревая железо и серу, получается сульфид железа с валентностью 2.
Если феррум расплавить и соединить его с углеродом, фосфором, кремнием, бором, азотом, то получатся соединения называемые сплавами.
Железо является металлом, поэтому оно вступает во взаимодействие и с кислотами (об этом кратко также говорилось чуть выше). Например, кислоты серная и азотная, имеющие высокую концентрацию, в среде с пониженной температурой, на железо не оказывают воздействия. Но стоит ей повысится, как происходит реакция, в результате которой железо окисляется до +3.
Чем выше концентрация кислоты, тем большую температуру необходимо дать.
Нагревая 2-х валентное железо в воде, получим его оксид и водород.
Также Fe обладает способностью вытеснять из водных растворов солей металлы, которые имеют пониженную активность. При этом он окисляется до +2.
При повышении температуры, железо восстанавливает металлы из оксидов.
Что такое валентность
Уже в предыдущем разделе немного встречалось понятие валентности, а также степени окисления. Пришло время рассмотреть валентность железа.
Но для начала необходимо понять, что это вообще за такое свойство химических элементов.
Химические вещества почти всегда постоянны в своем составе. Например, в формуле воды Н2О – 1 атом кислорода и 2 атома водорода. То же самое и с другими соединениями, в которых задействованы два химических элемента, один из которых водород: к 1 атому химического элемента может добавиться 1-4 атома водорода. Но никак не наоборот! А потому, видно, что водород присоединяет к себе всего 1 атом другого вещества. И именно это явление называют валентностью – способностью атомов химического элемента присоединять конкретное количество атомов других элементов.
Значение валентности и графическая формула
Есть элементы таблицы Менделеева, которые обладают постоянной валентностью – это кислород и водород.
А есть такие химические элементы, у которых она изменяется. Например, железо чаще 2-х и 3-х валентно, сера 2, 4, 6-ти, углерод 2 и 4-х. Это элементы с переменной валентностью.
Далее, понимая, что такое валентность, можно правильно написать графическую формулу соединений. Она отображает последовательность соединения атомов в молекуле.
Также, зная валентность одного из элементов в соединении, можно определить валентность другого.
Валентность железа
Как было отмечено, железо относится к элементам с переменной валентностью. И она может колебаться не только между показателями 2 и 3, но и достигать 4, 5 и даже 6.
Конечно, более подробно изучает валентность железа неорганическая химия. Рассмотрим этот механизм кратко на уровне простейших частиц.
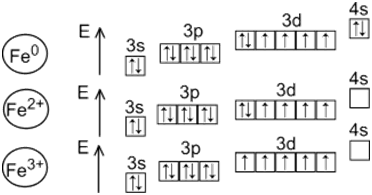
Железо является д-элементом, к которому причисляется еще 31 элемент таблицы Менделеева (это 4-7 периоды). С возрастанием порядкового номера, свойства д-элементов приобретают небольшие изменения. Атомный радиус у этих веществ также медленно возрастает. Они обладают переменной валентностью, которая зависит от того, что предвнешний д-электронный подуровень является незавершенным.
Потому для железа валентными есть не только с-электроны, находящиеся во внешнем слое, но и неспаренные 3д-электроны предвнешнего слоя. И, как следствие, валентность Fe в химических соединениях может равнятся 2, 3, 4, 5, 6. В основном, она равна 2 и 3 – это более устойчивые соединения железа с другими веществами. В менее устойчивых — он проявляет валентность 4, 5, 6. Но, такие соединения встречаются реже.
Двухвалентный феррум
При взаимодействии 2 валентного железа с водой получается оксид железа (2). Такое соединение обладает черным цветом. Достаточно легко взаимодействует с соляной (малой концентрации) и азотной (высокой концентрации) кислотами.
Если такому оксиду 2-х валентного железа провзаимодействовать или с водородом (температура 350 градусов по Цельсию), или с углеродом (коксом) при 1000 градусов, то оно восстанавливается до чистого состояния.
Добывают оксид железа 2-х валентного такими способами:
- через соединение оксида 3-х валентного железа с угарным газом;
- при нагревании чистого Fe, при этом низкое давление кислорода;
- при раскладывании оксалата 2-х валентного железа в вакуумной среде;
- при взаимодействии чистого железа с его оксидами, температура при этом 900-1000 градусов по Цельсию.
Что касается природной среды, то оксид железа 2-х валентного, присутствует в виде минерала вюстита.
Есть еще способ, как в растворе определить валентность железа – в данном случае, имеющего ее показатель 2. Необходимо провести реакции с красной солью (гексацианоферрат калия) и с щелочью. В первом случае наблюдается получение осадка темно-синего цвета – комплексной соли железа 2-х валентного. Во втором – получение темного серо-зеленого осадка – гидроксида железа также 2-х валентного, в то время, как гидроксид железа 3-х валентного имеет цвет в растворе темно-бурый.
Трехвалентное железо
Оксид 3-х валентного феррума имеет порошкообразную структуру, цвет которой красно-коричневый. Имеет также наименования: окись железа, железный сурик, красный пигмент, пищевой краситель, крокус.
В природе это вещество встречается в виде минерала – гематита.
Оксид такого железа с водой уже не взаимодействует. Но соединяется с кислотами и щелочами.
Применяется оксид железа (3) для окрашивания материалов, применяемых в строительстве:
- кирпичей;
- цемента;
- керамических изделий;
- бетона;
- тротуарной плитки;
- напольных покрытий (линолеум).
Железо в организме человека
Как отмечалось в начале статьи, вещество железо является важной составляющей человеческого организма.
Когда этого элемента является недостаточно, то могут возникнуть следующие последствия:
- повышенная усталость и чувствительность к холоду;
- сухость кожи;
- снижение мозговой деятельности;
- ухудшение прочности ногтевой пластины;
- головокружение;
- проблемы с пищеварением;
- седина и выпадение волос.
Накапливается железо, как правило, в селезенке и печени, а также почках и поджелудочной железе.
В рационе человека должны быть продукты, содержащие железо:
- говяжья печень;
- гречневая каша;
- арахис;
- фисташки;
- зеленый горошек консервированный;
- сушенные белые грибы;
- куриные яйца;
- шпинат;
- кизил;
- яблоки;
- груши;
- персики;
- свекла;
- морепродукты.
Недостаток железа в крови, приводит к снижению гемоглобина и развитию такого заболевания, как железодефицитная анемия.
Валентность железа
Общие сведения о валентности железа
В виде простого вещества железо – серебристо-белый металл. Плотность равна 7,87 г/см3. Температура плавления 1539oС, кипения 3200oС. Железо имеет несколько модификаций. До 769oС устойчиво α-железо с объемно центрированной кубической решеткой и ферромагнитными свойствами. При 769oС осуществляется переход в β-железо (кристаллическая структура та же, парамагнетик). При 910oС образуется γ-железо с гранецентрированной кристаллической решеткой. Парамагнитные свойства. При 1400oС и до температуры плавления – δ- железо с объемно центрированной кубической решеткой.
Валентность железа в соединениях
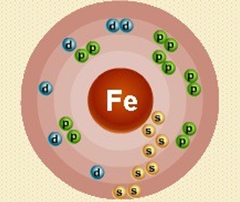
Железо – двадцать шестой по счету элемент Периодической таблицы Д.И. Менделеева. Оно находится в четвертом периоде в VIIIВ группе. В ядре атома железа содержится 26 протонов и 30 нейтронов (массовое число равно 56). В атоме железа есть четыре энергетических уровня, на которых находятся 26 электронов (рис. 1).
Рис. 1. Строение атома железа.
Электронная формула атома железа в основном состоянии имеет следующий вид:
1s22s22p63s23p63d64s2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
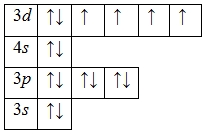
Железо проявляет в своих соединениях валентности II (FeO, Fe(OH)2, FeCl2, FeBr2) и III (Fe2O3, Fe(OH)3, FeCl3, Fe2S3).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
7.6.
Железо и его соединения
Железо – химический элемент четвертого периода и побочной подгруппы
VIII группы периодической системы. Атом железа содержит восемь валентных
электронов, однако в соединениях железо обычно проявляет степени окисления (+2)
и (+3), редко – (+6). Имеются сообщения о получении соединений восьмивалентного
железа.
Степень
окисления +3 для железа является наиболее устойчивой. Соединения железа(III)
могут быть восстановлены только под действием сильных восстановителей, таких как
водород в момент выделения, сероводород. Эти реакции проводят в кислой среде:
Fe2(SO4)3+H2S=2FeSO4+S+H2SO4
Железо
широко распространено в природе – это самый распространенный металл, после
алюминия. Существует гипотеза о том, что внутреннее ядро Земли – целиком
состоит из железа с примесью никеля и серы, а возможно и других
элементов.
В природе
железо встречается в
виде руд — оксидов Fe2O3 (гематит,
красный железняк) и Fe3O4 (магнетит, магнитный
железняк), гидратированного оксида Fe2O3⋅H2O
(лимонит, бурый железняк), карбоната FeCO3 (сидерит),
дисульфида FeS2 (пирит), редко встречается в виде самородков,
попадающих на землю с метеоритами. Такое метеоритное железо было известно людям
издревле. Освоение получения железа из железной руды послужило началом
железного века.
ПОЛУЧЕНИЕ ЖЕЛЕЗА
В настоящее
время железную руду восстанавливают коксом в доменных печах, при этом
расплавленное железо частично реагирует с углеродом, образуя карбид железа Fe3C
(цементит), а частично растворяет его. При затвердевании расплава образуется
чугун. Чугун, используемый для получения стали, называют передельным.
Запомнить! Сталь, в отличие от чугуна, содержит меньшее количество углерода.
При
получении стали, лишний углерод, содержащийся в чугуне, необходимо выжечь.
Этого добиваются, пропуская над расплавленным чугуном воздух, обогащенный
кислородом. Существует и прямой метод получения железа, основанный на
восстановлении окатышей магнитного железняка природным газом:
Fe3O4 +
CH4 = 3Fe + CO2 + 2H2O
ФИЗИЧЕСКИЕ
СВОЙСТВА
Железо –
серебристо-белый, ковкий и пластичный тугоплавкий (т. пл. 1535°C, т. кип.
2870°C) металл, при температурах ниже 769°C притягивается магнитом, то есть
обладает ферромагнетизмом. Ферромагнитные свойства вызваны наличием в
структуре металла отдельных зон – доменов, магнитные моменты которых под
действием внешнего магнитного поля ориентируются в одну и ту же сторону.
Железо существует в форме нескольких полиморфных (аллотропных) модификаций.
При температурах ниже 9100C устойчиво железо с объемно-центрированной
кристаллической решеткой (αα-Fe, немагнитное α-железо существующее
при 769–9100C называют β-Fe), в интервале
температур 910–14000C – более плотная модификация с кубической
гранецентрированной (γγ-Fe), а выше этой температуры и вплоть до температуры
плавления вновь становится устойчивой структура с объемно-центрированной
ячейкой (δ-Fe).
ХИМИЧЕСКИЕ СВОЙСТВА ЖЕЛЕЗА
Запомнить!
·
Степень
окисления +2 железо проявляет при взаимодействии со
слабыми окислителями: серой, йодом, соляной кислотой, растворами
солей.
·
Степень
окисления +3 железо проявляет при взаимодействии с
сильными окислителями: хлором, бромом.
·
Смешанную
степень окисления железо проявляет при взаимодействии с кислородом,
водяным паром.
1) с кислотами. На влажном воздухе окисляется, покрываясь
коричневой коркой гидратированного оксида Fe2O3⋅H2O,
ржавчины. Железо легко растворяется в разбавленных кислотах:
Fe + 2HCl = FeCl2 + H2
но пассивируется в холодных концентрированных
растворах кислот-окислителях – серной и азотной.
2) с солями.Будучи металлом средней химической активности, железо
вытесняет другие, менее активные металлы из растворов их солей:
Fe + CuSO4= FeSO4 + Cu
При этом, как и при растворении в кислотах, образуются
соли двухвалентного железа.
3) с парами воды.При температуре белого каления железо реагирует с
водой. Пропуская перегретый водяной пар через раскаленный на жаровне
чугунный пушечный ствол, Лавуазье получил водород:
3Fe + 4H2O = Fe3O4 +
4H2.
4) с кислородом.В кислороде железо сгорает с образованием черyого
порошка железной окалины – оксида железа(II, III) Fe3O4,имеющей
тот же состав, что и природный минерал магнитный железняк:
3Fe + 2O2 = Fe3O4
Искры, вырывающиеся при заточке стальных ножей или при
резке стальных листов ацетилено-кислородным пламенем, также представляют собой
раскаленные куски железной окалины.
5) с неметаллами. Степень окисления железа в
образующихся соединениях зависит от силы окислителя — неметалла. Так, при
взаимодействии с хлором образуется хлорид FeCl3:
2Fe + 3Cl2 = 2FeCl3,
с
серой – сульфид FeS:
Fe + S = FeS.
Соединения железа(II)
Запомнить! Оксид и
гидроксид железа(II) обладают основными свойствами.
Соединения железа(II) являются сильными восстановителями
и на воздухе легко окисляются до соединений трехвалентного железа:
4FeSO4 +
O2 + 2H2O = 4Fe(OH)SO4.
Белый осадок гидроксида железа(II) Fe(OH)2,
образующийся при действии на соли железа(II) растворов щелочей, на воздухе
мгновенно зеленеет, образуя «зеленую ржавчину» – смешанный гидроксид железа(II)
и железа(III), который лишь через некоторое время приобретает характерный для
Fe2O3⋅H2O ржавый цвет.
Соединения железа(III)
Гидроксид железа(III) выпадает в виде коричневого
осадка при действии растворов щелочей, сульфидов, карбонатов на соли
железа(III):
2FeCl3 +
3Na2CO3 + 6H2O = 2Fe(OH)3 +3CO2+
6NaCl
Запомнить! Оксид и
гидроксид железа(III) являются слабо амфотерными, с преобладанием основных
свойств.
Так, при
растворении гидроксида железа(III) в кислотах образуются соли железа(III), а
при сплавлении оксида с оксидами активных металлов – ферриты (ферраты(+3)):
2Fe(OH)3 +
2H2SO4 = Fe2(SO4)3 +
3H2O,
Fe2O3 + CaO = CaFe2O4.
В концентрированных щелочах Fe(OH)3 медленно
растворяется, образуя гидроксоферраты, например, Na3[Fe(OH)6]:
Fe(OH)3+3NaOHводн.=Na3[Fe(OH)6]
При действии
недостатка кислот они разлагаются в образованием осадка гидроксида железа(III):
Na3[Fe(OH)6]+3HClнед.=3NaCl+Fe(OH)3↓+3H2O
Na3[Fe(OH)6]+6HClизб.=3NaCl+FeCl3+6H2O
При пропускании углекислого газа они разлагаются
на гидроксид железа(III) и карбонат натрия:
2Na3[Fe(OH)6]+3CO2↑=3Na2CO3+2Fe(OH)3↓+3H2O
Запомнить! Соли железа(III) и некоторых слабых кислот, например, сернистой и
угольной не могут быть выделены из водных растворов по причине полного
необратимого гидролиза:
2FeCl3+3Na2S+6H2O=2Fe(OH)3+3H2S↑+6NaCl
О протекании реакции судят по выделению газа и
образованию коричневого осадка гидроксида железа(III).
Окисление Fe(OH)3 бромом в щелочной
среде приводит к образованию вишневых растворов ферратов (+6):
2Fe(OH)3 +
3Br2 + 10KOH = 2K2FeO4 + 6KBr + 8H2O.
Запомнить! Ферраты
содержат железо в степени окисления (+6), и являются сильными окислителями.
Применение железа
В виде
чугуна и стали железо находит широкое применение в народном хозяйстве. Хлорид
железа(III) используется при травлении медных плат, а сульфат железа(III) – в
качестве хлопьеобразователя (коагулянта) при очистке воды. Ферриты
двухвалентных металлов (магния, цинка, кобальта, никеля) со структурой шпинели
применяют в радиоэлектронике, вычислительной технике.
Соли
железа(III) образуют желто-коричневые растворы, цвет которых объясняется
гидролизом, приводящим к образованию коллоидного раствора гидроксида
железа(III). Многие из них, например, хлорид FeCl3×6H2O («хлорное
железо») сильно гигроскопичны, и при хранении в неплотно закрытых склянках,
отсыревают.
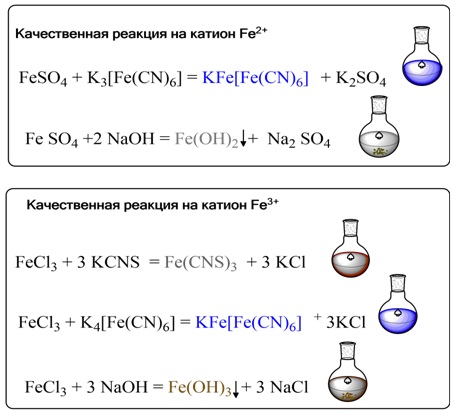
Качественные реакции на катионы
железа
На ионы
железа существуют удобные качественные реакции. Если к раствору соли
железа(III) прибавить разбавленный раствор роданида калия KCNS, то
образуется интенсивно-красное окрашивание, вызванное образованием роданида
железа(III):
FeCl3+3KSCN=Fe(SCN)3+3KCl
Другим
реагентом на ионы железа(III) служит комплексное соединение
гексацианоферрат(II) калия K4[Fe(CN)6], часто называемый также
«желтая кровяная соль». Такое странное на первый взгляд название
связано с тем, что раньше эту соль получали нагреванием крови с поташом и
железными опилками. С солями железа(III) она дает синий коллоидный
раствор «берлинской лазури» или «турнбуллева синь»:
K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓+3KCl
.
Аналогичное синие окрашивание осадка того же состава
можно получить при взаимодействии ионов железа(II) с раствором «красной
кровяной соли» — гексацианоферрат(III) калия K3[Fe(CN)6]:
K3[Fe(CN)6]+FeCl2=KFe[Fe(CN)6]↓+2KCl
Таким
образом, красная кровяная соль служит реактивом на соли двухвалентного железа.
При более высоких концентрациях растворов выделяется нерастворимая в воде форма
«берлинской лазури» состава Fe4[Fe(CN)6]3.
УПРАЖНЕНИЯ
1.
Соль, полученную при растворении железа
в горячей концентрированной серной кислоте, обработали избытком
раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и
прокалили. Полученное вещество сплавили с железом.
Напишите уравнения описанных реакций.
Решение:
Написаны
четыре уравнения описанных реакций:
1) 2Fe
+ 6H2SO4 → Fe2 (SO4)3 + 3SO2↑ +6H2O
2) Fe2
(SO4)3 + 6NaOH → 2Fe(OH)3 ↓ + 3Na2SO4
3) 2Fe(OH)3 → Fe2O3 + 3H2O
4) Fe2O3 + Fe → 3 FeO
_________________________________________________________________
2.
Смесь алюминия и железа обработали
избытком соляной кислоты, при этом выделилось 8,96 л газа (н.у.). Это же
количество смеси обработали избытком раствора гидроксида натрия, выделилось
6,72 л газа (н.у.). Найти массовую долю железа в исходной смеси.
Решение:
1) Составим
уравнения реакций взаимодействия металлов с
кислотой и
щелочью, при этом нужно учесть, что железо не реагирует с
раствором щелочи:
2Al + 6HCl =
2AlCl3+ 3H2 ↑ (1)
2моль 3моль
Fe + 2HCl = FeCl2 +H2↑ (2)
1моль 1моль
2Al + 2NaOH + 6H2O == 2Na[Al(OH)4]
+ 3H2↑ (3)
2моль 3моль
2) Поскольку
со щелочью реагирует только алюминий, то мож-
но найти его
количество вещества:
ν(Н2)
= V/VM = 6,72 (л) / 22,4 (л/моль) = 0,3
моль,
следовательно, ν(Al) =
0,2 моль.
3) Поскольку
для обеих реакций были взяты одинаковые количества смеси, то в реакцию с
соляной
кислотой вступило такое же количество алюминия, как и в реакцию со щелочью,
– 0,2 моль.
По уравнению
(1) находим:
ν(Н2)
= 0,3 моль.
4) Найдем
количество вещества водорода, выделившегося в результате реакции металлов с
кислотой:
νобщ(Н2)
= V / VМ = 8,96 (л) / 22,4
(л/моль) = 0,4 моль.
5) Найдем
количество вещества водорода, выделившегося при взаимодействии железа с
кислотой, и затем количество вещества железа:
ν(Н2)
= νобщ(Н2) – ν(Н2) = 0,4 – 0,3 = 0,1 моль,
ν(Fe) = 0,1
моль.
6) Найдем
массы Al, Fe, массу смеси и массовую долю железа в смеси:
m(Al) = 27 (г/моль) * 0,2 (моль) =
5,4 г,
m(Fe) = 56 (г/моль) * 0,1 (моль) =
5,6 г,
mсмеси(Al, Fe) = 5,4 + 5,6 = 11 г,
ω(Fe) = mв-ва / mсм =
5,6 / 11 = 0,5091 (50,91 %).
Ответ. ω(Fe) = 50,91 %.
_________________________________________________________________
3.
Напишите уравнения
реакций железа с простыми веществами: кислородом, хлором, серой, бромом.
Назовите образующиеся вещества.
Решение:
_________________________________________________________________
4.
Как доказать, что
в одном из двух растворов есть ионы Fe2+, а в другом — ионы Fe3+?
Напишите уравнения протекающих реакций.
Решение:
_________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1.
Изобразите схему строения атома
железа. Укажите степени окисления, которые железо проявляет в соединениях.
2.
Вычислите массовые доли железа в
соединениях: FeO, Fe2O3,
Fe3O4.
В каком из этих соединений массовая доля железа наибольшая.
3.
Как можно получить гидроксид железа
(II) из железа? Напишите
уравнения реакции.
4.
Как можно получить гидроксид железа
(III) из железа?
Напишите уравнения реакции.
5.
Как получить из сульфата железа (II) хлорид железа (II) и нитрат железа (II). Напишите
уравнения реакции.
6.
К раствору смеси хлорида железа (III) и хлорида алюминия добавили избыток раствора
гидроксида натрия. Какое вещество
выпадает в осадок, какие вещества остаются в растворе? Ответ поясните
уравнениями реакций.
7.
Минерал содержит 72,36% железа и
27,64% кислорода. Определите формулу минерала.
8.
Сколько граммов сульфата железа (II) можно получить при
растворении 140 г железа в разбавленной серной кислоте.
9.
Напишите молекулярные и ионные
уравнения реакций следующих превращений:
10.
Методом
электронного баланса составьте уравнения реакций, протекающих по следующим
схемам:
|
1. Укажите последовательность восстановления оксидов |
|
|
а) FeO→Fe3O4→ |
б) Fe3O4→Fe2O3→ FeO→Fe |
|
в) Fe2O3→Fe3O4→ FeO→Fe |
г) Fe3O4→FeO→ Fe2O3→Fe |
|
2. Число неспаренных электронов в основном состоянии |
|
|
а) 2 |
б) 4 |
|
в) 3 |
г) 1 |
|
3. Железо нельзя получить по реакции: |
|
|
а) Fe3O4 + С→ |
б) Fe(OН)3 |
|
в) FeSO4 (p-p) + Zn → |
г) Fe2O3 + H2 → |
|
4. С водными растворами каких веществ реагирует |
|
|
а) хлорид калия |
б) нитрат кальция |
|
в) хлороводород |
г) все ответы верны |
|
5. Гидроксид железа (II) |
|
|
а) оксида железа (II) и воды |
б) все ответы верны |
|
в) сульфата железа (II) и гидроксида натрия |
г) гидроксида железа (III) с влажным воздухом |
|
6. Для превращения магнетита в оксид железа (III) необходимо, чтобы магнетит прореагировал с: |
|
|
а) водородом |
б) кислородом |
|
в) оксидом углерода (II) |
г) коксом |
|
7. В каком из природных соединений железа его |
|
|
а) магнетит |
б) гематит |
|
в) пирит |
г) сидерит |
|
8. В отличие от гидроксида железа (III) гидроксид железа (II) |
|
|
а) соляной кислотой |
б) концентрированным раствором щелочи |
|
в) кислородом во влажном воздухе |
г) разбавленной серной кислотой |
|
9. При обычных условиях как железо, так и алюминий не |
|
|
а) соляной кислотой |
б) сульфатом меди (II) (р-р) |
|
в) все ответы верны |
г) азотной концентрированной кислотой |
|
10. Различить |
|
|
а) лакмуса |
б) нитрата серебра (I) |
|
в) серной кислоты |
г) гидроксида натрия |
Ответы:
|
1 |
в |
|
2 |
б |
|
3 |
б |
|
4 |
в |
|
5 |
в |
|
6 |
б |
|
7 |
а |
|
8 |
в |
|
9 |
г |
|
10 |
г |