Трудно переоценить роль железа для человеческого организма, ведь именно оно способствует «творению» крови, его содержание влияет на уровень гемоглобина и миоглобина, железо нормализует работу ферментной системы. Но что это за элемент с точки зрения химии? Какая валентность железа? Об этом будет рассказано в данной статье.
Немного истории
Человечество знало об этом химическом элементе и даже владело изделиями из него еще в IV веке до нашей эры. Это были народы Древнего Египта и Шумеры. Именно они первые начали изготавливать украшения, оружие из сплава железа и никеля, которые были найдены при археологических раскопках и тщательно исследованы химиками.
Немного позже, племена арийцев, переселившиеся в Азию, научилось добывать твердое железо из руды. Оно было настолько ценным для людей того времени, что изделия покрывали золотом!
Характеристика железа
Железо (Fe) стоит на четвертом месте по содержанию его в недрах земной коры. Оно занимает место в 7 группе 4 периода и имеет номер 26 в химической таблице элементов Менделеева. Валентность железа имеет прямую зависимость от своего положения в таблице. Но об этом позже.
Данный металл наиболее всего распространен в природе в виде руды, встречается в воде как минерал, а также в различных соединениях.
Наибольшее количество запасов железа в виде руды, находится в России, Австралии, Украине, Бразилии, США, Индии, Канаде.
Физические свойства
Прежде чем переходить к валентности железа, необходимо подробнее рассмотреть его физические свойства, так сказать, приглядеться к нему поближе.
Этот металл имеет серебристый цвет, достаточно пластичный, но способен к увеличению твердости путем его взаимодействия с другими элементами (например, с углеродом). Также он обладает магнитными свойствами.
Во влажной среде железо может корродировать, то есть ржаветь. Хотя абсолютно чистый металл устойчивее к влаге, но если в нем есть примеси, именно они провоцируют коррозию.
Железо хорошо взаимодействует с кислотной средой, даже может образовывать соли железной кислоты (при условии сильного окислителя).
В воздушной среде быстро покрывается оксидной пленкой, которая защищает его от взаимодействий.
Химические свойства
Также этот элемент обладает рядом химических свойств. Железо, как и остальные элементы таблицы Менделеева, имеет заряд атомного ядра, который соответствует порядковому номеру +26. А возле ядра вращается 26 электронов.
А вообще, если рассматривать свойства железа – химического элемента, то он является металлом с невысокой активной способностью.
Взаимодействуя с окислителями более слабыми, железо образует соединения, где оно двухвалентно (то есть его степень окисления +2). А если с сильными окислителями, то степень окисления железа достигает +3 (то есть валентность его становится равной 3).
При взаимодействии с химическими элементами, которые не являются металлами, Fe выступает по отношению к ним восстановителем, при этом степень окисления его становиться, кроме +2 и +3, даже +4, +5, +6. Такие соединения имеют очень сильные окислительные свойства.
Как уже отмечалось выше, железо в воздушной среде покрывается оксидной пленкой. А при нагревании скорость реакции повышается и может образоваться оксид железа с валентностью 2 (температура менее 570 градусов по Цельсию) или оксид с валентностью 3 (температурный показатель более 570 градусов).
Взаимодействие Fe с галогенами, приводит к образованию солей. Элементы фтор и хлор окисляют его до +3. Бром же – до +2 или +3 (все зависит от того, какие условия осуществления химического превращения при взаимодействии с железом).
Вступая во взаимодействия с йодом, элемент окисляется до +2.
Нагревая железо и серу, получается сульфид железа с валентностью 2.
Если феррум расплавить и соединить его с углеродом, фосфором, кремнием, бором, азотом, то получатся соединения называемые сплавами.
Железо является металлом, поэтому оно вступает во взаимодействие и с кислотами (об этом кратко также говорилось чуть выше). Например, кислоты серная и азотная, имеющие высокую концентрацию, в среде с пониженной температурой, на железо не оказывают воздействия. Но стоит ей повысится, как происходит реакция, в результате которой железо окисляется до +3.
Чем выше концентрация кислоты, тем большую температуру необходимо дать.
Нагревая 2-х валентное железо в воде, получим его оксид и водород.
Также Fe обладает способностью вытеснять из водных растворов солей металлы, которые имеют пониженную активность. При этом он окисляется до +2.
При повышении температуры, железо восстанавливает металлы из оксидов.
Что такое валентность
Уже в предыдущем разделе немного встречалось понятие валентности, а также степени окисления. Пришло время рассмотреть валентность железа.
Но для начала необходимо понять, что это вообще за такое свойство химических элементов.
Химические вещества почти всегда постоянны в своем составе. Например, в формуле воды Н2О – 1 атом кислорода и 2 атома водорода. То же самое и с другими соединениями, в которых задействованы два химических элемента, один из которых водород: к 1 атому химического элемента может добавиться 1-4 атома водорода. Но никак не наоборот! А потому, видно, что водород присоединяет к себе всего 1 атом другого вещества. И именно это явление называют валентностью – способностью атомов химического элемента присоединять конкретное количество атомов других элементов.
Значение валентности и графическая формула
Есть элементы таблицы Менделеева, которые обладают постоянной валентностью – это кислород и водород.
А есть такие химические элементы, у которых она изменяется. Например, железо чаще 2-х и 3-х валентно, сера 2, 4, 6-ти, углерод 2 и 4-х. Это элементы с переменной валентностью.
Далее, понимая, что такое валентность, можно правильно написать графическую формулу соединений. Она отображает последовательность соединения атомов в молекуле.
Также, зная валентность одного из элементов в соединении, можно определить валентность другого.
Валентность железа
Как было отмечено, железо относится к элементам с переменной валентностью. И она может колебаться не только между показателями 2 и 3, но и достигать 4, 5 и даже 6.
Конечно, более подробно изучает валентность железа неорганическая химия. Рассмотрим этот механизм кратко на уровне простейших частиц.
Железо является д-элементом, к которому причисляется еще 31 элемент таблицы Менделеева (это 4-7 периоды). С возрастанием порядкового номера, свойства д-элементов приобретают небольшие изменения. Атомный радиус у этих веществ также медленно возрастает. Они обладают переменной валентностью, которая зависит от того, что предвнешний д-электронный подуровень является незавершенным.
Потому для железа валентными есть не только с-электроны, находящиеся во внешнем слое, но и неспаренные 3д-электроны предвнешнего слоя. И, как следствие, валентность Fe в химических соединениях может равнятся 2, 3, 4, 5, 6. В основном, она равна 2 и 3 – это более устойчивые соединения железа с другими веществами. В менее устойчивых — он проявляет валентность 4, 5, 6. Но, такие соединения встречаются реже.
Двухвалентный феррум
При взаимодействии 2 валентного железа с водой получается оксид железа (2). Такое соединение обладает черным цветом. Достаточно легко взаимодействует с соляной (малой концентрации) и азотной (высокой концентрации) кислотами.
Если такому оксиду 2-х валентного железа провзаимодействовать или с водородом (температура 350 градусов по Цельсию), или с углеродом (коксом) при 1000 градусов, то оно восстанавливается до чистого состояния.
Добывают оксид железа 2-х валентного такими способами:
- через соединение оксида 3-х валентного железа с угарным газом;
- при нагревании чистого Fe, при этом низкое давление кислорода;
- при раскладывании оксалата 2-х валентного железа в вакуумной среде;
- при взаимодействии чистого железа с его оксидами, температура при этом 900-1000 градусов по Цельсию.
Что касается природной среды, то оксид железа 2-х валентного, присутствует в виде минерала вюстита.
Есть еще способ, как в растворе определить валентность железа – в данном случае, имеющего ее показатель 2. Необходимо провести реакции с красной солью (гексацианоферрат калия) и с щелочью. В первом случае наблюдается получение осадка темно-синего цвета – комплексной соли железа 2-х валентного. Во втором – получение темного серо-зеленого осадка – гидроксида железа также 2-х валентного, в то время, как гидроксид железа 3-х валентного имеет цвет в растворе темно-бурый.
Трехвалентное железо
Оксид 3-х валентного феррума имеет порошкообразную структуру, цвет которой красно-коричневый. Имеет также наименования: окись железа, железный сурик, красный пигмент, пищевой краситель, крокус.
В природе это вещество встречается в виде минерала – гематита.
Оксид такого железа с водой уже не взаимодействует. Но соединяется с кислотами и щелочами.
Применяется оксид железа (3) для окрашивания материалов, применяемых в строительстве:
- кирпичей;
- цемента;
- керамических изделий;
- бетона;
- тротуарной плитки;
- напольных покрытий (линолеум).
Железо в организме человека
Как отмечалось в начале статьи, вещество железо является важной составляющей человеческого организма.
Когда этого элемента является недостаточно, то могут возникнуть следующие последствия:
- повышенная усталость и чувствительность к холоду;
- сухость кожи;
- снижение мозговой деятельности;
- ухудшение прочности ногтевой пластины;
- головокружение;
- проблемы с пищеварением;
- седина и выпадение волос.
Накапливается железо, как правило, в селезенке и печени, а также почках и поджелудочной железе.
В рационе человека должны быть продукты, содержащие железо:
- говяжья печень;
- гречневая каша;
- арахис;
- фисташки;
- зеленый горошек консервированный;
- сушенные белые грибы;
- куриные яйца;
- шпинат;
- кизил;
- яблоки;
- груши;
- персики;
- свекла;
- морепродукты.
Недостаток железа в крови, приводит к снижению гемоглобина и развитию такого заболевания, как железодефицитная анемия.
Валентность железа
Общие сведения о валентности железа
В виде простого вещества железо – серебристо-белый металл. Плотность равна 7,87 г/см3. Температура плавления 1539oС, кипения 3200oС. Железо имеет несколько модификаций. До 769oС устойчиво α-железо с объемно центрированной кубической решеткой и ферромагнитными свойствами. При 769oС осуществляется переход в β-железо (кристаллическая структура та же, парамагнетик). При 910oС образуется γ-железо с гранецентрированной кристаллической решеткой. Парамагнитные свойства. При 1400oС и до температуры плавления – δ- железо с объемно центрированной кубической решеткой.
Валентность железа в соединениях
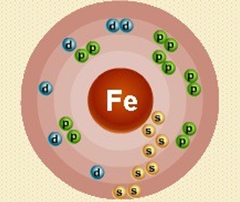
Железо – двадцать шестой по счету элемент Периодической таблицы Д.И. Менделеева. Оно находится в четвертом периоде в VIIIВ группе. В ядре атома железа содержится 26 протонов и 30 нейтронов (массовое число равно 56). В атоме железа есть четыре энергетических уровня, на которых находятся 26 электронов (рис. 1).
Рис. 1. Строение атома железа.
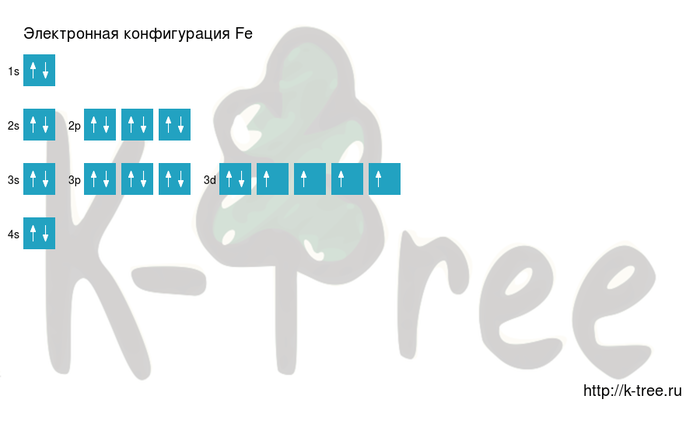
Электронная формула атома железа в основном состоянии имеет следующий вид:
1s22s22p63s23p63d64s2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
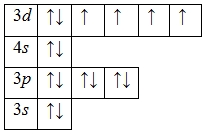
Железо проявляет в своих соединениях валентности II (FeO, Fe(OH)2, FeCl2, FeBr2) и III (Fe2O3, Fe(OH)3, FeCl3, Fe2S3).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Валентность железа.
Валентность железа:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Валентность железа равна II, III. Железо проявляет переменную валентность.
| Валентность железа в соединениях | |
| II | FeO, Fe(OH)2, FeCl2, FeBr2 |
| III | Fe2O3, Fe(OH)3, FeCl3, Fe2S3 |
Все свойства атома железа
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности
1 098
Железо в таблице менделеева занимает 26 место, в 4 периоде.
| Символ | Fe |
| Номер | 26 |
| Атомный вес | 55.8450000 |
| Латинское название | Ferrum |
| Русское название | Железо |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема железа
Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Короткая запись:
Fe: [Ar]4s2 3d6
Одинаковую электронную конфигурацию имеют
атом железа и
Mn-1, Co+1, Ni+2
Порядок заполнения оболочек атома железа (Fe) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Железо имеет 26 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
6 электронов на 3d-подуровне
Степень окисления железа
Атомы железа в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1, -2.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы железа
Валентность Fe
Атомы железа в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность железа характеризует способность атома Fe к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Fe
Квантовые числа определяются последним электроном в конфигурации,
для атома Fe эти числа имеют значение N = 3, L = 2, Ml = 3, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Fe:
Eo = 763 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Fe в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Но о применении железа поговорим позже. Сначала обозначим характеристики этого необыкновенного элемента.
Fe — строение, признаки, расположение в таблице Менделеева
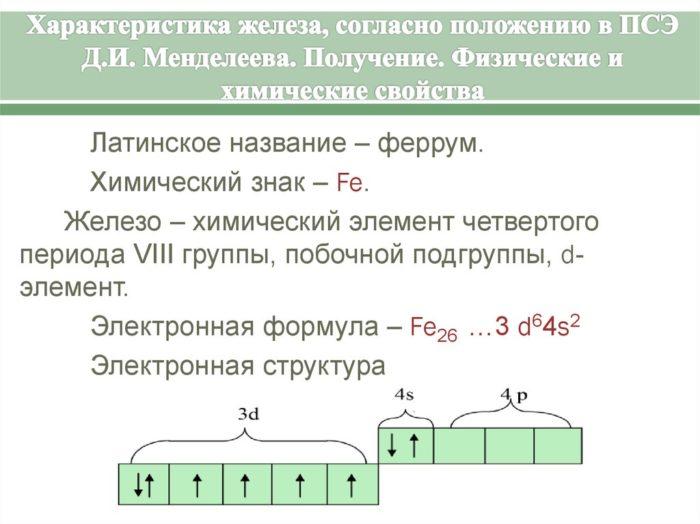
Железо (Fe) — элемент 8б группы 4 периода. Порядковый номер в периодической системе — 26. Отметим, что кобальт (Co) и никель (Ni), входящие в 8б группу таблицы Менделеева, включены в семейство железа. Строение электронной оболочки атома Fe таково:
1s22s22p63s23p63d64s2
Электронное строение атома данного элемента обусловливает характерные степени окисления: +2 и + 3. Железо также может находиться в степени +6. О некоторых исключениях и интересных веществах, где этот элемент проявляет необычные свойства, поговорим чуть позже.
Свойства Fe
Перед тем, как начать ознакомление со всеми соединениями железа, необходимо иметь представление о его физических и химических свойствах. Нельзя сказать, чтобы химические способности данного элемента выделялись среди ему подобных, но физические свойства обусловливают его ценность и уникальность.
Важно! Этот химический элемент в немалом количестве содержится в горах. Огромные залежи располагаются на Урале, в Сибири и других регионах России. Богаты железными рудами Украина, Прибалтика и т.д.
Физические свойства
Железо — ковкий и довольно прочный металл серебристо-белого цвета. На воздухе поддается коррозии с появлением желто-оранжевого налета — ржавчины. В чистом кислороде железо горит, а в обычных условиях кристаллизуется. Если брать только чистое железо, то оно является мягким и пластичным.
Химические свойства
Fe является химически активным элементом и чаще всего играет роль восстановителя. Итак, рассмотрим основные химические взаимодействия различных веществ с данным элементом:
- Реакции с неметаллами. При термическом воздействии вступает в реакции с кислородом, углеродом и галогенами, участвует в гидролизе (с температурой свыше 700 градусов).
- Реакции с солями. Железо вытесняет из солей слабые металлы, то есть те, у которых меньше значение электронного потенциала.
- Реакция с угарным газом. В ходе взаимодействия получаем пентакарбонил железа.
- Реакции с кислотами. Уделим особое внимание:
- Железо с легкостью вступает в реакции с соляной и разбавленной серной кислотами, образуя на выходе водород и соответствующие соли.
- Также взаимодействует с концентрированной серной кислотой, но по иному механизму. Здесь происходит образование кислотного оксида, соли и воды.
- Удачно реагирует с разбавленной азотной кислотой, а в аналогичной кислоте высокой концентрации железо пассивируется. Оксидная пленка покрывает поверхность металла, вследствие чего замедляется процесс коррозии.
Теперь перейдем к детальному изучению способностей соединений железа.
Соединения Fe (+2)
Начнем с тех веществ, где железо проявляет наименьшую окислительную степень после нуля — + 2. Данную степень этот химический элемент способен проявлять в различных бинарных соединениях, а также в сложных и комплексных солях.
Оксид железа II — FeO
Получить его возможно, если восстанавливать с помощью водорода оксид железа III. В целом FeO можно считать амфотерным оксидом, но в нем больше преобладают основные свойства. Представляет собой черный порошок, который невозможно растворить в воде. Ценится за свое быстрое окисление и восстановление до изначального вещества.
Гидроксид железа II — Fe(OH)2
Данный гидроксид также имеет основный характер и легко растворяется в кислотах. Это соединение является белым осадком, получаемым при взаимодействиях солей железа и щелочей. Такие реакции должны проходить в бескислородной среде, иначе может образоваться другой гидроксид, о котором будем говорить далее. Fe(OH)2 способен к активному окислению на воздухе с получением соединений, где Fe находится в степени окисления +3.
Соли Fe (+2): FeSO4, FeCl2
Соли данного элемента можно получить путем большого количества реакций. Большинство из них будут иметь светло-зеленоватую окраску в растворах. Превращаются в соли железа III, окисляясь на воздухе. При этом они имеют коричнево-бурую окраску. Также благодаря солям можно получить оксиды и гидроксиды, содержащие Fe.
Соль Мора — FeSO4*(NH4)2SO4*6H2O
Это вещество широко распространено в фармацевтике и медицине. Применяется для поставки недостающего железа в организм человека. Также противодействует гниению в дереве и деревянных изделиях. Участвует в обнаружении соединений хрома и ванадия.
Соединения Fe (+3)
Крупная группа веществ, в которой содержится трехвалентное железо. Эти соединения отличаются по своим свойствам по сравнению с предыдущими. Рассмотрим их подробнее.
Оксид железа III — Fe2O3
Проявляет амфотерные качества, соответственно — реагирует с кислотами и щелочами, образуя при этом средние, комплексные и другие соли. В обычных условиях является кристаллическим порошком коричнево-красного цвета, нерастворимым в воде.
Гидроксид железа III — Fe(OH)3
Так же, как и соответствующий ему оксид, проявляет амфотерные свойства. Имеет темно-коричневый цвет. Получают вещество в ходе реакций щелочей с солями трехвалентного железа. В результате образуется бурый, темноватый осадок — Fe(OH)3. Если это основание прокалить, то получим Fe2O3.
Соли Fe (+3): FeCl3, Fe2(SO4)3
Растворы солей трехвалентного железа имеют желтый окрас и являются слабыми окислителями. При воздействии восстановителей переходят в те вещества, где железо имеет степень окисления +2.
Важно! Солей данного типа открыто достаточно много, и все они используются в промышленных, медицинских отраслях, а также в повседневной жизни.
Соединения Fe (+2, +3)
В некоторых веществах этот химический элемент имеет целых две степени окисления. Подробнее изучим сами соединения и их свойства.
Оксид железа II, III — Fe3O4, железная окалина.
Данное вещество является смесью двух оксидов железа: II и III. Железо не может быть в степени +4, поэтому такое соединение записывается как: FeO*Fe2O3. Получают данный оксид путем взаимодействия железа с водой и кислородом, которое проходит при наличии высокой температуры.
Турнбулева синь или берлинская лазурь — KFe{Fe(CN)6}
Это необычное соединение является осадком темного и чуть синеватого цвета, получаемым в ходе реакции между FeSO4 и красной кровяной солью. Здесь один атом Fe имеет степень окисления +2, а другой — +3. Чтобы обнаружить ионы трехвалентного железа, применяют желтую кровяную соль K4{Fe(CN)6}.
Соединения Fe (+6)
Химические вещества, где окислительная степень железа равна +6, называются ферратами.
Ферраты: K2FeO4, Na2FeO4
Ферраты являются мощными восстановителями и сходными по всем остальным способностям. Немаловажным является наличие в них бактерицидных способностей. Это обусловливает их ценность в качестве средств, обеззараживающих воду в крупных количествах.
Органические вещества, содержащие Fe
Железо и его свойства крайне важны и полезны в повседневной жизни людей, хозяйственной и промышленной деятельности. Но еще соединения железа выполняют значимые функции в теле человека. Чаще всего биологическую роль выполняют именно органические вещества, содержащие Fe. Пожалуй, самым важным веществом в теле человека, содержащим железо, является гемоглобин. Гемоглобин является белком, который осуществляет транспортировку кислорода по крови и обеспечивает постоянный газообмен. Fe входит в состав многих ферментов и белков нашего тела. Этот элемент также влияет и на наш иммунитет. Не зря при нехватке железа человек чувствует себя уставшим и сонным. При снижении концентрации Fe повышается вероятность заражения инфекционными заболеваниями. Поэтому важно следить за тем, чтобы в рационе было достаточно продуктов, содержащих железо — бобы, крупы, орехи, сухофрукты, морская капуста.
Применение Fe и его соединений
В конце стоит сказать и о неизмеримом вкладе Fe в современную жизнь и ее сферы. В статье уже встречались строки об использовании железа в различных областях, но разберемся в этом вопросе подробнее:
- Вещества, включающие в себя Fe, широко применяются в хозяйственной деятельности. Повсеместно в качестве строительных материалов используются сплавы железа — чугун, стали и т.д. Ковкость и прочность делают Fe незаменимой деталью в громоздких и массивных сооружениях.
- Часто этот элемент применяют и в химической промышленности. Железо играет роль катализатора во многих реакциях органического и неорганического синтеза. Пириты (соединения железа и серы) применяют для выделения серы и ее производных.
- С помощью Fe2O3 производят краски, цемент, материалы, обладающие магнитными свойствами.
- Железный купорос используется в качестве защиты урожая от вредных насекомых, также он нашел применение и в гальванотехнике.
Итак, мы рассказали об основных соединениях железа, их свойствах, характеристиках, способах получения и областях применения. Стоит отметить, что данный элемент заметно выделяется на фоне остальных, рядом своих качеств и способностей. Как мы выяснили, он является незаменимым для жизни человека, значит, необходимо иметь представление о его строении, физических и химических свойствах. Для закрепления изученного материала рекомендуем пройти тест и посмотреть видео с интересными фактами.