ЛЕКЦИИ ДЛЯ УЧИТЕЛЕЙ
Элементы научного поиска
при решении нестандартных
химических задач*
Основной способ активного освоения любой новой
области деятельности – тренировка. В химии и
других естественных науках тренировка сводится
к решению задач. Принципиально разных типов
химических задач сравнительно немного, особенно
в школьном курсе [1]. Все они известны и четко
классифицированы по содержанию и способам
решения [2]. Поэтому в принципе не представляет
больших проблем натренировать школьников решать
стандартные задачи, включающие, например,
расчеты по уравнениям химических реакций или
определение молекулярной формулы по элементному
составу.Другое дело – задачи нестандартные. Любое
малейшее отклонение от проторенной дорожки
приводит большинство учащихся в ступор,
переходящий в полный паралич умственной
деятельности. Они просто не знают, что делать.
Результатом является чистый лист.В этих случаях для выхода из тупиковой ситуации
можно привлечь в помощь элементы научного
способа познания мира. Ведь наука – это, по
определению, поиск нового, создание информации,
отличающейся от уже имеющейся. Поэтому она может
помочь найти новый способ решения задачи.
Элементарные представления о том, как вести себя
в незнакомой ситуации, какие использовать методы
для поиска решения, любому школьнику не повредят.Научная работа как способ деятельности – это
не перманентное творчество, она включает в себя и
повседневный, причем иногда утомительный труд.
Наука – это профессия, поэтому у научных
работников есть много профессиональных приемов
и рецептов, как добиваться своих целей.
Некоторыми из этих приемов мы и хотим поделиться:
они оказываются полезными при решении школьных
химических задач. Каждый рецепт будет
проиллюстрирован примерами.Разумеется, эти рецепты не универсальны: они
годятся для решения одних задач и совершенно
непригодны для других, требующих иных, может
быть, еще неизвестных подходов. Именно поэтому в
науке всегда было, есть и будет место творчеству.
Р е ц е п т 1.
Пробовать
Дмитрий Иванович Менделеев, рассказывая о том,
как он открыл периодический закон, утверждал:
«Искать же что-либо, хотя бы грибы или
какую-нибудь зависимость, нельзя иначе, как
смотря и пробуя». Пробовать – это главный
научный рецепт. Для этого надо предложить любой
(пусть совсем неправильный) способ решения и
посмотреть, к чему он приводит. Можно попытаться
понять, в каком месте возникает отклонение от
условия задачи, и в этом месте подправить способ.
Так, путем проб и ошибок, методом
последовательных приближений иногда можно
решить задачу.
Пример 1. Установите возможную формулу
органического соединения, которое содержит 40%
углерода по массе.
Р е ш е н и е. Дана массовая доля углерода, а
больше про вещество ничего не известно. Давайте
пробовать разные варианты – будем
самостоятельно «назначать» дополнительную
информацию.
Самые простые органические вещества –
углеводороды CxHy. Пусть
неизвестное вещество содержит 40% углерода и 60%
водорода. Найдем его эмпирическую формулу
стандартным способом:
Углеводород CH18 не существует.
Пробуем дальше. Добавим в формулу вещества
символ кислорода: CxHyOz.
С помощью стандартного приема мы формулу найти
не можем, т.к. массовые доли кислорода и водорода
неизвестны. Попробуем принять наименьшее
возможное значение числа атомов углерода: x =
1. Тогда молярная масса вещества составляет:
M(CHyOz) = 12/0,4 = 30
г/моль.
Из 30 г на углерод приходится 12 г, а на водород и
кислород – 18 г, что соответствует H2O. Таким
образом, эмпирическая формула вещества – CH2O.
Этой формуле соответствуют, например, все
углеводы.
О т в е т. Возможная формула соединения
– CH2O.
Пример 2. Два углеводорода – A и B
– имеют одинаковый элементный состав: каждый
содержит по 92,3% мас. углерода. Образец
углеводорода A может присоединить в 6 раз
большее количество брома, чем равный по массе
образец углеводорода B. Определите возможные
структурные формулы веществ A и B.
Р е ш е н и е. Из элементного состава следует:
(C) :
(H) = (92,3/12) : (7,7/1) = 1:1.
Эмпирическая формула обоих углеводородов – CH.
Кроме того, они содержат кратные связи, т.к.
способны присоединять бром.
Попробуем рассмотреть несколько простейших
углеводородов такого состава и рассчитаем
количество брома, способное присоединиться к
одной и той же массе каждого углеводорода. В
качестве ограничения выберем 104 г – массу 1 моль
самого тяжелого из рассматриваемых веществ: C8H8
(таблица).
Таблица
| Формула углеводорода |
Структура | Kоличество вещества Br2 на 1 моль углеводорода, моль |
Kоличество вещества Br2 на 104 г углеводорода, моль |
|---|---|---|---|
| C2H2 (Mr = 26) | HC |
2 | 2•4 = 8 |
| C4H4 (Mr = 52) | HC |
3 | 3•2 = 6 |
| C6H6 (Mr = 78) | HC |
4 | 4•4/3 = 16/3 |
| C8H8 (Mr = 104) | C6H5CH=CH2 | 1 | 1 |
Из таблицы видно, что условию задачи
удовлетворяют винилацетилен (A) и стирол (B).
Молярные массы у них отличаются в 2 раза, а
количества вещества присоединяемого брома на 1
моль углеводорода – в 3 раза, итого при равных
массах получаем искомый коэффициент 6.
Уравнения реакций:
HCC–CH=CH2 + 3Br2
CHBr2CBr2CHBrCH2Br,
C6H5CH=CH2 + Br2 C6H5CHBrCH2Br.
Эта задача имеет бесконечно много решений, тем
она и трудна. Мы привели лишь самое простое
решение, найденное небольшим перебором.
О т в е т. Возможные структурные формулы
веществ: A – HCC–CH=CH2, B
– C6H5–CH=CH2.
Р е ц е п т 2.
Правильно выбирать переменные
Решение многих расчетных задач значительно
облегчается правильным выбором переменных –
тех, которые характеризуют наиболее
существенные свойства изучаемых объектов. При
этом надо стараться обходиться минимальным
числом переменных.
Пример 3. В каком оксиде массовая доля
кислорода наибольшая?
Р е ш е н и е. Общая формула бинарных
кислородсодержащих соединений – RxOy.
Если ограничиться оксидами элементов с
постоянной валентностью, то число неизвестных
переменных можно сократить – R2On,
где n – степень окисления элемента R (n
изменяется от 1 до 8).
В задаче осталось две переменных – атомная
масса элемента R (обозначим ее через X) и
степень окисления n. Запишем выражение для
массовой доли кислорода:
Надо найти максимальное ее значение. С двумя
переменными это сделать очень трудно, но в данном
случае их можно объединить в одну. Поделим
числитель и знаменатель дроби на 16n:
Для того чтобы выражение было максимальным,
знаменатель должен быть минимальным. Значит,
надо найти элемент, у которого отношение атомной
массы к степени окисления (это отношение иногда
называют эквивалентом) наименьшее: X/n = min.
Очевидно, что это водород: X = 1, n = 1. Искомый
оксид – вода.
О т в е т. Массовая доля кислорода
наибольшая в H2O.
Пример 4. 1000 г вещества содержат 0,3227 г
электронов. Определите формулу вещества (масса
электрона равна 1/1823 а.е.м.).
Р е ш е н и е. По данным задачи можно сразу найти
количество вещества электронов:
Количество самого вещества неизвестно, т.к. мы
не знаем его молярную массу. Обозначим ее через M
– это первая переменная, которую мы вводим.
Теперь находим количество вещества:
Как связаны между собой две указанные величины?
Для ответа на этот вопрос придется ввести еще
одну переменную n – число электронов в одной
молекуле. Тогда число молей электронов ровно в n
раз превышает число молей вещества:
Откуда M = 1,7n г/моль.
Предположим, что молярная масса выражается
почти целым числом, тогда n кратно 10. При n =
10 имеем M = 17 г/моль. Этой молярной массе
соответствует аммиак, его молекула содержит как
раз 10 электронов.
О т в е т. Формула вещества – NH3.
Р е ц е п т 3.
Строить модели с разумными допущениями
Многие химические объекты – молекулы,
коллоидные частицы, кристаллы, растворы и т.д. –
исследуют путем построения моделей. Модель – это
идеализированное представление объекта, которое
отражает некоторые его существенные свойства и
пренебрегает всеми остальными. Хорошая модель
содержит лишь небольшое число параметров.
Правильность моделей подтверждается сравнением
с экспериментальными данными. Искусство
научного работника состоит в том, чтобы выбрать
главное в модели и пренебречь несущественным.
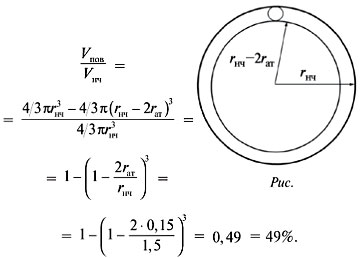
Пример 5. Радиус наночастицы золота
равен 1,5 нм, а радиус атома – 0,15 нм. Оцените,
сколько атомов входит в состав наночастицы и
какая их доля находится на поверхности.
Р е ш е н и е. Судя по условию задачи, наночастица
представляет большой шар, заполненный
маленькими шарами – атомами золота.
Шарообразные формы наночастицы и атома – это
первое допущение.
Предлагается определить число атомов по
порядку величины, т.е. получить ответ с невысокой
точностью. В таком грубом приближении можно
пренебречь свободным объемом между атомами в
наночастице и считать, что шары заполняют все
пространство. Это дает ошибку около 20%. Общее
число атомов равно отношению объема наночастицы
к объему атома:
В случае гетерогенных катализаторов реакция
происходит на поверхности частиц. Поэтому, чтобы
оценить каталитические возможности наночастиц,
надо знать долю атомов на поверхности. Для этого
найдем объем поверхностного слоя Vпов и
разделим его на объем наночастицы Vнч.
Объем поверхностного слоя равен разности между
объемами самой наночастицы и «внутреннего» шара,
радиус которого меньше радиуса наночастицы на
диаметр атома (рис.).
Доля атомов на поверхности:
О т в е т. Число атомов золота в составе
наночастицы – 1000;
их доля на поверхности – 49%.
Р е ц е п т 4.
Угадать и доказать, что правильно
Во многих задачах – преимущественно тех, в
которых зашифрованы цепочки превращений с
неизвестными веществами, – ответ можно угадать.
Но надо еще доказать, что он отвечает условиям
задачи.
Пример 6. После пропускания
электрического разряда через смесь газов А и
Б произошла реакция и образовалась смесь газов В
и Г с молярными массами, равными молярным
массам исходных газов. Определите формулы
исходных веществ А и Б.
Р е ш е н и е. Ключ к решению – равенство
молярных масс продуктов и реагентов. Известно
несколько газов с молярной массой 28 г/моль. Это CO,
C2H4, N2, B2H6. Другая
распространенная молярная масса – 44 г/моль, ей
отвечают CO2, N2O, C3H8, CH3CHO.
Числа 44 и 28 отличаются на 16 – это относительная
атомная масса кислорода. Поэтому реакция между
газами A и Б может сводиться к переходу кислорода
от одного вещества к другому. Такие вещества
среди перечисленных выше есть: N2O
(окислитель) и CO (восстановитель). Уравнение
реакции:
О т в е т. Формулы исходных
веществ – N2O и CO.
Мы рассмотрели лишь некоторые из большого
числа рецептов решения научных задач. Это очень
малая часть «технологии науки».На самом деле самое трудное в науке – не решать
задачи, а придумывать их. Ведь правильно заданный
вопрос содержит в себе большую часть ответа.
Самыми выдающимися считают не тех ученых,
которые решили какую-то проблему, а тех, которые
ее поставили. Самые крупные открытия начинаются
с правильной постановки задачи. Решение задачи –
зачастую дело техники, а вот формулировка
проблемы требует глубокого понимания скрытой
сути явлений. Подробно о том, как делались многие
открытия в химии и физике, можно прочитать в
книге [3].В заключение предлагаем несколько задач, при
решении которых можно использовать описанные
выше рецепты.
Задачи для
самостоятельного решения
1. При количественном окислении 5 г
оптически активного вещества А
перманганатом калия в кислой среде получено 5 г
вещества Б, которое взаимодействует с
веществом А с образованием жидкости В
состава C15H14O2. Установите
структуры веществ А–В.
О т в е т. A – C6H5CH(OH)CH3,
Б – C6H5COОH, В – сложный эфир,
образованный веществами А и Б.
2. Оксид неметалла массой 10,16 г добавили к
124 г 10%-го раствора гидроксида натрия и получили
раствор, в котором массовая доля соли равна 11,27%.
Определите формулы оксида и соли.
О т в е т. SeO3, Na2SeO4.
3. Константа изомеризации некоторого
вещества A = Б равна 0,8. Смешали 5 г вещества A и
10 г его изомера Б и смесь выдержали до
установления равновесия. Вычислите массовую
долю изомера Б в полученной смеси. Зависит ли
результат от количества изомеров в исходной
смеси?
О т в е т. 0,44; не зависит.
4. В cлучае гетерогенных катализаторов
реакция происходит на поверхности частиц. Пусть
частица состоит из атомов металла радиусом r.
Определите долю атомов на поверхности
катализатора, если его частицы имеют форму: а)
шара радиуса R; б) куба со стороной L. В каком
случае – шара или куба – доля атомов на
поверхности больше, если куб и шар имеют
одинаковый объем?
О т в е т. а) 6r/R; б) 12r/L.
В случае куба доля атомов больше.
5. Два газообразных простых вещества,
состоящих из двухатомных молекул, смешали в
объемном соотношении 1 : 9 в закрытом
реакционном сосуде при температуре 20 °С и
высоком давлении. Сосуд нагрели до 215 °С; при
этом с количественным выходом образовалось
газообразное сложное вещество, а давление по
окончании реакции оказалось равным
первоначальному. Определите формулу продукта
реакции.
О т в е т. ClF5.
6. Для полного гидролиза 7,4 г смеси двух
сложных эфиров потребовалось 70 г 8%-го раствора
гидроксида калия. При добавлении к такому же
количеству смеси избытка аммиачного раствора
оксида серебра выделилось 6,48 г осадка.
Определите строение сложных эфиров и их
содержание в исходной смеси (в мольных %).
О т в е т. 30% HCOOC2H5, 70% CH3COOCH3.
7. При нагревании до 170 °С смеси двух
твердых при обычных условиях веществ, взятых в
мольном соотношении 1 : 41, образовались
твердое и газообразное вещества в мольном
соотношении 40 : 41. Определите все вещества.
О т в е т. C40H82, S, C, H2S.
* По материалам лекции для
учителей, прочитанной на Фестивале науки в МГУ
им. М.В.Ломоносова в октябре 2006 г.
Л и т е р а т у р а
1. Еремин В.В., Кузьменко Н.Е. Сборник задач и
упражнений по химии. Школьный курс. М.: Экзамен,
2006.
2. Олейников Н.Н., Муравьева Г.П. Химия.
Основные алгоритмы решения задач. М.: УНЦ ДО, 2003.
3. Краткий миг торжества. О том, как делаются
научные открытия (библиотека журнала «Химия и
жизнь»). М.: Наука, 1988.
В.В.ЕРЕМИН,
профессор химического факультета МГУ
Download Article
Download Article
Every atom in the universe is a particular element. But how do we tell which of the 100+ elements it is? A larger pile of stuff might give us helpful clues: we can tell that iron is heavy, and grey, and magnetic. As you study chemistry, you’ll learn that all of those qualities come from small differences in the structure of atoms. This understanding of atomic structure is the foundation for the tools actual scientists use to identify elements.
-
An element is defined by the number of protons in one atom. For example, every single atom of hydrogen has exactly one proton. We say that hydrogen has a proton number or atomic number of 1.[1]
The periodic table is arranged in order of proton number, which is why hydrogen is in the very first box with a 1 next to it.
Advertisement
-
The total electron count equals the atomic number. In a neutral atom, the number of electrons is exactly equal to the number of protons. This number is the atomic number of the element, which you can look up on the periodic table. If you are a little further in your chemistry studies, you might be given an electron configuration to read. All of the superscript numbers (like this) are electron counts, so add all these together to find the total number of electrons.[2]
-
Memorize the periodic table structure to read electron configurations quickly. The structure of the periodic table is closely related to how electron orbitals are filled. With a little practice you can jump directly to the right region of the periodic table.[4]
Note that the electron configuration must be in its ground state for this to work.
Advertisement
-
Compare the spectra to the known spectra of elements. In spectroscopy, scientists examine how light interacts with an unknown material. Each element releases a unique pattern of light, which you can see on the spectroscopy results, called «spectra».[6]
- For example, a lithium spectrum has a very bright, thick green line, and several other fainter ones in different colors. If your spectrum has all those same lines on it, the light came from the element lithium.[7]
(Some types of spectra will show dark gaps instead of bright lines, but you can compare these the same way.) - Want to know why this works? Electrons only absorb and emit light at very specific wavelengths (meaning specific colors). Different elements have different arrangements of electrons, which leads to different colors of bands.[8]
- A more advanced spectroscope shows a detailed graph instead of a few lines. You can match the x-axis value at each peak to a table of known values to identify molecules. As you learn about different types of molecules, you’ll learn to focus on just a few useful spots on the graph to save time.[9]
- For example, a lithium spectrum has a very bright, thick green line, and several other fainter ones in different colors. If your spectrum has all those same lines on it, the light came from the element lithium.[7]
-
Look for elements whose atomic masses match the graph. A mass spectrometer sorts the components of a sample by mass. To read the bar graph showing the results, check the «m/z» axis for the values of the taller bars. Some values will match the atomic mass of an element that was part of the sample. Others (usually the larger ones) represent compounds, so that mass will equal the sum of masses of multiple atoms.[10]
- Let’s say the tallest bar is at m/z 18, with short bars at 1, 16, and 17. Only two of these match the atomic mass of an element: hydrogen (atomic mass 1) and oxygen (atomic mass 16). Adding these atoms together gives you the compounds HO (mass 1 + 16 = 17) and H2O (mass 1 + 1 + 16 = 18). This sample was water![11]
- Technically, a mass spectrometer ionizes the sample and sorts by the ratio of mass to charge (or m/z). But most ions will have a charge of 1, and so you can ignore the division problem and just look at mass. The smallest bars often represent small amounts of more charged particles that you can ignore for identification purposes.[12]
- Let’s say the tallest bar is at m/z 18, with short bars at 1, 16, and 17. Only two of these match the atomic mass of an element: hydrogen (atomic mass 1) and oxygen (atomic mass 16). Adding these atoms together gives you the compounds HO (mass 1 + 16 = 17) and H2O (mass 1 + 1 + 16 = 18). This sample was water![11]
Advertisement
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
Mass spectrometer readings get complicated when you sample large molecules that can break into many parts.[13]
If you can narrow down the sample to a few possibilities, you can look up the mass spectra of each one and compare that to your actual results. -
Electron configurations can also be written in noble gas notation, which uses a noble gas element symbol to stand in for that element’s electron shell.[14]
For instance,can be expanded with neon’s electron configuration into
. To identify the element by electron count, add the electrons in the expanded configuration.[15]
In this case there are 2+2+6+2+4 = 16 electrons, so this must be the sixteenth element, sulfur. -
Most periodic tables show two numbers next to each element. The smaller one (that always goes up by 1 as you go left to right) is the atomic number or proton number. The larger number is the atomic mass.
Thanks for submitting a tip for review!
Advertisement
-
If you are given an electron configuration in an excited state, you can’t use the highest energy electron to identify the element. Identify the ground state for that number of electrons first.
Advertisement
References
About This Article
Thanks to all authors for creating a page that has been read 19,348 times.
If you buy through links on our site, we may earn a commission.
Did this article help you?
Фреоны
Задача. В мастерской по ремонту холодильников и климатического оборудования отклеились этикетки от 5 баллонов с хранившимися в них фреонами (техническое название группы насыщенных алифатических галогенсодержащих углеводородов, применяемых в качестве хладагентов). Этикетки содержали следующие надписи: R-12, R-23, R-32, R-41, R-161. Для установления формул фреонов были проведены исследования. При сжигании фреона 1 образовалось 2,24 л СО2 и 4 г HF. Фреон 2 не горит (ω(C) = 9,92%; D(H2) = 60,5). У фреона 3 (ω(F) = 39,58%, ω(Н) = 10,42%). При взаимодействии фреона 4 с натрием образовался этан и фторид натрия. При щелочном гидролизе фреона 5 образовались две соли: формиат натрия (ω(C) = 17,65%; ω(О) = 47,06%) и фторид натрия. Установите структурные формулы указанных фреонов и дайте им химические названия, установите соответствие между кодом фреона и его формулой.
Данная задача предназначена для десятиклассников, которые еще не освоили курс кислородсодержащих органических соединений, поэтому даны массовые доли.
1. Начнем с фреона № 1. При его сжигании образовалось 2,24 л углекислого газа. Найдем количество углекислого газа. Делим его объем на молярный объем и получаем 0,1 моль. Соответственно, атомов углерода тоже 0,1 моль, поскольку в каждой молекуле углекислого газа содержится один атом углерода.
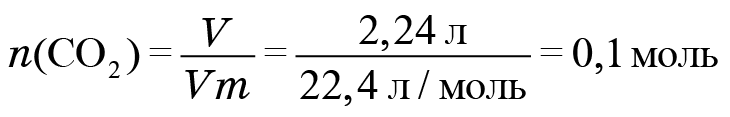
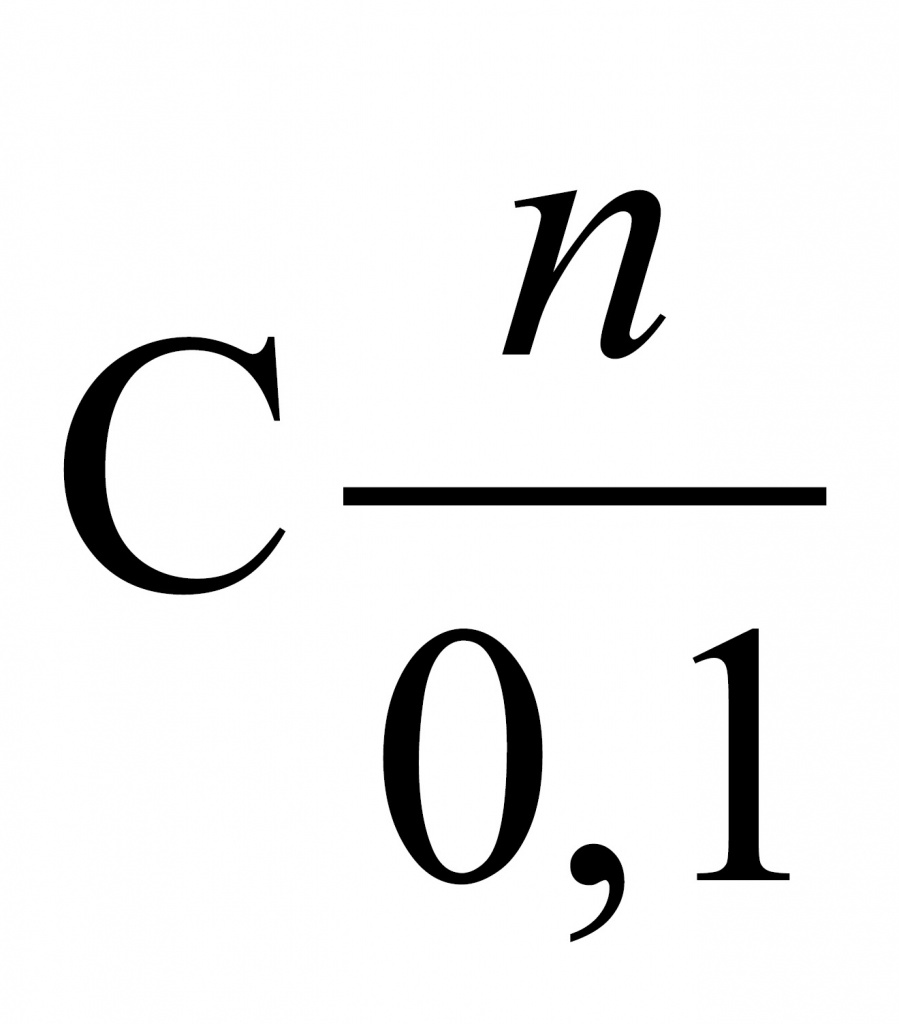
Информацию по водороду возьмем из фтороводорода. Найдем количество фтороводорода. Поскольку дана его масса, мы должны поделить массу (4 г) на молярную массу. Молекула фтороводорода состоит из атома фтора и атома водорода. Масса атома фтора 19, у водорода масса 1, значит, молярная масса 20. И мы получаем 0,2 моль.
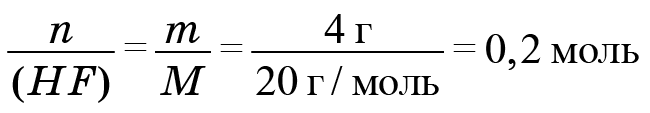
Следовательно, H = 0,2 и F = 0,2. Формула вещества, фреона № 1: CH2F2 (на один атом углерода приходится два атома водорода и два атома фтора).

2. Узнаем, что скрывается под фреоном № 2. Известно, что он не горит, и дана его плотность по водороду. Это относительная плотность, которая показывает, во сколько раз молярная масса вещества больше молярной массы (в данном случае) водорода. Молярная масса фреона № 2 равна 121 г/моль.
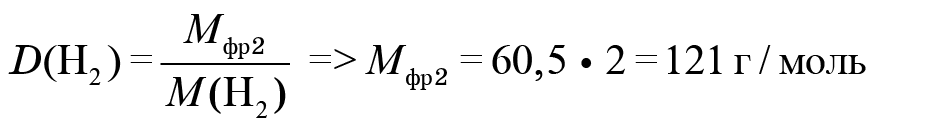
Сколько атомов углерода во фреоне № 2? Для подсчета используем массовую долю углерода. Масса углерода равна: молярную массу умножить на массовую долю. Получаем 12. Значит, в данной молекуле фреона № 2 содержится только один атом углерода.
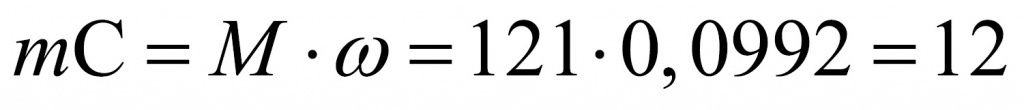
Нарисуем этот атом углерода. У него имеется четыре связи, поскольку в органической химии углерод четырехвалентный. Попробуем определить атомы, исходя из того, что в сумме один атом углерода и все остальные атомы должны равняться молярной массе (равной молекулярной) 121. Попробуем рассчитать. Если это четыре атома фтора, то получается мало. А если это четыре атома хлора, то много. Возьмем нечто среднее: половина — атомы фтора и половина — атомы хлора. Единица в показателе 121 говорит о том, что имеются нечетные значения. Молярная масса хлора 35,5. Для того чтобы получить целое численное значение, вероятно, нужны два атома хлора.
121 – 71 – 12 = 38 (ровно на два атома фтора)
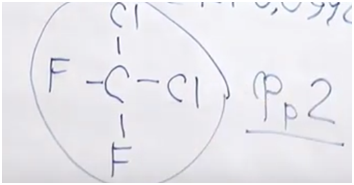
3. Перейдем к фреону № 3. Нам дана массовая доля фтора: 39,58. Дана массовая дола водорода: 10,42. Поскольку это органическое вещество, должен быть и углерод — попробуем его найти.
100 – 39,58 – 10,42 = 50
Проверим вариант, что там только хлор и нет других атомов. Предположим, что там всего один атом углерода (его масса будет равна 12). Посчитаем, какая масса при этом будет приходиться, например, на атом фтора.
12 ∙ 39,58 : 50 = 9,5
Как указано в периодической системе Менделеева, атомная масса фтора — 19. Ровно половина одного атома фтора — 9,5, так что в составе этой молекулы не может быть один атом углерода, их должно быть как минимум два. Следовательно, на углерод приходиться масса 24, на фтор — 19. Какая масса в данном случае приходится на водород? По сути, должно оставаться пять атомов водорода.
24 ∙ 10,42 : 50 = 5
Поскольку у нас один атом фтора, пять атомов водорода и два атома углерода, мы имеем дело с фторэтаном.

4. Что касается фреона № 4, то в реакции с натрием образовались этан и фторид натрия. Это реакция Вюрца — Фиттига. Мы имеем исходное вещество фторметан, которое реагирует с натрием, и образуются этан и фторид натрия.
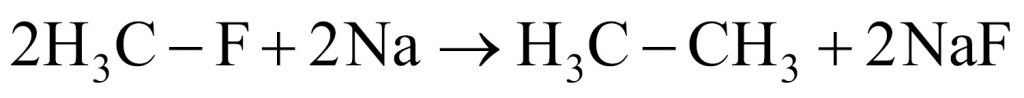
5. Переходим к фреону № 5. Формиат натрия образуется при гидролизе трифторметана. Получается формиат натрия, фторид натрия и две молекулы воды.
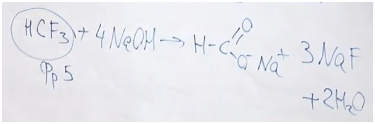
Посмотрев в справочную информацию, вы можете соотнести с кодами каждый из найденных фреонов.
Изучение фреонов очень интересно. Каждый тип холодильного оборудования требует особую марку фреона. Сегодня холодильное оборудование часто заполняют и углеводородами, поскольку, как известно, фреоны способствуют разрушению озонового слоя Земли. Но на сегодняшний день полного отказа от фреонов еще не произошло.

Химия. 10 класс. Углубленный уровень. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова и продолжает курс химии, изложенный в учебниках «Химия. 8 класс» и «Химия. 9 класс» данного авторскогo коллектива. Предназначен для изучения химии на углубленном уровне. Учебник соответствует федеральному государственному образовательному стандарту среднего общeгo образования.
Купить
Вильгельм Рудольф Фиттиг
Задача. Вещество, открытое в 1862 году немецким ученым Вильгельмом Рудольфом Фиттигом, представляет собой бесцветные кристаллы (tпл = +690С). Они широко применяются в качестве пищевой добавки для сохранения товарного вида фруктов (например, цитрусовых) путем нанесения на кожуру плода. Для установления состава вещество массой 15,4 г сожгли, образовалось 26,88 л (н.у.) углекислого газа и 9 г воды. Установите структурную формулу, если известно, что оно может подвергаться каталитическому галогенированию. Составьте уравнение этого вещества с избытком водорода на платиновом катализаторе при повышенном давлении.
Похожую задачу часто можно встретить на ЕГЭ.
Начнем с определения молекулярной формулы вещества, то есть узнаем состав этой молекулы. Найдем количество углекислого газа, а оно равно количеству углерода. Разделим объем на молярный объем. Поскольку условия нормальные, молярный объем для газообразного вещества составляет около 22,4 л/моль.
26,88 л : 22,4 л/моль = 1,2 моль
Поскольку воды 9 г, а молярная масса воды 18 г, следовательно, воды 0,5 моль, а водорода 1 моль. Как такое может быть? В одной молекуле воды содержится целых два атома водорода. Но нам не сказано: соединение ли углеводородом? содержит ли кислород? Мы должны проверить наличие кислорода и найти массу углерода и водорода.
1,2 моль ∙ 12 = 14,4 г
Сумма углерода и водорода: 14,4 + 1 = 15,4. Следовательно, в составе неизвестного вещества нет кислорода.

Молярное соотношение показывает, что формула вещества С12H10. Почему не С6H5? Потому что в углеводородах никогда не бывает нечетного числа атомов водорода. Радикал С6H5 в химии называется фенилом. Иными словами, мы имеем соединение, которое называется в химии дифенил. На это также указывают химические свойства дифенила, и он является разрешенной пищевой добавкой. В магазинах можно встретить, например, апельсины, покрытые белым веществом — это и есть дифенил. Иногда его применяют в изрядном количестве, поэтому нужно тщательно мыть фрукты.
Составим уравнение реакции с избытком водорода. Очень просто посчитать, сколько атомов водорода потребуется на реакцию с дифенилом. Мы видим шесть двойных связей. Следовательно, на одну двойную связь нужна одна молекула водорода, а на шесть двойных связей — шесть молекул водорода при исчерпывающем гидрировании. Конечно, на platinum-катализаторе, потому что соединение ароматическое и требует преодоления достаточно высокого энергетического барьера. Мы получаем соединение, которое нельзя назвать никак иначе, кроме как дициклогексил.

Соединение дифенил и было открыто Рудольфом Фиттигом в 1862 году с температурой плавления 69°С.
Желеобразующая жидкость
Задача. Некоторая нерастворимая в воде жидкость при хранении на воздухе способна уплотняться, превращаясь в желе. Химик отобрал, отмерив, некоторый объем этой жидкости и установил, что при действии избытка раствора брома в четыреххлористом углероде образовалось 26,4 г дибромида. А при действии раствора хлора на такой же объем этой жидкости образовалось 17,5 г дихлорида. Определите структурную формулу этой жидкости, если известно, что в ее состав входят только атомы водорода и углерода. Составьте уравнение реакции полимеризации этой жидкости.
Обозначим неизвестную жидкость-углеводород через формулу CXHY. О какой реакции идет речь: замещения или присоединения? Поскольку реакция протекает при обычных условиях, значит, речь идет о реакции присоединения.
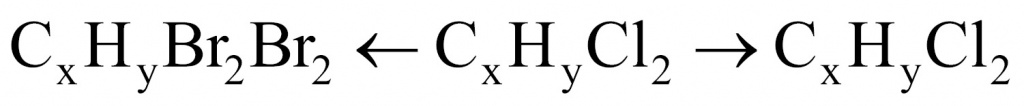
Для решения данной задачи нужно применить прием, известный в учебной химии как прием вычитания массы. Представим, что жидкости у нас ровно 1 моль. В этом случае разница между массой дибромида и дихлорида будет разницей между массой брома и хлора.
Молекула брома имеет массу 160, а молекула хлора — 71. Получаем 89. То есть если бы вещества у нас было 1 моль, то разница составила бы 89 г. Вычислим разницу массы дибромида и дихлорида:
26,4 – 17,5 = 8,9
Искомого вещества 0,1 моль.
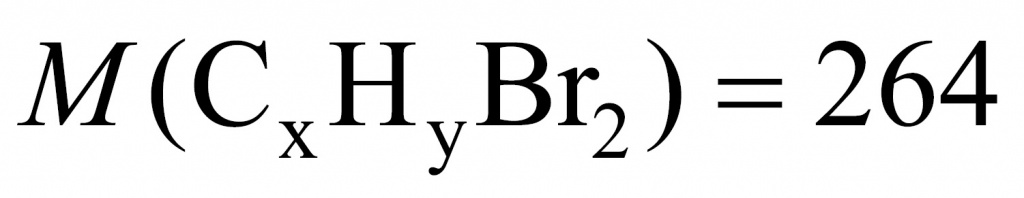
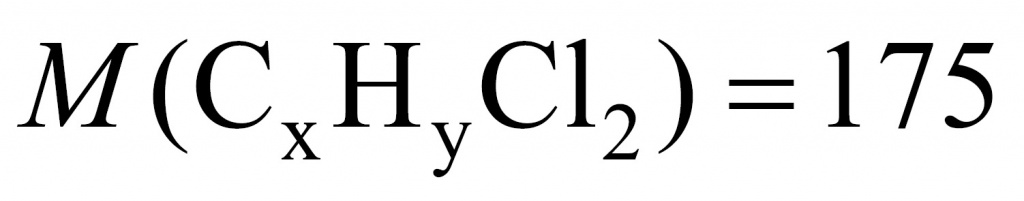
Теперь установим формулу. Обратимся к молекулярной записи. На углеводородную часть приходится 104. Сколько там может быть углеродов и водородов? Если углеродов 8 (что подходит), тогда на углероды приходится 96 и на водороды — 8.
Формула углеводорода C8H8.
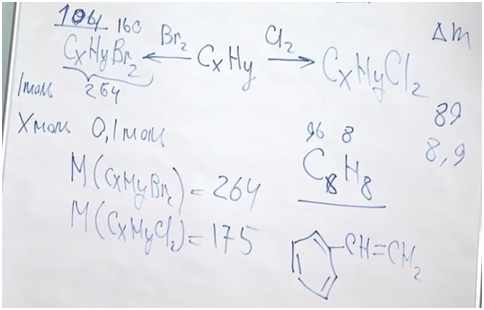
Разберемся, о каком углеводороде идет речь. Обратим внимание, что соединение непредельное, но оно способно присоединить только одну молекулу брома или одну молекулу хрома. Значит, исходя из малого числа атомов водорода по отношению к атомам углерода, скорее всего, это соединение есть не что иное, как производное бензола, то есть ароматическое соединение. В бензоле шесть атомов углерода и пять атомов водорода в остатке. У нас получается кетастирол.
Чтобы не было полимеризации, обычно в тот стирол, который можно купить в магазине, добавляют стабилизатор.
Уравнение полимеризации. Из n молекул стирола получается полимер, состоящий из n фрагментов.
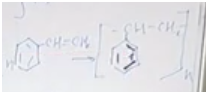
Полистирол — это, например, одноразовая посуда. Она наносит существенный вред окружающей среде, и сейчас идет речь о том, чтобы ее запретить.
Отдушка для мыла
Задача. Некоторое легкоплавкое вещество, обладающее приятным запахом, используют в качестве ингибитора полимеризации, в качестве отдушки для мыла. При сжигании этого вещества массой 8,4 г получили 11,2 л (н.у.) углекислого газа, 7,2 г воды. Установите структурную формулу неизвестного соединения, если известно, что оно не реагирует с бромной водой, но реагирует с водородом в присутствии катализатора. Известно, что это соединение может быть получено в результате прокаливания кальциевой соли органической кислоты. Составьте уравнение соответствующей химической реакции.
По данным задачи, углекислый газ составляет 0,1 моль, соответственно, столько же и углерода. Поскольку воды 7,2 г, что в молях 0,4, то водорода 0,8. Проверим на наличие кислорода. Масса углерода 6, масса водорода – 0,8. Поскольку общая масса сожженного вещества составляет 8,4, то на кислород приходится масса 1,6 (в молях 0,1). Получается молекулярная формула C5H8O.

Перейдем к структурой формуле вещества. Вещество не реагирует с бромной водой — из этого можно делать вывод, что нет кратных соединений (то есть двойных, тройных углерод-углеродных связей). Но вещество реагирует с водородом в присутствии катализатора. Исходя из условий, скорее всего, речь идет о двухосновной кислоте. В результате прокаливания, нагревания (в пределах 200–250°С) отщепляется карбонат кальция и образуется кетон циклопентанон.
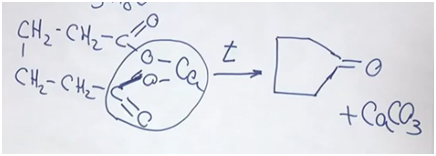
Циклопентанон как раз используют в качестве отдушки для мыла.
Ошибка А. М. Бутлерова
Задача. Установите структурную формулу альдегида, в определении которой немного ошибся великий А. М. Бутлеров, если известно, что в результате взаимодействия 100 г 0,9%-го раствора этого вещества с избытком раствора перманганата калия образуется осадок массой 3,48 г. Составьте уравнение реакции этого альдегида с раствором перманганата калия.
Все великие химики ошибались, в том числе и А. М. Бутлеров.
Для начала вспомним, как альдегиды взаимодействуют с перманганатом калия. Мы не знаем, о каком альдегиде идет речь. Допустим, у него была одна альдегидная группа (хотя, если в соединении две альдегидные группы, он все равно будет альдегидом). Возьмем также перманганат калия и мысленно нагреем. Мы получаем калиевую соль некой карбоновой кислоты, оксид марганца (IV) и гидроксид калия. Степень окисления углерода в альдегидной группе была +1, а стала +3. Получается, что углерод альдегид потерял два электрона. Марганец был +7, стал +4? значит, он принял три электрона. Так мы определили ключевые коэффициенты. Проблема состоит в том, что калия всего два атома. Можно сказать, что две молекулы были в форме соли, а одна молекула в форме кислоты. Поскольку гидроксида калия 3, мы видим, что его не хватает — вместо него будет вода.
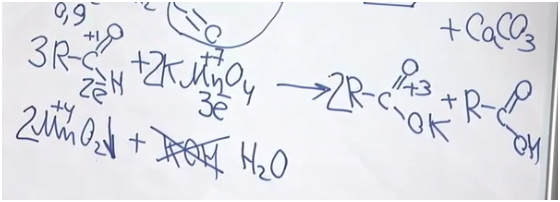
После составления уравнения найдем массу альдегида и массу осадка. Но осадок — это, разумеется, оксид марганца (IV).
Поскольку у нас 100 г 0,2%-го раствора и на 1% приходится 1 г, масса альдегида 0,9 г. Чтобы найти количество оксида марганца, 3,48 разделим на молярную масса оксида марганца — 87. Получаем 0,04 моль. В соответствии с этим уравнением альдегида у нас должно быть больше в полтора раза: 0,06 моль.
Найдем молярную массу альдегида.
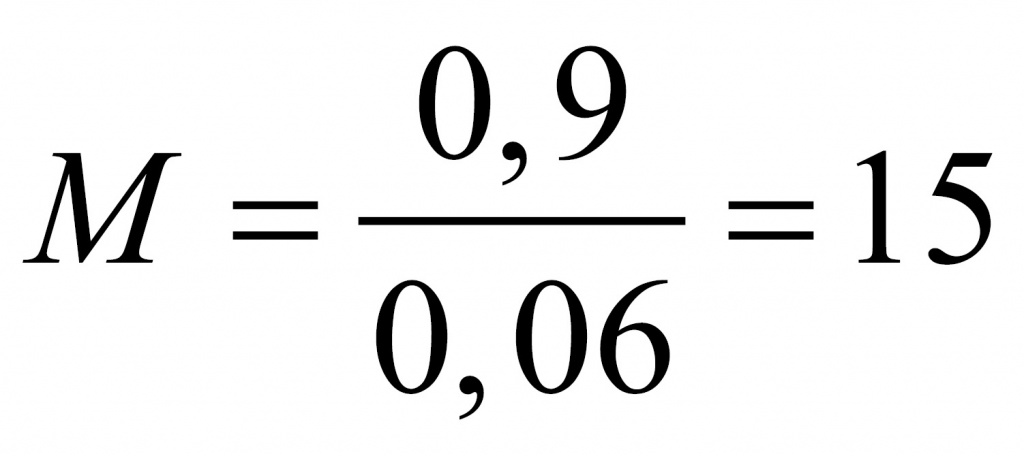
Где вы видели альдегид с молярной массой 15? Только на атом кислорода приходится 16. Значит, что либо альдегид содержал две альдегидные группы, либо это был формальдегид. Если бы он содержал две альдегидные группы, он бы отдал не два, а четыре электрона. Столько же отдал бы и формальдегид. Перманганат калия принимал бы три электрона. У оксида марганца (IV) было бы 4 моль. В этом случае оксида марганца 0,4 моль, а альдегида 0,3 моль.

Тогда
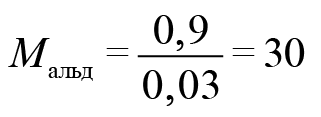
Следовательно, искомый альдегид — формальдегид. CH2O.
А. М. Бутлеров изначально определил формулу как C2H4O2.

Химия. 11 класс. Углубленный уровень. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова и продолжает курс химии для старшей школы, изложенный в учебнике «Химия. Углубленный уровень. 10 класс» данного авторского коллектива. Учебник предназначен для изучения химии на углублённом уровне. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
Купить
…ловая кислота
Задача. На полке в химической лаборатории стояла склянка с полустертой надписью. Единственное, что можно было разобрать: «…ловая кислота». Для установления состава кислоты провели ряд экспериментов. Для полной нейтрализации раствора, содержащего 0,36 г этой кислоты, понадобилось 50 мл 0,1-молярного раствора гидроксида натрия. Такая же навеска кислоты смогла обесцветить V = 80 мл (ω = 1%, ρ ≈ 1 г/мл) бромной воды. Восстановите надпись на склянке.
Обозначим формулу кислоты (будем считать, что она монокарбоновая). Если она одноосновная, то реакция идет один к одному. Найдем количество гидроксида натрия: 50 миллилитров 0,1-молярного раствора. У нас раствор, в одном литре которого содержится 0,1 моль вещества. Поскольку 50 мл — это в 20 раз меньше, то 0,1 разделим на 20. Получаем 0,005 гидроксида натрия. Столько же и карбоновой кислоты.
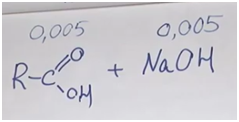
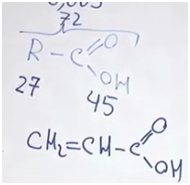
Отсюда легко находим молекулярную массу карбоновой кислоты.
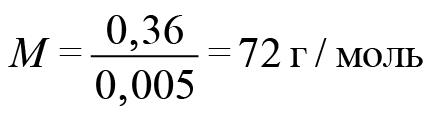
На карбоксильную группу приходится 45. Значит, на углеводородную часть приходится 27. В них поместятся два атома углерода и три атома водорода. Искомая кислота — акриловая.
Электроны
Задача. 0,800000 кг вещества содержит 0,2743 г электронов. Установите формулу вещества, если известно, что масса электрона равна 0,0005486 а.е.м.
Начнем с количества электронов. Масса электронов у нас известна и молярная масса тоже.
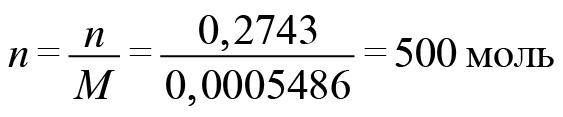
Число протонов равно количеству электронов:
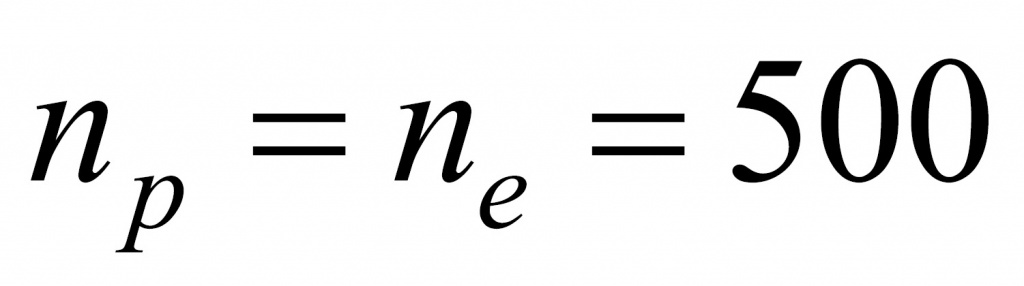
Отсюда находим массу, которая приходится на нейтроны (поскольку с точки зрения школьной химии любое число состоит из протонов, нейтронов и электронов). Обычно мы пренебрегаем массой электронов, но в данной задаче ей пренебрегать не нужно.
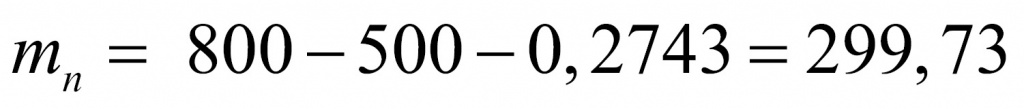
Получается интересное вещество. Обычно в атомах число нейтронов либо равно числу протонов, либо больше. В данном веществе протоны преобладают. Скорее всего, мы имеем дело с водородным соединением. Найдем соотношение между числом протонов и числом нейтронов.
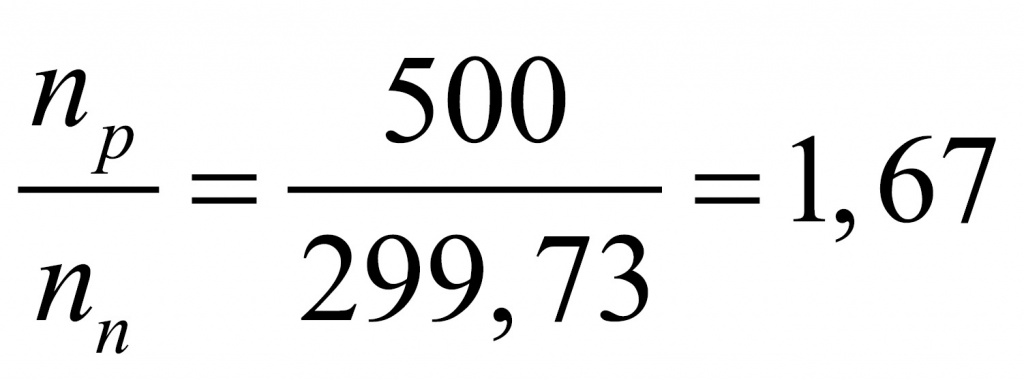
Если мы переберем водородные соединения элементов второго периода, то для метана получим, что в составе метана протонов буде 10, а нейтронов — 6.
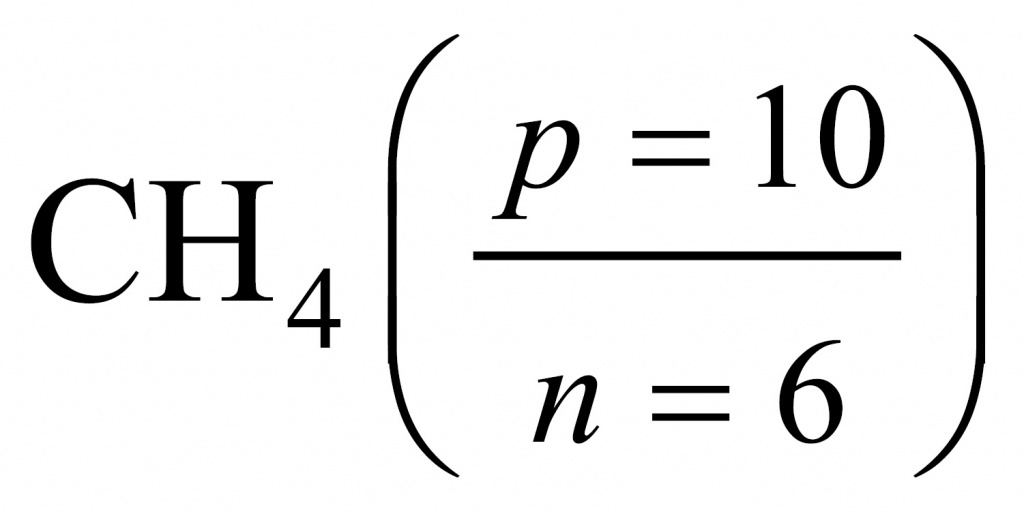
Поделив 10 на 6, получаем 1,67. Следовательно, искомым соединением был родоначальник предельных углеводородов, первый член гомологического ряда — метан.
#ADVERTISING_INSERT#
Загрузить PDF
Загрузить PDF
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-
1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-
2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-
3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-
4
Определите количество электронов. Протоны — это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-
5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-
6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер — это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-
1
Определите число ионов. Ион — это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-
2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-
3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 956 052 раза.
Была ли эта статья полезной?
Как определить общее число электронов в соединении?
Общее число электронов в соединении равно сумме электронов химических элементов этого соединения.
Число электронов химического элемента равно его порядковому номеру в периодической таблице: атом электронейтрален, а нумерация идет по заряду ядра. Каждый последующий химический элемент имеет заряд ядра на единицу больше, чем предыдущий. Водород +1, гелий +2, литий +3, бериллий +4, бор +5 и так далее.
При подсчете мы должны учитывать индексы (число атомов) элементов в соединении. Для этого число атомов данного химического элемента нужно умножить на число его электронов.
Примеры
Для начала рекомендую вам вспомнить, как определить общее число электронов в атоме?
Число электронов в молекуле хлора (Cl2) будет равно сумме электронов двух атомов хлора. Один атом хлора имеет 17 электронов, значит в молекуле хлора всего имеется 17 * 2 = 34 электрона.
Число электронов в молекуле воды (H2O) будет равно сумме электронов двух атомов водорода и одного атома кислорода: 1 * 2 + 8 = 10 электронов.
В молекуле глюкозы (C6H12O6) общее число электронов будет равно сумме электронов 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода: 6 * 6 + 12 * 1 + 6 * 8 = 36 + 12 + 48 = 96 электронов.
Суммарное число электронов в молекуле дактиномицина (C62H86N12O16) составляет собой сумму электронов 62 атомов углерода, 86 атомов водорода, 12 атомов азота и 16 атомов кислорода: 62 * 6 + 86 * 1 + 12 * 7 + 16 * 8 = 372 + 86 + 84 + 128 = 670 электронов.
Похожие вопросы:
– Как определить число протонов и нейтронов в атоме?
– Как определить общее число электронов в атоме?

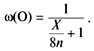
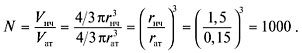





![{displaystyle [Ne]3s^{2}3p^{4}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/55fe9da9ab2a2a425fe5dfd58085632ae7c34af9)









