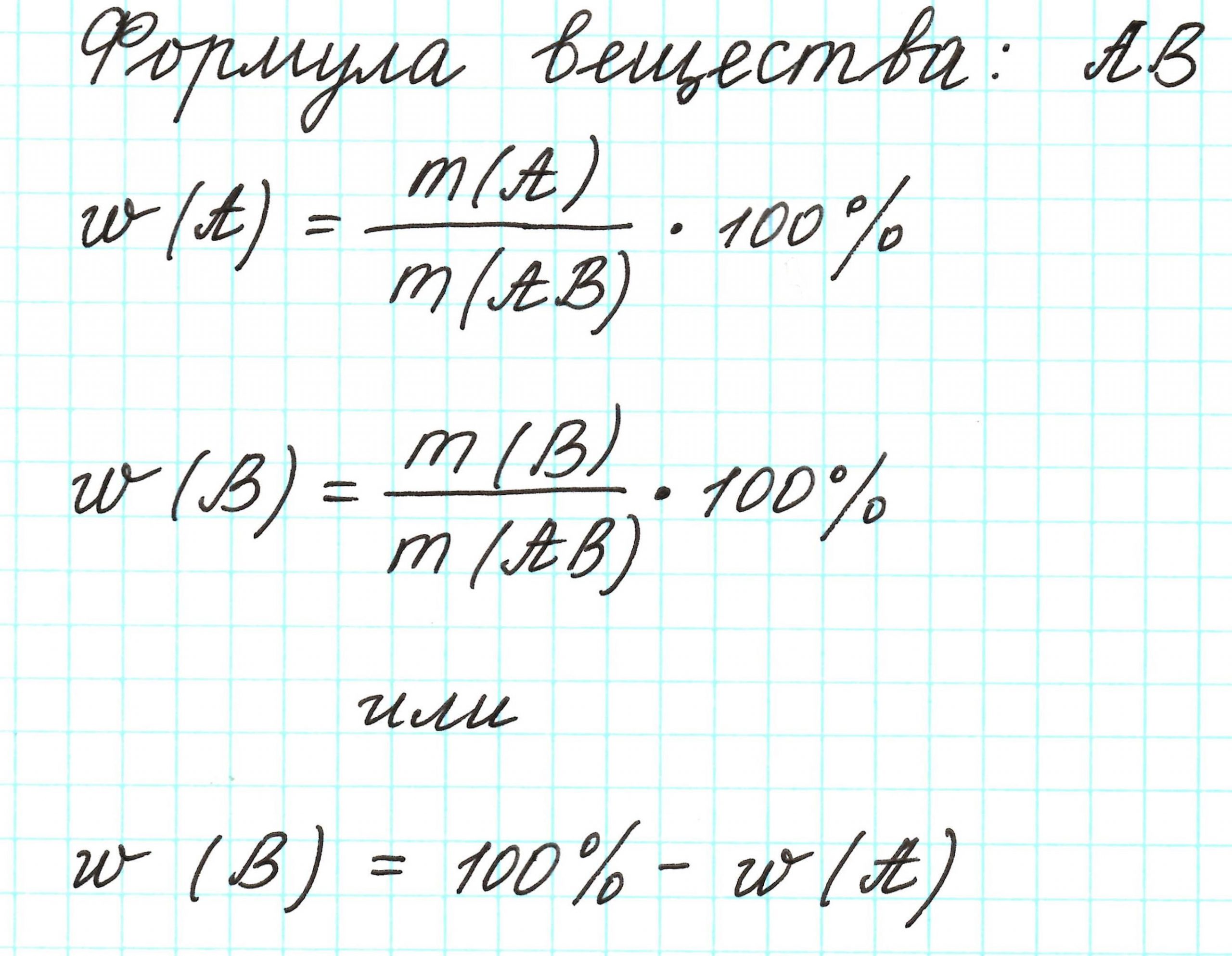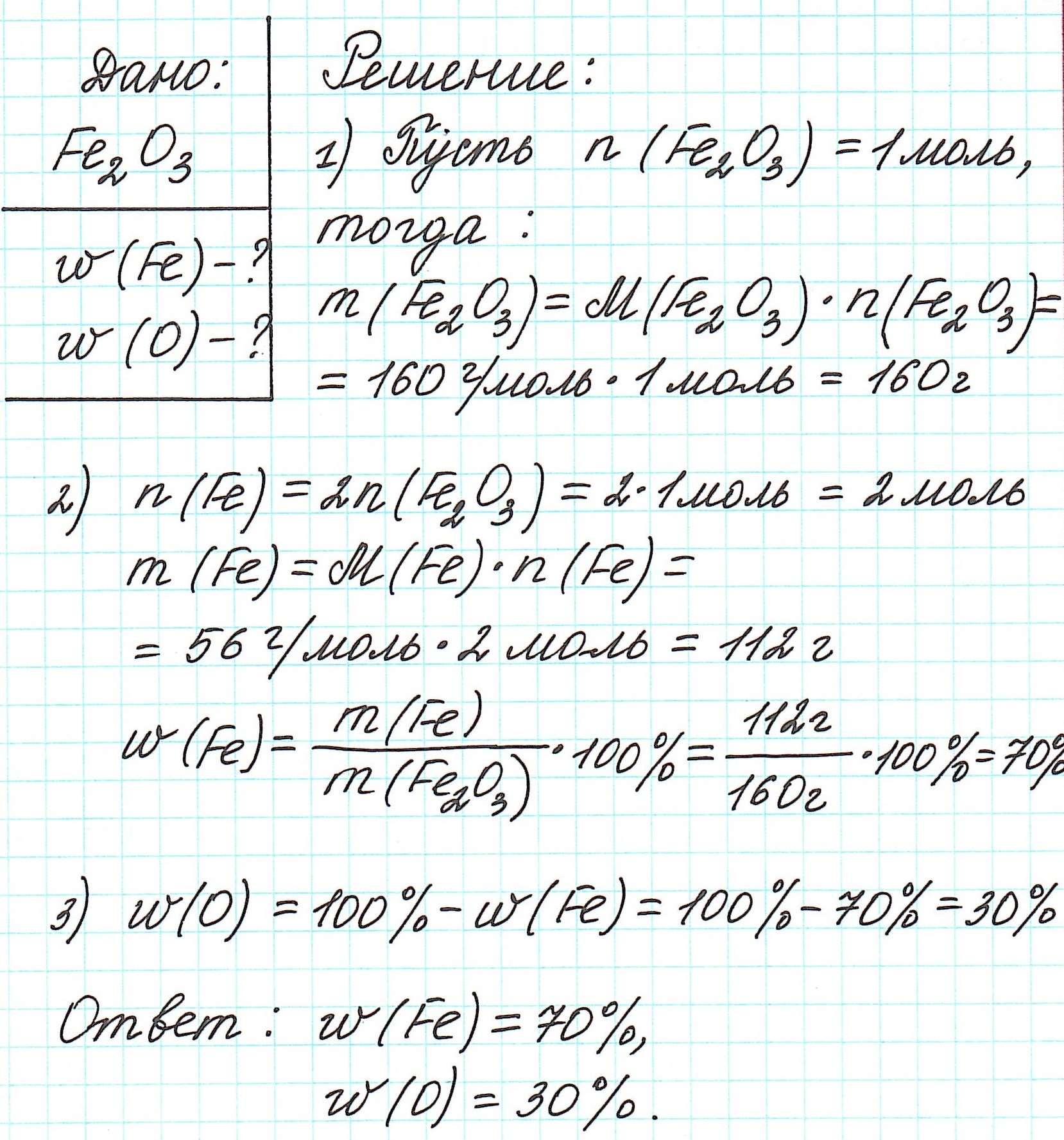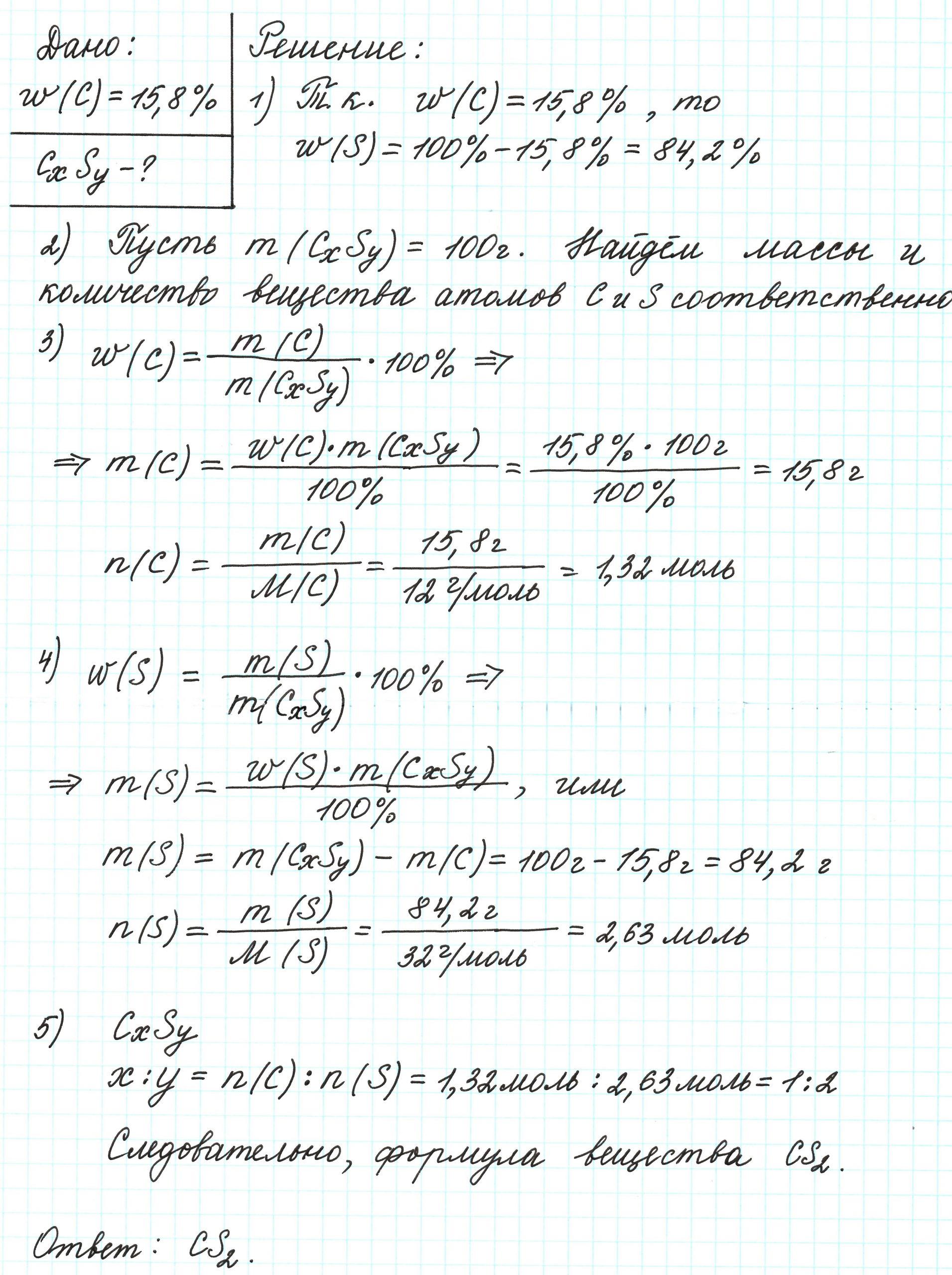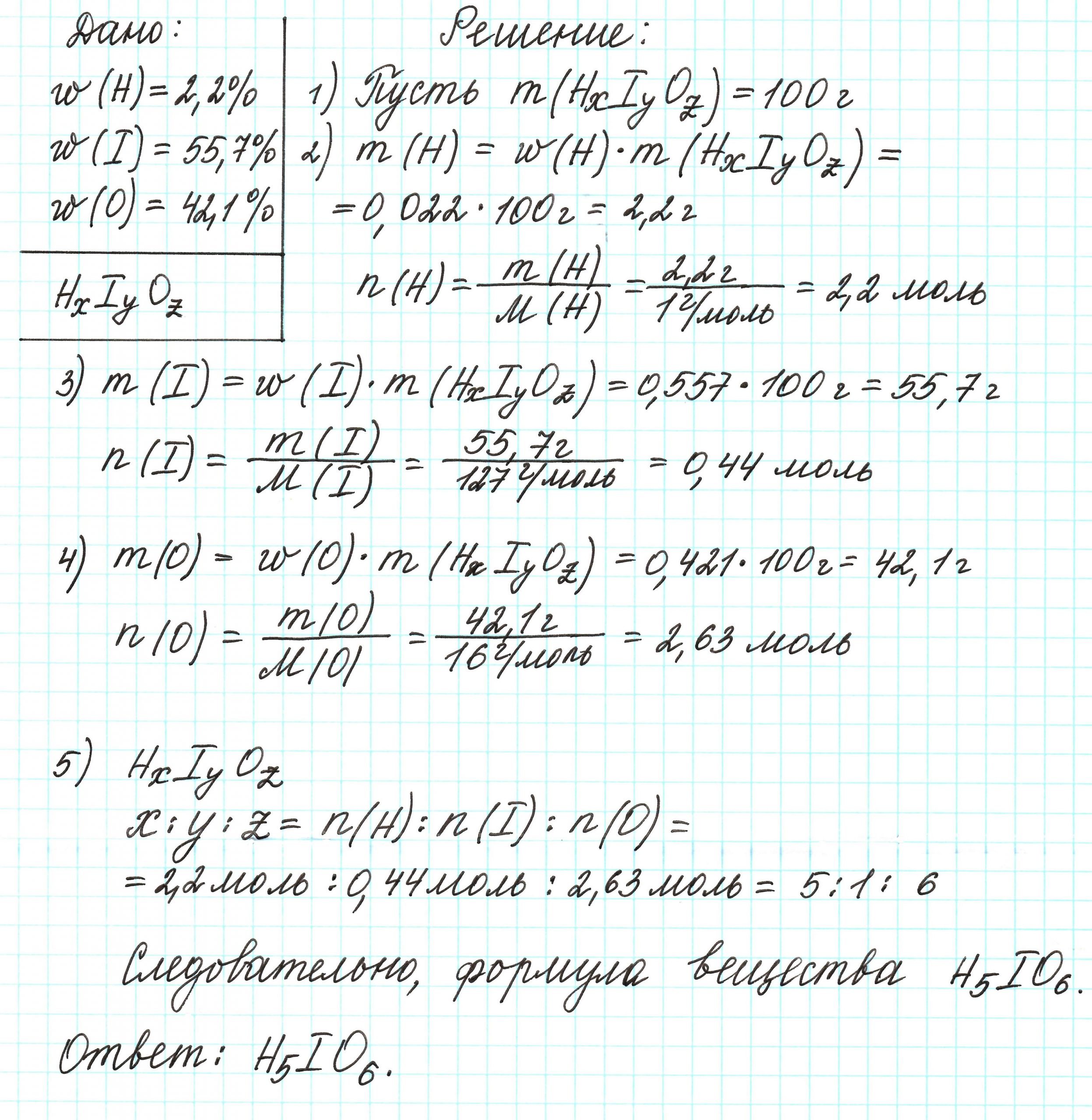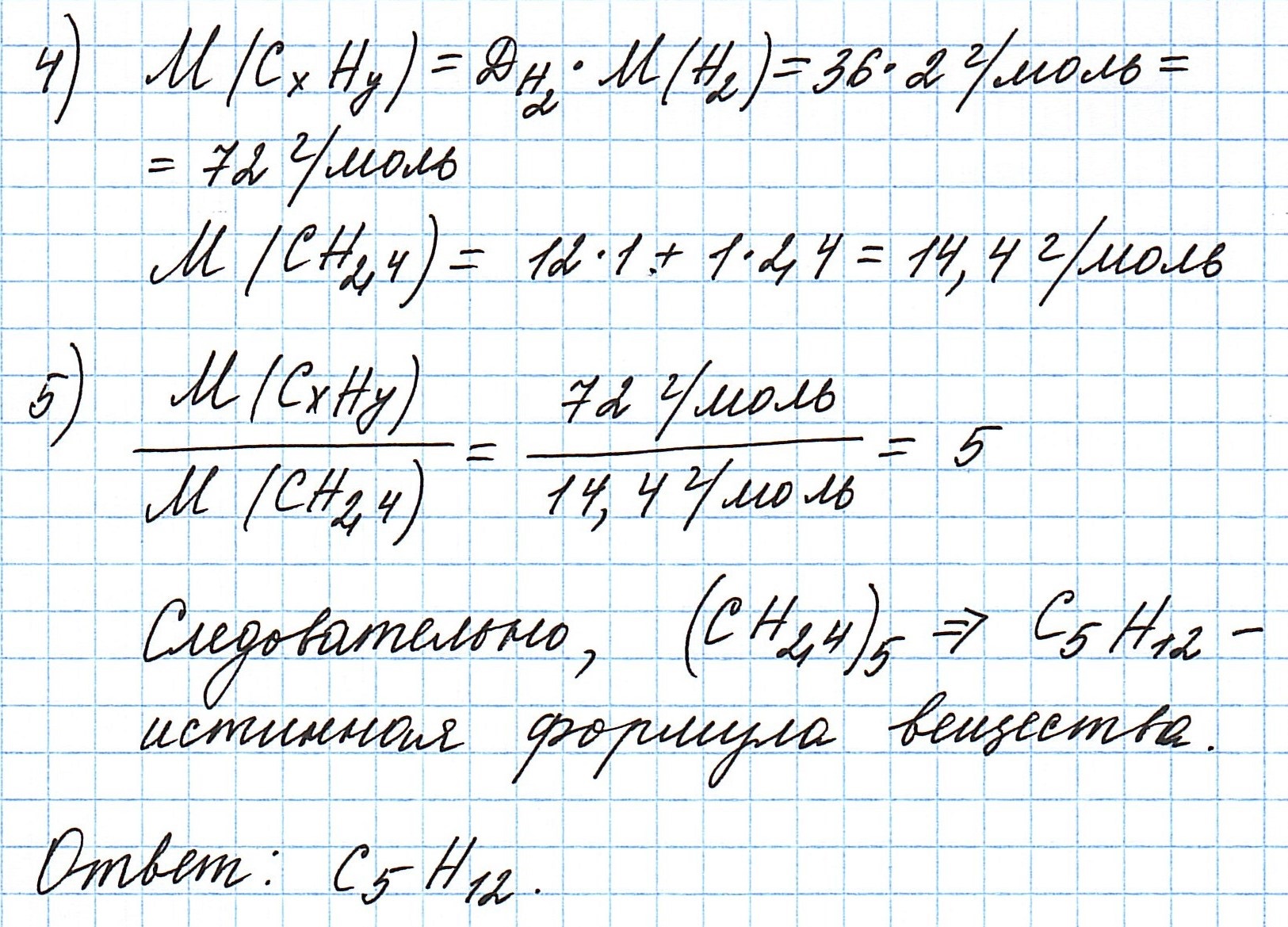По
формуле химического соединения можно
вычислить процентное содержание каждого
из элементов, образующих данное химическое
соединение.
Процентное
содержание элемента в веществе — это
отношение количества элемента,
содержащегося в молекуле вещества, к
массе всей молекулы, выраженное в
процентах.
Пример.
Вычислить процентное содержание меди
в оксиде меди (II)
CuO.
Решение:
Молекулярная
масса оксида меди (II)
CuO
равна 64+16=80. В 1 моле CuO,
масса которого 80 г , на долю Cu
приходиться 64 г , что составляет
от массы 1 моль. Чтобы выразить эту дробь
в процентах, надо умножить её на 100:
×100=80
Следовательно,
в оксиде меди (II)
CuO
содержится 80% меди.
Справочный
материал:
Массовая
доля — отношение массы растворённого
вещества к массе раствора. Массовая
доля измеряется в долях единицы или
процентах( долю умножают на 100%)
(*100%)
где:
m1
— масса растворённого вещества, г ;
m
— общая масса раствора.
Задания:
1)Вычислить
в перечисленных здесь веществах
процентное содержание элемента: а)
водорода в гашеной извести Ca(OH)2,
соляной кислоте HCl
и метане CH4;
б) кислорода в окиси меди CuO,
окиси ртути HgO,
окиси железа Fe2O3;
в) азота в азотной кислоте HNO3,
аммиаке NH3,
нашатыре NH4Cl;
г) серы в сернистом железе FeS,
сернистом газе SO2,
серной кислоте H2SO4.
(Ответ: а) 2,7%; 2,7%; 25% ; б)20,1%, 6,25%, 30,0%, в)22,22%,
82,4%, 26,2% , г)36,4%, 50,0%, 32,7%)
2)Технический
хлористый алюминий содержит 98% AlCl3;
остальное сосавляют примеси. Вычислить
процентное содержание хлора в этом
химическом продукте. (Ответ: 78,2%)
3)Неочищенный
сульфат магния содержит 96% MgSO4
( остальное — примеси, не содержащие
магния). Сколько магния содержит этот
химический продукт? (Ответ: 19,2%)
1.4 Вычисление процентного состава химического соединения по химической формуле соединения.
Результаты
химического анализа веществ принято
выражать процентным содержанием
элементов, образующих исследуемое
химическое соединение. Вычислить
процентный состав сложного вещества —
это определить процентное содержание
каждого элемента, входящего а его состав.
Пример.
Вычислить процентный состав едкого
натра NaOH.
Решение:
Молекулярная
масса NaOH
равна 23+16+1=40.
1
моль=40 г.
Вычисляем
процентное содержание натрия:
×100=57,5
(%).
Вычисляем
процентное содержание кислорода:
×100=40
(%).
Вычисляем
процентное содержание водорода:
×100=2,5
(%).
Ответ:
в едком натре содержится натрия — 57,5%,
кислорода — 40% и водорода — 2,5%.
Задания:
1)Сколько
азота содержится в: а) натриевой селитре
NaNO3;
б) сульфате аммония (NH4)2SO4;
в) цианамиде кальция CaCN2?
(Ответ: а)16,47%; б)21,21%; в)35% )
2)Сколько
фосфора находится в: а) 1 кг костяной
муки, содержащей 88% Ca3(PO4)2;
б) 2 т фосфоритной муки, содержащей 82%
Ca3(PO4)2;
в) 0,5 т двойного суперфосфата, содержащего
92% Ca(H2PO4)2?
(Ответ: а) 0,176 кг; б) 164кг; в) 50,34 кг.)
3)Вычислить
процентный состав следующих веществ:
а) едкого кали KOH;
б) угольной кислоты H2CO3;
в) сернистой кислоты H2SO3;
г) хлористого хрома CrCl2;
д) сернокислого кальция CaSO4;
е) азотнокислого магния Mg(NO3)2;
ж) сернокислого железа Fe2(SO4)3;
з) Фосфорнокислого кальция Ca3(PO4)2;
и) соды Na2CO3;
к) известняка CaCO3.
(Ответ: а)70,2%, 28,1%, 1,75%, б)3,22%, 19,35, 77,4%; в)
5,2%; 39%; 55,8%; г) 42,6%, 57,3%; д) 29,4%, к) 40%; 12%; 48%);
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Загрузить PDF
Загрузить PDF
Эмпирическая формула химического соединения представляет собой простейшую запись его состава. Эмпирическую формулу вещества можно определить по массе каждого входящего в него элемента, по весовым процентам элементов или по молекулярной формуле соединения.
-
1
Посмотрите, что дано. Если дан элементный состав неизвестного соединения в процентах, а не в граммах, следует предположить, что имеется ровно 100,0 граммов этого вещества.
- Ниже приведена процедура определения эмпирической формулы в том случае, если элементный состав дан в процентах. Если состав неизвестного соединения дан в граммах, перейдите к разделу «Использование веса в граммах».
- Пример: определите эмпирическую формулу соединения, которое состоит из 29,3% Na (натрий), 41,1% S (сера) и 29,6% O (кислород).
-
2
Определим количество граммов каждого элемента. Если мы предположим, что имеется 100 граммов неизвестного соединения, то количество граммов каждого элемента соответствует его процентному содержанию.
- Пример: в 100 граммах неизвестного вещества содержится 29,3 г Na, 41,1 г S и 29,6 г O.
-
3
Переведите массу каждого элемента в моли. Массу каждого входящего в соединение элемента следует перевести в моли. Для этого массу необходимо умножить на 1 моль и разделить на атомный вес соответствующего элемента.
- Проще говоря, следует разделить массу каждого элемента на его атомный вес.
- Учтите также, что при данных расчетах необходимо брать не менее четырех значимых цифр.
-
Пример: для соединения, которое состоит из 29,3 г Na, 41,1 г S и 29,6 г O, получаем:
- 29,3 г Na * (1 моль Na / 22,99 г Na) = 1,274 моль Na
- 41,1 г S * (1 моль S / 32,06 г S) = 1,282 моль S
- 29,6 г O * (1 моль O / 16,00 г O) = 1,850 моль O
-
4
Разделите найденное число молей каждого элемента на наименьшее количество молей. Следует найти стехиометрическое соотношение между элементами — это означает, что необходимо вычислить относительные доли каждого элемента по сравнению с остальными элементами, входящими в состав соединения. Для этого разделите каждое количество молей на наименьшее число молей.
-
Пример: наименьшее число молей в данном соединении составляет 1,274 моль (количество молей Na, натрия).
- 1,274 моль Na / 1,274 моль = 1,000 Na
- 1,282 моль S / 1,274 моль = 1,006 S
- 1,850 моль O / 1,274 моль = 1,452 O
-
Пример: наименьшее число молей в данном соединении составляет 1,274 моль (количество молей Na, натрия).
-
5
Умножьте полученные величины на коэффициент так, чтобы получились близкие к целым числа. Соотношение молей каждого элемента может не равняться целому числу. Это не проблема в случае малых отклонений от целого числа, которые не превышают одну десятую. Однако в случае более значительных отклонений следует умножить эти величины на один и тот же множитель, чтобы они стали близки к целым числам.
- Если соответствующая величина для одного элемента близка к 0,5, умножьте каждое значение на 2. Схожим образом, если для одного элемента число близко к 0,25, умножьте каждую величину на 4.
-
Пример: поскольку количество кислорода (O) близко к 1,5, чтобы приблизить его к целому значению, необходимо умножить каждую величину на “2”.
- 1,000 Na * 2 = 2,000 Na
- 1,006 S * 2 = 2,012 S
- 1,452 O * 2 = 2,904 O
-
6
Округлите полученные величины до ближайших целых чисел. Даже после последнего шага количество молей каждого элемента может слегка отличаться от целого числа. Поскольку в эмпирических формулах не используются десятичные дроби, необходимо округлить каждое значение до ближайшего к нему целого числа.
-
Пример: для определенных на предыдущем шаге значений получаем:
- 2,000 Na можно записать как 2 Na;
- 2,012 S можно округлить до 2 S;
- 2,904 O можно округлить до 3 O.
-
Пример: для определенных на предыдущем шаге значений получаем:
-
7
Запишите окончательный ответ. Переведите соотношение элементов в стандартную запись, которая используется для эмпирических формул. Количество каждого элемента в молекуле соединения записывается в виде подстрочного числа справа от символа соответствующего элемента (в случае единицы это число опускается).
- Пример: если соединение состоит из 2 частей Na, 2 частей S и 3 частей O, его эмпирическая формула записывается следующим образом: Na2S2O3
Реклама
-
1
Убедитесь, что количество элементов дано в граммах. Если элементный состав неизвестного соединения дан в граммах, используйте приведенные ниже шаги.
- С другой стороны, если вместо граммов даны проценты, перейдите к разделу «Использование весовых процентов».
- Пример: определите эмпирическую формулу неизвестного соединения, которое состоит из 8,5 г Fe (железо) и 3,8 г O (кислород).
-
2
Переведите массу каждого элемента в моли. Чтобы определить долю каждого элемента в молекуле соединения, необходимо перевести количество каждого элемента из граммов в моли. Для этого разделите массу каждого элемента в граммах на его атомный вес.
- При более формальном подходе следует умножить массу в граммах на один моль и разделить на атомный вес.
- Учтите, что для достаточной точности атомный вес необходимо округлить до четырех значимых цифр.
-
Пример: для 8,5 г Fe и 3,8 г O получаем:
- 8,5 г Fe * (1 моль Fe / 55,85 г Fe) = 0,152 моль Fe
- 3,8 г O * (1 моль O / 16,00 г O) = 0,238 моль O
-
3
Разделите количество молей каждого элемента на наименьшее значение. Определите, как каждый элемент соотносится с другими элементами, входящими в данное соединение. Для этого необходимо найти минимальное количество молей и разделить на него число молей каждого элемента.
-
Пример: для нашего случая минимальное количество молей составляет 0,152 (количество Fe, железа).
- 0,152 моль Fe / 0,152 моль = 1,000 Fe
- 0,238 моль O / 0,152 моль = 1,566 O
-
Пример: для нашего случая минимальное количество молей составляет 0,152 (количество Fe, железа).
-
4
Умножьте полученные значения, чтобы найти числа, близкие к целым. Часто количество молей не равно целому числу. Если отклонение от целого числа не превышает одной десятой, такое число можно просто округлить до целого. Однако в случае более значительного отклонения следует умножить каждое значение на такой коэффициент, чтобы получились близкие к целым числа.
- Например, если количество одного элемента превышает целое число примерно на 0,25, умножьте все значения на 4. Если же отклонение составляет около 0,5, умножьте все величины на 2.
-
Пример: поскольку соотношение для кислорода составляет 1,566, необходимо умножить оба соотношения на 2.
- 1,000 Fe * 2 = 2,000 Fe
- 1,566 O * 2 = 3,132 O
-
5
Округлите ответ до ближайшего целого числа. После того как соотношения для всех элементов не будут отличаться от целых чисел более чем на одну десятую, округлите их.
- Пример: количество Fe можно записать как 2. Количество O можно округлить до 3.
-
6
Запишите ответ. Найденное соотношение элементов следует переписать в форме, принятой для эмпирических формул. Полученные целые числа (за исключением 1) необходимо записать в виде подстрочных символов справа от символа соответствующего элемента.
- Пример: для соединения 2 частей Fe и 3 частей O эмпирическая формула имеет следующий вид: Fe2O3
Реклама
-
1
Определите, можно ли сократить подстрочные числа. Если дана молекулярная формула неизвестного соединения и требуется определить эмпирическую формулу, проверьте, нельзя ли сократить количество атомов. Посмотрите на подстрочные числа возле каждого элемента. Если все они имеют общий делитель (отличный от 1), понадобится несколько шагов, чтобы определить эмпирическую формулу соединения.
- Пример: C8H16O8
- С другой стороны, если подстрочные числа не имеют общего делителя, молекулярная формула является эмпирической формулой.
- Пример: Fe3O2H7
-
2
Найдите наибольший общий делитель подстрочных чисел. Выпишите делители для каждого подстрочного числа и определите максимальный общий делитель.
-
Пример: соединение C8H16O8 имеет подстрочные числа «4» and «8».
- Число 8 имеет следующие делители: 1, 2, 4, 8
- Число 16 имеет следующие делители: 1, 2, 4, 8, 16
- Число 8 является наибольшим общим делителем.
-
Пример: соединение C8H16O8 имеет подстрочные числа «4» and «8».
-
3
Разделите каждое подстрочное число на наибольший общий делитель. Чтобы привести каждое подстрочное число к простейшей форме, необходимо разделить его на только что найденный наибольший общий делитель.
-
Пример: для C8H16O8 получаем:
- Делим подстрочное число 8 на наибольший общий делитель 8: 8 / 8 = 1
- Делим подстрочное число 16 на наибольший общий делитель 8: 16 / 8 = 2
-
Пример: для C8H16O8 получаем:
-
4
Запишите ответ. Замените первоначальные подстрочные числа их упрощенными значениями. Таким образом вы определите эмпирическую формулу соединения по его молекулярной формуле.
- Помните, что если подстрочное число равно 1, то его обычно не записывают.
- Пример: C8H16O8 = CH2O
Реклама
Об этой статье
Эту страницу просматривали 7903 раза.
Была ли эта статья полезной?
Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
Содержание:
1.Понятие простейшей и истинной формулы вещества
2.Массовая доля химического элемента: что означает и как высчитывается
3.Как определить формулу вещества по массовым долям элементов
4.Как определить формулу органического соединения:
4.1. по общей формуле вещества
4.2. по продуктам сгорания вещества
5. Как определить формулу вещества: комбинированные задачи
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Простейшая, или иными словами, эмпирическая формула, указывает на соотношение атомов в молекуле (или в формульной единице, если речь идет о не ковалентном соединении).
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Истинная формула, или иначе молекулярная, отражает действительное количество атомов всех элементов в молекуле.
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.Массовая доля химического элемента: что означает и как высчитывается
Массовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Ну, а теперь проще.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Массовая доля элемента обозначается греческой буквой «омега» — ω. И записывается, например, так: ω(Н), ω(Сl), ω(С) и т.д. и рассчитывается:
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Из данных задачи следует, что углеводород может находиться в газообразном состоянии, так как известна плотность его паров. Эта величина всегда требуется для нахождения молярной (относительной молекулярной) массы вещества. Как она находится и что это такое читайте подробнее здесь.
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.
Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
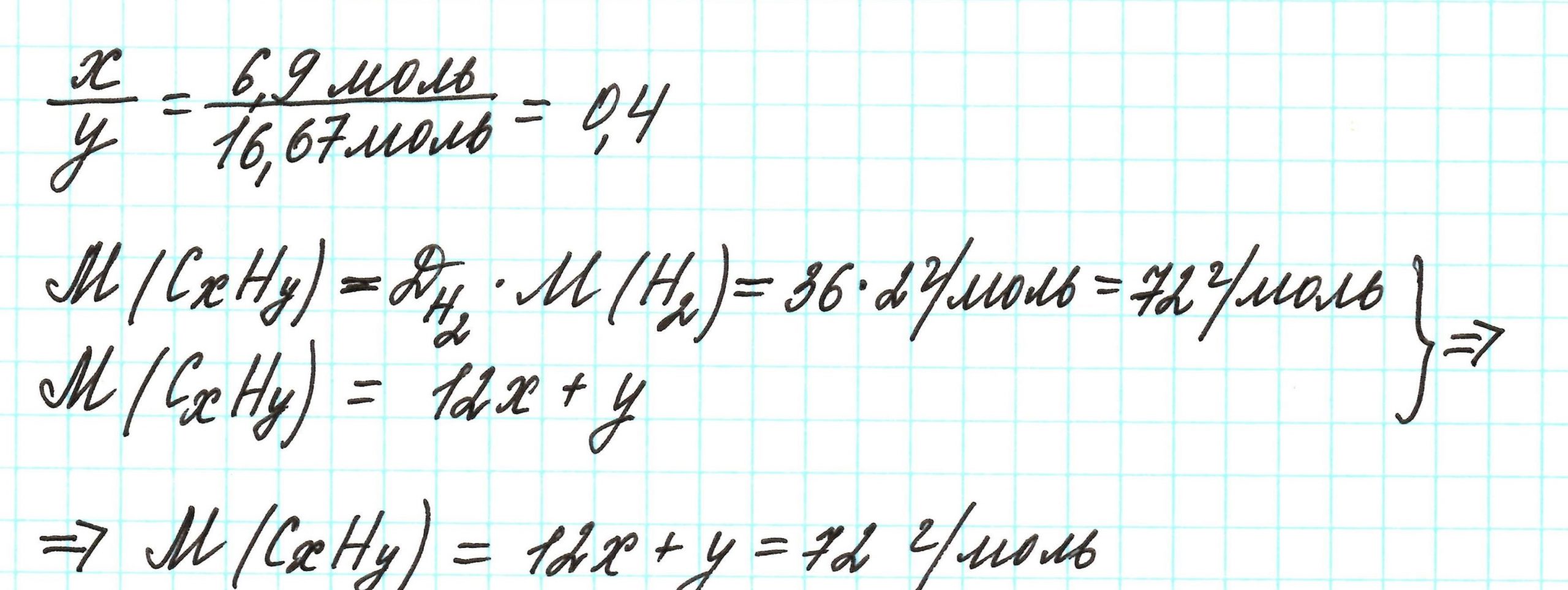
Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
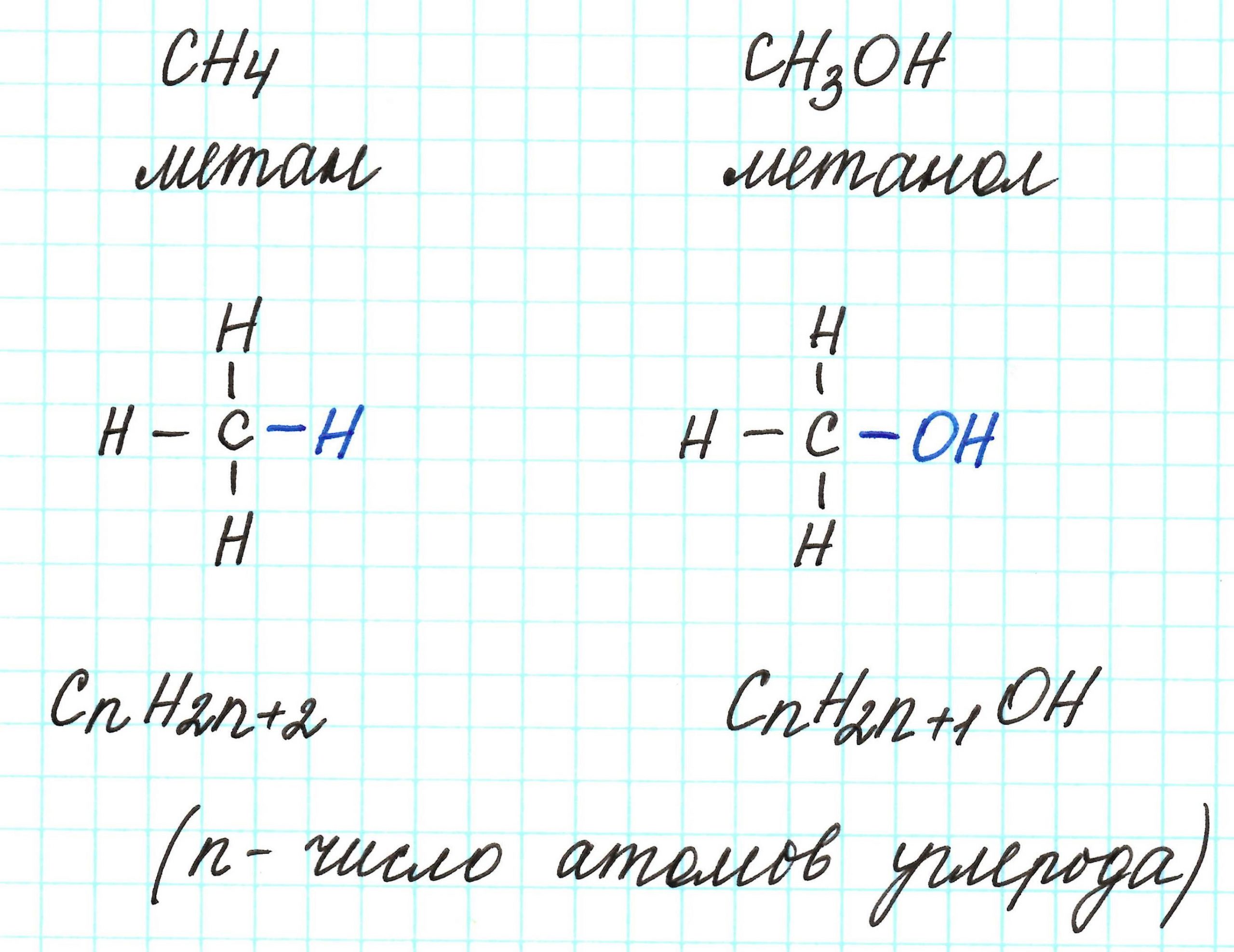
К слову, метан СН4 является представителем алканов, в молекулах которых на n атомов углерода и приходится 2n+2 атомов водорода. Алканы имеют общую молекулярную формулу, отражающую их состав: СnH2n+2.
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
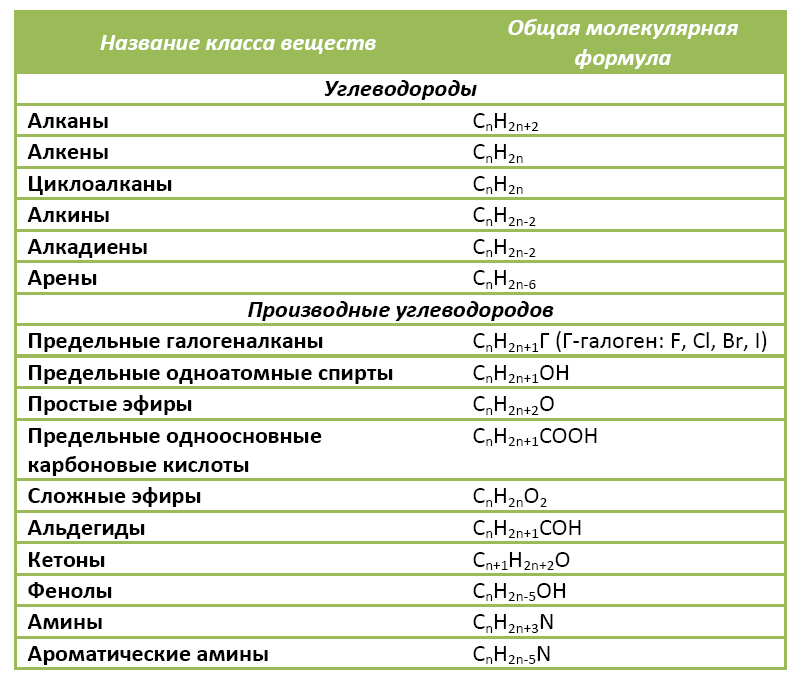
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?

4.2. Как определить формулу органического соединения
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.
Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.

5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
В этой задаче:
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.
Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.
Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.
Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
В этой задаче:
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.
Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Как рассчитать процентную концентрацию раствора?
Процентный состав по массе (%) Это масса растворенного вещества, деленная на массу раствора (масса растворенного вещества плюс масса растворителя), умноженная на 100.
Как рассчитать концентрацию вещества?
Поделите массу растворенного вещества на общий объем раствора. Запишите уравнение C = m/V, где m — масса растворенного вещества и V — общий объем раствора. Подставьте величины массы и объема и выполните деление, чтобы определить концентрацию раствора.
Как сделать 5% раствор?
Чтобы приготовить 5% раствор нужно 5 г марганцовки и 100 мл воды. Первым делом наливаем воду в приготовленную ёмкость, следом добавляем кристаллы. Затем все это перемешать до равномерного и насыщенного фиолетового окраса жидкости.
Как определить процентное содержание вещества в растворе?
Если известно процентное содержание вещества, то его концентрация находится по формуле: К=р/100% к — концентрация вещества; р — процентное содержание вещества (в процентах).
Как определить скольки процентный раствор?
Процентная концентрация (С%) вещества в растворе численно равна массовой доле растворенного вещества, выраженной в процентах. Определяется по формуле: С% вещества = (m вещества/ m раствора.) * 100%. Величина процентной концентрации показывает, сколько грамм вещества содержится в 100 г раствора.
Как определить концентрацию солевого раствора?
Солевой раствор. Солевой раствор –это количество соли в 100 г раствора или количество граммов соли на 100 г воды, но при этом концентрация будет разная. Например: если в 100 г солевого раствора содержится 25 г соли и 75 г воды, то концентрация соли равна 25 * 100 / 100 = 25 %;
Как сделать 10% раствор соли?
10—процентный раствор — это девять частей воды и одна часть соли. Например, на 10 граммов соли вам понадобится 90 граммов воды. Воду лучше брать чуть теплую, чтобы соль быстрее растворилась.
Как получить 3% раствор?
Для ранневесеннего опрыскивания (до распускания почек) готовят 3%-й раствор: 300 г медного купороса и 225 г гашеной извести-пушонки на 10 литров воды. Получается пропорция 1:0,75, хотя очень часто берут и 1:1 (300 г медного купороса и 300 г гашеной извести-пушонки на 10 литров воды).
Как определить плотность солевого раствора?
Ареометр общего назначения АОН-1 1360-1420 кг/м³ Ареометр АОН-1 подходит для измерения плотности любой жидкости (в том числе солевых растворов, кислот, солей, нефтепродуктов, химических соединений), а также растворов (например, цемент, бетон, строительные смеси и т. д.).
Как рассчитать количество вещества в растворе?
Количество растворенного вещества : = c•V, где c – молярная концентрация растворенного вещества в моль/л, V – объем раствора в л. где m(р-ра) – масса раствора в г, – массовая доля растворенного вещества.
Как можно найти массу раствора?
Масса раствора определяется по формуле m (раствора)= m (масса растворенного вещества)/ w (массовая доля растворенного вещества). Или m = r (плотность раствора — г/см3) * V (объем раствора). А как найти массу раствора, если изветны только массы воды и растворённого вещества?
Как приготовить раствор с заданной концентрацией?
ПРИГОТОВЛЕНИЕ РАСТВОРА ЗАДАННОЙ КОНЦЕНТРАЦИИ СМЕШИВАНИЕМ РАСТВОРОВ БОЛЕЕ ВЫСОКОЙ И БОЛЕЕ НИЗКОЙ КОНЦЕНТРАЦИИ. Раствор можно готовить, непосредственно вводя рассчитанное количество вещества в растворитель, или путем разбавления более концентрированных растворов до требуемого значения концентрации.
Как сделать 1 процентный раствор?
Как приготовить раствор Если вы хотите получить 1—процентный раствор любого вещества, то растворяете 10 г вещества в литре воды (или 100 г в 10 литрах). Соответственно, 2-процентный раствор содержит 20 г вещества в литре воды (200 г в 10 литрах) и так далее.
Что называют насыщенным раствором?
Насыщенным называют такой раствор, в котором при данной температуре вещество больше не растворяется. Если же при этой температуре в 100 г воды растворить хлорида калия меньше, чем 34,4 г, то раствор будет ненасыщенным.
Что необходимо для приготовления раствора?
Для приготовления раствора с определённой массовой долей растворённого вещества надо:
- вычислить массу растворённого вещества;
- вычислить массу (или объём) растворителя;
- взвесить вещество;
- отмерить растворитель;
- смешать вещества.
Как получить 10% раствор?
10-процентный раствор — это девять частей воды и одна часть соли. Например, на 10 граммов соли вам понадобится 90 граммов воды. Воду лучше брать чуть теплую, чтобы соль быстрее растворилась.
Что понимается под раствором?
Раство́р — однородная (гомогенная) система, в состав которой входят молекулы (атомы, ионы) двух или более типов, причём доля частиц каждого типа может непрерывно меняться в определённых пределах.
Какая система называется раствором?
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов). По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми.
Как изменяется растворимость веществ с изменением температуры?
При повышении температуры растворимость твердых веществ обычно увеличивается, а газов — уменьшается.
Что такое растворимость какая существует зависимость между изменением температуры?
Растворимость – максимально возможное число граммов вещества, которое может раствориться в 100 г растворителя при данной температуре. С повышением температуры растворимость большинства твердых веществ увеличивается, а растворимость газов снижается.
Что такое растворимость От каких факторов зависит?
Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры. Все вещества в той или иной степени растворимы в растворителях.
Какой фактор увеличивает растворимость?
Растворимость большинства твердых веществ в воде увеличивается с повышением температуры, растворимость газов, наоборот растворимость газов, наоборот уменьшится. На растворимость жидкостей, как смешивающихся, так и не смешивающихся с водой, температура практически не влияет.
Как влияет температура на взаимную растворимость жидких веществ и нерастворимых веществ в воде?
На растворимость жидкостей температура практически не влияет.
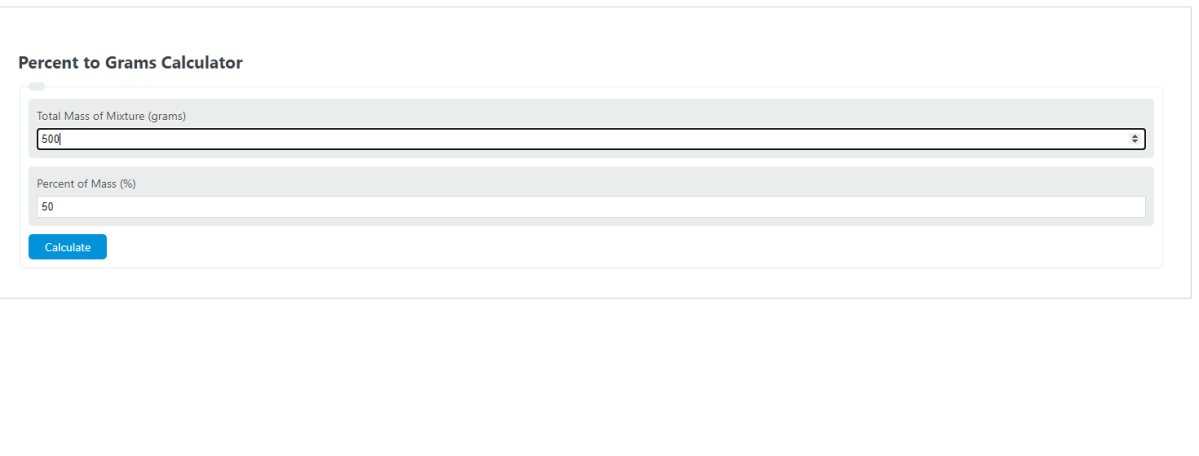
Enter the percentage of the total mass the substance or object takes up, and the total mass of the entire solution/mixture to determine the total number of grams of the substance.
- Percent Mixture Calculator
- Percent Solution Calculator
- Percent Volume Calculator
- Concentration Volume Calculator
- Mass to Concentration Calculator
Percent to Grams Formula
The following formula is used to calculate the percent of a substance in grams.
- Where G is the total number of grams of substance
- TM is the total mass of the solution/mixture (grams)
- POM is the percent of the mass of the entire mixture that the substance takes up (%)
To calculate grams from percentage, multiply the total mass of the mixture by the percentage of mass, then divide by 100.
How do you convert percentage to grams?
While percentage and grams can obviously not be converted to one another directly because one is a dimensionless ratio and the other is a unit of mass, you can calculate the number of grams of a substance in an entire mixture using the percentage of mass.
To do this, take the total mass of the solution and multiply it by the percentage of the mixture that is the substance.
How to calculate grams from percentage?
Example Problem:
The following example problem outlines the steps and information needed to calculate grams from percentage.
First, determine the total percentage of mass that the substance takes up. For this example, the substance takes up 50% of the total mass.
Next, determine the total mass of the mixture. In this case, the total mass is measured to be 500 grams.
Finally, calculate the number of grams using the formula above:
G = TM * POM / 100
G = 500 * 50 / 100
G = 250 grams