|
Посмотрим на гениальную таблицу «Периодическая система элементов» от русского ученого Дмитрия Менделеева. Таблица Дмитрия Менделеева весьма стройная и системная. Она отвечает на многие вопросы, в том числе и на заданный вами. Максимальное число электронов на энергетическом уровне: где n — номер энергетического уровня система выбрала этот ответ лучшим Вита75 8 лет назад Таблица Менделеева состоит из 8-ми столбцов, соответственно элементы в 1-ом столбце будут иметь по 1 электрону на внешнем слое , а в 8-ом по 8. Собственно количество электронов и определяет свойства элемента, (например щелчные металлы очень активны, а энертвые газы наоборот фактически не вступают ни в какие реакции). это связано с тем, что чем меньше электронов на внешнем слое тем их легче потерять, и труднее захватить свободный электрон при потере. Так же есть такие элементы как изотопы, которые при одинаковом количестве электронов на внешней оболочке имеют кординально разные свойства. (например дейтерий и тритий) оба имеют по 1-му электрону, но ядро дейтерия состоит из положительно заряженного протона и нейтрального нейтрона, он стабилен и относится скорее к водороду (тяжелый водород), а тритий, состоящий из протона и 2-ух нейтронов, радиактивен и по свойствам ближе к литию. В порироде не встречается из-за короткой живучести (период полураспада примерно 12 лет). Так к слову, есть такой изотоп кальция 48, имеется в виду что у него не 40 нейтронов в ядре как у обычного кальция у нас в костях, а 48, радиактивен, (в природе встречается крайне редко), нарабатывается в атомных реакторах, обстрелом нейтронами, несколько грамм за год. Служит для получения сверхтяжелых элементов (путем обстрела мишени из урана, плутония и т.д.). на данный момент самый дорогой элемент, 1 грамм стоит около 400000 евро. Чосик более года назад Для этого потребуется таблица Менделеева. В ней восемь групп, которые представлены как восемь столбиков. И как раз номер группы указывает, сколько электронов у элемента на последнем внешнем уровне. Например, берем водород — Н. Он относится к первой группе, идет первым. А мы знаем, что порядковый номер элемента совпадает с числом электронов на обиталях и с числом протонов в ядре. И у водорода на s-орбитали один электрон. Теперь берем литий — Li. Он также относится к первой группе, идет третьим. Его s-орбиталь заполнена, там два электрона. А последний, третий, находится на второй s-орбитали. Номер же периода указывается на число энергетических уровней. Литий относится ко второму периоду, потому у него два энергетических уровня. KritikSPb 4 года назад Чтобы определить, сколько электронов на внешнем энергетическом уровне, нужно открыть Периодическую таблицу Менделеева. В ней расположено 8 групп элементов. Номера группы и соответствуют количеству электронов на внешнем уровне. Например, элементы Гелий, аргон, железо, криптон, рутений, ксенон, осмий и радон принадлежат к восьмой группе, значит и электронов на внешнем уровне 8. У лития, натрия и калия — по одному электрону, у берилия, магния и кальция — 2, у алюминия — 3, у кремния и титана — по 4, у серы и хрома — по 6, у хлора и марганца — 7. Далее определяем электронные уровни элементов по аналогии. владсандрович более года назад Для решения данной задачи, нам просто необходимо, будет взглянуть в таблицу Менделеева. Она насчитывает в себе восемь групп. Они расположены в порядке восьми столбиков. Каждая группа имеет свой номер и этот самый номер как раз таки и говорит нам о том , сколько электронов имеет в себе тот или иной элемент, касательно его последнего внешнего уровня. Например железо относится к восьмой группе, а значит электронов на внешнем уровне оно имеет именно 8. Знаете ответ? |
Атомно-молекулярное учение
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома —
порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s2)
Состоит из s-подуровня: одной «s» ячейки (2s2) и p-подуровня: трех «p» ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s2), p-подуровня: трех «p» ячеек (3p6) и d-подуровня:
пяти «d» ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s2), p-подуровня: трех «p» ячеек (4p6), d-подуровня:
пяти «d» ячеек (4d10) и f-подуровня: семи «f» ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод — 1s22s22p2
- Серы — 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне — это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод — 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.

- Углерод — 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и скандия:
- Магний — 1s22s22p63s2
- Скандий — 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением — провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую «неправильную» (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
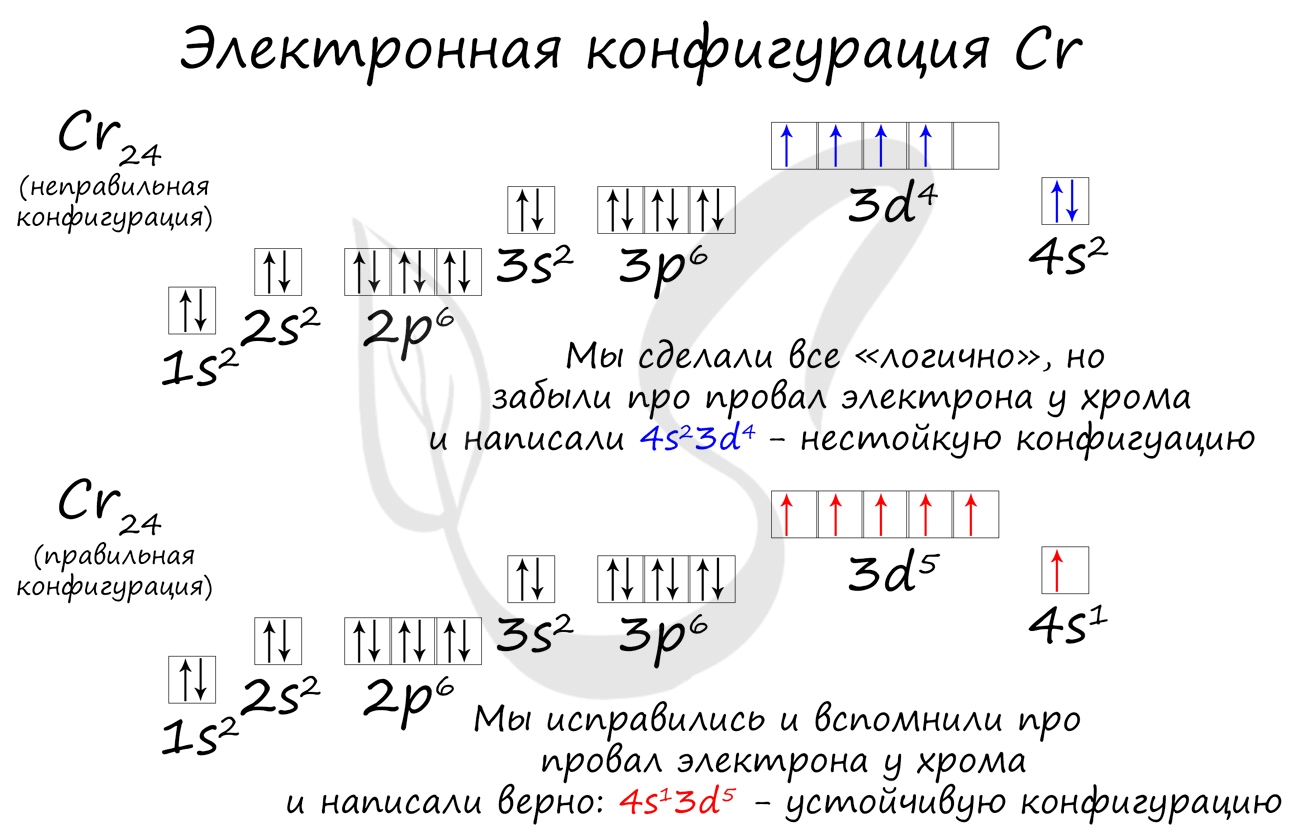
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора — возбужденное состояние невозможно, так как отсутствуют свободные орбитали («ячейки») — электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
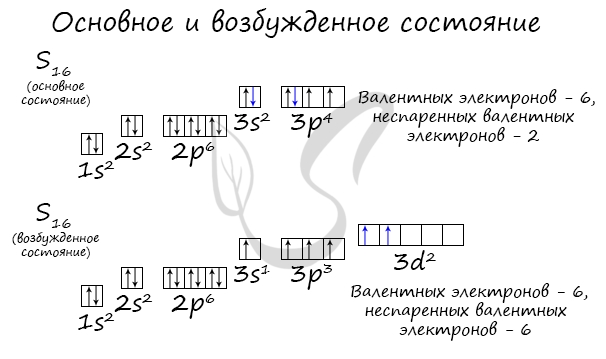
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Загрузить PDF
Загрузить PDF
Электрон является частицей с отрицательным зарядом и входит в состав атома. Все основные элементы состоят из электронов, протонов и нейтронов. В химии важно уметь определять, сколько электронов содержит атом. Это можно сделать с помощью периодической системы химических элементов (таблицы Менделеева). Также необходимо знать, как найти число нейтронов и валентных электронов (электронов на внешней оболочке атома).
-
1
Возьмите таблицу Менделеева. Это цветная таблица, в которой все известные элементы упорядочены согласно их атомной структуре. Каждый элемент обозначается символом в виде одной, двух или трех латинских букв, наряду с атомным весом и атомным номером элемента.[1]
- Таблицу Менделеева можно найти в учебниках по химии или в интернете.
-
2
Найдите нужный элемент в таблице Менделеева. Элементы упорядочены по атомному номеру и разделены на три основные группы: металлы, неметаллы и металлоиды (полуметаллы). Некоторые группы носят несистематические названия, такие как щелочные металлы, галогены и благородные газы.[2]
. Каждый столбец таблицы называется группой, а каждая строка — периодом.- Если вы знаете, в какой группе или периоде находится нужный элемент, вам будет легче найти его.
- Если вы знаете только символ элемента, просто просмотрите таблицу и найдите в ней этот символ.
-
3
Выясните атомный номер элемента. Атомный номер указывается в верхнем левом углу (над символом элемента). Атомный номер равен количеству протонов в атоме элемента.[3]
Протоны являются частицами с положительным зарядом. Так как электроны — это частицы с отрицательным зарядом, нейтральный атом включает равное количество протонов и электронов.- Например, атомный номер бора (B) равен 5, то есть в атоме бора 5 протонов и 5 электронов.
Реклама
-
1
Выясните атомный номер элемента. Атомный номер указывается в верхнем левом углу (над символом элемента). Атомный номер равен количеству протонов в атоме элемента.[4]
Протоны являются частицами с положительным зарядом. Так как электроны — это частицы с отрицательным зарядом, то нейтральный атом включает равное количество протонов и электронов.- Например, атомный номер бора (B) равен 5, то есть в атоме бора 5 протонов и 5 электронов.
-
2
Выясните заряд иона. Если добавить или удалить электрон из атома, элемент не поменяется на другой, но зато изменится его заряд. В этом случае получится ион, такой как K+, Ca2+ или N3-. Обычно заряд указывается сверху справа от символа элемента.
- Электрон — это частица с отрицательным зарядом, поэтому если в атом добавить электрон, получится ион с отрицательным зарядом.
- Если из атома удалить электрон, получится ион с положительным зарядом.
- Например, заряд N3- равен -3, а заряд Ca2+ равен +2.
-
3
Если дан ион с положительным зарядом, вычтите заряд из атомного номера. Если ион имеет положительный заряд, атом потерял электроны. Чтобы определить оставшееся количество электронов, вычтите заряд из атомного номера. У иона с положительным зарядом протонов больше, чем электронов.
- Например, заряд Ca2+ равен +2, то есть у этого иона на 2 электрона меньше, чем у нейтрального атома кальция. Атомный номер кальция равен 20, поэтому у этого иона 18 электронов.
-
4
Если дан ион с отрицательным зарядом, прибавьте заряд к атомному номеру. Если ион имеет отрицательный заряд, атом получил дополнительные электроны. Чтобы определить получившееся количество электронов, прибавьте заряд к атомному номеру. У иона с отрицательным зарядом протонов меньше, чем электронов.
- Например, заряд N3- равен -3, то есть у этого иона на 3 электрона больше, чем у нейтрального атома азота. Атомный номер азота равен 7, поэтому у этого иона 10 электронов.
Реклама
Об этой статье
Эту страницу просматривали 46 912 раз.
Была ли эта статья полезной?
Download Article
Download Article
All basic elements are made up of electrons, protons, and neutrons. An electron is a negatively charged particle that makes up part of an atom. A fundamental concept in chemistry is the ability to determine how many electrons an atom contains. By using a periodic table of elements, this can easily be determined. Other important concepts involve how to find the number of neutrons and valence electrons (number of electrons in its outermost shell) in an element.
-
1
Obtain a periodic table of elements. This is a color-coded table that organizes all the known elements by atomic structure. Each element has a 1, 2, or 3-letter abbreviation and is listed along with its atomic weight and atomic number.[1]
- Periodic tables can easily be found in chemistry books as well as online.
-
2
Find the element in question on the periodic table. The elements are ordered by atomic number and separated into three main groups: metals, non-metals, and metalloids (semi-metals). They are further grouped into families including alkali metals, halogens, and noble gases.[2]
Every column of the table is called a group and every row is called a period.- If you know the details of your element, such as what group or period it is in, it will be easier to locate.
- If you don’t know anything about the element in question, just search the table for its symbol until you find it.
Advertisement
-
3
Find the atomic number of an element. The atomic number appears in the upper left-hand corner or centrally above the element symbol in the square. The atomic number defines the number of protons present in that particular element.[3]
Protons are the particles in an element that provide a positive charge. Because electrons are negatively charged, when an element is in its neutral state, it will have the same number of protons as electrons.- For instance, boron (B) has an atomic number of 5, meaning that it has 5 protons and 5 electrons.
Advertisement
-
1
Identify the charge of the ion. Adding and removing electrons from an atom does not change its identity, but it changes its charge. In these cases, you now have an ion, such as K+, Ca2+, or N3-. Usually, the charge is expressed in a superscript to the right of the atom abbreviation.
- Because an electron has a negative charge, when you add extra electrons, the ion becomes more negative.
- When you remove electrons, the ion becomes more positive.
- For example, N3- has a -3 charge while Ca2+ has a +2 charge.
-
2
Subtract the charge from the atomic number if the ion is positive. If the charge is positive, the ion has lost electrons. To determine how many electrons are left, subtract the amount of charge from the atomic number. In this case, there are more protons than electrons.
- For example, Ca2+ has a +2 charge, therefore, it has 2 fewer electrons than a neutral calcium atom. Calcium’s atomic number is 20, therefore this ion has 18 electrons.
-
3
Add the charge to the atomic number if the charge is negative. If the charge is negative, the ion has gained electrons. To determine how many total electrons there are, add the amount of charge to the atomic number. In this case, there are fewer protons than electrons.
- For example, N3- has a -3 charge which means it has 3 more electrons than a neutral nitrogen atom. Nitrogen’s atomic number is 7, therefore this ion has 10 electrons.
Advertisement
Add New Question
-
Question
What if the charge has no number?
If the charge has no number (is 0), then the number of electrons is the same as the number of protons.
-
Question
How do I calculate the number of electrons by looking at a periodic table?
It is the atomic number. However, if it has positive ion, then this electron number will go down (ie +2 charge means two electrons have been lost, so the electron/atomic number will go down by two) and vice versa.
-
Question
How do I figure out the number of valence electrons?
Valence electrons are the electrons contained in the outermost shell. If you look at the periodic table and at the period numbers, that is the number of valence electrons. If the number is larger than 10, subtract 10 so you get two valence electrons. Example: Oxygen is in the 16th period. If we subtract 10 from 16, we get 6; therefore, oxygen has six valence electrons.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Video
References
About This Article
Article SummaryX
To find the number of electrons an atom has, start by looking up the element you’re working with on the periodic table and locating its atomic number, which will be in the upper left-hand corner of the square. Then, identify the charge of the ion, which will be written as a superscript to the right of the element. Finally, subtract the charge from the atomic number if the ion is positive or add the charge to the atomic number if the ion is negative. To learn how to read and use a periodic table, keep reading!
Did this summary help you?
Thanks to all authors for creating a page that has been read 365,113 times.
Reader Success Stories
-
Jeff Rodniklaem
Apr 18, 2016
«The article really informed me about finding the electrons as my school teacher struggled to help me a bit. I am…» more
Did this article help you?
Научная статья
на тему: “Внешние электроны / валентные электроны»
Внешние электроны — часто также называемые
валентными электронами — имеют особое значение в химии: они чрезвычайно важны
для химических реакций / связей. В этой статье по основам химии мы просто
объясняем, что такое внешние электроны или валентные электроны.Многие студенты
вообще не понимают, как работают химические связи. Одной из причин этого часто
является незнание так называемых внешних электронов атома. Именно этому и
посвящена данная статья. Я кратко обобщу некоторые базовые знания, необходимые
для этой статьи.Что такое внешние электроны / валентные
электроны?
Чтобы понять термины
внешний электрон или валентный электрон , следует небольшое напоминание и
пример: ученые Резерфорд и Бор предоставили новаторское понимание структуры
атома. В этом случае модель атома Бора уже упоминала так называемые оболочки,
на которых могут размещаться электроны. По-прежнему возник вопрос, сколько
электронов находится на соответствующих оболочках. Следующая таблица отвечает
на этот вопрос:
●
1-я оболочка: 2 электрона
●
2-я оболочка: 8 электронов
●
3-я оболочка: 18 электронов
● 4-я
оболочка: 32 электрона
На примере натрия (Na)
мы хотим показать распределение электронов по оболочкам. В периодической
таблице элементов (показать периодическую таблицу
) вы можете прочитать число 11 для натрия в верхнем левом углу. Это означает:
●
11 электронов пытаются облететь как можно ближе
к ядру атома.
●
Оболочка K полностью занята (2 электрона),
осталось 9 электронов.
●
L-оболочка полностью занята (8 электронов),
остается 1 электрон.
● M-оболочка
занята электроном
Самая внешняя оболочка,
занятая электронами, в этом примере была M-оболочкой. В нем есть электрон. Это
означает: есть внешний электрон. Все электроны, находящиеся во внешней оболочке
атома, называются внешними электронами !
Два важных замечания :
мы рассматриваем только элементы основных групп, а не переходные металлы!
Пример выше также показывает, что самая внешняя оболочка не всегда полностью
заполнена.
Распознавание внешних электронов стало
проще
Есть очень простой
способ узнать количество внешних электронов. Для этого возьмите периодическую
таблицу элементов (покажите периодическую таблицу
) и посмотрите на номер основной группы. Это число римскими цифрами в верхней
части таблицы Менделеева. I — основная группа 1, II — основная группа 2, III —
основная группа 3 …. и VIII — основная группа 8. Номер основной группы
соответствует количеству внешних электронов. Пример: Углерод находится в
основной группе № 4, поэтому у него 4 внешних электрона.
Также следует отметить,
что есть два разных способа записать количество внешних электронов. В первых
обозначениях для каждого внешнего электрона написана точка. Во второй записи
тоже есть точки, но две точки объединены в одну линию. Вы должны знать оба
написания!















