На этой странице вы можете рассчитать внутреннюю энергию идеального газа с помощью калькулятора онлайн или самостоятельно по формулам.
Содержание:
- калькулятор внутренней энергии идеального газа
- внутренняя энергия идеального газа через массу, молярную массу и температуру
- внутренняя энергия идеального газа через давление и объем
- внутренняя энергия идеального газа через количество вещества и температуру
- внутренняя энергия идеального газа через степени свободы
- степени свободы идеальных газов
Формула внутренней энергии идеального газа через массу, молярную массу и температуру
{U = dfrac{3}{2} cdot dfrac{m}{M} cdot R T}
U — внутренняя энергия газа
m — масса газа
M — молярная масса газа
R — универсальная газовая постоянная R = 8,314 462 618 153 24 Дж/(моль∙К)
T — абсолютная температура газа
Формула внутренней энергии идеального газа через давление и объем
{U = dfrac{3}{2} cdot p V}
U — внутренняя энергия газа
p — давление газа
V — объем газа
Формула внутренней энергии идеального газа через количество вещества и температуру
{U = dfrac{3}{2} cdot nu RT}
U — внутренняя энергия газа
ν — количество вещества (в молях)
R — универсальная газовая постоянная R = 8,314 462 618 153 24 Дж/(моль∙К)
T — абсолютная температура газа
Формула внутренней энергии идеального газа через степени свободы
{U = dfrac{i}{2} cdot nu RT}
U — внутренняя энергия газа
i — количество степеней свободы
ν — количество вещества (в молях)
R — универсальная газовая постоянная R = 8,314 462 618 153 24 Дж/(моль∙К)
T — абсолютная температура газа
Количество степеней свободы молекулы идеального газа
Число степеней свободы (i) — наименьшее число независимых координат, которое необходимо ввести, чтобы определить положение тела в пространстве.
- для одноатомного газа (гелий, неон, аргон, криптон, ксенон, радон, оганесон и т. д.) i=3;
- для двухатомного газа (водород, азот, кислород, фтор, хлор и т. д.) i=5;
- для трехатомного газа i=6;
- для многоатомного (>3) газа i=6;
Одним из важных вопросов при изучении термодинамических систем в физике является вопрос о возможности выполнения этой системой некоторой полезной работы. С концепцией работы тесно связано понятие внутренней энергии. В данной статье рассмотрим, что такое внутренняя энергия идеального газа, и приведем формулы для ее вычисления.
Идеальный газ
О газе, как агрегатном состоянии, не обладающем никакой силой упругости при внешнем воздействии на него и, как следствие, не сохраняющим объем и форму, знает каждый школьник. Концепция же газа идеального для многих остается непонятной и неясной. Объясним ее.

Идеальным называется любой газ, который удовлетворяет следующим двум важным условиям:
- Составляющие его частицы не имеют размера. В действительности они имеют размер, но он настолько мал в сравнении с расстояниями между ними, что его можно не учитывать во всех математических расчетах.
- Частицы не взаимодействуют друг с другом с помощью сил Ван-дер-Ваальса или сил иной природы. На самом деле во всех реальных газах такое взаимодействие присутствует, но его энергия пренебрежимо мала по сравнению со средней энергией кинетической частиц.
Описанным условиям удовлетворяют практически все реальные газы, температуры которых лежат выше 300 К, а давления не превышают одной атмосферы. Для слишком высоких давлений и низких температур наблюдает отклонение газов от идеального поведения. В таком случае говорят о реальных газах. Они описываются уравнением Ван-дер-Ваальса.
Понятие о внутренней энергии идеального газа
В соответствии с определением, под внутренней энергией системы понимают сумму кинетической и потенциальной энергий, заключенных внутри этой системы. Если применить эту концепцию к газу идеальному, то следует отбросить потенциальную составляющую. Действительно, поскольку частицы идеального газа не взаимодействуют друг с другом, то их можно считать движущимися свободно в абсолютном вакууме. Чтобы извлечь одну частицу из изучаемой системы, не нужно совершать работу против внутренних сил взаимодействия, поскольку этих сил не существует.
Таким образом, внутренняя энергия идеального газа всегда совпадает с его кинетической энергией. Последняя, в свою очередь, однозначно определяется молярной массой частиц системы, их количеством, а также средней скоростью поступательного и вращательного движения. Скорость движения зависит от температуры. Увеличение температуры приводит к увеличению внутренней энергии, и наоборот.
Формула для внутренней энергии
Обозначим внутреннюю энергию идеальной газовой системы буквой U. Согласно термодинамике, она определяется как разность энтальпии H системы и произведения давления на объем, то есть:
U = H — p*V.
В пункте выше мы выяснили, что величина U соответствует суммарной кинетической энергии Ek всех частиц газа:
U = Ek.
Из статистической механики в рамках положений молекулярно-кинетической теории (МКТ) идеального газа следует, что средняя кинетическая энергия одной частицы Ek1 равна следующей величине:
Ek1 = z/2*kB*T.
Здесь kB и T — постоянная Больцмана и температура, z — число степеней свободы. Полную кинетическую энергию системы Ek можно получить, если умножить Ek1 на количество частиц N в системе:
Ek = N*Ek1 = z/2*N*kB*T.
Таким образом, мы получили формулу для внутренней энергии идеального газа, записанную в общем виде через абсолютную температуру и число частиц в закрытой системе:
U = z/2*N*kB*T.
Одноатомный и многоатомный газ
Записанная в предыдущем пункте статьи формула для U является неудобной для ее практического использования, поскольку количество частиц N определить трудно. Тем не менее, если учесть определение количества вещества n, то это выражение можно переписать в более удобной форме:
n = N/NA; R = NA*kB = 8,314 Дж/(моль*К);
U = z/2*n*R *T.
Число степеней свободы z зависит от геометрии составляющих газ частиц. Так, для моноатомного газа z = 3, поскольку атом может независимо двигаться только в трех направлениях пространства. Если же газ является двухатомным, то z = 5, так как к трем поступательным степеням свободы добавляются еще две вращательные. Наконец, для любого другого многоатомного газа z = 6 (3 поступательные и 3 вращательные степени свободы). С учетом сказанного, можно записать в следующем виде формулы внутренней энергии идеального газа одноатомного, двухатомного и многоатомного:
U1 = 3/2*n*R*T;
U2 = 5/2*n*R*T;
U≥3 = 3*n*R*T.
Пример задачи на определение внутренней энергии
В баллоне объемом 100 литров находится чистый водород под давлением 3 атмосферы. Полагая водород идеальным газом при данных условиях, необходимо определить, чему равна его внутренняя энергия.

В записанных выше формулах для U присутствует количество вещества и температура газа. В условии же задачи совершенно ничего об этих величинах не сказано. Чтобы решить задачу, необходимо вспомнить универсальное уравнение Клапейрона-Менделеева. Оно имеет показанный на рисунке вид.
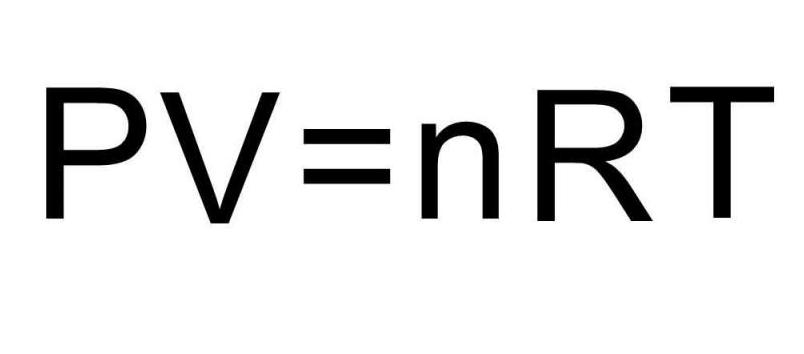
Поскольку водород H2 является двухатомной молекулой, то формула для внутренней энергии запишется в виде:
UH2 = 5/2*n*R*T.
Сравнивая оба выражения, приходим к конечной формуле для решения задачи:
UH2 = 5/2*P*V.
Остается перевести единицы давления и объема из условия в систему единиц СИ, подставить соответствующие значения в формулу для UH2 и получить ответ: UH2 ≈ 76 кДж.
Автор:
13-01-2019 19:00
Жду ваши вопросы и мнения в комментариях
Внутренняя энергия
-
Темы кодификатора ЕГЭ: внутренняя энергия, теплопередача, виды теплопередачи.
-
Внутренняя энергия одноатомного идеального газа
-
Функция состояния
-
Изменение внутренней энергии: совершение работы
-
Изменение внутренней энергии: теплопередача
-
Теплопроводность
-
Конвекция
-
Тепловое излучение
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: внутренняя энергия, теплопередача, виды теплопередачи.
Частицы любого тела — атомы или молекулы — совершают хаотическое непрекращающееся движение (так называемое тепловое движение). Поэтому каждая частица обладает некоторой кинетической энергией.
Кроме того, частицы вещества взаимодействуют друг с другом силами электрического притяжения и отталкивания, а также посредством ядерных сил. Стало быть, вся система частиц данного тела обладает ещё и потенциальной энергией.
Кинетическая энергия теплового движения частиц и потенциальная энергия их взаимодействия вместе образуют новый вид энергии, не сводящийся к механической энергии тела (т.е. кинетической энергии движения тела как целого и потенциальной энергии его взаимодействия с другими телами). Этот вид энергии называется внутренней энергией.
Внутренняя энергия тела — это суммарная кинетическая энергия теплового движения его частиц плюс потенциальная энергия их взаимодействия друг с другом.
Внутренняя энергия термодинамической системы — это сумма внутренних энергий тел, входящих в систему.
Таким образом, внутреннюю энергию тела образуют следующие слагаемые.
1. Кинетическая энергия непрерывного хаотического движения частиц тела.
2. Потенциальная энергия молекул (атомов), обусловленная силами межмолекулярного взаимодействия.
3. Энергия электронов в атомах.
4. Внутриядерная энергия.
В случае простейшей модели вещества — идеального газа — для внутренней энергии можно получить явную формулу.
к оглавлению ▴
Внутренняя энергия одноатомного идеального газа
Потенциальная энергия взаимодействия частиц идеального газа равна нулю (напомним, что в модели идеального газа мы пренебрегаем взаимодействием частиц на расстоянии). Поэтому внутренняя энергия одноатомного идеального газа сводится к суммарной кинетической энергии поступательного (у многоатомного газа приходится ещё учитывать вращение молекул и колебания атомов внутри молекул) движения его атомов. Эту энергию можно найти, умножив число атомов газа на среднюю кинетическую энергию
одного атома:
или
Мы видим, что внутренняя энергия идеального газа (масса и химический состав которого неизменнны) является функцией только его температуры. У реального газа, жидкости или твёрдого тела внутренняя энергия будет зависеть ещё и от объёма — ведь при изменении объёма изменяется взаимное расположение частиц и, как следствие, потенциальная энергия их взаимодействия.
к оглавлению ▴
Функция состояния
Важнейшее свойство внутренней энергии заключается в том, что она является функцией состояния термодинамической системы. А именно, внутренняя энергия однозначно определяется набором макроскопических параметров, характеризующих систему, и не зависит от «предыстории» системы, т.е. от того, в каком состоянии система находилась прежде и каким конкретно образом она оказалась в данном состоянии.
Так, при переходе системы из одного состояния в другое изменение её внутренней энергии определяется лишь начальным и конечным состояниями системы и не зависит от пути перехода из начального состояния в конечное. Если система возвращается в исходное состояние, то изменение её внутренней энергии равно нулю.
Опыт показывает, что существует лишь два способа изменения внутренней энергии тела:
• совершение механической работы;
• теплопередача.
Попросту говоря, нагреть чайник можно только двумя принципиально разными способами: тереть его чем-нибудь или поставить на огонь 
к оглавлению ▴
Изменение внутренней энергии: совершение работы
Если работа совершается над телом, то внутренняя энергия тела возрастает.
Например, гвоздь после удара по нему молотком нагревается и немного деформируется. Но температура — это мера средней кинетической энергии частиц тела. Нагревание гвоздя свидетельствует об увеличении кинетической энергии его частиц: в самом деле, частицы разгоняются от удара молотком и от трения гвоздя о доску.
Деформация же есть не что иное, как смещение частиц друг относительно друга; гвоздь после удара испытывает деформацию сжатия, его частицы сближаются, между ними возрастают силы отталкивания, и это приводит к увеличению потенциальной энергии частиц гвоздя.
Итак, внутренняя энергия гвоздя увеличилась. Это явилось результатом совершения над ним работы — работу совершили молоток и сила трения о доску.
Если же работа совершается самим телом, то внутренняя энергия тела уменьшается.
Пусть, например, сжатый воздух в теплоизолированном сосуде под поршнем расширяется и поднимает некий груз, совершая тем самым работу (процесс в теплоизолированном сосуде называется адиабатным. Мы изучим адиабатный процесс при рассмотрении первого закона термодинамики). В ходе такого процесса воздух будет охлаждаться — его молекулы, ударяя вдогонку по движущемуся поршню, отдают ему часть своей кинетической энергии. (Точно так же футболист, останавливая ногой быстро летящий мяч, делает ею движение от мяча и гасит его скорость.) Стало быть, внутренняя энергия воздуха уменьшается.
Воздух, таким образом, совершает работу за счёт своей внутренней энергии: поскольку сосуд теплоизолирован, нет притока энергии к воздуху от каких-либо внешних источников, и черпать энергию для совершения работы воздух может только из собственных запасов.
к оглавлению ▴
Изменение внутренней энергии: теплопередача
Теплопередача — это процесс перехода внутренней энергии от более горячего тела к более холодному, не связанный с совершением механической работы. Теплопередача может осуществляться либо при непосредственном контакте тел, либо через промежуточную среду (и даже через вакуум). Теплопередача называется ещё теплообменом.
Различают три вида теплопередачи: теплопроводность, конвекция и тепловое излучение.
Сейчас мы рассмотрим их более подробно.
к оглавлению ▴
Теплопроводность
Если железный стержень сунуть одним концом в огонь, то, как мы знаем, долго его в руке не продержишь. Попадая в область высокой температуры, атомы железа начинают колебаться интенсивнее (т.е. приобретают добавочную кинетическую энергию) и наносят более сильные удары по своим соседям.
Кинетическая энергия соседних атомов также возрастает, и теперь уже эти атомы сообщают дополнительную кинетическую энергию своим соседям. Так от участка к участку тепло постепенно распространяется по стержню — от помещённого в огонь конца до нашей руки. Это и есть теплопроводность (рис. 1)(Изображение с сайта educationalelectronicsusa.com).
Рис. 1. Теплопроводность
Теплопроводность — это перенос внутренней энергии от более нагретых участков тела к менее нагретым за счёт теплового движения и взаимодействия частиц тела.
Теплопроводность разных веществ различна. Высокую теплопроводность имеют металлы: лучшими проводниками тепла являются серебро, медь и золото. Теплопроводность жидкостей гораздо меньше. Газы проводят тепло настолько плохо, что относятся уже к теплоизоляторам: молекулы газов из-за больших расстояний между ними слабо взаимодействуют друг с другом. Вот почему, например, в окнах делают двойные рамы: прослойка воздуха препятствует уходу тепла).
Плохими проводниками тепла являются поэтому пористые тела — такие, как кирпич, вата или мех. Они содержат в своих порах воздух. Недаром кирпичные дома считаются самыми тёплыми, а в мороз люди надевают меховые шубы и куртки с прослойкой пуха или синтепона.
Но если воздух так плохо проводит тепло, то почему тогда прогревается от батареи комната?
Происходит это вследствие другого вида теплопередачи — конвекции.
к оглавлению ▴
Конвекция
Конвекция — это перенос внутренней энергии в жидкостях или газах в результате циркуляции потоков и перемешивания вещества.
Воздух вблизи батареи нагревается и расширяется. Действующая на этот воздух сила тяжести остаётся прежней, а выталкивающая сила со стороны окружающего воздуха увеличивается, так что нагретый воздух начинает всплывать к потолку. На его место приходит холодный воздух (тот же процесс, но в куда более грандиозных масштабах, постоянно происходит в природе: именно так возникает ветер), с которым повторяется то же самое.
В результате устанавливается циркуляция воздуха, которая и служит примером конвекции — распространение тепла в комнате осуществляется воздушными потоками.
Совершенно аналогичный процесс можно наблюдать и в жидкости. Когда вы ставите на плиту чайник или кастрюлю с водой, нагревание воды происходит в первую очередь благодаря конвекции (вклад теплопроводности воды тут весьма незначителен).
Конвекционные потоки в воздухе и жидкости показаны на рис. 2 (изображения с сайта physics.arizona.edu).
Рис. 2. Конвекция
В твёрдых телах конвекция отсутствует: силы взаимодействия частиц велики, частицы колеблются вблизи фиксированных пространственных точек (узлов кристаллической решётки), и никакие потоки вещества в таких условиях образоваться не могут.
Для циркуляции конвекционных потоков при отоплении комнаты необходимо, чтобы нагретому воздуху было куда всплывать. Если радиатор установить под потолком, то никакая циркуляция не возникнет — тёплый воздух так под потолком и останется. Именно поэтому нагревательные приборы помещают внизу комнаты. По той же причине чайник ставят на огонь, в результате чего нагретые слои воды, поднимаясь, уступают место более холодным.
Наоборот, кондиционер нужно располагать как можно выше: тогда охлаждённый воздух начнёт опускаться, и на его место будет приходить более тёплый. Циркуляция пойдёт в обратном направлении по сравнению с движением потоков при обогреве комнаты.
к оглавлению ▴
Тепловое излучение
Каким образом Земля получает энергию от Солнца? Теплопроводность и конвекция исключены: нас разделяет 150 миллионов километров безвоздушного пространства.
Здесь работает третий вид теплопередачи — тепловое излучение. Излучение может распространяться как в веществе, так и в вакууме. Как же оно возникает?
Оказывается, электрическое и магнитное поля тесно связаны друг с другом и обладают одним замечательным свойством. Если электрическое поле изменяется со временем, то оно порождает магнитное поле, которое, вообще говоря, также изменяется со временем (подробнее об этом будет рассказано в листке про электромагнитную индукцию). В свою очередь переменное магнитное поле порождает переменное электрическое поле, которое опять порождает переменное магнитное поле, которое опять порождает переменное электрическое поле…
В результате развития этого процесса в пространстве распространяется электромагнитная волна —«зацепленные» друг за друга электрическое и магнитное поля. Как и звук, электромагнитные волны обладают скоростью распространения и частотой — в данном случае это частота, с которой колеблются в волне величины и направления полей. Видимый свет — частный случай электромагнитных волн.
Скорость распространения электромагнитных волн в вакууме огромна: км/с. Так, от Земли до Луны свет идёт чуть больше секунды.
Частотный диапазон электромагнитных волн очень широк. Подробнее о шкале электромагнитных волн мы поговорим в соответствующем листке. Здесь отметим лишь, что видимый свет — это крохотный диапазон данной шкалы. Ниже него лежат частоты инфракрасного излучения, выше — частоты ультрафиолетового излучения.
Вспомним теперь, что атомы, будучи в целом электрически нейтральными, содержат положительно заряженные протоны и отрицательно заряженные электроны. Эти заряженные частицы, совершая вместе с атомами хаотическое движение, создают переменные электрические поля и тем самым излучают электромагнитные волны. Эти волны и называются тепловым излучением — в напоминание о том, что их источником служит тепловое движение частиц вещества.
Источником теплового излучения является любое тело. При этом излучение уносит часть его внутренней энергии. Встретившись с атомами другого тела, излучение разгоняет их своим колеблющимся электрическим полем, и внутренняя энергия этого тела увеличивается. Именно так мы и греемся в солнечных лучах.
При обычных температурах частоты теплового излучения лежат в инфракрасном диапазоне, так что глаз его не воспринимает (мы не видим, как мы «светимся»). При нагревании тела его атомы начинают излучать волны более высоких частот. Железный гвоздь можно раскалить докрасна — довести до такой температуры, что его тепловое излучение выйдет в нижнюю (красную) часть видимого диапазона. А Солнце кажется нам жёлто-белым: температура на поверхности Солнца настолько высока , что в спектре его излучения присутствуют все частоты видимого света, да ещё ультрафиолет, благодаря которому мы загораем.
Давайте ещё раз взглянем на три вида теплопередачи (рис. 3)(изображения с сайта beodom.com).
Рис. 3. Три вида теплопередачи: теплопроводность, конвекция и излучение
Спасибо за то, что пользуйтесь нашими материалами.
Информация на странице «Внутренняя энергия» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
08.05.2023
Главная
»
Самолетостроение
»
Физика (3 семестр)
»
Внутренняя энергия как функция состояния. Расчет внутренней энергии многоатомных газов.
Внутренняя энергия как функция состояния. Расчет внутренней энергии многоатомных газов.
Внутренняя энергия U как функция состояния вводится первым началом термодинамики, согласно которому разность между теплотой Q, переданной системе, и работой W, совершаемой системой, зависит только от начального и конечного состояний системы и не зависит от пути перехода, т.е. представляет изменение фуникции состояния ΔU
где U1 и U2 — внутренняя энергия системы в начальном и конечном состояниях соответственно. Уравнение (1) выражает закон сохранения энергии в применении к термодинамическим процессам, т.е. процессам, в которых происходит передача теплоты. Для циклического процесса, возвращающего систему в начальное состояние, ΔU=0. В изохорных процессах, т.е. процессах при постоянном объеме, система не совершает работы за счет расширения, W=0 и теплота, переданная системе, равна приращению внутренней энергии: Qv=ΔU. Для адиабатических процессов, когда Q=0, ΔU=-W.
Внутренняя энергия тела определяет его тепловое состояние и изменяется при переходе из одного состояния в другое
Рассчитать внутреннюю энергию можно только для идеального газа, т.к. молекулы не взаимодействуют между собой и потенциальная энергия их равна нулю
где i — степень свободы. Для одноатомного газа (например, инертные газы) i = 3, для двухатомного — i =5.
Из этих формул видно, что внутренняя энергия идеального газа зависит только от температуры и числа молекул и не зависит ни от объема, ни от давления. Поэтому изменение внутренней энергии идеального газа определяется только изменением его температуры и не зависит от характера процесса, в котором газ переходит из одного состояния в другое:
где ΔT = T2 — T1.
Вывод формулы
Средняя кинетическая энергия молекулы
Число молекул в газе
Следовательно, внутренняя энергия идеального газа
Учитывая, что k⋅NA = R — универсальная газовая постоянная, имеем
— внутренняя энергия идеального газа.
Друзья! Приглашаем вас к обсуждению. Если у вас есть своё мнение, напишите нам в комментарии.
Числом степеней
свободы
называется наименьшее число независимых
координат, которое необходимо ввести,
чтобы определить положение тела в
пространстве.
– число степеней свободы.
Рассмотрим
одноатомный
газ.
Молекулу такого газа можно считать
материальной точкой, положение
материальной точки
(рис. 11.1)
в пространстве определяется тремя
координатами.
Молекула может
двигаться в трех направлениях (рис.
11.2).
|
|
|
|
Рис. |
Рис. |
Следовательно,
обладает тремя поступательными степенями
свободы.
Молекула –
материальная точка.
Энергии вращательного
движения ,
т.к. момент инерции материальной точки
относительно оси, проходящей через
точку равен нулю
Для молекулы
одноатомного газа число степеней свободы
.
Рассмотрим
двухатомный
газ. В
двухатомной молекуле каждый атом
принимается за материальную точку и
считается, что атомы жёстко связаны
между собой, это гантельная модель
двухатомной молекулы. Двухатомная
жестко связанная молекула
(совокупность двух материальных точек,
связанных недеформируемой связью), рис.
11.3.
Положение центра
масс молекулы задаётся тремя координатами,
(рис. 11.4) это три степени свободы, они
определяют поступательное
движение молекулы. Но
молекула может совершать и вращательные
движения вокруг осей
и
,
это ещё две степени свободы, определяющиевращение
молекулы.
Вращение молекулы вокруг оси
невозможно, т.к. материальные точки не
могут вращаться вокруг оси, проходящей
через эти точки.
|
|
|
|
Рис. 11.3 |
Рис. 11.4 |
Для молекулы
двухатомного газа число степеней свободы
.
Рассмотрим
трёхатомный
газ. Модель
молекулы – три атома (материальные
точки), жёстко связанные между собой
(рис. 11.5).
Трёхатомная
молекула – жестко связанная молекула.
|
Рис. |
Молекула обладает
i = |
Для молекулы
трёхатомного газа число степеней свободы
.
Для многоатомной
молекулы число степеней свободы
.
Для реальных
молекул, не обладающих жёсткими связями
между атомами, необходимо учитывать
также степени свободы колебательного
движения, тогда число степеней свободы
реальной молекулы равно
i =
iпоступат + iвращат.+ iколеб. (11.1)
Закон равномерного распределения энергии по степеням свободы (закон Больцмана)
Закон о
равнораспределении энергии по степеням
свободы
утверждает, если система частиц находится
в состоянии термодинамического
равновесия, то средняя кинетическая
энергия хаотического движения молекул,
приходящаяся на 1 степень свободы
поступательного
и вращательного
движения, равна
Следовательно,
молекула, имеющая
степеней свободы, обладает энергией
, (11.2)
где
– постоянная Больцмана;
– абсолютная температура газа.
Внутренняя
энергия
идеального газа
– это сумма кинетических энергий всех
его молекул.
Находим внутреннюю
энергию
одного моля идеального газа.
,
где– средняя кинетическая энергия одной
молекулы газа,– число Авогадро (число молекул в одном
моле). Постоянная Больцмана.
Тогда
.
Если газ имеет
массу
,
то
– число молей, где
– масса моля, и внутренняя энергия газа
выражается формулой
. (11.3)
Внутренняя энергия
идеального газа зависит только от
температуры газа. Изменение внутренней
энергии идеального газа определяется
изменением температуры и не зависит от
процесса, при котором это изменение
произошло.
Изменение
внутренней энергии идеального газа
, (11.4)
где
– изменение температуры.
Закон равномерного
распределения энергии распространяется
на колебательное движение атомов в
молекуле. На колебательную степень
свободы приходится не только кинетическая
энергия, но и потенциальная, причём
среднее значение кинетической энергии,
приходящейся на одну степень равно
среднему значению потенциальной энергии,
приходящемуся на одну степень свободы
и равно
Следовательно,
если молекула имеет число степеней
свободы
i = iпоступат + iвращат + iколеб,
то средняя суммарная энергия молекулы:
,
а внутренняя энергия газа массы
:
. (11.5)
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #









