Внутренняя энергия сосредоточена «внутри» вещества и складывается из потенциальной энергии взаимодействующих молекул (атомов) и кинетической энергии их движения:
U=∑Ek0+∑Ep0
∑Ek0 — кинетическая энергия молекул (атомов), которая зависит от скорости их движения. Она изменяется только при изменении температуры. В процессе агрегатных переходов кинетическая энергия молекул остается неизменной.
∑Ep0 — потенциальная энергия взаимодействия молекул, которая зависит от расстояния между ними. Она изменяется при изменении температуры и объема. Например, в процессе агрегатных переходов изменяется именно потенциальная энергия молекул.
Способы изменения внутренней энергии:
- Совершение работы (за счет трения или ударов).
- Испарение (в процессе испарения внутренняя энергия жидкости понижается).
- Теплопередача (приведение в соприкосновение с более холодным или более нагретым телом).
Виды теплопередачи
Выделяют три вида теплопередачи: теплопроводность, конфекцию и излучение.
Теплопроводность
Определение
Теплопроводность — способность тел переносить внутреннюю энергию без переноса вещества от более нагретых участков тела к более холодным.
При теплопроводности происходит постепенное увеличение скорости движения молекул. Это возможно только благодаря межмолекулярному взаимодействию. Поэтому теплопроводность в твердых телах происходит быстрее, чем в жидкостях. В газах она осуществляется еще медленнее. Для сохранения тепла используют пористые материалы, в которых много воздуха. Воздух — это смесь газов, поэтому он плохо переводит тепло.
Важно! В вакууме теплопроводность невозможна.
Конвекция
Определение
Конвекция — это перенос внутренней энергии, сопровождающийся переносом вещества.
При конвекции теплые слои жидкости или газа поднимаются, а холодные опускаются. Конвекция осуществляется только в жидкостях и газах.
Важно! В твердых телах и в вакууме конвекция невозможна.
Излучение
Определение
Излучение — это перенос теплоты в пространстве, осуществляемый в результате распространения электромагнитных волн, энергия которых при взаимодействии с веществом переходит в тепло.
Энергию излучают все нагретые тела. Чем больше нагрето тело, тем сильнее излучение. Теплопередача за счет излучения возможна в любой среде, в том числе и в вакууме.
Темные поверхности хорошо поглощают излучение, но быстро отдают энергию при охлаждении. Зеркальные и светлые поверхности отражают часть излучения и медленно остывают.
Количество теплоты
Определение
Количество теплоты Q (Дж) — физическая величина, которая показывает, на сколько изменяется внутренняя энергия вещества в процессе теплопередачи:
Q=±U
Если внутренняя энергия вещества увеличивается, то Q > 0. Это происходит при нагревании, плавлении и кипении.
Если внутренняя энергия вещества уменьшается, Q < 0. Это происходит при охлаждении, отвердевании и конденсации.
Нагревание и охлаждение вещества
Формула теплоты при нагревании или охлаждении
При нагревании или охлаждении вещество получает (отдает) количество теплоты, определяемое по формуле:
Q=cmΔt=cm(t−t0)
∆t — изменение температуры вещества (в оС или К), t0 — начальная температура вещества, t — конечная температура вещества, m — его масса (кг), c — удельная теплоемкость вещества (Дж/(кг∙К)).
Удельная теплоемкость вещества показывает, какое количество теплоты необходимо затратить, чтобы нагреть 1 кг вещества на 1 градус. Такое же количество теплоты выделится при охлаждении 1 кг этого вещества на 1 градус.
Внимание! Удельная теплоемкость вещества — табличная величина.
Количество теплоты также определяется формулой:
Q=CΔT
∆T — изменение температуры в Кельвинах, а C — теплоемкость вещества.
Теплоемкость вещества показывает, сколько теплоты поглощает тело при нагревании на 1 К. Измеряется в Дж/кг. Численно теплоемкость равна произведению массы вещества на его удельную теплоемкость:
C=cm
Пример №1. Температура медного образца массой 100 г увеличилась на 40 оС. Какое количество теплоты получил образец? Удельная теплоемкость меди равна 380 Дж/(кг∙К).
100 г = 0,1 кг
Q=cmΔt=380·0,1·40=1520 (Дж)
Сгорание топлива
Формула теплоты при сгорании топлива
При сгорании топлива выделяется количество теплоты, определяемое формулой:
Q=qm
m — масса сгоревшего топлива (кг), q — удельная теплота сгорания топлива (Дж/кг).
Удельная теплота сгорания показывает, какое количество теплоты выделяется при полном сгорании 1 кг данного вида топлива.
Внимание! Удельная теплота сгорания — табличная величина.
Пример №2. Сгорело 5 сухих березовых поленьев. Каждый весил 1 кг. Определить, количество выделенной теплоты, если удельная теплота сгорания березовых дров составляет 15 МДж/кг.
15МДж = 15∙109 Дж
Так как сгорело 5 поленьев по 1 кг, то всего сгорело 5 кг сухих березовых дров. Отсюда:
Q=qm=5·15·109=75·109 (Дж)=75 (МДж)
Задание EF17492
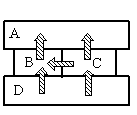
- A
- B
- C
- D
Алгоритм решения
- Определить тип теплопередачи.
- Вспомнить, как происходит этот тип теплопередачи.
- Сделав анализ рисунка, установить, какой брусок имеет указанную в задаче температуру.
Решение
Так как это твердые тела, поверхности которых соприкасаются друг с другом, и перенос тепла происходит без переноса вещества, то этот вид теплопередачи является теплопроводностью. Тепло всегда направлено от более нагретого тела к менее нагретому.
На рисунке видно, что самым нагретым телом является нижний брусок, так как он только отдает тепло, но не принимает его. Средний брусок справа менее нагрет, чем нижний, так как принимает от него тепло. Но он более теплый по сравнению со средним бруском слева, так как он делится с ним теплом. И оба этих бруска отдают свою энергию верхнему бруску, который сам только принимает тепло, но не отдает его. Следовательно, именно он имеет температуру +40 оС.
Ответ: A
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17563
Какую массу воды можно нагреть до кипения при сжигании в костре 1,8 кг сухих дров, если в окружающую среду рассеивается 95% тепла от их сжигания? Начальная температура воды 10 оС, удельная теплота сгорания сухих дров λ = 8,3 ⋅ 106 Дж/кг.
Алгоритм решения
1.Записать исходные данные.
2.Записать формулу для расчета количества теплоты, необходимого для нагревания вещества.
3.Записать формулу для расчета количества теплоты, выделенного при сгорании топлива.
5.Подставить известные данные и произвести вычисления.
Решение
Запишем исходные данные:
• Начальная температура воды: t0 = 10 oC.
• Конечная температура воды: tкип = 100 oC.
• Масса дров: mд = 1,8 кг.
• Удельная теплота сгорания дров: λ = 8,3∙106 Дж/кг.
• Удельная теплоемкость воды: c = 4200 Дж/(кг∙К).
Вода при нагревании до температуры кипения получит следующее количество теплоты:
Q1=cmв(tкип−t0)
При полном сгорании дров выделится следующее количество теплоты:
Q2=λmд
Так как в окружающую среду выделится 95% тепла, то вода получит лишь 5%. Следовательно:
Q1=0,05Q2
Отсюда:
cmв(tкип−t0)=0,05λmд
mв=0,05λmдc(tкип−t0)
mв=0,05·8,3·106·1,84200(100−10)≈1,98 (кг)
Округлим ответ до целых и получим 2 кг воды.
Ответ: 2
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17701
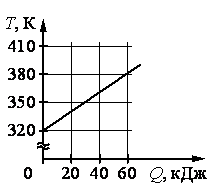
Ответ:
а) 1 кг
б) 2 кг
в) 3 кг
г) 4 кг
Алгоритм решения
1.Записать исходные данные и перевести единицы измерения величин в СИ.
2.По графику определить начальную температуру вещества.
3.Выбрать любую точку графика для определения количества теплоты и конечной температуры вещества.
4.Записать количество теплоты, которое получает тело при нагревании.
5.Выполнить решение в общем виде.
6.Вычислить массу, подставив данные, полученные из графика.
Решение
Запишем исходные данные и те данные, что получится выделить из графика:
• Удельная теплоемкость вещества: c = 500 Дж/(кг∙К).
• Начальная температура вещества: t0 = 320 К.
• Конечная температура вещества: t = 380 К.
• Количество полученной теплоты: Q = 60 кДж.
60 кДж = 60∙103 Дж
Количество теплоты вычисляется по формуле:
Q=cm(t−t0)
Отсюда масса вещества равна:
m=Qc(t−t0)=60·103500(380−320)=2 (кг)
Ответ: б
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 4k
Внутренняя энергия: первый закон термодинамики
Что такое внутренняя энергия в термодинамике
Наука термодинамика изучает тепловые явления. По сравнению с молекулярно-кинетической теорией, заключения которой основаны на знаниях о молекулярной структуре вещества, в термодинамике принимают во внимание общепринятые законы, описывающие тепловые процессы и применение характеристик макроскопических систем.
В данном случае выводы построены на комплексе фактов, сформулированных опытным путем, и не связаны со сведениями о внутреннем составе вещества. С другой стороны, во многих ситуациях термодинамика опирается на основы молекулярно-кинетические модели с целью наглядной демонстрации заключений.
Предметом изучения в термодинамике являются изолированные системы тел, которые пребывают в состоянии термодинамического равновесия. Подобные условия формируются в том случае, когда не наблюдаются макроскопические явления. Одним из ключевых свойств системы в равновесии с точки зрения термодинамики служит выравнивание температурных параметров каждой из ее частей.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
При стороннем воздействии на термодинамическую систему можно наблюдать в итоге переход этой системы в другое состояние равновесия. Этот процесс является термодинамическим. В случае низкой скорости течения рассматриваемого процесса в какой-либо временной момент система приближается к равновесию. Квазистатическими процессами называют такие, которые состоят из последовательности положений равновесия.
Одним из важных определений в термодинамике считают внутреннюю энергию. При рассмотрении этого понятия необходимо понимать, что любое из макроскопических тел наделено энергией, которая заключена внутри этих тел непосредственно.
Исходя из принципов молекулярно-кинетической теории, внутренняя энергия вещества состоит из кинетической энергии, заключенной во всех атомах и молекулах, а также потенциальной энергии их взаимодействия.
В процессе изучения понятия внутренней энергии в термодинамике рассматривают частный случай идеального газа. Внутренняя энергия данного вещества представляет собой сумму кинетической энергии каждой из составных частиц, которые постоянно движутся в неопределенных направлениях, то есть прибывают в состоянии теплового движения. Этот параметр определяется температурными характеристиками вещества и не обладает зависимостью от объема, что отражено в законе Джоуля.
Согласно положениям молекулярно-кинетической теории, внутренняя энергия 1 моля идеального газа с одним атомом, к примеру, гелия или неона, молекулы в котором движутся поступательно, вычисляется по формуле:
(U=frac{3}{2}N_{A}kT=frac{3}{2}RT)
Зная, что имеется определенная зависимость между потенциальной энергией взаимодействия молекул и расстоянием, на которое эти молекулы удалены друг от друга, можно сделать вывод о зависимости внутренней энергии объекта не только от температурных параметров, но и от объема. Данное заключение допустимо записать в виде уравнения:
(U = U(T,V))
В результате внутренняя энергия тела однозначно определяется макроскопическими характеристиками состояния, в котором пребывает рассматриваемое тело. Параметр не меняется в зависимости от способа формирования этого состояния. В термодинамике принято рассматривать внутреннюю энергию, как функцию состояния. Таким образом, подобная характеристика может менять значение в том случае, когда силы, оказывающие на тело воздействие извне, совершают какую-либо работу.
Свойства
При рассмотрении свойств внутренней энергии целесообразно принять это понятие за компонент полной энергии. Исходя из этого, перечислим следующие свойства внутренней энергии:
- Внутренняя энергия представляет собой индифферентный скаляр. Важно заметить, что к ней не относят кинетическую энергию, которой обладают система в виде единого целого и внутренняя среда системы. К таковым причисляют энергию смещения простейших областей в процессе деформирования твердых объектов, энергию потоков жидких и газообразных сред.
- Внутренняя энергия является аддитивной величиной. Смысл этого утверждения состоит в равенстве внутренней энергии системы суммарным величинам внутренних энергий, характерных для подсистем.
- Внутреннюю энергию определяют с точностью до неизменяемого слагаемого, которое зависит от заданного отчетного нуля и не влияет на величину изменения внутренней энергии, полученной путем измерений в процессе экспериментов.
Пример 1
Предположим, что имеется некий закупоренный сосуд с небольшим количеством воды на дне. Если в него закачивать воздух, то, спустя определенное время, крышка будет выдавлена давлением. При этом в сосуде формируется туман. Если проанализировать описанное явление, то можно прийти к выводу о том, что воздух внутри резервуара обладал некоторой силой. Когда пробка вылетела, воздухом совершалась работа. С другой стороны, такая возможность характерна лишь для объектов, имеющих энергетический запас. Исходя из вышесказанного, можно заключить, что воздух в сосуде обладал определенной энергии.
Первый закон термодинамики, формулы
С помощью первого начала термодинамики конкретизируют общую физическую закономерность, описывающую явление сохранения энергии в случае термодинамических систем. Согласно традиционному подходу, первое начало представляет собой отношение, формулирующее взаимосвязь внутренней энергии, работы и теплоты.
Согласно пониманию У. Томсона первое начало термодинамики представляют в виде дефиниции внутренней энергии для закрытых систем. Таким образом, внутренняя энергия U в некотором процессе изменяется на величину, вычисляемую путем суммирования количества тепловой энергии Q, участвующей в обмене между системой и внешней средой, и работы A , которую совершает непосредственно рассматриваемая система, либо произведенной над этой системой: (Delta Uequiv Q+A).
Проанализировав математическое соотношение, можно заметить, что в данном случае допустимо использовать термодинамический принцип знаков для теплоты и работы. Применительно к этим величинам, в термодинамике оперируют определениями из смежных физических направлений. С другой стороны, понятие количества чистоты используют лишь в термодинамике.
Исходя из вышесказанного, целесообразно определять первое начало термодинамики по Клаузиусу. Тогда теплоту рассчитывают по известным величинам внутренней энергии и работы. В таком случае формула примет следующий вид:
(Qequiv Delta U+A )
Если воспользоваться принципом знаков для теплоты и работы, то следует поменять знак у работы А на противоположный. Тогда соотношение будет записано таким образом:
(Qequiv Delta U-A.)
Задачи
Задача 1
Аэростат обладает объемом (500 м^{3}). Конструкция заполнена газообразным веществом, роль которого играет гелий. Давление во внутренней среде, состоящей из газа, равно 105 Па. Когда аэростат нагревается под лучами солнца, температурный режим внутри повышается с отметки в 10°C до значения в 25°C. Необходимо выяснить, на какую величину изменилась внутренняя энергия газообразной среды.
Решение
Из курса теории вспомним, что гелий является одноатомным газом. В таком случае допустимо применить в процессе решения задания соотношение, характеризующее внутреннюю энергию следующего формата:
(U_{1}=frac{3}{2}frac{m}{M} RT_{1})
По условию примера заметим, что температура повышается и достигает второго значения. Запишем для него формулу:
(U_{2}=frac{3}{2}frac{m}{M} RT_{2})
Тогда целесообразно представить запись соотношения, описывающего процесс, когда изменяется величина энергии:
(Delta U = U_{2} — U_{1} =frac{3}{2}frac{m}{M} R(T_{2} — T_{1}))
Заметим, что для вычисления искомого значения необходимо определить, чему равна масса. Узнать, сколько весит гелий в конкретном случае не представляется возможным. В связи с этим, целесообразно воспользоваться закономерностью Менделеева-Клапейрона, описывающей связь между исходной температурой, сформированным давлением и объемом газообразного вещества:
(frac{m R}{M} = frac{pV}{ T_{1}})
Путем подстановки записанного соотношения в ранее выведенную формулу получим следующее справедливое равенство для расчета искомой величины:
(Delta U = frac{3}{2}pV(frac{ T_{2} }{ T_{1}}- 1) approx 4cdot 10^{6} Дж.)
Ответ: внутренняя энергия изменится на (4cdot 10^{6} Дж).
Задача 2
Цилиндрический объект установили под увесистый поршневой механизм. Рассматриваемый цилиндр заполнен углекислым газом, молярная масса которого составляет 0,044 кг/мoль. Масса газообразного вещества равна 200 гр. Изменение температуры среды можно определить, как 88 K. Нужно вычислить величину совершаемой в процессе работы.
Решение
Заметим, что в описанной ситуации рассматривается расширение газообразного вещества при определенном и неизменном давлении, сформированным внешней атмосферной средой и поршневой установкой. Тогда целесообразно записать работу газа в виде следующего соотношения:
(A’ = p(V2 — V1))
Здесь V1 и V2 обозначают объем газообразной среды в начале и конце анализируемого процесса. Воспользуемся уже знакомым принципом Менделеева-Клапейрона, чтобы выразить произведения давления и объема, зафиксированные на разных этапах. Подставим полученные соотношения в формулу работы:
(A’ = frac{m R}{M} (Т2 — Т1) approx 3,3 Дж.)
Ответ: газ совершает работу, равную 3,3 Дж.
Задача 3
Газ совершает некую работу в процессе сжатия. Количество вещества составляет 3 моль. В результате температурный режим повысился на 100 К. Требуется вычислить, какую работу совершал газ, без учета тепловых потерь.
Решение
В первую очередь следует рассмотреть описанный в задаче процесс. Сжатие происходит при совершении внешней силой положительной работы. Таким образом, внутренняя энергия меняется, как и температура газообразного вещества. Запишем озвученное соотношение:
(А = Delta U)
Далее следует обратиться к формуле, описывающей то, как меняется внутренняя энергия:
(Delta U = frac{3}{2}vRDelta T)
Таким образом, путем подстановки записанного выражения в соотношение, определяющее работу, можно вычислить ее значение:
(А = -frac{3}{2}vR Delta T approx -1250 Дж.)
Ответ: работа, которую совершал газ под давлением, составляет -1250 Дж.
Задача 4
В процессе изменения состояния газообразного вещества меняются значения его давления и объема. Описать взаимную зависимость данных характеристик можно с помощью графика. На рисунке для наглядности продемонстрирована связь этих величин. Необходимо определить, чему равна работа газа.
Источник: class-fizika.ru
Решение
Заметим, что для вычисления работы в данном случае целесообразно определить значение площади, которой характеризуется закрашенная область на графике. На изображении с первого по второй и с третьего по четвертый отмечены изобарные процессы. Исходя из этой информации, запишем пару выражений для работы, совершаемой газом:
(А _{1-2}= р_{1}(V_{2}-V_{1}))
(А _{3-4}= р_{2}(V_{4}-V_{3}))
Отдельно нужно рассмотреть переход со второго этапа на третий. В процессе наблюдается изменение всех трех параметров. В связи с этим, запишем формулу для расчета работы:
(А _{2-3}= frac{р_{1}+р_{2}}{2} (V_{3}-V_{2}))
Проанализируем изменение объема газообразного вещества. В таком случае получим:
(V_{2} — V_{1} = V_{3} — V_{2} = V_{4} — V_{3} = Delta V)
Исходя из полученного выше соотношения, запишем выражение для расчета работы:
(А = (р_{1}+р_{2}+frac{р_{1}+р_{2}}{2}Delta V = frac{3}{2}(р_{1}+р_{2}) Delta V = 1800 Дж.)
Ответ: работа газа составляет 1800 Дж.
Внутренняя энергия
Тело состоит из молекул и, каждая молекула движется. Значит, она обладает энергией движения. Энергию движения называют кинетической энергией. Чем выше температура, тем быстрее двигаются молекулы, значит, тем больше их кинетическая энергия.
Молекулы могут действовать друг на друга – взаимодействовать. То есть, могут притягиваться к другим молекулам, или отталкиваться от других молекул. Физики говорят, когда есть взаимодействие (притяжение, или отталкивание), есть потенциальная энергия такого взаимодействия. Значит, каждая молекула обладает потенциальной энергией.
Способ подсчета внутренней энергии тел
Найдем внутреннюю энергию тела. Для этого посчитаем кинетическую энергию каждой молекулы. Затем сложим кинетические энергии всех молекул тела, получим суммарную кинетическую энергию.
Точно так же поступим с потенциальной энергией – посчитаем потенциальную энергию каждой молекулы тела и сложим потенциальные энергии всех молекул тела. Получим суммарную потенциальную энергию всех молекул.
Сложив общую кинетическую энергию молекул и общую потенциальную энергию, получим внутреннюю энергию тела.
Внутреннюю энергию тела обозначают символом U и измеряют в Джоулях в честь физика Джеймса Прескотта Джоуля.
[large boxed{ U = E_{text{к всех молекул}} + E_{text{п всех молекул}} }]
Примечание: Внутренняя энергия тела – это сумма кинетической и потенциальной энергии всех молекул этого тела.
(large U left( text{Дж} right) ) – внутренняя энергия тела.
(large E_{text{к всех молекул}} left( text{Дж} right) ) – суммарная энергия движения молекул (кинетическая энергия).
(large E_{text{п всех молекул}} left( text{Дж} right) ) – суммарная энергия притяжения и отталкивания молекул (потенциальная энергия).
Можно ли изменять внутреннюю энергию тел
Внутреннюю энергию тела можно изменять – увеличивать, или уменьшать. Это можно сделать двумя способами: с помощью работы, либо с помощью теплопередачи.
Для того, чтобы увеличить внутреннюю энергию тела, нужно его нагреть (передать ему тепловую энергию), или совершить работу над телом.
А чтобы внутреннюю энергию тела уменьшить, его нужно охладить (отобрать у него тепловую энергию), или сделать так, чтобы тело совершило работу над каким-либо другим телом.
Примечание: Внутренняя энергия тела уменьшается, когда тело совершает работу.
Рис.1. Два способа изменить внутреннюю энергию тела
Читайте подробнее о нескольких способах теплопередачи.
От чего зависит внутренняя энергия тела
Внутренняя энергия тела зависит от:
— температуры тела,
— агрегатного состояния (газообразное, жидкое, твердое),
— некоторых других факторов.
Чем выше температура тела, тем больше его внутренняя энергия.
Математики запишут это так: Внутренняя энергия – это функция температуры. Или сокращенно:
[large boxed{ U = f(T)}]
Символом T обозначена температура тела.
При равных температурах газы обладают наибольшей внутренней энергией. Внутренняя энергия жидкостей меньше, чем у газов. А внутренняя энергия твердых тел ниже, чем энергия жидкостей. Это можно изобразить с помощью рисунка 2:
Рис.2. При переходе из одного агрегатного состояния в другое, внутренняя энергия тела изменяется
Выводы
- Внутренняя энергия – это энергия, скрытая внутри тела;
- Эта энергия является суммарной энергией движения и взаимодействия всех молекул, из которых состоит тело;
- Можно изменять внутреннюю энергию тел двумя способами: либо работой, либо теплопередачей;
- Нагревая тело, повышаем его внутреннюю энергию, а охлаждая – понижаем ее, так как внутренняя энергия зависит от температуры. Математики скажут: Энергия, скрытая внутри тела, является функцией температуры.
- Внутренняя энергия тела зависит и от агрегатного состояния, в котором находится вещество (газообразное, жидкое, твердое), а, так же, от некоторых других факторов;
- Когда тело совершает работу, его внутренняя энергия уменьшается (например, воздух, расширяясь, теряет часть внутренней энергии);
- Когда мы совершаем работу над телом, то мы увеличиваем его внутреннюю энергию.
Оценка статьи:
Загрузка…
ТЕРМОДИНАМИКА
Внутренней энергией тела в молекулярно-кинетической теории называется суммарная кинетическая энергия хаотического движения всех молекул тела плюс суммарная потенциальная энергия взаимодействия этих молекул друг с другом (но не с другими телами).
Внутренняя энергия одноатомного идеального газа
В одноатомном идеальном газе молекулы не взаимодействуют друг с другом, по этому его внутренняя энергия такого газа будет определяться как кинетическая энергия беспорядочного движения молекул.
Тогда внутренняя энергия будет определяться как произведение средней кинетической энергии и количества молекул из которых состоит наш газ:
Вспоминаем что средняя кинетическая энергия поступательного движения молекул определяется как:
А количество молекул в газе можно найти следующим образом:
Делаем небольшие алгебраические преобразования.
Так как произведение числа Авогадро и постоянную Больцмана
называют универсальной газовой постоянной
, получаем:
Из полученного уравнения видно что внутренняя энергия одноатомного идеального газа напрямую зависит от его температуры. В таком случае изменение внутренней энергии можно определить как:
Работа газа при изобарном процессе
Работа газа при произвольном процессе равна площади под гафиком процесса в координатах (P,V). При линейной зависимости давления от объема равна:
Первый закон термодинамики количество теплоты сообщаемое газу идет на изменение внутренней энергии этого газа (), а так же на совершение работы этим газом (
).
Применение первого закона термодинамики к изопроцессам.
Изобарный
Изохорный
Изотермический
Адиабатный
Адиабатный процесс — процесс протекающий без внешнего теплообмена с окружающей средой.
Еще одна интерпретация первого закона термодинамики звучит следующим образом: «Изменение внутренней энергии () тела происходит в результате теплообмена (теплопередачи) либо совершения работы (
) над этим телом».
Количество теплоты () — энергия которую приобретает или теряет тело в результате теплообмена.
Теплопередача — это процесс передачи тепла от более нагретого тела жидкости или газа к менее нагретому. Можно выделить три вида теплопередачи: 1. Теплопроводность — передача тепла между различными частями одного тела, либо между телами при их непосредственном контакте; 2. Конвекция — вид теплообмена, при котором тепло передается струями и потоками жидкости или газа; 3. Излучение — передача тепла с помощью инфракрасного спектра электромагнитных волн.
Количество теплоты при нагревании или охлаждении
Удельная теплоемкость () — количество теплоты необходимое чтоб нагреть 1 килограмм данного вещества на 1 градус.
Количество теплоты при плавлении (кристаллизации) При плавлении тело получает тепло, по этому количество теплоты берется со знаком плюс, а при кристаллизации, жидкость напротив отдает свою энергию, по этому количество теплоты имеет отрицательное значение.
Удельная теплота плавления и кристаллизации () — количество теплоты необходимое для того, чтоб расславить 1 килограмм данного вещества.
Количество теплоты при парообразовании (конденсации) При кипении жидкость получает тепло, по этому количество теплоты берется со знаком плюс, а при конденсации, пар напротив теряет энергию, по этому количество теплоты имеет отрицательное значение.
Удельная теплота парообразования и конденсации () — количество теплоты необходимое для того, чтоб превратить в пар 1 килограмм жидкости.
Количество теплоты выделяемое при сгорании топлива
Удельная теплота сгорания () — количество теплоты выделяемое при сгорании одного килограмма топлива.
Уравнение теплового баланса В изолированной системе в результате теплообмена устанавливается тепловое равновесие, а католичества теплоты получаемые или отдаваемые телами этой системы в сумме будут равны нулю.
Тепловая машина
Тепловая машина — устройство, преобразующее тепловую энергию в механическую работу (тепловой двигатель) или механическую работу в тепло (холодильник).
В циклическом процессе изменение внутренней энергии за цикл равно нулю, а работа выполняемая машиной за цикл будет равна разности теплоты полученной от нагревателя
и теплоты отданной холодильнику
.
КПД циклического процесса
КПД идеальной тепловой машины работающей по циклу Карно
— соответственно температуры нагревателя и холодильника.
1. Внутренняя энергия газа
Из курса физики основной школы вы знаете, что сумму кинетической энергии хаотического движения частиц и потенциальной энергии их взаимодействия называют внутренней энергией.
Внутренняя энергия U данной массы одноатомного идеального газа равна произведению средней кинетической энергии 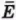
U = 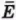
? 1. Объясните, почему внутренняя энергия U данной массы одноатомного идеального газа выражается формулой
Итак, внутренняя энергия идеального газа определяется только его абсолютной температурой и числом молекул в нем.
? 2. Объем одного моля газа при температуре 20 ºС и нормальном атмосферном давлении составляет 24 л.
а) Чему равна внутренняя энергия этого газа, если он одноатомный и его можно считать идеальным?
б) На какую высоту можно было бы забросить мяч массой 365 г, если бы можно было сообщить ему такую кинетическую энергию и пренебречь сопротивлением воздуха?
Выполнив это задание, вы сможете представить, как велика внутренняя энергия тела. Объясняется это тем, что скорость хаотического движения молекул в десятки и сотни раз превышает скорости движения окружающих нас тел. А кинетическая энергия пропорциональна квадрату скорости. Поэтому при увеличении скорости в 10 раз кинетическая энергия увеличивается в 100 раз, а при увеличении скорости в 100 раз кинетическая энергия увеличивается в 10 000 раз.
Внутреннюю энергию идеального одноатомного газа можно выразить также через его давление p и объем V.
? 3. Объясните, почему внутренняя энергия U данной массы одноатомного идеального газа выражается формулой
U = (3/2)pV. (2)
Подсказка. Воспользуйтесь формулой (1) и уравнением состояния идеального газа.
? 4. Из формулы (1) следует, что внутренняя энергия одного моля газа зависит только от его абсолютной температуры и количества вещества (числа молекул). А из формулы (2) следует, что она зависит от давления и объема, но зато не зависит от количества вещества. Объясните, почему тут нет противоречия.
? 5. Ширина класса 5 м, длина 10 м, а высота – 4 м. Температура воздуха 20 ºС, давление равно нормальному атмосферному давлению.
а) Чему была бы равна внутренняя энергия газа, заполняющего класс, если бы он был одноатомным? (Воздух состоит в основном из двухатомных молекул. Как показывает расчет, выходящий за рамки нашего курса, внутренняя энергия двухатомного газа при тех же макроскопических параметрах в 5/3 раза больше, чем внутренняя энергия одноатомного газа.)
б) На какую высоту можно было бы поднять автомобиль массой 1 т, затратив такую энергию?
в) Есть ли в условии лишние данные?
Результаты выполнения этого задания раскроют, какая огромная энергия «окружает» каждого из нас! А ведь мы ее практически не замечаем, считая воздух «пустотой».
Большую внутреннюю энергию имеют, конечно, и другие тела. Например, внутренняя энергия литра кипятка больше внутренней энергии того же литра воды при комнатной температуре на величину, равную работе, которую надо совершить для того, чтобы поднять легковой автомобиль на двенадцать этажей!
При изучении тепловых явлений мы учитываем только кинетическую энергию хаотического движения молекул и потенциальную энергию их взаимодействия. А ведь есть еще и во много раз большая энергия взаимодействия частиц в атомных ядрах. Вы знаете о ней из курса физики основной школы. К ядерной физике мы вернемся в 11-м классе.
Соотношение между различными видами энергии, которыми обладает данное тело, схематически представлено на рисунке 42.1. Мы видим, что непосредственно наблюдаемая механическая энергия составляет лишь очень малую долю всей энергии тела. Соблюсти масштаб на этом рисунке невозможно, потому что тепловая внутренняя энергия в тысячи раз больше механической, а ядерная – в миллионы раз больше тепловой.
Два способа изменения внутренней энергии
Из курса физики основной школы вы знаете, что внутреннюю энергию тела можно изменить двумя способами:
- совершая работу над телом – например, сжимая газ (рис. 42.2, а);
- посредством теплопередачи, то есть без совершения работы, – например, при контакте с более горячим телом (рис. 42.2, б). (Теплопередачу называют иногда также теплообменом.)
Напомним, что меру изменения внутренней энергии при теплопередаче называют количеством теплоты и обозначают Q. Количество теплоты измеряют в джоулях.
Как мы знаем, внутренняя энергия данной массы идеального газа определяется только его температурой и числом молекул. Поэтому при постоянном числе молекул изменить внутреннюю энергию идеального газа можно только изменив его температуру.
Например, при сжатии газа в теплоизолированном сосуде газ нагревается вследствие того, что над ним производят работу. Нагревание газа может быть при атом весьма заметным.
Поставим опыт
Поместим кусочек сухой ваты в толстостенный прозрачный цилиндр и быстро (резким толчком) вдвинем в цилиндр поршень (рис. 42.3).
Воздух в цилиндре нагреется так сильно, что вата воспламенится.
Нагревание газа при сжатии используют в дизельных двигателях: при сжатии горючая смесь в цилиндре нагревается настолько, что воспламеняется без искры.
Газовый процесс, который происходит в теплоизолированном сосуде, то есть без теплопередачи, называют адиабатным. Адиабатным можно считать также процесс, когда тепло- передачей можно пренебречь: например, если процесс происходит за время, в течение которого не успевает произойти теплообмен с окружающей средой.
При адиабатном расширении газ охлаждается. По этой причине, например, образуются облака. Поднимающийся влажный воздух попадает в более разреженные слои атмосферы, расширяется и вследствие этого охлаждается. Как мы увидим далее, при охлаждении ниже определенной температуры (точки росы) содержащийся в воздухе водяной пар конденсируется: образуются капельки тумана, из которого и состоят облака.
Увеличить или уменьшить температуру газа можно, конечно, и посредством теплопередачи. Например, сосуд с газом можно поместить над огнем, в кипящую воду или в морозильную камеру.
? 6. Изменяется ли, н если да, то как внутренняя энергия данной массы идеального газа:
а) при изотермическом расширении? сжатии?
б) при изобарном расширении? сжатии?
в) при изохорном охлаждении? нагревании?
г) при адиабатном сжатии? расширении?
2. Первый закон термодинамики
Итак, внутренняя энергия газа U может изменяться как вследствие того, что ему сообщают количество теплоты Q, так и потому, что внешние силы совершают работу A над газом.
Согласно закону сохранения энергии
изменение внутренней энергии газа ∆U равно сумме количества теплоты Q, переданного газу, и работы A, совершенной над газом:
∆U = Q + A. (3)
Закон сохранения энергии применительно к тепловым явлениям называют первым законом термодинамики. (Термодинамикой называют раздел физики, изучающий общие законы тепловых явлений.)
Как Q, так и A могут быть положительными, отрицательными или равными нулю. Если газ сжимают, то A > 0, а если он расширяется, то A < 0. Если объем газа не изменяется, то A = 0. Если газу передают некоторое количество теплоты, то Q > 0, а если газ отдает некоторое количество теплоты, то Q < 0.
В практических расчетах и при решении многих задач часто используют другую формулировку первого закона термодинамики. Дело в том, что при рассмотрении тепловых двигателей главный интерес представляет работа, совершенная самим газом (то есть силой давления, действующей со стороны газа на поршень; при расширении газа работа газа положительна).
Обозначим работу газа Aг. Она связана с работой A, совершенной внешними силами над газом, соотношением
Aг = –A.
При сжатии газа A > 0, Aг < 0; а при расширении газа A < 0, Aг > 0.
Используя понятие работы газа, первый закон термодинамики формулируют так:
количество теплоты, переданное газу, равно сумме изменения внутренней энергии газа и работы, совершенной газом:
Q = ∆U + Aг. (4)
Чтобы использовать соотношения (3) и (4) на практике, надо уметь находить выражения для изменения внутренней энергии газа и работы газа (или работы внешних сил).
Как найти изменение внутренней энергии газа?
Для одноатомного идеального газа внутренняя энергия выражается формулой (1), поэтому для изменения ∆U внутренней энергии получаем:
∆U = (3/2)νR∆T. (5)
Здесь ∆T = T2 – T1, ∆U = U2 – U1, а индексами 1 и 2 обозначены соответственно начальное и конечное состояния газа.
? 7. Начальная температура пяти молей гелия 100 ºС. Газ нагрели на 50 ºС.
а) Насколько увеличилась внутренняя энергия газа?
б) Есть ли в условии лишние данные?
Изменение внутренней энергии одноатомного идеального газа можно найти и с помощью формулы (2):
∆U = (3/2)∆(pV). (6)
Здесь ∆(pV) – изменение произведения давления на объем. Например, при переходе газа из состояния 1 в состояние 2
∆(pV) = p2V2 – p1V1. (7)
? 8. Чему равно изменение внутренней энергии одного моля одноатомного идеального газа:
а) при изобарном расширении, если давление газа равно p0, а объем газа увеличился от V0 до 3V0?
б) при изохорном охлаждении, если объем газа равен V0, а давление газа уменьшилось от p0 до 0,5p0?
в) в процессе, в котором начальные давление и объем газа равны p0 и V0, а конечные равны 2p0 и 3V0?
Есть ли в условии лишние данные?
Важным достоинством формулы (6) является то, что в нее не входят ни количество вещества в газе, ни его масса. Поэтому, например, если давление и объем газа остались неизменными, то не изменилась и внутренняя энергия газа, хотя при этом могла измениться его масса. Рассмотрим пример, в котором речь идет о воздухе, который состоит в основном из двух- атомных молекул. Их средняя кинетическая энергия при заданной температуре больше, чем у одноатомных молекул (двухатомные молекулы обладают еще кинетической энергией вращательного движения). Однако для выполнения следующего задания то, что воздух состоит из двухатомных молекул, несущественно.
? 9. До включения отопления температура воздуха в комнате объемом 60 м3 была равна 15 ºС. После включения отопления воздух нагрелся до 20 ºС. Давление воздуха постоянно и равно 105 Па.
а) На сколько процентов увеличилась средняя кинетическая энергия молекул в воздухе?
б) Как изменилась внутренняя энергия воздуха в комнате?
в) На сколько процентов изменилась концентрация молекул воздуха?
г) Насколько изменилась масса воздуха в комнате?
Как найти совершенную газом работу?
Рассмотрим сначала изобарное расширение газа в цилиндре под поршнем (рис. 42.4). Газ давит на поршень с силой F = pS, где p – давление газа, S – площадь поршня.
Если поршень переместился на ∆x, то совершенная газом работа Aг = F * ∆x = pS * ∆x. Так как S * ∆x = ∆V, получаем, что при изобарном расшинерии работа газа выражается формулой
Aг = p * ∆V. (8)
? 10. Используя рисунок 42.5, объясните, почему работа газа численно равна площади фигуры под графиком зависимости p(V).
Это свойство графика зависимости p(V) сохраняется и тогда, когда давление газа изменяется.
Пусть, например, график зависимости p(V) имеет вид, изображенный на рисунке 42.6. Процесс расширения газа мысленно разобьем на большое число этапов, в каждом из которых объем газа изменяется настолько мало, что его давление можно считать практически постоянным. Поскольку для каждого этапа работа газа численно равна площади под соответствующим участком графика, то и вся работа, совершенная газом при расширении, равна площади под всем графиком p(V).
? 11. Один моль идеального газа можно перевести из состояния 1 в состояние 2 многими способами. Рассмотрим процессы, которым соответствуют графики а и б (рис. 42.7).
а) В каком случае совершенная газом работа больше? Во сколько раз больше?
б) В каком случае изменение внутренней энергии газа больше? Во сколько раз больше?
в) В каком случае переданное газу количество теплоты больше? Во сколько раз больше?
На примере этого задания вы могли заметить, что изменение ∆U внутренней энергии данной массы идеального газа определяется только начальным и конечным состоянием газа.
Обусловлено это тем, что каждому состоянию данной массы газа (с определенными значениями p, V и T) соответствует одно определенное значение внутренней энергии, которое можно найти либо по формуле (1), либо по формуле (2).
А вот работа, совершенная газом при переходе из начального состояния в конечное, зависит от характера процесса, которым газ был переведен из начального состояния в конечное.
Действительно, работа газа численно равна площади под графиком зависимости p(V). А эта площадь зависит от того, какой вид имела функция p(V).
Если газ не расширяется, а сжимается (рис. 42.8), то внешние силы производят работу над газом. В таком случае говорят также, что газ производит отрицательную работу. Она численно равна взятой со знаком минус площади S под графиком зависимости p(V).
На том, что работа газа зависит от вида зависимости p(V), а не только от начального и конечного состояния, основан принцип действия тепловых двигателей (в следующем параграфе мы рассмотрим их подробнее).
В тепловых двигателях газ расширяется при высокой температуре. При атом давление газа велико, поэтому он совершает большую работу. А сжимают газ при более низкой температуре, когда давление газа меньше. Поэтому для того, чтобы вернуть газ в начальное состояние, внешние силы должны совершить меньшую работу.
Рассмотрим пример.
? 12. Газ совершает циклический процесс: переходит из состояния 1 в состояние 2 (рис. 42.9), а потом возвращается в состояние 1. При этом объем газа не должен быть меньше начального и больше конечного.
а) Какую максимально возможную работу может совершить газ при переходе 1–2, если давление газа не должно превышать 3p0?
б) Какую минимально возможную работу должны совершить внешние силы при переходе 2–1, если давление газа не должно быть меньше p0?
в) Насколько в этом случае работа газа при циклическом процессе больше работы внешних сил?
Применение первого закона термодинамики к изопроцессам и адиабатному процессу
? 13. Используя первый закон термодинамики, а также выражения для внутренней энергии и работы газа, объясните, почему:
а) при изохорном процессе Aг = 0, Q = ∆U, то есть сообщенное газу количество теплоты (напомним, что оно может быть как положительным, так и отрицательным) равно изменению внутренней энергии газа;
б) при изотермическом процессе ∆U = 0, Q = Aг, то есть сообщенное газу количество теплоты равно работе газа;
в) при изобарном процессе Aг ≠ 0, ∆U ≠ 0;
г) при адиабатном процессе Q = 0, Aг = –∆U, то есть при расширении газ совершает работу за счет уменьшения внутренней энергии, а при сжатии газа его внутренняя энергия увеличивается за счет работы внешних сил.
Подсказка. Если давление не изменяется, то ∆(pV) = p∆V.
Дополнительные вопросы и задания
14. На рисунках 42.10, а, б, в изображены графики трех процессов с данной массой одноатомного идеального газа. Чему равно изменение внутренней энергии газа для каждого из этих процессов при переходе 1–2?
15. При изобарном расширении данной массы одноатомного идеального газа его температура возросла от 0 ºС до 100 ºС. При этом газу было передано количество теплоты, равное 5 кДж.
а) Насколько изменилась внутренняя энергия газа?
б) Чему равно количество вещества в сосуде с газом?














