На этой странице вы можете рассчитать внутреннюю энергию идеального газа с помощью калькулятора онлайн или самостоятельно по формулам.
Содержание:
- калькулятор внутренней энергии идеального газа
- внутренняя энергия идеального газа через массу, молярную массу и температуру
- внутренняя энергия идеального газа через давление и объем
- внутренняя энергия идеального газа через количество вещества и температуру
- внутренняя энергия идеального газа через степени свободы
- степени свободы идеальных газов
Формула внутренней энергии идеального газа через массу, молярную массу и температуру
{U = dfrac{3}{2} cdot dfrac{m}{M} cdot R T}
U — внутренняя энергия газа
m — масса газа
M — молярная масса газа
R — универсальная газовая постоянная R = 8,314 462 618 153 24 Дж/(моль∙К)
T — абсолютная температура газа
Формула внутренней энергии идеального газа через давление и объем
{U = dfrac{3}{2} cdot p V}
U — внутренняя энергия газа
p — давление газа
V — объем газа
Формула внутренней энергии идеального газа через количество вещества и температуру
{U = dfrac{3}{2} cdot nu RT}
U — внутренняя энергия газа
ν — количество вещества (в молях)
R — универсальная газовая постоянная R = 8,314 462 618 153 24 Дж/(моль∙К)
T — абсолютная температура газа
Формула внутренней энергии идеального газа через степени свободы
{U = dfrac{i}{2} cdot nu RT}
U — внутренняя энергия газа
i — количество степеней свободы
ν — количество вещества (в молях)
R — универсальная газовая постоянная R = 8,314 462 618 153 24 Дж/(моль∙К)
T — абсолютная температура газа
Количество степеней свободы молекулы идеального газа
Число степеней свободы (i) — наименьшее число независимых координат, которое необходимо ввести, чтобы определить положение тела в пространстве.
- для одноатомного газа (гелий, неон, аргон, криптон, ксенон, радон, оганесон и т. д.) i=3;
- для двухатомного газа (водород, азот, кислород, фтор, хлор и т. д.) i=5;
- для трехатомного газа i=6;
- для многоатомного (>3) газа i=6;
Числом степеней
свободы
называется наименьшее число независимых
координат, которое необходимо ввести,
чтобы определить положение тела в
пространстве.
– число степеней свободы.
Рассмотрим
одноатомный
газ.
Молекулу такого газа можно считать
материальной точкой, положение
материальной точки
(рис. 11.1)
в пространстве определяется тремя
координатами.
Молекула может
двигаться в трех направлениях (рис.
11.2).
|
|
|
|
Рис. |
Рис. |
Следовательно,
обладает тремя поступательными степенями
свободы.
Молекула –
материальная точка.
Энергии вращательного
движения ,
т.к. момент инерции материальной точки
относительно оси, проходящей через
точку равен нулю
Для молекулы
одноатомного газа число степеней свободы
.
Рассмотрим
двухатомный
газ. В
двухатомной молекуле каждый атом
принимается за материальную точку и
считается, что атомы жёстко связаны
между собой, это гантельная модель
двухатомной молекулы. Двухатомная
жестко связанная молекула
(совокупность двух материальных точек,
связанных недеформируемой связью), рис.
11.3.
Положение центра
масс молекулы задаётся тремя координатами,
(рис. 11.4) это три степени свободы, они
определяют поступательное
движение молекулы. Но
молекула может совершать и вращательные
движения вокруг осей
и
,
это ещё две степени свободы, определяющиевращение
молекулы.
Вращение молекулы вокруг оси
невозможно, т.к. материальные точки не
могут вращаться вокруг оси, проходящей
через эти точки.
|
|
|
|
Рис. 11.3 |
Рис. 11.4 |
Для молекулы
двухатомного газа число степеней свободы
.
Рассмотрим
трёхатомный
газ. Модель
молекулы – три атома (материальные
точки), жёстко связанные между собой
(рис. 11.5).
Трёхатомная
молекула – жестко связанная молекула.
|
Рис. |
Молекула обладает
i = |
Для молекулы
трёхатомного газа число степеней свободы
.
Для многоатомной
молекулы число степеней свободы
.
Для реальных
молекул, не обладающих жёсткими связями
между атомами, необходимо учитывать
также степени свободы колебательного
движения, тогда число степеней свободы
реальной молекулы равно
i =
iпоступат + iвращат.+ iколеб. (11.1)
Закон равномерного распределения энергии по степеням свободы (закон Больцмана)
Закон о
равнораспределении энергии по степеням
свободы
утверждает, если система частиц находится
в состоянии термодинамического
равновесия, то средняя кинетическая
энергия хаотического движения молекул,
приходящаяся на 1 степень свободы
поступательного
и вращательного
движения, равна
Следовательно,
молекула, имеющая
степеней свободы, обладает энергией
, (11.2)
где
– постоянная Больцмана;
– абсолютная температура газа.
Внутренняя
энергия
идеального газа
– это сумма кинетических энергий всех
его молекул.
Находим внутреннюю
энергию
одного моля идеального газа.
,
где– средняя кинетическая энергия одной
молекулы газа,– число Авогадро (число молекул в одном
моле). Постоянная Больцмана.
Тогда
.
Если газ имеет
массу
,
то
– число молей, где
– масса моля, и внутренняя энергия газа
выражается формулой
. (11.3)
Внутренняя энергия
идеального газа зависит только от
температуры газа. Изменение внутренней
энергии идеального газа определяется
изменением температуры и не зависит от
процесса, при котором это изменение
произошло.
Изменение
внутренней энергии идеального газа
, (11.4)
где
– изменение температуры.
Закон равномерного
распределения энергии распространяется
на колебательное движение атомов в
молекуле. На колебательную степень
свободы приходится не только кинетическая
энергия, но и потенциальная, причём
среднее значение кинетической энергии,
приходящейся на одну степень равно
среднему значению потенциальной энергии,
приходящемуся на одну степень свободы
и равно
Следовательно,
если молекула имеет число степеней
свободы
i = iпоступат + iвращат + iколеб,
то средняя суммарная энергия молекулы:
,
а внутренняя энергия газа массы
:
. (11.5)
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Одним из важных вопросов при изучении термодинамических систем в физике является вопрос о возможности выполнения этой системой некоторой полезной работы. С концепцией работы тесно связано понятие внутренней энергии. В данной статье рассмотрим, что такое внутренняя энергия идеального газа, и приведем формулы для ее вычисления.
Идеальный газ
О газе, как агрегатном состоянии, не обладающем никакой силой упругости при внешнем воздействии на него и, как следствие, не сохраняющим объем и форму, знает каждый школьник. Концепция же газа идеального для многих остается непонятной и неясной. Объясним ее.

Идеальным называется любой газ, который удовлетворяет следующим двум важным условиям:
- Составляющие его частицы не имеют размера. В действительности они имеют размер, но он настолько мал в сравнении с расстояниями между ними, что его можно не учитывать во всех математических расчетах.
- Частицы не взаимодействуют друг с другом с помощью сил Ван-дер-Ваальса или сил иной природы. На самом деле во всех реальных газах такое взаимодействие присутствует, но его энергия пренебрежимо мала по сравнению со средней энергией кинетической частиц.
Описанным условиям удовлетворяют практически все реальные газы, температуры которых лежат выше 300 К, а давления не превышают одной атмосферы. Для слишком высоких давлений и низких температур наблюдает отклонение газов от идеального поведения. В таком случае говорят о реальных газах. Они описываются уравнением Ван-дер-Ваальса.
Понятие о внутренней энергии идеального газа
В соответствии с определением, под внутренней энергией системы понимают сумму кинетической и потенциальной энергий, заключенных внутри этой системы. Если применить эту концепцию к газу идеальному, то следует отбросить потенциальную составляющую. Действительно, поскольку частицы идеального газа не взаимодействуют друг с другом, то их можно считать движущимися свободно в абсолютном вакууме. Чтобы извлечь одну частицу из изучаемой системы, не нужно совершать работу против внутренних сил взаимодействия, поскольку этих сил не существует.
Таким образом, внутренняя энергия идеального газа всегда совпадает с его кинетической энергией. Последняя, в свою очередь, однозначно определяется молярной массой частиц системы, их количеством, а также средней скоростью поступательного и вращательного движения. Скорость движения зависит от температуры. Увеличение температуры приводит к увеличению внутренней энергии, и наоборот.
Формула для внутренней энергии
Обозначим внутреннюю энергию идеальной газовой системы буквой U. Согласно термодинамике, она определяется как разность энтальпии H системы и произведения давления на объем, то есть:
U = H — p*V.
В пункте выше мы выяснили, что величина U соответствует суммарной кинетической энергии Ek всех частиц газа:
U = Ek.
Из статистической механики в рамках положений молекулярно-кинетической теории (МКТ) идеального газа следует, что средняя кинетическая энергия одной частицы Ek1 равна следующей величине:
Ek1 = z/2*kB*T.
Здесь kB и T — постоянная Больцмана и температура, z — число степеней свободы. Полную кинетическую энергию системы Ek можно получить, если умножить Ek1 на количество частиц N в системе:
Ek = N*Ek1 = z/2*N*kB*T.
Таким образом, мы получили формулу для внутренней энергии идеального газа, записанную в общем виде через абсолютную температуру и число частиц в закрытой системе:
U = z/2*N*kB*T.
Одноатомный и многоатомный газ
Записанная в предыдущем пункте статьи формула для U является неудобной для ее практического использования, поскольку количество частиц N определить трудно. Тем не менее, если учесть определение количества вещества n, то это выражение можно переписать в более удобной форме:
n = N/NA; R = NA*kB = 8,314 Дж/(моль*К);
U = z/2*n*R *T.
Число степеней свободы z зависит от геометрии составляющих газ частиц. Так, для моноатомного газа z = 3, поскольку атом может независимо двигаться только в трех направлениях пространства. Если же газ является двухатомным, то z = 5, так как к трем поступательным степеням свободы добавляются еще две вращательные. Наконец, для любого другого многоатомного газа z = 6 (3 поступательные и 3 вращательные степени свободы). С учетом сказанного, можно записать в следующем виде формулы внутренней энергии идеального газа одноатомного, двухатомного и многоатомного:
U1 = 3/2*n*R*T;
U2 = 5/2*n*R*T;
U≥3 = 3*n*R*T.
Пример задачи на определение внутренней энергии
В баллоне объемом 100 литров находится чистый водород под давлением 3 атмосферы. Полагая водород идеальным газом при данных условиях, необходимо определить, чему равна его внутренняя энергия.

В записанных выше формулах для U присутствует количество вещества и температура газа. В условии же задачи совершенно ничего об этих величинах не сказано. Чтобы решить задачу, необходимо вспомнить универсальное уравнение Клапейрона-Менделеева. Оно имеет показанный на рисунке вид.
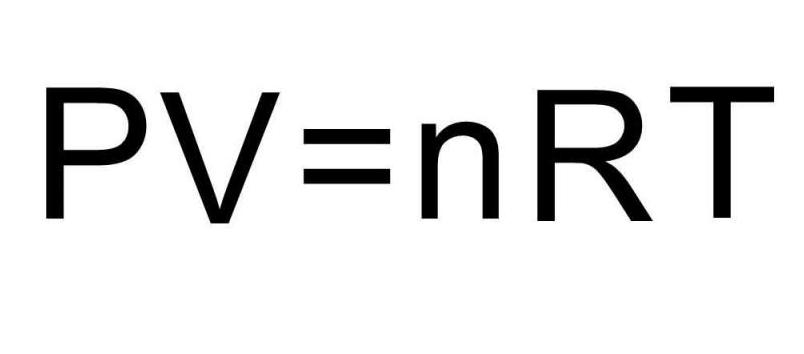
Поскольку водород H2 является двухатомной молекулой, то формула для внутренней энергии запишется в виде:
UH2 = 5/2*n*R*T.
Сравнивая оба выражения, приходим к конечной формуле для решения задачи:
UH2 = 5/2*P*V.
Остается перевести единицы давления и объема из условия в систему единиц СИ, подставить соответствующие значения в формулу для UH2 и получить ответ: UH2 ≈ 76 кДж.
Автор:
13-01-2019 19:00
Жду ваши вопросы и мнения в комментариях
Числом степеней свободы механической системы называют количество независимых величин, с помощью которых может быть задано положение системы.
Внутренняя энергия идеального газа представляет собой сумму только кинетической энергии всех молекул, а потенциальной энергией взаимодействия можно пренебречь:
U=∑Ek0=NEk0=mNAM·ikT2=i2·mMRT=i2νRT=i2pV
i — степень свободы. i = 3 для одноатомного (или идеального) газа, i = 5 для двухатомного газа, i = 6 для трехатомного газа и больше.
Изменение внутренней энергии идеального газа в изопроцессах
| Основная формула |
ΔU=32·mMRT=32νRT=32νR(T2−T1) |
| Изотермический процесс |
ΔU=0 Температура при изотермическом процессе — величина постоянная. Так как внутренняя энергия идеального газа постоянной массы в замкнутой системе зависит только от изменения температуры, то она тоже остается постоянной. |
| Изобарное расширение |
ΔU=32νR(T2−T1)=32(pV2−pV1)=32pΔV |
| Изохорное увеличение давления |
ΔU=32νR(T2−T1)=32(p2V−p1V)=32VΔp |
| Произвольный процесс |
ΔU=32νR(T2−T1)=32(p2V2−p1V1) |
Пример №1. На рисунке показан график циклического процесса, проведенного с идеальным газом. На каком из участков внутренняя энергия газа уменьшалась?
Внутренняя энергия газа меняется только при изменении температуры. Так как она прямо пропорциональная температуре, то уменьшается она тогда, когда уменьшается и температура. Температура падает на участке 3.
Работа идеального газа
Если газ, находящийся под поршнем, нагреть, то, расширяясь, он поднимет поршень, т.е. совершит механическую работу.
Механическая работа вычисляется по формуле:
A=Fscosα
Перемещение равно разности высот поршня в конечном и начальном положении:
s=h2−h1
Также известно, что сила равна произведению давления на площадь, на которое это давление оказывается. Учтем, что направление силы и перемещения совпадают. Поэтому косинус будет равен единице. Отсюда работа идеального газа равна произведению давления на площадь поршня:
Работа идеального газа
F=pS
p — давление газа, S — площадь поршня
Работа, необходимая для поднятия поршня — полезная работа. Она всегда меньше затраченной работы, которая определяется изменением внутренней энергии идеального газа при изобарном расширении:
A‘=p(V2−V1)=pΔV>0
Внимание! Знак работы определяется только знаком косинуса угла между направлением силы, действующей на поршень, и перемещением этого поршня.
Работа идеального газа при изобарном сжатии:
A‘=p(V2−V1)=pΔV<0
Работа идеального газа при нагревании газа:
A‘=νRΔT=νR(T2−T1)=mMνRΔT
Внимание! В изохорном процессе работа, совершаемая газом, равна нулю, так как работа газа определяется изменением его объема. Если изменения нет, работы тоже нет.
Геометрический смысл работы в термодинамике
В термодинамике для нахождения работы можно вычислить площадь фигуры под графиком в осях (p, V).
Примеры графических задач
| Изобарное расширение:
A‘=p(V2−V1) A‘>0 |
 |
| Изобарное сжатие:
A‘=p(V2−V1) A‘<0 |
 |
| Изохорное охлаждение:
V=const A‘=0 |
 |
|
Изохорное охлаждение и изобарное сжатие: 1–2: A‘=0 2–3: A‘=pΔV<0 |
 |
| Замкнутый цикл:
1–2: A‘>0 2–3: A‘=0 3–4: A‘<0 4–1: A‘=0 A‘=(p1−p3)(V2−V1) |
 |
| Произвольный процесс:
A‘=p1+p22(V2−V1) |
 |
Пример №2. На pV-диаграмме показаны два процесса, проведенные с одним и тем же количеством газообразного неона. Определите отношение работ A2 к A1 в этих процессах.
Неон — идеальный газ. Поэтому мы можем применять формулы, применяемые для нахождения работы идеального газа. Работа равна площади фигуры под графиком. С учетом того, что в обоих случаях изобарное расширение, получим:
A2=p(V2−V1)=4p(5V−3V)=4p2V=8pV
A1=p(V2−V1)=p(5V−V)=4pV
Видно, что работа, совершенная во втором процессе, вдвое больше работы, совершенной газом в первом процессе.
Задание EF17505

Для каждой величины подберите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
- Определить по графику, как меняется давление.
- Определить, как меняется объем.
- Определить, отчего зависит внутренняя энергия газа, и как она меняется в данном процессе.
Решение
На графике идеальный одноатомный газ изотермически сжимают, так как температура остается неизменной, а давление увеличивается. При этом объем должен уменьшаться. Но внутренняя энергия идеального газа определяется его температурой. Так как температура постоянна, внутренняя энергия не изменяется.
Ответ: 123
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17758
Один моль аргона, находящийся в цилиндре при температуре T1=600 K и давлении p1=4⋅105 Па, расширяется и одновременно охлаждается так, что его температура при расширении обратно пропорциональна объёму. Конечное давление газа p2=105 Па. Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A=2493 Дж?
Алгоритм решения
1.Записать исходные данные.
2.Записать уравнение состояния идеального газа.
3.Записать формулу для расчета внутренней энергии газа.
4.Используя первое начало термодинамики, выполнить общее решение задачи.
5.Подставив известные данные, вычислить неизвестную величину.
Решение
Запишем исходные данные:
• Начальная температура газа: T1 = 600 К.
• Начальное давление: p1 = 4∙105 Па.
• Конечное давление: p2 = 105 Па.
• Работа, совершенная газом: A = 2493 Дж.
Аргон является одноатомным газом. Поэтому для него можно использовать уравнение состояния идеального газа:
pV=νRT
Внутренняя энергия одноатомного идеального газа пропорциональна температуре:
U=32νRT
Внутренняя энергия аргона до расширения и после него:
U1=32νRT1
U2=32νRT2
Согласно условию задачи, температура при расширении обратно пропорциональна объёму. Следовательно:
T=constV
T1V1=T2V2
Выразим конечную температуру:
T2=T1V1V2
Составим уравнение состояния газа для состояний аргона 1 и 2:
p1V1=νRT1
p2V2=νRT2
Отсюда:
νR=p1V1T1=p2V2T2
Отсюда отношение объема аргона в состоянии 1 к объему газа в состоянии 2 равно:
V1V2=p2T1p1T2
Подставим это отношение в формулу для конечной температуры:
T2=T1V1V2=p2T12p1T2
Отсюда:
T2=T1√p2p1
Отсюда внутренняя энергия газа в состоянии 2 равна:
U2=32νRT1√p2p1
Уменьшение внутренней энергии аргона составило (изначально она была выше):
ΔU=U1−U2=32νRT1−32νRT1√p2p1=32νRT1(1−√p2p1)
В соответствии с первым началом термодинамики уменьшение внутренней энергии равно сумме совершённой работы и количества теплоты, отданного газом:
ΔU=Q+A
Следовательно, газ отдал следующее количество теплоты:
Q=ΔU−A=32νRT1(1−√p2p1)−A
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17966
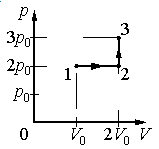
Ответ:
а) р0V0
б) 2р0V0
в) 4р0V0
г) 6р0V0
Алгоритм решения
1.Определить, на каком участке графика совершается работа.
2.Записать геометрический смысл работы.
3.Извлекая данные из графика, вычислить работу, совершенную газом.
Решение
Работа совершается только тогда, когда газ меняет объем. Поэтому работа совершается только на участке 1–2.
Работа идеального газа равна площади фигуры, заключенной под графиком термодинамического процесса в координатах (p, V).
Давление газа при этом равно 2p0, а объем равен разности 2V0 и V0. Следовательно, работа, совершенная газом, будет равна произведению:
A=2p0(2V0−V0)=2p0V0
Ответ: б
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 15.1k
Главная
»
Самолетостроение
»
Физика (3 семестр)
»
Внутренняя энергия как функция состояния. Расчет внутренней энергии многоатомных газов.
Внутренняя энергия как функция состояния. Расчет внутренней энергии многоатомных газов.
Внутренняя энергия U как функция состояния вводится первым началом термодинамики, согласно которому разность между теплотой Q, переданной системе, и работой W, совершаемой системой, зависит только от начального и конечного состояний системы и не зависит от пути перехода, т.е. представляет изменение фуникции состояния ΔU
где U1 и U2 — внутренняя энергия системы в начальном и конечном состояниях соответственно. Уравнение (1) выражает закон сохранения энергии в применении к термодинамическим процессам, т.е. процессам, в которых происходит передача теплоты. Для циклического процесса, возвращающего систему в начальное состояние, ΔU=0. В изохорных процессах, т.е. процессах при постоянном объеме, система не совершает работы за счет расширения, W=0 и теплота, переданная системе, равна приращению внутренней энергии: Qv=ΔU. Для адиабатических процессов, когда Q=0, ΔU=-W.
Внутренняя энергия тела определяет его тепловое состояние и изменяется при переходе из одного состояния в другое
Рассчитать внутреннюю энергию можно только для идеального газа, т.к. молекулы не взаимодействуют между собой и потенциальная энергия их равна нулю
где i — степень свободы. Для одноатомного газа (например, инертные газы) i = 3, для двухатомного — i =5.
Из этих формул видно, что внутренняя энергия идеального газа зависит только от температуры и числа молекул и не зависит ни от объема, ни от давления. Поэтому изменение внутренней энергии идеального газа определяется только изменением его температуры и не зависит от характера процесса, в котором газ переходит из одного состояния в другое:
где ΔT = T2 — T1.
Вывод формулы
Средняя кинетическая энергия молекулы
Число молекул в газе
Следовательно, внутренняя энергия идеального газа
Учитывая, что k⋅NA = R — универсальная газовая постоянная, имеем
— внутренняя энергия идеального газа.
Друзья! Приглашаем вас к обсуждению. Если у вас есть своё мнение, напишите нам в комментарии.











