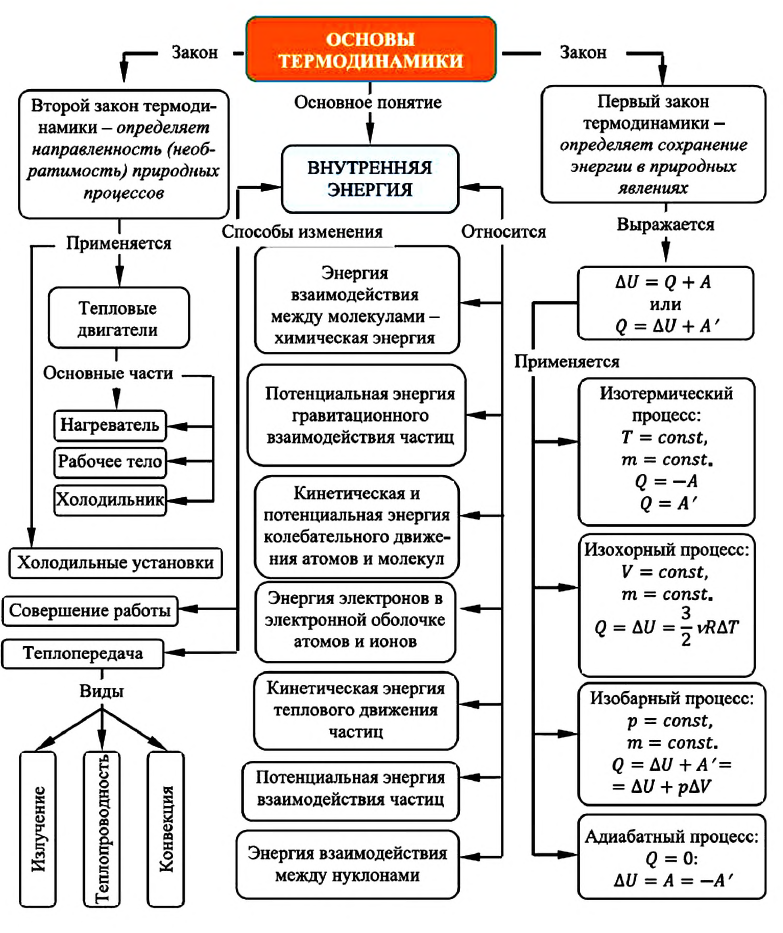
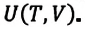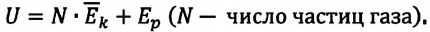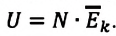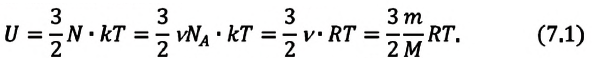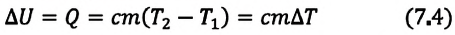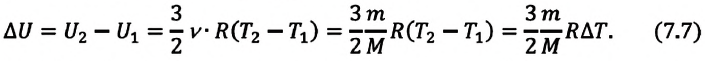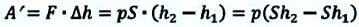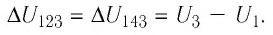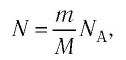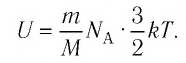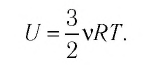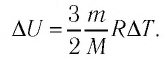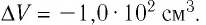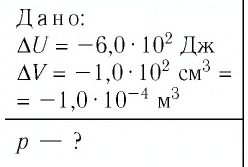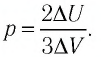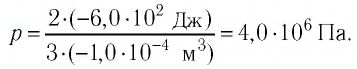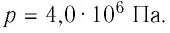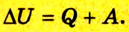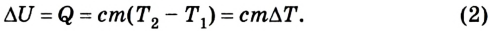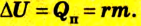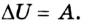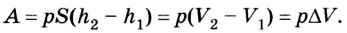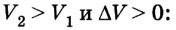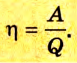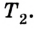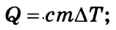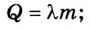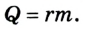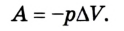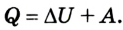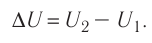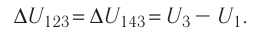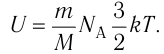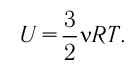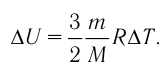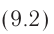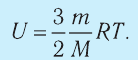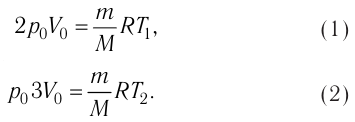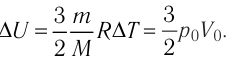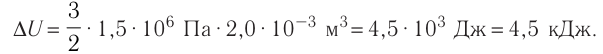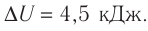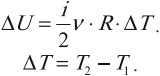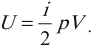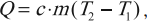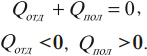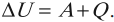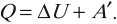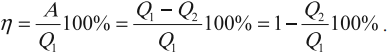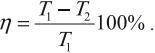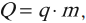Внутренняя энергия: первый закон термодинамики
Что такое внутренняя энергия в термодинамике
Наука термодинамика изучает тепловые явления. По сравнению с молекулярно-кинетической теорией, заключения которой основаны на знаниях о молекулярной структуре вещества, в термодинамике принимают во внимание общепринятые законы, описывающие тепловые процессы и применение характеристик макроскопических систем.
В данном случае выводы построены на комплексе фактов, сформулированных опытным путем, и не связаны со сведениями о внутреннем составе вещества. С другой стороны, во многих ситуациях термодинамика опирается на основы молекулярно-кинетические модели с целью наглядной демонстрации заключений.
Предметом изучения в термодинамике являются изолированные системы тел, которые пребывают в состоянии термодинамического равновесия. Подобные условия формируются в том случае, когда не наблюдаются макроскопические явления. Одним из ключевых свойств системы в равновесии с точки зрения термодинамики служит выравнивание температурных параметров каждой из ее частей.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
При стороннем воздействии на термодинамическую систему можно наблюдать в итоге переход этой системы в другое состояние равновесия. Этот процесс является термодинамическим. В случае низкой скорости течения рассматриваемого процесса в какой-либо временной момент система приближается к равновесию. Квазистатическими процессами называют такие, которые состоят из последовательности положений равновесия.
Одним из важных определений в термодинамике считают внутреннюю энергию. При рассмотрении этого понятия необходимо понимать, что любое из макроскопических тел наделено энергией, которая заключена внутри этих тел непосредственно.
Исходя из принципов молекулярно-кинетической теории, внутренняя энергия вещества состоит из кинетической энергии, заключенной во всех атомах и молекулах, а также потенциальной энергии их взаимодействия.
В процессе изучения понятия внутренней энергии в термодинамике рассматривают частный случай идеального газа. Внутренняя энергия данного вещества представляет собой сумму кинетической энергии каждой из составных частиц, которые постоянно движутся в неопределенных направлениях, то есть прибывают в состоянии теплового движения. Этот параметр определяется температурными характеристиками вещества и не обладает зависимостью от объема, что отражено в законе Джоуля.
Согласно положениям молекулярно-кинетической теории, внутренняя энергия 1 моля идеального газа с одним атомом, к примеру, гелия или неона, молекулы в котором движутся поступательно, вычисляется по формуле:
(U=frac{3}{2}N_{A}kT=frac{3}{2}RT)
Зная, что имеется определенная зависимость между потенциальной энергией взаимодействия молекул и расстоянием, на которое эти молекулы удалены друг от друга, можно сделать вывод о зависимости внутренней энергии объекта не только от температурных параметров, но и от объема. Данное заключение допустимо записать в виде уравнения:
(U = U(T,V))
В результате внутренняя энергия тела однозначно определяется макроскопическими характеристиками состояния, в котором пребывает рассматриваемое тело. Параметр не меняется в зависимости от способа формирования этого состояния. В термодинамике принято рассматривать внутреннюю энергию, как функцию состояния. Таким образом, подобная характеристика может менять значение в том случае, когда силы, оказывающие на тело воздействие извне, совершают какую-либо работу.
Свойства
При рассмотрении свойств внутренней энергии целесообразно принять это понятие за компонент полной энергии. Исходя из этого, перечислим следующие свойства внутренней энергии:
- Внутренняя энергия представляет собой индифферентный скаляр. Важно заметить, что к ней не относят кинетическую энергию, которой обладают система в виде единого целого и внутренняя среда системы. К таковым причисляют энергию смещения простейших областей в процессе деформирования твердых объектов, энергию потоков жидких и газообразных сред.
- Внутренняя энергия является аддитивной величиной. Смысл этого утверждения состоит в равенстве внутренней энергии системы суммарным величинам внутренних энергий, характерных для подсистем.
- Внутреннюю энергию определяют с точностью до неизменяемого слагаемого, которое зависит от заданного отчетного нуля и не влияет на величину изменения внутренней энергии, полученной путем измерений в процессе экспериментов.
Пример 1
Предположим, что имеется некий закупоренный сосуд с небольшим количеством воды на дне. Если в него закачивать воздух, то, спустя определенное время, крышка будет выдавлена давлением. При этом в сосуде формируется туман. Если проанализировать описанное явление, то можно прийти к выводу о том, что воздух внутри резервуара обладал некоторой силой. Когда пробка вылетела, воздухом совершалась работа. С другой стороны, такая возможность характерна лишь для объектов, имеющих энергетический запас. Исходя из вышесказанного, можно заключить, что воздух в сосуде обладал определенной энергии.
Первый закон термодинамики, формулы
С помощью первого начала термодинамики конкретизируют общую физическую закономерность, описывающую явление сохранения энергии в случае термодинамических систем. Согласно традиционному подходу, первое начало представляет собой отношение, формулирующее взаимосвязь внутренней энергии, работы и теплоты.
Согласно пониманию У. Томсона первое начало термодинамики представляют в виде дефиниции внутренней энергии для закрытых систем. Таким образом, внутренняя энергия U в некотором процессе изменяется на величину, вычисляемую путем суммирования количества тепловой энергии Q, участвующей в обмене между системой и внешней средой, и работы A , которую совершает непосредственно рассматриваемая система, либо произведенной над этой системой: (Delta Uequiv Q+A).
Проанализировав математическое соотношение, можно заметить, что в данном случае допустимо использовать термодинамический принцип знаков для теплоты и работы. Применительно к этим величинам, в термодинамике оперируют определениями из смежных физических направлений. С другой стороны, понятие количества чистоты используют лишь в термодинамике.
Исходя из вышесказанного, целесообразно определять первое начало термодинамики по Клаузиусу. Тогда теплоту рассчитывают по известным величинам внутренней энергии и работы. В таком случае формула примет следующий вид:
(Qequiv Delta U+A )
Если воспользоваться принципом знаков для теплоты и работы, то следует поменять знак у работы А на противоположный. Тогда соотношение будет записано таким образом:
(Qequiv Delta U-A.)
Задачи
Задача 1
Аэростат обладает объемом (500 м^{3}). Конструкция заполнена газообразным веществом, роль которого играет гелий. Давление во внутренней среде, состоящей из газа, равно 105 Па. Когда аэростат нагревается под лучами солнца, температурный режим внутри повышается с отметки в 10°C до значения в 25°C. Необходимо выяснить, на какую величину изменилась внутренняя энергия газообразной среды.
Решение
Из курса теории вспомним, что гелий является одноатомным газом. В таком случае допустимо применить в процессе решения задания соотношение, характеризующее внутреннюю энергию следующего формата:
(U_{1}=frac{3}{2}frac{m}{M} RT_{1})
По условию примера заметим, что температура повышается и достигает второго значения. Запишем для него формулу:
(U_{2}=frac{3}{2}frac{m}{M} RT_{2})
Тогда целесообразно представить запись соотношения, описывающего процесс, когда изменяется величина энергии:
(Delta U = U_{2} — U_{1} =frac{3}{2}frac{m}{M} R(T_{2} — T_{1}))
Заметим, что для вычисления искомого значения необходимо определить, чему равна масса. Узнать, сколько весит гелий в конкретном случае не представляется возможным. В связи с этим, целесообразно воспользоваться закономерностью Менделеева-Клапейрона, описывающей связь между исходной температурой, сформированным давлением и объемом газообразного вещества:
(frac{m R}{M} = frac{pV}{ T_{1}})
Путем подстановки записанного соотношения в ранее выведенную формулу получим следующее справедливое равенство для расчета искомой величины:
(Delta U = frac{3}{2}pV(frac{ T_{2} }{ T_{1}}- 1) approx 4cdot 10^{6} Дж.)
Ответ: внутренняя энергия изменится на (4cdot 10^{6} Дж).
Задача 2
Цилиндрический объект установили под увесистый поршневой механизм. Рассматриваемый цилиндр заполнен углекислым газом, молярная масса которого составляет 0,044 кг/мoль. Масса газообразного вещества равна 200 гр. Изменение температуры среды можно определить, как 88 K. Нужно вычислить величину совершаемой в процессе работы.
Решение
Заметим, что в описанной ситуации рассматривается расширение газообразного вещества при определенном и неизменном давлении, сформированным внешней атмосферной средой и поршневой установкой. Тогда целесообразно записать работу газа в виде следующего соотношения:
(A’ = p(V2 — V1))
Здесь V1 и V2 обозначают объем газообразной среды в начале и конце анализируемого процесса. Воспользуемся уже знакомым принципом Менделеева-Клапейрона, чтобы выразить произведения давления и объема, зафиксированные на разных этапах. Подставим полученные соотношения в формулу работы:
(A’ = frac{m R}{M} (Т2 — Т1) approx 3,3 Дж.)
Ответ: газ совершает работу, равную 3,3 Дж.
Задача 3
Газ совершает некую работу в процессе сжатия. Количество вещества составляет 3 моль. В результате температурный режим повысился на 100 К. Требуется вычислить, какую работу совершал газ, без учета тепловых потерь.
Решение
В первую очередь следует рассмотреть описанный в задаче процесс. Сжатие происходит при совершении внешней силой положительной работы. Таким образом, внутренняя энергия меняется, как и температура газообразного вещества. Запишем озвученное соотношение:
(А = Delta U)
Далее следует обратиться к формуле, описывающей то, как меняется внутренняя энергия:
(Delta U = frac{3}{2}vRDelta T)
Таким образом, путем подстановки записанного выражения в соотношение, определяющее работу, можно вычислить ее значение:
(А = -frac{3}{2}vR Delta T approx -1250 Дж.)
Ответ: работа, которую совершал газ под давлением, составляет -1250 Дж.
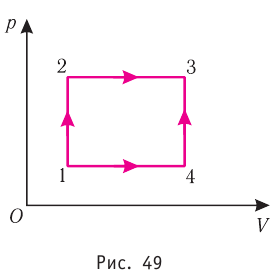
Задача 4
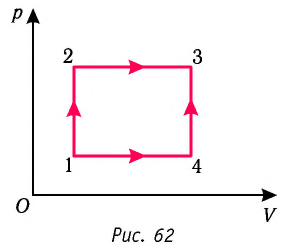
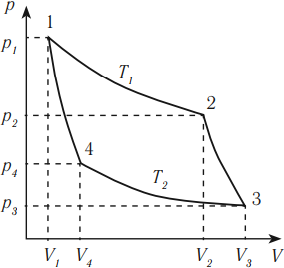
В процессе изменения состояния газообразного вещества меняются значения его давления и объема. Описать взаимную зависимость данных характеристик можно с помощью графика. На рисунке для наглядности продемонстрирована связь этих величин. Необходимо определить, чему равна работа газа.
Источник: class-fizika.ru
Решение
Заметим, что для вычисления работы в данном случае целесообразно определить значение площади, которой характеризуется закрашенная область на графике. На изображении с первого по второй и с третьего по четвертый отмечены изобарные процессы. Исходя из этой информации, запишем пару выражений для работы, совершаемой газом:
(А _{1-2}= р_{1}(V_{2}-V_{1}))
(А _{3-4}= р_{2}(V_{4}-V_{3}))
Отдельно нужно рассмотреть переход со второго этапа на третий. В процессе наблюдается изменение всех трех параметров. В связи с этим, запишем формулу для расчета работы:
(А _{2-3}= frac{р_{1}+р_{2}}{2} (V_{3}-V_{2}))
Проанализируем изменение объема газообразного вещества. В таком случае получим:
(V_{2} — V_{1} = V_{3} — V_{2} = V_{4} — V_{3} = Delta V)
Исходя из полученного выше соотношения, запишем выражение для расчета работы:
(А = (р_{1}+р_{2}+frac{р_{1}+р_{2}}{2}Delta V = frac{3}{2}(р_{1}+р_{2}) Delta V = 1800 Дж.)
Ответ: работа газа составляет 1800 Дж.
Внутренняя
энергия термодинамической системы
U
– энергия хаотического (теплового)
движения микрочастиц системы (молекул,
атомов, электронов, ядер) и энергия
взаимодействия этих частиц.
К внешней энергии
не относится кинетическая энергия
движения системы как целого и потенциальная
энергия системы во внешних полях.
Важнейшее свойство
внутренней энергии:
внутренняя энергия зависит только от
температуры U = BT
(В
– коэффициент пропорциональности,
который остается постоянным в весьма
широком интервале температур).
Внутренняя энергия
– однозначная функция термодинамического
состояния системы, т.е. в любом состоянии
система обладает вполне определенной
внутренней энергией, причем при переходе
системы из одного состояния в другое
изменение внутренней энергии определяется
только разностью значений внутренней
энергии этих состояний и не зависит от
пути перехода.
Внутренняя
энергия 1 моль идеального газа.
Так как в идеальном газе взаимная
потенциальная энергия молекул равна
нулю (молекулы между собой не
взаимодействуют, то внутренняя энергия
1 моль идеального газа равна сумме
кинетических энергий
молекул). Внутренняя энергия 1 моль газа:
.
Для произвольной
массы газа:
,
где М
– молярная масса; K
– постоянная Больцмана; R
– универсальная газовая постоянная;
число Авогадро; i
– число степеней свободы.
11.3. Первое начало термодинамики
Рассмотрим
термодинамическую систему. Внутренняя
энергия системы может изменяться в
результате: 1) совершения над системой
работ (сжатие газа); 2) передача некоторого
количества теплоты – теплообмен.
Таким образом,
существует две формы передачи энергии
от одних тел к другим: работа и теплота.
Энергия механического движения может
превращаться в энергию теплового
движения и наоборот. При этих превращениях
выполняется закон сохранения и превращения
энергий.
Первое начало
термодинамики – закон сохранения и
превращения энергии применительно к
термодинамическим системам.
Пусть система
находясь в состоянии 1 с внутренней
энергией
.
Получив некоторое количество теплотыQ,
система перешла в состояние 2 с внутренней
энергией
и совершила работуА
против внешних сил.
В соответствии с
законом сохранения энергии при любом
переходе из состояния 1 в состояние 2,
изменение внутренней энергии будет
одинаковым равным разности между
полученной теплотой Q
и работой А
против внешних сил:
.
Первое начало
термодинамики:
.
Теплота, сообщаемая
системе, расходуется на изменение ее
внутренней энергии и на совершение ею
работы против внешних сил.
В более корректной
форме:
,
где
бесконечно малое изменение внутренней
энергии системы;
бесконечно малое количество теплоты;
элементарная работа.
Вторая формулировка:
вечный двигатель первого рода (двигатель,
который совершил бы работу большую, чем
сообщенная извне энергия) невозможен.
Доказательство: если система периодически
возвращается в исходное состояние, то
.
Тогда,
следовательно, вечный двигатель первого
рода невозможен.
11.4. Работа газа при изменении его объема
Найдем в общем
виде работу, совершаемую газом при
изменении его объема:
Рассмотрим газ,
находящийся под поршнем в цилиндрическом
сосуде. Если газ расширяется, то он
передвигает поршень на бесконечно малое
расстояние dx
и совершает над газом работу:
,
где S
– площадь поршня;
изменение объема системы.
Таким образом,
.
Полная работа,
совершаемая газом при изменении его
объема от
до
найдем интегрированием этого выражения:

Это выражение
справедливо при любых изменениях объемов
твердых, жидких и газообразных тел.
Графическое
представление работы.
Равновесный процесс
– процесс, в котором система проходит
непрерывный ряд бесконечно близких
термодинамически равновесных состояний
(изменение термодинамических параметров
за конечный промежуток времени бесконечно
мало). Все реальные процессы неравновесны,
но в ряде случаев неравновесностью
реальных процессов можно пренебречь:
чем медленнее процесс, тем он ближе к
равновесному. Графически можно изображать
только равновесные процессы. Изменение
давления газа при его расширении задано
на рисунке продольной кривой. При
увеличении объема на dV
совершаемая газом работа равна PdV,
т.е. определяется площадью заштрихованной
полоски. Полная работа, совершаемая
газом при расширении от объема
до объема
,
определяется площадью ограниченной
осью абсцисс, кривойи прямыми
и
.
Соседние файлы в папке 432_lecfiz
- #
- #
- #
- #
- #
- #
- #
- #
Содержание:
Термодинамические системы и макропараметры состояния вещества:
Термодинамический подход основывается на понятии термодинамической системы, которая представляет собой любое макроскопическое тело или совокупность таких тел. Состояние термодинамической системы определяется ее внутренними параметрами, например состоянием движения микрочастиц, из которых состоит тело. Тепловое состояние тела, которое характеризуется температурой, тесно связано со скоростью движения атомов и молекул — чем больше скорость их движения, тем выше температура тела.
Температура тела зависит от скорости движения атомов и молекул, из которых оно состоит, — чем больше скорость, тем выше температура.
Внутреннее состояние тела очень сложно определить через параметры движения микрочастиц, потому что их очень много. Поэтому, чтоб упростить описание состояния термодинамической системы, его связывают с физическими величинами, которые характеризуют тело в целом, независимо от его молекулярного строения. К таким величинам принадлежат, в частности, масса, объем, плотность, давление, температура и т. п.
Их называют макропараметрами системы. Фактически они являются усредненными значениями данных физических величин на протяжении длительного времени.
Температура — один из основных макропараметров термодинамической системы, характеризующий состояние ее теплового или термодинамического равновесия. Сущность данного понятия объясняется течением тепловых явлений и процессов.
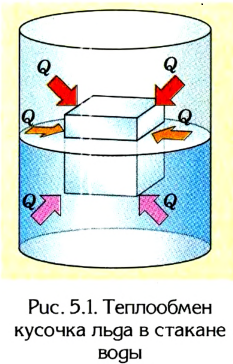
Например, из собственного опыта нам известно, что более нагретые тела отдают теплоту менее нагретым, вследствие чего со временем их температуры станут одинаковыми. Если, к примеру, кусочек льда бросить в стакан с теплой водой (рис. 5.1), то лед будет таять, а вода в стакане охлаждаться, отдавая определенное количество теплоты тающему льду. Кроме того, стакан с водой и лед пребывают в состоянии теплообмена с окружающей средой. Поэтому со временем температуры всех этих тел станут одинаковыми.
Тела с более высокой температурой отдают тепловую энергию телам с более низкой температурой; теплообмен происходит до тех пор, пока их температуры не станут одинаковыми.
Следовательно, со временем вследствие теплообмена в термодинамических системах наступает состояние термодинамического равновесия, когда температуры всех тел становятся одинаковыми и теплообмен между ними прекращается. Значение температуры характеризует вполне определенное состояние теплового равновесия термодинамической системы, в котором она пребывает в данный момент. Он может быть изменен в результате термодинамического процесса.
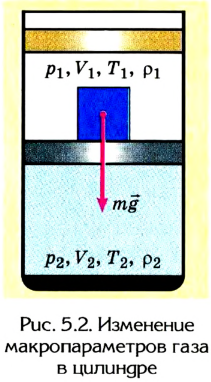
Если, например, на поршень в цилиндре с газом положить груз (рис. 5.2), то объем газа будет изменяться до тех пор, пока давление не сравняется с внешним давлением. Т. е. термодинамическая система «цилиндр — газ» перейдет в иное состояние, характеризующееся новыми значениями макропараметров — давлением 
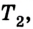
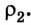
Термодинамика рассматривает в основном состояния термодинамического равновесия и процессы, которые происходят достаточно медленно, и поэтому каждое новое их состояние можно считать равновесным. В состоянии термодинамического равновесия между макропараметрами системы существуют определенные функциональные зависимости, отображаемые уравнениями состояния термодинамической системы.
Карта основ термодинамики:
Термодинамическая система
Раздел физики, изучающий тепловые явления в макроскопических системах, называется термодинамикой. В основе термодинамики лежат термодинамические законы, опирающиеся на большое количество экспериментальных фактов. Эти законы отвечают на вопрос «как?», например, как изменяется состояние тела (твердого тела, жидкости или газа) при нагревании (или охлаждении), в каком направлении и как передается тепло, как изменяется температура газа при его расширении и другие. Объектами исследования термодинамики являются термодинамические системы.
Любое макроскопическое тело или система макроскопических тел называется термодинамической системой. Состояние термодинамической системы характеризуется макроскопическими или термодинамическими параметрами (масса, плотность, объем, давление, температура).
Внутренняя энергия
Величины, определяющие состояние термодинамической системы в данный момент времени, то есть соответствующие этому состоянию макроскопические параметры, называются функциями состояния. Основной среди этих величин является внутренняя энергия.
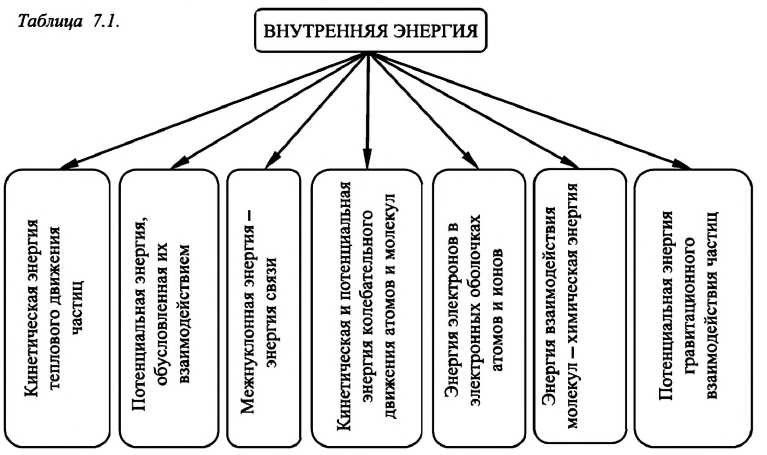
Внутренняя энергия — это сумма кинетических энергий различных видов, движения частиц системы и потенциальных энергий взаимодействия этих частиц (см.: таблица 7.1).
Внутренняя энергия термодинамической системы является функцией температуры и объема, определяющих состояние системы:
Внутренняя энергия одноатомного идеального газа
Газ, молекулы которого состоят из одного атома, называют одноатомным газом. Внутренняя энергия одноатомного газа равна сумме кинетических энергий поступательного движения частиц и потенциальных энергий их взаимодействия:
Однако внутренняя энергия идеального газа данной массы равна сумме средних кинетических энергий хаотического движения частиц:
Средняя кинетическая энергия одной частицы одноатомного идеального газа определяется выражением 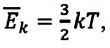
Это выражение является формулой закона Джоуля:
Внутренняя энергия идеального газа зависит от ее массы, рода (молярной массы) и температуры. Даже если давление и объем газа изменятся, при постоянной температуре его внутренняя энергия не изменится.
Сопоставив формулу (7.1) с выражением Менделеева-Клапейрона, получим:
Способы изменения внутренней энергии
Для изменения внутренней энергии термодинамической системы необходимо изменить или среднюю кинетическую энергию теплового движения молекул системы, или потенциальную энергию их взаимодействия, или же изменить обе энергии одновременно. Из многочисленных опытов было определено, что существует два способа изменения внутренней энергии: теплопередача и совершение работы.
Изменение внутренней энергии системы происходит двумя способами: передачей количества теплоты 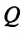
Если внутренняя энергия изменяется только в результате теплообмена, то изменение внутренней энергии равно полученному (или отданному) системой количеству теплоты. Например, при нагревании и охлаждении тела изменение его внутренней энергии определяется так:
Изменение внутренней энергии в процессе плавления твердого тела или кристаллизации жидкости происходит за счет изменения потенциальной энергии взаимодействия молекул тела. Изменение внутренней энергии при этих процессах численно равно теплоте плавления (кристаллизации):
Где 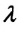
Изменение внутренней энергии тела в процессе парообразования и конденсации также равно затраченному во время этого процесса количеству теплоты:
Где 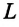
Изменение внутренней энергии одноатомного идеального газа определяется изменением его температуры:
Где 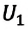
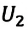
Внимание. Изменение внутренней энергии термодинамической системы зависит не от вида процесса, а от его начального и конечного состояния.
Работа в термодинамике
Если изменение внутренней энергии происходит только в результате совершения механической работы, то это изменение равно или работе внешних сил над системой 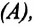
Работа в термодинамике — это одна из мер изменения внутренней энергии термодинамической системы.
Работа газа
Предположим, что в толстостенном цилиндре находится газ, сжимаемый поршнем. При сжатии поршень передает часть своей кинетической энергии молекулам газа, в результате чего увеличивается внутренняя энергия газа и повышается его температура — внешние силы совершают работу над газом. При расширении, наоборот, молекулы газа, передавая часть своей кинетической энергии поршню, уменьшают свою скорость и газ охлаждается — он совершает работу над внешними силами (b).
Таким образом, работа, совершенная газом над внешними силами, в результате расширении газа данной массы при постоянном давлении равна:
или
Работа же, совершенная внешними силами над газом равна :
Где 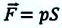
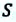

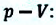
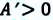
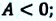
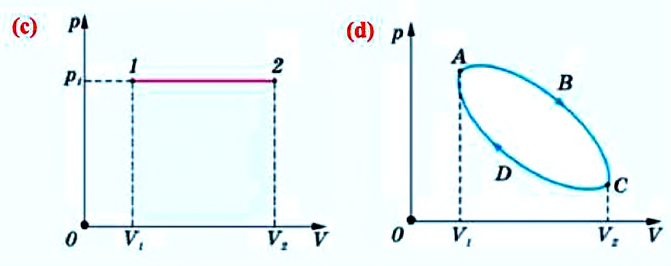
Если в процессе совершения работы газ через некоторое время возвращается в первоначальное состояние, то такой процесс называется замкнутым или циклическим процессом.
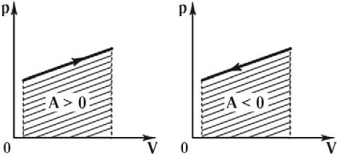
Если стрелки, показывающие направление циклического процесса, совпадают с направлением вращения часовых стрелок, то работа газа положительна, а работа внешних сил отрицательна (d). Если же стрелки, определяющие направление процесса, направлены против вращения часовых стрелок, то работа газа отрицательна, а работа внешних сил положительна.
Что такое термодинамическая система
Полную энергию физической системы можно представить как алгебраическую сумму её механической энергии и внутренних энергий тел, образующих систему. Убыль механической энергии системы в ряде случаев происходит при самопроизвольном переходе её части во внутреннюю энергию тел системы. Так, например, режущие инструменты заметно нагреваются при заточке. При скольжении конькобежца под коньками тает лёд, что обеспечивает хорошее скольжение. В этих примерах тела при трении нагреваются, и интенсивность теплового движения их молекул возрастает, что приводит к увеличению внутренней энергии тел. Как же определить внутреннюю энергию термодинамической системы? И что понимают под термодинамической системой?
В термодинамике физические тела и их модели называют термодинамическими системами. Для их описания используют параметры системы, такие, как давление, объём, температура (макропараметры), а не физические характеристики молекул (микропараметры). Макропараметры можно непосредственно измерить, используя приборы, или выразить через другие величины, которые можно измерить на опыте. Мы рассмотрим простейшие термодинамические системы, состояние которых определяют, используя только давление, объём и температуру.
Тела, образующие термодинамическую систему, могут обмениваться с окружающей средой энергией, а также веществом. Если этого не происходит, то термодинамическую систему называют замкнутой или изолированной.
Что такое внутренняя энергия
Рассматривая полную энергию макроскопического тела, необходимо учитывать не только его механическую энергию (кинетическую и потенциальную), но также и энергию, заключённую внутри самого тела, — внутреннюю энергию.
Внутренняя энергия макроскопического тела — алгебраическая сумма кинетической энергии теплового движения всех частиц, образующих тело, и потенциальной энергии их взаимодействия.
Внутренняя энергия любой термодинамической системы состоит из внутренних энергий тел, входящих в данную систему, и является одной из основных физических величин, используемых в термодинамике.
В термодинамике представляет интерес не само значение внутренней энергии системы, а её изменение. Поэтому обычно принимают во внимание только те составляющие внутренней энергии, которые изменяются в рассматриваемых процессах.
Рассмотрим переход некоторой массы идеального газа из состояния 1, в котором его внутренняя энергия 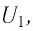
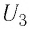
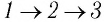
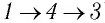
Внутренняя энергия зависит от конкретного состояния системы. Это означает, что изменение внутренней энергии при переходе термодинамической системы из одного состояния в другое зависит только от значений параметров этих состояний и не зависит от процесса перехода.
Внутренняя энергия идеального одноатомного газа
Определим внутреннюю энергию идеального одноатомного газа, т. е. газа, образованного атомами. Например, одноатомными газами являются инертные газы — гелий, неон, аргон и др.
Из определения понятия «идеальный газ» следует, что его внутренняя энергия является суммой кинетических энергий хаотического движения всех атомов (или молекул) (потенциальная энергия взаимодействия между частицами отсутствует). Следовательно, внутренняя энергия идеального одноатомного газа равна произведению средней кинетической энергии 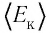
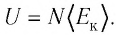
где 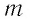
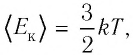
С учётом того, что произведение постоянной Больцмана и постоянной Авогадро 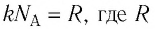
или
Из формулы (11.1) следует, что внутренняя энергия данной массы идеального одноатомного газа пропорциональна его абсолютной температуре. Она не зависит от других макроскопических параметров состояния — давления и объёма. Следовательно, изменение внутренней энергии данной массы одноатомного идеального газа происходит только при изменении его температуры:
При определении внутренней энергии реальных газов, жидкостей и твёрдых тел необходимо учитывать потенциальную энергию взаимодействия частиц, которая зависит от расстояния между ними. Поэтому в общем случае внутренняя энергия макроскопических тел зависит не только от абсолютной температуры, но и от объёма.
Изменить внутреннюю энергию термодинамической системы можно двумя способами: используя теплообмен и совершая работу. Процесс теплообмена и совершение работы характеризуют соответственно физическими величинами — количеством теплоты Q и работой А, которые являются мерами изменения внутренней энергии системы.
Пример решения задачи №1
При изобарном охлаждении внутренняя энергия идеального одноатомного газа изменилась на 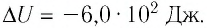
Решение. Приращение внутренней энергии некоторого количества идеального одноатомного газа
Используя уравнение Клапейрона—Менделеева, можно осуществить замену:
Решая совместно уравнения (1) и (2), получим:
Ответ:
Внутренняя энергия тела
Любое макроскопическое тело обладает энергией, что обусловлено его микросостоянием. Эта энергия называется внутренней (обозначается U). Она равна энергии всех микрочастиц вещества, из которых состоит данное тело. Например, внутренняя энергия идеального газа состоит из кинетической энергии всех его молекул, без учета их потенциальной энергии, поскольку взаимодействием молекул в модели идеального газа пренебрегают.
Модель идеального газа предусматривает, что молекулы пребывают на расстоянии нескольких диаметров друг от друга. Поэтому энергия их взаимодействия намного меньше энергии их движения, следовательно, ею можно пренебречь.
В реальных газах, а также в жидкостях и твердых телах внутреннюю энергию необходимо учитывать, потому что она соизмерима с кинетической энергией и существенно влияет на их свойства. В таком случае их внутренняя энергия состоит из кинетической энергии теплового движения микрочастиц и потенциальной энергии их взаимодействия.
Для того чтобы изменить внутреннюю энергию тела, следует фактически изменить или кинетическую энергию теплового движения микрочастиц, или потенциальную энергию их взаимодействия, или и ту и другую вместе. Многовековой опыт человечества убеждает нас в том, что это можно сделать двумя способами — либо в процессе теплообмена, либо в ходе выполнения работы. В первом случае это произойдет вследствие передачи определенного количества теплоты Q; во втором — в результате выполнения работы А.
Изменение внутренней энергии тела может произойти за счет теплообмена или в результате выполнения работы:
Следовательно, передача количества теплоты и выполнение работы являются факторами, благодаря которым можно изменить внутреннюю энергию тела:
В случае, когда происходит лишь теплообмен, полученное или отданное телом количество теплоты полностью идет на изменение его внутренней энергии, в частности кинетической энергии его атомов и молекул: 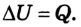
В процессе плавления или кристаллизации твердых тел внутренняя энергия изменяется за счет потенциальной энергии взаимодействия микрочастиц, потому что происходит структурная перестройка вещества. В данном случае изменение внутренней энергии равно теплоте плавления (кристаллизации) тела:
где 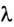
Если изменение внутренней энергии тела происходит вследствие теплообмена, то 
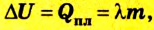
Испарение жидкости или конденсация пара также ведет к изменению внутренней энергии, которая равна в таком случае теплоте парообразования:
где r — удельная теплота парообразования (конденсации) жидкости.
Изменение внутренней энергии тела вследствие выполнения механической работы (без теплообмена) равно значению работы:
Следовательно, с точки зрения молекулярной физики внутренняя энергия тела является суммой кинетической энергии теплового движения атомов, молекул и других частиц, из которых оно состоит, и потенциальной энергии их взаимодействия. Это энергия термодинамической системы, которая зависит от ее внутреннего состояния. Поэтому вычисляют изменение внутренней энергии 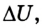
Работа газа
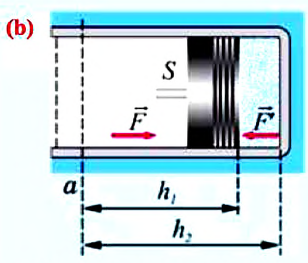
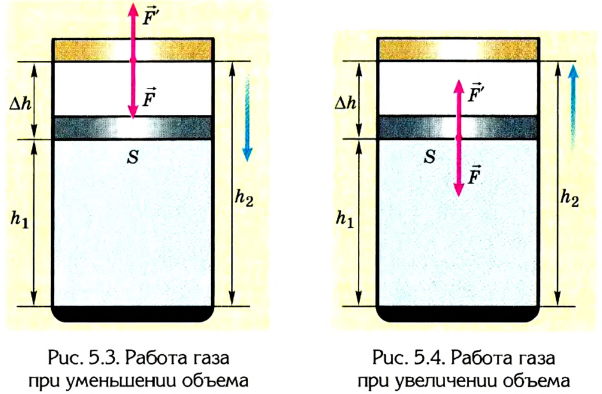
Вычисление выполненной работы в термодинамике связывают с макропараметрами системы. Рассмотрим газ, находящийся в цилиндре под поршнем площадью S (рис. 5.3).
Пусть на газ действует поршень, вызывая его сжатие. Под действием силы F поршень опускается на высоту 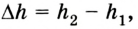
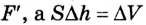
Поскольку 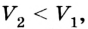
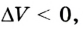
Если под действием силы давления F’ газ расширяется (рис. 5.4), т. е. он сам выполняет работу 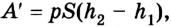
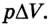
Во время незначительных изменений объема и при постоянном давлении формулы (1) и (2) справедливы не только для газов, но и иных термодинамических систем. Поскольку изменение объема при постоянном давлении сопровождается изменением температуры тела, то можно сделать вывод, что выполнение работы в термодинамике вызывает изменение состояния тела, ведь при этом изменяются его температура Т и объем V.
Первый закон термодинамики
Тот факт, что внутреннюю энергию тела можно изменить двумя способами — в результате выполнения работы или за счет теплопередачи, вынуждал ученых искать соотношение между соответствующими величинами. Вначале в 1842 г. немецкий естествоиспытатель Р. Майер теоретически установил, а затем в 1843 г. английский ученый Дж. Джоуль экспериментально измерил эквивалентность значений количества теплоты и работы. В соответствии с полученными результатами ученые сделали обобщения, которые касались сохранения энергии в природе: энергия в природе не возникает из ничего и не пропадает бесследно; она лишь переходит из одного вида в другой.
Позже этот фундаментальный закон природы приобрел логическую форму первого закона термодинамики: переход термодинамической системы из одного состояния в другое характеризуется изменением ее внутренней энергии, равной сумме работы внешних сил и количества теплоты, переданной системе:
В каком бы состоянии не было тело, оно обладает определенной внутренней энергией. Однако нельзя утверждать, что оно содержит определенное количество теплоты либо запас выполненной работы. Независимо от того, каким из этих способов произведено изменение состояния тела, его состояние однозначно определяется внутренней энергией. Например, газ может быть нагрет за счет передачи ему некоторого количества теплоты либо в результате выполнения внешними силами над ним работы (сжатие газа). Однако невозможно однозначно указать, благодаря какому из этих процессов — выполнению работы или теплопередаче — произошло нагревание газа.
Если система сама выполняет работу (А = -А’), то первый закон термодинамики приобретает другой вид:
т. е. передача термодинамической системе определенного количества теплоты вызывает изменение ее внутренней энергии или выполнение работы, либо то и другое одновременно.
Еще в 1775 г. Французская академия наук приняла решение не рассматривать проекты вечных двигателей.
Последняя формулировка первого закона термодинамики важна с точки зрения отрицания возможности создания вечного двигателя: нельзя создать машину, которая бы неограниченно выполняла работу, не получая энергию извне. Ведь, если количество теплоты Q = 0, то А’ = 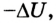
Тепловые двигатели
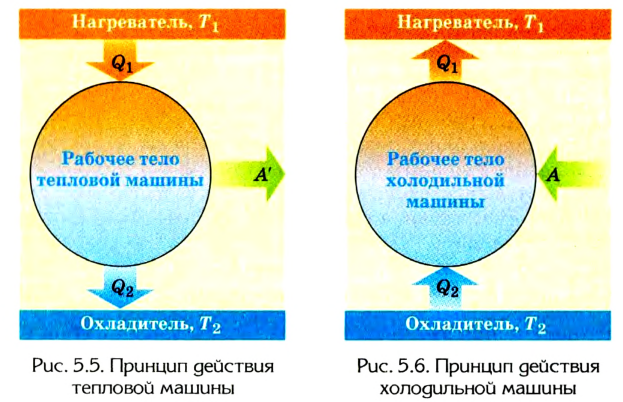
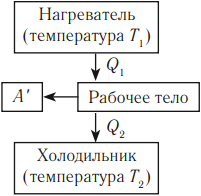
Человечество научилось использовать тепловую энергию, создав тепловые машины и двигатели. В основу их действия положена идея, что выполнение механической работы может осуществляться за счет теплоты, получаемой от какого-либо нагревателя и частично отдаваемой холодильнику.
Принцип действия тепловой машины можно представить схематически (рис. 5.5). Нагреватель передает рабочему телу определенное количество теплоты 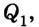
может быть газ или пар, выполняющие работу вследствие своего расширения при нагревании. В паровых турбинах это происходит благодаря паровым котлам, в двигателях внутреннего сгорания — в результате сгорания топливной смеси, в реактивных двигателях — за счет большой теплоотдачи топлива во время быстрого его сгорания.
Выполняя работу, рабочее тело отдает определенную часть количества теплоты 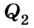
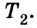
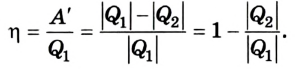
Согласно закону сохранения энергии значение выполненной работы 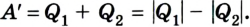
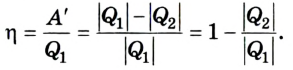
Следовательно, коэффициент полезного действия тепловой машины всегда меньше 1 (часто его представляют в процентах). К примеру, у двигателей внутреннего сгорания он равен приблизительно 44 %, у паровых турбин — до 40 %.
Коэффициент полезного действия равен отношению величины выполненной работы к затраченной при этом энергии:
Холодильник также является тепловой машиной. Принцип его действия основан на обратимости цикла тепловой машины. Холодильная машина работает как тепловой насос: она отбирает тепловую энергию у менее нагретого тела и передает ее более нагретому (рис. 5.6). Это не противоречит законам термодинамики, поскольку охлаждение происходит за счет выполнения работы.
Для того чтобы привести в действие холодильную машину, необходимо над рабочим телом выполнить работу. В таком случае нагревателю будет передаваться количество теплоты, превышающее по значению то, которое отбирается у охладителя: 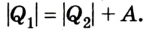
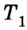
Эффективность работы холодильной машины характеризуется отношением количества теплоты 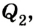
Основные определения и формулы
В основу термодинамического подхода положено описание термодинамической системы при помощи легко измеримых макропараметров — температуры (Т), давления (р), объема (V), массы (m) и др.
Внутренняя энергия тела равна энергии всех микрочастиц вещества, из которых оно состоит. Ее можно изменить за счет теплообмена или в результате выполнения работы. Количество теплоты, переданное телу (либо отобранное у него), определяется в зависимости от теплового процесса, который при этом осуществляется:
при нагревании (охлаждении )
при плавлении (кристаллизации )
при парообразовании (конденсации)
Работа газа при постоянном давлении (р = const) равна: 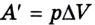
Первый закон термодинамики устанавливает, что количество теплоты, переданное термодинамической системе, вызывает изменение ее внутренней энергии или выполнение работы, либо и той другое одновременно:
Он отражает сущность фундаментального закона сохранения энергии, которым отрицается возможность создания вечного двигателя: нельзя создать машину, которая неограниченно выполняла бы работу, не получая энергию извне.
Законы термодинамики получили широкое практическое применение, в частности, в технике, при конструировании тепловых машин. Все тепловые машины (двигатели внутреннего сгорания, реактивные двигатели, паровые и газовые турбины, холодильные машины и пр.) построены по принципу выполнения механической работы за счет внутренней энергии. Их КПД всегда меньше 1 и равен:
Основы термодинамики
В 9 классе вы узнали, что полная энергия физической системы представляет собой сумму её механической энергии и внутренних энергий тел, образующих систему. Причём изменение механической энергии в ряде случаев происходит в результате перехода её части во внутреннюю энергию тел системы. Режущие инструменты заметно нагреваются при заточке их на точильном камне. При скольжении конькобежца по льду под коньками тает лёд, что обеспечивает хорошее скольжение. В этих примерах тела при трении нагреваются, и интенсивность хаотического движения молекул возрастает, что приводит к увеличению внутренней энергии тел. Как же определить внутреннюю энергию термодинамической системы? И что понимают под термодинамической системой?
Выводы термодинамики основаны на фундаментальных законах, называемых началами термодинамики. Эти законы установлены в результате обобщения многочисленных экспериментальных фактов. Опираясь на них, термодинамика позволяет делать определённые выводы о свойствах исследуемых систем, которые подтверждаются экспериментально. Физические тела и их модели в термодинамике называют термодинамическими системами. Термодинамическую систему характеризуют набором параметров, определяющих её состояние. В отличие от молекулярно-кинетической теории в термодинамике не рассматривают микроскопическое строение тел и для их описания используют не физические характеристики молекул (микропараметры), а параметры системы (макропараметры), такие как давление, объём, температура.
Замкнутая, или же изолированная, термодинамическая система стремится к равновесию, когда все её макропараметры не изменяются с течением времени. Иначе говоря, для каждой изолированной термодинамической системы существует состояние термодинамического равновесия, в которое она переходит самопроизвольно.
Это утверждение называют нулевым началом термодинамики.
Говоря о полной энергии макроскопического тела, необходимо всегда учитывать не только его механическую энергию (кинетическую и потенциальную), но также кинетическую энергию теплового движения его частиц и потенциальную энергию их взаимодействия. В термодинамике под внутренней энергией тела понимают полную энергию, относящуюся к самим частицам, образующим тело. Это кинетическая энергия теплового движения молекул, кинетическая энергия движения атомов внутри молекул, потенциальная энергия взаимодействия между молекулами, энергия электронных оболочек атомов и внутриядерная энергия.
Внутренняя энергия любой термодинамической системы состоит из внутренних энергий тел, входящих в данную систему.
В термодинамике главную роль играет не сама внутренняя энергия, а её изменение, которое происходит при переходе системы из одного состояния в другое. Под приращением (изменением) внутренней энергии понимают разность внутренних энергий в конечном и начальном состояниях:
Например, переход некоторой массы идеального газа из состояния / в состояние 3 (рис. 49) можно осуществить или в ходе процесса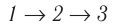
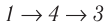
Внутренняя энергия является функцией состояния системы. Это означает, что изменение внутренней энергии при переходе термодинамической системы из одного состояния в другое зависит только лишь от значений параметров этих состояний, а не от процесса перехода.
Внутренняя энергия идеального одноатомного газа:
Определим внутреннюю энергию идеального одноатомного газа, т. е. газа, состоящего из отдельных атомов. Например, к одноатомным газам относят инертные газы — гелий, неон, аргон и др.
Из определения понятия «идеальный газ» следует, что его внутренняя энергия является суммой кинетических энергий хаотического движения всех молекул или атомов (взаимодействие между частицами отсутствует). Следовательно, внутренняя энергия идеального одноатомного газа равна произведению средней кинетической энергии 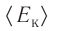
т. е. 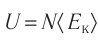
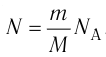
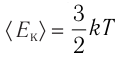
С учётом того, что 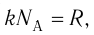
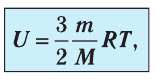
или
Как видно из формулы (9.1), внутренняя энергия данной массы идеального одноатомного газа пропорциональна абсолютной температуре газа. Она не зависит от других макроскопических параметров состояния — давления и объёма. Следовательно, изменение внутренней энергии данной массы идеального одноатомного газа происходит только при изменении его температуры:
При определении внутренней энергии реальных газов, жидкостей и твёрдых тел необходимо учитывать потенциальную энергию взаимодействия частиц, которая зависит от расстояния между ними. Поэтому в общем случае внутренняя энергия макроскопических тел зависит не только от абсолютной температуры, но и от объёма.
При изучении физики в 8 классе вы узнали, что изменить состояние термодинамической системы можно двумя способами: используя теплопередачу и совершая работу. Процесс теплопередачи и совершение работы характеризуют соответственно физическими величинами — количеством теплоты Q и работой А, которые являются мерами изменения внутренней энергии системы.
- Физические тела и их модели в термодинамике называют термодинамическими системами. Термодинамическую систему характеризуют набором макронараметров, определяющих её состояние.
- Состояние изолированной термодинамической системы, когда все её макропараметры не изменяются с течением времени, называют равновесным.
- Под внутренней энергией термодинамической системы понимают сумму кинетической энергии всех частиц системы и потенциальной энергии их взаимодействия.
- Изменение внутренней энергии тела при переходе из одного состояния в другое зависит только лишь от значений параметров этих состояний, а не от процесса перехода.
- Внутренняя энергия данной массы идеального одноатомного газа зависит только от температуры:
Пример решения задачи №2
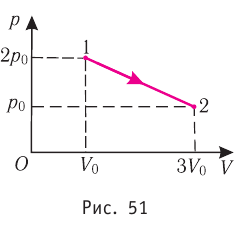
На рисунке 51 в координатах (р, V) изображён процесс перехода идеального одноатомного газа определённой массы из состояния 1 в состояние 2. Определите приращение внутренней энергии газа, если давление газа в конечном состоянии 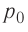
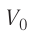
Решение.
Приращение внутренней энергии идеального одноатомного газа 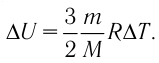
изменение температуры 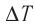
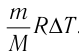
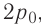
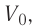
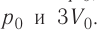
Вычтем из уравнения (2) уравнение (1):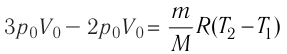
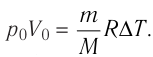
Ответ:
- Необратимость тепловых процессов
- Адиабатический процесс
- Молекулярно-кинетическая теория
- Работа в термодинамике
- Освоение космоса — история, этапы и достижения с фотографиями
- Закон сохранения механической энергии в физике
- Релятивистская механика в физике
- Теория относительности Эйнштейна
Термодинамика
Термодинамика – это раздел физики, изучающий тепловые свойства макроскопических тел и систем тел, находящихся в состоянии теплового равновесия, на основе закона сохранения энергии, без учета внутреннего строения тел, составляющих систему.
Термодинамика не рассматривает микроскопические величины – размеры атомов и молекул, их массы и количество.
Законы термодинамики устанавливают связи между непосредственно наблюдаемыми физическими величинами, характеризующими состояние системы, такими как давление ( p ), объем ( V ), температура ( T ).
Содержание
- Внутренняя энергия
- Тепловое равновесие
- Теплопередача
- Количество теплоты. Удельная теплоемкость вещества
- Работа в термодинамике
- Уравнение теплового баланса
- Первый закон термодинамики
- Второй закон термодинамики
- КПД тепловой машины
- Принципы действия тепловых машин
- Проблемы энергетики и охрана окружающей среды
Внутренняя энергия
Внутренняя энергия – это физическая величина, равная сумме кинетической энергии теплового движения частиц тела и потенциальной энергии их взаимодействия друг с другом.
Обозначение – ( U ), в СИ единица измерения – Джоуль (Дж).
В термодинамике внутренняя энергия зависит от температуры и объема тела.
Внутренняя энергия тел зависит от их температуры, массы и агрегатного состояния. С ростом температуры внутренняя энергия увеличивается. Наибольшая внутренняя энергия у вещества в газообразном состоянии, наименьшая – в твердом.
Внутренняя энергия идеального газа представляет собой только кинетическую энергию теплового движения его частиц; потенциальная энергия взаимодействия частиц равна нулю.
Внутренняя энергия идеального газа прямо пропорциональна его температуре, а от объема не зависит (молекулы идеального газа не взаимодействуют друг с другом):
где ( i ) – коэффициент, равный числу степеней свободы молекулы, ( nu ) – количество вещества, ( R ) – универсальная газовая постоянная, ( T ) – абсолютная температура.
Число степеней свободы равно числу возможных движений частицы.
Важно!
Для одноатомных газов коэффициент ( i ) = 3, для двухатомных газов ( i ) = 5.
На практике часто важно уметь находить изменение внутренней энергии:
При решении задач можно записать формулу для вычисления внутренней энергии, используя уравнение Менделеева–Клапейрона:
где ( p ) – давление, ( V ) – объем газа.
Внутренняя энергия реальных газов зависит как от температуры, так и от объема.
Изменить внутреннюю энергию можно за счет изменения температуры (при теплопередаче) и за счет изменения давления и объема (при совершении работы).
Тепловое равновесие
Тепловое равновесие – это состояние системы, при котором все ее макроскопические параметры остаются неизменными сколь угодно долго.
Величины, характеризующие состояние макроскопических тел без учета их молекулярного строения, называются макроскопическими параметрами. К ним относятся давление и температура, объем, масса, концентрация отдельных компонентов смеси газа и др. В состоянии теплового равновесия отсутствует теплообмен с окружающими телами, отсутствуют переходы вещества из одного агрегатного состояния в другое, не меняются температура, давление, объем.
Любая термодинамическая система переходит самопроизвольно в состояние теплового равновесия. Каждому состоянию теплового равновесия, в которых может находиться термодинамическая система, соответствует определенная температура.
Важно!
В состоянии теплового равновесия объем, давление могут быть различными в разных частях термодинамической системы, и только температура во всех частях термодинамической системы, находящейся в состоянии теплового равновесия, является одинаковой. Микроскопические процессы внутри тела не прекращаются и при тепловом равновесии: меняются положения молекул, их скорости при столкновениях.
Теплопередача
Теплопередача – процесс изменения внутренней энергии тела без совершения работы.
Существуют три вида теплопередачи: теплопроводность, конвекция и излучение (лучистый теплообмен). Теплопередача происходит между телами, имеющими разную температуру. Тепло передается от тела с более высокой температурой к телу с более низкой температурой.
Теплопроводность – это процесс переноса энергии от более нагретых тел (частей тела) к менее нагретым в результате движения и взаимодействия частиц тела. Высокую теплопроводность имеют металлы – так, лучшие проводники тепла – медь, золото, серебро. Теплопроводность жидкостей меньше, а газы являются плохими проводниками тепла. Пористые тела плохо проводят тепло, так как в порах содержится воздух. Вещества с низкой теплопроводностью используют в качестве теплоизоляторов. Теплопроводность невозможна в вакууме. При теплопроводности не происходит переноса вещества.
Явление теплопроводности газов аналогично явлению диффузии. Быстрые молекулы из слоя с более высокой температурой перемещаются в более холодный слой, а молекулы из холодного слоя перемещаются в более нагретый. За счет этого средняя кинетическая энергия молекул более теплого слоя уменьшается, и его температура становится ниже.
В жидкостях и твердых телах при повышении температуры какого-либо участка твердого тела или жидкости его частицы начинают колебаться сильнее. Соударяясь с соседними частицами, где температура ниже, эти частицы передают им часть своей энергии, и температура этого участка возрастает.
Конвекция – перенос энергии потоками жидкости или газа.
Объяснить механизм конвекции можно на основе теплового расширения тел и закона Архимеда. При нагревании объем жидкости увеличивается, а плотность уменьшается. Нагретый слой под действием силы Архимеда поднимается вверх, а холодный опускается вниз. Это естественная конвекция. Она возникает при неравномерном нагревании жидкости или газа снизу в поле тяготения.
При вынужденной конвекции перемещение вещества происходит под действием насосов, лопастей вентилятора. Такая конвекция применяется в состоянии невесомости. Интенсивность конвекции зависит от разности температур слоев среды и агрегатного состояния вещества. Конвекционные потоки поднимаются вверх. При конвекции происходит перенос вещества.
В твердых телах конвекция невозможна, так как частицы не могут из-за сильного взаимодействия покидать свои места. В вакууме конвекция также невозможна.
Примером конвективных потоков в природе являются ветры (бризы дневной и ночной, муссоны).
Излучение (лучистый теплообмен) – перенос энергии электромагнитными волнами. Перенос тепла излучением возможен в вакууме. Источником излучения является любое тело, температура которого отлична от нуля К. При поглощении энергия теплового излучения переходит во внутреннюю энергию. Темные тела быстрее нагреваются излучением, чем тела с блестящей поверхностью, но и остывают быстрее. Мощность излучения зависит от температуры тела. С увеличением температуры тела энергия излучения увеличивается. Чем больше площадь поверхности тела, тем интенсивнее излучение.
Количество теплоты. Удельная теплоемкость вещества
Количество теплоты – это скалярная физическая величина, равная энергии, которую тело получило или отдало при теплопередаче.
Обозначение – ( Q ), в СИ единица измерения – Дж.
Удельная теплоемкость – это скалярная физическая величина, численно равная количеству теплоты, которое тело массой 1 кг получает или отдает при изменении его температуры на 1 К.
Обозначение – ( c ), в СИ единица измерения – Дж/(кг·К).
Удельная теплоемкость определяется не только свойствами вещества, но и тем, в каком процессе осуществляется теплопередача. Поэтому выделяют удельную теплоемкость газа при постоянном давлении – ( c_P ) и удельную теплоемкость газа при постоянном объеме – ( c_V ). Для нагревания газа на 1 К при постоянном давлении требуется большее количество теплоты, чем при постоянном объеме – ( c_P > c_V ).
Формула для вычисления количества теплоты, которое получает тело при нагревании или отдает при охлаждении:
где ( m ) – масса тела, ( c ) – удельная теплоемкость, ( T_2 ) – конечная температура тела, ( T_1 ) – начальная температура тела.
Важно!
При решении задач на расчет количества теплоты при нагревании или охлаждении можно не переводить температуру в кельвины. Так как 1К=1°С, то( Delta T=Delta t ).
Работа в термодинамике
Работа в термодинамике равна изменению внутренней энергии тела.
Обозначение работы газа – ( A’ ), единица измерения в СИ – джоуль (Дж). Обозначение работы внешних сил над газом – ( A ).
Работа газа ( A’ =-A ).
Работой расширения идеального газа называют работу, которую газ совершает против внешнего давления.
Работа газа положительна при расширении и отрицательна при его сжатии. Если объем газа не изменяется (изохорный процесс), то работы газ не совершает.
Графически работа газа может быть вычислена как площадь фигуры под графиком зависимости давления от объема в координатных осях ( (p,V) ), ограниченная графиком, осью ( V ) и перпендикулярами, проведенными из точек начального и конечного значений объема.
Формула для вычисления работы газа:
в изобарном процессе ( A’=pcdotDelta V. )
в изотермическом процессе ( A’=frac{m}{M}RTlnfrac{V_2}{V_1}. )
Уравнение теплового баланса
Если система тел является теплоизолированной, то ее внутренняя энергия не будет изменяться несмотря на изменения, происходящие внутри системы. Если ( A ) = 0, ( Q ) = 0, то и ( Delta U ) = 0 .
При любых процессах, происходящих в теплоизолированной системе, ее внутренняя энергия не изменяется (закон сохранения внутренней энергии).
Рассмотрим теплоизолированную систему из двух тел с разными температурами. При контакте между ними будет проходить теплообмен. Тело с большей температурой будет отдавать некоторое количество теплоты, а тело с меньшей температурой – получать, пока температуры тел не станут равными. Так как суммарная внутренняя энергия не должна изменяться, то, на сколько уменьшится внутренняя энергия более нагретого тела, на столько должна увеличиться внутренняя энергия второго тела. Так как работа не совершается, то изменение внутренней энергии равно количеству теплоты.
Количество теплоты, отданное при теплообмене телом с большей температурой, равно по модулю количеству теплоты, полученному телом с меньшей температурой:
Другая формулировка: если тела образуют замкнутую систему и между ними происходит только теплообмен, то алгебраическая сумма отданных ( Q_{отд} ) и полученных ( Q_{пол} ) количеств теплоты равна нулю:
Первый закон термодинамики
Закон сохранения и превращения энергии, распространенный на тепловые явления, называется первым законом (началом) термодинамики.
Можно дать формулировку этого закона исходя из способов изменения внутренней энергии.
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
Если рассматривать работу самой системы над внешними телами, то закон может быть сформулирован так:
количество теплоты, переданное системе, идет на изменение ее внутренней энергии и совершение системой работы над внешними телами:
Если система изолирована и над ней не совершается работа и нет теплообмена с внешними телами, то в этом случае внутренняя энергия не изменяется. Если к системе не поступает теплота, то работа системой может совершаться только за счет уменьшения внутренней энергии. Это значит, что невозможно создать вечный двигатель – устройство, способное совершать работу без каких-либо затрат топлива.
Первый закон термодинамики для изопроцессов
Изотермический процесс: ( Q=A’,(T=const, Delta U=0) )
Физический смысл: все переданное газу тепло идет на совершение работы.
Изобарный процесс: ( Q=Delta U+A’ )
Физический смысл: подводимое к газу тепло идет на увеличение его внутренней энергии и на совершение газом работы.
Изохорный процесс: ( Q=Delta U,(V=const, A’=0) )
Физический смысл: внутренняя энергия газа увеличивается за счет подводимого тепла.
Адиабатный процесс: ( Delta U=-A’ ) или ( A=Delta U,mathbf{(Q=0)} )
Физический смысл: внутренняя энергия газа уменьшается за счет совершения газом работы. Температура газа при этом понижается.
Задачи об изменении внутренней энергии тел
Такие задачи можно разделить на группы:
- При взаимодействии тел изменяется их внутренняя энергия без совершения работы над внешней средой.
- Рассматриваются явления, связанные с превращением одного вида энергии в другой при взаимодействии двух тел. В результате происходит изменение внутренней энергии одного тела вследствие совершенной им или над ним работы.
При решении задач первой группы:
- установить, у каких тел внутренняя энергия уменьшается, а у каких – возрастает;
- составить уравнение теплового баланса ( (Delta U=0) ), при записи которого в выражении ( Q =cm(t_2 – t_1) ) для изменения внутренней энергии нужно вычитать из конечной температуры тела начальную и суммировать члены с учетом получающегося знака;
- решить полученное уравнение относительно искомой величины;
- проверить решение.
При решении задач второй группы:
- убедиться, что в процессе взаимодействия тел теплота извне к ним не подводится, т.е. действительно ли ( Q = 0 );
- установить, у какого из двух взаимодействующих тел изменяется внутренняя энергия и что является причиной этого изменения – работа, совершенная самим телом, или работа, совершенная над телом;
- записать уравнение ( Q = Delta U + A ) для тела, у которого изменяется внутренняя энергия, учитывая знак перед работой и КПД рассматриваемого процесса;
- если работа совершается за счет уменьшения внутренней энергии одного из тел, то ( А= -Delta U ), а если внутренняя энергия тела увеличивается за счет работы, совершенной над телом, то ( A=Delta U );
- найти выражения для ( Delta U ) и ( A );
- подставить в исходное уравнение вместо ( Delta U ) и ( A ) выражения для них, получить окончательное соотношение для определения искомой величины;
- решить полученное уравнение относительно искомой величины;
- проверить решение.
Второй закон термодинамики
Все процессы в природе протекают только в одном направлении. В обратном направлении самопроизвольно они протекать не могут. Необратимым называется процесс, обратный которому может протекать только как составляющая более сложного процесса.
Примеры необратимых процессов:
- переход тепла от более нагретого тела к менее нагретому телу;
- переход механической энергии во внутреннюю энергию.
Первый закон термодинамики ничего не говорит о направлении процессов в природе.
Второй закон термодинамики выражает необратимость процессов, происходящих в природе. Существует несколько его формулировок.
Второй закон термодинамики (формулировка Клаузиуса):
невозможно перевести тепло от более холодной системы к более горячей при отсутствии одновременных изменений в обеих системах или окружающих телах.
Второй закон термодинамики (формулировка Кельвина):
невозможно осуществить такой периодический процесс, единственным результатом которого было бы получение работы за счет теплоты, взятой от одного источника.
Эта формулировка говорит также и о том, что невозможно построить вечный двигатель второго рода, то есть двигатель, совершающий работу за счет охлаждения какого-либо одного тела.
Важно!
В формулировке второго закона термодинамики большое значение имеют слова «единственным результатом». Если процессы, о которых идет речь, не являются единственными, то запреты снимаются. Например, в холодильнике происходит передача тепла от более холодного тела к нагретому и при этом осуществляется компенсирующий процесс превращения механической энергии окружающих тел во внутреннюю энергию.
Второй закон термодинамики выполняется для систем с огромным числом частиц. В системах с малым количеством частиц возможны флуктуации – отклонения от равновесия.
КПД тепловой машины
Коэффициентом полезного действия (КПД) тепловой машины (двигателя) называется отношение работы ( A ), совершаемой двигателем за цикл, к количеству теплоты ( Q_1 ), полученному за цикл от нагревателя:
Тепловая машина с максимальным КПД была создана Карно. В машине осуществляется круговой процесс (цикл Карно), при котором после ряда преобразований система возвращается в начальное состояние.
Цикл Карно состоит из четырех стадий:
- Изотермическое расширение (на рисунке — процесс 1–2). В начале процесса рабочее тело имеет температуру ( T_1 ), то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передает ему количество теплоты ( Q_1 ). При этом объем рабочего тела увеличивается.
- Адиабатное расширение (на рисунке — процесс 2–3). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника ( T_2 ).
- Изотермическое сжатие (на рисунке — процесс 3–4). Рабочее тело, имеющее к тому времени температуру ( T_2 ), приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты ( Q_2 ).
- Адиабатное сжатие (на рисунке — процесс 4–1). Рабочее тело отсоединяется от холодильника. При этом его температура увеличивается до температуры нагревателя ( T_1 ).
КПД цикла Карно:
Отсюда видно, что КПД цикла Карно с идеальным газом зависит только от температуры нагревателя ( (T_1) ) и холодильника ( (T_2) ).
Из уравнения следуют выводы:
- для повышения КПД тепловой машины нужно увеличить температуру нагревателя и уменьшить температуру холодильника;
- КПД тепловой машины всегда меньше 1.
Цикл Карно обратим, так как все его составные части являются равновесными процессами.
КПД тепловых двигателей: двигатель внутреннего сгорания — 30%, дизельный двигатель — 40%, паровая турбина — 40%, газовая турбина — 25–30%.
Принципы действия тепловых машин
Тепловым двигателем называют устройство, преобразующее внутреннюю энергию топлива в механическую энергию.
Основные части теплового двигателя:
- Нагреватель – тело с постоянной температурой, преобразующее внутреннюю энергию топлива в энергию газа. В каждом цикле работы двигателя нагреватель передает рабочему телу некоторое количество теплоты.
- Рабочее тело – это газ, совершающий работу при расширении.
- Холодильник – тело с постоянной температурой, которому рабочее тело передает часть тепла.
Любая тепловая машина получает от нагревателя некоторое количество теплоты ( Q_1 ) и передает холодильнику количество теплоты ( Q_2 ). Так как ( Q_1 > Q_2 ), то совершается работа ( A’ = Q_1 – Q_2 ).
Тепловой двигатель должен работать циклически, поэтому расширение рабочего тела должно сменяться его сжатием. Работа расширения газа должна быть больше работы сжатия, совершаемой внешними силами (условие совершения полезной работы). Температура газа при расширении должна быть выше, чем температура при сжатии. Тогда давление газа во всех промежуточных состояниях при сжатии будет меньше, чем при расширении.
В реальных тепловых машинах нагревателем является камера сгорания. В них рабочее тело нагревается за счет тепла, выделяющегося при сгорании топлива. Количество теплоты, выделяющееся при сгорании топлива, вычисляется по формуле:
где ( q ) – удельная теплота сгорания топлива, ( m ) – масса топлива.
Холодильником чаще всего у реальных двигателей служит атмосфера.
Виды тепловых двигателей:
- паровой двигатель;
- турбина (паровая, газовая);
- двигатель внутреннего сгорания (карбюраторный, дизельный);
- реактивный двигатель.
Тепловые двигатели широко используются на всех видах транспорта: на автомобилях – двигатели внутреннего сгорания; на железнодорожном транспорте – дизельные двигатели (на тепловозах); на водном транспорте – турбины; в авиации – турбореактивные и реактивные двигатели. На тепловых и атомных электростанциях тепловые двигатели приводят в движение роторы генераторов переменного тока.
Проблемы энергетики и охрана окружающей среды
Тепловые двигатели широко применяются на транспорте и в энергетике (тепловые и атомные электростанции). Использование тепловых двигателей сильно влияет на состояние биосферы Земли. Можно выделить следующие вредные факторы:
- при сжигании топлива используется кислород из атмосферы, что приводит к снижению содержания кислорода в воздухе;
- при сгорании топлива в атмосферу выделяется углекислый газ. Концентрация углекислого газа в атмосфере повышается. Это изменяет прозрачность атмосферы, так как молекулы углекислого газа поглощают инфракрасное излучение, что ведет к повышению температуры (парниковый эффект);
- при сжигании угля в атмосферу поступают азотные, серные соединения и соединения свинца, вредные для здоровья человека.
Решение проблемы охраны окружающей среды от вредного воздействия предприятий тепловой энергетики требует комплексного подхода. Массовыми загрязнителями при работе тепловых электростанций являются летучая зола, диоксид серы и оксиды азота. Методы сокращения выбросов зависят от свойств топлива и условия его сжижения. Предотвращение загрязнения летучей золой достигается очисткой всего объема продуктов сгорания твердого топлива в высокоэффективных золоуловителях. Сокращение выбросов оксидов азота с продуктами сгорания топлива на тепловых электростанциях, а также в парогазовых и газотурбинных установках обеспечивается, главным образом, технологией сжигания топлива. Уменьшение выброса диоксида серы может быть достигнуто различными методами облагораживания и переработки топлива вне тепловых электростанций либо непосредственно на тепловых электростанциях, а также очисткой дымовых газов.
Контроль за выбросом вредных веществ электростанций осуществляется специальными приборами.
В ряде случаев достаточно эффективным решением вопросов очистки выбросов в атмосферу остается сооружение фильтров-уловителей и дымовых труб. У дымовой трубы два назначения: первое — создавать тягу и тем самым заставлять воздух — обязательный участник процесса горения — в нужном количестве и с должной скоростью входить в топку; второе — отводить продукты горения (вредные газы и имеющиеся в дыме твердые частицы) в верхние слои атмосферы. Благодаря непрерывному турбулентному движению вредные газы и твердые частицы уносятся далеко от источника их возникновения и рассеиваются.
Для рассеивания сернистого ангидрида, содержащегося в дымовых трубах тепловых электростанций, сооружаются дымовые трубы высотой 180, 250 и 320 м. Тепловые электростанции России, работающие на твердом топливе, за год выбрасывают в отвалы около 100 млн т золы и шлаков. Зола и шлаки занимают большие площади земель, неблагоприятно влияют на окружающую среду.
Более половины всех загрязнений создает транспорт. Один из путей решения проблемы защиты окружающей среды заключается в переходе на дизельные двигатели, электродвигатели, повышение КПД.
Алгоритм решения задач раздела «Термодинамика»:
- выделить систему тел и определить ее тип (замкнутая, адиабатически замкнутая, замкнутая в механическом смысле, незамкнутая);
- выяснить, как изменяются параметры состояния ( (p,V,T) ) и внутренняя энергия каждого тела системы при переходе из одного состояния в другое;
- записать уравнения, связывающие параметры двух состояний системы, формулы для расчета изменения внутренней энергии каждого тела системы при переходе из одного состояния в другое;
- определить изменение механической энергии системы и работу внешних сил по изменению ее объема;
- записать формулу первого закона термодинамики или закона сохранения и превращения энергии;
- решить систему уравнений относительно искомой величины;
- проверить решение.
Основные формулы раздела «Термодинамика»
Термодинамика
3 (60.68%) 206 votes
Виктор Матвеевич Скоков
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Важнейшей физической величиной, которая отвечает за характеристику равновесного состояния термодинамической системы, считается внутренняя энергия.
Термодинамическая система и определение энергии
Рисунок 1. Внутренняя энергия термодинамической системы. Автор24 — интернет-биржа студенческих работ
Определение 1
Термодинамическая система представляет собой систему, в которой производится процесс материального обмена между составляющими ее частями (речь идет о массообмене и теплообмене).
Различают (в зависимости от степени изолированности) следующие разновидности систем:
- изолированные (представляют системы, которые не взаимодействуют с внешней средой);
- закрытые (не производят обмен с внешней средой веществом (атомами, ионами, молекулами и пр.), но при этом взаимодействуют с ней, благодаря процессу механической работы, излучения и теплового обмена);
- открытые (данный вид систем обменивается с внешней средой механической работой, веществом, излучением и теплотой).
Энергия (в переводе с греческого, — действие) представляет собой общую количественную меру движения и взаимодействия всех разновидностей материи. Энергия не может возникать из ничего и исчезать.
В изолированной системе энергия способна к переходу из одной формы в другую, однако в количественном отношении она сохраняет свое постоянство.
При не изолированности системы ее энергия способна к изменениям, однако, при параллельном изменении энергии внешней среды на аналогичную величину (или посредством энергии взаимодействия с внешней средой).
«Внутренняя энергия в термодинамике» 👇
В процессе перехода системы из одного состояния в другое степень изменения энергии не будет зависеть от того, каким именно способом (вследствие каких превращений) был произведен данный переход. Энергия, иными словами, является не функцией процесса, а функцией состояния.
Энергия представляет неотъемлемое свойство системы в том плане, что абсолютно любая система будет обладать определенными запасами энергии.
Внутренняя энергия системы
Рисунок 2. Изменение внутренней энергии. Автор24 — интернет-биржа студенческих работ
В природе выделяют три вида энергии:
- движения (кинетическая);
- положения и взаимодействия (потенциальная);
- состояния (внутренняя энергия).
Определение 2
Внутренняя энергия системы считается в физике суммой потенциальной энергии взаимодействия каждой ее частицы в совокупности между собой, а также кинетической энергии их движения.
Внутренняя энергия включает такие составляющие:
- энергию поступательного, колебательного, вращательного движений молекул;
- энергии внутриатомного, межмолекулярного, внутримолекулярного, внутриядерного взаимодействия;
- энергии излучения и гравитации и т.д.
Внутренняя энергия представляет собой суммарный энергетический запас системы за вычетом кинетической и потенциальной энергий ее пространственного положения. Абсолютная величина у внутренней энергии остается неизвестной, однако важно знать изменение внутренней энергии в процессе перехода системы из одного состояния в другое.
Внутренняя энергия остается независимой от пути процесса, последовав которому система пришла в подобное состояние, и однозначно определяется исключительно самим состоянием. Поскольку внутренняя энергия зависима от массы, она представляет собой экстенсивную величину (объем, количество и масса вещества). В то же время, интенсивными величинами будут считаться: давление, температура и все удельные характеристики.
Первый закон термодинамики
Внутренняя энергия термодинамической системы может меняться за счет той работы, которую будут совершать над ней внешние тела, или же сама система осуществит над внешними телами. К примеру, приложив внешнюю силу, мы можем сжать газ, что приведет в результате к повышению его температуры, и, следовательно, — к росту внутренней энергии. Также внутреннюю энергию возможно изменить за счет передачи системе (или отнимая у нее) некоторого количества теплоты.
Замечание 1
Если основываться на закон сохранения энергии, то можно прийти к выводу, что изменение внутренней энергии системы приравнивается к сумме полученной ею теплоты и работы, совершенной над ней. Такая формулировка закона по сохранению энергии, применительно к термодинамическим системам, получила название «первый закон термодинамики».
Ученые акцентируют внимание на том, что, в отличие от внутренней энергии (энергии состояния), работа и количество теплоты являются зависимыми не только от начального и конечного состояния системы, но и от того пути, по которому производилось изменение ее состояния.
Внутренняя энергия идеального и молекулярных газов
Рисунок 3. Внутренняя энергия идеального газа. Автор24 — интернет-биржа студенческих работ
В условиях изучения тепловых явлений (наряду с механической энергией тел) в физике вводится такой вид энергии, как внутренняя энергия идеального газа, вычислить которую особого труда не составляет.
Наиболее простым по своим свойствам считается одноатомный газ, состоящий не из молекул, а из отдельных атомов. К одноатомным относятся такие инертные газы, как неон, гелий, аргон и др. Можно также получить одноатомный (атомарный) водород, кислород и др. Но подобные газы не будут устойчивыми, поскольку при столкновениях атомов образуются молекулы $H_2, O_2$.
Молекулы идеального газа не будут взаимодействовать между собой (исключение составят моменты непосредственных столкновений). Это объясняет незначительность их средней потенциальной энергии и ситуацию, когда вся энергия является кинетической энергией хаотического перемещения молекул. Тогда становится справедливым утверждение о покоящемся газе в сосуде, поскольку он, как целое, не движется (упорядоченное движение отсутствует, а механическая энергия газа приравнивается к нулю).
Идеальный газ обладает энергией, называемой внутренней. Она является прямо пропорциональной его абсолютной температуре и не зависимой от объема газа. Внутренняя энергия газа считается средней кинетической энергией всех его атомов.
Внутренняя энергия одноатомного газа, по существу, представляет среднекинетическую энергию поступательного молекулярного движения молекул. В сравнении с атомами, молекулы, которые лишены сферической симметрии, еще способны к вращению. По этой причине, в комплексе с кинетической энергией от поступательного движения, молекулам также свойственна кинетическая энергия вращательного движения.
В классической молекулярной кинетической теории рассмотрение молекул и атомов осуществляется в качестве очень малых и абсолютно твердых тел. Любое тело в рамках классической механики будет характеризоваться конкретным числом степеней свободы (числом независимых переменных), которые однозначно определяют положение тела в пространстве.
Атом способен к совершению исключительно поступательного движения, согласно трем независимым и взаимно перпендикулярным направлениям. Двухатомная молекула имеет осевую симметрию и обладает пятью степенями свободы, три из которых будут соответствовать ее поступательному, а две — вращательному движениям вокруг двух перпендикулярных друг другу осей и оси симметрии (объединяющей центры атомов в молекуле).
Многоатомная молекула (подобно твердому телу произвольной формы) будет характеризоваться шестью степенями свободы; молекула, наряду с поступательным движением, способна совершать вращения вокруг трех осей (взаимно перпендикулярных).
Внутренняя энергия газа считается зависимой от числа степеней свободы молекул. Следствием полной беспорядочности теплового движения является тот факт, что ни один из видов движения молекулы не обладает преимуществами перед другим.
На каждую соответствующую поступательному (вращательному) движениям молекул степень свободы приходится одинаковая средняя кинетическая энергия. В этом заключается теорема равномерного распределения кинетической энергии согласно степеням свободы, доказываемая в статистической механике.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме