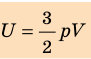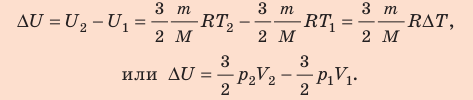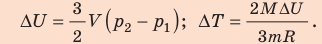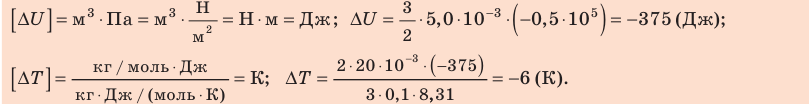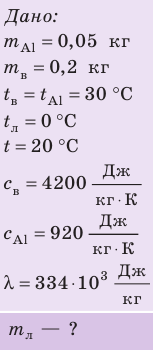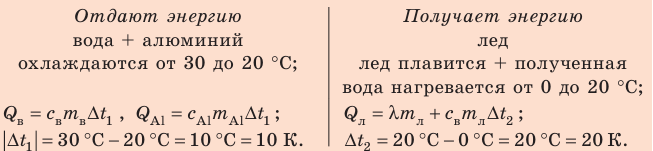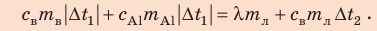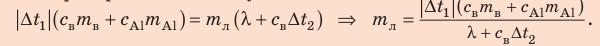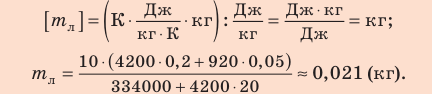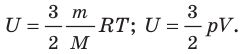Как найти внутреннюю энергию воды. Термодинамика
«Физика — 10 класс»
Тепловые явления можно описывать с помощью величин (макроскопических параметров), измеряемых такими приборами, как манометр и термометр. Эти приборы не реагируют на воздействие отдельных молекул. Теория тепловых процессов, в которой не учитывается молекулярное строение тел, называется термодинамикой
. В термодинамике рассматриваются процессы с точки зрения превращения теплоты в другие виды энергии.
Что такое внутренняя энергия.
Какие способы изменения внутренней энергии вы знаете?
Термодинамика была создана в середине XIX в. после открытия закона сохранения энергии. В её основе лежит понятие внутренняя энергия
. Само название «внутренняя» предполагает рассмотрение системы как ансамбля движущихся и взаимодействующих молекул. Остановимся на вопросе о том, какая связь существует между термодинамикой и молекулярно-кинетической теорией.
Термодинамика и статистическая механика.
Первой научной теорией тепловых процессов была не молекулярно-кинетическая теория, а термодинамика.
Термодинамика возникла при изучении оптимальных условий использования теплоты для совершения работы. Это произошло в середине XIX в., задолго до того, как молекулярно-кинетическая теория получила всеобщее признание. Тогда же было доказано, что наряду с механической энергией макроскопические тела обладают ещё и энергией, заключённой внутри самих тел.
Сейчас в науке и технике при изучении тепловых явлений используется как термодинамика, так и молекулярно-кинетическая теория. В теоретической физике молекулярно-кинетическую теорию называют статистической механикой
Термодинамика и статистическая механика изучают различными методами одни и те же явления и взаимно дополняют друг друга.
Термодинамической системой
называют совокупность взаимодействующих тел, обменивающихся энергией и веществом.
Внутренняя энергия в молекулярно-кинетической теории.
Основным понятием в термодинамике является понятие внутренней энергии.
Внутренняя энергия тела
(системы) — это сумма кинетической энергии хаотичного теплового движения молекул и потенциальной энергии их взаимодействия.
Механическая энергия тела (системы) как целого не входит во внутреннюю энергию. Например, внутренняя энергия газов в двух одинаковых сосудах при равных условиях одинакова независимо от движения сосудов и их расположения относительно друг друга.
Вычислить внутреннюю энергию тела (или её изменение), учитывая движение отдельных молекул и их положения относительно друг друга, практически невозможно из-за огромного числа молекул в макроскопических телах. Поэтому необходимо уметь определять значение внутренней энергии (или её изменение) в зависимости от макроскопических параметров, которые можно непосредственно измерить.
Внутренняя энергия идеального одноатомного газа.
Вычислим внутреннюю энергию идеального одноатомного газа.
Согласно модели молекулы идеального газа не взаимодействуют друг с другом, следовательно, потенциальная энергия их взаимодействия равна нулю. Вся внутренняя энергия идеального газа определяется кинетической энергией беспорядочного движения его молекул.
Для вычисления внутренней энергии идеального одноатомного газа массой т нужно умножить среднюю кинетическую энергию одного атома на число атомов. Учитывая, что kN A = R, получим формулу для внутренней энергии идеального газа:
Внутренняя энергия идеального одноатомного газа прямо пропорциональна его абсолютной температуре.
Она не зависит от объёма и других макроскопических параметров системы.
Изменение внутренней энергии идеального газа
т. е. определяется температурами начального и конечного состояний газа и не зависит от процесса.
Если идеальный газ состоит из более сложных молекул, чем одноатомный, то его внутренняя энергия также пропорциональна абсолютной температуре, но коэффициент пропорциональности между U и Т другой. Объясняется это тем, что сложные молекулы не только движутся поступательно, но ещё и вращаются и колеблются относительно своих положений равновесия. Внутренняя энергия таких газов равна сумме энергий поступательного, вращательного и колебательного движений молекул. Следовательно, внутренняя энергия многоатомного газа больше энергии одноатомного газа при той же температуре.
Зависимость внутренней энергии от макроскопических параметров.
Мы установили, что внутренняя энергия идеального газа зависит от одного параметра — температуры.
У реальных газов, жидкостей и твёрдых тел средняя потенциальная энергия взаимодействия молекул не равна нулю
. Правда, для газов она много меньше средней кинетической энергии молекул, но для твёрдых и жидких тел сравнима с ней.
Средняя потенциальная энергия взаимодействия молекул газа зависит от объёма вещества, так как при изменении объёма меняется среднее расстояние между молекулами. Следовательно, внутренняя энергия реального газа в термодинамике в общем случае зависит наряду с температурой T и от объёма V.
Можно ли утверждать, что внутренняя энергия реального газа зависит от давления, основываясь на том, что давление можно выразить через температуру и объём газа.
Значения макроскопических параметров (температуры Т объёма V и др.) однозначно определяют состояние тел. Поэтому они определяют и внутреннюю энергию макроскопических тел.
Внутренняя энергия U макроскопических тел однозначно определяется параметрами, характеризующими состояние этих тел: температурой и объёмом.
Определение
Внутренней энергией тела (системы)
называют энергию, которая связана со всеми видами движения и взаимодействия частиц,
составляющих тело (систему), включая энергию взаимодействия и движения сложных частиц.
Из выше сказанного следует, что к внутренней энергии не относят кинетическую энергию движения центра масс системы и потенциальную энергию системы, вызванную действием внешних сил. Это энергия, которая зависит только от термодинамического состояния системы.
Внутреннюю энергию чаще всего обозначают буквой U. При этом бесконечно малое ее изменение станет обозначаться dU. Считается, что dU является положительной величиной, если внутренняя энергия системы растет, соответственно, внутренняя энергия отрицательна, если внутренняя энергия уменьшается.
Внутренняя энергия системы тел равна сумме внутренних энергий каждого отдельного тела плюс энергия взаимодействия между телами внутри системы.
Внутренняя энергия – функция состояния системы. Это означает, что изменение внутренней энергии системы при переходе системы из одного состояния в другое не зависит от способа перехода (вида термодинамического процесса при переходе) системы и равно разности внутренних энергий конечного и начального состояний:
Для кругового процесса полное изменение внутренней энергии системы равно нулю:
Для системы, на которую не действуют внешние силы и находящуюся в состоянии макроскопического покоя, внутренняя энергия – полная энергия системы.
Внутренняя энергия может быть определена только с точностью до некоторого постоянного слагаемого (U 0), которое не определимо
методами термодинамики. Однако, данный факт не существенен, так как при использовании термодинамического анализа, имеют дело с изменениями
внутренней энергии, а не абсолютными ее величинами. Часто U_0 полагают равным нулю. При этом в качестве внутренней энергии рассматривают ее
составляющие, которые изменяются в предлагаемых обстоятельствах.
Внутреннюю энергию считают ограниченной и ее граница (нижняя) соответствует T=0K.
Внутренняя энергия идеального газа
Внутренняя энергия идеального газа зависит только от его абсолютной температуры (T) и пропорциональна массе:
где C V – теплоемкость газа в изохорном процессе; c V — удельная теплоемкость газа в изохорном процессе;
– внутренняя энергия, приходящаяся на единицу массы газа
при абсолютном нуле температур. Или:
i – число степеней свободы молекулы идеального газа, v – число молей газа, R=8,31 Дж/(моль К) – универсальная газовая постоянная.
Первое начало термодинамики
Как известно первое начало термодинамики имеет несколько формулировок. Одна из формулировок, которую предложил К.
Каратеодори говорит о существовании внутренней энергии как составляющей полной энергии системы.Она является функцией состояния,
в простых системах зависящей от объема (V), давления (p), масс веществ (m i), которые составляют данную систему:
. В формулировке, которую дал Каратеодори внутренняя
энергия не является характеристической функцией своих независимых переменных.
В более привычных формулировках первого начала термодинамики, например, формулировке Гельмгольца внутренняя энергия системы вводится как физическая характеристика системы. При этом поведение системы определено законом сохранения энергии. Гельмгольц не определяет внутреннюю энергию как функцию конкретных параметров состояния системы:
– изменение внутренней энергии в равновесном процессе,
Q – количество теплоты, которое получила система в рассматриваемом процессе, A – работа, которую система совершила.
Единицы измерения внутренней энергии
Основной единицей измерения внутренней энергии в системе СИ является: [U]=Дж
Примеры решения задач
Пример
Задание.
Вычислите, на какую величину изменится внутренняя энергия гелия имеющего массу 0,1 кг, если его температура увеличилась на 20С.
Решение.
При решении задачи считаем гелий одноатомным идеальным газом, тогда для расчетов можно применить формулу:
Так как мы имеем с одноатомным газом, то , молярную массу
() возьмем из таблицы Менделеева
( кг/моль). Масса газа в представленном процессе
не изменяется, следовательно, изменение внутренней энергии равно:
Все величины необходимые для вычислений имеются:
Ответ.
(Дж)
Пример
Задание.
Идеальный газ расширили в соответствии с законом, который изображен графиком на рис.1. от начального объема
V 0 . При расширении объем сал равен .
Каково приращение внутренней энергии газа в заданном процессе? Коэффициент адиабаты равен
.
При
изучении тепловых явлений наряду с
механической энергией тел вводится
новый вид энергии
—
внутренняя
энергия. Вычислить внутреннюю энергию
идеального газа не составляет большого
труда.
Наиболее
прост по своим свойствам одноатомный
газ, т. е. газ, состоящий из отдельных
атомов, а не молекул. Одноатомными
являются инертные газы — гелий, неон,
аргон и др. Можно получить одноатомный
(атомарный) водород, кислород и т. д.
Однако такие газы будут неустойчивыми,
так как при столкновениях атомов
образуются молекулы Н 2 ,
О 2
и др.
Молекулы
идеального газа не взаимодействуют
друг с другом, кроме моментов
непосредственного столкновения. Поэтому
их средняя потенциальная энергия очень
мала и вся
энергия представляет собой кинетическую
энергию хаотического движения молекул.
Это,
конечно, справедливо, если сосуд с газом
покоится, т. е. газ как целое не движется
(его центр масс находится в покое). В
этом случае упорядоченное движение
отсутствует и механическая энергия
газа равна нулю. Газ обладает энергией,
которую называют внутренней.
Для
вычисления внутренней энергии идеального
одноатомного газа массой т
нужно
умножить среднюю энергию одного атома,
выражаемую формулой (4.5.5), на число
атомов. Это число равно произведению
количества вещества
на
постоянную Авогадро N
A
.
Умножая
выражение (4.5.5) на

получим
внутреннюю энергию идеального одноатомного
газа:

Внутренняя
энергия идеального газа прямо
пропорциональна его абсолютной
температуре.
От
объема газа она не зависит. Внутренняя
энергия газа представляет собой среднюю
кинетическую энергию всех его атомов.
Если
центр масс газа движется со скоростью
v
0
,
то
полная энергия газа равна сумме
механической (кинетической) энергии

:
(4.8.2)
Внутренняя энергия молекулярных газов
Внутренняя энергия
одноатомного газа (4.8.1) — это по существу
средняя кинетическая энергия
поступательного движения молекул. В
отличие от атомов молекулы, лишенные
сферической симметрии, могут еще
вращаться. Поэтому наряду с кинетической
энергией поступательного движения
молекулы обладают и кинетической
энергией вращательного движения.
В
классической молекулярно-кинетической
теории атомы и молекулы рассматриваются
как очень маленькие абсолютно твердые
тела. Любое тело в классической механике
характеризуется определенным числом
степеней свободы
f
— числом независимых переменных
(координат), однозначно определяющих
положение тела в пространстве.
Соответственно число независимых
движений, которые тело может совершать,
также равно f
.
Атом
можно рассматривать как однородный
шарик с числом степеней свободы f
=
3 (рис. 4.16, а). Атом может совершать только
поступательное движение по трем
независимым взаимно перпендикулярным
направлениям. Двухатомная молекула
обладает осевой симметрией (рис. 4.16, б)
и
имеет пять степеней свободы. Три степени
свободы соответствуют ее поступательному
движению и две — вращательному вокруг
двух осей, перпендикулярных друг другу
и оси симметрии (линии, соединяющей
центры атомов в молекуле). Многоатомная
молекула, подобно, твердому телу
произвольной формы, характеризуется
шестью степенями свободы (рис. 4.16, в);
наряду
с поступательным движением молекула
может совершать вращения вокруг трех
взаимно перпендикулярных осей.
От числа степеней
свободы молекул зависит внутренняя
энергия газа. Вследствие полной
беспорядочности теплового движения ни
один из видов движения молекулы не имеет
преимущества перед другим. На каждую
степень свободы, соответствующую
поступательному или вращательному
движению молекул, приходится одна и та
же средняя кинетическая энергия. В этом
состоит теорема о равномерном распределении
кинетической энергии по степеням свободы
(она строго доказывается в статистической
механике).
Средняя
кинетическая энергия поступательного
движения молекул равна

Поступательному
движению соответствуют три степени
свободы. Следовательно, средняя
кинетическая энергия

приходящаяся на одну степень свободы,
равна:

Если
эту величину умножить на число степеней
свободы и число молекул газа массой т,
то
получится внутренняя энергия произвольного
идеального газа:

Эта
формула отличается от формулы (4.8.1) для
одноатомного газа заменой множителя 3
на множитель f
.
Внутренняя
энергия идеального газа прямо
пропорциональна абсолютной температуре
и не зависит от объема газа.
Мы знаем, что внутреннюю энергию тела можно изменить двумя способами — путем совершения работы и путем теплообмена. При осуществлении первого из этих способов внутренняя энергия тела изменяется на величину совершенной работы А, а при осуществлении второго из них — на величину, равную количеству переданной теплоты Q.
Обозначим начальную внутреннюю энергию тела через U 1 , а конечную (после того, как ее изменили) — через U 2 . Тогда изменение внутренней энергии тела будет равно разности U 2 -U 1 . Изменение любой физической величины в физике принято обозначать греческой буквой А (дельта) Поэтому мы можем записать:
ΔU — изменение внутренней энергии
U = U 2 – U 1
Изменение внутренней энергии может выражаться как положительной, так и отрицательной величиной:
1) если внутренняя энергия тела увеличивается, то U 2 > U 1 и, следовательно, ΔU > 0;
2) если внутренняя энергия тела уменьшается, то U 2 < U 1 и, следовательно, ΔU < 0.
В зависимости от того, каким путем (путем совершения над телом работы или путем теплообмена) изменялась внутренняя энергия тела, ее изменение можно рассчитывать двумя способами:
ΔU = A — при совершении работы (33.1)
ΔU = Q — при теплообмене (33.2)
Применяя уравнение (33.1), следует помнить, что в его правой части фигурирует работа внешних сил, действующих на тело. Работа самого тела A тела отличается от нее знаком:
A тела = –A
Количество теплоты Q также может быть как положительным, так и отрицательным:
1) если внутренняя энергия тела увеличивается в процессе теплообмена, то Q>О (тело получает количество теплоты);
2) если внутренняя энергия тела уменьшается в процессе теплообмена, то Q<0 (тело отдает количество теплоты).
В общем случае внутренняя энергия тела (или системы тел) может изменяться сразу двумя способами — и путем совершения работы, и путем теплообмена. Тогда для расчета изменения внутренней энергии применяют уравнение
ΔU = A + Q (33.3)
Согласно этому уравнению, изменение внутренней энергии системы равно сумме работы внешних сил и количества теплоты, полученного системой.
1. Как обозначаются внутренняя энергия тела и изменение внутренней энергии тела? 2. В каком случае изменение внутренней энергии тела положительно и в каком отрицательно? 3. Какой знак имеет: а) количество теплоты, полученное телом; б) количество теплоты, отданное телом? Почему? 4. Напишите формулу, по которой рассчитывается изменение внутренней энергии тела при теплообмене. 5. Напишите формулу, по которой рассчитывается изменение внутренней энергии тела при совершении над ним работы. 6. По какой формуле рассчитывается изменение внутренней энергии в общем случае?
Термодинамика как дисциплина сформировалась к середине 19-го столетия. Это произошло после открытия закона о сохранении энергии. Существует определенная связь между термодинамикой и молекулярной кинетикой. Какое место в теории занимает внутренняя энергия? Рассмотрим это в статье.
Статистическая механика и термодинамика
Исходной научной теорией о тепловых процессах стала не молекулярно-кинетическая. Первой была термодинамика. Она сформировалась в процессе изучения оптимальных условий применения теплоты для осуществления работы. Это случилось в середине 19-го столетия, до того как молекулярная кинетика получила признание. На сегодняшний день в технике и науке применяется как термодинамика, так и молекулярно-кинетическая теория. Последняя в теоретической физике именуется статистической механикой. Она наряду с термодинамикой исследует с применением различных методов одинаковые явления. Эти две теории взаимно дополняют друг друга. Основа термодинамики составлена двумя ее законами. Оба они касаются поведения энергии и установлены опытным путем. Законы эти справедливы для любого вещества вне зависимости от внутреннего строения. Более глубокой и точной наукой считается статистическая механика. По сравнению с термодинамикой она представляет большую сложность. Ее применяют в том случае, когда термодинамические соотношения оказываются недостаточными для объяснения исследуемых явлений.
Молекулярно-кинетическая теория
К середине 19-го века было доказано, что наряду с механической существует и внутренняя энергия макроскопических тел. Она входит в баланс энергетических природных превращений. После того как была открыта внутренняя энергия, было сформулировано положение о ее сохранении и превращении. В то время как шайба, скользящая по льду, останавливается под воздействием силы трения, ее кинетическая (механическая) энергия не просто перестает существовать, но и передается молекулам шайбы и льда. При движении неровности поверхностей тел, подвергающихся трению, деформируются. При этом интенсивность движущихся беспорядочно молекул возрастает. При нагревании обоих тел возрастает внутренняя энергия. Нетрудно пронаблюдать и обратный переход. При нагревании воды в закрытой пробирке внутренняя энергия (и ее, и образующегося пара) начинает возрастать. Давление увеличится, в результате чего пробка будет вытеснена. Внутренняя энергия пара станет причиной увеличения кинетической энергии. В процессе расширения пар совершает работу. При этом его внутренняя энергия уменьшается. В итоге происходит охлаждение пара.
Внутренняя энергия. Общая информация
При беспорядочном движении всех молекул сумма их кинетических энергий, а также потенциальных энергий их взаимодействий составляет внутреннюю энергию. Учитывая положение молекул относительно друг друга и их движение, вычислить эту сумму практически невозможно. Это обусловлено огромным количеством элементов в макроскопических телах. В связи с этим необходимо уметь вычислять значение в соответствии с макроскопическими параметрами, которые можно измерить.
Одноатомный газ
Вещество считается достаточно простым по своим свойствам, поскольку состоит из отдельных атомов, а не молекул. К одноатомным газам относят аргон, гелий, неон. Потенциальная энергия в данном случае равна нулю. Это обусловлено тем, что молекулы в идеальном газе друг с другом не взаимодействуют. Кинетическая энергия беспорядочного молекулярного движения является определяющей для внутренней (U). Для того чтобы вычислить U одноатомного газа массой m, нам необходимо произвести умножение кинетической энергии (средней) 1-го атома на общее число всех атомов. Но при этом нужно учитывать, что kNA=R. Исходя из имеющихся у нас данных, мы получаем следующую формулу: U= 2/3 х m/M х RT,
где внутренняя энергия прямо пропорциональна абсолютной температуре. Все изменения U определяются только T (температурой), замеренной в изначальном и итоговом состоянии газа, и не имеют прямого отношения к объему. Это связано с тем, что взаимодействия его потенциальной энергии равны 0, и уж вовсе не зависят от других системных параметров макроскопических объектов. При наличии более сложных молекул идеальный газ также будет иметь внутреннюю энергию, прямо пропорциональную абсолютной температуре. Но, надо сказать, при этом между U и T коэффициент пропорциональности изменится. Ведь сложные молекулы выполняют не только поступательные движения, но и вращательные. Внутренняя энергия равна сумме этих движений молекул.
От чего зависит U?
Внутренняя энергия находится под влиянием одного из макроскопических параметров. Это температура. У реальных газов, жидких и твердых тел потенциальная энергия (средняя) при взаимодействии молекул не равняется нулю. Хотя, если рассмотреть точнее, для газов она много меньше кинетической (средней же). При этом для твердых и жидких тел — сравнима с ней. А вот средняя U зависит от V вещества, потому что в период его изменения меняется и среднее расстояние, которое есть между молекулами. Из этого следует, что в термодинамике внутренняя энергия зависит не только от температуры T, но и от V (объема). Их значение однозначно определяет состояние тел, а значит и U.
Мировой океан
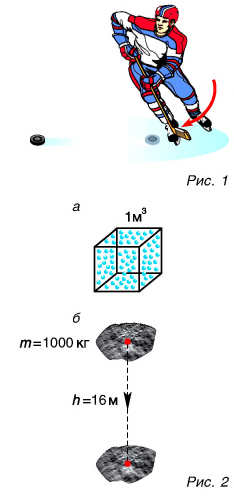
Сложно представить, какие невероятно большие запасы энергии содержит в себе Мировой океан. Рассмотрим, что собой представляет внутренняя энергия воды. Надо отметить, что она же является тепловой, потому что образовалась в результате перегрева жидкой части поверхности океана. Так вот, имея разницу, к примеру, в 20 градусов по отношению к донной воде, она приобретает значение около 10^26 Дж. При измерении течений в океане его кинетическая энергия оценивается величиной около 10^18 Дж.
Глобальные проблемы
Существуют глобальные проблемы, которые можно поставить на мировой уровень. К ним относят:
Истощение запасов ископаемого топлива (в первую очередь нефти и газа);
Значительное загрязнение окружающей среды, связанное с использованием этих ископаемых;
Тепловое «загрязнение», плюс ко всему повышение концентрации атмосферной углекислоты, грозящее глобальными климатическими нарушениями;
Использование урановых запасов, приводящих к появлению радиоактивных отходов, которые весьма негативно сказываются на жизнедеятельности всего живого;
Использование термоядерной энергии.
Заключение
Вся эта неопределенность касательно ожидания последствий, которые непременно настанут, если не перестать потреблять энергию, добытую такими способами, заставляет ученых и инженеров уделять практически все свое внимание решению этой проблемы. Их главной задачей является поиск оптимального источника энергии, Немаловажно и задействование различных природных процессов. Среди них наибольший интерес представляют: солнце, вернее солнечное тепло, ветер и энергия в Мировом океане.
Во многих странах моря и океаны давно рассматривают как источник энергии, и их перспективы становятся все более многообещающими. Океан таит в себе немало тайн, его внутренняя энергия — это бездонный кладезь возможностей. Одно только то, сколько способов извлечения энергии он нам предоставляет (таких как океанские течения, энергия приливов и отливов, термальная энергия и другие), уже заставляет задуматься о его величии.
Внутренняя энергия — жидкость
Cтраница 1
Внутренняя энергия жидкости выше, чем упорядоченного твердого тела, поэтому переход из одного состояния в другое сопровождается выделением или поглощением энергии.
[1]
Внутренняя энергия жидкости выше, чем упорядоченной твердой фазы, поэтому переход из одного состояния в другое сопровождается выделением ( или поглощением) тепла. LK, равна теплоте плавления Ln, но противоположна ей по знаку.
[2]
Внутренняя энергия жидкости выше, чем упорядоченного твердого тела, поэтому переход из одного состояния в другое сопровождается выделением или поглощением тепла.
[3]
Изменение внутренней энергии жидкости, при переходе единицы ее массы в пар при температуре кипения, называется внутренней удельной теплотой парообразования. Удельная теплота парообразования уменьшается при повышении температуры кипения и обращается в яуль при критической температуре ( стр.
[4]
Под внутренней энергией жидкости понимается сумма внутренней кинетической энергии теплового движения молекул и внутренней потенциальной энергии взаимодействия между молекулами; внутренняя энергия жидкости зависит от ее локальной температуры и плотности.
[5]
И — внутренняя энергия жидкости, которая должна поступить в контрольный объем.
[6]
Расчет составляющих внутренней энергии жидкости, зависящих от поступательного, вращательного и колебательного движения, производится независимо от межмолекулярного потенциала по ранее рассмотренным общим правилам.
[7]
В первом приближении внутренняя энергия жидкости пропорциональна температуре U СуТ и уравнение энергии есть уравнение для температуры. Если источники тепла отсутствуют, то это уравнение описывает изменение температуры тела под действием механических процессов, т.е. обратимый и необратимый переход механической энергии в тепловую.
[8]
Расчет остальных составляющих внутренней энергии жидкости, зависящих от поступательного, вращательного и колебательного движения, производится независимо от межмолекулярного потенциала, по общим правилам, рассмотренным в гл.
[9]
Расчет остальных составляющих внутренней энергии жидкости, зависящих от поступательного, вращательного и колебательного движения, производится независимо от межмолекулярного потенциала по общим правилам, рассмотренным в гл.
[10]
Теплота парообразования характеризует изменение внутренней энергии жидкости при ее переходе в газообразное состояние. Представление же внутренней энергии в виде суммы двух членов, один из которых зависит от температуры, другой — от объема, является приближенным. Более точное разбиение этой функции на слагаемые может быть сделано из следующих соображений.
[11]
При повышении температуры включения возрастает внутренняя энергия жидкости и газа, заключенных в пузырьке, что влечет за собой повышение давления Р на стенки пузырька.
[12]
Полученное выражение используют для определения внутренней энергии жидкости на линии насыщения.
[13]
Для этой цели условно принимают внутреннюю энергию жидкости в тройной точке, равной нулю.
[14]
Так же как и кинетическая энергия, внутренняя энергия жидкости не сохраняется.
[15]
Страницы:
1
2
3
4
Содержание:
Внутренняя энергия:
Вы знаете, что движущееся тело обладает кинетической энергией. А если оно еще и взаимодействует с другим телом, то обладает потенциальной энергией. Оба вида энергии представляют собой механическую энергию. Они взаимно превращаемы: кинетическая энергия может переходить в потенциальную и наоборот. Кроме того, вы знаете, что любое тело имеет дискретную структуру, т. е. состоит из частиц (атомов, молекул). Частицы находятся в непрерывном хаотическом движении. А частицы жидкости и твердого тела еще и взаимодействуют между собой. Следовательно, частицы обладают кинетической, а частицы жидкости и твердых тел — еще и потенциальной энергией. Сумма кинетической и потенциальной энергий всех частиц тела называется внутренней энергией. Внутренняя энергия измеряется в джоулях. Чем отличается внутренняя энергия от механической? В чем ее особенности? Может ли механическая энергия переходить во внутреннюю?
Для ответа на эти вопросы рассмотрим пример. Шайба, двигавшаяся горизонтально по льду (рис. 1), остановилась. Как изменилась ее механическая энергия относительно льда?
Кинетическая энергия шайбы уменьшилась до нуля. Положение шайбы над уровнем льда не изменилось, шайба не деформировалась. Значит, изменение потенциальной энергии равно нулю. Означает ли это, что се механическая (кинетическая) энергия исчезла бесследно? Нет. Механическая энергия шайбы перешла во внутреннюю энергию шайбы и льда.
А может ли внутренняя энергия тела, как механическая, быть равной нулю? Движение частиц, из которых состоит тело, не прекращается даже при самых низких температурах. Значит, тело всегда (подчеркиваем, всегда) обладает некоторым запасом внутренней энергии. Его можно либо увеличить, либо уменьшить — и только!
Велико ли значение внутренней энергии тела? Энергия одной частицы, например кинетическая, в силу незначительности ее массы чрезвычайно мала. Расчеты для средней энергии поступательного движения молекулы кислорода показывают, что ее значение при комнатной температуре
Главные выводы:
- Независимо от того, есть у тела механическая энергия или нет, оно обладает внутренней энергией.
- Внутренняя энергия тела равна сумме кинетической и потенциальной энергий частиц, из которых оно состоит.
- Внутренняя энергия тела всегда не равна нулю.
Способы изменения внутренней энергии
Чтобы изменить механическую энергию тела, надо изменить скорость его движения, взаимодействие с другими телами или взаимодействие частей тела. Вы уже знаете, что это достигается совершением работы.
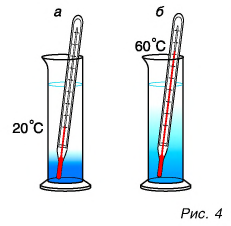
Как можно изменить (увеличить или уменьшить) внутреннюю энергию тела? Рассуждаем логически. Внутренняя энергия определяется как сумма кинетической и потенциальной энергий частиц. Значит, нужно изменить либо скорость движения частиц, либо их взаимодействие (изменить расстояния между ними). Очевидно, можно изменить и скорость, и расстояния между частицами одновременно. Изменить скорость частиц тела можно, увеличив или уменьшив его температуру. Действительно, наблюдения за диффузией показывают, что быстрота ее протекания увеличивается при нагревании (рис. 4, а, б).
Значит, увеличивается средняя скорость движения частиц, а следовательно, их средняя кинетическая энергия. Отсюда следует важный вывод: температура является мерой средней кинетической энергии частиц.
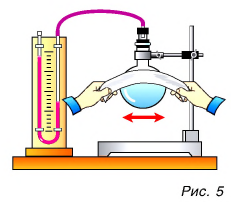
Как изменить кинетическую энергию частиц тела? Существуют два способа. Рассмотрим их на опытах. Будем натирать колбу с воздухом полоской сукна (рис. 5).
Через некоторое время уровень жидкости в правом колене манометра (см. рис. 5) опустится, т. е. давление воздуха в колбе увеличится. Это говорит о нагревании воздуха. Значит, увеличилась скорость движения и кинетическая энергия его молекул, а следовательно, и внутренняя энергия. Но за счет чего? Очевидно, за счет совершения механической работы при трении сукна о колбу. Нагрелась колба, а от нее — газ.
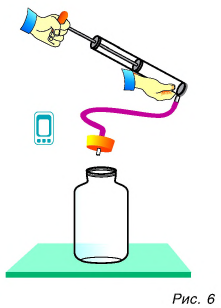
Проведем еще один опыт. В толстостенный стеклянный сосуд нальем немного воды (чайную ложку для увлажнения воздуха в нем. Насосом (рис. 6) будем накачивать в сосуд воздух. Через несколько качков пробка вылетит, а в сосуде образуется туман. Из наблюдений за окружающей средой мы знаем, что туман появляется тогда, когда после теплого дня наступает холодная ночь. Образование тумана в сосуде свидетельствует об охлаждении воздуха, т. е. об уменьшении его внутренней энергии. Но почему уменьшилась энергия? Потому что за ее счет совершена работа по выталкиванию пробки из сосуда.
Сравним результаты опытов. В обоих случаях изменилась внутренняя энергия газа, но в первом опыте она увеличилась, так как работа совершалась внешней силой (над колбой с газом), а во втором — уменьшилась, ибо работу совершала сила давления самого газа.
А можно ли, совершая работу, изменить потенциальную энергию взаимодействия молекул?
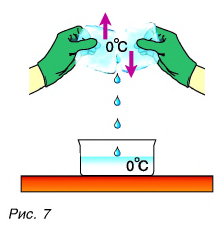
Опять обратимся к опыту. Два куска льда при О °C будем тереть друг о друга (рис. 7).
Лед превращается в воду, при этом температура воды и льда остается постоянной, равной О °C (см. рис. 7). На что тратится механическая работа силы трения?
Конечно же, на изменение внутренней энергии!
Но кинетическая энергия молекул не изменилась, так как температура не изменилась. Лед превратился в воду. При этом изменились силы взаимодействия молекул 
Совершение механической работы — один из способов изменения внутренней энергии тела.
А есть ли возможность изменить внутреннюю энергию тела, не совершая механическую работу?
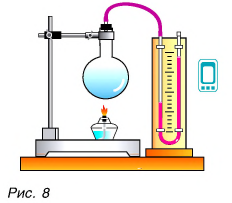
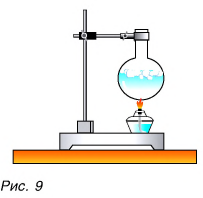
Да, есть. Нагреть воздух в колбе (рис. 8), расплавить лед (рис. 9) можно с помощью спиртовки, передав и воздуху, и льду теплоту. В обоих случаях внутренняя энергия увеличивается.
При охлаждении тел (если колбы со льдом и воздухом поместить в морозильник) их внутренняя энергия уменьшается. Теплота от тел передается окружающей среде.
Процесс изменения внутренней энергии тела, происходящий без совершения работы, называется теплопередачей (теплообменом).
Таким образом, совершение механической работы и теплопередача — два способа изменения внутренней энергии тела.
Величину, равную изменению внутренней энергии при теплопередаче, называют количеством теплоты (обозначается Q). Единицей количества теплоты, как работы и энергии, в СИ является 1 джоуль.
Для любознательных:
Физики XVIII в. и первой половины XIX в. рассматривали теплоту не как изменение энергии, а как особое вещество — теплород — жидкость (флюид), которая может перетекать от одного тела к другому. Если тело нагревалось, то считалось, что в него вливался теплород, а если охлаждалось — то выливался. При нагревании тела расширяются. Это объяснялось тем, что теплород имеет объем. Но если теплород — вещество, то тела при нагревании должны увеличивать свою массу. Однако взвешивания показывали, что масса тела не менялась. Поэтому теплород считали невесомым. Теорию теплорода поддерживали многие ученые, в том числе и такой гениальный ученый, как Г. Галилей. Позже Дж. Джоуль на основании проведенных им опытов пришел к выводу, что теплород не существует и что теплота есть мера изменения кинетической и потенциальной энергий движущихся частиц тела.
В дальнейшем выражение «сообщить телу количество теплоты» мы будем понимать как «изменить внутреннюю энергию тела без совершения механической работы, т. е. путем теплообмена». А выражение «нагреть тело» будем понимать как «повысить его температуру» любым из двух способов.
Главные выводы:
- Внутреннюю энергию тела можно изменить путем совершения механической работы или теплопередачи (теплообмена).
- Изменение внутренней энергии при нагревании или охлаждении тела при постоянном объеме связано с изменением средней кинетической энергии его частиц.
- Изменение внутренней энергии тела при неизменной температуре связано с изменением потенциальной энергии его частиц.
Основы термодинамики
МКТ стала общепризнанной на рубеже XIX и XX веков. Задолго до ее создания исследованием тепловых процессов занималась термодинамика — раздел физики, изучающий превращение внутренней (тепловой) энергии в другие виды энергии и наоборот, а также количественные соотношения при таких превращениях.
- Заказать решение задач по физике
Внутренняя энергия и ее особенности
Внутренняя энергия макроскопического тела определяется характером движения и взаимодействия всех микрочастиц, из которых состоит тело (система тел). Таким образом, к внутренней энергии следует отнести:
- кинетическую энергию хаотического (теплового) движения частиц вещества (атомов, молекул, ионов);
- потенциальную энергию взаимодействия частиц вещества;
- энергию взаимодействия атомов в молекулах (химическую энергию);
- энергию взаимодействия электронов и ядра в атоме и энергию взаимодействия нуклонов в ядре (внутриатомную и внутриядерную энергии).
Однако для описания тепловых процессов важно не столько значение внутренней энергии, как ее изменение. При тепловых процессах химическая, внутриатомная и внутриядерная энергии практически не изменяются. Именно поэтому внутренняя энергия в термодинамике определяется как сумма кинетических энергий хаотического (теплового) движения частиц вещества (атомов, молекул, ионов), из которых состоит тело, и потенциальных энергий их взаимодействия.
Внутреннюю энергию обозначают символом U.
Единица внутренней энергии в СИ — джоуль: [U]=1 Дж (J).
Особенности внутренней энергии идеального газа
- Атомы и молекулы идеального газа практически не взаимодействуют друг с другом, поэтому внутренняя энергия идеального газа равна кинетической энергии поступательного и вращательного движений его частиц.
- Внутренняя энергия данной массы идеального газа прямо пропорциональна его абсолютной температуре. Докажем данное утверждение для одноатомного газа. Атомы такого газа движутся только поступательно, поэтому, чтобы определить его внутреннюю энергию, следует среднюю кинетическую энергию поступательного движения атомов умножить на количество атомов:
Итак, для одноатомного идеального газа:
. Используя уравнение состояния
, выражение для внутренней энергии идеального одноатомного газа можно представить так:
- Внутренняя энергия — функция состояния системы, то есть она однозначно определяется основными макроскопическими параметрами (p, V, T), характеризующими систему. Независимо от того, каким образом система переведена из одного состояния в другое, изменение внутренней энергии будет одинаковым.
- Внутреннюю энергию можно изменить двумя способами: совершением работы и теплопередачей.
Какие существуют виды теплопередачи
Теплопередача (теплообмен) — процесс изменения внутренней энергии тела или частей тела без совершения работы. Процесс теплопередачи возможен только при наличии разности температур. Самопроизвольно тепло всегда передается от более нагретого тела к менее нагретому. Чем больше разность температур, тем быстрее — при прочих равных условиях — протекает процесс передачи тепла.
| Виды теплопередачи | ||
|---|---|---|
| Теплопроводность | Конвекция | Излучение |
|
Вид теплопередачи, который обусловлен хаотическим движением частиц вещества и не сопровождается переносом этого вещества. Лучшие проводники тепла — металлы, плохо проводят тепло дерево, стекло, кожа, жидкости (за исключением жидких металлов); самые плохие проводники тепла — газы. Передача энергии от горячей воды к батарее отопления, от поверхности воды до ее нижних слоев и т. д. происходит благодаря теплопроводности. |
Вид теплопередачи, при котором тепло переносится потоками жидкости или газа. Теплые потоки жидкости или газа имеют меньшую плотность, поэтому под действием архимедовой силы поднимаются, а холодные потоки — опускаются. Благодаря конвекции происходит циркуляция воздуха в помещении, нагревается жидкость в стоящей на плите кастрюле, существуют ветры и морские течения и т. д. В твердых телах конвекция невозможна. | Вид теплопередачи, при котором энергия передается посредством электромагнитных волн. Излучение — универсальный вид теплопередачи: тела всегда излучают и поглощают инфракрасное (тепловое) излучение. Это единственный вид теплообмена, возможный в вакууме (энергия от Солнца передается только излучением). Лучше излучают и поглощают энергию тела с темной поверхностью. |
Как определить количество теплоты
Количество теплоты Q — это физическая величина, равная энергии, которую тело получает (или отдает) в ходе теплопередачи.
Единица количества теплоты в СИ — джоуль: [П] =1 Дж (J).
Из курса физики 8 класса вы знаете, что количество теплоты, которое поглощается при нагревании вещества (или выделяется при его охлаждении), вычисляют по формуле: Q=cm∆Т=cm∆t , где c — удельная теплоемкость вещества; m — масса вещества; 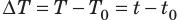
Обратите внимание! Произведение удельной теплоемкости на массу вещества, из которого изготовлено тело, называют теплоемкостью тела: C=cm . Если известна теплоемкость C тела, то количество теплоты, которое получает тело при изменении температуры на ∆T, вычисляют по формуле: Q=C∆T .
| Расчет количества теплоты при фазовых переходах | |
|---|---|
| Кристаллическое состояние ↔ Жидкое состояние | Жидкое состояние ↔ Газообразное состояние |
|
Температуру, при которой происходят фазовые переходы «кристалл → жидкость» и «жидкость → кристалл», называют температурой плавления. Температура плавления зависит от рода вещества и внешнего давления. Количество теплоты Q, которое поглощается при плавлении кристаллического вещества (или выделяется при кристаллизации жидкости), вычисляют по формуле: Q = λm, где m — масса вещества; λ — удельная теплота плавления. |
Фазовые переходы «жидкость → пар» и «пар → жидкость» происходят при любой температуре. Количество теплоты Q, которая поглощается при парообразовании (или выделяется при конденсации), вычисляют по формуле: Q=rm (Q=Lm), где m — масса вещества; r (L) — удельная теплота парообразования при данной температуре (обычно в таблицах представлена удельная теплота парообразования при температуре кипения жидкости). |
| Напомним: и при плавлении, и при кипении температура вещества не изменяется. |
Пример решения задачи №1
Неон массой 100 г находится в колбе объемом 5,0 л. В процессе изохорного охлаждения давление неона уменьшилось с 100 до 50 кПа. На сколько при этом изменились внутренняя энергия и температура неона?
Решение:
Неон — одноатомный газ; для таких газов изменение внутренней энергии равно:
Поскольку охлаждение изохорное, объем неона не изменяется: 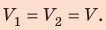
Проверим единицы, найдем значения искомых величин:
Анализ результатов. Знак «–» свидетельствует о том, что внутренняя энергия и температура неона уменьшились, — это соответствует изохорному охлаждению. Ответ: ∆U = –375 Дж; ∆T = –6 К.
Пример решения задачи №2
Внутренний алюминиевый сосуд калориметра имеет массу 50 г и содержит 200 г воды при температуре 30 °С. В сосуд бросили кубики льда при температуре 0 °С, в результате чего температура воды в калориметре снизилась до 20 °С. Определите массу льда. Удельные теплоемкости воды и алюминия: 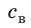
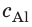
Анализ физической проблемы.
Калориметр имеет такое устройство, что теплообмен с окружающей средой практически отсутствует, поэтому для решения задачи воспользуемся уравнением теплового баланса. В теплообмене участвуют три тела: вода, внутренний сосуд калориметра, лед.
Решение:
Запишем уравнение теплового баланса:
После преобразований получим:
Проверим единицу, найдем значение искомой величины:
Ответ: 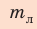
Выводы:
- В термодинамике под внутренней энергией U тела понимают сумму кинетических энергий хаотического движения частиц вещества, из которых состоит тело, и потенциальных энергий их взаимодействия. Внутренняя энергия однозначно определяется основными макроскопическими параметрами (p, V, T), характеризующими термодинамическую систему. Внутреннюю энергию идеального одноатомного газа определяют по формулам:
- Внутреннюю энергию можно изменить двумя способами: совершением работы и теплопередачей. Существует три вида теплопередачи: теплопроводность, конвекция, излучение.
- Физическую величину, равную энергии, которую тело получает или отдает при теплопередаче, называют количеством теплоты (Q): Q=cm∆T = С∆T — количество теплоты, которое поглощается при нагревании тела (или выделяется при его охлаждении); Q = λm — количество теплоты, которое поглощается при плавлении вещества (или выделяется при кристаллизации); Q=rm (Q=Lm) — количество теплоты, которое поглощается при парообразовании вещества (или выделяется при конденсации).
- Теплопроводность в физике
- Конвекция в физике
- Излучение тепла в физике
- Виды излучений в физике
- Машины и механизмы в физике
- Коэффициент полезного действия (КПД) механизмов
- Тепловые явления в физике
- Тепловое движение в физике и его измерение
В
данной теме формулировка первого начала
термодинамики и принципы эквивалентности
отражены значения энтальпии и закон
сохранения энергии для рабочего тела.
Внутреннюю
энергию
рабочего тела составляют кинетическая
энергия
тепловых движений
молекул и колебательных внутримолекулярных
движений
атомов, а также
потенциальная энергия взаимодействия
молекул.
Кинетическая
энергия поступательного и вращательного
движения молекул,
а также энергия
колебательного движения атомов
зависит только от температуры.
Изменение
внутренней энергии не зависит от
характера его протекания, а
определяется
начальным и конечным состояниями
рабочего тела, т.е.
∆u
= u2
– u1,
(9.15)
где u1
и u2
― внутренняя энергия соответственно
в начале и в конце процесса.
Если
удельный объем ω = const,
то работа расширения равна нулю и
всё
количество
подведённой теплоты q
= сω (Т2 – Т1) расходуется на увеличение
внутренней
энергии:
u2
– u1
= сω
(Т2
– Т1).
(9.16)
Если к
системе подводится теплота, то
изменяется не только внутренняя
энергия. При
расширении рабочего тела (dω
> 0) им совершается механическая
работа. Такая
работа считается положительной. При
сжатии рабочего тела (dω
< 0)
работа производится
со стороны внешней среды. Эта работа
считается отрицатель-
ной.
Размерность рdω
соответствует размерности работы,
производимой 1
кг рабочего тела.
Энтальпия, как функция температуры
Выражение
u
+ рω =i
имеет размерность Дж/кг и называется
энтальпией.
Чтобы лучше
понять, что представляет собой
энтальпия, рассмотрим цилиндр,
под поршнем
которого находится 1 кг газа. Действие
на поршень газа,
имеющего давление
р, уравновешено весом поршня G.
Так как G
= pf,
где
f
– площадь поршня, энергия системы
будет равна
u
+ Gh
= u
+ pfh,
(9.17)
где u
– внутренняя энергия системы; Gh
– потенциальная энергия груза (поршня),
поднятого на
высоту h.
Поскольку
fh
= ω, то
энергия системы равна u
+ pω,
т.е. величине энтальпии
Подставив
в уравнение (11.4) значения u
и рω,
выраженные через температуру
Т (u
= cωТ,
рω = RT),
получим
i
= cωT
+ RT = (cω
+ R)T, (9.18)
где cω
– удельная
изохорная теплоёмкость; R
– газовая постоянная.
Связь между
сω
и удельной изобарной теплоемкостью
ср
устанавливает
уравнение Майера:
ср
– cω
= R,
или ср
= cω
+ R, (9.19)
Следовательно,
энтальпия газа при температуре Т
(или t)
численно равна
количеству
теплоты, которое подведено к рабочему
телу при его нагревании от
0 К (или 0 ºС) до
температуры Т
(или t)
при постоянном давлении.
Принципы
эквивалентности и сохранения энергии
Закон
сохранения энергии
устанавливает, что энергия не
создаётся, не
уничтожается и
что одна форма энергии может переходить
в другую, при этом
превращение
совершается таким образом, что
определенное количество одной
формы энергии
переходит в равное количество другой
формы энергии.
Принцип
эквивалентности
характеризует взаимные превращения
теплоты
и работы, являющихся
основными формами передачи энергии
между телами.
Принцип
эквивалентности утверждает, что
превращение теплоты в работу и
работы в теплоту
осуществляется в строго постоянном
соотношении, которое
характеризуется
тепловым эквивалентом.
Д. Джоуль
установил, что между затраченной
работой L1,2
и количеством
полученной теплоты
Q1,2
существует прямая зависимость
Q1,2
= АL1,2, (9.20)
где А
– коэффициент пропорциональности.
Коэффициент
А
сохраняет постоянное значение
независимо от того, как
получена теплота,
каков вид работ, какова температура
тела и т.п. Таким образом,
было установлено,
что при затрате одного и того же
количества работы всегда
выделяется одно
и то же количество теплоты. Коэффициент
А получил наимено-
вание теплового
эквивалента работы.
Тепловой
эквивалент работы в системе СИ
принимается равным
А
= 1 Дж / (Н ∙ м).
Математическое
выражение первого закона
Q1,2
= (U2
– U1)
+ L1,2,
(9.21)
где Q1,2
― теплота, подводимая или отводимая
в процессе 1-2;
U1
и U2
―
внутренняя энергия
в начале и в конце процесса 1-2;
L1,2
― работа изменения
объема в процессе
1-2.
Для рабочего
тела массой 1 кг уравнение первого
начала термодинамики
принимает вид
q1,2
= (u2
– u1)
+ l1,2, (9.22)
где q1,2
― удельная теплота, подводимая или
отводимая в процессе 1-2;
u1
и u2
― удельная внутренняя энергия в
начале и в конце процесса 1-2;
l1,2
― удельная работа изменения объема
в процессе 1-2.
Для определения
знака каждой из этих величин
руководствуются следующими
правилами:
– внешняя теплота
Q1,2
является положительной, если она
подводится к рабочему
телу, и
отрицательной, если она отводится от
него;
– работа изменения
объема L1,2
будет положительной, если она
совершается
рабочим телом
(т.е. при расширении рабочего тела),
и отрицательной, если
совершается
внешней средой над рабочим телом
(т.е. при сжатии рабочего
тела);
– изменение
внутренней энергии является
положительной величиной, если эта
энергия
увеличивается. В этом случае в конце
процесса 1-2 конечное значение
внутренней
энергии должно быть больше начального,
т.е. U2
> U1,
а поэтому
разность U2
― U1
> 0. Если же в процессе 1-2 внутренняя
энергия уменьшается,
значит U2
< U1
и U2
― U1
< 0.
Из уравнения
первого начала термодинамики следует
также, что невозможно
создать вечный
двигатель первого рода, т.е. двигатель,
который производил бы
работу без
затраты энергии.
Формулировка
I
– го закона (начала) термодинамики.
Вся
теплота, подведенная к системе,
расходуется на изменение внутренней
энергии системы
и на совершение внешней работы:
Q
= u2
– u1
+ L,
(9.23)
где Q
– теплота, подводимая к системе;
u1
– внутренняя энергия системы в начале
процесса; u2
– в конце;
L
– работа, совершенная системой.
I
– ый закон термодинамики выразить
в дифференциальной форме и L,
совершенную
газом, отнести к 1 кг газа, то уравнение
примет вид:
dq
= du
+ dl.
(9.24)
I
– ый закон устанавливает количественную
оценку, не указывает условий,
при которых
протекает преобразование одного вида
энергии в другой.
В уравнении
(2) учитывая, что dl
= pdυ
уравнение (2) примет вид:
dq
= du
+ pdυ
(9.25)
Это
уравнение (3) для произвольного
конечного процесса изменения
состояния газа.
q
= u2
– u1
+
pdυ
= d
(pυ)
– υdp,
то уравнение (3)
примет вид:
dq
= du
+ d
(pυ)
– υdp
или
dq
=
(9.26)
u
+ pυ
= i
– энтальпия
– эта величина складывается из
внутренней энергии и
работы рυ, которую
газ способен совершать при изменении
V
от 0 до V
при
р
= const.
di =
du + d (pυ)
(9.27)
Подставляя
в I
– ый закон термодинамики:
dq
= du + pdυ
dq
= di –
элементарная
работа расширения газа
(с
учетом работы проталкивания)
Для
процесса с p
= const
(υdp
= 0) уравнение:
dqp
= const = di
dqp
= const = i2
– i1
(9.28)
Отсюда
следует, что количество теплоты,
которое передаётся в процессе с
р = const,
можно найти как разность энтальпий
в конечном и начальном состоя-
ниях процесса р
= const.
Удельная
энтальпия:
i
= u
+ pυ.
Уравнение
Майера.
Уравнение
Майера:
Взаимное
превращение теплоты и работы
совершается в строго эквивалент-
ном соотношении:
Q
= L,
где Q
– теплота;
L
– работа, получаемая за счет тепла.
Контрольные
вопросы:
1.
Что представляет собой внутренняя
энергия рабочего тела?
2.
Как формулируется закон сохранения
энергии?
3.
Как формулируется принцип эквивалентности?
4.
Сформулируйте первый закон термодинамики.
5.
Что такое вечный двигатель первого
рода?
6.
Что такое энтальпия? Как она
определяется?
7.
В чем отличие уравнения первого
начала термодинамики для потока от
уравнения первого
начала для замкнутого пространства?
8.
Как формулируется закон Майера? Каково
его практическое значение?
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Внутренняя энергия
-
Темы кодификатора ЕГЭ: внутренняя энергия, теплопередача, виды теплопередачи.
-
Внутренняя энергия одноатомного идеального газа
-
Функция состояния
-
Изменение внутренней энергии: совершение работы
-
Изменение внутренней энергии: теплопередача
-
Теплопроводность
-
Конвекция
-
Тепловое излучение
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: внутренняя энергия, теплопередача, виды теплопередачи.
Частицы любого тела — атомы или молекулы — совершают хаотическое непрекращающееся движение (так называемое тепловое движение). Поэтому каждая частица обладает некоторой кинетической энергией.
Кроме того, частицы вещества взаимодействуют друг с другом силами электрического притяжения и отталкивания, а также посредством ядерных сил. Стало быть, вся система частиц данного тела обладает ещё и потенциальной энергией.
Кинетическая энергия теплового движения частиц и потенциальная энергия их взаимодействия вместе образуют новый вид энергии, не сводящийся к механической энергии тела (т.е. кинетической энергии движения тела как целого и потенциальной энергии его взаимодействия с другими телами). Этот вид энергии называется внутренней энергией.
Внутренняя энергия тела — это суммарная кинетическая энергия теплового движения его частиц плюс потенциальная энергия их взаимодействия друг с другом.
Внутренняя энергия термодинамической системы — это сумма внутренних энергий тел, входящих в систему.
Таким образом, внутреннюю энергию тела образуют следующие слагаемые.
1. Кинетическая энергия непрерывного хаотического движения частиц тела.
2. Потенциальная энергия молекул (атомов), обусловленная силами межмолекулярного взаимодействия.
3. Энергия электронов в атомах.
4. Внутриядерная энергия.
В случае простейшей модели вещества — идеального газа — для внутренней энергии можно получить явную формулу.
к оглавлению ▴
Внутренняя энергия одноатомного идеального газа
Потенциальная энергия взаимодействия частиц идеального газа равна нулю (напомним, что в модели идеального газа мы пренебрегаем взаимодействием частиц на расстоянии). Поэтому внутренняя энергия одноатомного идеального газа сводится к суммарной кинетической энергии поступательного (у многоатомного газа приходится ещё учитывать вращение молекул и колебания атомов внутри молекул) движения его атомов. Эту энергию можно найти, умножив число атомов газа на среднюю кинетическую энергию
одного атома:
или
Мы видим, что внутренняя энергия идеального газа (масса и химический состав которого неизменнны) является функцией только его температуры. У реального газа, жидкости или твёрдого тела внутренняя энергия будет зависеть ещё и от объёма — ведь при изменении объёма изменяется взаимное расположение частиц и, как следствие, потенциальная энергия их взаимодействия.
к оглавлению ▴
Функция состояния
Важнейшее свойство внутренней энергии заключается в том, что она является функцией состояния термодинамической системы. А именно, внутренняя энергия однозначно определяется набором макроскопических параметров, характеризующих систему, и не зависит от «предыстории» системы, т.е. от того, в каком состоянии система находилась прежде и каким конкретно образом она оказалась в данном состоянии.
Так, при переходе системы из одного состояния в другое изменение её внутренней энергии определяется лишь начальным и конечным состояниями системы и не зависит от пути перехода из начального состояния в конечное. Если система возвращается в исходное состояние, то изменение её внутренней энергии равно нулю.
Опыт показывает, что существует лишь два способа изменения внутренней энергии тела:
• совершение механической работы;
• теплопередача.
Попросту говоря, нагреть чайник можно только двумя принципиально разными способами: тереть его чем-нибудь или поставить на огонь 
к оглавлению ▴
Изменение внутренней энергии: совершение работы
Если работа совершается над телом, то внутренняя энергия тела возрастает.
Например, гвоздь после удара по нему молотком нагревается и немного деформируется. Но температура — это мера средней кинетической энергии частиц тела. Нагревание гвоздя свидетельствует об увеличении кинетической энергии его частиц: в самом деле, частицы разгоняются от удара молотком и от трения гвоздя о доску.
Деформация же есть не что иное, как смещение частиц друг относительно друга; гвоздь после удара испытывает деформацию сжатия, его частицы сближаются, между ними возрастают силы отталкивания, и это приводит к увеличению потенциальной энергии частиц гвоздя.
Итак, внутренняя энергия гвоздя увеличилась. Это явилось результатом совершения над ним работы — работу совершили молоток и сила трения о доску.
Если же работа совершается самим телом, то внутренняя энергия тела уменьшается.
Пусть, например, сжатый воздух в теплоизолированном сосуде под поршнем расширяется и поднимает некий груз, совершая тем самым работу (процесс в теплоизолированном сосуде называется адиабатным. Мы изучим адиабатный процесс при рассмотрении первого закона термодинамики). В ходе такого процесса воздух будет охлаждаться — его молекулы, ударяя вдогонку по движущемуся поршню, отдают ему часть своей кинетической энергии. (Точно так же футболист, останавливая ногой быстро летящий мяч, делает ею движение от мяча и гасит его скорость.) Стало быть, внутренняя энергия воздуха уменьшается.
Воздух, таким образом, совершает работу за счёт своей внутренней энергии: поскольку сосуд теплоизолирован, нет притока энергии к воздуху от каких-либо внешних источников, и черпать энергию для совершения работы воздух может только из собственных запасов.
к оглавлению ▴
Изменение внутренней энергии: теплопередача
Теплопередача — это процесс перехода внутренней энергии от более горячего тела к более холодному, не связанный с совершением механической работы. Теплопередача может осуществляться либо при непосредственном контакте тел, либо через промежуточную среду (и даже через вакуум). Теплопередача называется ещё теплообменом.
Различают три вида теплопередачи: теплопроводность, конвекция и тепловое излучение.
Сейчас мы рассмотрим их более подробно.
к оглавлению ▴
Теплопроводность
Если железный стержень сунуть одним концом в огонь, то, как мы знаем, долго его в руке не продержишь. Попадая в область высокой температуры, атомы железа начинают колебаться интенсивнее (т.е. приобретают добавочную кинетическую энергию) и наносят более сильные удары по своим соседям.
Кинетическая энергия соседних атомов также возрастает, и теперь уже эти атомы сообщают дополнительную кинетическую энергию своим соседям. Так от участка к участку тепло постепенно распространяется по стержню — от помещённого в огонь конца до нашей руки. Это и есть теплопроводность (рис. 1)(Изображение с сайта educationalelectronicsusa.com).
Рис. 1. Теплопроводность
Теплопроводность — это перенос внутренней энергии от более нагретых участков тела к менее нагретым за счёт теплового движения и взаимодействия частиц тела.
Теплопроводность разных веществ различна. Высокую теплопроводность имеют металлы: лучшими проводниками тепла являются серебро, медь и золото. Теплопроводность жидкостей гораздо меньше. Газы проводят тепло настолько плохо, что относятся уже к теплоизоляторам: молекулы газов из-за больших расстояний между ними слабо взаимодействуют друг с другом. Вот почему, например, в окнах делают двойные рамы: прослойка воздуха препятствует уходу тепла).
Плохими проводниками тепла являются поэтому пористые тела — такие, как кирпич, вата или мех. Они содержат в своих порах воздух. Недаром кирпичные дома считаются самыми тёплыми, а в мороз люди надевают меховые шубы и куртки с прослойкой пуха или синтепона.
Но если воздух так плохо проводит тепло, то почему тогда прогревается от батареи комната?
Происходит это вследствие другого вида теплопередачи — конвекции.
к оглавлению ▴
Конвекция
Конвекция — это перенос внутренней энергии в жидкостях или газах в результате циркуляции потоков и перемешивания вещества.
Воздух вблизи батареи нагревается и расширяется. Действующая на этот воздух сила тяжести остаётся прежней, а выталкивающая сила со стороны окружающего воздуха увеличивается, так что нагретый воздух начинает всплывать к потолку. На его место приходит холодный воздух (тот же процесс, но в куда более грандиозных масштабах, постоянно происходит в природе: именно так возникает ветер), с которым повторяется то же самое.
В результате устанавливается циркуляция воздуха, которая и служит примером конвекции — распространение тепла в комнате осуществляется воздушными потоками.
Совершенно аналогичный процесс можно наблюдать и в жидкости. Когда вы ставите на плиту чайник или кастрюлю с водой, нагревание воды происходит в первую очередь благодаря конвекции (вклад теплопроводности воды тут весьма незначителен).
Конвекционные потоки в воздухе и жидкости показаны на рис. 2 (изображения с сайта physics.arizona.edu).
Рис. 2. Конвекция
В твёрдых телах конвекция отсутствует: силы взаимодействия частиц велики, частицы колеблются вблизи фиксированных пространственных точек (узлов кристаллической решётки), и никакие потоки вещества в таких условиях образоваться не могут.
Для циркуляции конвекционных потоков при отоплении комнаты необходимо, чтобы нагретому воздуху было куда всплывать. Если радиатор установить под потолком, то никакая циркуляция не возникнет — тёплый воздух так под потолком и останется. Именно поэтому нагревательные приборы помещают внизу комнаты. По той же причине чайник ставят на огонь, в результате чего нагретые слои воды, поднимаясь, уступают место более холодным.
Наоборот, кондиционер нужно располагать как можно выше: тогда охлаждённый воздух начнёт опускаться, и на его место будет приходить более тёплый. Циркуляция пойдёт в обратном направлении по сравнению с движением потоков при обогреве комнаты.
к оглавлению ▴
Тепловое излучение
Каким образом Земля получает энергию от Солнца? Теплопроводность и конвекция исключены: нас разделяет 150 миллионов километров безвоздушного пространства.
Здесь работает третий вид теплопередачи — тепловое излучение. Излучение может распространяться как в веществе, так и в вакууме. Как же оно возникает?
Оказывается, электрическое и магнитное поля тесно связаны друг с другом и обладают одним замечательным свойством. Если электрическое поле изменяется со временем, то оно порождает магнитное поле, которое, вообще говоря, также изменяется со временем (подробнее об этом будет рассказано в листке про электромагнитную индукцию). В свою очередь переменное магнитное поле порождает переменное электрическое поле, которое опять порождает переменное магнитное поле, которое опять порождает переменное электрическое поле…
В результате развития этого процесса в пространстве распространяется электромагнитная волна —«зацепленные» друг за друга электрическое и магнитное поля. Как и звук, электромагнитные волны обладают скоростью распространения и частотой — в данном случае это частота, с которой колеблются в волне величины и направления полей. Видимый свет — частный случай электромагнитных волн.
Скорость распространения электромагнитных волн в вакууме огромна: км/с. Так, от Земли до Луны свет идёт чуть больше секунды.
Частотный диапазон электромагнитных волн очень широк. Подробнее о шкале электромагнитных волн мы поговорим в соответствующем листке. Здесь отметим лишь, что видимый свет — это крохотный диапазон данной шкалы. Ниже него лежат частоты инфракрасного излучения, выше — частоты ультрафиолетового излучения.
Вспомним теперь, что атомы, будучи в целом электрически нейтральными, содержат положительно заряженные протоны и отрицательно заряженные электроны. Эти заряженные частицы, совершая вместе с атомами хаотическое движение, создают переменные электрические поля и тем самым излучают электромагнитные волны. Эти волны и называются тепловым излучением — в напоминание о том, что их источником служит тепловое движение частиц вещества.
Источником теплового излучения является любое тело. При этом излучение уносит часть его внутренней энергии. Встретившись с атомами другого тела, излучение разгоняет их своим колеблющимся электрическим полем, и внутренняя энергия этого тела увеличивается. Именно так мы и греемся в солнечных лучах.
При обычных температурах частоты теплового излучения лежат в инфракрасном диапазоне, так что глаз его не воспринимает (мы не видим, как мы «светимся»). При нагревании тела его атомы начинают излучать волны более высоких частот. Железный гвоздь можно раскалить докрасна — довести до такой температуры, что его тепловое излучение выйдет в нижнюю (красную) часть видимого диапазона. А Солнце кажется нам жёлто-белым: температура на поверхности Солнца настолько высока , что в спектре его излучения присутствуют все частоты видимого света, да ещё ультрафиолет, благодаря которому мы загораем.
Давайте ещё раз взглянем на три вида теплопередачи (рис. 3)(изображения с сайта beodom.com).
Рис. 3. Три вида теплопередачи: теплопроводность, конвекция и излучение
Спасибо за то, что пользуйтесь нашими материалами.
Информация на странице «Внутренняя энергия» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
08.05.2023








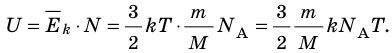 Итак, для одноатомного идеального газа:
Итак, для одноатомного идеального газа: 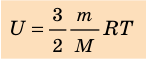 . Используя уравнение состояния
. Используя уравнение состояния 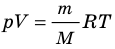 , выражение для внутренней энергии идеального одноатомного газа можно представить так:
, выражение для внутренней энергии идеального одноатомного газа можно представить так: