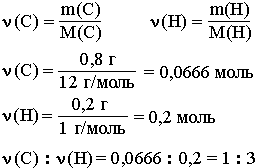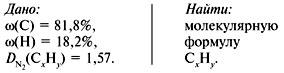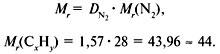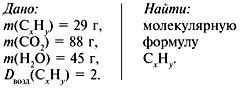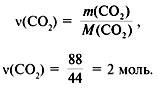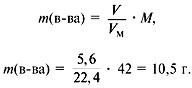Тема: «Решение задач на нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов»
1. Цели.
-
Образовательные:
-
закрепить знание понятий «органические вещества», «углеводороды», «массовая доля», «количество вещества», «относительная плотность»;
-
научить студентов решать задачи на нахождение молекулярной формулы органического вещества;
-
сформировать умения определять состав органических веществ исходя из знания массовых долей элементов, а также масс или объемов продуктов сгорания этих веществ;
-
Развивающие: развивать умения анализировать, сравнивать, применять теоретические знания на практике для решения задач;
-
Воспитательные: способствовать формированию научного мировоззрения.
2. Обеспечение занятия: таблица «Периодическая система», инструкции для студентов, тестовые задания для проверки знаний, карточки задания.
3. Порядок выполнения:
3.1. Разбор алгоритма решения задач.
3.2. Самостоятельное решение заданий.
3.3. Выполнение проверочной работы по вариантам.
4. Схема отчета:
4.1. Записать тему и цели практического занятия.
4.2. Привести решение задач.
4.3. Ответы к проверочной работе.
5. Анализ преподавателем выполнения работы.
6. Рекомендуемая литература:
-
Саенко О. Е. Химия. Учебник для колледжей. Ростов на Дону, 2008.
-
Габриелян О. С. Химия. Учебник для студентов среднего профессионального образования. –М.:Академия, 2008.
-
Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия. Для школьников старших классов и поступающих в вузы. – М.: ОНИКС 21 век: Мир и образование, 2002. – С. 177–236.
Вывод формул соединений.
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Например, анализ показал, что вещество является углеводородом CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
Таким образом, CH3 является простейшей формулой данного вещества. Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C2H6, C3H9, C4H12 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая DH2 = 15.
Тогда M(CxHy) = 15 M(H2) = 15•2 г/моль = 30 г/моль.
Поскольку M(CH3) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C2H6.
Алгоритм 1. Решение расчетных задач на вывод
молекулярной формулы вещества по массовым долям элементов
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Решение
1. Записать условие задачи.
2. Вычислить относительную молекулярную массу Mr(CхHy) по относительной плотности:
3. Найти индексы х и y по отношению :
4. Записать простейшую формулу: С3Н8.
Проверка: Мr(C3H8) = 44, следовательно, C3H8 – истинная формула.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Решение
1. Записать условие задачи.
2. Найти массовую долю водорода:
(Н) = 100% – 83,3% = 16,7%.
3. Найти индексы и простейшую формулу для углеводорода CхHy:
следовательно, простейшая формула – C2H5.
4. Найти истинную формулу. Поскольку общая формула алканов СnH2n+2, то истинная формула – С4Н10.
Алгоритм 2. Решение расчетных задач на вывод
молекулярной формулы вещества по массе (объему) продуктов сгорания
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Решение
1. Записать условие задачи.
2. Найти относительную молекулярную массу вещества:
Mr = Dвозд•Мr(возд.),
Mr(CхHy)= 2•29 = 58.
3. Найти количество вещества образовавшегося оксида углерода(IV):
4. Найти количество вещества углерода в сожженном веществе:
(C) =
(CO2) = 2 моль.
5. Найти количество вещества воды:
(H2O) = 45/18 = 2,5 моль.
6. Найти количество вещества водорода в сожженном веществе:
(H) = 2
(H2O),
(H) = 2,5•2 = 5 моль.
7. Найти простейшую формулу углеводорода:
(C) :
(Н) = 2 : 5,
следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
Мr(C2H5) = 29,
Mr (CхHy) = 58,
следовательно, истинная формула – C4H10.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его молекулярную формулу.
Решение
1. Записать условие задачи.
2. Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:
(CO2) = 16,8/22,4 = 0,75 моль,
(C) = 0,75 моль.
4. Найти количества веществ воды и водорода:
(H2O) = 13,5/18 = 0,75 моль,
(H) = 0,75•2 = 1,5 моль.
5. Найти сумму масс углерода и водорода:
m(C) + m(H) = 0,75•12 +1,5•1 = 10,5 г.
6. Найти массу сожженного вещества:
Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:
(C) :
(H) = 0,75 : 1,5 = 1 : 2,
следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
Mr(CH2) = 14,
Mr(в-ва) : Mr(CH2) = 42 : 14 = 3,
следовательно, истинная формула – С3Н6.
Задачи для самостоятельного решения:
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
Решение:
-
Общая формула алканов CnH2n+2, общая формула монохлоралканов CnH2n+1Cl
-
Cоставим выражение для расчета массовой доли хлора:
М(Cl) 35,5
ω( Сl) =——————-=————-=0,3838 , откуда n=4
М(CnH2n+1Cl) 14n+36,5
Формула монохлоралкана С4Н9Сl
3. Графические формулы изомеров:
СН3 – СН2 – СН2 – СН2Сl 1-хлорбутан
СН3 – СН2 – СНCl– СН3 2- хлорбутан
СН3 – СН – СН2Сl 2-метил-1-хлорпропан
|
СН3
СН3 – СCl – СН3 2-метил-2-хлорпропан
|
СН3
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера.
Решение:
-
Общая формула монобромлканов CnH2n+1Br. Молярная масса монобромлкана М= 12n+2n+1+80=14n+81
-
Зная относительную плотность вещества по воздуху, находим молярную массу: М=29∙4,24=123г/моль
Из выражения 14n+81=123 n=3
-
Формула бромалкана С3Н7Br, исходного алкана С3Н6 – пропен. Изомер – циклопропан.
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
Решение:
-
Уравнения реакций:
CnH2n + Н Сl = CnH2n+1Cl
CnH2n + Н Br = CnH2n+1Br
-
Так как количество вещества алкена одно и то же в обеих реакциях, то количества веществ галогеналканов равны:
n(CnH2n+1Cl) = n(CnH2n+1Br)
3. Из выражения 5,23/14n+36,5=8,2/14n+81 n=3
Формула алкена С3Н6
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
Решение:
-
Находим количество вещества алкена:
n(CnH2n) = 1,012/22,4 = 0,045 моль
-
По уравнению реакции
CnH2n +Сl2 = CnH2nCl2
n(CnH2nCl2)= n(CnH2n) =0,045 моль
-
М(CnH2nCl2)=m/n=5,09/0,045=113г/моль
12n +2n+71=113 n=3
Формула алкена С3Н6
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу.
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
|
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода. |
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров. |
|
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу. |
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле. |
|
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного. |
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера. |
|
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного. |
Задача 8. При сжигании 3.2г углеводорода образуется 8,8г СО2. Относительная плотность по водороду этого вещества равна 8. Найдите формулу углеводорода. |
|
Задача 9. При сжигании углеводорода массой 2,1 г получили 6,6г оксида углерода (IV). Относительная плотность органического соединения по водороду равна 42. Выведите молекулярную формулу углеводорода |
Задача 10. При сжигании 4,4г алкана выделилось 13,4г углекислого газа. Относительная плотность вещества по воздуху равна 1,52. Определите молекулярную формулу алкана. |
Задачи для самостоятельного решения:
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества ( при н.у.) равна 1,875 г. Найти его молекулярную формулу.
Задача 5. При сгорании 11,2 г Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 6. При сжигании 2.2 г вещества получили 4,4 г оксида углерода и 1,8 г воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 7. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 8. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Задача 9. Найти формулу вещества, содержащего 85,71% углерода и 14,29% водорода, если относительная плотность паров этого вещества по воздуху равна 1,448.
Задача10. При сгорании 4,3 г Углеводорода получили оксид углерода массой 13,2 г и воду массой 6,3 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 11. При сгорании 2,1 г вещества получили оксид углерода массой 6,6 г и воду массой 2,7 г. Относительная плотность этого углеводорода по воздуху равна 2,96. Выведите молекулярную формулу.
Задача 12. При сгорании 8,6 г Углеводорода получили оксид углерода массой 26,4 г и воду массой 12,6 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 13. При сжигании 3,9 г органического вещества плотность паров по водороду- 39, образовалось 13,2 г углекислого газа и 2,7 г воды. Определить формулу вещества .
Задача 14. При сжигании алкена массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность алкена по воздуху равна 1,93. Найти молекулярную формулу алкена.
Задача 15. Определить молекулярную формулу углеводорода, если при сжигании 2,2 г его было получено 3,36л углекислого газа и 3,6 г воды. Плотность вещества по воздуху равна 1,5172.
Задача 16. Определить молекулярную формулу углеводорода, если при сжигании 1,3 г его было получено 2,24л углекислого газа и 0,9 г воды. Плотность вещества по водороду равна 12,992.
Задача 17. При сжигании 5,25 г газообразного углеводорода с плотностью по водороду =21 получили 8,4 л углекислого газа и 6,75 г воды. Определить формулу вещества.
Задача 18. Найти молекулярную формулу углеводорода, имеющего плотность по водороду =22. если при сгорании 4,4 г его образуется 6,72л CO2 и 7,2 г Н2О.
Задача 19. Относительная плотность по водороду некоторого алкана 15. Определите его формулу.
Задача 20. Массовая доля углерода в алкане составляет 84%. Определите его формулу.
Задача 21. При сгорании 2,2 г органического вещества, имеющего плотность по воздуху 1,517, образовалось 3,36 л углекислого газа (н.у.) и 3,6 г воды. Определите формулу органического вещества.
Задача 22. Органическое вещество содержит углерод (массовая доля 84,21%) и водород (15,79%). Плотность паров вещества по воздуху составляет 3,93. Определите формулу органического вещества.
Задача 23. Массовая доля углерода в углеводороде составляет 83,33%. плотность паров по водороду =36. Определите формулу углеводорода. Сколько он имеет изомеров? Напишите структурные формулы этих изомеров и назовите их.
Задача 24. Определите формулу предельного одноатомного спирта, если при дегидратации образца его объемом 37 мл и плотностью 1,4 г/мл получили алкен 39,2 г.
Задача 25. Определите молекулярную формулу предельного трехатомного спирта, массовая доля углерода в котором равна массовой доле кислорода.
I. Нахождение формулы органического вещества по массовой доле химических элементов и относительной плотности газов
1. Выпишите в тетрадь основные формулы
D2 = Mr(1)/Mr(2)
D — относительная плотность первого газа по второму (безразмерная величина).
Например:
D(O2) = Mr(газа)/Mr(O2)=Mr(газа)/32;
D(H2) = Mr(газа)/Mr(H2)=Mr(газа)/2;
D(воздуха)=Mr(газа)/Mr(воздуха)=Mr(газа)/29
Wэлемента = (n * Ar (элемента) * 100%) / Mr (вещества),
где n – индекс, число атомов;
W – массовая доля элемента (%).
2. Разберите образец решения задачи
Этиловый спирт содержит 52,18% углерода:13,04% водорода: 34,78% кислорода. Плотность паров спирта по водороду 23. Определите формулу этилового спирта.
Решение:
1. Определим молекулярную массу искомого вещества:
Mr(CxHyOz) = D(H2) · Mr(H2)=23· 2 =46
2.По формуле n = (Wэлемента * Mr(вещества)) / Ar элемента * 100% вычислим число атомов C, H, O
n(C)=(52,18% · 46) / 12· 100% = 2
n(H)=( 13,04% · 46) /1· 100% =6
n(O)=( 34,78% · 46) / 16· 100% =1
Получаем x:y:z =2:6:1, следовательно, вещество C2H6O
Проверка, Mr(C2H6O)= 46
II. Нахождение формулы органического вещества по массовой доле химических элементов и плотности вещества при нормальных условиях
1. Выпишите в тетрадь основные формулы
M = ρ * Vm
где Vm =22,4 л/моль (при н.у.);
M – молярная масса вещества (г/моль);
ρ = m/V (плотность)
Wэлемента = (n * Ar (элемента) * 100%) / Mr (вещества),
где n – индекс, число атомов;
W – массовая доля элемента (%)
2. Разберите образец решения задачи
Углеводород содержит 81,82% углерода. Масса 1 л этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу этого углеводорода.
Решение:
1. Определим молярную массу искомого вещества:
ρ = m/V, следовательно М(СхНу) = ρ· Vm = 1,964 г/л · 22,4 л/моль = 44
2. По формуле: n = (Wэлемента * Mr(вещества)) / Ar элемента * 100%
вычислим число атомов C, H.
Здесь Мr=M
n(C)=(81,82% · 44) / (12 · 100%) = 3
n(H)=(18,18% · 44) / (1· 100%) = 8
Получаем x:y =3 : 8, следовательно, вещество C3H8
Проверка, Mr(C3H8)= 44
III. Определение формулы по продуктам сгорания
Разберите образец решения задачи
При сгорании 10,5 г органического вещества получили 16,8 л углекислого газа (н.у.) и 13,5 г воды. Плотность этого вещества при н.у. равна 1,875 г/л. Определите молекулярную формулу вещества.
Решение:
1. Находим молярную массу вещества и его количество вещества:
Если в условии задачи дана относительная плотность органического вещества, то его молекулярную массу определяем согласно формулам:
D(O2) = Mr(газа)/Mr(O2)=Mr(газа)/32;
D(H2) = Mr(газа)/Mr(H2)=Mr(газа)/2;
D(воздуха)=Mr(газа)/Mr(воздуха)=Mr(газа)/29.
M(вещества) = ρ· Vm = 1.875 г/л · 22,4 л/моль = 42 г/моль
υ(вещества ) = m / M = 10,5 г / 42 г/моль = 0,25 моль
2. Найдём количества вещества C, H по формулам:
υ = V/Vm или υ = m/M
υ(C) = υ(CO2)= V/Vm =16,8 л/22,4 л/моль=0,75 моль
υ(H) = 2 · υ(H2O) = 2 · m/M = (2 · 13,5 г)/18 г/моль = 1,5 моль
3. Определим наличие кислорода в формуле вещества:
m(C) = υ(C) · M(C) = 0,75 моль · 12 г/моль = 9 г
m(H) = υ(H) · M(H) = 1,5 моль · 1 г/моль = 1,5 г
m(O) = m(вещества) – (m(C) + m(H)) = 10.5 г – (9 г + 1,5 г) = 0 г, следовательно кислород отсутствует и это углеводород — CxHy
4. Находим формулу
υ(CxHy) : υ(С) : υ(Н) = 0,25 : 0,75 : 1,5 = 1 : 3 : 6
(здесь к целым числам пришли путём деления всех чисел на меньшее из них, т.е. на 0,25)
Следовательно, 1 моль вещества содержит 3 моль углерода и 6 моль водорода, таким образом, искомая формула С3Н6.
IV. Решите задачи
Задача №1. В углеводороде массовая доля углерода равна 84%. Относительная плотность паров углеводорода по воздуху равна 3,45. Определите формулу углеводорода.
Задача №2. Массовая доля углерода в углеводороде составляет 83,33%. Плотность паров углеводорода по водороду равна 36. Определите формулу.
Задача №3. Массовая доля углерода в углеводороде составляет 85,7%. Плотность паров углеводорода по воздуху равна 1,931. Определите формулу.
Задача №4. Углеводород содержит 16,28% водорода. Плотность этого вещества при нормальных условиях 3,839 г/л. Найдите молекулярную формулу этого углеводорода.
Задача №5. Углеводород содержит 82,76% углерода. Масса 1 л этого углеводорода (н.у.) составляет 2.589 г. Найдите молекулярную формулу этого углеводорода.
Задача №6. При сгорании вещества массой 4,25 г образовались оксид углерода (IV) массой 13,2 г и вода массой 5,85 г. Относительная плотность паров этого вещества по воздуху равна 5,862. Определите формулу вещества.
Выведите молекулярную формулу углеводорода (CxHy), 5,6 литра которого имеют массу 11 грамм.
Решение задачи
Зная объем и массу углеводорода (CxHy), найдем молярную массу углеводорода (CxHy) по формуле перерасчета, устанавливающей связь между массой и объемом газа:
Откуда:
Получаем:
M (CxHy) = 11 ∙ 22,4 / 5,6 = 44 (г/моль)
Учитывая, что молярные массы углерода (C) и водорода (H) соответственно равны 12 г/моль и 1 г/моль, составим уравнение:
Далее выведем молекулярную формулу углеводорода (CxHy), используя метод подбора.
Пусть х = 1,
Тогда:
12 + y = 44
y = 32
Получаем:
CH32 – углеводорода с такой формулой нет.
Пусть х = 2,
Тогда:
12 ∙ 2 + y = 44
y = 20
Получаем:
C2H20 – углеводорода с такой формулой нет.
Пусть х = 3,
Тогда:
12 ∙ 3 + y = 44
y =8
Получаем:
C3H8 – пропан.
Ответ:
молекулярная формула углеводорода C3H8.
2023-03-20
Химическое соединение — газ, содержащий углерод (массовая доля 85,7 %) и водород (14,3 %). Образец этого соединения массой 5,25 г занимает объем 2,8 л (н. у.).
Определите структурную формулу этого газа, если известно, что он обесцвечивает бромную воду.
Решение:
Определим количества вещества углерода и водорода в газе (исходя из его массы, равной 100 г):
$n_{C} = frac{85,7}{12} = 7,14 моль; n_{H} = frac{14,3}{1} = 14,3 моль$;
$frac{n_{C}}{n_{H}} = frac{7,14}{14,3} = 0,5$.
Формула газа:
$C_{x}H_{y} : frac{x}{y} = 0,5$.
Найдем молярную массу $C_{x}H_{y}$:
$n_{C_{x}H_{y}} = frac{2,8}{22,4} = 0,125 моль; M_{C_{x}H_{y}} = frac{5,25}{0,125} = 42 г/моль$.
$M(C_{x}H_{y}) = 12 cdot x + y cdot 1$,
$begin{cases} frac{x}{y} = 0,5, \ 12x + y = 12, end{cases}$
отсюда $x = 3, y = 6$.
Вещество имеет формулу $C_{3}H_{6}$, оно реагирует с бромной водой, следовательно, это алкен $CH_{2} = CH — CH_{3}$.
связь углерод-водород (связь C – H ) — это связь между углеродом и атомами водорода, которые можно найти во многих органических соединениях. Эта связь является ковалентной, что означает, что углерод разделяет свои внешние валентные электроны с четырьмя атомами водорода. Это завершает обе их внешние оболочки, делая их стабильными. Связи углерод-водород имеют длину связи около 1,09 Å (1,09 × 10 м) и энергию связи около 413 kJ /моль (см. таблицу ниже). По шкале Полинга — C (2,55) и H (2,2) — разница электроотрицательностей между этими двумя атомами составляет 0,35. Из-за этой небольшой разницы в электроотрицательностях связь C-H обычно считается неполярной. В структурных формулах молекул атомы водорода часто опускаются. Классы соединений, состоящие исключительно из связей C – H и связей C – C, включают алканы, алкены, алкины и ароматические углеводороды. Все вместе они известны как углеводороды.
. В октябре 2016 года астрономы сообщили, что самые основные химические ингредиенты жизни — молекула углерод-водород (CH, или метилидиновый радикал ), положительный ион углерода-водорода (CH +) и ион углерода (C +) — в значительной степени являются результатом ультрафиолетового света от звезд, а не другими способами, такими как результат турбулентных событий, связанных с сверхновыми и молодыми звездами, как считалось ранее.
Реакции
Связь C − H в целом очень прочная, поэтому она относительно инертна. В нескольких классах соединений, вместе называемых углеродными кислотами, связь C-H может быть достаточно кислой для удаления протонов. Неактивированные связи C-H находятся в алканах и не соседствуют с гетероатомом (O, N, Si и т. Д.). Такие связи обычно участвуют только в радикальном замещении. Однако известно, что многие ферменты влияют на эти реакции.
Хотя связь C-H является одной из самых сильных, она варьируется более 30% по величине для довольно стабильных органических соединений, даже при отсутствии гетероатомы.
| Связь | Углеводородный радикал | Молярная энергия диссоциации связи (ккал) | Молярная энергия диссоциации связи (кДж) |
|---|---|---|---|
| CH3-H | Метил | 104 | 440 |
| C2H5-H | Этил | 98 | 410 |
| (CH 3)2HC-H | Изопропил | 95 | 400 |
| (CH 3)3C-H | трет-бутил | 93 | 390 |
| CH2= CH-H | винил | 112 | 470 |
| HC≡C-H | этинил | 133 | 560 |
| C6H5-H | фенил | 110 | 460 |
| CH2= CHCH 2 -H | Аллил | 88 | 370 |
| C6H5CH2-H | Бензил | 85 | 360 |
| OC4H7-H | тетрагидрофуранил | 92 | 380 |
| CH3C (O) CH 2 -H | ацетонил | 96 | 400 |