Воспалительные заболевания кишечника
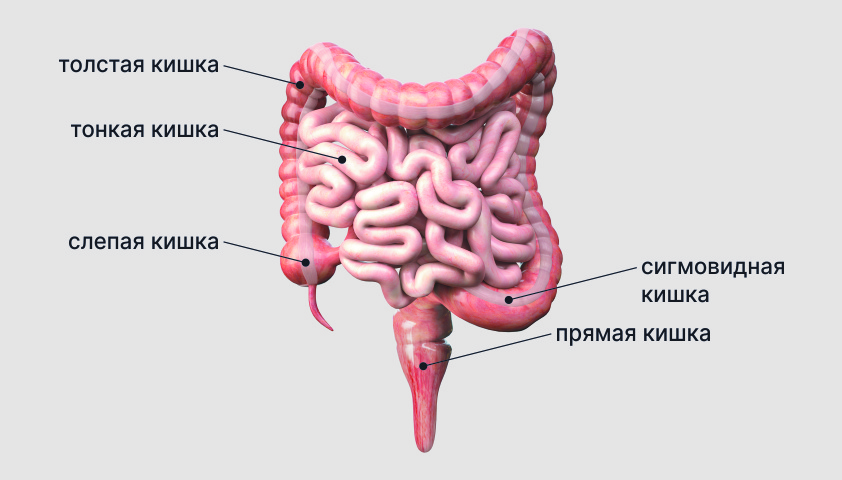
Воспалительные заболевания кишечника – это хронические иммунопатологические болезни неизвестной этиологии, которые поражают разные отделы ЖКТ. Они возникают на фоне генетической предрасположенности, нарушения микробиоты тонкой и толстой кишки, действия экзогенных факторов. Патология вызывает кишечные симптомы (боли в животе, расстройства стула, появление слизи и крови в кале), сопровождающиеся разнообразными внекишечными проявлениями. Для диагностики используют данные УЗИ, рентгенографии и КТ органов живота, эндоскопии (ЭФГДС, колоноскопия), лабораторных анализов. Лечение консервативное, при осложнениях требуется хирургическое вмешательство.
Общие сведения
Группу воспалительных заболеваний кишечника (ВЗК) составляют две основные нозологические единицы: язвенный колит (ЯК) и болезнь Крона (БК). Суммарная частота встречаемости патологий составляет 60-300 случаев на 100 тыс. населения. Некоторые исследователи выделяют третью форму ВЗК – недифференцированный неспецифический колит. Несмотря на относительно низкую распространенность, воспалительные заболевания кишечника имеют высокую медико-социальную значимость, не теряют актуальности в практической гастроэнтерологии.
Воспалительные заболевания кишечника
Причины
Этиологические факторы воспалительных заболеваний пока точно не установлены. Большое значение уделяется генетическим изменениям. Описан полиморфизм Ala893 – гена множественной лекарственной резистентности (MDR1), полигенные мутации главного комплекса гистосовместимости, мутации IBD5 и CARD15 (NOD2) на 16-ой хромосоме. Гены участвуют в формировании эпителиального защитного барьера, регулируют иммунный ответ. Другие возможные причины ВЗК:
- Дисбиоз кишечника. Патология возникает при снижении числа полезных бифидобактерий, возрастании количества болезнетворных энтеробактерий и анаэробных микроорганизмов. Дисбаланс микрофлоры оказывает токсическое и аллергизирующее действие, нарушает естественную иммунную защиту в кишечнике.
- Внешние факторы. Риск развития заболевания повышают вирусы (герпесвирус, возбудитель кори), бактерии (хламидии, листерии, микобактерии). Определенную роль в формировании ВЗК играет хронический стресс, проживание в регионе с плохой экологией, употребление рафинированных продуктов и пищи с большим количеством консервантов.
Патогенез
Под действием генетических факторов и внешних агентов развиваются повреждения кишечной стенки и сопутствующие нарушения иммунного ответа. Эпителиальный барьер кишечника становится проницаемым для антигенов, в ответ на которые в организме активно формируются антитела. Постепенно у 60-75% пациентов образуются противотолстокишечные аутоантитела, реже встречаются антинейтрофильные аутоантитела (ANSA).
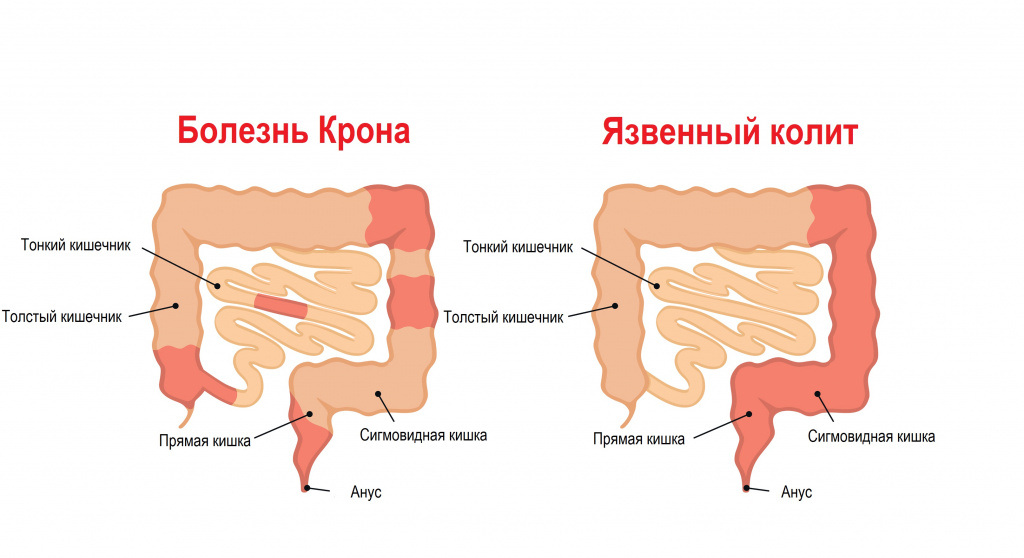
При болезни Крона иммунные комплексы атакуют любые отделы ЖКТ – от ротовой полости до ануса, вызывая характерное гранулематозное воспаление с трансмуральным поражением стенки пищеварительного канала. При неспецифическом язвенном колите наблюдается поверхностное воспаление толстой кишки без отдельных гранулем. При ВЗК нарушается всасывательная, секреторная и эвакуаторная функция кишечника, с чем связаны различные гастроэнтерологические симптомы.
Большое значение в патогенезе воспалительных заболеваний имеют провоспалительные цитокины, которые синтезируются макрофагами, Т-лимфоцитами и эндотелиальными клетками. К ним относят фактор некроза опухолей, интерлейкины 1 и 6, гамма-интерферон. Со временем в крови появляются иммунные комплексы, которые поражают другие органы и ткани: кожу, орган зрения опорно-двигательный аппарат, систему кроветворения.
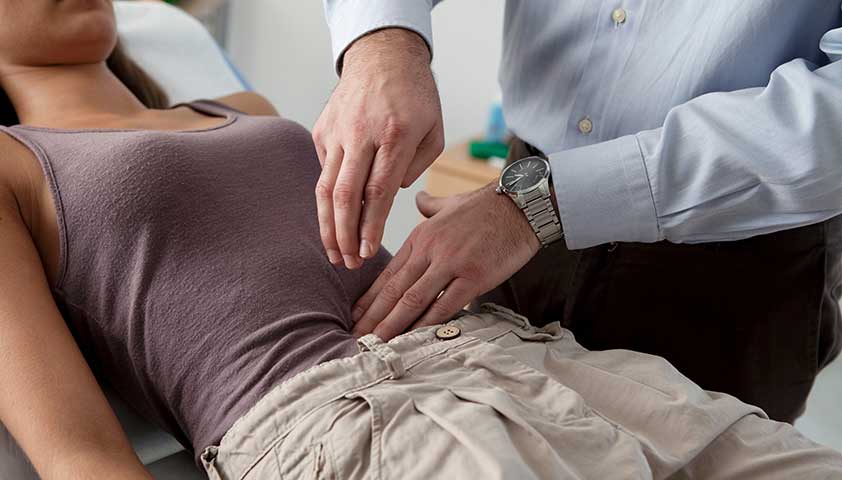
Боль в животе при ВЗК
Симптомы
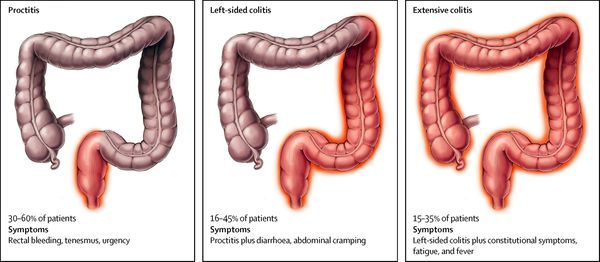
Манифестация воспалительных заболеваний кишечника чаще всего происходит в возрасте 20-40 лет. При ВЗК развиваются типичные признаки поражения ЖКТ: хроническая диарея, боли в животе различной локализации, примеси крови и слизи в каловых массах. Для язвенного колита характерны ложные позывы на дефекацию (тенезмы), выделение малых объемов кала («ректальный плевок»). У 25-35% пациентов наблюдаются трещины и свищи в перианальной зоне, которые более характерны для БК.
Вторую группу симптомов ВЗК составляют внекишечные проявления, вызванные системным действием иммунопатологических механизмов. Они в 3 раза чаще встречаются при язвенном колите и болезни Крона с поражением толстого кишечника, чем при изолированном терминальном илеите, типичном для БК. Внекишечные признаки отягощают течение воспалительного заболевания, снижают качество жизни и могут стать причиной инвалидизации.
Поражение опорно-двигательной системы представлено артритом крупных суставов, остеопорозом, сакроилеитом и анкилозирующим спондилитом (болезнью Бехтерева). Нарушения зрения возникают в результате эписклерита и увеита. Вовлечение в процесс кожи и слизистых оболочек проявляется узловатой эритемой, афтозным стоматитом, гангренозной пиодермией.
У 3-5% больных с ВЗК возникают патологии гепатобилиарной системы: первичный склерозирующий холангит, аутоиммунный гепатит, желчнокаменная болезнь. При длительном существовании заболевания и значительном поражении кишечника развивается синдром мальабсорбции, который сопровождается железодефицитной или В12-дефицитной анемией, полигиповитаминозами, признаками недостатка микроэлементов.
Осложнения
Вероятность тяжелого обострения ВЗК составляет 15% на протяжении жизни. При проведении адекватного лечения рецидивы возникают у 50% пациентов в первые 5 лет от начала терапии, у 80% больных – в течение 10 лет. Серьезной проблемой остается зависимость от системных стероидов, которые применяются для купирования обострений – в организме снижается синтез собственных гормонов, поэтому после отмены лекарств возможна надпочечниковая недостаточность.
К жизнеугрожающим последствиям воспалительных заболеваний относят токсическую дилатацию кишечника, перфорацию стенки с массивным кровотечением. Для БК характерно образование свищей, которые открываются в перианальной области. При заживлении язв зачастую формируются рубцовые стриктуры, которые нарушают пассаж каловых масс и со временем приводят к острой кишечной непроходимости.
ВЗК относят к факультативным предраковым заболеваниям. Риск развития колоректального рака возрастает в 20 раз по сравнению со среднепопуляционным значением. От манифестации воспалительного заболевания кишечника до формирования злокачественной опухоли проходит более 10 лет. Если человек болеет дольше 30 лет, вероятность развития рака составляет свыше 18%.
Диагностика
При подозрении на ВЗК пациенту необходима консультация врача-гастроэнтеролога. Первый этап диагностики – уточнение жалоб и детальный сбор анамнеза, чтобы уточнить время и очередность появления симптомов, количество внекишечных проявлений, результативность проводимого ранее лечения. Второй этап – физикальное обследование с пальпацией живота и осмотром перианальной зоны. На третьем этапе назначаются такие методы исследования:
- Неинвазивные методы визуализации. Базовое обследование при гастроэнтерологических жалобах включает УЗИ и обзорную рентгенографию органов брюшной полости, рентгенологическое исследование с контрастированием. В спорных случаях для уточнения диагноза назначают КТ или МРТ органов живота.
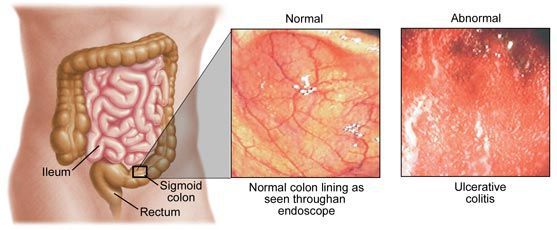
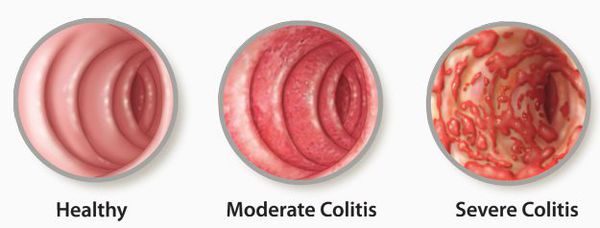
- Эндоскопическая диагностика. При синдроме колита проводится колоноскопия, чтобы оценить степень и распространенность поражения стенки кишечника, выполнить биопсию пораженных участков для гистологического анализа. При болезни Крона с вовлечением в процесс верхних отделов ЖКТ потребуется ЭФГДС, по показаниям назначают капсульную эндоскопию.
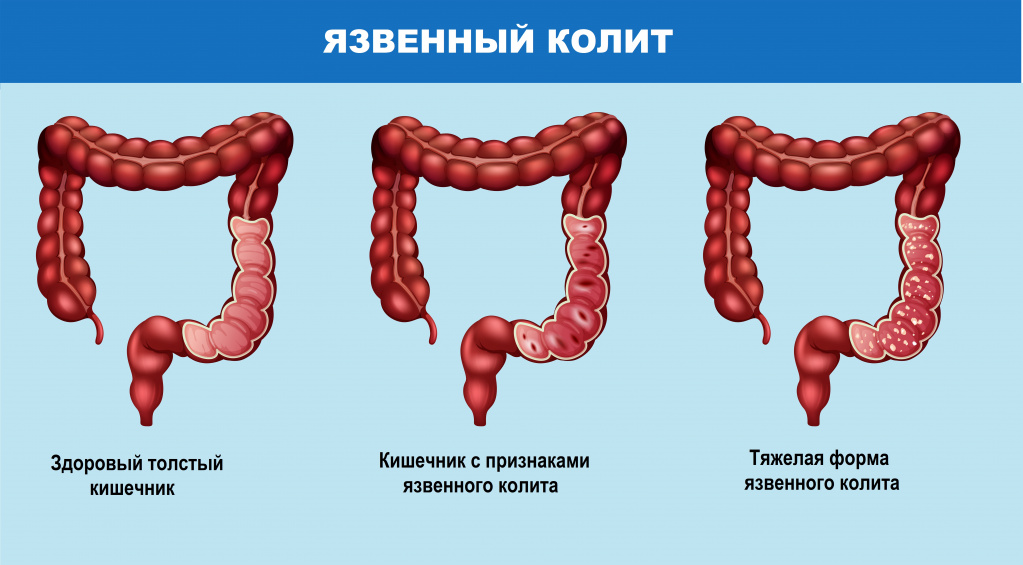
- Биопсия стенки кишечника. К патогномоничным признакам воспалительных заболеваний кишечника относят поверхностные (при НЯК) или глубокие щелевидные язвы (при БК), лимфоплазмоцитарную инфильтрацию, структурные изменения ворсин. При язвенном колите определяются нарушения секреции слизи и крипт-абсцессы.
- Лабораторные исследования. В стандартный комплекс входит клинический и биохимический анализ крови, определение острофазовых показателей, коагулограмма. Также проводится копрограмма, бактериологический посев кала, анализ каловых масс на яйца гельминтов.
Дифференциальная диагностика
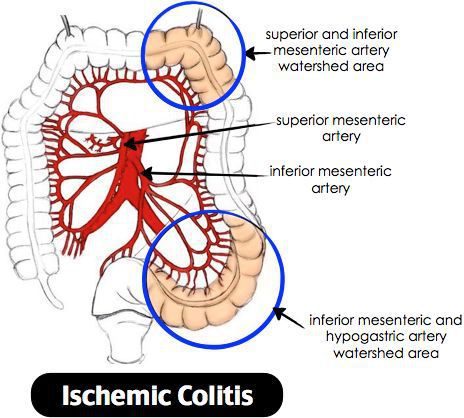
При постановке диагноза исключают более распространенные причины абдоминальных болей и диспепсических нарушений. ВЗК дифференцируют с инфекционными болезнями (сальмонеллез, дизентерия, амебиаз, паразитозы), антибиотик-ассоциированной диареей, туберкулезом кишечника, ишемическим колитом. Выделение крови с калом требует дифференциальной диагностики с геморроем, анальной трещиной, колоректальным раком.
Эндоскопическое исследование ЖКТ
Лечение воспалительных заболеваний кишечника
Консервативная терапия
При болезни Крона и язвенном колите требуется комплексное медикаментозное лечение для индукции и длительного поддержания ремиссии, профилактики осложнений. Терапевтическая программа подбирается с учетом степени тяжести заболевания, выраженности клинических проявлений, наличия внекишечной симптоматики. Используемые препараты подразделяются на 3 категории:
- Средства для индукции ремиссии. В первую линию терапии входят системные глюкокортикостероиды и иммуносупрессоры, по показаниям их дополняют антибиотиками и салицилатами. Высокую эффективность показывают генно-инженерные препараты – моноклональные антитела к провоспалительным цитокинам.
- Противорецидивные средства. После ликвидации острых проявлений назначаются поддерживающие курсы иммуносупрессоров, препаратов 5-аминосалициловой кислоты и моноклональных антител. Основная задача этого этапа – стойкий контроль симптомов без применения гормонов.
- Вспомогательные медикаменты. Используется фармакотерапия для коррекции осложнений ВЗК: препараты железа при анемии, средства с кальцием при остеопорозе, парентеральные растворы для устранения белково-электролитных нарушений.
Хирургическое лечение
Операцию назначают при осложненной форме воспалительного заболевания, отсутствии эффекта от консервативной терапии. По возможности ограничиваются минимально травматичными вмешательствами: стриктуропластикой, дилатацией стриктур, эндоскопической остановкой кровотечения, чтобы сохранить целостность кишечника. Глубокое поражение стенки кишки требует резекции отдельных участков с наложением анастомозов или выведением стомы.
Прогноз и профилактика
Правильно подобранное лечение позволяет контролировать симптоматику воспалительных заболеваний кишечника и поддерживать удовлетворительное качество жизни пациента. При развитии осложнений и потребности в радикальных операциях прогноз сомнительный. Поскольку причины и факторы риска точно не определены, эффективные превентивные меры отсутствуют. Вторичная профилактика заключается в ранней диагностике и своевременном начале терапии.
|
Литература 1. Клинические рекомендации Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России по диагностике и лечению язвенного колита. – 2020. 2. Воспалительные заболевания кишечника. Клиническое руководство/ под ред. И.П. Халифа. – 2018. 3. Воспалительная болезнь кишечника. Глобальные практические рекомендации Всемирной гастроэнтерологической ассоциации. – 2015. 4. Воспалительные заболевания кишечника/ И.П. Павлова и соавт. – 2014. |
Код МКБ-10 К50-К52 |
Воспалительные заболевания кишечника — лечение в Москве
| Inflammatory bowel diseases | |
|---|---|
 |
|
| Micrograph showing inflammation of the large bowel in a case of inflammatory bowel disease. Colonic biopsy. H&E stain. | |
| Specialty | Gastroenterology |
| Differential diagnosis | Gastroenteritis, irritable bowel syndrome, celiac disease |
| Frequency | 11.2 million worldwide (2015)[1] |
| Deaths | 47,400 worldwide (2015)[2] |
Inflammatory bowel disease (IBD) is a group of inflammatory conditions of the colon and small intestine, Crohn’s disease and ulcerative colitis (UC) being the principal types.[3] Crohn’s disease affects the small intestine and large intestine, as well as the mouth, esophagus, stomach and the anus, whereas ulcerative colitis primarily affects the colon and the rectum.[4][5][6]
Signs and symptoms[edit]
| Crohn’s disease | Ulcerative colitis | |
|---|---|---|
| Defecation | Often porridge-like,[7] sometimes steatorrhea |
Often mucus-like and with blood[7] |
| Tenesmus | Less common[7] | More common[7] |
| Fever | Common[7] | Indicates severe disease[7] |
| Fistulae | Common[8] | Seldom |
| Weight loss | Often | More seldom |
In spite of Crohn’s and UC being very different diseases, both may present with any of the following symptoms: abdominal pain, diarrhea, rectal bleeding, severe internal cramps/muscle spasms in the region of the pelvis and weight loss. Anemia is the most prevalent extraintestinal complication of inflammatory bowel disease.[9][10] Associated complaints or diseases include arthritis, pyoderma gangrenosum, primary sclerosing cholangitis, and non-thyroidal illness syndrome (NTIS).[11] Associations with deep vein thrombosis (DVT)[12] and bronchiolitis obliterans organizing pneumonia (BOOP) have also been reported.[13] Diagnosis is generally by assessment of inflammatory markers in stool followed by colonoscopy with biopsy of pathological lesions.[14]
| Crohn’s disease | Ulcerative colitis | |
|---|---|---|
| Terminal ileum involvement | Commonly | Seldom |
| Colon involvement | Usually | Always |
| Rectum involvement | Seldom | Usually (95%)[15] |
| Involvement around the anus |
Common[16] | Seldom |
| Bile duct involvement | No increase in rate of primary sclerosing cholangitis | Higher rate[17] |
| Distribution of disease | Patchy areas of inflammation (skip lesions) | Continuous area of inflammation[15] |
| Endoscopy | Deep geographic and serpiginous (snake-like) ulcers | Continuous ulcer |
| Depth of inflammation | May be transmural, deep into tissues[16][5] | Shallow, mucosal |
| Stenosis | Common | Seldom |
| Granulomas on biopsy | May have non-necrotizing non-peri-intestinal crypt granulomas[16][18][19] | Non-peri-intestinal crypt granulomas not seen[20] |
Causes[edit]
| Crohn’s disease | Ulcerative colitis | |
|---|---|---|
| Cytokine response | Associated with Th17[21] | Vaguely associated with Th2 |
IBD is a complex disease which arises as a result of the interaction of environmental and genetic factors leading to immunological responses and inflammation in the intestine.[4]
Diet[edit]
People living with IBD are very interested in diet, but little is known about the impact of diet on these patients. Recent reviews underlined the important role of nutritional counselling in IBD patients. Patients should be encouraged to adopt diets that are best supported by evidence and involve monitoring for the objective resolution of inflammation.[22][23]
A 2022 study found that diets with increased intake of fruits and vegetables, reduction of processed meats and refined carbohydrates, and preference of water for hydration were associated with lower risk of active symptoms with IBD, although increased intake of fruits and vegetables alone did not reduce risk of symptoms with Crohn’s disease.[24]
Dietary patterns are associated with a risk for ulcerative colitis. In particular, subjects who were in the highest tertile of the healthy dietary pattern had a 79% lower risk of ulcerative colitis.[25]
Gluten sensitivity is common in IBD and associated with having flareups. Gluten sensitivity was reported in 23.6% and 27.3% of Crohn’s disease and ulcerative colitis patients, respectively.[26]
A diet high in protein, particularly animal protein, and/or high in sugar may be associated with increased risk of inflammatory bowel disease and relapses.[27][28]
Bile acids[edit]
Emerging evidence indicates that bile acids are important etiological agents in IBD pathogenesis.[29] IBD patients have a consistent pattern of an increased abundance of primary bile acids such as cholic acid and chenodeoxycholic acid (and their conjugated forms), and a decreased abundance of secondary bile acids such as lithocholic acid and deoxycholic acid.[29]
Microbiota[edit]
As a result of microbial symbiosis and immunity, alterations in the gut microbiome may contribute to inflammatory gut diseases.[30] IBD-affected individuals have been found to have 30–50 percent reduced biodiversity of commensal bacteria, such as decreases in Bacillota (namely Lachnospiraceae) and Bacteroidota. Further evidence of the role of gut flora in the cause of inflammatory bowel disease is that IBD-affected individuals are more likely to have been prescribed antibiotics in the 2–5 year period before their diagnosis than unaffected individuals.[31] The enteral bacteria can be altered by environmental factors, such as concentrated milk fats (a common ingredient of processed foods and confectionery) or oral medications such as antibiotics and oral iron preparations.[32] The mucosal microbiota in the large intestine of IBD patients with active inflammation was found to be associated with pro-inflammatory changes to the host epigenome.[33] However, large international studies have failed to identify a single microbial biomarker of IBD indicating it’s not driven by any single micro-organism.[34]
Breach of intestinal barrier[edit]
Loss of integrity of the intestinal epithelium plays a key pathogenic role in IBD.[35] Dysfunction of the innate immune system as a result of abnormal signaling through immune receptors called toll-like receptors (TLRs)—which activates an immune response to molecules that are broadly shared by multiple pathogens—contributes to acute and chronic inflammatory processes in IBD colitis and associated cancer.[36] Changes in the composition of the intestinal microbiota are an important environmental factor in the development of IBD. Detrimental changes in the intestinal microbiota induce an inappropriate (uncontrolled) immune response that results in damage to the intestinal epithelium. Breaches in this critical barrier (the intestinal epithelium) allow further infiltration of microbiota that, in turn, elicit further immune responses. IBD is a multifactorial disease that is nonetheless driven in part by an exaggerated immune response to gut microbiota that causes defects in epithelial barrier function.[37]
Oxidative stress and DNA damage[edit]
Pereira et al.[38] reviewed evidence from numerous studies indicating that oxidative stress and DNA damage likely have a role in the pathophysiology of IBD. Oxidative DNA damage as measured by 8-OHdG levels was found to be significantly increased in patients with IBD compared to control patients, and in inflamed mucosa compared with non-inflamed mucosa.[38]
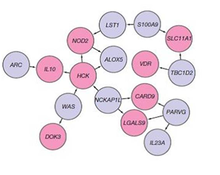
Genetics[edit]
Associated loci pane. Pink genes are in IBD associated loci, blue are not.
A genetic component to IBD has been recognized for over a century.[39] Research that has contributed to understanding of the genetics include studies of ethnic groups (e.g., Ashkenazi Jews, Irish), familial clustering, epidemiological studies, and twin studies. With the advent of molecular genetics, understanding of the genetic basis has expanded considerably, particularly in the past decade.[40] The first gene linked to IBD was NOD2 in 2001. Genome-wide association studies have since added to understanding of the genomics and pathogenesis of the disease. More than 200 single nucleotide polymorphisms (SNPs or «snips») are now known to be associated with susceptibility to IBD.[41] One of the largest genetic studies of IBD was published in 2012.[42] The analysis explained more of the variance in Crohn’s disease and ulcerative colitis than previously reported.[40] The results suggested that commensal microbiota are altered in such a way that they act as pathogens in inflammatory bowel diseases. Other studies show that mutations in IBD-associated genes might interfere with the cellular activity and interactions with the microbiome that promote normal immune responses.[43] Many studies identified that microRNAs dysregulation involved in IBD and to promote colorectal cancer.[44] By 2020, single-cell RNA sequencing analysis was launched by a small consortium using IBD patient biopsy material in a search for therapeutic targets.[45]
Diagnosis[edit]
The diagnosis is usually confirmed by biopsies on colonoscopy. Fecal calprotectin is useful as an initial investigation, which may suggest the possibility of IBD, as this test is sensitive but not specific for IBD.[46][47]
Differential diagnosis[edit]
Other diseases may cause an increased excretion of fecal calprotectin, such as infectious diarrhea, untreated celiac disease, necrotizing enterocolitis, intestinal cystic fibrosis and neoplastic pediatric tumor cells.[48]
Conditions with similar symptoms as Crohn’s disease includes intestinal tuberculosis, Behçet’s disease, ulcerative colitis, nonsteroidal anti-inflammatory drug enteropathy, irritable bowel syndrome and coeliac disease.[49]
Conditions with similar symptoms as ulcerative colitis includes acute self-limiting colitis, amebic colitis, schistosomiasis, Crohn’s disease, colon cancer, irritable bowel syndrome, intestinal tuberculosis and nonsteroidal anti-inflammatory drug enteropathy.[49]
Liver function tests are often elevated in inflammatory bowel disease, and are often mild and generally return spontaneously to normal levels.[50] The most relevant mechanisms of elevated liver functions tests in IBD are drug-induced hepatotoxicity and fatty liver.[50]
Classification[edit]
The chief types of inflammatory bowel disease are Crohn’s disease and ulcerative colitis (UC). Inflammatory bowel diseases fall into the class of autoimmune diseases, in which the body’s own immune system attacks elements of the digestive system.[51]
Accounting for fewer cases are other forms of IBD, which are not always classified as typical IBD:[52]
- Microscopic colitis subdivided into collagenous colitis and lymphocytic colitis
- Diversion colitis
- Behçet’s disease
- Early Onset IBD[53]
- Indeterminate colitis
No disease specific markers are currently known in the blood, enabling the reliable separation of Crohn’s disease and ulcerative colitis patients.[54] The way doctors can tell the difference between Crohn’s disease and UC is the location and nature of the inflammatory changes. Crohn’s can affect any part of the gastrointestinal tract, from mouth to anus (skip lesions), although a majority of the cases start in the terminal ileum. Ulcerative colitis, in contrast, is restricted to the colon and the rectum.[55] Microscopically, ulcerative colitis is restricted to the mucosa (epithelial lining of the gut), while Crohn’s disease affects the full thickness of the bowel wall («transmural lesions»). Lastly, Crohn’s disease and ulcerative colitis present with extra-intestinal manifestations (such as liver problems, arthritis, skin manifestations and eye problems) in different proportions.[56]
In 10–15% of cases,[57] a definitive diagnosis neither of Crohn’s disease nor of ulcerative colitis can be made because of idiosyncrasies in the presentation. In this case, a diagnosis of indeterminate colitis may be made. Although a recognised definition, not all centres refer to this.[58]
Treatment[edit]
| Crohn’s disease | Ulcerative colitis | |
|---|---|---|
| Mesalazine | Less useful[59] | More useful[59] |
| Antibiotics | Effective in long-term[60] | Generally not useful[61] |
| Surgery | Often returns following removal of affected part |
Usually cured by removal of colon |
Surgery[edit]
CD and UC are chronic inflammatory diseases, and are not medically curable.[62] However, Ulcerative Colitis can in most cases be cured by proctocolectomy, although this may not eliminate extra-intestinal symptoms. An ileostomy will collect feces in a bag. Alternatively, a pouch can be created from the small intestine; this serves as the rectum and prevents the need for a permanent ileostomy. Between one-quarter and one-half of patients with ileo-anal pouches do have to manage occasional or chronic pouchitis.[63]
Surgery cannot cure Crohn’s disease but may be needed to treat complications such as abscesses, strictures or fistulae.[64] Severe cases may require surgery, such as bowel resection, strictureplasty or a temporary or permanent colostomy or ileostomy. In Crohn’s disease, surgery involves removing the worst inflamed segments of the intestine and connecting the healthy regions, but unfortunately, it does not cure Crohn’s or eliminate the disease. At some point after the first surgery, Crohn’s disease can recur in the healthy parts of the intestine, usually at the resection site.[65] (For example, if a patient with Crohn’s disease has an ileocecal anastomosis, in which the caecum and terminal ileum are removed and the ileum is joined to the ascending colon, their Crohn’s will nearly always flare-up near the anastomosis or in the rest of the ascending colon).[66]
Medical therapies[edit]
Medical treatment of IBD is individualised to each patient.[62] The choice of which drugs to use and by which route to administer them (oral, rectal, injection, infusion) depends on factors including the type, distribution, and severity of the patient’s disease, as well as other historical and biochemical prognostic factors, and patient preferences. For example, mesalazine is more useful in ulcerative colitis than in Crohn’s disease.[59] Generally, depending on the level of severity, IBD may require immunosuppression to control the symptoms, with drugs such as prednisone, tumor necrosis factor inhibitors (TNF inhibitors), azathioprine, methotrexate, or 6-mercaptopurine.[67]
Steroids, such as the glucocorticoid prednisone, are frequently used to control disease flares and were once acceptable as a maintenance drug. Biological therapy for inflammatory bowel disease, especially the TNF inhibitors, are used in people with more severe or resistant Crohn’s disease and sometimes in ulcerative colitis.[68]
Treatment is usually started by administering drugs with high anti-inflammatory effects, such as prednisone. Once the inflammation is successfully controlled, another drug to keep the disease in remission, such as mesalazine in UC, is the main treatment. If further treatment is required, a combination of an immunosuppressive drug (such as azathioprine) with mesalazine (which may also have an anti-inflammatory effect) may be needed, depending on the patient. Controlled release budesonide is used for mild ileal Crohn’s disease.[62]
Nutritional and dietetic therapies[edit]
Exclusive enteral nutrition is a first-line therapy in pediatric Crohn’s disease with weaker data in adults.[69]: 331 [70] Evidence supporting exclusive enteral nutrition in ulcerative colitis is lacking.[69]: 333
Nutritional deficiencies play a prominent role in IBD. Malabsorption, diarrhea, and GI blood loss are common features of IBD. Deficiencies of B vitamins, fat-soluble vitamins, essential fatty acids, and key minerals such as magnesium, zinc, and selenium are extremely common and benefit from replacement therapy. Dietary interventions, including certain exclusion diets like the specific carbohydrate diet (SCD) can be beneficial for symptom management.[71] Dietary fiber interventions, such as psyillium supplementation (a mixture of soluble and insoluble fibers), may relieve symptoms as well as induce/maintain remission by altering the microbiome composition of the GI tract, thereby improving regulation of immune function, reducing inflammation, and helping to restore the intestinal mucosal lining.[72]
Anaemia is commonly present in both ulcerative colitis and Crohn’s disease. Due to raised levels of inflammatory cytokines which lead to the increased expression of hepcidin, parenteral iron is the preferred treatment option as it bypasses the gastrointestinal system, has lower incidence of adverse events and enables quicker treatment. Hepcidin itself is also an anti-inflammatory agent. In the murine model very low levels of iron restrict hepcidin synthesis, worsening the inflammation that is present.[73] Enteral nutrition has been found to be efficient to improve hemoglobin level in patients with inflammatory bowel disease, especially combined with erythropoietin.[74]
Gastrointestinal bleeding, occurring especially during ulcerative colitis relapse, can contribute to anaemia when chronic, and may be life-threatening when acute. To limit the possible risk of dietary intake disturbing hemostasis in acute gastrointestinal bleeding, temporary fasting is often considered necessary in hospital settings.[75] The effectiveness of this approach is unknown; a Cochrane review in 2016 found no published clinical trials including children.[76]
Microbiome[edit]
There is preliminary evidence of an infectious contribution to inflammatory bowel disease in some patients that may benefit from antibiotic therapy, such as with rifaximin.[77] The evidence for a benefit of rifaximin is mostly limited to Crohn’s disease with less convincing evidence supporting use in ulcerative colitis.[78][79]
The use of oral probiotic supplements to modify the composition and behaviour of the microbiome has been considered as a possible therapy for both induction and maintenance of remission in people with Crohn’s disease and ulcerative colitis. A Cochrane review in 2020 did not find clear evidence of improved remission likelihood, nor lower adverse events, in people with Crohn’s disease, following probiotic treatment.[80]
For ulcerative colitis, there is low-certainty evidence that probiotic supplements may increase the probability of clinical remission.[81] People receiving probiotics were 73% more likely to experience disease remission and over 2x as likely to report improvement in symptoms compared to those receiving a placebo, with no clear difference in minor or serious adverse effects.[81] Although there was no clear evidence of greater remission when probiotic supplements were compared with 5‐aminosalicylic acid treatment as a monotherapy, the likelihood of remission was 22% higher if probiotics were used in combination with 5-aminosalicylic acid therapy.[81] Whereas in people who are already in remission, it is unclear whether probiotics help to prevent future relapse, either as a monotherapy or combination therapy.[82]
Fecal microbiota transplant is a relatively new treatment option for IBD which has attracted attention since 2010.[83][84] Some preliminary studies have suggested benefits similar to those in Clostridium difficile infection but a review of use in IBD shows that FMT is safe, but of variable efficacy. A 2014 review stated that more randomized controlled trials were needed.[84]
Alternative medicine[edit]
Complementary and alternative medicine approaches have been used in inflammatory bowel disorders.[85] Evidence from controlled studies of these therapies has been reviewed; risk of bias was quite heterogeneous. The best supportive evidence was found for herbal therapy, with Plantago ovata and curcumin in UC maintenance therapy, wormwood in CD, mind/body therapy and self-intervention in UC, and acupuncture in UC and CD.[86]
Novel approaches[edit]
Stem cell therapy is undergoing research as a possible treatment for IBD. A review of studies suggests a promising role, although there are substantial challenges, including cost and characterization of effects, which limit the current use in clinical practice.[87]
Psychological interventions[edit]
Currently, there is no evidence to recommend psychological treatment, such as psychotherapy, stress management and patient’s education, to all adults with IBD in general.[88] These treatments had no effect on quality of life, emotional well-being and disease activity.[88] The need for these approaches should be individually assessed and further researched to identify subgroups and determine type of therapy that may benefit individuals with IBD.[88] In adolescents population such treatments may be beneficial on quality of life and depression, although only short-term effects have been found, which also imposes the need for further research.[88]
Treatment standards[edit]
Crohn’s and Colitis Australia, the peak body for IBD in Australia, where prevalence is one of the highest in the world, reviewed the quality of care for patients admitted to Australian hospitals. They found that only one hospital met accepted standards for multidisciplinary care, but that care was improved with the availability of even minimal specialised services.[89]
Prognosis[edit]
| Crohn’s disease |
Ulcerative colitis |
||
|---|---|---|---|
| Nutrient deficiency | Higher risk | ||
| Colon cancer risk | Slight | Considerable | |
| Prevalence of extraintestinal complications[90][91][92] | |||
| Iritis/uveitis | Females | 2.2% | 3.2% |
| Males | 1.3% | 0.9% | |
| Primary sclerosing cholangitis |
Females | 0.3% | 1% |
| Males | 0.4% | 3% | |
| Ankylosing spondylitis |
Females | 0.7% | 0.8% |
| Males | 2.7% | 1.5% | |
| Pyoderma gangrenosum |
Females | 1.2% | 0.8% |
| Males | 1.3% | 0.7% | |
| Erythema nodosum | Females | 1.9% | 2% |
| Males | 0.6% | 0.7% |
While IBD can limit quality of life because of pain, vomiting, and diarrhea, it is rarely fatal on its own. Fatalities due to complications such as toxic megacolon, bowel perforation and surgical complications are also rare.[93] Fatigue is a common symptom of IBD and can be a burden.[94]
Around one-third of individuals with IBD experience persistent gastrointestinal symptoms similar to irritable bowel syndrome (IBS) in the absence of objective evidence of disease activity.[95] Despite enduring the side-effects of long-term therapies, this cohort has a quality of life that is not significantly different to that of individuals with uncontrolled, objectively active disease, and escalation of therapy to biological agents is typically ineffective in resolving their symptoms.[96] The cause of these IBS-like symptoms is unclear, but it has been suggested that changes in the gut-brain axis, epithelial barrier dysfunction, and the gut flora may be partially responsible.[97][needs update]
While patients of IBD do have an increased risk of colorectal cancer, this is usually caught much earlier than the general population in routine surveillance of the colon by colonoscopy, and therefore patients are much more likely to survive.[98]
New evidence suggests that patients with IBD may have an elevated risk of endothelial dysfunction and coronary artery disease.[99][100]
The goal of treatment is toward achieving remission, after which the patient is usually switched to a lighter drug with fewer potential side effects. Every so often, an acute resurgence of the original symptoms may appear; this is known as a «flare-up». Depending on the circumstances, it may go away on its own or require medication. The time between flare-ups may be anywhere from weeks to years, and varies wildly between patients – a few have never experienced a flare-up.[101]
Life with IBD can be challenging; however, many with the condition lead relatively normal lives. IBD carries a psychological burden due to stigmatization of being diagnosed, leading to high levels of anxiety, depression, and a general reduction in the quality of life.[102][103] Although living with IBD can be difficult, there are numerous resources available to help families navigate the ins and out of IBD, such as the Crohn’s and Colitis Foundation of America (CCFA).
Epidemiology[edit]
IBD resulted in a global total of 51,000 deaths in 2013 and 55,000 deaths in 1990.[104] The increased incidence of IBD since World War II has been correlated to the increase in meat consumption worldwide, supporting the claim that animal protein intake is associated with IBD.[105] However, there are many environmental risk factors that have been linked to the increased and decreased risk of IBD, such as smoking, air pollution and greenspace, urbanization and Westernization.[106] Inflammatory bowel diseases are increasing in Europe.[107] Incidence and prevalence of IBD has risen steadily for the last decades in Asia, which could be related changes in diet and other environmental factors.[108]
Around 0.8% of people in the UK have IBD.[109] Similarly, around 270,000 (0.7%) of people in Canada have IBD,[110] with that number expected to rise to 400,000 (1%) by 2030.[111]
Research[edit]
The following treatment strategies are not used routinely, but appear promising in some forms of inflammatory bowel disease.
Initial reports[112] suggest that «helminthic therapy» may not only prevent but even control IBD: a drink with roughly 2,500 ova of the Trichuris suis helminth taken twice monthly decreased symptoms markedly in many patients. It is even speculated that an effective «immunization» procedure could be developed—by ingesting the cocktail at an early age.[113]
Prebiotics and probiotics are focusing increasing interest as treatments for IBD. Currently, there is evidence to support the use of certain probiotics in addition to standard treatments in people with ulcerative colitis but there is no sufficient data to recommend probiotics in people with Crohn’s disease. Both single strain and multi-strain probiotics have been researched for mild to moderate cases of ulcerative colitis. The most clinically researched multi-strain probiotic with over 70 human trials is the De Simone Formulation.[114] Further research is required to identify specific probiotic strains or their combinations and prebiotic substances for therapies of intestinal inflammation.[115]
Currently, the probiotic strain, frequency, dose and duration of the probiotic therapy are not established.[116] In severely ill people with IBD there is a risk of the passage of viable bacteria from the gastrointestinal tract to the internal organs (bacterial translocation) and subsequent bacteremia, which can cause serious adverse health consequences.[116] Live bacteria might not be essential because of beneficial effects of probiotics seems to be mediated by their DNA and by secreted soluble factors, and their therapeutic effects may be obtained by systemic administration rather than oral administration.[116][117]
In 2005 New Scientist published a joint study by Bristol University and the University of Bath on the apparent healing power of cannabis on IBD. Reports that cannabis eased IBD symptoms indicated the possible existence of cannabinoid receptors in the intestinal lining, which respond to molecules in the plant-derived chemicals. CB1 cannabinoid receptors – which are known to be present in the brain – exist in the endothelial cells which line the gut, it is thought that they are involved in repairing the lining of the gut when damaged.[118]
The team deliberately damaged the cells to cause inflammation of the gut lining and then added synthetically produced cannabinoids; the result was that gut started to heal: the broken cells were repaired and brought back closer together to mend the tears. It is believed that in a healthy gut, natural endogenous cannabinoids are released from endothelial cells when they are injured, which then bind to the CB1 receptors. The process appears to set off a wound-healing reaction, and when people use cannabis, the cannabinoids bind to these receptors in the same way.[118]
Previous studies have shown that CB1 receptors located on the nerve cells in the gut respond to cannabinoids by slowing gut motility, therefore reducing the painful muscle contractions associated with diarrhea. CB2, another cannabinoid receptor predominantly expressed by immune cells, was detected in the gut of people with IBD at a higher concentration. These receptors, which also respond to chemicals in cannabis, appear to be associated with apoptosis – programmed cell death – and may have a role in suppressing the overactive immune system and reducing inflammation by mopping up excess cells.[118]
Activation of the endocannabinoid system was found efficient in ameliorating colitis and increasing the survival rate of mice, and reducing remote organ changes induced by colitis, further suggest that modulation of this system is a potential therapeutic approach for IBDs and the associated remote organ lesions.[119]
Alicaforsen is a first generation antisense oligodeoxynucleotide designed to bind specifically to the human ICAM-1 messenger RNA through Watson-Crick base pair interactions in order to subdue expression of ICAM-1.[120] ICAM-1 propagates an inflammatory response promoting the extravasation and activation of leukocytes (white blood cells) into inflamed tissue.[120] Increased expression of ICAM-1 has been observed within the inflamed intestinal mucosa of people with ulcerative colitis, pouchitis and Crohn’s, where ICAM-1 over production correlated with disease activity.[121] This suggests that ICAM-1 is a potential therapeutic target in the treatment of these diseases.[122][123]
Cannabinoid CB2 receptor agonists are found to decrease the induction of ICAM-1 and VCAM-1 surface expression in human brain tissues and primary human brain endothelial cells (BMVEC) exposed to various pro-inflammatory mediators.[124]
In 2014, an alliance among the Broad Institute, Amgen and Massachusetts General Hospital formed with the intention to «collect and analyze patient DNA samples to identify and further validate genetic targets.»[125]
In 2015, a meta-analysis on 938 IBD patients and 953 controls, IBD was significantly associated with having higher odds of vitamin D deficiency.[126]
Gram-positive bacteria present in the lumen could be associated with extending the time of relapse for ulcerative colitis.[127]
Bidirectional pathways between depression and IBD have been suggested [128] and psychological processes have been demonstrated to influence self-perceived physical and psychological health over time.[129] IBD-disease activity may impact quality of life and over time may significantly affect individual’s mental well-being, which may be related to the increased risk to develop anxiety and/or depression.[128][130][131] On the other hand, psychological distress may also influence IBD activity.[132]
Higher rates of anxiety and depression are observed among those with IBD compared to healthy individuals, which correlated with disease severity.[130][132] Moreover, anxiety and depression rates increase during active disease compared with inactive phases.[132]
In other Species[edit]
IBD also occurs in dogs and is thought to arise from a combination of host genetics, intestinal microenvironment, environmental components and the immune system. There is an ongoing discussion, however, that the term «chronic enteropathy» might be better to use than «inflammatory bowel disease» in dogs because it differs from IBD in humans in how the dogs respond to treatment. For example, many dogs respond to only dietary changes compared to humans with IBD, who often need immunosuppressive treatment. Some dogs may also need immunosuppressant or antibiotic treatment when dietary changes are not enough. After having excluded other diseases that can lead to vomiting, diarrhea, and abdominal pain in dogs, intestinal biopsies are often performed to investigate what kind of inflammation is occurring (lymphoplasmacytic, eosinophilic, or granulomatous). In dogs, low levels of cobalamin in the blood have been shown to be a risk factor for negative outcome.[133][134][135]
See also[edit]
- Inflammatory bowel disease-22
- World Inflammatory Bowel Disease Day
References[edit]
- ^ GBD 2015 Disease and Injury Incidence and Prevalence Collaborators (October 2016). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1545–1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ^ GBD 2015 Disease and Injury Incidence and Prevalence Collaborators (October 2016). «Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1459–1544. doi:10.1016/S0140-6736(16)31012-1. PMC 5388903. PMID 27733281.
- ^ Talley N (2018). Clinical examination: A systematic guide to physical diagnosis. Chatswood, N.S.W: Elsevier Australia. p. 227. ISBN 978-0-7295-4259-3. OCLC 988941211.
- ^ a b Baumgart DC, Carding SR (May 2007). «Inflammatory bowel disease: cause and immunobiology». Lancet. 369 (9573): 1627–40. doi:10.1016/S0140-6736(07)60750-8. PMID 17499605. S2CID 13544348.
- ^ a b Baumgart DC, Sandborn WJ (May 2007). «Inflammatory bowel disease: clinical aspects and established and evolving therapies». Lancet. 369 (9573): 1641–57. doi:10.1016/S0140-6736(07)60751-X. PMID 17499606. S2CID 35264387.
- ^ Xavier RJ, Podolsky DK (July 2007). «Unravelling the pathogenesis of inflammatory bowel disease». Nature. 448 (7152): 427–34. Bibcode:2007Natur.448..427X. doi:10.1038/nature06005. PMID 17653185. S2CID 4337332.
- ^ a b c d e f internetmedicin.se > Inflammatorisk tarmsjukdom, kronisk, IBD By Robert Löfberg. Retrieved Oct 2010 Translate.
- ^ Hanauer SB, Sandborn W (March 2001). «Management of Crohn’s disease in adults». The American Journal of Gastroenterology. 96 (3): 635–43. doi:10.1111/j.1572-0241.2001.3671_c.x (inactive 31 December 2022). PMID 11280528. S2CID 31219115.
{{cite journal}}: CS1 maint: DOI inactive as of December 2022 (link) - ^ Wang GF, Ren JA, Liu S, Chen J, Gu GS, Wang XB, et al. (July 2012). «Clinical characteristics of non-perianal fistulating Crohn’s disease in China: a single-center experience of 184 cases». Chinese Medical Journal. 125 (14): 2405–10. PMID 22882911.
- ^ Stein J, Hartmann F, Dignass AU (November 2010). «Diagnosis and management of iron deficiency anemia in patients with IBD». Nature Reviews. Gastroenterology & Hepatology. 7 (11): 599–610. doi:10.1038/nrgastro.2010.151. PMID 20924367. S2CID 25341683.
- ^ Liu S, Ren J, Zhao Y, Han G, Hong Z, Yan D, et al. (February 2013). «Nonthyroidal illness syndrome: is it far away from Crohn’s disease?». Journal of Clinical Gastroenterology. 47 (2): 153–9. doi:10.1097/MCG.0b013e318254ea8a. PMID 22874844. S2CID 35344744.
- ^ Warner J (February 22, 2011). Martin LJ (ed.). «Inflammatory Bowel Disease Health Center». WebMD. Retrieved 14 October 2014.
- ^ Lu DG, Ji XQ, Liu X, Li HJ, Zhang CQ (January 2014). «Pulmonary manifestations of Crohn’s disease». World Journal of Gastroenterology. 20 (1): 133–41. doi:10.3748/wjg.v20.i1.133. PMC 3886002. PMID 24415866.
- ^ Aydoğdu, Müge; Gürsel, Gül; Özyilmaz, Ezgi; Akyürek, Nalan; Memış, Leyla (2012). «A case of ulcerative colitis complicated with bronchiolitis obliterans organizing pneumonia (BOOP) and air leak syndrome». The Turkish Journal of Gastroenterology. 23 (5): 590–595. doi:10.4318/tjg.2012.0428. ISSN 2148-5607. PMID 23161307.
- ^ a b Rubin DT, Ananthakrishnan AN, Siegel CA, Sauer BG, Long MD (March 2019). «ACG Clinical Guideline: Ulcerative Colitis in Adults». The American Journal of Gastroenterology. 114 (3): 384–413. doi:10.14309/ajg.0000000000000152. PMID 30840605. S2CID 73473272.
- ^ a b c Hanauer SB, Sandborn W (March 2001). «Management of Crohn’s disease in adults». The American Journal of Gastroenterology. 96 (3): 635–43. doi:10.1111/j.1572-0241.2001.3671_c.x (inactive 31 December 2022). PMID 11280528. S2CID 31219115.
{{cite journal}}: CS1 maint: DOI inactive as of December 2022 (link) - ^ Broomé U, Bergquist A (February 2006). «Primary sclerosing cholangitis, inflammatory bowel disease, and colon cancer». Seminars in Liver Disease. 26 (1): 31–41. doi:10.1055/s-2006-933561. PMID 16496231.
- ^ Shepherd NA (August 2002). «Granulomas in the diagnosis of intestinal Crohn’s disease: a myth exploded?». Histopathology. 41 (2): 166–8. doi:10.1046/j.1365-2559.2002.01441.x. PMID 12147095. S2CID 36907992.
- ^ Mahadeva U, Martin JP, Patel NK, Price AB (July 2002). «Granulomatous ulcerative colitis: a re-appraisal of the mucosal granuloma in the distinction of Crohn’s disease from ulcerative colitis». Histopathology. 41 (1): 50–5. doi:10.1046/j.1365-2559.2002.01416.x. PMID 12121237. S2CID 29476514.
- ^ DeRoche TC, Xiao SY, Liu X (August 2014). «Histological evaluation in ulcerative colitis». Gastroenterology Report. 2 (3): 178–92. doi:10.1093/gastro/gou031. PMC 4124271. PMID 24942757.
- ^ Elson CO, Cong Y, Weaver CT, Schoeb TR, McClanahan TK, Fick RB, Kastelein RA (2007). «Monoclonal anti-interleukin 23 reverses active colitis in a T cell-mediated model in mice». Gastroenterology. 132 (7): 2359–70. doi:10.1053/j.gastro.2007.03.104. PMID 17570211.
- ^ Ananthakrishnan AN, Kaplan GG, Bernstein CN, Burke KE, Lochhead PJ, Sasson AN, Agrawal M, Tiong JHT, Steinberg J, Kruis W, Steinwurz F, Ahuja V, Ng SC, Rubin DT, Colombel JF, Gearry R; International Organization for Study of Inflammatory Bowel Diseases. Lifestyle, behaviour, and environmental modification for the management of patients with inflammatory bowel diseases: an International Organization for Study of Inflammatory Bowel Diseases consensus. Lancet Gastroenterol Hepatol. 2022 Apr 26:S2468-1253(22)00021-8.
- ^ Roncoroni L, Gori R, Elli L, Tontini GE, Doneda L, Norsa L, Cuomo M, Lombardo V, Scricciolo A, Caprioli F, Costantino A, Scaramella L, Vecchi M. Nutrition in Patients with Inflammatory Bowel Diseases: A Narrative Review. Nutrients. 2022 Feb 10;14(4):751.
- ^ Limketkai, Berkeley N.; Hamideh, Mohamed; Shah, Rishabh; Sauk, Jenny S.; Jaffe, Nancee (2022-01-29). «Dietary Patterns and Their Association With Symptoms Activity in Inflammatory Bowel Diseases». Inflammatory Bowel Diseases. 28 (11): 1627–1636. doi:10.1093/ibd/izab335. ISSN 1536-4844. PMID 35092268.
- ^ Rashvand S, Behrooz M, Samsamikor M, Jacobson K, Hekmatdoost A (June 2018). «Dietary patterns and risk of ulcerative colitis: a case-control study». Journal of Human Nutrition and Dietetics. 31 (3): 408–412. doi:10.1111/jhn.12544. PMID 29468761. S2CID 3452004.
- ^ Limketkai BN, Sepulveda R, Hing T, Shah ND, Choe M, Limsui D, Shah S (February 2018). «Prevalence and factors associated with gluten sensitivity in inflammatory bowel disease». Scandinavian Journal of Gastroenterology. 53 (2): 147–151. doi:10.1080/00365521.2017.1409364. PMID 29216767. S2CID 4119392.
- ^ Andersen V, Olsen A, Carbonnel F, Tjønneland A, Vogel U (March 2012). «Diet and risk of inflammatory bowel disease». Digestive and Liver Disease. 44 (3): 185–94. doi:10.1016/j.dld.2011.10.001. PMID 22055893.
- ^ Barron M (2021-01-11). «Sugar may trigger inflammatory bowel disease by breaking down gut mucus». Massive Science. Retrieved 2021-01-15.
{{cite web}}: CS1 maint: url-status (link) - ^ a b Thomas JP, Modos D, Rushbrook SM, Powell N, Korcsmaros T. The Emerging Role of Bile Acids in the Pathogenesis of Inflammatory Bowel Disease. Front Immunol. 2022 Feb 3;13:829525. doi: 10.3389/fimmu.2022.829525. PMID: 35185922; PMCID: PMC8850271
- ^ Mukhopadhya I, Hansen R, El-Omar EM, Hold GL (February 2012). «IBD-what role do Proteobacteria play?». Nature Reviews. Gastroenterology & Hepatology. 9 (4): 219–30. doi:10.1038/nrgastro.2012.14. PMID 22349170. S2CID 24538712.
- ^ Aroniadis OC, Brandt LJ (January 2013). «Fecal microbiota transplantation: past, present and future». Current Opinion in Gastroenterology. 29 (1): 79–84. doi:10.1097/MOG.0b013e32835a4b3e. PMID 23041678. S2CID 39943619.
- ^ Kotanko P, Carter M, Levin NW (August 2006). «Intestinal bacterial microflora—a potential source of chronic inflammation in patients with chronic kidney disease». Nephrology, Dialysis, Transplantation. 21 (8): 2057–60. doi:10.1093/ndt/gfl281. PMID 16762961.
- ^ Ryan, F. J.; Ahern, A. M.; Fitzgerald, R. S.; Laserna-Mendieta, E. J.; Power, E. M.; Clooney, A. G.; O’Donoghue, K. W.; McMurdie, P. J.; Iwai, S.; Crits-Christoph, A.; Sheehan, D. (2020-03-23). «Colonic microbiota is associated with inflammation and host epigenomic alterations in inflammatory bowel disease». Nature Communications. 11 (1): 1512. Bibcode:2020NatCo..11.1512R. doi:10.1038/s41467-020-15342-5. ISSN 2041-1723. PMC 7089947. PMID 32251296.
- ^ Clooney, Adam G.; Eckenberger, Julia; Laserna-Mendieta, Emilio; Sexton, Kathryn A.; Bernstein, Matthew T.; Vagianos, Kathy; Sargent, Michael; Ryan, Feargal J.; Moran, Carthage; Sheehan, Donal; Sleator, Roy D. (March 2021). «Ranking microbiome variance in inflammatory bowel disease: a large longitudinal intercontinental study». Gut. 70 (3): 499–510. doi:10.1136/gutjnl-2020-321106. ISSN 1468-3288. PMC 7873428. PMID 32536605.
- ^ Maloy KJ, Powrie F (June 2011). «Intestinal homeostasis and its breakdown in inflammatory bowel disease». Nature. 474 (7351): 298–306. doi:10.1038/nature10208. PMID 21677746. S2CID 205225483. Archived from the original on 2019-10-29. Retrieved 2019-10-29.
- ^ Cario E (September 2010). «Toll-like receptors in inflammatory bowel diseases: a decade later». Inflammatory Bowel Diseases. 16 (9): 1583–97. doi:10.1002/ibd.21282. PMC 2958454. PMID 20803699.
- ^ Coskun M (2014-08-25). «Intestinal epithelium in inflammatory bowel disease». Frontiers in Medicine. 1: 24. doi:10.3389/fmed.2014.00024. PMC 4292184. PMID 25593900.
- ^ a b Pereira, Cristiana; Grácio, Daniela; Teixeira, João P.; Magro, Fernando (October 2015). «Oxidative Stress and DNA Damage: Implications in Inflammatory Bowel Disease». Inflammatory Bowel Diseases. 21 (10): 2403–2417. doi:10.1097/MIB.0000000000000506. PMID 26193347. S2CID 8068289.
- ^ Ek WE, D’Amato M, Halfvarson J (2014). «The history of genetics in inflammatory bowel disease». Annals of Gastroenterology. 27 (4): 294–303. PMC 4188925. PMID 25331623.
- ^ a b Liu TC, Stappenbeck TS (May 2016). «Genetics and Pathogenesis of Inflammatory Bowel Disease». Annual Review of Pathology. 11: 127–48. doi:10.1146/annurev-pathol-012615-044152. PMC 3204665. PMID 26907531.
- ^ Ye BD, McGovern DP (October 2016). «Genetic variation in IBD: progress, clues to pathogenesis and possible clinical utility». Expert Review of Clinical Immunology. 12 (10): 1091–107. doi:10.1080/1744666X.2016.1184972. PMC 5083126. PMID 27156530.
- ^ Jostins L, Ripke S, Weersma RK, Duerr RH, McGovern DP, Hui KY, et al. (November 2012). «Host-microbe interactions have shaped the genetic architecture of inflammatory bowel disease». Nature. 491 (7422): 119–24. Bibcode:2012Natur.491..119.. doi:10.1038/nature11582. PMC 3491803. PMID 23128233.
- ^ Chu H, Khosravi A, Kusumawardhani IP, Kwon AH, Vasconcelos AC, Cunha LD, et al. (May 2016). «Gene-microbiota interactions contribute to the pathogenesis of inflammatory bowel disease». Science. 352 (6289): 1116–20. Bibcode:2016Sci…352.1116C. doi:10.1126/science.aad9948. PMC 4996125. PMID 27230380.
- ^ Bocchetti M, Ferraro MG, Ricciardiello F, Ottaiano A, Luce A, Cossu AM, et al. (April 2021). «The Role of microRNAs in Development of Colitis-Associated Colorectal Cancer». International Journal of Molecular Sciences. 22 (8): 3967. doi:10.3390/ijms22083967. PMC 8068787. PMID 33921348.
- ^ Staff (1 July 2020). «Celsius Therapeutics Teams With Oxford, Cleveland Clinic, LMU on Single-Cell IBD Research». genomeweb. New York City: Crain Communications. Retrieved 1 July 2020.
- ^ Henderson P, Anderson NH, Wilson DC (May 2014). «The diagnostic accuracy of fecal calprotectin during the investigation of suspected pediatric inflammatory bowel disease: a systematic review and meta-analysis». The American Journal of Gastroenterology. 109 (5): 637–45. doi:10.1038/ajg.2013.131. PMID 23670113. S2CID 30604736.
- ^ Waugh N, Cummins E, Royle P, Kandala NB, Shyangdan D, Arasaradnam R, et al. (November 2013). «Faecal calprotectin testing for differentiating amongst inflammatory and non-inflammatory bowel diseases: systematic review and economic evaluation». Health Technology Assessment. 17 (55): xv–xix, 1–211. doi:10.3310/hta17550. PMC 4781415. PMID 24286461.
- ^ Vaos G, Kostakis ID, Zavras N, Chatzemichael A (2013). «The role of calprotectin in pediatric disease». BioMed Research International (Review). 2013: 542363. doi:10.1155/2013/542363. PMC 3794633. PMID 24175291.
- ^ a b «Inflammatory Bowel Disease» (PDF). World Gastroenterology Organization. August 2015. Retrieved Mar 13, 2016.
- ^ a b Cappello M, Randazzo C, Bravatà I, Licata A, Peralta S, Craxì A, Almasio PL (2014). «Liver Function Test Abnormalities in Patients with Inflammatory Bowel Diseases: A Hospital-based Survey». Clinical Medicine Insights. Gastroenterology. 7: 25–31. doi:10.4137/CGast.S13125. PMC 4069044. PMID 24966712.
- ^ «IBD Facts». Archived from the original on 2013-02-12. Retrieved 2013-02-13.
- ^ Levine, Jonathan S.; Burakoff, Robert (2011). «Extraintestinal Manifestations of Inflammatory Bowel Disease». Gastroenterology & Hepatology. 7 (4): 235–241. ISSN 1554-7914. PMC 3127025. PMID 21857821.
- ^ Glocker EO, Kotlarz D, Boztug K, Gertz EM, Schäffer AA, Noyan F, et al. (November 2009). «Inflammatory bowel disease and mutations affecting the interleukin-10 receptor». The New England Journal of Medicine. 361 (21): 2033–2045. doi:10.1056/NEJMoa0907206. PMC 2787406. PMID 19890111.
- ^ Bennike, Tue; Birkelund, Svend; Stensballe, Allan; Andersen, Vibeke (2014-03-28). «Biomarkers in inflammatory bowel diseases: Current status and proteomics identification strategies». World Journal of Gastroenterology. 20 (12): 3231–3244. doi:10.3748/wjg.v20.i12.3231. ISSN 1007-9327. PMC 3964395. PMID 24696607.
- ^ «Crohn’s & Colitis Foundation of America».
- ^ Yamamoto-Furusho, J. K.; Bosques-Padilla, F.; de-Paula, J.; Galiano, M. T.; Ibañez, P.; Juliao, F.; Kotze, P. G.; Rocha, J. L.; Steinwurz, F.; Veitia, G.; Zaltman, C. (2017-01-01). «Diagnosis and treatment of inflammatory bowel disease: First Latin American Consensus of the Pan American Crohn’s and Colitis Organisation». Revista de Gastroenterología de México (English Edition). 82 (1): 46–84. doi:10.1016/j.rgmxen.2016.07.003. ISSN 2255-534X. PMID 27979414.
- ^ Guindi M, Riddell RH (December 2004). «Indeterminate colitis». Journal of Clinical Pathology. 57 (12): 1233–44. doi:10.1136/jcp.2003.015214. PMC 1770507. PMID 15563659.
- ^ Guindi, M; Riddell, R H (2004). «Indeterminate colitis». Journal of Clinical Pathology. 57 (12): 1233–1244. doi:10.1136/jcp.2003.015214. ISSN 0021-9746. PMC 1770507. PMID 15563659.
- ^ a b c Agabegi ED, Agabegi SS (2008). «Inflammatory bowel disease (IBD)». Step-Up to Medicine (Step-Up Series). Hagerstwon, MD: Lippincott Williams & Wilkins. pp. 152–156. ISBN 0-7817-7153-6.
- ^ Feller M, Huwiler K, Schoepfer A, Shang A, Furrer H, Egger M (February 2010). «Long-term antibiotic treatment for Crohn’s disease: systematic review and meta-analysis of placebo-controlled trials». Clinical Infectious Diseases. 50 (4): 473–80. doi:10.1086/649923. PMID 20067425.
- ^ Prantera C, Scribano ML (July 2009). «Antibiotics and probiotics in inflammatory bowel disease: why, when, and how». Current Opinion in Gastroenterology. 25 (4): 329–33. doi:10.1097/MOG.0b013e32832b20bf. PMID 19444096.
- ^ a b c Mowat C, Cole A, Windsor A, Ahmad T, Arnott I, Driscoll R, et al. (May 2011). «Guidelines for the management of inflammatory bowel disease in adults». Gut. 60 (5): 571–607. doi:10.1136/gut.2010.224154. PMID 21464096. S2CID 8269837.
- ^ «Pouchitis: Symptoms & Causes». Mayo Clinic. 21 December 2018.
- ^ Karimuddin A, Gilles G. «Surgery for Abdominal/Intestinal Crohn’s Disease». Trusted Therapies. Trusted Therapies. Retrieved 19 May 2015.
- ^ «Inflammatory Bowel Disease». Mayo Clinic. Retrieved November 18, 2022.
- ^ DiLauro, Steven; Crum-Cianflone, Nancy F. (2010). «Ileitis: When It Is Not Crohn’s Disease». Current Gastroenterology Reports. 12 (4): 249–258. doi:10.1007/s11894-010-0112-5. ISSN 1522-8037. PMC 2914216. PMID 20532706.
- ^ Cohen, Benjamin L.; Torres, Joana; déric Colombel, Jean-Fré (2012). «Immunosuppression in inflammatory bowel disease: how much is too much?». Current Opinion in Gastroenterology. 28 (4): 341–348. doi:10.1097/MOG.0b013e328354567f. ISSN 0267-1379. PMC 6681654. PMID 22573191.
- ^ D’Haens GR, Panaccione R, Higgins PD, Vermeire S, Gassull M, Chowers Y, et al. (February 2011). «The London Position Statement of the World Congress of Gastroenterology on Biological Therapy for IBD with the European Crohn’s and Colitis Organization: when to start, when to stop, which drug to choose, and how to predict response?». The American Journal of Gastroenterology. 106 (2): 199–212, quiz 213. doi:10.1038/ajg.2010.392. PMID 21045814. S2CID 24401720.
- ^ a b Forbes A, Escher J, Hébuterne X, Kłęk S, Krznaric Z, Schneider S, et al. (April 2017). «ESPEN guideline: Clinical nutrition in inflammatory bowel disease». Clinical Nutrition. 36 (2): 321–347. doi:10.1016/j.clnu.2016.12.027. PMID 28131521.
- ^ Ashton JJ, Gavin J, Beattie RM (February 2019). «Exclusive enteral nutrition in Crohn’s disease: Evidence and practicalities». Clinical Nutrition. 38 (1): 80–89. doi:10.1016/j.clnu.2018.01.020. PMID 29398336. S2CID 25135919.
- ^ Charlebois A, Rosenfeld G, Bressler B (June 2016). «The Impact of Dietary Interventions on the Symptoms of Inflammatory Bowel Disease: A Systematic Review». Critical Reviews in Food Science and Nutrition. 56 (8): 1370–8. doi:10.1080/10408398.2012.760515. PMID 25569442. S2CID 267557.
- ^ Wong C, Harris PJ, Ferguson LR (June 2016). «Potential Benefits of Dietary Fibre Intervention in Inflammatory Bowel Disease». International Journal of Molecular Sciences. 17 (6): 919. doi:10.3390/ijms17060919. PMC 4926452. PMID 27314323.
- ^ Pagani A, Nai A, Corna G, Bosurgi L, Rovere-Querini P, Camaschella C, Silvestri L (July 2011). «Low hepcidin accounts for the proinflammatory status associated with iron deficiency». Blood. 118 (3): 736–46. doi:10.1182/blood-2011-02-337212. PMID 21628413. S2CID 27452694.
- ^ Liu S, Ren J, Hong Z, Yan D, Gu G, Han G, et al. (February 2013). «Efficacy of erythropoietin combined with enteral nutrition for the treatment of anemia in Crohn’s disease: a prospective cohort study». Nutrition in Clinical Practice. 28 (1): 120–7. doi:10.1177/0884533612462744. PMID 23064018.
- ^ Hébuterne, Xavier; Vanbiervliet, Geoffroy (2011). «Feeding the patients with upper gastrointestinal bleeding». Current Opinion in Clinical Nutrition and Metabolic Care. 14 (2): 197–201. doi:10.1097/MCO.0b013e3283436dc5. ISSN 1363-1950. PMID 21252654. S2CID 39937720.
- ^ Luo, Shuang-Hong; Guo, Qin; Liu, Guan J; Wan, Chaomin (2016-05-19). Cochrane Gut Group (ed.). «Fasting for haemostasis in children with gastrointestinal bleeding». Cochrane Database of Systematic Reviews. 2021 (7): CD010714. doi:10.1002/14651858.CD010714.pub2. PMC 7066502. PMID 27197069.
- ^ Lopetuso LR, Napoli M, Rizzatti G, Gasbarrini A (June 2018). «The intriguing role of Rifaximin in gut barrier chronic inflammation and in the treatment of Crohn’s disease». Expert Opinion on Investigational Drugs. 27 (6): 543–551. doi:10.1080/13543784.2018.1483333. PMID 29865875. S2CID 46928303.
- ^ Scribano ML (2015). «Role of Rifaximin in Inflammatory Bowel Disease Treatment». Mini Reviews in Medicinal Chemistry. 16 (3): 225–9. doi:10.2174/1389557515666150722104230. PMID 26202194.
- ^ Sartor RB (January 2016). «Review article: the potential mechanisms of action of rifaximin in the management of inflammatory bowel diseases». Alimentary Pharmacology & Therapeutics. 43 (Suppl 1): 27–36. doi:10.1111/apt.13436. PMID 26618923. S2CID 26119818.
- ^ Limketkai, Berkeley N; Akobeng, Anthony K; Gordon, Morris; Adepoju, Akinlolu Adedayo (2020-07-17). Cochrane Gut Group (ed.). «Probiotics for induction of remission in Crohn’s disease». Cochrane Database of Systematic Reviews. 2020 (7): CD006634. doi:10.1002/14651858.CD006634.pub3. PMC 7389339. PMID 32678465.
- ^ a b c Kaur, Lakhbir; Gordon, Morris; Baines, Patricia Anne; Iheozor-Ejiofor, Zipporah; Sinopoulou, Vasiliki; Akobeng, Anthony K (2020-03-04). Cochrane IBD Group (ed.). «Probiotics for induction of remission in ulcerative colitis». Cochrane Database of Systematic Reviews. 3 (3): CD005573. doi:10.1002/14651858.CD005573.pub3. PMC 7059959. PMID 32128795.
- ^ Iheozor-Ejiofor, Zipporah; Kaur, Lakhbir; Gordon, Morris; Baines, Patricia Anne; Sinopoulou, Vasiliki; Akobeng, Anthony K (2020-03-04). Cochrane IBD Group (ed.). «Probiotics for maintenance of remission in ulcerative colitis». Cochrane Database of Systematic Reviews. 3 (3): CD007443. doi:10.1002/14651858.CD007443.pub3. PMC 7059960. PMID 32128794.
- ^ Sunkara T, Rawla P, Ofosu A, Gaduputi V (2018). «Fecal microbiota transplant — a new frontier in inflammatory bowel disease». Journal of Inflammation Research. 11: 321–328. doi:10.2147/JIR.S176190. PMC 6124474. PMID 30214266.
- ^ a b Colman RJ, Rubin DT (December 2014). «Fecal microbiota transplantation as therapy for inflammatory bowel disease: a systematic review and meta-analysis». Journal of Crohn’s & Colitis. 8 (12): 1569–81. doi:10.1016/j.crohns.2014.08.006. PMC 4296742. PMID 25223604.
- ^ Gilardi D, Fiorino G, Genua M, Allocca M, Danese S (September 2014). «Complementary and alternative medicine in inflammatory bowel diseases: what is the future in the field of herbal medicine?». Expert Review of Gastroenterology & Hepatology. 8 (7): 835–46. doi:10.1586/17474124.2014.917954. PMID 24813226. S2CID 207205293.
- ^ Langhorst J, Wulfert H, Lauche R, Klose P, Cramer H, Dobos GJ, Korzenik J (January 2015). «Systematic review of complementary and alternative medicine treatments in inflammatory bowel diseases». Journal of Crohn’s & Colitis. 9 (1): 86–106. doi:10.1093/ecco-jcc/jju007. PMID 25518050.
- ^ Dave M, Mehta K, Luther J, Baruah A, Dietz AB, Faubion WA (November 2015). «Mesenchymal Stem Cell Therapy for Inflammatory Bowel Disease: A Systematic Review and Meta-analysis». Inflammatory Bowel Diseases. 21 (11): 2696–707. doi:10.1097/MIB.0000000000000543. PMC 4615553. PMID 26230863.
- ^ a b c d Timmer, Antje; Preiss, Jan C; Motschall, Edith; Rücker, Gerta; Jantschek, Günther; Moser, Gabriele (2011-02-15). Cochrane IBD Group (ed.). «Psychological interventions for treatment of inflammatory bowel disease». Cochrane Database of Systematic Reviews (2): CD006913. doi:10.1002/14651858.CD006913.pub2. PMID 21328288.
- ^ Massuger, Wayne; Moore, Gregory T. C.; et al. (2019). «Crohn’s & Colitis Australia inflammatory bowel disease audit: measuring the quality of care in Australia» (PDF). Internal Medicine Journal. Wiley. 49 (7): 859–866. doi:10.1111/imj.14187. hdl:11343/286098. ISSN 1444-0903. PMID 30525299. S2CID 54564573.
- ^ Greenstein AJ, Janowitz HD, Sachar DB (September 1976). «The extra-intestinal complications of Crohn’s disease and ulcerative colitis: a study of 700 patients». Medicine. 55 (5): 401–412. doi:10.1097/00005792-197609000-00004. PMID 957999.
- ^ Bernstein CN, Blanchard JF, Rawsthorne P, Yu N (April 2001). «The prevalence of extraintestinal diseases in inflammatory bowel disease: a population-based study». The American Journal of Gastroenterology. 96 (4): 1116–1122. doi:10.1111/j.1572-0241.2001.03756.x. PMID 11316157.
- ^ Harbord M, Annese V, Vavricka SR, Allez M, Barreiro-de Acosta M, Boberg KM, et al. (March 2016). «The First European Evidence-based Consensus on Extra-intestinal Manifestations in Inflammatory Bowel Disease». Journal of Crohn’s & Colitis. 10 (3): 239–254. doi:10.1093/ecco-jcc/jjv213. PMID 26614685.
- ^ Greenstein, A. J.; Aufses, A. H. (1985). «Differences in pathogenesis, incidence and outcome of perforation in inflammatory bowel disease». Surgery, Gynecology & Obstetrics. 160 (1): 63–69. ISSN 0039-6087. PMID 3871126.
- ^ Farrell D, Artom M, Czuber-Dochan W, Jelsness-Jørgensen LP, Norton C, Savage E (April 2020). «Interventions for fatigue in inflammatory bowel disease». The Cochrane Database of Systematic Reviews. 2020 (4): CD012005. doi:10.1002/14651858.CD012005.pub2. PMC 7161727. PMID 32297974.
- ^ Halpin SJ, Ford AC (October 2012). «Prevalence of symptoms meeting criteria for irritable bowel syndrome in inflammatory bowel disease: systematic review and meta-analysis». The American Journal of Gastroenterology. 107 (10): 1474–82. doi:10.1038/ajg.2012.260. PMID 22929759. S2CID 11007309.
- ^ Gracie DJ, Williams CJ, Sood R, Mumtaz S, Bholah MH, Hamlin PJ, Ford AC (March 2017). «Negative Effects on Psychological Health and Quality of Life of Genuine Irritable Bowel Syndrome-type Symptoms in Patients With Inflammatory Bowel Disease». Clinical Gastroenterology and Hepatology. 15 (3): 376–384.e5. doi:10.1016/j.cgh.2016.05.012. PMID 27189912.
- ^ Abdul Rani R, Raja Ali RA, Lee YY (October 2016). «Irritable bowel syndrome and inflammatory bowel disease overlap syndrome: pieces of the puzzle are falling into place». Intestinal Research. 14 (4): 297–304. doi:10.5217/ir.2016.14.4.297. PMC 5083258. PMID 27799880.
- ^ Guagnozzi, Danila; Lucendo, Alfredo J (2012-04-16). «Colorectal cancer surveillance in patients with inflammatory bowel disease: What is new?». World Journal of Gastrointestinal Endoscopy. 4 (4): 108–116. doi:10.4253/wjge.v4.i4.108. ISSN 1948-5190. PMC 3329610. PMID 22523611.
- ^ Gandhi S, Narula N, Marshall JK, Farkouh M (October 2012). «Are patients with inflammatory bowel disease at increased risk of coronary artery disease?». The American Journal of Medicine. 125 (10): 956–62. doi:10.1016/j.amjmed.2012.03.015. PMID 22840916.
- ^ Roifman I, Sun YC, Fedwick JP, Panaccione R, Buret AG, Liu H, et al. (February 2009). «Evidence of endothelial dysfunction in patients with inflammatory bowel disease». Clinical Gastroenterology and Hepatology. 7 (2): 175–82. doi:10.1016/j.cgh.2008.10.021. PMID 19121648.
- ^ «Inflammatory bowel disease». nhs.uk. 2017-10-18. Retrieved 2022-11-29.
- ^ Kemp K, Griffiths J, Lovell K. Understanding the health and social care needs ofpeople living with IBD: a meta-synthesis of the evidence. World J Gastroenterol2012;18:6240–9.
- ^ Borghi L., Poli S., Furfaro F., Allocca M., Vegni E.A.M. Psychological Challenges for Patients with Inflammatory Bowel Disease during the COVID-19 Pandemic. Psychosom. Med.. 2021;83(4):397-398. doi:10.1097/PSY.0000000000000888
- ^ GBD 2013 Mortality Causes of Death Collaborators (January 2015). «Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013». Lancet. 385 (9963): 117–71. doi:10.1016/S0140-6736(14)61682-2. PMC 4340604. PMID 25530442.
- ^ Jantchou P, Morois S, Clavel-Chapelon F, Boutron-Ruault MC, Carbonnel F (October 2010). «Animal protein intake and risk of inflammatory bowel disease: The E3N prospective study». The American Journal of Gastroenterology. 105 (10): 2195–201. doi:10.1038/ajg.2010.192. PMID 20461067. S2CID 13160121.
- ^ Kaplan GG, Bernstein CN, Coward S, Bitton A, Murthy SK, Nguyen GC, Lee K, Cooke-Lauder J, Benchimol EI (November 2018). «The Impact of Inflammatory Bowel Disease in Canada 2018: Epidemiology». Journal of the Canadian Association of Gastroenterology. 2 (Suppl 1): S6–S16. doi:10.1093/jcag/gwy054. PMC 6512243. PMID 31294381.
- ^ Burisch J, Jess T, Martinato M, Lakatos PL (May 2013). «The burden of inflammatory bowel disease in Europe». Journal of Crohn’s & Colitis. 7 (4): 322–37. doi:10.1016/j.crohns.2013.01.010. PMID 23395397.
- ^ Park J, Cheon JH (February 2021). «Incidence and Prevalence of Inflammatory Bowel Disease across Asia». Yonsei Medical Journal. 62 (2): 99–108. doi:10.3349/ymj.2021.62.2.99. PMC 7859683. PMID 33527789.
- ^ British Society of Gastroenterology https://www.bsg.org.uk/covid-19-advice/bsg-advice-for-management-of-inflammatory-bowel-diseases-during-the-covid-19-pandemic/
- ^ Crohn’s and Colitis Canada 2018 Impact of IBD in Canada Report. https://crohnsandcolitis.ca/About-Us/Resources-Publications/Impact-of-IBD-Report/
- ^ Coward S, Clement F, Benchimol EI, Bernstein CN, Avina-Zubieta JA, Bitton A, Carroll MW, Hazlewood G, Jacobson K, Jelinski S, Deardon R, Jones JL, Kuenzig ME, Leddin D, McBrien KA, Murthy SK, Nguyen GC, Otley AR, Panaccione R, Rezaie A, Rosenfeld G, Peña-Sánchez JN, Singh H, Targownik LE, Kaplan GG (May 2019). «Past and Future Burden of Inflammatory Bowel Diseases Based on Modeling of Population-Based Data». Gastroenterology. 156 (5): 1345–1353.e4. doi:10.1053/j.gastro.2019.01.002. PMID 30639677.
- ^ Summers RW, Elliott DE, Qadir K, Urban JF, Thompson R, Weinstock JV (September 2003). «Trichuris suis seems to be safe and possibly effective in the treatment of inflammatory bowel disease». The American Journal of Gastroenterology. 98 (9): 2034–41. CiteSeerX 10.1.1.457.8633. doi:10.1111/j.1572-0241.2003.07660.x. PMID 14499784. S2CID 2605979.
- ^ Weinstock, Joel V; Elliott, David E. (2013). «Translatability of helminth therapy in inflammatory bowel diseases». International Journal for Parasitology. 43 (3–4): 245–251. doi:10.1016/j.ijpara.2012.10.016. ISSN 0020-7519. PMC 3683647. PMID 23178819.
- ^ Tursi, A.; Brandimarte, G.; Papa, A.; Giglio, A.; Elisei, W.; Giorgetti, G. M.; Forti, G.; Morini, S.; Hassan, C.; Pistoia, M. A.; Modeo, M. E.; Rodino’, S.; d’Amico, T.; Sebkova, L.; Sacca’, N.; Di Giulio, E.; Luzza, F.; Imeneo, M.; Larussa, T.; Di Rosa, S.; Annese, V.; Danese, S.; Gasbarrini, A. (2010). «Treatment of Relapsing Mild-to-Moderate Ulcerative Colitis with the Probiotic VSL#3 as Adjunctive to a Standard Pharmaceutical Treatment: A Double-Blind, Randomized, Placebo-Controlled Study». The American Journal of Gastroenterology. 105 (10): 2218–2227. doi:10.1038/ajg.2010.218. PMC 3180711. PMID 20517305.
- ^ Ghouri YA, Richards DM, Rahimi EF, Krill JT, Jelinek KA, DuPont AW (Dec 9, 2014). «Systematic review of randomized controlled trials of probiotics, prebiotics, and synbiotics in inflammatory bowel disease». Clinical and Experimental Gastroenterology (Review). 7: 473–87. doi:10.2147/CEG.S27530. PMC 4266241. PMID 25525379.
- ^ a b c Durchschein F, Petritsch W, Hammer HF (February 2016). «Diet therapy for inflammatory bowel diseases: The established and the new». World Journal of Gastroenterology (Review). 22 (7): 2179–94. doi:10.3748/wjg.v22.i7.2179. PMC 4734995. PMID 26900283.
- ^ Dotan I, Rachmilewitz D (July 2005). «Probiotics in inflammatory bowel disease: possible mechanisms of action». Current Opinion in Gastroenterology (Review). 21 (4): 426–30. PMID 15930982.
- ^ a b c Wright K, Rooney N, Feeney M, Tate J, Robertson D, Welham M, Ward S (August 2005). «Differential expression of cannabinoid receptors in the human colon: cannabinoids promote epithelial wound healing». Gastroenterology. 129 (2): 437–53. doi:10.1053/j.gastro.2005.05.026. PMID 16083701.
- ^ Zhao X, Liang P, Liu J, Jiang H, Fan X, Chen G, Zhou C (December 2017). «Elevation of arachidonoylethanolamide levels by activation of the endocannabinoid system protects against colitis and ameliorates remote organ lesions in mice». Experimental and Therapeutic Medicine. 14 (6): 5664–5670. doi:10.3892/etm.2017.5222. PMC 5740744. PMID 29285108.
- ^ a b Bennett CF, Condon TP, Grimm S, Chan H, Chiang MY (April 1994). «Inhibition of endothelial cell adhesion molecule expression with antisense oligonucleotides». Journal of Immunology. 152 (7): 3530–40. doi:10.4049/jimmunol.152.7.3530. PMID 7511650. S2CID 34563008.
- ^ Jones SC, Banks RE, Haidar A, Gearing AJ, Hemingway IK, Ibbotson SH, et al. (May 1995). «Adhesion molecules in inflammatory bowel disease». Gut. 36 (5): 724–30. doi:10.1136/gut.36.5.724. PMC 1382677. PMID 7541009.
- ^ van Deventer SJ, Wedel MK, Baker BF, Xia S, Chuang E, Miner PB (May 2006). «A phase II dose ranging, double-blind, placebo-controlled study of alicaforsen enema in subjects with acute exacerbation of mild to moderate left-sided ulcerative colitis». Alimentary Pharmacology & Therapeutics. 23 (10): 1415–25. doi:10.1111/j.1365-2036.2006.02910.x. PMID 16669956. S2CID 31495688.
- ^ Thomas S, Baumgart DC (February 2012). «Targeting leukocyte migration and adhesion in Crohn’s disease and ulcerative colitis». Inflammopharmacology. 20 (1): 1–18. doi:10.1007/s10787-011-0104-6. PMID 22205271. S2CID 11663330.
- ^ Ramirez SH, Haskó J, Skuba A, Fan S, Dykstra H, McCormick R, et al. (March 2012). «Activation of cannabinoid receptor 2 attenuates leukocyte-endothelial cell interactions and blood-brain barrier dysfunction under inflammatory conditions». The Journal of Neuroscience. 32 (12): 4004–16. doi:10.1523/JNEUROSCI.4628-11.2012. PMC 3325902. PMID 22442067.
- ^ «Amgen, MGH, Broad form IBD Therapeutics Initiative». News: Discovery & Development. Gen. Eng. Biotechnol. News (paper). Vol. 34, no. 4. p. 14.
- ^ Del Pinto R, Pietropaoli D, Chandar AK, Ferri C, Cominelli F (November 2015). «Association Between Inflammatory Bowel Disease and Vitamin D Deficiency: A Systematic Review and Meta-analysis». Inflammatory Bowel Diseases. 21 (11): 2708–17. doi:10.1097/MIB.0000000000000546. PMC 4615394. PMID 26348447.
- ^ Ghouri YA, Richards DM, Rahimi EF, Krill JT, Jelinek KA, DuPont AW (9 December 2014). «Systematic review of randomized controlled trials of probiotics, prebiotics, and synbiotics in inflammatory bowel disease». Clinical and Experimental Gastroenterology. 7: 473–87. doi:10.2147/CEG.S27530. PMC 4266241. PMID 25525379.
- ^ a b Keefer L, Kane SV (2017). «Considering the Bidirectional Pathways Between Depression and IBD: Recommendations for Comprehensive IBD Care». Gastroenterology & Hepatology. 13 (3): 164–169. PMC 5439135. PMID 28539843.
- ^ Trindade IA, Ferreira C, Pinto-Gouveia J (February 2018). «The longitudinal effects of emotion regulation on physical and psychological health: A latent growth analysis exploring the role of cognitive fusion in inflammatory bowel disease». British Journal of Health Psychology. 23 (1): 171–185. doi:10.1111/bjhp.12280. hdl:10316/46833. PMID 28980414. S2CID 3375968.
- ^ a b Gao, Xin; Tang, Yu; Lei, Na; Luo, Ying; Chen, Pingrun; Liang, Chang; Duan, Shihao; Zhang, Yan (2021-01-14). «Symptoms of anxiety/depression is associated with more aggressive inflammatory bowel disease». Scientific Reports. 11 (1): 1440. Bibcode:2021NatSR..11.1440G. doi:10.1038/s41598-021-81213-8. ISSN 2045-2322. PMC 7809475. PMID 33446900.
- ^ Choi, Kookhwan; Chun, Jaeyoung; Han, Kyungdo; Park, Seona; Soh, Hosim; Kim, Jihye; Lee, Jooyoung; Lee, Hyun Jung; Im, Jong Pil; Kim, Joo Sung (2019-05-10). «Risk of Anxiety and Depression in Patients with Inflammatory Bowel Disease: A Nationwide, Population-Based Study». Journal of Clinical Medicine. 8 (5): 654. doi:10.3390/jcm8050654. ISSN 2077-0383. PMC 6572298. PMID 31083476.
- ^ a b c Mikocka-Walus, Antonina; Knowles, Simon R.; Keefer, Laurie; Graff, Lesley (March 2016). «Controversies Revisited: A Systematic Review of the Comorbidity of Depression and Anxiety with Inflammatory Bowel Diseases». Inflammatory Bowel Diseases. 22 (3): 752–762. doi:10.1097/MIB.0000000000000620. ISSN 1536-4844. PMID 26841224. S2CID 6315815.
- ^ Dandrieux JR (November 2016). «Inflammatory bowel disease versus chronic enteropathy in dogs: are they one and the same?». The Journal of Small Animal Practice. 57 (11): 589–599. doi:10.1111/jsap.12588. hdl:11343/291847. PMID 27747868.
- ^ Allenspach K, Wieland B, Gröne A, Gaschen F (July 2007). «Chronic enteropathies in dogs: evaluation of risk factors for negative outcome». Journal of Veterinary Internal Medicine. 21 (4): 700–8. doi:10.1111/j.1939-1676.2007.tb03011.x. PMID 17708389.
- ^ Simpson KW, Jergens AE (March 2011). «Pitfalls and progress in the diagnosis and management of canine inflammatory bowel disease». The Veterinary Clinics of North America. Small Animal Practice. Chronic Intestinal Diseases of Dogs and Cats. 41 (2): 381–98. doi:10.1016/j.cvsm.2011.02.003. PMID 21486642.
External links[edit]
- Inflammatory bowel disease at Curlie
Определение болезни
Колит — это острое или хроническое воспаление слизистой оболочки толстого кишечника.
Острая форма болезни через некоторое время проходит. Хроническая до конца не излечивается, протекает с периодическими обострениями.
Анатомия кишечника
Причины колита
Как правило, колит развивается на фоне бактериальной или вирусной инфекции. Но в некоторых случаях его причину установить не так легко. Дело в том, что патология может возникнуть из-за сбоя в работе иммунной системы, аномалий строения органов желудочно-кишечного тракта или из-за аллергии. Каждый отдельный случай колита требует тщательного обследования.
Наиболее распространённые причины колита:
- вирусные и бактериальные инфекции;
- инфекции, вызванные простейшими и паразитами;
- аутоиммунные заболевания, при которых организм по ошибке атакует собственные ткани и органы;
- нарушение кровоснабжения толстой кишки, возникшее из-за частичной или полной закупорки артерий;
- пищевое отравление;
- тяжёлая аллергическая реакция;
- ослабленный иммунитет;
- бесконтрольный приём антибиотиков, нестероидных противовоспалительных препаратов;
- злоупотребление острой, пряной пищей, спиртными напитками.
Инфекционный колит часто развивается при заражении бактериями — кампилобактером, кишечной палочкой, сальмонеллами, стафилококками, шигеллами
Виды колита
В зависимости от течения болезни выделяют острый и хронический колит.
Для острого колита характерны яркие симптомы: сильная боль и вздутие живота, диарея, прожилки крови в кале, тошнота, частые позывы опорожнить кишечник.
Мучительная боль в животе — один из симптомов острого колита
Симптомы хронического колита практически такие же. Разница — в течении болезни. Острый колит со временем проходит. Хронический — не излечивается.
По распространённости патологического процесса колит бывает диффузный и сегментарный.
Диффузный колит охватывает два и более отдела толстой кишки.
Основные виды диффузного колита:
- проктосигмоидит — затрагивает сигмовидную и прямую кишку;
- панколит — вовлечены все отделы толстого кишечника.
Сегментарный колит — воспаление слизистой оболочки одного отдела толстого кишечника.
Основные виды сегментарного колита:
- тифлит — поражена слепая кишка;
- проктит — прямая кишка;
- сигмоидит — сигмовидная кишка;
- трансверзит — поперечная ободочная кишка.
Также различают виды колита в зависимости от изменений, которые происходят в слизистой оболочке толстой кишки.
Виды колита по изменениям слизистой оболочки:
- эрозивный — на слизистой оболочке образуются поверхностные повреждения;
- язвенный — слизистая оболочка толстой кишки отекает, на ней появляются язвы;
- геморрагический — возникают очаги кровоизлияний;
- атрофический — слизистая оболочка толстой кишки истончается.
Характерные симптомы геморрагического колита — спазмы в животе и диарея с кровью
Инфекционный колит
Одним из самых распространённых видов колита считается инфекционный. По статистике, им хотя бы раз в жизни болел каждый человек. Обычно такой колит протекает в острой форме.
Возбудители инфекционного колита — бактерии (чаще всего кампилобактер, кишечная палочка, сальмонеллы, стафилококки, шигеллы), вирусы (цитомегаловирус, ротавирус), простейшие (дизентерийная амёба). Иногда заболевание развивается при заражении гельминтами — острицами, аскаридами, власоглавом.
Также на практике часто встречается клостридиальный колит. Его возбудитель — бактерия Clostridioides difficile (Cl. difficile) — вырабатывает токсичные вещества, которые провоцируют воспаление слизистой оболочки толстой кишки. Часто так бывает после приёма антибиотиков, которые позволяют этим бактериям обитать в кишечнике.
Амёба — микроскопическое одноклеточное, один из возбудителей инфекционного колита
Кроме того, инфекционный колит зачастую возникает как осложнение сифилиса, туберкулёза или СПИДа.
Общие для инфекционного колита симптомы — понос, повышение температуры тела, плохое самочувствие, слабость. Если в процесс вовлекается и тонкий кишечник, то количество каловых масс увеличивается. При этом из-за диареи человек теряет большое количество жидкости — возникает риск обезвоживания.
При дизентерии чаще всего воспаляется сигмовидная кишка. Заболевание протекает остро: развивается диарея (дефекация происходит до 20 раз в сутки), в кале появляется слизь и кровь. Пациенты жалуются на сильную боль в животе и высокую температуру.
Похожие признаки — у амёбиаза, разновидности инфекционного колита, вызванного амёбами, простейшими одноклеточными.
Ишемический колит
Это острое воспаление толстого кишечника, обусловленное нарушением кровоснабжения его стенок. Примерно 80% случаев болезни приходится на людей старше 55 лет.
Чаще всего кровоснабжение нарушается при атеросклерозе, эмболии или тромбоэмболии сосудов брыжейки , аллергиях, травмах, послеоперационных осложнениях.
Кроме того, ишемический колит может развиться на фоне артериальной гипотонии, тяжёлой анемии, обезвоживания организма, а также аневризмы брюшной аорты.
Специфический симптом ишемического колита — острая сильная боль в животе. Также пациенты жалуются на расстройство стула (чередование запоров и поносов), периодически возникающие кишечные кровотечения.
Сильная боль в животе, кровь в стуле и ложные позывы к дефекации — возможные признаки ишемического колита
Лучевой колит
Лучевой колит — воспаление слизистой оболочки толстой кишки, вызванное воздействием радиации. Обычно он развивается у пациентов со злокачественными опухолями органов брюшной полости, малого таза и гениталий. Такие новообразования лечат, направляя на поражённые органы и ткани ионизирующую радиацию.
Риск развития лучевого колита повышается, если у пациента есть сопутствующие патологии — воспалительные заболевания кишечника, сахарный диабет.
Во время радиотерапии на пациента воздействует рентгеновское излучение
Симптомы лучевого и инфекционного колита схожи. У пациентов появляется тошнота и рвота, диарея, боли в животе.
Симптомы острого и хронического колита
Острый колит развивается внезапно и сопровождается нестерпимой болью в животе, диареей с прожилками крови в кале. Обострение хронического колита имеет сходные симптомы.
Основные признаки острого колита и хронического в стадии обострения:
- сильная боль в животе,
- вздутие живота,
- диарея,
- прожилки крови в кале,
- тошнота,
- частые позывы к дефекации.
Осложнения колита
Если не начать лечение, колит может привести к серьёзным осложнениям, вплоть до некроза, то есть отмирания тканей.
Основные осложнения колита:
- образование рубца, который приведёт к сужению просвета толстой кишки;
- непроходимость кишечника;
- внутреннее кровотечение;
- разрыв кишечника;
- некроз (отмирание) тканей;
- перитонит — воспаление брюшины;
- рак толстой кишки.
Диагностика колита
Если появились симптомы колита, нужно записаться на приём к врачу — терапевту или гастроэнтерологу. Врач уточнит у пациента характер и локализацию боли в животе. Поинтересуется другими симптомами — есть ли нарушения стула, тошнота и рвота, повышенная температура.
Если боли в животе нестерпимые, а в стуле появилась кровь, нужно немедленно вызвать скорую помощь.
Затем врач проведёт пальпацию — ощупывание живота. Спросит, проявляются ли боли при надавливании на ту или иную область. Также врач может послушать живот: шумы, урчание и бульканье вместе с обозначенными пациентом симптомами помогут дополнить картину заболевания.
Пальпация живота
Лабораторная диагностика
При подозрении на колит врач направит пациента на общий анализ крови. Дефицит гемоглобина укажет на анемию, обусловленную внутренним кровотечением. Повышение уровня лейкоцитов позволит обнаружить воспалительный процесс.
3.9.1.
Вен. кровь (+230 ₽)
Клинический анализ крови — исследование состава крови, которое позволяет оценить общее состояние здоровья, выявить воспаление, бактериальные, вирусные и грибковые инфекции, а также помочь в диагностике анемий, заболеваний кроветворных органов, аллергических реакций и аутоиммунных болезней.




Обнаружить воспаление в толстой кишке поможет анализ на кальпротектин в кале.
26.44. Колич.
Колич. 5 дней
Анализ на кальпротектин в кале позволяет найти причину болей в животе и желудочно-кишечных кровотечений, отличить воспалительные заболевания кишечника (язвенный колит и болезнь Крона) от невоспалительных и проконтролировать эффективность лечения.

При подозрении на бактериальную инфекцию будет полезен посев кала на возбудителей кишечных инфекций.
120.0. 
4 дня

120.0.05.19.01.3. 
5 дней

Исключить или подтвердить глистную инвазию и заражение простейшими помогают прицельные исследования.
20.1. Вен. кровь (+230 ₽) 
Вен. кровь (+230 ₽) П/колич. 3 дня

21.7. 
Кач. 1 день

При подозрении на клостридиальный колит врач может назначить прицельный анализ на Clostridium difficile.
130.0. 
4 дня

130.0.05.19.01.0. 
5 дней

Инструментальная диагностика
Колоноскопия — информативное эндоскопическое исследование толстой кишки. Пациенту через анальное отверстие в толстый кишечник вводят тонкую гибкую трубку, на конце оснащённую видеокамерой с подсветкой. На монитор выводится изображение слизистой оболочки органа. При необходимости во время колоноскопии делают биопсию, чтобы затем изучить ткани под микроскопом.
КТ органов брюшной полости с двойным контрастированием помогает заподозрить новообразования кишечника, воспаления, нарушения кровотока, а также обнаружить жидкость в брюшной полости.
Лечение колита
Колит лёгкой степени лечат амбулаторно — назначают специальную диету, а если обнаружена инфекция — антибиотики и противовоспалительные препараты. При тяжёлом течении острого колита и при обострении хронического пациента необходимо госпитализировать. При аутоиммунном колите применяют специальные противовоспалительные препараты.
Диетотерапия
В острой фазе болезни из рациона нужно исключить все трудноусвояемые продукты.
Запрещённые при колите продукты:
- копчёности;
- мясо, мясные бульоны;
- соль;
- уксус;
- бобовые;
- фрукты и овощи;
- жирная пища.
Количество соли в сутки не должно превышать 8–10 г — это примерно одна чайная ложка без горки. Блюда можно тушить или варить без добавления жира.
Обычно такую диету назначают на неделю. Как правило, этого достаточно, чтобы снять острые симптомы.
Консервативное лечение
Тактика лечения колита зависит от причины болезни. Если у пациента обнаружена инфекция — ему назначат антибиотики. Методы лечения сопутствующих заболеваний органов ЖКТ определяет врач. Для защиты микрофлоры кишечника он также может назначить пациенту пробиотики и пребиотики.
Если результаты анализов показали глистную инвазию, проводят курс противопаразитарной терапии.
Воспаление в нижних отделах толстого кишечника хорошо купируется местными средствами — анальными свечами. Они не только регулируют перистальтику кишечника, но и оказывают противовоспалительное действие.
Хирургическое лечение
Операция показана, только если есть риск для жизни пациента. Обычно так бывает при осложнениях колита — массивном кровотечении, разрыве кишечника.
Относительное показание к операции — частичная непроходимость кишечника.
Язвенный колит в тяжёлых случаях также лечат хирургически. Для этого проводят колопроктэктомию — частичное или полное удаление толстой кишки с установкой илеостомы (искусственного выходного отверстия из конечного отдела тонкой кишки на поверхность кожи).
Прогноз и профилактика
При своевременном обнаружении и лечении колита прогноз благоприятный.
Меры профилактики колита несложные, при этом они сводят риск развития болезни к минимуму.
Основные меры профилактики колита:
- сбалансированное питание,
- соблюдение личной гигиены,
- отказ от приёма антибиотиков без назначения врача.
Источники
- Burgers K., Lindberg B., Bevis Z. J. Chronic Diarrhea in Adults: Evaluation and Differential Diagnosis // Am Fam Physician. 2020. Vol. 101(8). P. 472–480.
- Язвенный колит (дети) : клинические рекомендации / Союз педиатров России, Российская ассоциация детских хирургов, Общество детских гастроэнтерологов, гепатологов и нутрициологов. 2021.
- Язвенный колит (взрослые) : клинические рекомендации / Российская гастроэнтерологическая ассоциация, Ассоциация колопроктологов России. 2020.
Колит (лат. colitis, от греч. kolon (толстый кишечник) и itis (воспаление) — собирательное понятие, включающее большую группу заболеваний с одним общим признаком: воспалением толстого кишечника.
Основные признаки колита: частый жидкий стул с кровью, боль в животе и высокая температура.
Колиты встречаются в практике гастроэнтерологов, инфекционистов, терапевтов, колопроктологов, хирургов и других специалистов.
Этиология колита
Основные формы колитов можно описать только по отдельности, в зависимости от этиологического фактора. Размеры статьи не позволяют коснуться всех видов колита. Рассмотрим только основные из них.
Инфекционный колит — это заболевание кишечника, возникающее из-за активизации условно-патогенных микроорганизмов в кишечнике или попадания новых болезнетворных микробов из внешней среды.[1]
Инфекционный колит имеет очень широкое распространение: нет человека, ни разу не переносившего данное заболевание. Количество заболевших увеличивается в жаркий период, когда создаются благоприятные условия для распространения инфекции. Поэтому чаще болеют люди в регионах с жарким климатом (Африка, Юго-Восточная и Средняя Азия). Заболевание чаще встречается в детском возрасте, особенно у детей, посещающих учебные заведения (детские сады, школы и т. д.). Гастроэнтерологи и проктологи могут встречать в практике больных с данной патологией, но она не является профильной. Лечат заболевание обычно инфекционисты.
Причины инфекционного колита:
- бактерии (шигеллы, эшерихии, сальмонеллы, клостридии, иерсинии, брюшнотифозная палочка, кампилобактерии, протей, стафилококки);
- вирусы (аденовирус, энтеровирус, ротавирус);
- простейшие (амебы, лямблии и др.);
- возбудители туберкулеза и сифилиса;
- грибки (кандида, актиномицеты). Возникновение грибкового колита свидетельствует о снижении иммунитета и часто проявляется у лиц, страдающих СПИДом, получающих химиотерапию, стероидные гормоны;
- дисбактериоз.
Формы инфекционного колита:
- катаральная;
- фиброзная;
- катарально-геморрагическая;
- флегмонозная;
- флегмонозно-гангренозная;
- некротическая.
Воспалительные явления могут иметь стадийный характер, а могут сразу иметь картину запущенного воспаления. Его выраженность напрямую зависит от характера инфекции. Некротическое и флегмонозно-гангренозное воспаление встречается при клостридиальной инфекции. Катарально-геморрагическое — при дизентерии. Катаральное воспаление встречается чаще при вирусных заболеваниях.[2]
Ишемический колит — воспаление стенки толстого кишечника, возникающее из-за нарушения процессов кровобращения. Существует хроническое и острое нарушение кровообращения.[3]
Причиной нарушения кровообращения является полное прекращение или критическое снижение притока крови к толстой кишке, вследствие чего возникает воспаление. При тяжёлом течении может приводить к некрозу стенки кишечника. Причиной закупорки сосудов могут быть тромбы, но чаще всего к сужению просвета сосуда приводят атеросклеротические бляшки. Поэтому болезнь чаще проявляется у лиц пожилого возраста. Около 79% больных ишемическим колитом старше 48 лет.[4] Частота встречаемости не имеет связи с половой принадлежностью и регионом. Впервые открыт в 1966 году. Ишемический колит является профильным заболеванием для колопроктологов, но им также занимаются общие хирурги и гастроэнтерологи.[5]
Причины ишемического колита:
- атеросклероз сосудов;
- закупорка брыжеечных сосудов вследствие эмболии или тромбоэмболии (в результате аллергических реакций, травм, осложнений операций, системного васкулита, ДВС-синдрома);
- снижение давления крови может приводить к нарушению питания стенки кишки.
Закупорка просвета сосуда приводит к ишемии стенки кишки, а как следствие — к некрозу и далее перфорации.[6]
Объём поражения зависит от размера питающей артерии, длительности закупорки. Если закупорка сосуда происходит постепенно (при образовании атеросклеротических бляшек в сосудах), то говорят о хроническом нарушении кровообращения, что в свою очередь приводит к стриктурам.
При критических состояниях и снижении давления крови (например, анафилактический шок, ДВС-синдром и т.д.), происходит централизация кровообращения, при этом резко снижается приток крови к кишечнику, что приводит к ишемии и некрозу.
При атеросклерозе чаще страдает сигмовидная и поперечная ободочная кишка. Воспаление начинается со слизистой оболочки, затем переходит на все слои.[7]
По характеру поражения выделяют:
- транзиторную форму (когда ишемические процессы обратимы);
- стенозирующую (когда формируются стриктуры);
- гангренозную (когда образуются язвы с дальнейшим развитием некроза, поражение носит необратимый характер).[8]
Лучевой колит — образуется в результате ионизирующего воздействия на стенку толстого кишечника.
Симптомы острого и хронического колита: боль в животе, кровь в кале, диарея, высокая температура, слабость, слизь и кровь в стуле, спазмы.
Симптомы язвенного колита: к перечисленным выше признакам добавляются боли в анусе и анемия.
Боли при колите кишечника:
Инфекционный колит
Клиника инфекционного колита напрямую зависит от возбудителя.
Для любого инфекционного колита независимо от этиологии характерно:
- начало заболевания, как правило, имеет острый характер;
- жидкий частый стул с примесью слизи в кале;
- боли локализуются чаще в левом подреберье, но могут также распространяться по всем отделам живота;
- боль имеет периодический, спазматический характер;
- высокая температура;
- чувство слабости, недомогания;
- сухость кожных покровов и слизистых;
- белый налет на корне языка;
- рвота как первый симптом колита кишечника (если в воспалительный процесс вовлечен желудок).
Для первичной оценки этиологии инфекционного колита оценивают характер дефекации, объём и особенности каловых масс.
- при дезентерии стул очень частый, малыми порциями (до 20 раз за день) со слизью и прожилками алой крови (ректальный «плевок»);
- при амебиазе кал имеет вид малинового желе;
- при сальмонеллезе кал напоминает болотную тину, имеет неприятный запах;
- при псевдомембранозном колите (вызыванном клостридиями) частый жидкий стул с запахом гнили.
Ишемический колит
Симптоматика очень вариабельна, характерно быстрое прогрессирование.
- болезненные ощущения в животе;
- кровь и слизь в стуле;
- неустойчивый, частый стул;
- выраженные боли в околопупочной и левой подвздошной области;
- при ректальном осмотре можно заметить кал с кровью, слизью или гноем;
- при хронической форме боли имеют низкую интенсивность, обычно возникают после еды;
- при длительной хронической ишемии появляются стриктуры в толстой кишке, которые в дальнейшем могут быть следствием непроходимости или малигнизации (раковому перерождению).
Лучевой колит
Обычно колит формируется у лиц, перенёсших курс лучевой терапии по поводу новообразований, локализующихся в области малого таза или брюшной полости.[12]
- большую чувствительность к излучению имеет тонкий кишечник, формируется лучевой энтерит, который клинически проявляется нарушением абсорбции в тонком кишечнике;
- повреждению кишечника свойствен избирательный характер, обычно воспаление локализуется в прямой и сигмовидной кишке, при этом клиника сопоставима с клиникой язвенного и ишемического колита. При воздействии больших доз радиации клиника развивается не сразу, проявляется обильным, жидким стулом, при этом нарушается всасывание в толстом кишечнике.[13]
Толстый кишечник очень восприимчив к ионизирующему излучению.[10] Лучевой колит возникает при воздействии малых доз облучения: происходит атрофия слизистой оболочки (сразу после облучения).
- Усиливаются процессы деления клеток, уменьшается длина ворсинок.
- Активизируются воспалительные процессы с нейтрофильной реакцией. Чаще всего эти процессы локализуются в прямой и сигмовидной кишке.
- При воздействии больших доз (более 40 Гр.) воспалительные процессы могут возникать спустя длительное время после облучения (до нескольких лет), в данной ситуации происходит воспаление мелких сосудов кишечника, что приводит к ишемизации кишечника. Развиваются язвы и стриктуры. Могут поражаться все отделы толстого и тонкого кишечника.[11]
По течению:
- острый;
- хронический.
По этиологии:
- язвенный колит кишечника и болезнь Крона (воспалительные заболевания кишечника с неизвестной этиологией);
- инфекционный (этиологический фактор бактериальный, вирусный, грибковый, паразитарный);
- ишемический (развивается вследствие снижения притока крови к толстой кишке);
- спастический (из-за неправильного питания нарушается моторика толстого кишечника и возникают спазмы);
- токсический (при применении нестероидных противовоспалительных препаратов);
- лучевой (при поражении радиацией).
По локализации:
| Вид колита | Локализация |
|---|---|
| проктит | воспаление прямой кишки |
| панколит | тотальное поражение кишечника |
| тифлит | воспаление слепой кишки |
| трансверзит | воспаление поперечной ободочной кишки |
| сигмоидит | воспаление сигмовидной кишки |
| диффузный колит кишечника | охватывает два и более отдела кишечника |
Поражение кишечной стенки подразделяют на три вида:
- катаральный колит кишечника — слабое воспаление, слизистая краснеет, и возникает отёк;
- эрозивный колит кишечника — появляются эрозии;
- атрофический колит кишечника — слизистая атрофируется.
Инфекционный колит:
- Лабораторные методы:
- анализ кала на вирусы, бактерии, паразиты (позволяет точно поставить диагноз);
- серологическое исследование (определяют антитела к вирусам, паразитам);
- анализ крови на стерильность (при подозрении на сепсис);
- общеклинический анализ крови (высокое СОЭ, увеличение количества лимфоцитов при вирусной этиологии).
- Инструментальные методы:
- ректороманоскопия используется как дополнительный метод для дифференциальной диагностики;
- ультразвуковое исследование используется для исключения осложнений.
Ишемический колит:
- Ректороманоскопия дает возможность оценить состояние слизистой оболочки. При осмотре можно отметить наличие точечных кровоизлияний, сглаженность сосудистого рисунка, бледность слизистой. При обнаружении данных признаков показано взятие биопсии.
- Ирригоскопия — самое необходимое исследование. Обнаруживается симптом пальцевых вдавливаний. Признаки дефектов слизистой свидетельствуют о наличии язв, сужения просвета при стриктурах.
- Колоноскопия показана для уточнения распространенности воспаления, также показана биопсия в области измененного участка.
- Ангиография позволяет определить степень сужения сосуда и его локализацию.[9]
Дифференциальная диагностика
- Злокачественные новообразования. Опухоли развиваются достаточно длительное время, в течении многих лет.
- Инфекционный колит. Преобладают симптомы общей интоксикации (слабость, лихорадка и т.д.). Кроме того, имеет место эпидемический анамнез.
- Язвенный колит и болезнь Крона. Для них характерно достаточно медленное прогрессирование. Проявляются обычно в раннем возрасте.
Лучевой колит:
- При сборе анамнеза учитывают наличие факта облучения ионизирующей радиацией.
- Ректороманоскопия и колоноскопия с биопсией позволяют выявить воспаление слизистой оболочки толстого кишечника. При лучевом энтерите воспаление сочетается с атрофией слизистой. Крипты становятся менее глубокими, уменьшается длина ворсинок. При лучевом колите на слизистой обнаруживают язвы, стриктуры.[14]
Дифференциальная диагностика
- Энтерит лучевого генеза следует дифференцировать с болезнями тонкой кишки, при которых страдает функция всасывания (целиакия), при данных заболеваниях происходит атрофия по гиперрегенераторному типу, а при лучевом поражении преобладают гипорегенераторные процессы слизистой.
- Радиационные поражения толстого кишечника дифференцируют с язвенным колитом, болезнью Крона, новообразованиями толстого кишечника.[15]
Инфекционный колит:
- антибактериальные, противогрибковые средства с учетом чувствительности микроорганизмов. Предпочтение отдают таблетированным формам препаратов;
- восполнение потерянной жидкости и минералов: растворами для приема внутрь (Регидрон и др.), внутривенное введение (раствор Рингера, Трисоль и др.);
- прием сорбентов;
- пробиотики и пребиотики;
- ферменты (креон, фестал);
- симптоматическая терапия (противовоспалительные средства, спазмолитики и др.)
Ишемический колит:
- консервативное лечение колита (щадящая диета, препараты, смягчающие стул, лекарства для улучшения кровотока, дезагреганты, витаминные препараты, дезинтоксикационное лечение, восполнение баланса электролитов и жидкости, гемотрансфузии (при показаниях), антибактериальные препараты);
- оперативное лечение колита.
Показаниями для срочного хирургического лечения служат:
- перфорация, толстокишечная непроходимость. В таком случае удаляется участок кишки, с последующей санацией и дренированием брюшной полости.
- плановое оперативное лечение колита кишечника показано больным в случае сужения (стриктуры) толстого кишечника без явлений острой кишечной непроходимости.
Терапия лучевого колита схожа с терапией язвенного колита и болезни Крона:
- лекарства, содержащие 5-аминосалициловую кислоту (месалазин, салофальк);
- антибактериальная терапия.
Может быть полезно вести дневник питания, чтобы отслеживать, что вы едите, а также свои чувства. Если вы обнаружите, что некоторые продукты вызывают обострение ваших симптомов, вы можете попробовать их устранить.
Диетотерапия
Убедительных доказательств того, что неправильное питание приводит к воспалению кишечника, нет. Но оно может усугубить симптомы болезни, особенно при обострении. Поэтому полезно вести дневник питания и отслеживать свои реакции на определённые продукты.
Также рекомендовано:
- есть меньше молочных продуктов — у пациента может быть непереносимость лактозы, т. е. организм не переваривает молочный сахар;
- есть небольшими порциями по 5–6 раз в день;
- пить больше жидкости — предпочтительнее вода; алкоголь и напитки, содержащие кофеин, стимулируют кишечник и могут усилить симптомы болезни [15].
На сегодняшний день хорошо известны причины возникновения инфекционного колита, разработаны современные методики лечения. Поэтому при неосложненном течении и вовремя начатой терапии удается достигнуть полного выздоровления. Менее благоприятный прогноз у лиц с явлениями иммунодефицита и ослабленной иммунной системой (например, у людей пожилого возраста). Прогноз благоприятный.
Основными методами профилактики являются:
- гигиенические мероприятия (тщательное мытье рук);
- использование только свежих продуктов, чистой воды;
- уделение особого внимания термической обработке пищи.
При транзиторной форме ишемического колита прогноз благоприятный. При гангренозной форме — зависит от вовремя поставленного диагноза и проведенного лечения.
Так как ишемический колит является осложнением других болезней, то для его профилактики необходимо:
- своевременное лечение сопутствующих заболеваний;
- сбалансированное питание.
Лучевой колит приводит к постоянным, необратимым изменениям кишечной стенки, поэтому прогноз неблагоприятный.
При радиационном колите могут появляться язвы и стриктуры на слизистой оболочке толстого кишечника, что может привести к кишечной непроходимости. В таком случае необходимо хирургическое лечение, от своевременности которого зависит прогноз. При правильном и вовремя проведенном лечении прогноз благоприятный. Специальных методов профилактики лучевого колита не существует.
Колит: причины появления, симптомы, диагностика и способы лечения.
Определение
Колит – это общее название группы заболеваний, для которых характерно острое или хроническое воспаление слизистой оболочки толстого кишечника.
Причины возникновения колита
Колит может развиться в результате инфекции, недостаточности кровоснабжения кишечника (ишемии), лекарственного поражения, бывает вторичным по отношению к иммунодефицитным состояниям, может возникать после лучевой терапии органов малого таза при гинекологическом, урологическом и ректальном раке.
Воспаление слизистой толстого кишечника характерно для болезни Крона (БК) и неспецифического язвенного колита (НЯК).
Выделяют также микроскопический колит, при котором данные рентгенологических и эндоскопических исследований кишечника не показывают отклонений, а признаки воспаления определяются с помощью биопсии.
Инфекционное поражение кишечника могут вызывать бактерии (чаще всего Campylobacter jejuni), вирусы, простейшие и паразиты. Заражение бактерией Campylobacter jejuni происходит в результате употребления грязных продуктов или воды. Развитие колита зависит от количества попавших в кишечник бактерий, их вирулентности (способности вызвать заболевания) и иммунитета человека. Инкубационный период составляет 2-4 дня. Бактерии размножаются в желчи, а затем проникают через слизистую оболочку в кишечник, вызывая выраженное воспаление.
Другие бактериальные возбудители — сальмонеллы, шигеллы и микобактерии туберкулеза.
Причиной развития инфекционных колитов у пациентов с ослабленным иммунитетом, у больных с заболеваниями крови, новообразованиями, лучевой болезнью могут стать условно-патогенные микроорганизмы (представители нормальной микрофлоры кишечника) — стафилококки, протеи, кишечная палочка.
Анаэробные бактерии Clostridium difficile, продуцирующие токсины, вызывают псевдомембранозный колит. Заболевание возникает на фоне изменений нормальной микрофлоры кишечника, в основном под влиянием антибиотиков (цефалоспоринов, бета-лактамных препаратов), которые подавляют рост других микроорганизмов и обеспечивают рост Clostridium difficile.
Среди вирусов, способных вызвать колит, выделяют цитомегаловирус, среди простейших – дизентерийную амебу (Entamoeba histolytica). К паразитам, результатом жизнедеятельности которых становится колит, относятся острицы, аскариды, власоглав, среди циркулирующих в крови – шистосомы.
Ишемический колит возникает при недостаточном кровоснабжении толстого кишечника, что приводит к воспалению слизистой, появлению язв и кровоизлияний.
Чем продолжительнее нарушение кровоснабжения, тем тяжелее поражается кишечник. При возобновлении нормального кровообращения может возникнуть реперфузионный синдром, который приводит к дальнейшим тяжелым повреждениям кишки. Пациенты с ишемическим колитом обычно страдают заболеваниями сердечно-сосудистой системы (сердечной недостаточностью, атеросклерозом, фибрилляцией предсердий), могут иметь злокачественные новообразования и патологии свертывающей системы крови, ведущие к тромбозам. Кроме того, ишемические повреждения кишечника определяются при так называемых ятрогенных (связанных с оказанием медицинской помощи) вмешательствах – операциях по устранению аневризмы брюшного отдела аорты, в ходе подготовки к колоноскопии или во время ее проведения.
К лекарственному колиту может привести прием нестероидных противовоспалительных препаратов, аспирина, ингибиторов протонной помпы, бета-блокаторов, статинов, иммуносупрессивных препаратов.
Развитие микроскопического колита связано с аутоиммунными заболеваниями, такими как целиакия, сахарный диабет 1-го типа, псориаз, нарушения функции щитовидной железы. Выделяют два основных подтипа микроскопического колита – коллагенозный и лимфоцитарный.
НЯК и БК относят к так называемым воспалительным заболеваниям кишечника. Точные причины развития этих заболеваний неизвестны, однако, вероятно, при НЯК повреждение стенки кишки сопровождается аутоиммунной реакцией с продукцией антител к собственным клеткам кишечника. Среди причин развития БК обсуждаются наследственные, инфекционные, иммунологические и др., но ни одна из теорий на настоящий момент не является абсолютно подтвержденной.
Классификация заболевания
Помимо этиологического (причинного) фактора, колиты подразделяют в зависимости от остроты процесса (острые и хронические) и степени тяжести. Хронические колиты классифицируют по характеру течения заболевания (непрерывное, рецидивирующее, перемежающееся) и по фазам (обострение или ремиссия). В зависимости от того, насколько поражен толстый кишечник при хроническом колите, выделяют тифлит (воспаление слепой кишки), трансверзит (воспаление поперечно-ободочной кишки), сигмоидит (воспаление сигмовидной кишки), проктит (воспаление прямой кишки), угловой колит (лево- и правосторонний в зависимости от пораженного изгиба поперечно-ободочной кишки), причем нередко они могут сочетаться (проктосигмоидит). При панколите поражены все отделы толстого кишечника.
Симптомы колита
Острый колит сопровождается сильными болезненными ощущениями, пациенты отмечают резь и спазмы в животе и в области прямой кишки (тенезмы). Для хронического воспаления характерны колики и ощущение тяжести в животе. У пациентов могут наблюдаться запоры, водянистая диарея, иногда с кровью и слизью, бурление в животе, ложные позывы к дефекации, усталость, повышение температуры тела.
При болезни Крона присутствуют ректальные кровотечения, боль в животе, диарея, лихорадка, анемия, поражения анальной и перианальной области с формированием свищей, язв, анальных трещин. Нередко бывают внекишечные проявления – артриты, поражения глаз, афтозный стоматит, узловатая эритема – эти поражения отмечены у трети пациентов с БК и неразрывно связаны с воспалением кишечника.
В клинической картине неспецифического язвенного колита также отмечаются боли, тенезмы, появление крови в кале и диарея в ночные часы. Как и при БК, развитие НЯК сопровождается внекишечными поражениями кожи, полости рта, суставов, органов зрения.
Диагностика колита
Диагностика колита основывается на клинических и лабораторных данных, эндоскопии и биопсии.
В первую очередь необходимо провести микробиологические исследования и посевы для исключения инфекционного поражения.
- Копрограмма.
К каким врачам обращаться
При появлении болей в животе, нарушении стула, симптомов общей интоксикации, бледности кожи и слизистых, слабости необходимо обратиться к
врачу-терапевту
, который выберет объем необходимых обследований и лечения, а также определит необходимость консультации узких специалистов:
гастроэнтеролога
,
онколога
, проктолога.
Лечение колита
Некоторые инфекционные колиты требуют проведения антибактериальной терапии. Назначение антибиотиков показано пациентам с дизентерией и высокой температурой, злокачественными новообразованиями, больным СПИДом, пациентам после трансплантации, протезирования, с клапанными заболеваниями сердца и пожилым.
Для легких и умеренных случаев псевдомембранозного колита, вызванного Clostridium difficile, предпочтительным лечением является метронидазол. В тяжелых случаях рекомендуется ванкомицин. В осложненных случаях — пероральный прием ванкомицина с внутривенным введением метронидазола.
Цитомегаловирусный колит лечат валганцикловиром; продолжительность лечения определяет врач в зависимости от клинической картины и лабораторных показателей.
Цель терапии НЯК и БК — достижение и удержание ремиссии, профилактика осложнений, своевременное назначение хирургического лечения, улучшение качества жизни пациентов.
Лечебные мероприятия при НЯК включают назначение лекарственных препаратов, хирургическое лечение, психосоциальную поддержку и диетические рекомендации. Основой консервативной терапии являются препараты 5-аминосалициловой кислоты, глюкокортикоиды, иммуносупрессоры, но полное излечение достигается только благодаря оперативному вмешательству.
В основе терапии БК — стероидные гормоны, салицилаты, иммуносупрессоры и антибактериальные препараты. В отличие от НЯК, при болезни Крона хирургическое лечение, к сожалению, не ведет к излечению больных, а его целью являются борьба с осложнениями и улучшение качества жизни пациентов, когда это невозможно достичь медикаментозными средствами.
Пациентам с ишемическим поражением кишечника без признаков перитонита (воспаления серозного покрова брюшной полости) показано медикаментозное лечение с восполнением объема циркулирующей крови и оптимизацией работы сердца, антибиотикотерапия, кислородная поддержка и внутривенное питание с целью обеспечить покой кишечнику. В случае недостаточности медикаментозного лечения и развития перитонеальных признаков или перфорации кишечника требуется резекция кишечника.
Осложнения
К осложнениям колита относятся:
- перфорация (сквозное повреждение стенки) кишечника,
- стриктуры (сужения) кишечника, свищи, абсцессы и кишечная непроходимость,
- недержание кала,
- кожные свищи, особенно при болезни Крона,
- воспалительные осложнения после операций по поводу НЯК и БК,
- Синдром Гийена-Барре (при Campylobacter jejuni colitis, цитомегаловирусном колите и НЯК),
- гемолитический уремический синдром (при поражении энтерогеморрагической E. coli, при шигеллёзе),
- энцефалопатия, судороги (при шигеллёзе),
- токсический мегаколон — редкое осложнение колита, характеризующееся тотальным или сегментарным расширением толстой кишки, которое не связано с обструкцией (непроходимостью), а вызвано системной интоксикацией. Общая смертность при этом осложнении достигает 19%. Язвенный колит и псевдомембранозный колит осложняются токсическим мегаколоном более чем в 60% случаев.
Профилактика колита
В качестве профилактики воспалительных заболеваний кишечника рекомендованы общие мероприятия: соблюдение санитарно-гигиенических норм и режима труда и отдыха, здоровый рацион питания, своевременное прохождение профилактических осмотров и лечение хронических заболеваний.
Источники:
- Миронов И. Л., Ратникова Л. И., Пирогов Д. В., Мильченко И. Б. Колит, ассоциированный с C.Difficile. Экспериментальная и клиническая гастроэнтерология, журнал. Выпуск 111, № 11, 2014. С. 65-69.
- Burgers K, Lindberg B, Bevis ZJ. Chronic Diarrhea in Adults: Evaluation and Differential Diagnosis. Am Fam Physician. 2020 Apr 15;101(8):472-480. PMID: 32293842.
- Клинические рекомендации «Язвенный колит (дети). Разраб.: Союз педиатров России, Российская ассоциация детских хирургов, Общество детских гастроэнтерологов, гепатологов и нутрициологов. – 2021.
- Клинические рекомендации «Язвенный колит (взрослые). Разраб.: Российская гастроэнтерологическая ассоциация, Ассоциация колопроктологов России. – 2020.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.