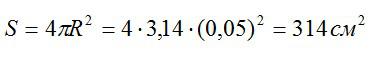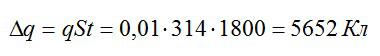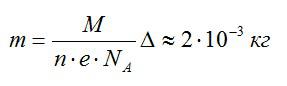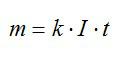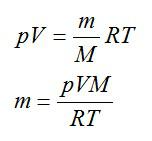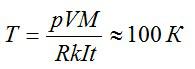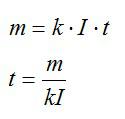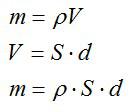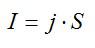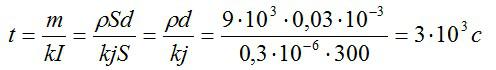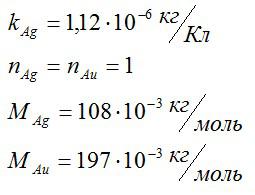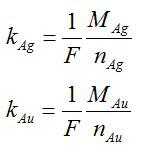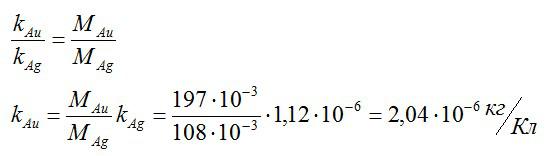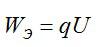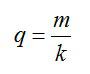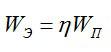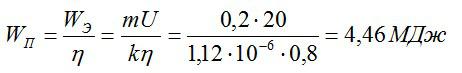Задачи по химии с решениями на законы электролиза
Расчет времени электролиза, с использованием формулы выхода по току
Задача 26.
При прохождении через раствор сульфата никеля (II) тока силой 2А масса катода увеличилась на 2,4 г. Рассчитайте время электролиза, если выход по току равен 0,8.
Решение:
Э(Ni) = 58,6934/2 = 29.3467 г/моль;
(р-р)NiSO4;
I = 2A;
mпр.(Ni) = 2,4г;
n = 0,8;
t — ?
1) Химизм электролиза:
NiSO4 = Ni+2 + SO42-
K(-) Ni+2 + 2
A(+) 2H2O – 4
2NiSO4 + 2H2O (elekt. power) → 2Ni + O2 + 2H2SO4
Отношение массы практически полученного вещества к теоретически рассчитанной массе, выраженное в процентах, называется выходом вещества по току. Его можно определть по формуле:
n = (mпр . F)/Э.I.t
Подставив в данное уравнение известные значения рассчитаем время электролиза, получим:
t = (mпр. . F)/Э.I.n = (2,4г . 96500 c.A/моль)/(29,3467 г/моль . 2A . 0,8) = 4932 c.
Ответ: t = 4932c.
Определение состава соли, расплав которой подвергли электролизу
Задача 27
При действии постоянного тока силой 6,4А на расплав соли трехвалентного металла на катоде в течение 30 мин выделилось 1,07г металла, а на аноде – выделился газ, относительная плотность паров которого по гелию составляет 17,75. Определите состав соли, расплав которой подвергли электролизу.
Решение:
D(Не) = 17,75;
I = 6,4 A;
t = 30мин = 1800с;
m(Me) = 1,07г;
n = 3;
M(Me) = ?
соль — ?
на катоде : Me3+ + 3
на аноде : — ?
1) По условию: D(Не) = 17,75. Значит, M(газа) = D(Не) = M(He) . 17,75 = 4 г/моль . 17,75 = 71 г/моль. Из газообразных веществ такую молярную массу имеет гах хлор Cl2, M(Cl2) = 71 г/моль. Значит, на аноде выделяется газообразный хлор:
на аноде : 2Cl– -2
По формуле объединенного закона электролиза:
m = Э.I.t/F = М.I.t/n.F = K.I.t, где
Э – эквивалентная масса вещества (молярная масса эквивалента); F– постоянная Фарадея, равная 96500 Кл/моль или 96500 А.с/моль;. I – сила тока, А; t – время проведения электролиза, с; М – молярная масса вещества; n – число отданных или принятых электронов; К – электрохимический эквивалент вещества.
Рассчитаем молярную массу металла М(Ме), получим:
М(Ме) = m(Me).n.F/I.t = (1,07г .3 96500 А.с/моль)/(6,4А. 1800с) = 26,89 г/моль.
M(A1) = 27г/моль. Значит, соль – хлорид аммония A1Cl3.
Ответ: хлорид аммония A1Cl3.
Самостоятельное решение задач – боль многих студентов и школьников. Чтобы уменьшить ее, разберем несколько примеров решений задач на электрический ток в электролитах.
Наш телеграм – это полезная информация для всех учащихся, присоединяйтесь! Кстати, у нас есть и второй канал, где публикуется информация об акциях и приятных скидках, не упустите шанс воспользоваться ими.
Электрический ток в электролитах: задачи
Как решать задачи? Прочтите теорию (лучше несколько раз), вспомните памятку по решению физических задач, и вперед!
Задача на ток в электролитах №1
Условие
Проводящая сфера радиусом R = 5 см помещена в электролитическую ванну, наполненную раствором медного купороса. Насколько увеличится масса сферы, если отложение меди длится 30 минут, а электрический заряд, поступающий на каждый квадратный сантиметр поверхности сферы за 1 секунду, равен 0,01 Кл? Молярная масса меди М = 0,0635 кг/моль.
Решение
Площадь поверхности сферы вычислим по формуле:
Теперь можем вычислить общий заряд, перенесенный ионами за 30 минут:
Рассчитаем массу выделившейся меди:
Ответ: 2 грамма.
Задача на ток в электролитах №2
Условие
Электролиз длился один час при силе тока, равной 5 А. Чему равна температура выделившегося атомарного водорода, если при давлении, равном 10^5 Па, его объём равен 1,5 л? Электрохимическии эквивалент водорода принять равным k=1*10^-8 кг/Кл.
Решение
Согласно первому закону Фарадея, масса выделившегося водорода определяется по формуле:
Также эту массу можно выразить из уравнения Клапейрона-Менделеева:
Приравняем два выражения для массы и найдем температуру:
Ответ: 100 К.
Задача на ток в электролитах №3
Условие
В процессе электролиза под действием тока плотностью 300 А/м^2 на электроде выделился слой меди толщиной 0,03 мм. В течении какого времени протекал электролиз?
Решение
Время электролиза определим из закона Фарадея:
Масса равна плотности, умноженной на объем. Объем меди можно вычислить, зная толщину слоя и плотность. Запишем:
Силу тока выразим через плотность тока и площадь:
Подставим выражения для массы и силы тока в выражение для времени, упростим его и вычислим:
Ответ: 3000 секунд.
Плотность, как и значение электрохимического эквивалента, берутся из таблиц.
Задача на ток в электролитах №4
Условие
Зная электрохимический эквивалент серебра, определите электрохимический эквивалент золота.
Решение
Для решения данной задачи будем применять второй закон Фарадея. Валентость золота и серебра, а также молярные массы этих элементов возьмем из таблицы Менделеева. Запишем известные величины:
Теперь запишем второй закон Фарадея для золота и серебра:
Разделим одно уравнение на другое и выразим искомую величину:
Ответ: 2,04*10^-6 кг/Кл.
Задача на ток в электролитах №5
Условие
Сколько электрической энергии понадобилось для получения серебра массой 0,2 кг, если КПД установки равен 0,8? Электролиз проводят при напряжении 20 В. Электрохимический эквивалент серебра возьмите из предыдущей задачи.
Решение
Энергия, которая идет только на электролиз, равна:
По закону Фарадея:
Полная затраченная энергия и энергия, затраченная только на электролиз, связаны выражением:
Отсюда:
Ответ: 4,46 МДж.
Вопросы на тему «Электрический ток в электролитах»
Вопрос 1. Что такое электролиты?
Ответ. Дадим определение и некоторые сведения об электролитах:
- Электролиты – вещества, проводящие электрический ток вследствие электролитической диссоциации.
- Электролитическая диссоциация – процесс распада молекул на ионы. Диссоциация на ионы происходит в растворах и некоторых твердых кристаллах.
- К электролитам относятся кислоты, соли и некоторые кристаллы.
- Носителями заряда в электролитах являются ионы.
Электролит – широкое понятие, которое используется не только в физике, но также в биологии, химии и медицине. В разных отраслях науки это слово может иметь разные значения.
Вопрос 2. В чем состоит суть электролиза?
Ответ. Электролиз – окислительно-восстановительный процесс, происходящий на электродах, когда ток проходит через раствор электролита. На электродах выделяются части растворенных веществ и продукты вторичных реакций.
Вопрос 3. Сформулируйте первый закон Фарадея.
Ответ. Помимо прочего, Майкл Фарадей занимался задачей исследования проводимости электрического тока в электролитах. Первый закон Фарадея гласит:
Масса вещества, выделившегося на электроде, прямо пропорциональна заряду, переданному на электрод.
Вопрос 4. Как звучит второй закон Фарадея?
Ответ. Второй закон Фарадея гласит:
Масса вещества, осевшего на электроде, прямо пропорциональна молярной массе элемента, деленной на электрохимический эквивалент вещества.
Вопрос 5. Что такое электрохимический эквивалент вещества?
Ответ. Электрохимический эквивалент вещества – количество вещества, которое должно выделиться во время электролиза на электроде, при прохождении через электролит заряда в 1 Кулон.
Нужна скорая помощь в решении задач и других заданий? Обращайтесь за ней в профессиональный сервис для учащихся.
-
Законы электролиза Фарадея и их применение для расчета количественных характеристик процесса электролиза
Электролизомназывается
совокупность электрохимических
окислительно-восстановительных реакций,
протекающих на электродах при прохождении
постоянного электрического тока через
раствор или расплав электролита. При
этом на катоде происходит процесс
восстановления,
а на аноде – окисления.
Катионы восстанавливаются в ионы более
низкой степени окисления или в атомы,
например:
Fe3+
+ e –
→ Fe2+
; (3.54)
Cu2+
+ 2 e –
→
Cu. (3.55)
Нейтральные
молекулы могут участвовать в превращениях
на катоде непосредственно или
взаимодействовать с продуктами катодного
процесса, которые рассматриваются в
этом случае как промежуточные вещества.
Например, восстановление воды:
2
H2O
+ 2 e –
→ H2
+ 2 OH–. (3.56)
На
аноде окисляются ионы или молекулы,
поступающие из объема электролита,
например:
4 OH–
– 4 e – →
2 H2O
+ H2; (3.57)
2
Cl–
– 2 e –
→ Cl2,– (3.58)
или
принадлежащие материалу анода. в
последнем случае анод растворяется,
например:
Cu
– 2 e
–
→ Cu2+
(растворение
медного анода). (3.59)
Протекание
электродных реакций зависит от состава
и концентрации электролита, материала
электродов, электродного потенциала,
температуры, гидродинамических условий.
Процессы
электролиза описываются законами
Фарадея,
которые в объединенной форме читаются
следующим образом: массы
веществ, испытавших электрохимические
превращения на электродах, прямо
пропорциональны количеству протекшего
через электролит электричества и
электрохимическим эквивалентам этих
веществ:
(3.60)
где
m
– масса вещества, превратившегося на
электроде (выделившегося на электроде),
электрохимический
эквивалент
– величина характеризующая массу
продуктов электролиза, выделившихся
на электродах при прохождении через
электролит 1 Кл электричества;
Э
– химический
эквивалент вещества (эквивалентная
масса вещества) при окислительно-восстановительном
превращении, г/экв;
q
– количество
прошедшего электричества, Кл;
F
– число Фарадея (96485 Кл/г-экв) – количество
электричества, необходимое для химического
превращения (выделения на электроде) 1
г-экв вещества.
Так
как q
= I
·
τ (I
– сила тока, А; τ
– продолжительность электролиза, с),
то уравнение
закона Фарадея
может быть записано следующим образом:
(3.61)
Химический
эквивалент вещества (эквивалентная
масса вещества) при окислительно-восстановительном
превращении рассчитывается по формуле:
, (3.62)
где М– молярная
масса вещества, претерпевающего
превращение на электроде, г/моль;
n– количество электронов, участвующих
в одном акте химического превращения.
При
электрохимических процессах часто
наблюдаются отклонения от законов
Фарадея: масса действительно полученного
или разложившегося продукта не
соответствует теоретической. Эти
отклонения – кажущиеся и возникают за
счет одновременного протекания побочных
электрохимических процессов; химических
реакций, в которые вступает продукт;
потерь продукта и потерь электроэнергии
на преодоление сопротивления электролизера.
Эффективность электрохимического
процесса оценивается выходом
по току Вт:
(3.63)
Эта величина может быть выражена в
процентах:
.
(3.64)
Тогда
практическое количество вещества,
образующееся при электролизе рассчитывается
по формуле:
.
(3.65)
П
р и м е р 3.18. Какое количество алюминия
выделится при электролизе за время 12
ч, если сила тока I
=2,5 A, а выход по току составляет 88 %.
Молярная масса алюминия М,
равная его грамм-атомной массе А,
составляет 26,98 г/моль.
Р е ш е
н и е
Выделение алюминия при электролизе
происходит на катоде при прохождении
следующей реакции восстановления:
Al3+
+ 3 e –
= Al; n
=
3.
Химический эквивалент алюминия
рассчитываем по формуле (3.62):
Э
= М / 3 = 26,98 / 3 =
8,99 г/экв.
Продолжительность
электролиза τ
= 12 час = 12 ·
3600 = 43200 с.
По
объединенному закону Фарадея (3.61) находим
теоретическое количество алюминия,
выделяющееся при электролизе в указанных
условиях:
г.
Практическое
количество выделившегося при электролизе
алюминия находим с учетом величины ВТ
по формуле (3.65):
П
р и м е р 3.19. Определить время, необходимое
для выделения при электролизе 1,2 г меди,
если сила тока I
= 2 A,
а выход по току ВТ
= 96 %.
Р е ш е
н и е
На
основании формулы (3.64) находим, на какое
теоретическое количество меди необходимо
рассчитывать продолжительность
электролиза:
Выделение
меди при электролизе происходит на
катоде при прохождении следующей реакции
восстановления:
Сu2+
+ 2 e–
= Cu; n
= 2.
Химический эквивалент меди рассчитываем
по формуле (3.62):
Э
= М / 2 = 63,54 / 2 =
31,77 г/экв.
Из уравнения закона Фарадея (3.61) находим
время процесса:
Соседние файлы в папке физическая химия 1
- #
- #
- #
- #
- #
- #
- #
- #
- #
Закон Фарадея для электролиза
Содержание
- 1 Что такое электролиз
- 2 Законы Фарадея об электролизе
- 2.1 Первый закон
- 2.2 Второй закон
- 2.3 Объединённый закон
- 3 Практическое применение
- 4 Видео по теме
В результате исследований Майкла Фарадея были открыты основополагающие законы электролиза. Этот процесс активно используется в современной технике и промышленности. Законы электролиза Фарадея позволяют рассчитать условия протекания процесса и его количественные показатели.
Что такое электролиз
Ток, как известно, представляет собой упорядоченное движение зарядов. Он может протекать не только по проводам, но и через другие вещества. Для этого необходимо, чтобы вещество имело носители зарядов.
В качестве проводника может выступать жидкость, в которой происходят окислительно-восстановительные реакции. В ней имеется большое количество ионов. При пропускании через такой раствор электрического тока происходит оседание вещества на электродах. На практике этим можно воспользоваться, например, для получения металлов с высокой степенью чистоты.
При электролизе на катоде будет проходить процесс восстановления, а на аноде — окисления. Продукты реакций иногда откладываются на электродах, а в некоторых случаях продолжают вступать во вторичные реакции.
Если раствор содержит соли металлов, то последний будет откладываться на катоде, а на аноде образуется газ. Это можно продемонстрировать на электролизе поваренной соли (NaCl). Чистый натрий будет оседать на катоде, а хлор — на аноде.
Растворы веществ, обеспечивающих высокое содержание ионов в жидкости, называются электролитами. Этот термин ввёл в употребление Фарадей. Согласно его определению, речь идёт о тех жидкостях, способных пропускать электроток.
Протекание электролитических реакций возможно при выполнении следующих условий:
- В электролите не должно быть пространственной электрической однородности. В нем должна присутствовать объёмная неравномерность по уровню потенциала. Как пример можно привести ситуацию, когда в аккумуляторах происходит выработка электрического тока. Под его воздействием происходит неравномерное объёмное распределение зарядов в электролитах. Электроток обязательно должен быть постоянным.
- Чтобы можно было говорить о прохождении тока, в растворе должны присутствовать носители электрозарядов. При этом важно, чтобы они могли свободно перемещаться под действием приложенного к ним электрического поля.
На практике к электролитам относят растворимые соли, а также кислоты и щёлочи. При прохождении электротока через металлический проводник в качестве носителей заряда выступают только электроны. В электролитах присутствует ещё одна их разновидность — ионы.
Обычно атомы водорода или металлов теряют электроны и становятся положительными ионами. Отрицательно заряженные ионы —это гидроксильные группы или кислотные молекулярные остатки. При воздействии электрополя на раствор ионы с отрицательным зарядом начинают притягиваться к аноду, а с положительным — к катоду. Электрический ток в жидкостях практически представляет собой одновременное перемещение носителей заряда противоположных знаков.
В результате отрицательные ионы отдают лишние электроны положительному электроду. Соответственно, положительные ионы восполняют недостающие электроны за счёт частиц, которые получают у отрицательного электрода. После восстановления электрической нейтральности эти вещества выделяются из раствора, осаждаясь или выделяясь в виде газа.
Здесь рассмотрена ситуация, когда происходит только одна электролитическая реакция. На практике получившиеся вещества могут участвовать в других реакциях. В результате процесс электролиза становится более сложным. Таких реакций может быть 2, 3 или больше.
Законы Фарадея об электролизе
Процессы электролиза подчиняются законам Фарадея. Он обнародовал свои изыскания в 1833 году, основываясь на собственноручно проделанных опытах.
Первый закон
Первый закон электролиза Фарадея рассматривает массу вещества, которое задержалось на электродах в результате химической реакции при пропускании электротока за определённое время.
Формулировка первого закона Фарадея имеет следующий вид: если взвесить вещество, образовавшееся на электродах в результате пропускания через раствор электротока, то его вес будет пропорционален заряду, прошедшему через этот раствор.
Формула содержит коэффициент пропорциональности k. Он является постоянным для определённого вещества. Его величина равна весу вновь образованного материала при прохождении заряда в 1 Кулон. Коэффициент носит название электрохимического эквивалента.
Уравнение представлено в двух вариантах — с учётом заряда или силы тока. В последнем случае закон Фарадея для электролиза формулируется следующим образом: количество вещества, выделенного на электродах за определённое время, пропорционально силе электротока, протекающего в жидкости.
Закономерность, которую выражает первый закон Фарадея, можно продемонстрировать с помощью опыта. Для этого нужно через раствор медного купороса пропустить электрический ток. Следует сравнить две ситуации, когда пропускается электроток различной силы. При более слабом количество меди, выделившейся на электроде, будет меньше.
Второй закон
Второй закон Фарадея тесно связан с первым. Он гласит следующее: масса, полученного при помощи электролиза вещества, пропорциональна его химическому эквиваленту.
К такому выводу Фарадей пришел, пропуская один и тот же электрический ток в жидкостях различного состава. Взвешивая каждый раз полученный металл, он увидел, что результат получается различным. Ученый понял, что результат зависит от химического состава вещества. Поэтому в законе используется понятие химического эквивалента. Он выражается отношением молярной массы вещества к валентности.
Фарадей провёл дополнительные эксперименты и выяснил, что получить один моль вещества можно, если на электролитическую реакцию затратить 96485 Кулонов. Это число называют постоянной Фарадея и обозначают буквой F.
Исходя из этого, можно записать выражение для определения электрохимического эквивалента:
Следовательно, зная химическую формулу вещества и массу, которую необходимо получить, можно вычислить, какой заряд необходимо в этом случае потратить.
Объединённый закон
Для определения количественных показателей электрохимических реакций на практике используется объединённый закон Фарадея.
Обобщенный закон можно представить в виде такой формулировки: отношение массы полученного вещества к его химическому эквиваленту равно отношению использованного заряда к тому, который надо потратить на извлечение одного моля вещества.
Практическое применение
Электролиз и поясняющие его законы Фарадея, имеют широкое практическое применение. Впервые в истории это явление использовал русский физик Якоби. Он создал оттиски фигур для оформления Исаакиевского собора в Санкт-Петербурге, применив метод, который носит название гальванопластики. Данный метод позволяет получать качественные копии металлических фигур.
Ещё одно направление использования электролиза в химии — получение металлов высокой степени чистоты. В частности, таким образом можно добывать магний, алюминий, натрий и кальций. Обычно электролизу подвергается расплав руды.
Применяя такую технологию, как гальваностегия можно покрывать металлическую деталь тонкой и равномерной оболочкой определённого вещества. Данным способом создают защитные покрытия.
С помощью электролиза можно проводить очищение металлов от примесей, повышая их степень чистоты. Также можно получать концентрированные щёлочи и кислоты.
Электролиз приносит пользу не только за счет того, что на электроде оседает вещество, но и за счет того, что на аноде выделяется газ. Такой технологический процесс позволяет получать, например, водород.
Электрохимия нашла своё применение и при очистке сточных вод. При помощи химического разложения загрязнения выводятся из жидкости, делая её пригодной для повторного использования.
Видео по теме
Закон Фарадея для электролиза

4.3
Средняя оценка: 4.3
Всего получено оценок: 269.
4.3
Средняя оценка: 4.3
Всего получено оценок: 269.
В 1836 году Майкл Фарадей опубликовал выведенные математически количественные характеристики электролиза. Обнаруженные взаимосвязи между количеством прошедшего через электролит электричества и количеством выделившегося при этом вещества впоследствии были названы законами Фарадея для электролиза.
Первый закон
Если пропускать через раствор медного купороса электрический ток в течение определённого количества времени, то на катоде выделяется небольшое количество меди. Однако если пустить ток большей силы, за такое же количество времени на катоде образуется большее количество меди. При увеличении времени и одинаковой силе тока также увеличивается количество меди.
Фарадей установил взаимосвязь массы вещества, силы тока и времени. Математически эта взаимосвязь выражается следующим образом:
m = kIt,
где:
- m – масса вещества;
- k – электрохимический эквивалент;
- I – сила тока;
- t – время.
Электрохимический эквивалент – это масса вещества, образованная при прохождении через электролит тока в 1 А за одну секунду. Выражается как соотношение массы вещества к количеству электричества или г/Кл.
Произведение силы тока и времени выражает количество электричества: q = It. Это электрический заряд, измеряемый в кулонах (один ампер к одной секунде). Электрический заряд отражает способность тела быть источником электромагнитного поля и принимать участие в электромагнитном взаимодействии.
Соответственно, уравнение Фарадея приобретает вид:
m = kq.
Первый закон электролиза Фарадея: масса вещества, выделившегося при электролизе, прямо пропорциональна количеству электрического тока, пропущенного через электролит.
Второй закон
Фарадей, пропуская электрический ток одинаковой силы через различные электролиты, заметил, что массы веществ на электродах неодинаковы. Взвесив выделившиеся вещества, Фарадей сделал вывод, что вес зависит от химической природы вещества. Например, на каждый грамм выделенного водорода приходилось 107,9 г серебра, 31,8 г меди, 29,35 г никеля.
На основе полученных данных Фарадей вывел второй закон электролиза: для определённого количества электричества масса химического элемента, образовавшегося на электроде, прямо пропорциональна эквивалентной массе элемента. Она равна массе одного эквивалента – количеству вещества, реагирующему или замещающему 1 моль атомов водорода в химических реакциях:
μeq = μ/z,
где:
- μ – молярная масса вещества;
- z – число электронов на один ион (валентное число ионов).
Для выделения одного моля эквивалента затрачивается одинаковое количество электричества – 96485 Кл/моль. Это число называется числом Фарадея и обозначается буквой F.
Согласно второму закону, электрохимический эквивалент прямо пропорционален эквивалентной массе вещества:
k = (1/F) μeq или k = (1/zF)μ.
Два закона Фарадея можно привести к общей формуле: m = (q / F) ∙ (μ/z).
Что мы узнали?
Фарадей, проводя реакцию электролиза разных веществ, вывел два закона. Согласно первому закону, масса вещества, осевшего на электрод, прямо пропорциональная количеству электричества, пропущенного через электролит: m = kq. Второй закон отражает взаимосвязь электрохимического эквивалента и эквивалентной массы вещества: k = (1/F) μeq. Электрохимический эквивалент – количество выделившегося вещества при прохождении единицы электричества. Эквивалентная масса – количество вещества, реагирующее с 1 молем водорода.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Лиза Шифр
4/5
-
Евгений Пшеничный
5/5
-
Татьяна Батарон
4/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 269.
А какая ваша оценка?