Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру. Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается.
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10оС.
Правило Вант-Гоффа звучит так: повышение температуры на 10оС приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ. Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например, для реакции образования аммиака:
N2 + 3H2 ↔ 2NH3
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления. При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается.
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
CaCO3 + SiO2 ↔ CaSiO3 + CO2↑
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором.
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
N2 + 3H2 ↔ 2NH3
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например, для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности. Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например, при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например, хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например, оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
596
Создан на
11 января, 2022 От Admin
Скорость химических реакций
Тренажер задания 18 ЕГЭ по химии
1 / 10
Из предложенного перечня выберите два фактора, которые приводят к увеличению скорости реакции, которую описывает сокращённое ионное уравнение:
CuO(тв) + 2Н+(р-р) = Cu2+(р-р) + H2O(ж)
1) повышение давления в системе
2) понижение давления в системе
3) повышение температуры
4) добавление воды
5) измельчение оксида меди(II)
Запишите в поле ответа номера выбранных факторов.
2 / 10
Из предложенного перечня выберите все внешние воздействия, которые оказывают влияние на скорость реакции образования оксида углерода(IV) из оксида углерода(II и кислорода.
1) повышение давления в системе
2) увеличение концентрации кислорода
3) уменьшение концентрации оксида углерода(IV)
4) уменьшение концентрации оксида углерода(II)
5) повышение температуры
3 / 10
Из предложенного перечня выберите два фактора, которые приводят к увеличению скорости химической реакции между алюминием и раствором гидроксида калия.
1) увеличение концентрации раствора щёлочи
2) добавление индикатора
3) добавление воды
4) измельчение алюминия
5) понижение температуры
Запишите в поле ответа номера выбранных факторов.
4 / 10
Из предложенного перечня выберите все внешние воздействия, которые способствуют увеличению скорости реакции цинка с соляной кислотой.
1) уменьшение концентрации кислоты
2) увеличение температуры
3) пропускание хлороводорода через реакционную смесь
4) увеличение площади поверхности соприкосновения реагентов
5) добавление индикатора
Запишите номера выбранных ответов.
5 / 10
Из предложенного перечня выберите все пары веществ, скорость реакции между которыми не зависит от величины площади поверхности соприкосновения реагентов.
1) сера и железо
2) кремний и кислород
3) водород и кислород
4) цинк и соляная кислота
5) этилен и хлороводород
Запишите номера выбранных ответов.
6 / 10
Из предложенного перечня выберите два вещества, между которыми реакция протекает с наибольшей скоростью в одинаковых условиях.
1) Fe (проволока)
2) Ca(OH)2 (р-р)
3) HCl (р-р)
4) Fe (порошок)
5) Cu (порошок)
7 / 10
Из предложенного перечня выберите все внешние воздействия, которые уменьшают скорость химической реакции между цинком и раствором сульфата меди(II).
1) нагревание реакционной смеси
2) добавление воды
3) охлаждение реакционной смеси
4) использование индикатора
5) уменьшение давления
Запишите номера выбранных ответов.
8 / 10
Из предложенного перечня выберите все реакции, для которых увеличение давления не приводит к увеличению скорости реакции.
1) 2P + 5Cl2(г) = 2PCl5
2) Zn + CuSO4 = ZnSO4 + Cu
3) Ba + 2H2O(ж) = Ba(OH)2 + H2
4) Fe2O3 + H2 = 2FeO + H2O
5) 2NaOH + H2SO4 = Na2SO4 + 2H2O
9 / 10
Из предложенного списка химических реакций выберите все, скорость которых увеличивается при повышении концентрации водорода.
1) N2 + 3H2 = 2NH3
2) CO + 2H2 = CH3OH
3) Zn + 2HCl = ZnCl2 + H2
4) C + H2O = CO + H2
5) C3H6 + H2 = C3H8
10 / 10
Из предложенного перечня выберите уравнения всех реакций, на скорость которых оказывает влияние измельчение простого вещества, участвующего в этой реакции.
1) Fe(тв.) + S(тв.) = FeS(тв.)
2) C(тв.) + O2(г) = CO2(г)
3) 3Br2(p-p) + 6KOH(p-p) = 5KBr(p-p) + KBrO3(p-p) + 3H2O(ж)
4) 4Mg(тв.) + 10HNO3(p-p) = 4Mg(NO3)2(p-p) + NH4NO3(p-p) + 3H2O(ж)
5) 2AgNO3(тв.) = 2Ag(тв.) + 2NO2(г) + O2(г)
Ваша оценка
The average score is 40%
При 353 К реакция заканчивается за 20 секунд. Сколько длится время реакции при 293 К, если температурный коэффициент этой реакции равен 2,5.
Решение задачи
Между скоростью протекания химических реакций и их продолжительностью (время реакции) существует обратно пропорциональная зависимость:
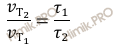
Где:
τ1 и τ2 – время протекания реакции
при температурах T1 и T2.
Правило Вант-Гоффа: скорость большинства химических реакций при повышении температуры на каждые 10 0C возрастает в 2 – 4 раза.
Правило Вант-Гоффа в данном случае можно записать в виде:
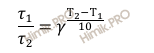
Откуда:
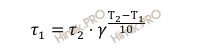
Получаем, что время реакции:
τ1 = 20 ⋅
2,5353-293 /10 = 20 ⋅
2,56
lg τ1 = lg 20 + 6 lg
2,5 = 3,6884
τ1 = 4879 с = 1 ч 21 мин 19 с.
При температуре 293 К эта реакция заканчивается за 1 час 21 минуту 19 секунд.
Ответ:
время реакции длится 1 ч 21 мин 19 с.
Скорость химической реакции — основное понятие химической кинетики, выражающее отношения количества
прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции:
моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в
другое в единице объема.
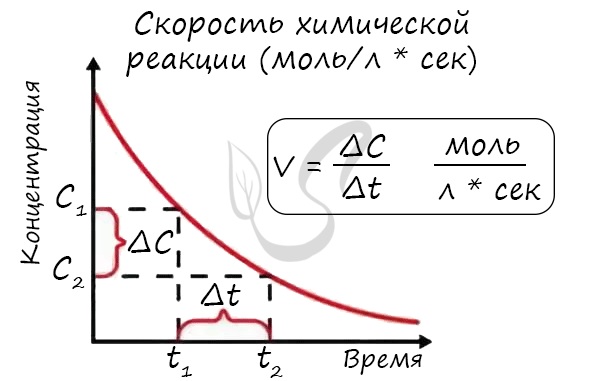
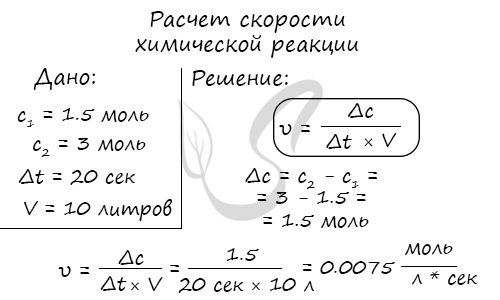
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость
реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции — 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд.
Рассчитайте скорость реакции.
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.

Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения
реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное
железо — железная стружка.

Химическая активность также играет важную роль. Например, отвечая на вопрос «какой из металлов Fe или Ca быстрее прореагирует с серой?» мы отдадим
предпочтение кальцию, так как в ряду активности металлов он стоит левее железа, а значит кальций активнее железа.

Иного подхода требуют реакции металлов с водой, где нужно учитывать радиус атома. Например, отвечая на вопрос «какой из металлов Li или K быстрее прореагирует с водой?» мы отдадим предпочтение калию, так как калий имеет больший радиус атома. Калий будет быстрее взаимодействовать с водой, чем литий.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас
я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота
относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации «прямо пропорционально» скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при
уменьшении — понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема
возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.

Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции
aA + bB → cC определяют по уравнению:
υ = k × СaA × СbB
Физический смысл константы скорости — k — в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих
веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени — a и b.
Записанное выше следствие закона действующих масс нужно не только «зазубрить», но и понять. Поэтому мы решим пару задач, где потребуется
написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции,
если объемы системы уменьшить в три раза?

По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции
образования аммиака, если уменьшить концентрацию водорода в два раза?

В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: «Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как
экзотермической, так и эндотермической. Исключений нет!»
Очень часто в заданиях следующей темы — химическом равновесии, вас будут пытаться запутать и ввести в заблуждение, но вы не поддавайтесь
и помните про постулат!
Итак, влияние температуры на скорость реакции «прямо пропорционально»: чем выше температура, тем выше скорость реакции — чем ниже
температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая «пропорция».
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так:
«При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза»

В формуле, написанной выше, используются следующие обозначение:
- υ1 — скорость реакции при температуре t1
- υ2 — скорость реакции при температуре t2
- γ — температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку.
Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
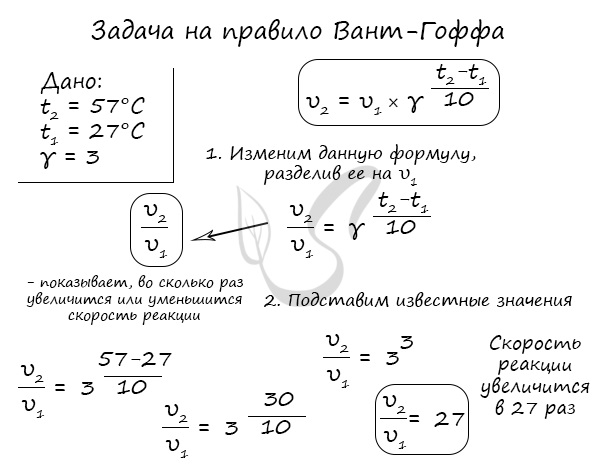
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: «Рассчитайте, чему равен температурный коэффициент
скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз».

Катализаторы и ингибиторы
Катализатор (греч. katalysis — разрушение) — вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов — белковых молекул, ферментов. Без катализаторов
подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора
— каталитическими.

Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества
являются ингибиторами.
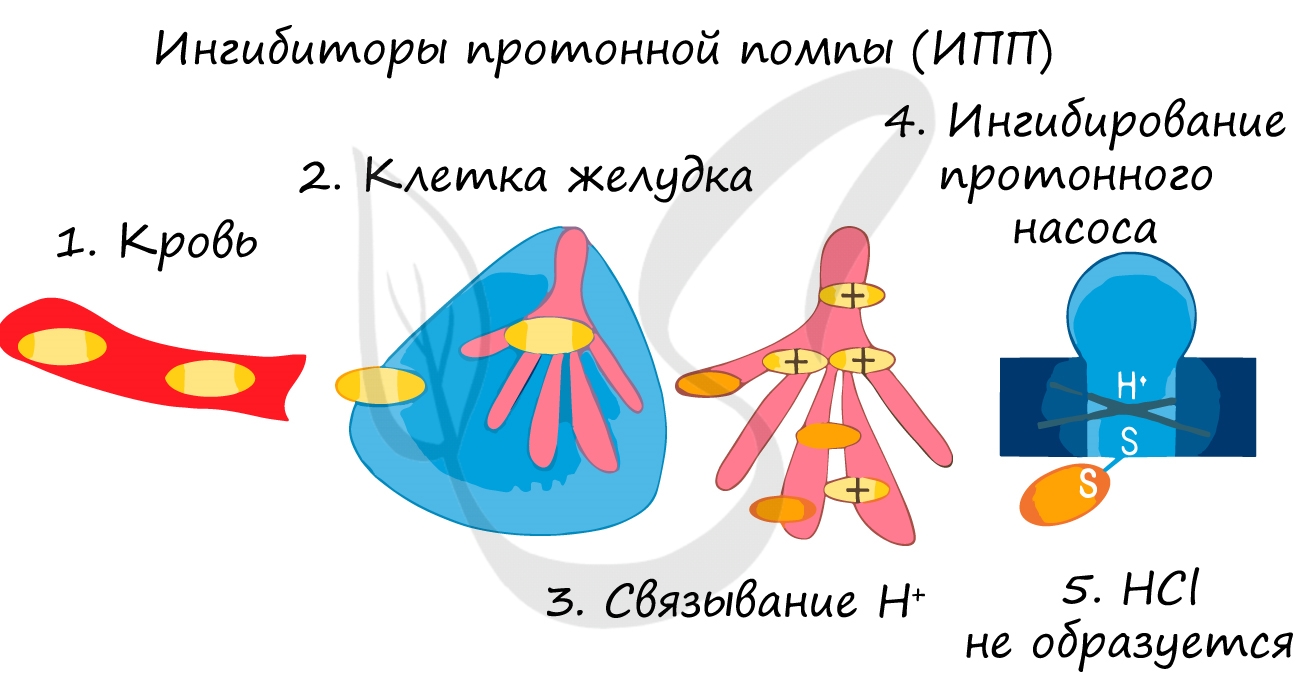
Так при лечении гастрита — воспаления желудка (греч. gaster — желудок) или язв часто назначаются ингибиторы протонной помпы — химические вещества,
которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка,
воспаление стихает.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Скорость
химической реакции характеризует
изменение концентрации веществ (реагентов
и продуктов реакции) во времени. Различают
реакции в газовых смесях или растворах
(гомогенные
реакции) и гетерогенные
реакции, когда хотя бы один реагент
находится в иной фазе, чем другие
(газ-жидкость, твердое тело-жидкость).
Скорость гомогенной
реакции измеряется изменением концентрации
реагентов (или продуктов) в единицу
времени. В гетерогенных реакциях
контролируется изменение концентрации
газовых или находящихся в растворе
компонентов:
.
Скорость реакций
зависит от природы и концентрации
реагирующих веществ, температуры,
давления (для газовых реакций), величины
поверхности раздела фаз (для гетерогенных
реакций), а также от присутствия и
количества катализаторов или ингибиторов.
Зависимость
скорости реакции от концентрации
реагентов выражается законом
действия масс
— для реакции aA + bB
cC :
,
т.е. скорость
реакции пропорциональна концентрации
реагирующих веществ.
k — фактор
пропорциональности, представляет собой
удельную скорость реакции (константу
скорости), т.е. скорость реакции при
единичных концентрациях компонентов
A и B. В отличие от скорости реакции
константа k не зависит от концентрации
растворов и является количественной
характеристикой процесса. В гетерогенных
реакциях концентрации конденсированных
компонентов (твердых тел или несмешивающихся
жидкостей) в уравнении закона действия
масс не учитываются. Так, скорость
реакции
CaO
(тв)
+ H2O
(ж)
Ca(OH)2
зависит только от
площади поверхности твердой CaO и
интенсивности перемешивания смеси.
Зависимость
константы скорости реакции от температуры
описывается уравнением
Аррениуса:
,
где
Z0
— количество соударений молекул (ионов,
атомов) реагентов в секунду в единице
объема, p — стерический фактор, показывающий,
какая доля всех соударений благоприятна
для данной реакции, e — основание
натуральных логарифмов, R — газовая
постоянная, T — температура (в K), Eакт
— энергия активации реакции.
Энергия активации
— избыточный запас энергии по отношению
к средней энергии молекул реагентов,
достаточный для протекания реакции.
Любая реакция протекает через образование
переходного состояния реакции
(активационная стадия) — т.е. состояние,
в котором старые связи окончательно не
разорвались, а новые еще не образовались:
A
+ B
[A Ч
Ч Ч B]
№
®
C.
Энергия активации
определяется при измерении нескольких
констант скорости при разных температурах
либо графически из зависимости ln(k)-1/T,
либо аналитически из уравнения Аррениуса
для каждой пары температур.
Зависимость
скорости от температуры для многих
реакций подчиняется эмпирическому
правилу
Вант-Гоффа:
при изменении температуры на 10 градусов
скорость реакции изменяется в 2 . . . 4
раза, т.е.

где
температурный
коэффициент g
=
2
. . . 4.
Большинство
химических процессов в определенных
условиях может протекать обратимо:
A
+ B
C + D.
В этом случае в
системе имеют место как прямая, так и
обратная реакции, причем по мере
превращения скорость прямой реакции
убывает, а обратной — возрастает. При
уравнивании обеих скоростей возникает
состояние динамического равновесия —
количество образовавшихся продуктов
реакции (C и D) в единицу времени равно
количеству распавшихся на исходные
вещества (A и B).
Химическое
равновесие реакции aA + bB
cC
+ dD характеризуется константой равновесия:
.
В
зависимости от необходимости различают
Kc
(константа равновесия, учитывающая
концентрации реагирующих партнеров),
Kp
(константа, учитывающая парциальные
давления газов) и Kf
(константа, учитывающая мольные доли
компонентов):


При
этом между Kc,
Kp
и Kf
существует простая связь:
,
,
где
Dn
— разность между суммой коэффициентов
компонентов реакции (Snпрод
— Snисх),
p0
— общее
давление газовой смеси. При Dn
=0 (реакция идет без изменения числа
молей) Kc=Kp=Kf
.
В этом случае
.
В общем же случае
при постоянной температуре
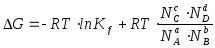
Примеры
решения задач
Задача
3.1.
Как
изменится скорость реакции 2A(раствор)
+ 3B(раствор)
®
4C(раствор)
(исходные концентрации [A]=5
моль/л,
[B]=6
моль/л)
после израсходования 60% компонента A?
Решение:
по уравнению реакции на 2 моль A расходуется
3 моля B. Прореагировало 5 Ч
0.6
= 3 моля A. Из пропорции:
2 моля A — 3 моля
B,
3 моля A — x молей
B
находим x = 4.5 молей
B.
Таким образом, в
реакционной смеси осталось (5-3)=2 моля A
и (6-4.5)=1.5 моля B. В соответствии с законом
действия масс начальная скорость реакции
.
После того, как
прореагировало 60% А:
,
.
Таким образом,
скорость реакции уменьшится в 400 раз.
Задача
3.2.
Написать выражения
закона действия масс для реакций:
1.
2 CO(газ)
+ O2(газ)
®
2
CO2(газ),
2.
CO2(газ)
+ C(тв)
®
2 CO(газ)
,
3.
CaO(тв)
+ H2O(ж)
®
Ca(OH)2(тв)
,
4.
NaOH(раствор)
+ HCl(раствор)
®
NaCl(раствор)
+
H2O(ж)
.
Решение:
в первой реакции участвуют реагенты в
газовом состоянии (система гомогенная),
следовательно:
.
Вторая реакция
проходит в гетерогенных условиях (газ
— твердое тело). Так как в химических
процессах меняются только концентрации
компонентов, находящихся в газовых
смесях или в растворах (концентрация
несмешивающихся жидкостей, а также
твердых компонентов постоянна), выражение
закона действия масс для этой реакции
.
Реакция
CaO + H2O
®
Ca(OH)2
гетерогенна: участвуют жидкость (H2O)
и твердое тело (CaO), концентрации которых
в процессе не изменяются. Следовательно:
.
В последнем случае
реакция гомогенна (раствор):
.
Задача
3.3.
Как
изменится скорость реакции
2A(газ)+3B(газ)®C(газ)
при повышении давления в 2 раза?
Решение:
увеличение давления в газовой реакции
связано с уменьшением реакционного
объема; при сохранении количества
веществ это означает увеличение их
концентрации. При увеличении давления
в 2 раза концентрация А и В увеличится
вдвое. Следовательно:
,
.
Скорость реакции
увеличится в 32 раза.
Задача
3.4.
Как
изменится скорость реакции
A(тв)+2B(газ)®3С(тв)
при уменьшении давления в 3 раза?
Решение:
при уменьшении давления уменьшится
концентрация только газового компонента
В, т.е. [B] уменьшится втрое.
,
.
Скорость реакции
уменьшится в 9 раз.
Задача
3.5.
Как
изменится скорость реакции 2 A + 3 B ®
С
при повышении температуры с 40 до 80°С
(температурный коэффициент Вант-Гоффа
равен 2)?
Решение:
в соответствии с правилом Вант-Гоффа

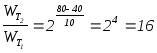
Скорость реакции
повысится в 16 раз.
Задача
3.6.
Как
следует изменить температуру, чтобы
понизить скорость химической реакции
в 1024 раза (g=2)?
Решение: 
;
,
;
;
.
Температуру реакции
следует понизить на 100 градусов.
Задача
3.7.
Как
изменится
скорость
реакции 4A(газ)+3B(газ)®3С(газ)
при повышении температуры на 35°С
и понижении давления в 2 раза? (Температурный
коэффициент скорости равен 3).
Решение:
при
повышении температуры скорость реакции
увеличится:
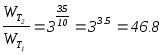
При понижении
давления скорость реакции уменьшится:

;
.
Следовательно
.
При одновременном
изменении давления и температуры
скорость реакции составит 0.3656 от
исходной.
Задача
3.8.
Найти
энергию активации реакции, если при
20°С
константа скорости реакции составляет
2,5 Ч
10—2,
а при 30°С
— 5,0 Ч
10—2
л/м Ч
с?
Решение:
в соответствии с законом Аррениуса
;
;
;
.
Вычтем из второго
уравнения первое:
,
,
51
134
Дж/моль
=
51.134
кДж/моль.
Задача
3.9.
В
реакции 2A(газ)+B(газ)
3С(газ)
равновесные концентрации составляют:
[A]=5 моль/л,
[B]= 3 моль/л,
[C]= 4 моль/л.
Найти
константу равновесия (Kc).
Решение: .
Задача
3.10.
Найти
константу равновесия (Kp)
реакции 2A(газ)+3B(газ)С(газ),
если после установления равновесия в
смеси содержится 30% А, 20% В и 50% С по объему
при общем давлении 2 атм.
Решение:
.
Парциальные
давления компонентов, учитывая закон
Авогадро, составляют:
Pi
=
Pобщ
Ч
Cмол
=
Pобш
Ч
Cоб.%,
PA
= 2 Ч
0.3 = 0.6 атм,
PB
= 2 Ч
0.2 = 0.4 атм,
PC
= 2 Ч
0.5 = 1.0 атм.
Отсюда:
.
Задача
3.11.
Найти
константу равновесия в газовой реакции
2A+5B3C+D,
если исходные концентрации [A]=5моль/л,
[B]=7моль/л, и к моменту установления
равновесия прореагировало 30% А.
Решение:
к моменту установления равновесия
прореагировало 5 Ч
0.3 = 1.5 моль/л компонента А. Найдем
количество прореагировавшего компонента
В и образовавшихся С и D. По уравнению
реакции
-
на 2 моля А
расходуется— 5 молей В;
1.5 моля A
— x молей В;
=>
;
из 2 молей А
образуется— 3 моля С;
1.5 моля A
— y;
=>
;
из 2 молей А
образуется—
1 моль D;1.5 моля A
—
z;=>
z=0.75.
Следовательно,
равновесные концентрации реагентов
составляют:
[A]равн
= 5 — 1.5 = 3.5 моль/л;
[B]равн
= 7 — 3.75 = 3.25 моль/л;
[C]равн
= 2.25 моль/л;
[D]равн
= 0.75 моль/л.
Тогда
.
Задача
3.12.
Используя
стандартные значения DH0
и DS0,
рассчитать
константу равновесия реакции N2+3H22NH3
при 1000°С.
(Зависимостью DH
и DS
от температуры пренебречь).
Решение:
N2(газ)
+
3 H2(газ)
2
NH3(газ).
ѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕ
DHобр
(кДж/моль)
0
0
-46
ѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕ
Sобр
192 131
192
(Дж/моль
Ч
К)
ѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕ
DHр =
-92 кДж/моль,
DS =
2 Ч
SобрNH3
— SобрN2
—
3
Ч
SобрH2
= 2 Ч
192
— 192 — 3 Ч
131
=
=
-201 Дж/моль Ч
К
= -0.201 кДж/моль Ч
К,
DG
= DH
— TDS
= -92 + 0.201 Ч
1273
=
= 163.87 кДж/моль,
DG
= — RT
Ч
ln
k,
.
Константа
равновесия реакции
.
Задача
3.13.
При
100°С
константа равновесия реакции A+B2C
равна 4. Найти равновесные концентрации
А, В и С, если исходные концентрации
[A]0=[B]0
= 2 моль/л.
Решение: 
Примем
[C]равн
= x моль/л, тогда количество прореагировавших
А и В определяем как x/2 молей и равновесные
концентрации [A] и [B] = (2- x/2) моль/л.
Подставив эти
величины в выражение константы равновесия,
получим

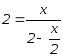
откуда x
= 2.
Следовательно:
[C]равн
= 2 моль/л;
[A]равн
= [B]равн
=(2 — 2/2) = 1 моль/л.
Растворы
— это гомогенные системы переменного
состава. Для характеристики относительного
содержания компонентов растворов
используют различные методы выражения
концентраций:
Массовые
(объемные) проценты
(%масс,
%об)
— процентное содержание растворенного
вещества, отнесенного ко всему раствору;
Молярная
концентрация
(M, моль/л) — количество молей растворенного
вещества в 1 л раствора;
Нормальная
концентрация
(н, моль/л) — количество эквивалентов
вещества, содержащихся в 1 л раствора;
Моляльная
концентрация
(m, моль/кг) — количество молей растворенного
вещества, приходящееся на 1 кг растворителя;
Мольная
доля (Ni)
— количество молей растворенного вещества
или растворителя, отнесенное к общей
сумме молей.
Связь между
свойствами растворов и их концентрацией
может быть выражена несколькими
уравнениями:
|
Для растворов |
Для растворов |
|
|
|
1-й |
|
Здесь
P0
— давление насыщенного пара над
растворителем, P — давление пара над
раствором, N2
— мольная доля растворенного вещества,
i — изотонический коэффициент.
|
Dtфп |
2-й |
Dtфп |
|
Dtкип |
Рауля |
Dtкип |
|
Dtкрист |
Dtкрист |
Здесь Dtкип
=
tкип.
раствора —
tкип.
растворителя,
Dtкрист
=
tкрист.
растворителя —
tкрист.
раствора,
E — эбулиоскопическая
постоянная растворителя,
K — криоскопическая
постоянная растворителя.
Осмотический
закон
Вант-Гоффа
Pосм=C
Ч
R
Ч
T;
Pосм=
i Ч
C
Ч
R
Ч
T.
где
Pосм
— осмотическое давление, С — молярная
концентрация растворенного вещества,
R — газовая постоянная.
Различие между
растворами неэлектролитов и электролитов
обусловлено присутствием в последних
большего числа частиц вследствие
электролитической диссоциации молекул
растворенного вещества (при одинаковой
концентрации обоих растворов).
.
При
этом
,где
i=1 для неэлектролитов, i>1 для электролитов.
Между константой
диссоциации, степенью диссоциации и
изотоническим коэффициентом существуют
простые связи:
(для
слабых электролитов
),
,
где N = m + n.
Вода — лучший
растворитель, обладающий высокой
ионизирующей способностью, является
чрезвычайно слабым электролитом:
H2O
H+
+ HO—,
а
точнее 2H2O
H3O+
+ HO—.
Степень
диссоциации воды »
2
Ч
10—9
при комнатной температуре. Поэтому
произведение концентраций ионов воды
является постоянной величиной (ионное
произведение воды):
KH2O
= [H+]
Ч
[HO—]
= 10—14
(при 22°C).
Концентрация
ионов водорода H+,
а чаще водородный
показатель
pH=-lg(CH+)
используется как мера кислотности
среды:
в
нейтральной среде [H+]=[HO—]=10—7;
pH
= 7,
в
кислой среде [H+]>[HO—]
>10—7;
pH < 7,
в
щелочной среде [H+]<[HO—]
<10—7;
pH > 7.
В
этих средах [H+]=
KH2O
/ [HO
—]=10
—14
/ [HO
—],
pH = 14 — pOH.
Для
труднорастворимых сильных электролитов
произведение концентраций ионов в
растворе (KnAm)
при постоянной температуре — величина
постоянная (произведение
растворимости
ПР), качественно указывающая на
растворимость этого электролита при
данной температуре:
KnAm
nKm+
+ mAn—,
ПР
= [Km+]n
Ч
[An—]m.
Низкие значения
ПР указывают на слабую растворимость
электролита. Вещество полностью
растворится, если произведение
концентраций ионов в растворе меньше
ПР, и выпадает в осадок, если это
произведение больше ПР.
При
растворении солей в воде наряду с
диссоциацией молекул на ионы в ряде
случаев имеет место обмен ионами между
солью и водой (гидролиз
солей):
KA
+ H2O
KOH + HA.
Учитывая, что в
этом равновесном процессе самым слабым
электролитом является вода, легко понять
невысокие степени гидролиза солей.
Степень гидролиза достигает значительных
величин лишь в условиях больших
разбавлений растворов, при повышенных
температурах и малой растворимости
продуктов гидролиза.
Рассмотрим несколько
примеров гидролиза солей:
А. При гидролизе
могут образовываться только сильные
кислоты и основания:
K+
+ A—
+ H2O
K+
+ HO—
+ H+
+ A—.
Наличие в системе
лишь одного слабого электролита (воды)
смещает равновесие в сторону исходной
соли — гидролиз не идет.
Б. При гидролизе
образуется слабое основание и сильная
кислота:
K+
+ A—
+ H2O
KOH + H+
+ A—
или
K+
+ H2O
KOH + H+,
pH<7.
Следовательно,
регулятором гидролиза является
образование некоторого количества
слабо-диссоциирующего основания и
понижение pH среды (среда кислая).
Соли, содержащие
многовалентные катионы, образуют при
гидролизе основные соли:
ZnCl2
+ H2O
Zn(OH)Cl + HCl,
Zn2+
+ H2O
(ZnOH)+
+ H+.
Гидролиз по 2-ой
стадии
(ZnOH)+
+ H2O
Zn(OH)2
+ H+
идет в значительно
меньшей степени.
В. При гидролизе
образуется сильное основание и слабая
кислота:
K+
+ A—
+ H2O
K+
+ HO—
+ HA
или
A—
+ H2O
HA + HO—,
pH>7.
Результатом
гидролиза является образование
слабодиссоциированной кислоты и
повышение pH среды (среда щелочная).
При гидролизе
солей, имеющих многовалентные анионы,
образуются кислые соли:
Na2CO3
+ H2O
NaHCO3
+ NaOH,
CO32—
+ H2O
HCO3—
+ HO—.
Г. При гидролизе
образуются слабые основания и кислота:
K+
+ A—
+ H2O
KOH + HA,
CH3COONH4
+ H2O
CH3COOH
+ NH4OH.
Уксусная
кислота (CH3COOH)
и гидроксид аммония (NH4OH)
— слабые электролиты, поэтому глубина
гидролиза в данном случае может быть
выше, чем в ранее рассмотренных случаях
(Б, В), но pH среды, определяющийся
относительной силой образующихся
кислоты и основания, близок к нейтральному.
Таким образом,
увеличению степени гидролиза способствует
разбавление раствора и повышение
температуры. Снижение гидролиза может
быть достигнуто повышением концентрации
соли в растворе, снижением температуры
и добавлением к раствору сильных кислот
(Б) или оснований (В).
Примеры
решения задач
Задача
4.1.
Найти
количество воды и NaNO3,
необходимые для приготовления 2 л 22%
раствора (d=1.14 г/мл).
Решение:
масса 2 л раствора составляет 2 Ч
1.14 = 2.28 кг. Следовательно:
|
22 |
— |
100 |
|
х г |
— |
2280 |
х
= 501.6 г NaNO3.
Отсюда
масса воды mH2O
= 2280 — 501.6 = 1778.4 г.
Задача
4.2.
Рассчитать
мольную долю, молярную, нормальную и
моляльную концентрацию 78% раствора
H2SO4
(d=1.70 кг/дм3).
Решение:
прежде чем решать задачу, проанализируем
ее исходные данные: по условиям 78 г H2SO4
(78/98=0.796
молей) содержится в 100 г (100/1.7=58.8мл)
раствора, т.е. на 0.796 молей H2SO4
приходится (100-78)/18=1.222 моля H2O.
Таким
образом, мольная доля H2SO4:

0.796 / (0.796 + 1.222) = 0.3944.
Моляльная
концентрация (количество молей вещества
на 1000 г растворителя):
|
0.796 |
— |
22 |
|
m |
— |
1000 |
m
= (0.796 Ч
1000)/22
= 36.18 моль/кг.
Молярная концентрация
(количество молей вещества в 1 л раствора):
|
0.796 |
— |
58.8 |
|
М |
— |
1000 |
M
= (0.796 Ч
1000)/58.8
= 13.5 моль/л.
Так
как эквивалент H2SO4
составляет
1/2 моля, то
N
= 2 Ч
M
= 2 Ч
13.5
= 27 моль/л.
Задача
4.3.
Какое
количество 45.5% KOH (d=1.46 г/см3)
потребуется для полной нейтрализации
0.5 л 2н серной кислоты?
Решение:
в 0.5 л 2н H2SO4
содержится
1 эквивалент (0.5 моля) кислоты, следовательно,
для ее нейтрализации потребуется 1
эквивалент (1 моль) щелочи.
В 100 г раствора KOH
(100 : 1.46 = 68.5 мл) содержится 45.5 г (45.5/56 =
0.8125 моля) KOH. Составим пропорцию:
|
0.8125 моля KOH |
— |
685 мл раствора, |
|
1 моль |
— |
х |
Таким образом,
объем щелочи составляет
(68.5
Ч
1)
: 0.8125 = 84.3 мл.
Задача
4.4.
Рассчитать
давление пара раствора, содержащего
100 г сахарозы C12H22O11
в 800 мл воды, если давление насыщенных
паров воды при температуре 25°С
составляет 3.167 кПа.
Решение:
согласно закону Рауля давление пара
над раствором составляет P1
= NH2OPH2O,
где P1
— давление пара над раствором, PH2O
—
давление пара над чистым растворителем,
а NH2O
—
мольная доля растворителя в растворе.
MC12H22O11
= 342 г/моль
MH2O
= 18 г/моль
Следовательно:

Поэтому давление
паров воды над раствором
P1
= N1
Ч
P0
= 0.9935 Ч
3.167
= 3.146 кПа = 3146 Па.
Задача
4.5.
Найти
температуру кипения и замерзания 20%
раствора фенола (C6H5OH)
в воде.
Решение:
согласно закону Рауля Dtкип
= E Ч
m,
Dtзам
= K Ч
m,
где m — моляльная
концентрация.
KH2O=1.86°C,
EH2O=0.52°C.
Найдем моляльную
концентрацию раствора:
|
20 |
содержится в 80 |
|
|
x |
— |
в |
Из
этой пропорции: x
= 0.2128 Ч
1000/80=2.66
моль/кг.
Следовательно:
Dtкип
= 0.52 Ч
2.66
= 1.38°C,
Dtзам
= 1.86 Ч
2.66
= 4.95°C.
Таким
образом, температура кипения раствора
101.38°C,
а температура замерзания — 4.95°C.
Задача
4.6.
Найти
осмотическое давление раствора, в 1.5 л
которого содержится 300 г глюкозы
(C6H12O6),
при 25°C.
Решение:
согласно закону Вант-Гоффа Pосм
= C Ч
RT.
Молярная концентрация раствора составляет
(молекулярная масса глюкозы = 180):
C
= 300 / 1.5 Ч
180
= 1.11 кмоль/м3.
Следовательно,
Pосм
= 1.11 Ч
8.314
Ч
298
= 2753 кПа.
Задача
4.7.
Найти
процентную концентрацию раствора
глюкозы, замерзающего при -5°C.
Решение: Dtзам
= K Ч
m,
m
= Dtзам
/ K = 5/1.86 = 2.6882 моль/кг.
Таким
образом, на 1000 г воды в растворе приходится
2.6882 Ч
Mгл
= 2.6882 Ч
180
= 483.9 г глюкозы.
Следовательно:
|
в (483.9 г глюкозы |
содержится 483.9 |
|
|
100 г |
— |
x. |
x
= (483.9 Ч
100)
/ 1483.9 = 32.6%.
Задача
4.8.
Рассчитать
объемы воды и этиленгликоля (C2H6O2,
M=62 г/моль, d=1.1088 г/см3),
необходимые для получения 5 л антифриза
(d=1.0713 кг/дм3),
замерзающего при-40°С.
Решение:
Dt
= K Ч
m,
m
= Dt
/ K = 40/1.86 = 21.5 моль/кг.
Следовательно,
на 1 кг воды в антифризе приходится 21.5
Ч
62
= 1333 г этиленгликоля.
Масса
5 л антифриза составляет 5 Ч
1.0713 =
5.356 кг. Следовательно:
|
в (1000 + 1333), т.е. в |
содержится 1333 г |
|
|
5356 г |
— |
x. |
x
=(5356 Ч
1333)
/ 2333 = 3077 г = 3.077 кг,
масса воды 5356 —
3077 = 2279 г = 2.279 кг.
Таким образом, для
получения 5 л антифриза потребуется
3.077 : 1.1088=2.775 л этилен-гликоля и 2.279 л воды.
Задача
4.9.
Раствор
1 г нитробензола в 65 г бензола застывает
при 4.86°С.
Температура кристаллизации бензола
5.5°С,
К=5.12°С.
Рассчитать молекулярную массу
нитробензола.
Решение:
|
1 г нитробензола |
растворен в 65 г |
|
|
х |
— |
в |
x = 1000/65 = 15.38 г.
Dtкр
= 5.5 —
4.86
= 0.64°С
= K Ч
m
= 5.12 Ч
m.
Отсюда m = 0.64 / 5.12 =
0.125 моль/кг.
Следовательно,
15.38 г нитробензола составляют 0.125 моля
и M = 15.38/0.125 = 123 г/моль, что действительно
соответствует формуле C6H5NO2.
Задача
4.10.
Рассчитать
кажущуюся степень диссоциации Na2CO3
в
растворе, если при растворении 1.06 г его
в 200 мл воды температура кипения повысилась
на 0.062°С.
Решение:
Na2CO3
— электролит. По закону Рауля Dtкип=iЧEЧm.
Находим моляльную концентрацию раствора:
|
1.06г |
растворено |
|
|
m |
— |
в |
m
= (0.01 Ч
1000)
/ 200 = 0.05 моль/кг.
Тогда изотонический
коэффициент
.
.
Задача
4.11.
Рассчитать
процентную концентрацию раствора KOH,
если он замерзает при -0.519°С.
Степень диссоциации щелочи в растворе
0.86.
Решение: ,
i
= a
+
1 = 0.86 + 1 = 1.86,
Dt=0-(-0.519)=0.519.
По
закону Рауля Dtзам
=
i Ч
K
Ч
m,
отсюда:
m
= Dtзам
/
i
Ч
K
= 0.519 / (1.86 Ч
1.86)
= 0.15 моль/кг.
Составим пропорцию:
|
0.15 |
содержится в |
|
|
x |
— |
в |
x
= (8.4 Ч
100)
/ 1008.4 = 0.833 г.
В 100 г раствора
содержится 0.833 г KOH, т.е. процентная
концентрация раствора равна 0.833%.
Задача
4.12.
Произведение
растворимости AgBr составляет 5.3Ч10—13
при 25°С.
Вычислить растворимость соли (моль/л)
при данной температуре.
Решение:
обозначим растворимость AgBr за S моль/л.
Тогда концентрации [Ag+]=[Br—]=S
моль/л. Следовательно, ПР = 5.3
Ч
10—13
= S2,
и отсюда:
=
7.28
Ч
10—7
моль/л.
Задача
4.13.
Возможно
ли получение 0.001% раствора Ba3(PO4)2
(м.м.=538) при комнатной температуре?
ПРBa3(PO4)2
=
6 Ч
10—39.
Решение:
если принять концентрацию соли за S
моль/л, то [Ba2+]=3S,
[PO43—]=2S.
ПР
= 6 Ч
10—39
=
[Ba2+]3
Ч
[PO43—]2
=
(3S)3
Ч
(2S)2
=
108
Ч
S5,
моль/л
Таким
образом, в 1 л раствора (плотность его
можно принять за 1 г/см3)
содержится
8.89
Ч
10—9
Ч
M
= 8.89
Ч
10—9
Ч
538
=4.783
Ч
10—6
г.
Следовательно,
концентрация насыщенного раствора не
может быть больше чем
|
4.783 |
— |
в 1000 г раствора, |
|
x |
— |
в |
x
= 4.783
Ч
10—7%.
Задача
4.14.
Насыщенный
раствор BaCrO4
при некоторой температуре содержит 3.8
Ч
10—4%
соли. Рассчитать ПРBaCrO4.
Решение:
в 100 г раствора, плотность которого можно
принять за 1 г/см3,
содержится 3.8 Ч
10—4
г соли. В 1 л раствора содержится 3.8 Ч
10—3
г соли. То есть концентрация соли (м.м.
BaCrO4
=253)
составит:
3.8
Ч
10—3
/
253 = 1.5 Ч
10—5
моль/л,
ПР
= [Ba2+]
Ч
[CrO42—]=
(1.5 Ч
10—5)2
= 2.25 Ч
10—10.
Задача
4.15.
Образуется
ли осадок Ag2SO4,
если к 0.01М раствору AgNO3
добавить равный объем 0.25М раствора
K2SO4?
(ПРAg2SO4
= 2 Ч
10—5)
Решение:
при смешивании растворов концентрации
растворов уменьшаются вдвое. Следовательно,
[Ag+]=0.005
моль/л, [SO42—]=0.125
моль/л. Тогда
[Ag+]2
Ч [SO42—]=
(0.005)2
Ч
(0.125)
= 3.125 Ч
10—6.
3.125
Ч
10—6
< ПР=2 Ч
10—5,
поэтому осадок не образуется.
Под
химическими
источниками тока
(ХИТ) подразумевают устройства, в которых
химическая энергия гетерогенных
окислительно-восстановительных реакций,
происходящих на поверхности электродов,
может быть преобразована в электрическую
энергию. Электрод, на поверхности
которого происходит восстановление,
называют катодом;
электрод, на поверхности которого
происходит окисление, называют анодом.
В
основе работы таких устройств лежат
явления, происходящие на границе раздела
между металлом и раствором (расплавом)
электролита, связанные с возникновением
скачка потенциала (электродного
потенциала). Электродный
потенциал
(j)
зависит от природы металла, активности
(концентрации) катионов металла в
растворе (расплаве) и температуры.
Электродный потенциал при стандартных
условиях, т.е. при активности (концентрации)
катионов металла 1 моль/л и температуре
298 К называют стандартным (j0).
Стандартные электродные потенциалы,
измеренные относительно эталонного
водородного электрода, сведены в ряд
напряжений. Потенциал водородного
электрода (Pt, H2/H2SO4)
при стандартных условиях принят за
нуль.
Электродные
потенциалы любых окислительно-восстановительных
систем (редокс-потенциалы)
можно рассчитать по уравнению
Нернста:
,
где
j0
— стандартный потенциал (В), R — универсальная
газовая постоянная (ДжЧмоль—1ЧК—1),
n — число электронов, участвующих в
окислительно-восстановительном процессе,
Т — температура (К), F — постоянная Фарадея
(Кл), [Ox] — концентрация окисленной формы,
[Red] — концентрация восстановленной
формы.
Подставив значения
постоянных (R=8.314, T=298, F=96500) и приведя
натуральные логарифмы к десятичным,
получим
,
а для системы
«металл-раствор соли металла»:
.
Движущей
силой любой химической реакции является
уменьшение свободной энергии Гиббса
(DG),
определяющей максимальную работу
реакции. Максимальную работу ХИТ
совершает в условиях равновесной
реакции, которая возможна только при
нулевой силе тока (I=0). В этих условиях
DG
= -Amax
= Q Ч
Umax
= Q Ч
E,
где
Q — количество электричества, U ‑
напряжение, E
— электродвижущая
сила
ХИТ (ЭДС). То есть
DG
= — n Ч
F Ч
E,
или в стандартных условиях DG0
= — n Ч
F Ч
E
0.
Таким
образом, ЭДС — разность потенциалов ХИТ,
измеряемая компенсационным путем в
условиях равновесных электродных
процессов (I=0 А). Отсюда E
>
0, поэтому расчет ЭДС гальванической
системы ведут по схеме
E
= jкатода
— jанода
(катод
— электрод с бóльшим
значением j,
анод
— с мéньшим).
Например, для системы, состоящей из
металлов А и В, опущенных в растворы их
солей:

| соль MeA
|| соль MeB
| MeB
jMeB
> jMeA;
MeA
— анод, MeB
— катод.
Электродные
процессы в ХИТ:
К:
MeBn+
+
n e—
ѕ®
MeB,
А:
MeA
—
m e—
ѕ®
MeAm+.
При этом количество
электронов, участвующих в катодном и
анодном процессах, должно быть одинаковым.
Электролизом
называют совокупность процессов,
происходящих при прохождении постоянного
электрического тока через расплав или
раствор электролита. Восстановительные
(катодные) и окислительные (анодные)
процессы происходят в соответствии с
величиной электродного потенциала.
На
катоде легче восстанавливаются частицы
с бóльшим
электродным потенциалом, на аноде легче
окисляются частицы с мéньшим
электродным потенциалом.
При
определении процессов, протекающих на
катоде
при электролизе водных растворов,
следует помнить:
1. Легко
восстанавливаются ионы металлов с
положительными значениями электродных
потенциалов.
2.
Ионы металлов с умеренно отрицательными
значениями потенциалов (Zn2+,
Fe2+,
Cd2+,
Ni2+
и другие) восстанавливаются одновременно
с восстановлением ионов водорода (в
кислой среде) или воды (в нейтральной
или щелочной среде):
2H+
+ 2e—
ѕ®
H2,
2H2O
+ 2e—
ѕ®
H2
+ 2OH—.
3.
Ионы металлов с высокоотрицательными
значениями электродных потенциалов (j
<
-1.66 В, то есть от Li+
до Al3+
в ряду напряжений) ни при каких условиях
не восстанавливаются при электролизе
водных растворов.
При
определении анодных
процессов
следует помнить:
1.
При использовании металлических анодов
(металлы с j0
<
0.8 В) окисляется материал анода:
Me0
— n e—
ѕ®
Men+.
2.
На инертных электродах при электролизе
водных растворов легко окисляются
одноатомные бескислородные анионы
(кроме F—).
3. Кислородсодержащие
анионы при электролизе водных растворов
практически не окисляются. В этих случаях
идет окисление воды:
2H2O
— 4 e—
ѕ®
O2
+ 4H+.
Количественно
процессы электролиза описываются
законом
Фарадея:
количество вещества, претерпевающего
превращения при электролизе, пропорционально
количеству прошедшего через электролит
электричества.
m
=
k
Ч Q
или
(для
любых веществ),
(для
газообразных веществ),
где
m и V — масса и объем, I — сила тока, t — время,
F — постоянная Фарадея (96500 Кл или 26.8
АЧчас),
mэкв
и Vэкв
— эквивалентная масса и объем данного
вещества. При
пропускании 96500 Кл или 26.8 АЧчаса
электричества превращается 1 эквивалент
вещества.
Отношение
экв/F называют электрохимическим
эквивалентом,
т.е. оно характеризует количество
вещества, превращающегося при пропускании
1 Кл (АЧс)
или 1 АЧчаса
электричества.
В условиях реального
электролиза закон Фарадея в приведенной
форме не выполняется, поэтому вводят
поправку на выход по току:
,
где
h
-эмпирическая
величина (в % или долях от 1), характеризующая
неидеальность процесса:
%.
Для расчета расхода
электроэнергии используют уравнение
W
= Q Ч
U,
где
Q — количество электричества, U — напряжение
в сети, В. При расчете нужно помнить, что
1 А Ч
с
Ч
В=1Вт
Ч
с,
поэтому
.
Примеры
решения задач
Задача
5.1.
Рассчитать
электродный потенциал системы Cu | CuSO4
(0.01 М).
Решение:
расчет
проводим по уравнению
j
= j0+(RT/nF)
lg(CMen+)
= j0+(0.059/n)
lg(CCu2+),
j0Cu2+=0.338;
n=2,
j
= 0.338 + (0.059/2) lg(10—2)
= 0.279 В.
Задача
5.2.
Рассчитать
электродный потенциал водородного
электрода при pH=2, 7, 14.
Решение:
j =
j0+(0.059/n)
lg
CMen+
=
=
j0H+/H
+ 0.059 lg CH+=
=
0 + 0.059 lg CH+
=
= -0.059 pH,
т.к.
pH=-lg(CH+).
Отсюда jpH=2
=
-2 Ч
0.059 = -0.118 В,
jpH=7
=
-7 Ч
0.059 = -0.413 В,
jpH=14=
-14 Ч
0.059 = -0.826 В.
Задача
5.3.
Рассчитать
электродный потенциал системы Pt,H2|H2S
(С=0.01 моль/л, КД(1)=6Ч10—8).
Решение:
для расчета потенциала этого водородного
электрода необходимо найти концентрацию
ионов водорода в растворе (или pH). H2S
— слабый электролит:
H2S
H+
+ HS—.
.
Следовательно, [H+]
= aC
= 2.45 Ч
10—3
Ч
0.01
= 2.45 Ч
10—5.
pH
= — lg CH+
= — lg 2.45
Ч 10—5
= 4.61;
j
=
-0.059 pH = -0.059
Ч 4.61
= -0.272 В.
Задача
5.4.
Рассчитать
потенциал водородного электрода
Pt,H2|NaOH
(С=0.01 моль/л).
Решение:
для расчета pH раствора используем ионное
произведение воды:
NaOH
Na+
+ HO—,
[HO—]
= [NaOH] = 0.1 М.
Следовательно, [H+]=KH2O/[HO—]=10—14/0.1=10—13.
pH=-lg(CH+)
= 13;
j
= -0.059 pH = -0.059
Ч 13
= -0.767 В.
Задача
5.5.
Определить ЭДС
гальванического элемента
Zn
| ZnSO4
||
Fe(NO3)3
|
Fe
0.01
моль/л 0.1 моль/л
и привести схему
электродных процессов.
Решение:
jZn|Zn2+
= -0.763 + lg(0.01)
Ч 0.059/2
= -0.822 В,
jFe|Fe3+
= -0.037 + lg(0.1)
Ч 0.059/3
= -0.057 В.
jFe|Fe3+
> jZn|Zn2+
, следовательно, железный электрод
является катодом, а цинковый — анодом.
К:
2Fe3+
+ 6e ѕ®
2Fe.
А:
3Zn — 6e ѕ®
3Zn2+.
E
= jК
— jА
= -0.057 — (-0.822) = 0.765 В.
Задача
5.6.
Определить ЭДС
концентрационного элемента и привести
схему электродных процессов:
Cr
| Cr2SO4
|| CrCl2
| Cr
0.1
моль/л 0.001 моль/л
Решение:
j1
= -0.91 + lg(0.1)
Ч 0.059/2
= -0.9395 В,
j2
= -0.91 + lg(0.01)
Ч 0.059/2
= -0.9985 В.
Следовательно,
катодом является электрод ,
а анодом — электрод .
К
(электрод ):
Cr2++
2e ѕ®
Cr.
А
(электрод ):
Cr — 2e ѕ®
Cr2+.
E
= j1
— j2
= 0.059 В.
Задача
5.7.
Определить ЭДС и
написать электродные процессы в
гальваническом элементе:
H2(Pt)
| HCl || NaOH | (Pt)H2
0.1
моль/л 0.01 моль/л
Решение:
jH|H+
= -0.059 pH.
В
сильной кислоте [H+]=0.1,
т.е. pH=1, следовательно, jH|H+
= -0.059 В.
В
щелочи [HO—]=0.01
м/л, значит, [H+]=
10—14/0.01
= 10—12
и pH=12.
Следовательно,
потенциал этого электрода:
j
= -0.059
Ч 12
= -0.708 В.
Отсюда:
E
= -0.059 — (-0.708) = 0.649 В.
К:
2H++
2e ѕ®
H2
(электрод
с HCl).
А:
H2
— 2e ѕ®
2H+
(электрод
с NaOH).
Задача
5.8.
Найти
концентрацию (моль/л) FeCl2
в гальваническом элементе:
Mn
| MnSO4
|| FeCl2
| Fe,
0.01
моль/л x моль/л
если ЭДС элемента
составляет 0.7215 В.
Решение:
jMn|Mn2+
= -1.192 + lg(0.01)
Ч 0.059/2
= -1.251 В.
0.7215
=
jFe|Fe2+
—
(-1.251), значит jFe|Fe2+=-0.5295
В.
jFe|Fe2+
= -0.441 + lg(x)
Ч 0.059/2
= -0.5295 В.
Следовательно, lg
x = (-0.5295+0.441)/0.0295 = -3.
Поэтому
[FeCl2]
= 0.001 моль/л.
Задача
5.9.
Определить
количество алюминия, которое можно
получить при электролизе Al2O3
током 25А в течение 24 часов при выходе
по току 88%.
Решение:
учитывая, что при пропускании 26.8 АЧчаса
(1F) электричества можно получить 1 экв.
алюминия (9 г), составим пропорцию:
|
26.8 |
— |
9 |
|
25 |
— |
х |
откуда
х = 25 Ч
24
Ч
9
/ 26.8 = 201.5 г.
Однако из-за 88%
выхода по току практически получаемое
количество Al составит
mAl
= 201.5 Ч
0.88
= 177.3 г.
Задача
5.10.
Определить время,
которое потребуется для получения 100 л
водорода (н.у.) электролизом раствора
NaOH током 3А при выходе по току 75%.
Решение:
1 F (26.8 А Ч
ч)
расходуется на получение 1 экв. водорода
(11.2 л), следовательно:
|
26.8 |
— |
11.2 |
|
3 |
— |
100, |
откуда
t = (26.8 ×
100)/(3 ×
11.2) = 79.8 часа.
Практически же
потребуется из-за 75% выхода по току
tпр
= t / 0.75 = 106.3 часа.
Задача
5.11.
Ток силой 10 А
пропускали через 0.5 кг 5%-го раствора
NaOH. Через сколько часов концентрация
раствора увеличится вдвое? Выход по
току считать 100%.
Решение:
при электролизе водного раствора щелочи
происходит разложение воды с выделением
водорода на катоде и кислорода на аноде.
Следовательно, концентрация щелочи по
ходу электролиза возрастает. Количество
NaOH в растворе постоянно и равно
0.05 ×
500=25 г. Обозначим убыль воды за х грамм.
Тогда масса раствора составит (500-х) г.
Следовательно, в 10% растворе щелочи:
25 / (500-х) = 0.1
25
= 50 — 0.1 ×
х
0.1
×
х = 25
х = 250 г.
То есть чтобы вдвое
увеличить концентрацию щелочи в растворе,
необходимо разложить 250 г воды.
Найдем время t, за
которое пройдет разложение этого
количества воды из пропорции
|
26.8 |
— |
9 |
|
10 |
— |
250. |
Отсюда
t = (26.8 ×
250)/(10 ×
9) = 74.4 часа.
Задача
5.12.
Определить
объем кислорода (н.у.), который можно
получить, затратив 100 кВт ×
ч электроэнергии при напряжении в сети
10 В и выходе по току 79%.
Решение:
известно, что количество электроэнергии
(W) и количество электричества (Q) связаны
уравнением:
W
= Q ×
U
100
кВт ×
ч = 100 000 Вт ×
ч = Q ×
10 В
Q
= 100 000 / 10 = 10 000 А ×
час
Отсюда:
|
26.8 |
— |
5.6 |
|
10 |
— |
х |
Из
этой пропорции находим х = (10000 ×
5.6)/26.8 = 2089.6 л.
С учетом выхода
по току количество кислорода, которое
можно получить при этих условиях,
Vкисл
= 2086.6 ×
0.79 = 1650.7 л.
Задача
5.13.
Укажите наиболее
коррозионно-опасный контакт металлов:
Cu/Fe, Cr/Co, Mg/Ni
Решение:
в одинаковых условиях скорость коррозии
пропорциональна разности потенциалов
металлов в контакте (ЭДС элемента).
-
Cu/Fe
Cr/Co
Mg/Ni
j0,
В0.338
—
0.441— 0.91
—
0.234— 2.37
—
0.25E,
В0.779
0.676
2.12
Следовательно,
наиболее коррозионно-опасным является
контакт Mg/Ni.
Задача
5.14.
Укажите катодные
(опасные) и анодные (неопасные) покрытия
железа:
Sn/Fe, Cu/ Fe, Cr/ Fe
Решение:
катодным для железа является покрытие
металлом, имеющим больший электродный
потенциал, т.е. в гальванической паре с
железом металл покрытия должен выполнять
катодные функции (анод — железо). Такие
покрытия опасны — при повреждении
покрытия развивается подповерхностная
коррозия (разрушение железа под
покрытием). Анодным является покрытие
железа более активным металлом, имеющим
более низкий электродный потенциал.
Металл такого покрытия выполняет роль
анода. В приведенных примерах:
|
Sn/Fe |
Cu/Fe |
Cr/Fe |
|||
|
— 0.14 |
— |
+ 0.338 |
— |
— 0.91 |
— |
Покрытия оловом
и медью являются катодными, хромом —
анодным.
Задача
5.15.
Напишите электродные
процессы при коррозии для контактов:
Fe/Zn
в HClразб,
Fe/Sn во влажном
воздухе,
Cu/Zn в серной
кислоте.
Решение:
1.
В паре Fe-0.441/Zn-0.763
анодом является цинк, следовательно:
|
А: |
Zn — 2e |
¾® |
Zn2+, |
|
К: |
2H+ |
¾® |
H2. |
2.
В паре Fe-0.441/Sn-0.14
анодом является железо, следовательно:
|
А: |
2Fe — 4e |
¾® |
2Fe2+, |
|
К: |
O2 |
¾® |
4HO—. |
3.
В паре Cu+0.338/Zn-0.763
анодом является цинк, следовательно:
|
А: |
2Zn — 4e |
¾® |
2Zn2+, |
|
К: |
O2 |
¾® |
2H2O. |
Задачи и упражнения
по общей химии
Сергей Петрович
Коршунов
Валентина Михайловна
Казанцева
Редактор Н.А.
Фомичева
Подписано в печать
5.10.98. Печать оперативная. Усл. п.л.
2,5.
Уч.-изд. л. 2,3. Тираж экз.
Заказ № .
Тольяттинский
политехнический институт
Тольятти, ул.
Белорусская, 14
38
1.4.3. Скорость реакции, ее зависимость от различных факторов.
Некоторые химические реакции происходят практически мгновенно (взрыв кислородно-водородной смеси, реакции ионного обмена в водном растворе), вторые — быстро (горение веществ, взаимодействие цинка с кислотой), третьи — медленно (ржавление железа, гниение органических остатков). Известны настолько медленные реакции, что человек их просто не может заметить. Так, например, преобразование гранита в песок и глину происходит в течение тысяч лет.
Другими словами, химические реакции могут протекать с разной скоростью.
Но что же такое скорость реакции? Каково точное определение данной величины и, главное, ее математическое выражение?
Скоростью реакции называют изменение количества вещества за одну единицу времени в одной единице объема. Математически это выражение записывается как:
Где n1 и n2 – количество вещества (моль) в момент времени t1 и t2 соответственно в системе объемом V.
То, какой знак плюс или минус (±) будет стоять перед выражением скорости, зависит от того, на изменение количества какого вещества мы смотрим – продукта или реагента.
Очевидно, что в ходе реакции происходит расход реагентов, то есть их количество уменьшается, следовательно, для реагентов выражение (n2 — n1) всегда имеет значение меньше нуля. Поскольку скорость не может быть отрицательной величиной, в этом случае перед выражением нужно поставить знак «минус».
Если же мы смотрим на изменение количества продукта, а не реагента, то перед выражением для расчета скорости знак «минус» не требуется, поскольку выражение (n2 — n1) в этом случае всегда положительно, т.к. количество продукта в результате реакции может только увеличиваться.
Отношение количества вещества n к объему, в котором это количество вещества находится, называют молярной концентрацией С:
Таким образом, используя понятие молярной концентрации и его математическое выражение, можно записать другой вариант определения скорости реакции:
Скоростью реакции называют изменение молярной концентрации вещества в результате протекания химической реакции за одну единицу времени:
Факторы, влияющие на скорость реакции
Нередко бывает крайне важно знать, от чего зависит скорость той или иной реакции и как на нее повлиять. Например, нефтеперерабатывающая промышленность в буквальном смысле бьется за каждые дополнительные полпроцента продукта в единицу времени. Ведь учитывая огромное количество перерабатываемой нефти, даже полпроцента вытекает в крупную финансовую годовую прибыль. В некоторых же случаях крайне важно какую-либо реакцию замедлить, в частности коррозию металлов.
Так от чего же зависит скорость реакции? Зависит она, как ни странно, от множества различных параметров.
Для того чтобы разобраться в этом вопросе прежде всего давайте представим, что происходит в результате химической реакции, например:
A + B → C + D
Написанное выше уравнение отражает процесс, в котором молекулы веществ А и В, сталкиваясь друг с другом, образуют молекулы веществ С и D.
То есть, несомненно, для того чтобы реакция прошла, как минимум, необходимо столкновение молекул исходных веществ. Очевидно, если мы повысим количество молекул в единице объема, число столкновений увеличится аналогично тому, как возрастет частота ваших столкновений с пассажирами в переполненном автобусе по сравнению с полупустым.
Другими словами, скорость реакции возрастает при увеличении концентрации реагирующих веществ.
В случае, когда один из реагентов или сразу несколько являются газами, скорость реакции увеличивается при повышении давления, поскольку давление газа всегда прямо пропорционально концентрации составляющих его молекул.
Тем не менее, столкновение частиц является, необходимым, но вовсе недостаточным условием протекания реакции. Дело в том, что согласно расчетам, число столкновений молекул реагирующих веществ при их разумной концентрации настолько велико, что все реакции должны протекать в одно мгновение. Тем не менее, на практике этого не происходит. В чем же дело?
Дело в том, что не всякое соударение молекул реагентов обязательно будет эффективным. Многие соударения являются упругими – молекулы отскакивают друг от друга словно мячи. Для того чтобы реакция прошла, молекулы должны обладать достаточной кинетической энергией. Минимальная энергия, которой должны обладать молекулы реагирующих веществ для того, чтобы реакция прошла, называется энергией активации и обозначается как Еа. В системе, состоящей из большого количества молекул, существует распределение молекул по энергии, часть из них имеет низкую энергию, часть высокую и среднюю. Из всех этих молекул только у небольшой части молекул энергия превышает энергию активации.
Как известно из курса физики, температура фактически есть мера кинетической энергии частиц, из которых состоит вещество. То есть, чем быстрее движутся частицы, составляющие вещество, тем выше его температура. Таким образом, очевидно, повышая температуру мы по сути увеличиваем кинетическую энергию молекул, в результате чего возрастает доля молекул с энергией, превышающей Еа и их столкновение приведет к химической реакции.
Факт положительного влияния температуры на скорость протекания реакции еще в 19м веке эмпирически установил голландский химик Вант Гофф. На основании проведенных им исследований он сформулировал правило, которое до сих пор носит его имя, и звучит оно следующим образом:
Скорость любой химической реакции увеличивается в 2-4 раза при повышении температуры на 10 градусов.
Математическое отображение данного правила записывается как:
где V2 и V1 – скорость при температуре t2 и t1 соответственно, а γ – температурный коэффициент реакции, значение которого чаще всего лежит в диапазоне от 2 до 4.
Часто скорость многих реакций удается повысить, используя катализаторы.
Катализаторы – вещества, ускоряющие протекание какой-либо реакции и при этом не расходующиеся.
Но каким же образом катализаторам удается повысить скорость реакции?
Вспомним про энергию активации Ea . Молекулы с энергией меньшей, чем энергия активации в отсутствие катализатора друг с другом взаимодействовать не могут. Катализаторы, изменяют путь, по которому протекает реакция подобно тому, как опытный проводник проложит маршрут экспедиции не напрямую через гору, а с помощью обходных троп, в результате чего даже те спутники, которые не имели достаточно энергии для восхождения на гору, смогут перебраться на другую ее сторону.
Не смотря на то что катализатор при проведении реакции не расходуется, тем не менее он принимает в ней активное участие, образуя промежуточные соединения с реагентами, но к концу реакции возвращается к своему изначальному состоянию.
Кроме указанных выше факторов, влияющих на скорость реакции, если между реагирующими веществами есть граница раздела (гетерогенная реакция), скорость реакции будет зависеть также и от площади соприкосновения реагентов. Например, представьте себе гранулу металлического алюминия, которую бросили в пробирку с водным раствором соляной кислоты. Алюминий – активный металл, который способен реагировать с кислотами неокислителями. С соляной кислотой уравнение реакции выглядит следующим образом:
2Al + 6HCl → 2AlCl3 + 3H2↑
Алюминий представляет собой твердое вещество, и это значит, что реакция с соляной кислотой идет только на его поверхности. Очевидно, что если мы увеличим площадь поверхности, предварительно раскатав гранулу алюминия в фольгу, мы тем самым предоставим большее количество доступных для реакции с кислотой атомов алюминия. В результате этого скорость реакции увеличится. Аналогичным образом увеличения поверхности твердого вещества можно добиться измельчением его в порошок.
Также на скорость гетерогенной реакции, в которой реагирует твердое вещество с газообразным или жидким, часто положительно влияет перемешивание, что связано с тем, что в результате перемешивания достигается удаление из зоны реакции скапливающихся молекул продуктов реакции и «подносится» новая порция молекул реагента.
Последним следует отметить также огромное влияние на скорость протекания реакции и природы реагентов. Например, чем ниже в таблице Менделеева находится щелочной металл, тем быстрее он реагирует с водой, фтор среди всех галогенов наиболее быстро реагирует с газообразным водородом и т.д.
Резюмируя все вышесказанное, скорость реакции зависит от следующих факторов:
1) концентрация реагентов: чем выше, тем больше скорость реакции.
2) температура: с ростом температуры скорость любой реакции увеличивается.
3) площадь соприкосновения реагирующих веществ: чем больше площадь контакта реагентов, тем выше скорость реакции.
4) перемешивание, если реакция происходит между твердым веществом и жидкостью или газом перемешивание может ее ускорить.







