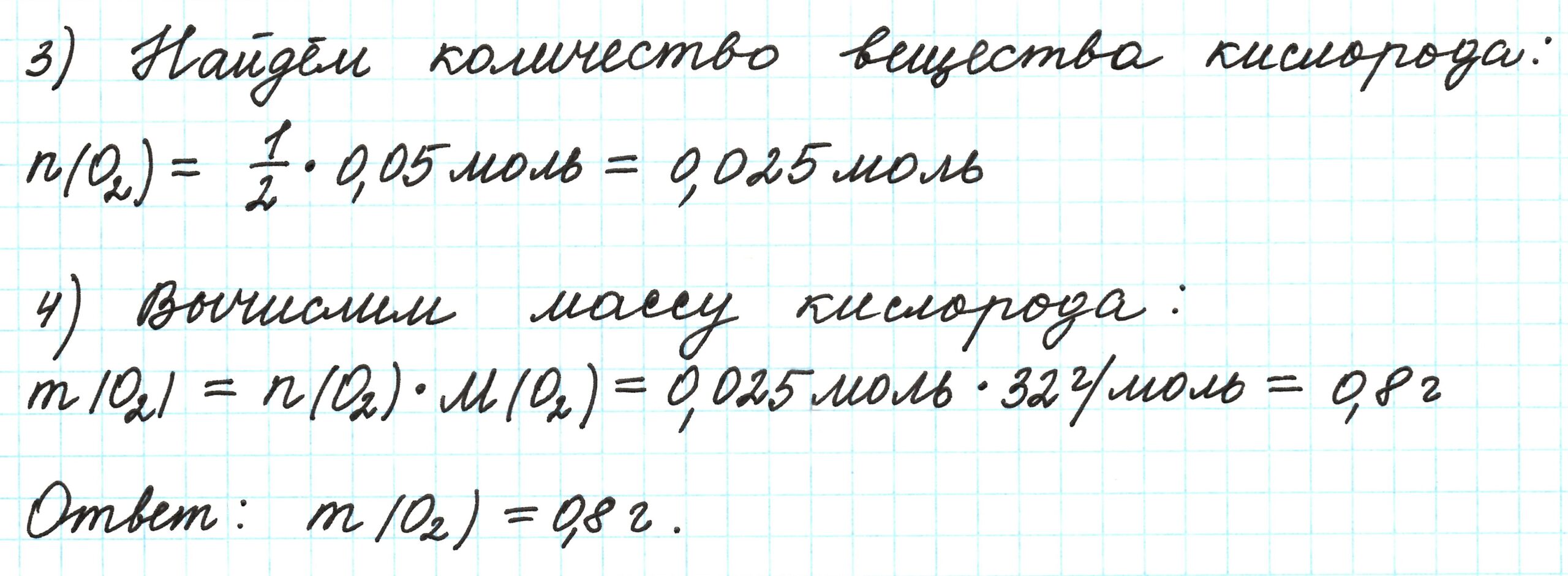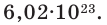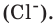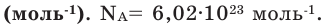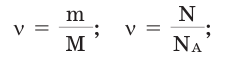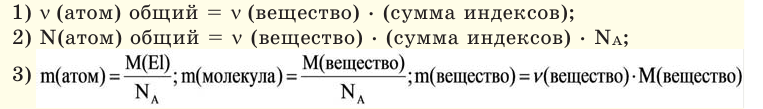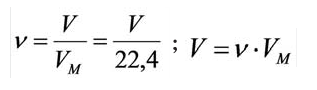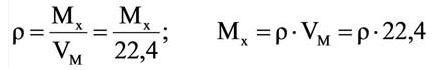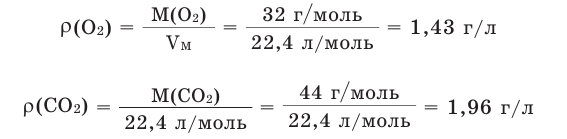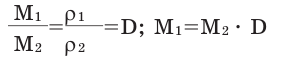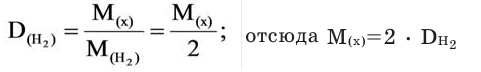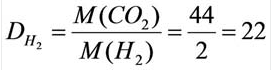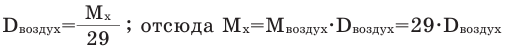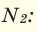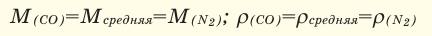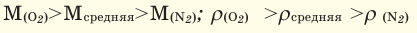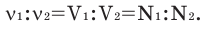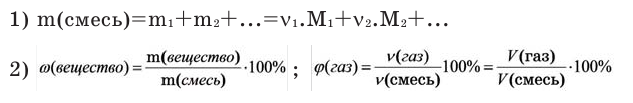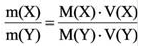Вам понадобится:
- молярная масса
- масса молекулы
- уравнение Менделеева-Клапейрона
- таблица Менделеева
#1
Если в сосуде находится смесь газов, то рассчитать объем этой смеси и давление не составит труда. Объем газа равен объему сосуда, так как газы имеют свойство заполнять всю предоставленную им емкость. Давление измеряют манометром. А вот как найти массу смеси газов? Задача легко решается, если известно процентное содержание газов в данной смеси. Например, пусть в сосуде находится 20% углекислого газа и 80% кислорода. Большинство заданий требует нахождение молярной массы вещества. Поэтому, для расчета молярной массы смеси понадобятся еще и относительные молекулярные массы присутствующих газов, найденные по таблице Менделеева. Для углекислого газа это число составляет 44, а для кислорода 32.
#2
Молярная масса смеси находится следующим образом, 44*0,2+32*0,8. Рассчитав таким образом молярную массу, можно решить задачу, как определить массу молекулы. Для ее нахождения нужно молярную массу газа разделить на постоянную Авогадро, численное значение которой Nа=6.3 моль-1. Чтобы рассчитать массу газа проделываем следующее математическое действие: массу одной молекулы умножаем на число молекул. Правда, надо еще уметь найти количество молекул каждого газа в сосуде. Можно поступить по-другому. Для того, как рассчитать массу газа, надо вспомнить уравнение Менделеева-Клапейрона PV = mRT/M.
#3
Преобразуя уравнение, можно получить расчетную формулу для нахождения массы газа m= PVM / RT, где М- молярная масса газа; R- универсальная газовая постоянная R=8,1 Дж/моль. К; Р – давление газа; Т – абсолютная температура; V – объем газа. В химии существует некоторая аналогия между смесью газов и раствором веществ. Ведь раствор – это такая же смесь, например воды и соли. Задаваясь вопросом, как найти массу раствора, приходим к следующему выводу. Нужно складывать массу воды и массу растворенной в ней соли. Точно так же, чтобы найти массу газовой смеси, нужно суммировать массы входящих в нее газов.
#4
На молекулярном уровне действует тот же принцип. Как найти относительную молекулярную массу какого-либо вещества? Необходимо складывать массы всех атомов, из которых строится молекула этого вещества. Относительные атомные массы всех химических элементов приведены в той же знаменитой таблице Менделеева. Их табличные значения надо округлять. Например, относительная атомная масса кислорода 16. Таким образом, для газов, жидкостей, и даже молекул нахождение общей массы сводится к суммированию масс компонентов, составляющих смесь или раствор. Этот принцип сложения получил название аддитивности масс.
РАСЧЕТЫ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ, или Как вычислить массу вещества (или объем газа) по известному количеству вещества одного из вступающих в реакцию или образующихся в результате нее веществ
Расчеты по химическим уравнениям являются одними из самых широко используемых в химии.
Это самый простой тип расчетных задач, в основе которых лежит химическое уравнение.
Содержание
Особенности задач с расчетами по химическим уравнениям
Основной алгоритм расчетов с использованием химических уравнений
Расчеты по химическим уравнениям: примеры
Особенности задач с расчетами по химическим уравнениям
В задачах с расчетами по химическим уравнениям речь идет о каком-либо химическом превращении (например, разложении) одного какого-то вещества или химическом взаимодействии двух или нескольких веществ. Причем:
- Масса или объем одного из них известны. Требуется найти массу или объем продукта реакции – вещества (или одного из веществ), образующегося в результате взаимодействия.
- Либо, наоборот, известны масса или объем образовавшегося вещества, требуется найти массу или объем исходного вещества.
- Либо известны масса или объем одного из реагентов, необходимо вычислить массу или объем второго реагента.
Прежде, чем приступить к вычислениям, важно составить уравнение реакции взаимодействия и правильно расставить коэффициенты.
Необходимо помнить, что коэффициенты, стоящие перед формулами веществ в уравнении реакции, показывают, в каких эквивалентных (достаточных, необходимых, пропорциональных) количествах реагируют вещества. Эти количества называют «количествами вещества по уравнению реакции» и записывают под формулами соответствующих веществ в уравнении.
Те количества вещества, которые находят, используя данные задачи, называют «количествами вещества по условию задачи» и в уравнение не записывают.
В ходе решения сравнивают «количества вещества по уравнению реакции» для того, чтобы узнать, в каком соотношении находятся вещества, о которых идет речь в задаче. Используя данные об этом соотношении, определяют «количества вещества по условию задачи». А затем, применяя основную расчетную формулу, вычисляют искомые массу или объем вещества.
Основной алгоритм расчетов с использованием химических уравнений
Основные шаги, которые необходимо сделать при решении задач с использованием химических уравнений, можно отобразить в виде схемы:
Расчеты по химическим уравнениям: примеры
Приведем несколько примеров с расчетами по химическим уравнениям.
Пример 1. В избытке воды растворили 11,5 г металлического натрия. Какой объем водорода выделился при этом?
- Так как в задаче говорится о химическом процессе: натрий реагирует с водой, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярную массу натрия (смотрим по таблице Менделеева) и молярный объем для водорода (так как требуется найти объем этого газа, а не массу).
- В условии говорится, что натрий реагирует с избытком воды. Это означает только то, что её будет достаточно для взаимодействия с металлом.
Пример 2. Кальций массой 2 г прореагировал с кислородом. Какая масса кислорода вступила в реакцию?
- Так как в задаче говорится о химическом процессе: кальций реагирует с кислородом, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
Пример 3. Смесь, состоящую из 3 г магния и 3,9 г цинка, сплавили с серой, которая находилась в избытке. Рассчитайте массу полученной смеси сульфидов металлов.
- В составе смеси два металла: магний и цинк. Однако каждый из них прореагирует с серой самостоятельно. Поэтому запишем два уравнения реакции и решим фактически две задачи в одной.
- Над формулами веществ в уравнениях реакций расставим данные условия задачи.
- Под формулами веществ в уравнениях реакций расставим количества веществ (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
- Поскольку требуется найти массу смеси образовавшихся сульфидов, то рассчитаем массу каждого из них из соответствующего уравнения. Укажем это в уравнениях над формулами сульфидов.
- Избыток серы говорит только о том, что ее будет достаточно для полного реагирования как магния, так и цинка.
Итак, при расчетах по химическим уравнениям важно правильно записать уравнение реакции и расставить коэффициенты.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Содержание:
Количество вещества:
В чём разница между понятиями «масса» и «количество»
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число —
Например, в 1 моле водородного газа содержится 

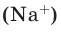

Количество частиц, содержащихся в 1 моле химических веществ ( 
Количество вещества можно вычислить по следующей формуле:
Здесь 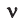
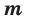
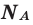
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):
Как видно из сравнений, молярная масса веществ по своей единице отличается от относительной молекулярной массы. То есть молярная масса — измеряемая величина.
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
Закон Авогадро и молярный объём газов
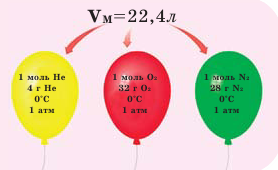
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.
Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит 
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 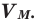
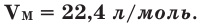
Здесь 
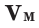
На основе закона Авогадро и молярного объёма газов можно вычислить плотность газов при нормальных условиях и относительную плотность одного газа по отношению к другому газу. Плотность обозначается буквой 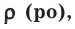
измерения —
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 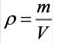
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
Относительную плотность газов в большинстве случаев вычисляют по самому легкому газу — водороду и воздуху:
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
Способы вычисления средней молярной массы газовой смеси
Здесь: 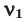
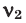
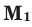
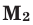

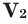
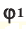
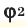
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 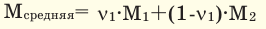
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании 
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании 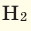
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
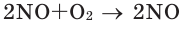
Численное соотношение объемов, молей и молекул газов равно друг другу.
Можно производить следующие вычисления по смесям:
3) Массовое соотношение двух газов:
- Физические и химические явления
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
- Химическая формула
- Относительная атомная и относительная молекулярная масса
Как найти молярную массу смеси газов
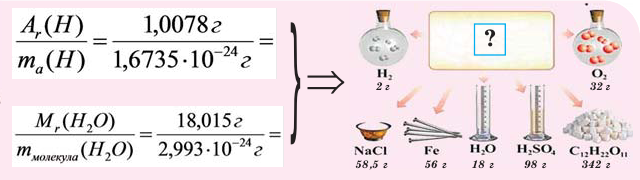
Молярная масса – это масса одного моля любого вещества, то есть такого его количества, в котором содержится 6,022*10^23 элементарных частиц. Численно молярная масса совпадает с молекулярной, выраженной в атомных единицах массы (а.е.м.), но размерность у нее другая – грамм/моль.

Инструкция
Если бы вам надо было вычислить молярную массу любого газа, вы бы взяли величину атомной массы азота и умножили ее на индекс 2. В итоге получили бы 28 грамм/моль. Но как вычислить молярную массу смеси газов? Эта задача решается элементарно. Надо лишь знать, какие именно газы и в какой пропорции входят в состав смеси.
Рассмотрите конкретный пример. Предположим, у вас есть газовая смесь, которая состоит из 5% (массовых) водорода, 15% азота, 40% углекислого газа, 35% кислорода и 5% хлора. Какова ее молярная масса? Воспользуйтесь формулой для смеси, состоящей из х компонентов: Мсм = M1N1 + M2N2 + M3N3 +…+ MxNx, где M – молярная масса компонента, а N – его массовая доля (процентная концентрация).
Молярные массы газов вы узнаете, вспомнив величины атомных весов элементов (тут вам понадобится Таблица Менделеева). Их массовые доли известны по условиям задачи. Подставив величины в формулу и произведя вычисления, получите: 2*0,05 + 28*0,15 + 44*0,40 + 32*0,35 + 71*0,05 = 36,56 грамм/моль. Вот такова молярная масса указанной смеси.
Можно ли решить задачу другим способом? Да, конечно. Предположим, у вас точно такая же смесь, заключенная в герметичный сосуд объемом V при комнатной температуре. Как можно лабораторным путем вычислить ее молярную массу? Для этого вам понадобится сначала взвесить этот сосуд на точных весах. Обозначьте его массу как М.
Потом с помощью подсоединенного манометра измерьте давление P внутри сосуда. Затем с помощью шланга, подсоединенного к вакуум-насосу, откачайте немного смеси. Легко можно понять, что давление внутри сосуда уменьшится. Перекрыв вентиль, подождите примерно полчаса для того, чтобы смесь внутри сосуда снова приняла температуру окружающего воздуха. Проверив это с помощью термометра, измерьте давление смеси манометром. Обозначьте его P1. Взвесьте сосуд, обозначьте новую массу как M1.
Ну а дальше вспомните универсальное уравнение Менделеева-Клапейрона. Согласно ему, в обоих случаях:- PV = MRT/m;- P1V = M1RT/m.Немного видоизменив это уравнение, вы получите:- m = MRT/PV;- m = M1RT/P1V.
Отсюда следует, что m = (M – M1)RT/ (P – P1)V. А m – та самая молярная масса смеси газов, которую вам надо узнать. Подставив в формулу известные величины, вы получите ответ.
Источники:
- молекулярная масса смеси
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Воронежская
область
Нижнедевицкий
район
МКОУ
«Вязноватовская СОШ имени Пенькова С.В.»
ВЫЧЕСЛЕНИЕ МАССЫ КОМПОНЕНТОВ В СМЕСИ
подготовил:
учитель химии Носов А.В.
В
части С задач по химии в рамках ЕГЭ встречаются задачи разной направленности и
разной степени трудности. Приведем примеры решения задач на взаимодействие
смеси веществ с одним реагентом.
Предлагаю
решение задач словесно-логическим методом. Использование данного метода
развивает в первую очередь логику и помогает решать задачи как по химии, так и
по другим предметам.
Разберем
вариант, когда в смеси взаимодействует с реагентом только один компонент.
Смесь
веществ А и В, массой х, обработали реагентом, при этом выделился газ.
Определить массовые доли компонентов в исходной смеси.
Записываем
уравнение взаимодействия одного из веществ с реагентом.
А
+ Р(реагент) → СД + Г(газ)
Находим
массу газа и записываем над Г. Проводим вспомогательные расчеты. Решаем пропорцию
по нахождению массы А. Затем рассчитываем массовую долю в исходной смеси.
Записываем ответ.
Например(демоверсии по
химии):
1. Определите массовые
доли ( в %) сульфата железа( II)
и сульфида алюминия в смеси, если при обработке 25 г. этой смеси водой
выделился газ, который полностью прореагировал с 960 г 5% раствора сульфата
меди.
Запишем уравнения
реакций:
1)
FeSO4
+ H2O
→ реакция не идет
2)
Al2S3
+ 6H2O → 2Al(OH)3 + 3H2S↑
Определили, что
выделившийся газ H2S.
Определим массу сульфата меди.
|
Дано |
Решение |
|||
|
w(CuSO4)=5% |
Составим пропорцию |
|||
|
m(р-ра)= |
960 — 100% |
|||
|
Найти |
х — 5% |
|||
|
m(CuSO4)-? |
||||
Определим массу газа.
|
Дано |
Решение |
||||||
|
m(CuSO4)=48г. |
х |
48 |
|||||
|
найти |
H2S |
+ CuSO4 |
→ CuS↓ + H2SO4 |
||||
|
m(H2S)-? |
34 |
160 |
|||||
|
Решаем пропорцию по |
|||||||
Решаем второе уравнение:
|
Дано |
Решение |
|||||
|
m(H2S)= |
х |
10,2 |
||||
|
Найти |
Al2S3 |
+ 6H2O → |
3H2S↑ |
|||
|
m(Al2S3)-? |
150 |
102 |
||||
|
Решаем пропорцию по |
||||||
Получаем m(Al2S3)=15г.
Соответственно m(FeSO4)=25-15=10г.
Произведя несложные
расчеты, получаем ответ: w(Al2S3)=60%,
w(FeSO4)=40%.
2.Смесь алюминия и меди
массой 9 г обработали хлороводородной кислотой. После окончания реакции собрали
5,6 л газа. Определите массовую долю (в %) меди в смеси.
Запишем уравнения
реакций:
Cu
+ HCl →
реакция не идет
2Al
+ 6HCl
→ 2AlCl3
+ 3H2
Переведём 5,6 л газа
(водорода) в граммы. Получим 0,5г.
Определим массу алюминия:
|
Дано |
Решение |
|
m(H2)=0.5г |
|
|
найти |
2Al |
|
m(Al)=? |
|
Находим х=4,5
Вычисляем массу m(Cu)=9-4,5=4,5
Соответственно вычисляем
правильный ответ w(Cu)=50%.
Литература:
1.
Лидин Р.А. Полный сборник
задач для школьников и поступающих в вузы /М. : Дрофа. 2007.
2.
Киреев В.А. Курс физической
химии. Изд.3-е, перераб. и доп. М., «Химия»1975г.
3.
Глинка П.Л. Общая химия.
Госхимиздат 1955 г.