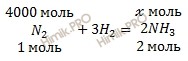Задачи на выход продукта химической реакции. Как решать задачи на выход продукта реакции. Что такое выход продукта химической реакции. Теоретическое и практическое количество продукта химической реакции.
При решении задач на расчеты по уравнениям химических реакций мы принимаем, что в ходе реакции образуется точно рассчитанное количество продукта, исходя из мольного соотношения реагентов и продуктов. Количество продукта реакции, которое должно получится из реагентов согласно стехиометрическим расчетам — это теоретическое количество (масса, объем) или теоретический выход продукта реакции nтеор.
Однако на практике это соотношение не выполняется, и в большинстве случаев образуется меньшее количество продукта реакции, чем было рассчитано — практическое количество (масса, объем) или практический выход продукта реакции nпр.
Практический и теоретический выход не совпадают в силу разных причин — неэффективные соударения реагирующих частиц, побочные процессы, потери в ходе проведения реакции и т.д.
Обратите внимание! Понятия теоретического или практического количества реагента не существует. Ведь мы всегда берем определенное количество реагентов. А вот вступать в реакцию не полностью реагенты могут.
Массовая (мольная, объемная) доля выхода продукта реакции η или ω — это соотношение массы (количества вещества, объема) продукта, которая практически получена в ходе реакции, mпр., к массе (количеству, объему) продукта, которая рассчитана теоретически, mтеор.:
η = mпр./mтеор.
Массовую (мольную, объемную) долю выхода продукта реакции можно выражать в долях, а можно в процентах:
η = mпр./mтеор.·100%
Рассмотрим несколько задач на определение и использование выхода продукта реакции.
1. Какое количество вещества аммиака получится при действии избытка раствора гидроксида натрия на 500 г сульфата аммония, если выход в данной реакции 70%?
Решение.
2NaOH + (NH4)2SO4 = Na2SO4 + 2NH3 + 2H2O
Количество вещества сульфата аммония:
n((NH4)2SO4) = m/M = 500/132 = 3,79 моль
Теоретическое количество аммиака:
nтеор.(NH3) = 2·n((NH4)2SO4) = 2·3,79 = 7,58 моль
Зная мольную долю выхода продукта реакции, определим практический выход аммиака:
nпр.(NH3) = η·nтеор.(NH3) = 0,7·7,58 = 5,3 моль
Ответ: nпр.(NH3) = 5,3 моль
2. При хлорировании метана объемом 112 л (н. у.) получен дихлорметан массой 255 г. Определите долю выхода дихлорметана.
Решение.
CH4 + 2Cl2 = CH2Cl2 + 2HCl
Количество вещества метана:
n(CH4) = V/Vm = 112/22,4 = 5 моль
Теоретическое количество дихлорметана:
nтеор.(CH2Cl2) = n(CH4) = 5 моль
mтеор.(CH2Cl2) = M·nтеор.(CH2Cl2) = 85 г/моль·5 моль = 425 г
Масса дихлорметана, которая приведена в условии задачи — это практический выход дихлорметана.
Доля выхода дихлорметана:
η = mпр./mтеор. = 255/425 = 0,6 или 60%
Ответ: выход продукта реакции 60%
3. Определите массу оксида меди (II), которая потребуется для получения 500 г нитрата меди, если доля выхода в реакции взаимодействия оксида меди с HNO3 составляет 92%?
4. Определите объем (н.у., л) аммиака, который получится при действии избытка раствора гидроксида натрия на 48 г карбоната аммония, если выход в реакции составляет 70%?
5. Определите массу соли, г, которая образуется при растворении в избытке азотной кислоты 80 г оксида меди (II), если выход в реакции составляет 80%?
6. При термическом разложении 1700 г нитрата натрия было получено 174,4 л кислорода (н.у.). Определите массовую долю выхода в этой реакции.
7. Рассчитайте массу оксида магния, которая образуется при разложении гидроксида магния массой 50 г, если реакция разложений прошла с выходом 95,5%.
8. Какая масса бензола (кг) может получиться из 369,6 м3 (н.у.) ацетилена, если доля выхода бензола составила 65% от теоретически возможного?
9. Определите массу спирта, полученного при гидратации 40 л пропилена (н.у.), если доля выхода продукта реакции составляет 65% от теоретически возможного.
10. Определите долю выхода в реакции каталитического окисления аммиака кислородом, если при окислении 10 моль аммиака образуется 200 л оксида азота (II) при н.у.?
11. Пары брома объемом 20 л смешали с избытком водорода, в результате из смеси выделили 32 л бромоводорода. Определите долю выхода, %, если объемы газов измерялись при одинаковых условиях.
12. Оксид кальция массой 0,64 кг нагрели до 1200° С с достаточной массой оксида кремния (IV). Масса образовавшегося силиката кальция оказалась равной 1,024 кг. Определите выход (%) реакции соединения.
13. Из 36 г метанола было получено 24 г диметилового эфира. Рассчитайте выход реакции дегидратации
14. Углекислый газ объемом 6 л (н.у.) пропустили над раскалённым углем, продукт реакции пропустили через избыток известковой воды, после чего собрали 7,2 л (н.у.) газа. Определите степень превращения углекислого газа, %.
15. Определите массу, г нитрата аммония, которая содержалась в растворе, если при действии на этот раствор избытка гидроксида кальция выделилось 6 г аммиака. Реакция прошла с выходом 88,2 %.
16. При термическом разложении не загрязненного примесями карбоната кальция образовалось 20 г оксида кальция. Известно, что реакция прошла с выходом 85%. Вычислите массу карбоната кальция, взятого для проведения реакции разложений и объем (н.у.) образовавшегося углекислого газа.
17. Какой объем пропана (н.у.) потребуется для получения 42 г пропена, если доля выхода продуктов реакции составляет 60% от теоретически возможного?
18. При бромировании пентена-2 массой 8,4 г получен 2,3-дибромпентан массой 24,3 г. Определите долю выхода продукта реакции.
19. Из 69 г этанола получен бутадиен-1,3 массой 36,85 г. Определите массовую долю выхода продукта реакции.
20. При бромировании 5,4 г дивинила избытком брома образуется 28,2 г 1,2,3,4-тетрабромбутана. Определите выход продукта реакции.
21. Определите, какая масса 2-метилбутана необходима для получения 46,24 г изопрена, если доля выхода продукта реакции составляет 85%?
22. Определите объем метана, который потребуется для получения 63 л ацетилена (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
23. Определите, какую массу уксусного альдегида можно получить по реакции Кучерова из 11,2 л ацетилена (н. у.), если доля выхода продуктов реакции составляет 80% от теоретически возможного?
24. При действии избытка воды на 48 г технического карбида кальция, содержащего 10% примесей, образовался ацетилен объемом 10,08 л (н.у.). Определите долю выхода продукта реакции.
25. Определите массу технического карбида алюминия, содержащего 7% примесей, необходимого для получения 56 л метана (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
26. Из 179,2 л бутана (н.у.) с объемной долей примесей 25% двухстадийным синтезом получен бутанол-2 массой 159,84 г. Доли выхода продуктов на первой и второй стадиях одинаковы. Определите доли выхода продуктов реакций.
27. Циклогексан массой 16 г сожгли в избытке кислорода и полученный углекислый газ пропустили через избыток раствора гидроксида кальция, в результате чего выпал осадок массой 90 г. Определите массовую долю негорючих примесей в циклогексане, если доля выхода продуктов горения составляет 90% от теоретически возможного.
28. При нитровании 46,8 г бензола получен нитробензол массой 66,42 г. Определите выход продуктов реакции.
Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
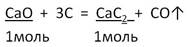 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Выход от теоретически возможного
Сколько литров аммиака (NH3) образуется при взаимодействии 112 килограмм азота (N2) с водородом (H2)? Выход от теоретически возможного 80% (нормальные условия).
Решение задачи
Запишем уравнение реакции образования аммиака (NH3):
Напомню, что под выходом от теоретически возможного продукта реакции понимают отношение массы (объема, числа молей) практически полученного вещества к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
Выход от теоретически возможного. Учитывая, что молярная масса азота (N2) равна 28 г/моль (смотри таблицу Менделеева), найдем химическое количество азота (N2) по формуле, устанавливающей связь между химическим количеством вещества и массой:
Получаем:
n (N2) = 112000 /28 = 4000 (моль) = 4 (кмоль).
По уравнению реакции найдем химическое количество аммиака (NH3) (теоретическое химическое количество вещества), которое выделяется в ходе реакции образования аммиака (NH3):
из 1 моль N2 образуется 2 моль NH3
из 4000 моль N2 образуется х моль NH3
Откуда:
Выход от теоретически возможного.
По формуле, устанавливающей связь между химическим количеством вещества и объемом, вычислим объем аммиака (NH3), который образуется в ходе реакции:
Получаем:
V теор.( NH3) = 8000 ∙ 22,4 = 179200 (л).
Вычислим объем аммиака (NH3) практический (выход от теоретически возможного) по формуле:
Выход от теоретически возможного.
Получаем:
V практ. (NH3) = 80 ⋅ 179200 / 100 = 143360 (л) = 143,36 (м3).
Ответ:
объем аммиака (NH3) равен 143,36 м3.
Загрузить PDF
Загрузить PDF
В химии теоретический выход – это максимальное количество продукта, которое получается в результате химической реакции. На самом деле большинство реакций не являются идеальными, то есть практический выход продукта всегда меньше теоретического. Чтобы вычислить эффективность реакции, необходимо найти процент выхода продукта по формуле: выход (%) = (практический выход/теоретический выход) x100. Если процент выхода равен 90%, это означает, что реакция эффективна на 90%, а 10% реагентов были потрачены впустую (они не вступили в реакцию или не соединились).
-
1
Начните со сбалансированного химического уравнения. Химическое уравнение включает реагенты (слева от знака равенства) и образующиеся продукты (справа от знака равенства). В некоторых задачах химическое уравнение дано, а в других его надо написать. Во время химической реакции атомы не создаются и не уничтожаются, поэтому у каждого элемента должно быть одинаковое число атомов слева и справа от знака равенства.[1]
-
2
Найдите молярную массу каждого исходного вещества. Определите молярную массу каждого атома вещества, а затем сложите молярные массы, чтобы вычислить молярную массу всего вещества. Сделайте это для одной молекулы реагента.
-
3
Преобразуйте массу каждого реагента из граммов в число молей. Теперь рассмотрите реакцию, которую вы собираетесь провести. Запишите массу каждого реагента в граммах. Полученное значение разделите на молярную массу вещества, чтобы преобразовать граммы в число молей.[2]
-
4
Найдите молярное соотношение реагентов. Помните, что моль – это величина, которая используется химиками для «подсчета» молекул. Вы определили количество молекул каждого исходного вещества. Разделите число молей одного реагента на число молей другого, чтобы найти молярное соотношение двух реагентов.
- Вы взяли 1,25 моль кислорода и 0,139 моль глюкозы. Молярное соотношение кислорода и глюкозы: 1,25/0,139 = 9. Это означает, что на 1 молекулу глюкозы приходятся 9 молекул кислорода.
-
5
Найдите оптимальное соотношение реагентов. Вернитесь к сбалансированному уравнению, которое вы записали ранее. С помощью этого уравнения можно определить оптимальное соотношение реагентов, то есть соотношение, при котором оба вещества будут израсходованы одновременно.
- Левая сторона уравнения:
. То есть на 1 одну молекулу глюкозы приходятся 6 молекул кислорода. Оптимальное соотношение реагентов: 6 кислород/ 1 глюкоза = 6.
- Не перепутайте вещества, которые находятся в числителе и в знаменателе дроби. Если поделить кислород на глюкозу, а потом глюкозу на кислород, вы получите неправильный результат.
- Левая сторона уравнения:
-
6
Сравните соотношения, чтобы найти ключевой компонент реакции. В химической реакции один реагент расходуется быстрее другого. Такой ключевой реагент определяет скорость химической реакции. Сравните два соотношения, которые вы вычислили, чтобы найти ключевой реагент:[3]
- Если молярное соотношение больше оптимального, вещества, которое находится в числителе дроби, слишком много. При этом вещество, которое находится в знаменателе дроби, является ключевым реагентом.
- Если молярное соотношение меньше оптимального, вещества, которое находится в числителе дроби, слишком мало и оно является ключевым реагентом.
- В нашем примере молярное соотношение (кислород/глюкоза = 9) больше оптимального соотношения (кислород/глюкоза = 6). Таким образом, вещество, которое находится в знаменателе дроби (глюкоза), является ключевым реагентом.
Реклама
-
1
Определите продукты реакции. В правой части химического уравнения перечислены продукты реакции. Каждый продукт имеет теоретический выход, то есть количество продукта, которое получится в случае идеальной реакции.
-
2
Запишите число молей ключевого реагента. Теоретический выход продукта равен количеству продукта, который получится при идеальных условиях. Чтобы вычислить теоретический выход, начните с числа молей ключевого реагента (читайте предыдущий раздел).
- В нашем примере вы выяснили, что ключевым реагентом является глюкоза. Также вы вычислили, что взяли 0,139 моль глюкозы.
-
3
Найдите соотношение молекул продукта и реагента. Вернитесь к сбалансированному уравнению. Разделите количество молекул продукта на количество молекул ключевого реагента.
-
4
Умножьте полученное соотношение на количество реагента в молях. Так вы получите теоретический выход продукта (в молях).
- Вы взяли 0,139 моль глюкозы, а отношение углекислого газа к глюкозе равно 6. Теоретический выход углекислого газа: (0,139 моль глюкозы) x (6 моль углекислого газа/1 моль глюкозы) = 0,834 моль углекислого газа.
-
5
Полученный результат преобразуйте в граммы. Полученное число молей умножьте на молярную массу продукта, чтобы найти теоретический выход в граммах. Эту единицу измерения можно использовать в большинстве экспериментов.
- Например, молярная масса CO2 приблизительно равна 44 г/моль (молярная масса углерода ≈ 12 г/моль, молярная масса кислорода ≈ 16 г/моль, поэтому 12 + 16 + 16 = 44).
- Перемножьте: 0,834 моль CO2 x 44 г/моль CO2 ≈ 36,7 г. Теоретический выход продукта равен 36,7 г CO2.
Реклама
-
1
Уясните, что такое процент выхода. Теоретический выход предполагает, что реакция прошла идеально. На самом деле, идеальных реакций не бывает: нежелательные примеси и другие непредсказуемые проблемы приводят к тому, что часть реагентов не преобразуется в продукт. Поэтому в химии используются три понятия, которые характеризуют выход продукта:
- Теоретический выход – это максимальное количество продукта, которое может получиться в результате реакции.
- Практический выход – это реальное количество продукта, масса которого измеряется на весах.
- Процент выхода = (практический выход/теоретический выход)*100%. Например, если процент выхода равен 50%, это означает, что количество продукта составляет 50% от теоретически возможного.
-
2
Запишите практический выход продукта. Если вы провели эксперимент самостоятельно, соберите продукт реакции и взвесьте его на весах, чтобы найти его массу. Если перед вами химическая задача или результаты чужого эксперимента, практический выход будет дан.
- Предположим, что в результате реакции вы получили 29 г CO2.
-
3
Разделите практический выход на теоретический. Убедитесь, что вы используете одну и ту же единицу измерения для обоих значений (обычно граммы). Результат запишите без единицы измерения.
- Практический выход равен 29 г, а теоретический выход равен 36,7 г:
- Практический выход равен 29 г, а теоретический выход равен 36,7 г:
-
4
Результат умножьте на 100, чтобы получить проценты. Так вы вычислите процент выхода продукта.
- 0,79 x 100 = 79, то есть процент выхода продукта равен 79%. Таким образом, в результате реакции получилось 79% от максимально возможного количества CO2.
Реклама
Советы
- Некоторые учащиеся путают процентный выход (количество практического выхода по отношению к теоретическому) с процентной погрешностью (как практический выход отличается от теоретического). Формула для вычисления процента выхода (процентного выхода): (практический выход/теоретический выход)*100%. Чтобы вычислить процентную погрешность, в знаменателе этой формулы нужно записать разность между практическим и теоретическим выходам.
- Если вы получили совершенно разные результаты, проверьте единицы измерения. Если практический выход отличается от теоретического на порядок или больше, скорее всего, на каком-то этапе вычислений вы использовали неправильные единицы измерения. Повторите вычисления и следите за единицами измерения.
- Если процент выхода больше 100%, и вы уверены в правильности вычислений, продукт имеет нежелательные примеси. Очистите продукт (например, высушите или отфильтруйте его), а затем снова взвесьте.
Реклама
Об этой статье
Эту страницу просматривали 51 591 раз.
Была ли эта статья полезной?
Здравствуйте! Друзья!
Сегодня
мы познакомимся и научимся решать ещё один тип расчетных задач, связанных с
вычислениями по уравнению химической реакции. Это расчетные задачи типа
«Определение выхода продукта реакции в процентах от теоретического».
На
уроке нам понадобятся:
1.
Периодическая система химических элементов Д. И. Менделеева.
2.
Калькулятор.
3.
И, как всегда, огромное желание научиться чему-то новому!
Желаю вам успехов!
Задачи
на вычисление выхода продукта реакции от теоретически возможного
Признак
В условии задачи встречается слово
«выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём,
практическая масса или объём» могут быть использованы только для
веществ-продуктов.
Массовая доля выхода продукта обозначается
буквой h (эта), измеряется в процентах или долях,
объёмная доля выхода продукта может обозначаться в различных источниках h (эта)
Также для расчётов может использоваться
отношения количеств веществ:
Первый
тип задач – Известны масса (объём) исходного
вещества и масса (объём) продукта реакции. Необходимо определить выход продукта
реакции в %.
Задача
1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили
соль массой 5, 5 г. Определите выход продукта реакции (%).
|
1. |
Дано: m(Mg) = 1,2 г mпрактическая (MgSO4) = 5,5 _____________________ Найти:
|
|
2. Запишем Под |
|
|
3. |
M(Mg) = 24 г/моль M(MgSO4) = 24 |
|
4. |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 |
|
5. По |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим |
Ответ: Выход сульфата магния составляет |
Второй
тип задач – Известны масса (объём) исходного
вещества (реагента) и выход (в %) продукта реакции. Необходимо найти
практическую массу (объём) продукта реакции.
Задача
2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид
кальция массой 16,8 г, если выход составляет 80%.
|
1. |
Дано: m(CaO) = 16,8 г
____________________ Найти: mпракт (CaC2) = ? |
|
2. Запишем Под |
|
|
3. |
M(CaO) = 40 + 16 = 56 M(CaC2) = 40 + |
|
4. |
ν(CaO) = 16,8 (г) / 56 |
|
5. По |
|
|
6. Находим |
mпрактич (CaC2) = 0,8 Ответ: mпрактич (CaC2) = 15,36 |
Третий
тип задач – Известны масса (объём) практически
полученного вещества и выход этого продукта реакции. Необходимо вычислить массу
(объём) исходного вещества.
Задача
3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу
карбоната натрия нужно взять для получения оксида углерода (IV)
объёмом 28,56 л (н. у.). Практический выход продукта 85%.
|
1. |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = φ = 85% или 0,85 _____________________ Найти: m(Na2CO3) =? |
|
2. Находим |
M (Na2CO3) =2·23 + |
|
3. |
Vтеоретич(CO2) = Vпрактич(CO2) / 0,85 = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 |
|
4. Запишем Под |
|
|
5. |
По УХР: , следовательно ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
5. Определяем m V |
m = ν · M m (Na2CO3) = 106 |