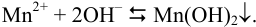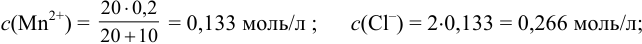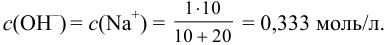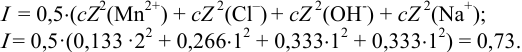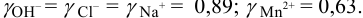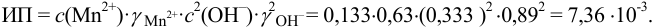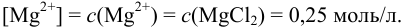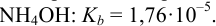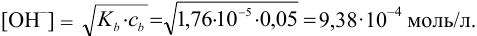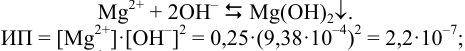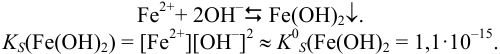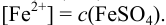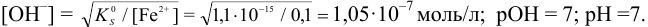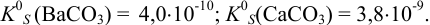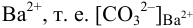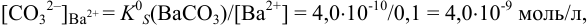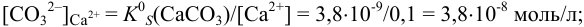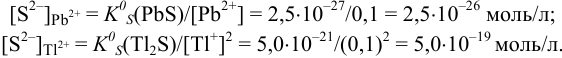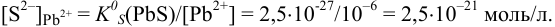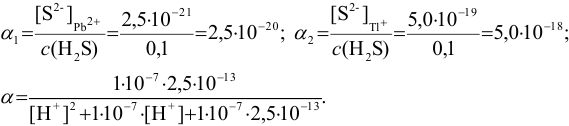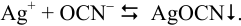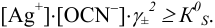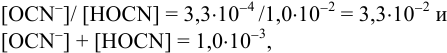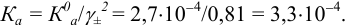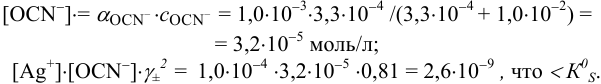Если понять, то задача очень даже легкая
Сначала напишем уравнение
FeCl3- хлорид железа(3)
KOH- гидроксид калия
FeCl3 + 3KOH = Fe(OH)3 + 3KCl
Fe(OH)3 — осадок бурого цвета
Масса- это произведения количества вещества на молярную массу
Молярная масса гидроксида железа 3 равна 56+ 16+ 16+ 16+ 1+1 +1 = 107 г/моль
Количества гидроксида найдем через хлорид железа
Количество хлорида железа равно 300г умножить на 0,06 разделить на 162,5 г/моль(молярная масса хлорида железа) равно 0,11 моль
Количество гидроксида железа по уравнению равно количеству хлорида железа и это 0,11 моль
Получаем, что масса осадка равна 0,11 моль умножить на 107 г/моль равно 11,77 г
Как найти массу осадка
Часто бывает так, что в ходе химической реакции образуется малорастворимое вещество, выпадающее в осадок (к примеру, сульфат бария, фосфат кальция, хлорид серебра и т.д.). Предположим, химику поставлена задача: определить массу этого осадка. Каким образом можно это сделать?

Инструкция
Если вам неизвестны точные количества исходных веществ, то придется действовать опытным путем. То есть сначала отделите осадок от раствора (путем фильтрования или на обычной воронке, или с использованием воронки Бюхнера). После чего тщательно высушите его и взвесьте на аналитических весах. Так вы получите достаточно точный результат.
Ну а если вам известны точные количества веществ, вступавших в реакцию, то все будет гораздо проще. Например, изначально было 28,4 грамма сульфата натрия и 20,8 грамма хлорида бария. Сколько граммов осадка образовалось?
Напишите правильное уравнение химической реакции: Na2SO4 + BaCl2 = BaSO4 + 2NaCl.В результате этой реакции образуется практически нерастворимое вещество – сульфат бария, мгновенно выпадающий в виде плотного белого осадка.
Вычислите, какое из веществ было взято в недостатке, а какое – в избытке. Для этого подсчитайте молярные массы исходных реагентов:46 + 32 + 64 = 142 г/моль – молярная масса сульфата натрия;
137 + 71 = 208 г/моль – молярная масса хлорида бария.То есть в реакцию вступали 0,2 моля сульфата натрия и 0,1 моля хлорида бария. Сульфат натрия был взят в избытке, следовательно, весь хлорид бария прореагировал.
Подсчитайте количество образовавшегося осадка. Для этого разделите молекулярную массу сульфата бария на молекулярную массу хлорида бария и результат умножьте на количество исходного вещества:20,8 * 233/208 = 23,3 грамма.
А если бы сульфат натрия был в недостатке? Предположим, в реакцию вступило бы не 28,4 грамма этой соли, а в 5 раз меньше – всего 5,68 грамма. И тут нет абсолютно ничего сложного. 5,68 грамма сульфата натрия составляют 0,04 моля. Следовательно, в реакцию с таким количеством этой соли могло вступить также всего 0,04 моля хлорида бария, то есть 0,04 х 208 = 8,32 грамма. Прореагировало только 8,32 грамма из исходных 20,8 граммов.
Умножив эту величину на соотношение молярных масс сульфата бария и хлорида бария, получите ответ: 8,32 * 233/208 = 9,32 грамма осадка.
Источники:
- как найти массу осадка в растворе
- Вычисление молярной массы эквивалента
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Как вычислить массу осадка
В ходе химической реакции могут образоваться самые разные вещества: газообразные, растворимые, малорастворимые. В последнем случае они выпадают в осадок. Часто возникает необходимость узнать, какова точная масса образовавшегося осадка. Каким образом это можно вычислить?
Можете действовать опытным путем. То есть, проведите химическую реакцию, тщательно отделите образовавшийся осадок от фильтрата с помощью обычной стеклянной воронки и бумажного фильтра, например. Более полное отделение достигается с помощью вакуумной фильтрации (на воронке Бюхнера).
После этого осадок высушите – естественным путем или под вакуумом, и взвесьте с возможно большей точностью. Лучше всего, на чувствительных лабораторных весах. Вот так будет решена поставленная задача. К этому методу прибегают, когда неизвестны точные количества исходных веществ, вступивших в реакцию.
Если же вам известны эти количества, тогда задачу можно решить гораздо проще и быстрее. Предположим, необходимо вычислить, сколько хлористого серебра образовалось при взаимодействии 20 грамм хлористого натрия — поваренной соли — и 17 грамм азотнокислого серебра.Прежде всего, напишите уравнение реакции:NaCl+AgNO3 = NaNO3 + AgCl.
В ходе этой реакции образуется очень мало растворимое соединение – хлорид серебра, выпадающий в виде белого осадка.
Подсчитайте молярные массы исходных веществ. Для хлористого натрия она примерно составляет 58,5 г/моль, для азотнокислого серебра – 170 г/моль. То есть, изначально по условиям задачи вы имели 20/58,5 = 0,342 моля хлористого натрия и 17/170 = 0,1 моля азотнокислого серебра.
Таким образом, получается, что хлористый натрий изначально был взят в избытке, то есть, реакция по второму исходному веществу пройдет до конца (прореагируют все 0,1 моля азотнокислого серебра, «связав» те же 0,1 моля поваренной соли). Сколько же образуется хлористого серебра? Для ответа на этот вопрос, найдите молекулярную массу образовавшегося осадка: 108 + 35,5 = 143,5. Умножив изначальное количество азотнокислого серебра (17 грамм) на соотношение молекулярных масс продукта и исходного вещества, получите ответ: 17* 143,5/170 = 14,3 грамма.Вот такова будет точная масса осадка, образовавшегося в ходе реакции.
Определение условий выпадения осадка и разделения ионов
Малорастворимое соединение начинает выделяться в виде твердой фазы, когда произведение концентраций (точнее, активностей) ионов данного электролита (так называемое ионное произведение, обозначаемое ИП) достигает величины произведения растворимости. Если 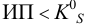
Пример 6.1.
Образуется ли осадок гидроксида марганца, если к 20 мл 0,20 М раствора хлорида марганца прилить 10 мл 1,0 М раствора 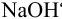
Решение:
Образование осадка происходит по реакции:
Значение 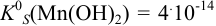
Вычисляем ионную силу раствора по формуле (2.1):
По табл. 1 приложения для полученного значения I находим коэффициенты активности:
Вычисляем ионное произведение с учетом того, что ионы в растворе взаимодействуют по основной реакции в соответствии с равновесными концентрациями, равными общим, побочных реакций нет (не учитываем гидролиз 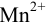
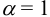
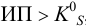
Пример 6.2.
Может ли образоваться осадок 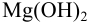
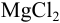
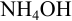
Решение:
При сливании двух равных объемов суммарный объем увеличивается вдвое, а концентрация веществ уменьшается вдвое, т. е. концентрация 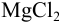
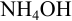
Равновесную концентрацию 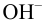
Взаимодействие ионов с образованием осадка протекает по реакции 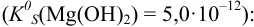
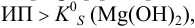
Пример 6.3.
Найдите pH начала выпадения осадка 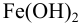
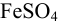
Решение:
Образование осадка можно представить уравнением:
Так как FeSO4-сильный электролит,
Следовательно, при pH = 7 начнется выпадение осадка 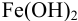
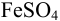
Осаждение (связывание) иона считается практически полным, если его концентрация в растворе становится <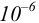
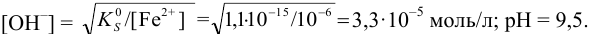
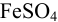
В растворе могут присутствовать несколько ионов, участвующих в реакциях образования осадков с одним и тем же реагентом. Это используется при объединении ионов в одну аналитическую группу аналитических классификаций катионов и анионов. По схеме расчета, подобной приведенной в примере 6.4, можно рассчитать условия начала и конца совместного осаждения группы катионов. Практический интерес представляет также определение возможности разделения двух ионов (при достаточно заметной разнице в As их соединений с одним и тем же реагентом), т. е. возможности их фракционного осаждения.
Пример 6.4.
Какой осадок выпадет первым и какая доля первого иона останется в растворе к началу осаждения второго, если к раствору, содержащему по 0,10 моль/л нитратов кальция и бария, постепенно добавлять 0,10 М карбонат аммония. Возможно ли количественное разделение ионов 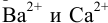
Решение:
Ионную силу учесть в данном случае сложно, поскольку меняется ионный состав раствора в ходе осаждения. Однако её изменения одинаково скажутся на изменении коэффициентов активности ионов, входящих в состав осадков, и не повлияют на общий вывод. Поэтому будем считать 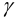
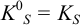
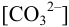
и для начала осаждения ионов 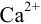
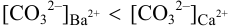
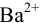
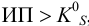
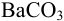
К началу осаждения 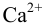
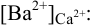
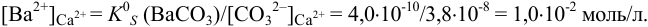
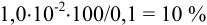
При практически полном осаждении доля иона в растворе составляла бы величину менее 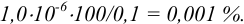
Пример 6.5.*
Найдите условия количественного разделения 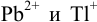
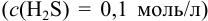
Решение:
Представим равновесия двух главных реакций:
Найдем концентрации 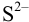
Следовательно, первым будет осаждаться 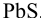
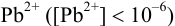
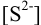
При сравнении полученной величины с концентрацией 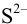
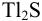
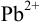
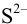
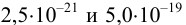
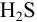
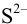
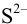
Предварительно вычислим молярные доли для иона S» в этих двух случаях при c(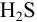
Решая последнее уравнение относительно 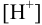
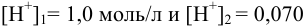
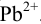
Пример 6.6.*
Установите возможность образования осадка 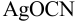
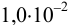
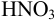
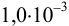
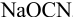
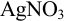
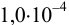
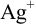
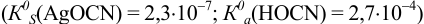
Решение:
Реакция образования осадка:
Условие осаждения:
По величине ионной силы в исходном растворе, равной 0,011, находим 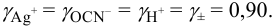
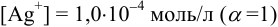
Равновесную концентрацию 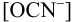
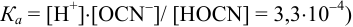
или предварительно вычислив 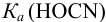
Учитывая, что 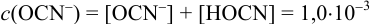
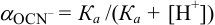
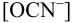
Осадок не выпадет.
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
Качественные реакции
О чем эта статья:
Что такое качественная реакция
Предположим, у нас есть две пробирки — с водой и с гидроксидом натрия (каустической содой). Можно ли отличить один раствор от другого? Можно, если подобрать правильный реагент, с которым один раствор будет реагировать, а другой нет, или на который эти вещества будут реагировать по-разному.
Для таких целей подойдут не все реагенты. Например, если смешать гидроксид натрия с соляной кислотой, реакция произойдет: NaOH + HCl = NaCl + H2O. Но внешне она никак не проявится — два прозрачных раствора образуют такой же прозрачный третий. Такой реагент не подходит.
Если же смешать гидроксид натрия с хлоридом магния, результат химической реакции будет заметен невооруженным глазом. Характерным признаком станет образование белого осадка: 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl. При смешивании хлорида магния с водой белый осадок не образуется. Значит, этот реагент позволяет отличить один раствор от другого.
Качественными называются реакции, позволяющие идентифицировать в исследуемом объекте определенные атомы, молекулы, функциональные группы и т. д. Идентификация происходит по внешним проявлениям, которые сопровождают реакцию: выделение газа, изменение цвета раствора, образование осадка, появление специфического запаха и др.
Качественные реакции — это простой и быстрый способ узнать качественный состав раствора или другого сложного вещества.
Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
Правила растворимости химических соединений
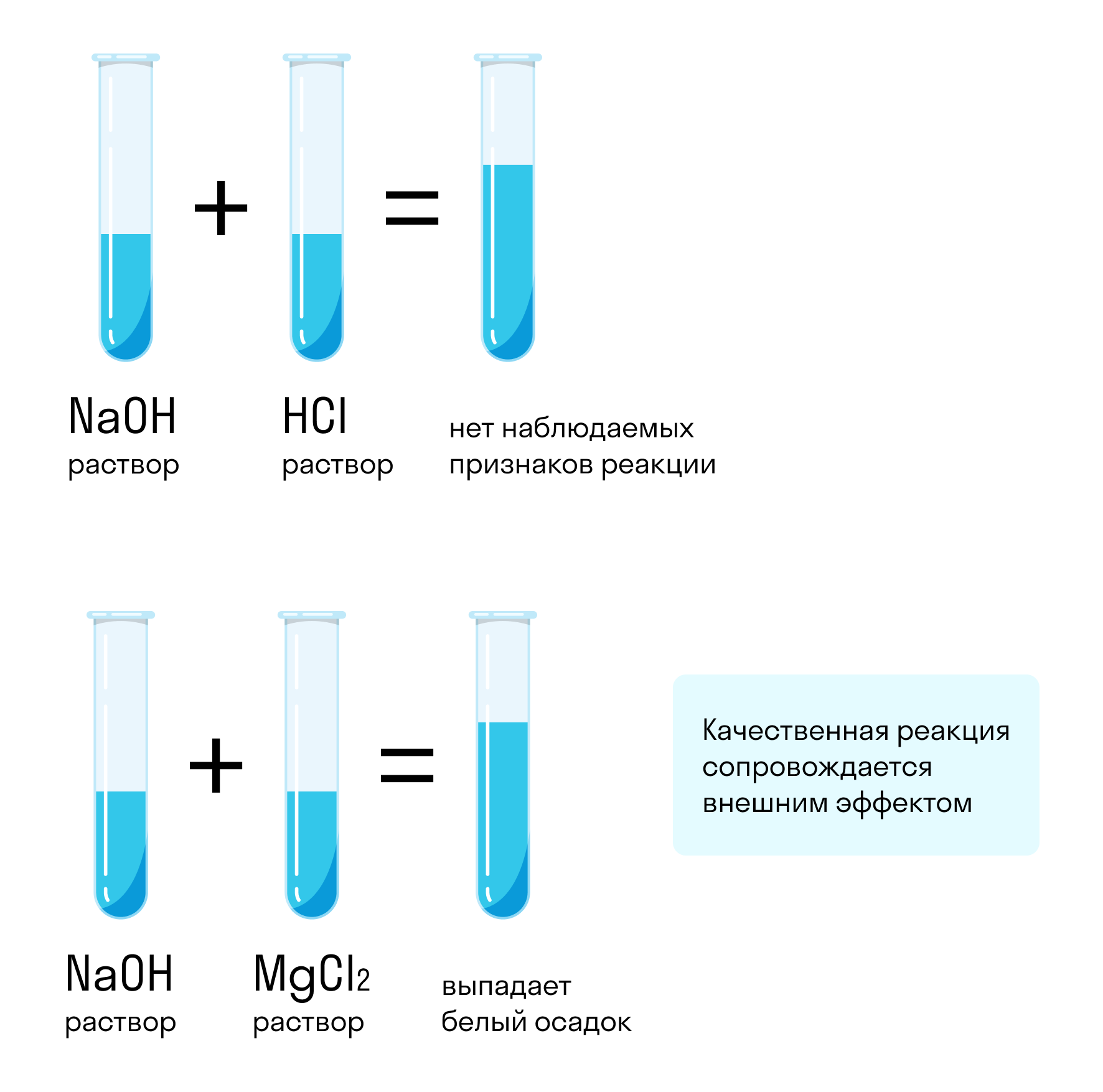
Сухим способом обычно проводят анализ в полевых условиях, а в лабораториях чаще использую растворы. Поэтому для изучения качественных реакций в химии (неорганической и органической) желательно знать правила растворимости сложных веществ. Наизусть учить, конечно, их не стоит — можно воспользоваться таблицей растворимости, которая приведена ниже.
Растворимы:
абсолютно все нитраты;
большинство солей аммония, натрия, калия (но есть исключения, например — гексанитритокобальтат (III) калия K3[Co(NO2)6]);
соли йодидной, хлороводородной и бромоводородной кислоты (но галогениды свинца (II), ртути (I) и серебра обладают умеренной растворимостью);
почти все сульфаты, кроме BaSO4, SrSO4, PbSO4 (при этом CaSO4 и Ag2SO4 умеренно растворимы).
Нерастворимы:
любые сульфиды, кроме сульфидов щелочных и щелочноземельных металлов, а также (NH4)2S;
любые гидроксиды, кроме гидроксидов щелочных металлов (умеренной растворимостью отличаются Sr(OH)2, Ca(OH)2, Ba(OH)2);
Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
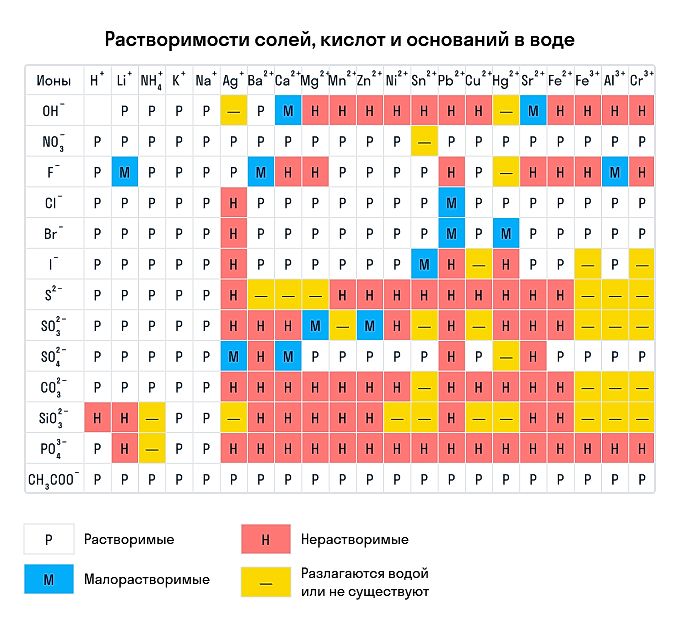
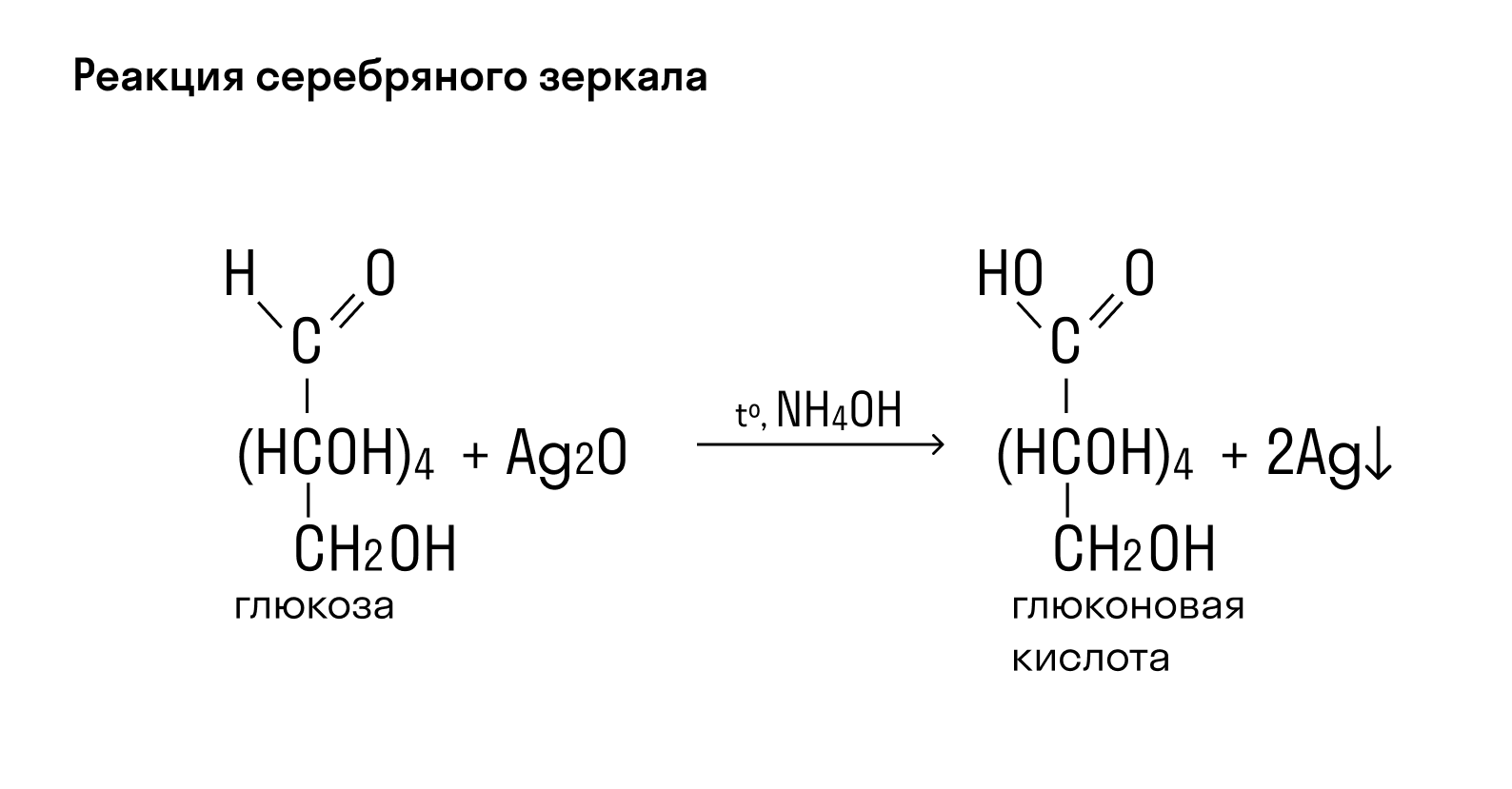
Глюкоза благодаря содержанию альдегидной группы в реакции с аммиачным раствором оксида серебра образует на стенках пробирки «серебряное зеркало». Вместе со свежеосажденным гидроксидом меди (II) она окрашивает раствор в синий цвет, а если данный раствор нагреть — происходит образование красно-оранжевого осадка.
СН2ОН — (СНОН)4 — СОН + Ag2O = СН2ОН — (СНОН)4 — СООН + 2Ag↓ — реакция «серебряного зеркала».
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).
Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
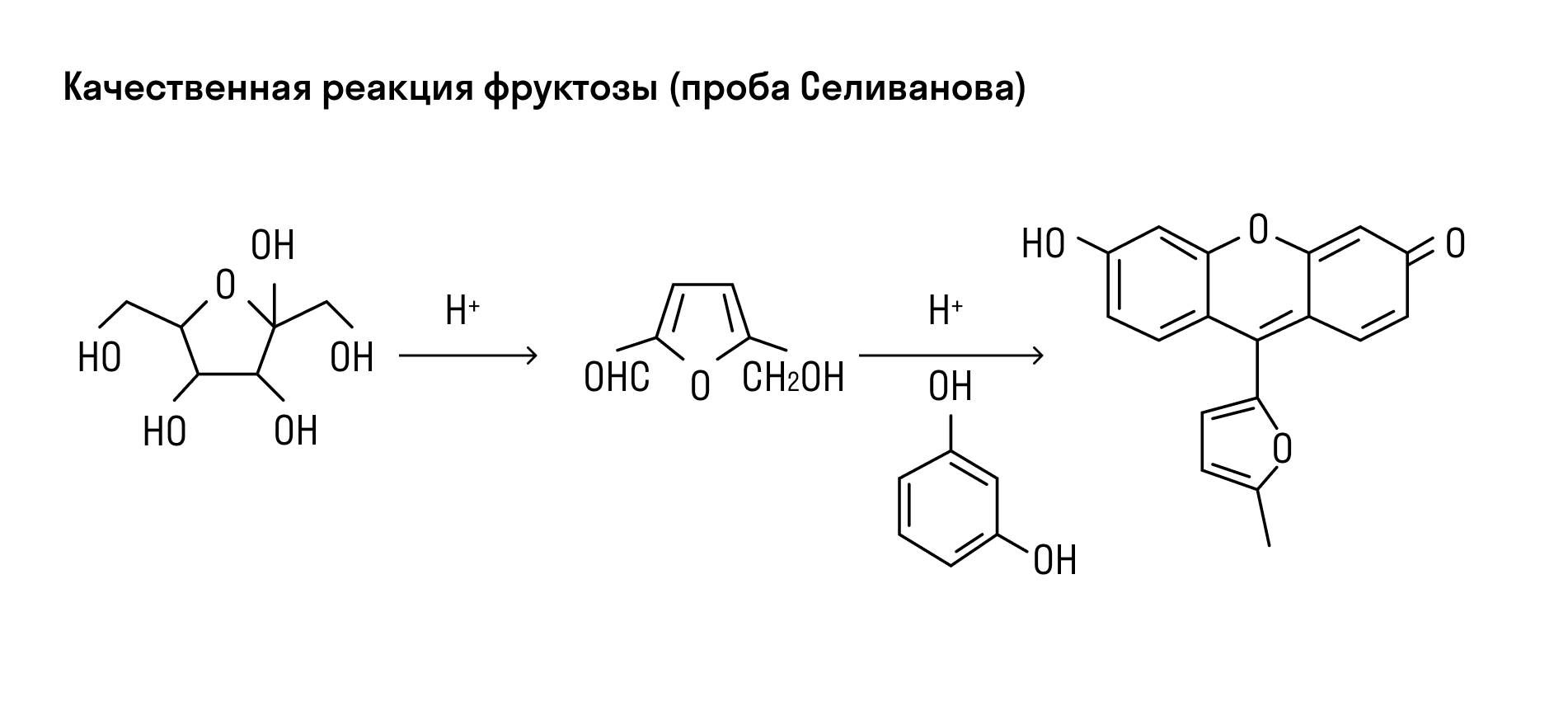
Углеводы с содержанием крахмала можно узнать по синему цвету раствора при добавлении йода. После нагревания такой раствор теряет цвет, но при охлаждении снова становится синим. Фруктозу можно идентифицировать по реакции с резорцином в растворе c соляной кислотой — смесь приобретает вишневый цвет (проба Селиванова).
Все качественные реакции с органическими соединениями в рамках статьи описать невозможно, но в таблице ниже указаны самые важные из них.
Цвета осадков и газов в неорганической химии
Для сдачи ОГЭ необходимо знать и предсказывать по формуле цвет осадка или газа, а также характерные запахи, которыми обладают газы. В данном документе собраны необходимые данные по этому вопросу.
Осадки бывают разных цветов и разной консистенции. Все это является частью описания признака реакции.
Задание 13 ОГЭ по химии.

Автор: Фрундина Дарья Андреевна, учитель химии.
4.1.4. Качественные реакции на неорганические вещества и ионы.
Представим себе такую ситуацию:
Вы работаете в лаборатории и решили провести какой-либо эксперимент. Для этого вы открыли шкаф с реактивами и неожиданно увидели на одной из полок следующую картину. У двух баночек с реактивами отклеились этикетки, которые благополучно остались лежать неподалеку. При этом установить точно какой банке соответствует какая этикетка уже невозможно, а внешние признаки веществ, по которым их можно было бы различить, одинаковы.
В таком случае проблема может быть решена с использованием, так называемых, качественных реакций.
Качественными реакциями называют такие реакции, которые позволяют отличить одни вещества от других, а также узнать качественный состав неизвестных веществ.
Например, известно, что катионы некоторых металлов при внесении их солей в пламя горелки окрашивают его в определенный цвет:
Данный метод может сработать только в том случае, если различаемые вещества по разному меняют цвет пламени, или же одно из них не меняет цвет вовсе.
Но, допустим, как назло, вам определяемые вещества цвет пламени не окрашивают, или окрашивают его в один и тот же цвет.
В этих случаях придется отличать вещества с применением других реагентов.
В каком случае мы можем отличить одно вещество от другого с помощью какого-либо реагента?
Возможны два варианта:
- Одно вещество реагирует с добавленным реагентом, а второе нет. При этом обязательно, должно быть ясно видно, что реакция одного из исходных веществ с добавленным реагентом действительно прошла, то есть наблюдается какой-либо ее внешний признак — выпадал осадок, выделился газ, произошло изменение цвета и т.п.
Например, нельзя отличить воду от раствора гидроксида натрия с помощью соляной кислоты, не смотря на то, что щелочи с кислотами прекрасно реагируют:
NaOH + HCl = NaCl + H2O
Связано это с отсутствием каких-либо внешних признаков реакции. Прозрачный бесцветный раствор соляной кислоты при смешении с бесцветным раствором гидроксида образует такой же прозрачный раствор:
Но зато, можно воду от водного раствора щелочи можно различить, например, с помощью раствора хлорида магния – в данной реакции выпадает белый осадок:
2) также вещества можно отличить друг от друга, если они оба реагируют с добавляемым реагентом, но делают это по-разному.
Например, различить раствор карбоната натрия от раствора нитрата серебра можно с помощью раствора соляной кислоты.
с карбонатом натрия соляная кислота реагирует с выделением бесцветного газа без запаха — углекислого газа (СО2):
а с нитратом серебра с образованием белого творожистого осадка AgCl
Ниже в таблицах представлены различные варианты обнаружения конкретных ионов:
Качественные реакции на катионы
Выпадение белого осадка, не растворимого в кислотах:
1) Выпадение осадка голубого цвета:
2) Выпадение осадка черного цвета:
Выпадение осадка черного цвета:
Выпадение белого осадка, не растворимого в HNO3, но растворимого в аммиаке NH3·H2O:
2) Гексацианоферрат (III) калия (красная кровяная соль) K3[Fe(CN)6]
1) Выпадение белого осадка, зеленеющего на воздухе:
2) Выпадение синего осадка (турнбулева синь):
2) Гексацианоферрат (II) калия (желтая кровяная соль) K4[Fe(CN)6]
3) Роданид-ион SCN −
1) Выпадение осадка бурого цвета:
2) Выпадение синего осадка (берлинская лазурь):
3) Появление интенсивно-красного (кроваво-красного) окрашивания:
Fe 3+ + 3SCN − = Fe(SCN)3
Выпадение белого осадка гидроксида алюминия при приливании небольшого количества щелочи:
и его растворение при дальнейшем приливании:
Выделение газа с резким запахом:
Посинение влажной лакмусовой бумажки
| Катион | Реактив | Признак реакции |
| Ba 2+ | SO4 2- | |
| Al 3+ | Щелочь (амфотерные свойства гидроксида) | |
| NH4 + | OH − , нагрев | |
| H + (кислая среда) |
Красное окрашивание |
Качественные реакции на анионы
Выпадение белого осадка, не растворимого в кислотах:
1) Образование раствора синего цвета, содержащего ионы Cu 2+ , выделение газа бурого цвета (NO2)
2) Возникновение окраски сульфата нитрозо-железа (II) [Fe(H2O)5NO] 2+ . Окраска от фиолетовой до коричневой (реакция «бурого кольца»)
Выпадение светло-желтого осадка в нейтральной среде:
Выпадение желтого осадка, не растворимого в уксусной кислоте, но растворимого в HCl:
Выпадение черного осадка:
1) Выпадение белого осадка, растворимого в кислотах:
2) Выделение бесцветного газа («вскипание»), вызывающее помутнение известковой воды:
Выпадение белого осадка и его растворение при дальнейшем пропускании CO2:
Выделение газа SO2 с характерным резким запахом (SO2):
Выпадение белого осадка:
Выпадение белого творожистого осадка, не растворимого в HNO3, но растворимого в NH3·H2O(конц.):
http://4ege.ru/gia-po-himii/60744-cveta-osadkov-i-gazov-v-neorganicheskoj-himii.html
http://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/4-1-4-kachestvennye-reakcii-na-neorganicheskie-veshhestva-i-iony
| Анион | Воздействие или реактив | Признак реакции. Уравнение реакции |
| SO4 2- | Ba 2+ | |
| CrO4 2- | Ba 2+ | |
| CO2 | Известковая вода Ca(OH)2 |