Темы кодификатора ЕГЭ: Электроотрицательность. Степень окисления и валентность химических элементов.
Когда атомы взаимодействуют и образуют химическую связь, электроны между ними в большинстве случаев распределяются неравномерно, поскольку свойства атомов различаются. Более электроотрицательный атом сильнее притягивает к себе электронную плотность. Атом, который притянул к себе электронную плотность, приобретает частичный отрицательный заряд δ—, его «партнер» — частичный положительный заряд δ+. Если разность электроотрицательностей атомов, образующих связь, не превышает 1,7, мы называем связь ковалентной полярной. Если разность электроотрицательностей, образующих химическую связь, превышает 1,7, то такую связь мы называем ионной.
Степень окисления – это вспомогательный условный заряд атома элемента в соединении, вычисленный из предположения, что все соединения состоят из ионов (все полярные связи – ионные).
Что значит «условный заряд»? Мы просто-напросто договариваемся, что немного упростим ситуацию: будем считать любые полярные связи полностью ионными, и будем считать, что электрон полностью уходит или приходит от одного атома к другому, даже если на самом деле это не так. А уходит условно электрон от менее электроотрицательного атома к более электроотрицательному.
Например, в связи H-Cl мы считаем, что водород условно «отдал» электрон, и его заряд стал +1, а хлор «принял» электрон, и его заряд стал -1. На самом деле таких полных зарядов на этих атомах нет.
Наверняка, у вас возник вопрос — зачем же придумывать то, чего нет? Это не коварный замысел химиков, все просто: такая модель очень удобна. Представления о степени окисления элементов полезны при составлении классификации химических веществ, описании их свойств, составлении формул соединений и номенклатуры. Особенно часто степени окисления используются при работе с окислительно-восстановительными реакциями.
Степени окисления бывают высшие, низшие и промежуточные.
Высшая степень окисления равна номеру группы со знаком «плюс».
Низшая определяется, как номер группы минус 8.
И промежуточная степень окисления — это почти любое целое число в интервале от низшей степени окисления до высшей.
Например, для азота характерны: высшая степень окисления +5, низшая 5 — 8 = -3, а промежуточные степени окисления от -3 до +5. Например, в гидразине N2H4 степень окисления азота промежуточная, -2.
Чаще всего степень окисления атомов в сложных веществах обозначается сначала знаком, потом цифрой, например +1, +2, -2 и т.д. Когда речь идет о заряде иона (предположим, что ион реально существует в соединении), то сначала указывают цифру, потом знак. Например: Ca2+, CO3 2-.
Для нахождения степеней окисления используют следующие правила:
- Степень окисления атомов в простых веществах равна нулю;
- В нейтральных молекулах алгебраическая сумма степеней окисления равна нулю, для ионов эта сумма равна заряду иона;
- Степень окисления щелочных металлов (элементы I группы главной подгруппы) в соединениях равна +1, степень окисления щелочноземельных металлов (элементы II группы главной подгруппы) в соединениях равна +2; степень окисления алюминия в соединениях равна +3;
- Степень окисления водорода в соединениях с металлами (солеобразные гидриды — NaH, CaH2 и др.) равна -1; в соединениях с неметаллами (летучие водородные соединения) +1;
- Степень окисления кислорода равна -2. Исключение составляют пероксиды – соединения, содержащие группу –О-О-, где степень окисления кислорода равна -1, и некоторые другие соединения (супероксиды, озониды, фториды кислорода OF2 и др.);
- Степень окисления фтора во всех сложных веществах равна -1.
Выше перечислены ситуации, когда степень окисления мы считаем постоянной. У всех остальных химических элементов степень окисления — переменная, и зависит от порядка и типа атомов в соединении.
Примеры:
Задание: определите степени окисления элементов в молекуле дихромата калия: K2Cr2O7.
Решение: степень окисления калия равна +1, степень окисления хрома обозначим, как х, степень окисления кислорода -2. Сумма всех степеней окисления всех атомов в молекуле равна 0. Получаем уравнение: +1*2+2*х-2*7=0. Решаем его, получаем степень окисления хрома +6.
В бинарных соединениях более электроотрицательный элемент характеризуется отрицательной степенью окисления, менее электроотрицательный – положительной.
Обратите внимание, что понятие степени окисления – очень условно! Степень окисления не показывает реальный заряд атома и не имеет реального физического смысла. Это упрощенная модель, которая эффективно работает, когда нам необходимо, например, уравнять коэффициенты в уравнении химической реакции, или для алгоритмизации классификации веществ.
Степень окисления – это не валентность! Степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе Н2 равна I, а степень окисления, согласно правилу 1, равна 0.
Это базовые правила, которые помогут Вам определить степень окисления атомов в соединениях в большинстве случаев.
В некоторых ситуациях вы можете столкнуться с трудностями при определении степени окисления атома. Рассмотрим некоторые из этих ситуаций, и разберем способы их разрешения:
- В двойных (солеобразных) оксидах степень у атома, как правило, две степени окисления. Например, в железной окалине Fe3O4 у железа две степени окисления: +2 и +3. Какую из них указывать? Обе. Для упрощения можно представить это соединение, как соль: Fe(FeO2)2. При этом кислотный остаток образует атом со степенью окисления +3. Либо двойной оксид можно представить так: FeO*Fe2O3.
- В пероксосоединениях степень окисления атомов кислорода, соединенных ковалентными неполярными связями, как правило, изменяется. Например, в пероксиде водорода Н2О2, и пероксидах щелочных металлов степень окисления кислорода -1, т.к. одна из связей – ковалентная неполярная (Н-О-О-Н). Другой пример – пероксомоносерная кислота (кислота Каро) H2SO5 (см. рис.) содержит в составе два атома кислорода со степенью окисления -1, остальные атомы со степенью окисления -2, поэтому более понятной будет такая запись: H2SO3(O2). Известны также пероксосоединения хрома – например, пероксид хрома (VI) CrO(O2)2 или CrO5, и многие другие.
- Еще один пример соединений с неоднозначной степенью окисления – супероксиды (NaO2) и солеобразные озониды KO3. В этом случае уместнее говорить о молекулярном ионе O2 с зарядом -1 и и O3 с зарядом -1. Строение таких частиц описывается некоторыми моделями, которые в российской учебной программе проходят на первых курсах химических ВУЗов: МО ЛКАО, метод наложения валентных схем и др.
- В органических соединениях понятие степени окисления не очень удобно использовать, т.к. между атомами углерода существует большое число ковалентных неполярных связей. Тем не менее, если нарисовать структурную формулу молекулы, то степень окисления каждого атома также можно определить по типу и количеству атомов, с которыми данный атом непосредственно связан. Например, у первичных атомов углерода в углеводородах степень окисления равна -3, у вторичных -2, у третичных атомов -1, у четвертичных — 0.
Потренируемся определять степень окисления атомов в органических соединениях. Для этого необходимо нарисовать полную структурную формулу атома, и выделить атом углерода с его ближайшим окружением — атомами, с которыми он непосредственно соединен.
Полезные советы:
- Для упрощения расчетов можно использовать таблицу растворимости – там указаны заряды наиболее распространенных ионов. На большинстве российских экзаменов по химии (ЕГЭ, ГИА, ДВИ) использование таблицы растворимости разрешено. Это готовая шпаргалка, которая во многих случаях позволяет значительно сэкономить время.
- При расчете степени окисления элементов в сложных веществах сначала указываем степени окисления элементов, которые мы точно знаем (элементы с постоянной степенью окисления), а степень окисления элементов с переменной степенью окисления обозначаем, как х. Сумма всех зарядов всех частиц равна нулю в молекуле или равна заряду иона в ионе. Из этих данных легко составить и решить уравнение.
Тренировочный тест по теме «Степени окисления и валентность» 10 вопросов, при каждом прохождении новые.
239
Создан на
07 января, 2022 От Admin
Тренировочный тест «Степени окисления»
1 / 10
1) Al 2) Sr 3) In 4) Tl 5) C
Из числа указанных в ряду элементов выберите два элемента, каждый из которых может образовать оксид с общей формулой ЭО.
Запишите в поле ответа номера выбранных элементов.
2 / 10
1) Na 2) N 3) F 4) Cu 5) Be
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях проявляют переменную степень окисления.
3 / 10
1) K 2) Na 3) Se 4) Mg 5) S
Из числа указанных в ряду элементов выберите два элемента, которые в соединении с водородом проявляют степень окисления +1.
4 / 10
1) Na 2) Cl 3) As 4) Ca 5) Ge
Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +5.
5 / 10
1) Ne 2) Be 3) N 4) C 5) O
Из указанных в ряду элементов выберите два элемента, которые могут проявлять валентность, равную номеру группы.
6 / 10
1) Be 2) O 3) Cl 4) Mn 5) N
Из числа указанных в ряду элементов выберите два элемента, которые не проявляют валентности, равной номеру группы.
7 / 10
1) C 2) Rb 3) Sr 4) Be 5) Si
Из числа указанных в ряду элементов выберите два элемента, которые в оксидах проявляют валентность IV.
8 / 10
1) Mn 2) Sc 3) F 4) Si 5) P
Из числа указанных в ряду элементов выберите два элемента, которые имеют одинаковую разность между значениями их высшей и низшей степеней окисления.
9 / 10
1) Cr 2) Al 3) Ti 4) P 5) S
Из числа указанных в ряду элементов выберите два элемента, которые в высших оксидах проявляют одинаковую степень окисления.
10 / 10
1) Ga 2) Cr 3) O 4) Br 5) Mn
Из числа указанных в ряду элементов выберите два элемента, которые проявляют степень окисления –1.
Ваша оценка
The average score is 54%
На этой странице вы узнаете:
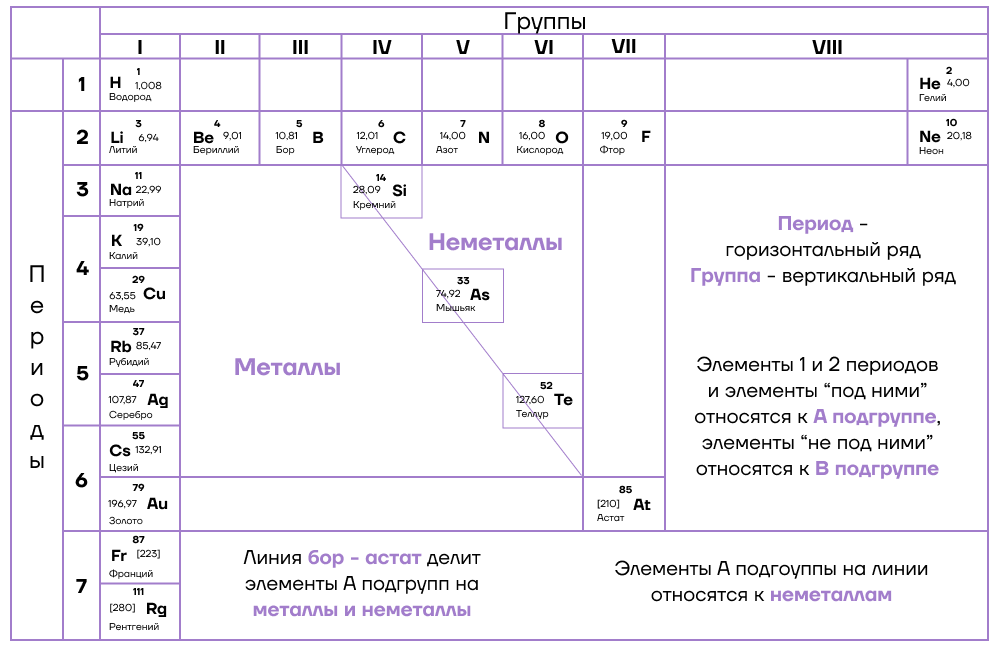
- Закономерности изменения химических свойств элементов и их соединений по периодам и группам в Периодической системе.
- Как связаны снеговик и радиус атома?
Химические элементы — законопослушные граждане! Они подчиняются Периодическому закону, о котором сейчас пойдет речь.
В 1869 г. Д.И.Менделеев сформулировал периодический закон, современная формулировка которого звучит следующим образом:
Свойства химических элементов находятся в периодической зависимости от заряда ядра атомов химических элементов.
Перед тем как говорить о Периодической системе, давайте разберемся с тем, что же такое собственно химический элемент.
Химический элемент — совокупность (группа, сорт, вид) атомов, обладающих одинаковыми свойствами, с одним и тем же количеством протонов и нейтронов в ядре, электронов в электронной оболочке.
Свойства элементов можно распределить по нескольким группам:
- металлические/неметаллические свойства;
- окислительно-восстановительные свойства;
- радиус атома;
- электроотрицательность;
- валентность и степени окисления;
- энергия ионизации;
- энергия сродства к электрону.
Также химические элементы, в отличие от веществ:
- Могут образовывать ионы.
- Содержатся в различных органических и неорганических веществах.
- Могут образовывать аллотропные модификации (аллотропия — способность химического элемента образовывать несколько простых веществ). Например, атом кислорода может быть в виде соединения кислорода О2 и озона О3.
Имеют изотопы — разновидности атомов химического элемента, имеющие одинаковое количество протонов и электронов, но разное количество нейтронов, следовательно, и разную атомную массу.
Давай разберем подробнее, как именно зависят свойства элемента от местонахождения в Периодической системе.
Закономерности изменения химических свойств элементов
- Металлические/восстановительные свойства
Под металлическими свойствами подразумевают способность атомов отдавать электроны.
Можно провести воображаемую линию, которая начинается у атома бора и заканчивается у атома астата. Так вот, все элементы, которые попадут в левую область таблицы будут являться металлами, а элементы главных подгрупп, которые попадут в правую часть — неметаллами.
Поэтому металлические/восстановительные свойства в периодах увеличиваются справа налево, а в группах — сверху вниз (т.е. при движении к францию).
- Неметаллические/окислительные свойства
Здесь работает все с точностью наоборот: они будут увеличиваться слева направо в периодах, а в группах — снизу вверх (т.е. при движении к фтору).
- Радиус атома
При движении по периоду увеличивается число электронов на соответствующем валентном уровне — электрончики начинают сильнее притягиваться к положительному ядру, тем самым «сжимая» размер радиуса. Т.е. радиус атома уменьшается слева направо при движении по периоду.
При движении по группе сверху вниз увеличивается число электронных оболочек, атом становится «толще», поэтому сверху вниз по группе радиус атома увеличивается.

С увеличением номера периода количество электронных слоев растет, а значит, увеличивается и радиус атома; но так как к фтору увеличивается электроотрицательность, то электроны всё ближе и ближе «прижимаются» к ядру атома: атомный радиус уменьшается.
Проще всего это представить в виде снеговика, у которого самая «маленькая» голова и самое «большое» туловище. Именно так увеличивается радиус ядра атома по группе.
- Электроотрицательность
Это способность атомов оттягивать на себя электроны других атомов в химической связи. Электроотрицательность увеличивается при движении в периодической системе слева направо и снизу вверх. Самым электроотрицательным элементом является фтор, это нужно запомнить!
- Основные свойства высших оксидов/гидроксидов
Основные свойства зависят от металлических свойств и меняются точно так же — в периодах увеличиваются справа налево, а в группах — сверху вниз.
- Кислотные свойства высших оксидов/гидроксидов
Кислотные свойства зависят уже от неметаллических свойств и меняются соответствующим образом — увеличиваются слева направо в периодах, а в группах — снизу вверх.
- Высшая/низшая степень окисления
Чтобы определить высшую/низшую степень окисления элемента, необходимо смотреть на номер группы, в которой находится элемент: высшая степень окисления равна номеру группы со знаком «плюс» (+N). Низшая c.o. определяется, как разность номера группы и восьми:
Высшая с.o. = N
Низшая с.o. = N – 8,
где N — номер группы, в которой располагается элемент
В простых веществах степень окисления элемента будет равна 0.
Простое вещество — химическое вещество, состоящее исключительно из атомов одного химического элемента.
Простые вещества имеют определенный набор физических свойств:
- агрегатное состояние (твердое, жидкое, газообразное);
- твердость/хрупкость;
- плотность;
- кристаллическая решетка;
- цвет, запах, наличие блеска и др.
При взаимодействии двух простых веществ (неметалла с металлом или неметалла с другим неметаллом) образуются бинарные соединения.
Бинарные соединения — соединения, которые состоят из двух элементов: металла и неметалла или двух различных неметаллов.
- Высшая/низшая валентность
Здесь используем следующие правила:
Высшая валентность = N
Низшая валентность = 8 — N
Исключением является азот, у которого максимальная валентность равна IV
Можно поинтересоваться, а почему так?
У азота есть только основное состояние атома, в котором три неспаренных электрона и неподеленная электронная пара. Возможность «рассорить» эту пару у азота попросту нет! Поэтому возможны следующие варианты:
- один неспаренный электрон = валентность I;
- два неспаренных электрона = валентность II;
- три неспаренных электрона = валентность III;

- три неспаренных электрона + неподеленная электронная пара = валентность IV.

Аналогичные исключения действует для кислорода и фтора, запоминаем их по аббревиатуре FON.

- Кислотные свойства водородных соединений
В группе кислотные свойства зависят от от радиуса атома — чем больше атом, с которым связан водород, тем легче последнему отщепляться от него, поэтому в группе кислотные свойства усиливаются сверху вниз.
В периоде кислотные свойства зависят от неметаллических свойств — они увеличиваются слева направо.
- Энергия ионизации
Это энергия, необходимая для отрыва одного электрона от нейтрального атома. В группах она увеличивается снизу вверх, в периодах — слева направо.
- Сродство к электрону
Это энергия, выделяющаяся при присоединении одного электрона к нейтральному атому. Она изменяется аналогично изменению энергии ионизации.
Фактчек
- Таблица Менделеева состоит из «столбцов», т.е. групп и «строк», т.е. периодов;
- Металлические свойства связаны со способностью отдавать электроны;
- Радиус атома увеличивается при увеличении числа электронных оболочек;
- Высшая валентность для большинства элементов равна номеру группы.
Проверь себя
Задание 1.
Какова высшая валентность алюминия?
- I;
- II;
- III;
- IV.
Задание 2.
Водородное соединение какого элемента обладает наибольшими основными свойствами?
- Азот;
- Фосфор;
- Сурьма;
- Мышьяк.
Задание 3.
Из перечисленных элементов металлом является:
- Кремний;
- Франций;
- Радон;
- Астат.
Задание 4.
Гидроксид какого элемента проявляет основные свойства?
- Серы;
- Хлора;
- Рубидия;
- Фосфора.
Ответы: 1. — 3 ; 2. — 1; 3. — 2; 4. — 3.
- Курс
Меня зовут Кузьмин Владимир Александрович.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
Степень окисления
Мы уже говорили, что термин валентность допустимо применять только к атомам, которые связаны с другими атомами ковалентными химическими связями. Так как по определению, валентность — это количество ковалентных связей конкретного атома.
Во многих школьных учебниках и пособиях учат составлять формулы по валентностям, даже для соединений с ионными связями. Для упрощения процедуры составления формул это, на наш взгляд, допустимо. Но нужно понимать, что это не совсем корректно ввиду вышеизложенной причины.
Более универсальным понятием является понятие о степени окисления. По значениям степеней окисления атомов
так же как и по значениям валентности можно составлять химические формулы и записывать формульные единицы.
Степень окисления — это условный заряд атома в частице (молекуле, ионе, радикале), вычисленный в приближении того, что все связи в частице являются ионными.
Прежде чем определять степени окисления, необходимо сравнить электроотрицательности связуемых атомов. Атом с большим значением электроотрицательности имеет отрицательную степень окисления, а с меньшим положительную.
С целью объективного сравнения значений электроотрицательности атомов при расчёте степеней окисления, в 2013 году IUPAC дал рекомендацию использовать шкалу Аллена.
* Так, например, по шкале Аллена электроотрицательность азота 3,066, а хлора 2,869.
Проиллюстрируем данное выше определение на примерах. Составим структурную формулу молекулы воды.
Ковалентные полярные связи O-H обозначены синим цветом.
Представим, что обе связи являются не ковалентными, а ионными. Если бы они были ионными, то с каждого атома водорода на более электроотрицательный атом кислорода перешло бы по одному электрону. Обозначим эти переходы синими стрелками.
*В этом
примере, стрелка служит для наглядной иллюстрации полного перехода электронов, а не для иллюстрации индуктивного эффекта.
Легко заметить, что число стрелок показывает количество перешедших электронов, а их направление — направление перехода электронов.
На атом кислорода направлено две стрелки, это значит, что к атому кислорода переходит два электрона: 0 + (-2) = -2. На атоме кислорода образуется заряд равный -2. Это и есть степень окисления кислорода в молекуле воды.
С каждого атома водорода уходит по одному электрону: 0 — (-1) = +1. Значит, атомы водорода имеют степень окисления равную +1.
Сумма степеней окисления всегда равняется общему заряду частицы.
Например, сумма степеней окисления в молекуле воды равна: +1(2) + (-2) = 0. Молекула — электронейтральная частица.
Если мы вычисляем степени окисления в ионе, то сумма степеней окисления, соответственно, равна его заряду.
Значение степени окисления принято указывать в верхнем правом углу от символа элемента. Причём, знак пишут впереди числа. Если знак стоит после числа — то это заряд иона.
Например, S-2 — атом серы в степени окисления -2, S2- — анион серы с зарядом -2.
S+6O-242- — значения степеней окисления атомов в сульфат-анионе (заряд иона выделен зелёным цветом).
Теперь рассмотрим случай, когда соединение имеет смешанные связи: Na2SO4. Связь между сульфат-анионом и катионами натрия — ионная, связи между атомом серы и атомами кислорода в сульфат-ионе — ковалентные полярные. Запишем графическую формулу сульфата натрия, а стрелками укажем направление перехода электронов.
*Структурная формула отображает порядок ковалентных связей в частице (молекуле, ионе, радикале). Структурные формулы применяют только для частиц с ковалентными связями. Для частиц с ионными связями понятие структурной формулы не имеет смысла. Если в частице имеются ионные связи, то применяют графическую формулу.
Видим, что от центрального атома серы уходит шесть электронов, значит степень окисления серы 0 — (-6) = +6.
Концевые атомы кислорода принимают по два электрона, значит их степени окисления 0 + (-2) = -2
Мостиковые атомы кислорода принимают по два электрона, их степень окисления равна -2.
Определить степени окисления возможно и по структурно-графической формуле, где черточками указывают ковалентные связи, а у ионов указывают заряд.
В этой формуле мостиковые атомы кислорода уже имеют единичные отрицательные заряды и к ним дополнительно приходит по электрону от атома серы -1 + (-1) = -2, значит их степени окисления равны -2.
Степень окисления ионов натрия равна их заряду, а т.е. +1.
Определим степени окисления элементов в надпероксиде (супероксиде) калия. Для этого составим графическую формулу супероксида калия, стрелочкой покажем перераспределение электронов. Связь O-O является ковалентной неполярной, поэтому в ней перераспределение электронов не указывается.
* Надпероксид-анион является ион-радикалом. Формальный заряд одного атома кислорода равен -1, а другого, с неспаренным электроном, 0.
Видим, что степень окисления калия равна +1. Степень окисления атома кислорода, записанного в формуле напротив калия, равна -1. Степень окисления второго атома кислорода равна 0.
Точно также можно определить степени окисления и по структурно-графической формуле.
В кружочках указаны формальные заряды иона калия и одного из атомов кислорода. При этом значения формальных зарядов совпадают со значениями степеней окисления.
Так как оба атома кислорода в надпероксид-анионе имеют разные значения степени окисления, то можно вычислить средне-арифметическую степень окисления кислорода.
Она будет равна [0 + (-1)] / 2 = — 1/2 = -0,5.
Значения среднеарифметических степеней окисления обычно указывают в брутто-формулах или формульных единицах, чтобы показать что сумма степеней окисления равна общему заряду системы.
Для случая с надпероксидом: +1 + 2(-0,5) = 0
Легко определить степени окисления используя электронно-точечные формулы, в которых указывают точками неподеленные электронные пары и электроны ковалентных связей.
Кислород — элемент VIА — группы, следовательно в его атоме 6 валентных электронов. Представим, что в молекуле воды связи ионные, в этом случае атом кислорода получил бы октет электронов.
Степень окисления кислорода соответственно равна: 6 — 8 = -2.
А атомов водорода: 1 — 0 = +1
Умение определять степени окисления по графическим формулам бесценно для понимания сущности этого понятия, так же это умение потребуется в курсе органической химии. Если же мы имеем дело с неорганическими веществами, то необходимо уметь определять степени окисления по молекулярным формулам и формульным единицам.
Для этого прежде всего нужно понять, что степени окисления бывают постоянными и переменными. Элементы, проявляющие постоянную степень окисления необходимо запомнить.
Любой химический элемент характеризуется высшей и низшей степенями окисления.
Низшая степень окисления — это заряд, который приобретает атом в результате приёма максимального количества электронов на внешний электронный слой.
Ввиду этого, низшая степень окисления имеет отрицательное значение, за исключением металлов, атомы которых электроны никогда не принимают ввиду низких значений электроотрицательности. Металлы имеют низшую степень окисления равную 0.
Большинство неметаллов главных подгрупп старается заполнить свой внешний электронный слой до восьми электронов, после этого атом приобретает устойчивую конфигурацию (правило октета). Поэтому, чтобы определить низшую степень окисления, необходимо понять сколько атому не хватает валентных электронов до октета.
Например, азот — элемент VА группы, это значит, что в атоме азота пять валентных электронов. До октета атому азота не хватает трёх электронов. Значит низшая степень окисления азота равна: 0 + (-3) = -3
Высшая степень окисления — это заряд, который приобретает атом в результате отдачи максимального количества валентных электронов.
По этой причине высшая степень окисления имеет положительное значение, за исключением фтора, атом которого электроны никогда и никому не отдаёт, фтор — самый электроотрицательный элемент.
Высшая степень окисления фтора равна 0.
Чтобы определить высшую степень окисления, необходимо понять какое максимальное количество валентных электронов может отдать атом другим атомам.
Например, в атоме азота пять валентных электронов, если все пять электронов атом азота отдаст другому, более электроотрицательному атому 0 — (-5), то он приобретет степень окисления равную +5.
+5 — это высшая степень окисления азота.
Атом кислорода не может отдать все шесть валентных электронов, так как у кислорода высокое значение электроотрицательности. Кислород максимум может отдать два валентные электрона и то только атому фтора. По этой причине высшая степень окисления кислорода равна +2 в соединении OF2 — фторид кислорода.
Значение степени окисления часто не совпадает с валентностью.
Формальный заряд при этом тоже может отличаться (он указывается в кружочках).
Рекомендуем запомнить некоторые примеры, иллюстрирующие этот факт.
В катионе аммония валентность азота равна IV, а степень окисления -3.
В молекуле угарного газа (CO) валентность углерода и кислорода равна III, а степени окисления +2 и -2 (не удивляйтесь этому, даже если Вас учили, что кислород всегда двухвалентен, так как в современном понимании валентность — всего лишь число ковалентных связей атома).
В катионе гидроксония атом кислорода трёхвалентен, а его степень окисления равна -2.
В молекуле азотной кислоты атом азота четырёхвалентен, а его степень окисления равна +5. При этом один из атомов кислорода I-валентен, но его степень окисления равна -2.
*Попробуйте для примера определить валентности и степени окисления атомов кислорода в молекуле озона, а также в синглетном и триплетном состояниях молекулы кислорода.



![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/2/ava/thumbnails/RgocnqRS3C4j3ys.jpg)













