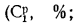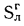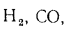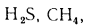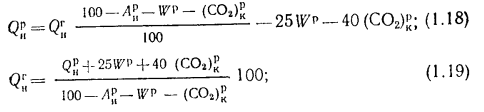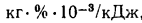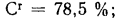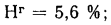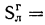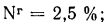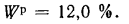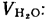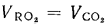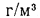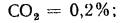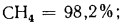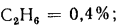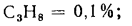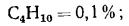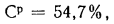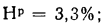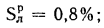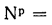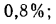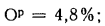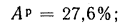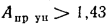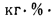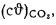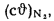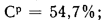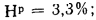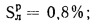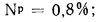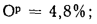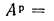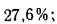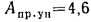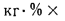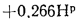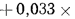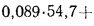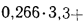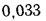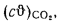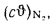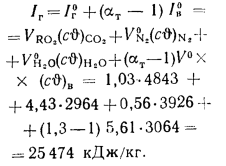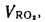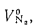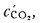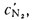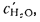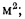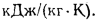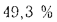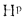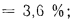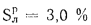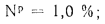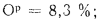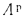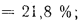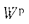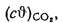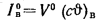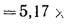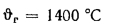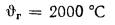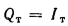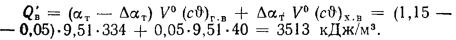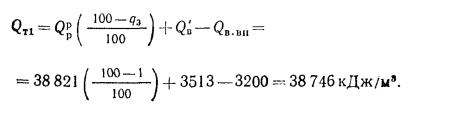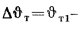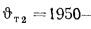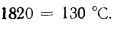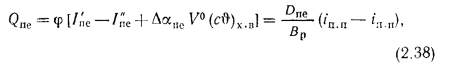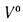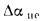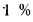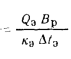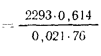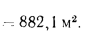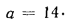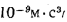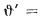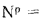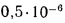Теплота сгорания
топлива.
Теплотой сгорания топлива называют
количество теплоты в кДж, выделяемой
при полном сгорании 1 кг твердого
(жидкого) или 1 м3
газообразного топлива.
Для твердого и
жидкого топлива различают теплоту
сгорания высшую
Qв
(кДж/кг) и
низшую Qн
(кДж/кг).
Величины высшей
и низшей теплоты сгорания рабочей,
горючей и сухой массы твердого
(жидкого) топлива связаны выражениями:
Q=Q
+225Нр+25Wp; (1.9
)
Q=Q
+225Нг; (1.10)
Q=Q
+225Нс. (1.11)
Тепловые расчеты
котлов выполняют, пользуясь низшей
теплотой сгорания рабочей массы
топлива:
низшая теплота
сгорания (кДж/кг) рабочей массы твердого
и жидкого топлива
Q=338Cp+1025Hp-108,5(Op-S
)-25Wp, (1.12)
где Ср,
Нр,
Ор,
S,
Wp
— содержание элементов в рабочей массе
топлива, %;
низшая теплота
сгорания (кДж/м3)
газообразного топлива
Q=108H2
+ 126CO
+ 234H2S
+ 358CH4
+ 591C2H4
+ 638C2H6+860С3Н6
+ 913С3Н8
+
+ 1135С4Н8+1187С4Н10+1461С5Н12+
1403C6H6, (1.13)
где Н2,
СО, H2S,
СН4,
С2Н4
и т. д. — объемное содержание газов,
входящих в состав газообразного топлива,
%.
При пересчете
низшей теплоты сгорания пользуются
следующими формулами:
с горючей массы
на рабочую и обратно
(1.14)
(1.15)
с сухой массы на
рабочую и обратно
(1.16)
(1.17)
для горючих сланцев
— с горючей массы на рабочую и обратно
(1.18)
(1.19)
при изменении
влажности

Для смеси двух
твердых, жидких или газообразных топлив
низшая теплота сгорания определяется
по формуле
, (1.21)
где b1
— массовая
доля одного из топлив в смеси;
— низшая
теплота сгорания первого вида топлива
в смеси, кДж/кг (кДж/м3);
—
низшая теплота сгорания второго вида
топлива, кДж/кг (кДж/м3).
Для сравнения
тепловой ценности различных видов
топлива пользуются понятием условного
топлива. Условным
топливом называют
такое топливо, теплота сгорания которого
равна 29 300 кДж/кг.
Пересчет расхода
натурального топлива на условное
осуществляется по формуле
Ву=ВЭ, (1.22)
где Ву
и
В —
соответственно расход условного и
натурального топлива, кг, кг/с; Э
— тепловой
эквивалент топлива, определяемый по
формуле
Э=/29
300. (1.23)
Зольность,
влажность и
сернистость
топлива. При
рассмотрении условий работы котлов
на различных видах топлива пользуются
приведенными величинами зольности Апр
влажности
Wnp
и сернистости
Sпр,
топлива:
приведенная
зольность топлива, кг·%/МДж,
Апр=Ар/; (1.24)
приведенная
влажность топлива, кг·%/МДж,
Wпр=Wр/; (1.25)
приведенная
сернистость топлива, кг·%/МДж,
Sпр=/
; (1.26)
Задача 1.9.
Определить низшую и высшую теплоту
сгорания рабочей массы челябинского
угля марки БЗ состава: Ср=37,3%;
Нр=2,8%;
=l,0%;
Np=0,9%;
Ор=10,5%;
Ар=29,5%
и Wp=18,0%.
Ответ: =13997
кДж/кг; =15077
кДж/кг.
Задача 1.10.
Определить низшую и высшую теплоту
сгорания рабочей массы кузнецкого угля
марки Д, если состав его горючей массы:
Cг=78,5%;
Нг=5,6%;с
S=0,4%;
Nг=2,5%;
Ог=13,0%.
Зольность сухой массы Ас=15,0%
и влажность рабочая Wр=12,0%.
Решение:
Пользуясь коэффициентами пересчета
(табл. 1.1), определяем зольность рабочей
массы топлива
и состав рабочей
массы:
Низшая теплота
сгорания рабочей массы топлива, по
формуле (1.12),
Q
=
338Cp+1025Hp-108,5(Op-S)-25Wp=338·58,7+1025·4,2-108,5(9,7-0,3)-25·12=
=22
825 кДж/кг.
Высшая теплота
сгорания, по формуле (1.9),
Q=Q
+225Нр+25Wp=22825+225·4,2+25·12,0=24
070 кДж/кг.
Задача 1.11.
Определить
низшую теплоту сгорания рабочей и сухой
массы донецкого угля марки Г, если
известны его низшая теплота сгорания
горючей массы Q=33170
кДж/кг, зольность сухой массы Ас=25,0%
и влажность
рабочая Wp=
8,0%.
Ответ: Q=22024
кДж/кг; Q=24157
кДж/кг.
Задача 1.12.
Определить
низшую теплоту сгорания горючей и сухой
массы кузнецкого угля марки Т, если
известны его низшая теплота сгорания
рабочей массы Q=26180
кДж/кг, зольность сухой массы Аc=
18,0% и влажность
рабочая Wp
= 6,5%.
Ответ:
Q=34345
кДж/кг; Q=28174
кДж/кг.
Задача 1.13.
Определить
высшую теплоту сгорания горючей и сухой
массы кизеловского угля марки Г, если
известны следующие величины: Q=l9680
кДж/кг; Нр=3,6%;
Aр=31,0%;
Wp=6,0%.
Ответ: Q=21
961 кДж/кг; Q=32635кДж/кг.
Задача 1.14.
Определить
низшую и высшую теплоту сгорания рабочей
массы ленинградских сланцев, если
известны следующие величины: Q=36848
кДж/кг; Нр=2,7%;
Aр=46,0%;
Wp=11,5%
и (СО2)=16,4%.
Ответ: Q=
9337 кДж/кг; Q=10
232 кДж/кг.
Задача 1.15.
Определить
низшую и высшую теплоту сгорания горючей
массы высокосернистого мазута, если
известны следующие величины: Q=38772
кДж/кг; Нр=10,4%;
Ар=0,1%
Wp=3,0%.
Решение:
Содержание водорода в горючей массе
определяем, пользуясь коэффициентом
пересчета (табл. 1.1):
Низшая теплота
сгорания горючей массы топлива, по
формуле (1.15),
кДж/кг.
Высшая теплота
сгорания, по формуле (1.10),
Q=Q
+225Нг=40090+225·10,7
= 42497 кДж/кг.
Задача
1.16. Определить
низшую теплоту сгорания сухо природного
газа Саратовского месторождения состава:
СО2=0,8%;
СН4=84,5%;
С2Н6=3,8%;
С3Н8=1,9%;
С4Н10=0,9%;
С5Н12=0,3%;
N2=7,8%.
Ответ: Q=35799
кДж/м3.
Задача 1.17.
Определить низшую теплоту сгорания
рабочей массы челябинского угля марки
БЗ состава: Ср=37,3%;
Нр=2,8%;
S=1,O%;
Np=0,9%;
Ор=10,5%;
Aр=29,5%;
Wp=18%,
— при увеличении его влажности до
Wp=20%.
Ответ:
Q=13542
кДж/кг.
Задача 1.18.
В топке котла сжигается смесь, состоящая
из 3·103
кг кузнецкого угля марки Д и 7·103
кг кузнецкого угля марки Т. Определить
низшую теплоту сгорания смеси, если
известно, что низшая теплота сгорания
угля марки Д составляет Q=22825
кДж/кг, а угля марки Т — Q=26180
кДж/кг. .
Ответ: Q=25174
кДж/кг.
Задача 1.19.
Определить высшую теплоту сгорания
рабочей массы, приведенную влажность,
приведенную зольность, приведенную
сернистость и тепловой эквивалент
подмосковного угля марки Б2 состава:
Ср=28,7%;
Нр=2,2%;
S=2,7%;
Np=0,6%;
Оp=8,6%;
Ap=25,2%;
Wp=32%.
Решение:
Низшая теплота сгорания рабочей массы
топлива, по формуле (1.12),
Q=338Cp+1025Нр-108,5
(Op-S)-25Wp=338·28,7+1025·2,2-108,5(8,6-2,7)-25·32=
=10516
кДж/кг.
Высшая теплота
сгорания рабочей массы топлива, по
формуле (1.9),
Q=Q
+225Hp+25Wp=10516
+ 225·2,2+25·32=11811
кДж/кг.
Приведенная
влажность топлива, по формуле (1.25),
Wnp=Wp/Q=
32/10,516 = 3,04 кг·
%/МДж.
Приведенная
зольность топлива, по формуле (1.24),
Aпр=Aр/Q=25,2/10,516
= 2,39 кг·%/МДж.
Приведенная
сернистость топлива, по формуле (1.26),
Snp=Sp/Q=2,7/10,516
= 0,257 кг·%/МДж.
Тепловой эквивалент
топлива, по формуле (1.23),
Э=Q/29300=10516/29300=0,36.
Задача 1.20.
Определить
высшую теплоту сгорания рабочей массы,
приведенную влажность, приведенную
зольность, приведенную сернистость
и тепловой эквивалент донецкого угля
марки А, если известны следующие величины:
Q=22625
кДж/кг; Нр=1,2%;
S=l,7%;
Ар=22,9%;
Wp=8,5%.
Ответ: Q=23107,5
кДж/кг; Wnp=0,375
кг·%/МДж;
Anp=1,01
кг·%/МДж;
Snp=0,075
кг·%/МДж;
Э
= 0,77.
Задача 1.21.
Определить
приведенную влажность, приведенную
зольность и приведенную сернистость
донецкого угля марки Т состава: Сp=62,7%;
Нр=3,1%;
S=2,8%;
Np=0,9%;
Op=l,7%;
Aр=23,8%;
Wp=5%.
Ответ: Wnp=0,203
кг·%/МДж;
Anp=0,966
кг·%/МДж;
Snp=0,114
кг·%/МДж.
Задача 1.22.
Определить
приведенную влажность, приведенную
зольность и тепловой эквивалент
челябинского угля марки БЗ, если
известен, состав его горючей массы:
Сг=71,1%;
Hг=5,3%;
S=l,9%;
Nг=l,7%;
Ог=20,0%;
зольность сухой массы Ас=36%
и влажность рабочая Wр=18%.
Ответ: Wnр=1,286
кг·%/МДж;
Ар=2,107
кг·%/МДж;
Э=0,48.
Задача 1.23. На
складе котельной имеется 60·103
кг ангренского угля марки Б2, состав
которого по горючей массе: Cг=76,0%;
Hг=3,8%;
S=2,5%;
Nг=0,4%;
Ог=17,3%;
зольность сухой массы Ас=20,0%
и влажность рабочая Wр=34,5%.
Определить запас угля на складе в кг
условного топлива.
Ответ: Ву=28315
кг.
Задача 1.24. Для
котельной, в которой установлены котлы
с различными топками, подвезено 50·103
кг донецкого угля марки Т состава:
Ср=
62,7%; Нр=3,1%;
S=2,8%;
Np=0,9%;
Op=1,7%;
Ар=23,8%;
Wр=5,0%,
и 60·103
кг донецкого угля марки А состава:
Ср=63,8%;
Нр=1,2%;
S=l,7%;
Np=0,6%;
Op=l,3%;
Ар=22,9%;
Wp=8,5%.
Определить время работы топок, если
известно, что топки, работающие на угле
марки Т, расходуют 2·103
кг/ч условного топлива, а топки, работающие
на угле марки А, — 2,3·103
кг/ч условного топлива.
Решение:
Низшая теплота сгорания рабочей массы
донецкого угля марки Т, по формуле
(1.12),
Q=338Cp+1025Hp-108,5(Op-S
)-25Wp=338·62,7+1025·3,1-108,5(1,7-2,8)-25·5,0=
=24365
кДж/кг.
Масса условного
топлива, соответствующая 50·103
кг донецкого угля марки Т, по формуле
(1.22);
By1=B1Э=В1Q/29300=50·103-24365/29300=41,6·103
кг.
Определяем время
работы топок на донецком угле марки Т:
τ1=Ву1/(2·103)=41,6103/(2·103)
=20,8 ч.
Низшая теплота
сгорания рабочей массы донецкого угля
марки А, по формуле (1.12),
Q=338Ср+1025Нр-108,5(Op-S
)-25Wp=338·63,8+1025·1,2-108,5(1,3-1,7)-25·8,5=
=22625
кДж/кг.
Масса условного
топлива, соответствующая 60·103
кг донецкого угля марки А, по формуле
(1.22),
By2=B2Q/29300=60·103-22625/29300=46,3·103
кг.
Находим время
работы топок на донецком угле марки А:
τ2=Bу2/(2,3·103)=46,3·103/(2,3·103)=20,1
ч.
Задача 1.25.
Две котельные установки одинаковой
производительности работают на
различных видах топлива. Первая из них
сжигает 10·103
кг/ч кузнецкого угля марки Т состава:
Ср=68,6%;
Нр=3,1%;
S=0,4%;
Np=l,5%;
Ор=3,1%;
Aр=16,8%;
Wp=6,5%.
Вторая расходует 6·103
кг/ч кузнецкого угля марки Д состава:
Cp=58,7%;
Нр=4,2%;
S=0,3%;
Np=l,9%;
Ор=9,7%;
Ap=13,2%;
Wp=12,0%.
Определить, какому количеству
условного топлива эквивалентен часовой
расход топлива в установках.
Ответ: By1=9000
кг/ч; Ву2=4674
кг/ч.
Задача 1.26.
В котельной за 10 ч сжигается 106
кг донецкого угля марки Г состава:
Сp=55,2%;
Нр=3,8%;
S=3,2%;
Np=1,0%;
Ор=5,8%;
Ар=23,0%;
Wp=8,0%.
Определить часовую потребность котельной
в условном топливе.
Ответ: Ву=15170
кг/ч.
Соседние файлы в папке задачи по турбинам
- #
- #
- #
- #
- #
- #
Возможность использования вещества в качестве альтернативного топлива
Как правильно рассчитать теплотворную способность топлива (топливно-воздушной смеси)
Сравнительные характеристики (QН, Lовозд., qН)бензина:
1. Низшая теплотворная способность QН = 43,3 – 44,0 МДж/кг;
2. Стехиометрическая потребность воздуха в процессе сгорания Lовозд. = 14,9;
3. Низшая теплота сгорания топливовоздушной смеси qН = 3439 – 3910 кДж/м3.
Теплота сгорания топлива – это тепловой эффект химической реакции сгорания топлива в воздухе. При составлении уравнения этой реакции необходимо учитывать не только кислород, принимающий участие в реакции окисления, но и азот, входящий в состав воздуха. Так как на 1 моль кислорода в воздухе приходится 3,75 моля азота, реакция сгорания топлива может быть выражена следующим уравнением:
CnHmOr + (n + m/4 — r/2)•(O2 + 3,75N2) → nCO2(г) + m/2H2O(ж) + (n + m/4 — r/2)•3,75N2(г), где
CnHmOr — органическое вещество (топливо);
n — число атомов углерода;
m — число атомов водорода;
r — число атомов кислорода.
Согласно первому закону термодинамики, высшая теплота сгорания топлива:
QB = ∆Носгор.топлива, где
∆Носгор.топлива — высшая энтальпия сгорания топлива при стандартных условиях.
∆Носгор.топлива = (∑∆Нокон.прод — ∑∆Ноисх.веществ).
Высшая удельная теплота сгорания топлива (теплотворная способность топлива) QВ (кДж/кг топлива) рассчитывается по уравнению:
QB = ΔНоВ/(M.10-3), где
ΔНоВ — высшая энтальпия сгорания топлива (ΔНоВ = ∆Носгор.топлива), кДж/моль;
М — масса моля топлива, г/моль.
Низшая энтальпия сгорания топлива ΔНоН (кДж/моль топлива) рассчитывается по уравнению реакции (1):
∆НоН = ∑∆Нокон.прод — ∑∆Ноисх.веществ
Низшая энтальпия сгорания топлива отличается от высшей на величину энтальпии конденсации водяного пара (∆Ноконд.(Н2О)пар = -44,01 кДж/моль:
∆НоН = ΔНоВ — ∆Ноконд.(Н2О)пар
Низшая удельная теплота сгорания топлива QН (кДж/кг топлива) составит:
QH = ΔНоН/(M.10-3), где
М — масса моля топлива, г/моль.
Для полного сгорания массовой или объемной единицы топлива необходимо вполне определенное количество воздуха, которое называется теоретически необходимым.
Теоретически необходимое количество воздуха для полного сгорания 1 кг топлива (кг воздуха/кг топлива) для реакции (1) рассчитывается по уравнению:
Lовозд. = (n + m/4 — r/2) • [М(O2) + 3,75M(N2)]/Мтоплива, где
М(O2), M(N2)], Мтоплива – масса моля кислорода, азота и топлива соответственно, г/моль.
Количество топливовоздушной смеси (М1, моль) для реакции (1) равно:
М1 = 1 моль топлива + (n + m/4 — r/2)•(O2 + 3,75N2).
Низшая теплота сгорания топливовоздушной смеси (калорийность стехиометрической смеси топлива с воздухом, qН, кДж/м3) рассчитывается как отношение низшей теплоты сгорания единицы топлива к общему количеству горючей смеси:
qH = ∆НоН/[M1.22,4.10-3)].
Полученные результаты сравниваются с характеристиками бензина (приведенными выше) и веществом, предлагаемого в качестве альтернативного топлива. Затем, делается вывод о возможности использования данного вещества в качестве топлива.
Примеры расчетных задач на возможность использования вешества в качестве альтернативного топлива
Задача 50.
На основании зависимости эксплуатационных свойств и от физико-химических характеристик и термодинамических расчетов рассмотреть возможность использования изопропилового спирта в качестве альтернативного топлива или добавки к традиционным видам топлив.
Решение:
М(С3Н7ОН) = 60,0952 г/моль;
∆Носгор.(С3Н7ОН) = –2003,8 кДж/моль.
1. Реакция горения в воздухе:
С3Н7ОН(ж) + 4,5(O2 + 3,75N2)(г) = 3CO2(г) + 4H2O(ж) + 16,8755N2(г).
2. Табличное значение стандартной энтальпии сгорания изопропилового спирта ΔНосгор. = –2003,8 кДж/моль.
Следовательно, высшая энтальпия сгорания топлива (ΔНоВ = ∆Носгор.топлива = –2003,8 кДж/моль С3Н7ОН.
3. Высшая теплота сгорания топлива QВ:
QB = 2003,8/(60.10-3) = 33,40 МДж/кг С3Н7ОН.
4. Низшая энтальпия сгорания (∆НоН, кДж /моль топлива) отличается от высшей на величину энтальпии конденсации водяного пара
∆Ноконд.Н2О(пара) = –44,01 кДж/моль. Поэтому
∆НоН = ∆Носгор.топлива — ∆Ноконд.Н2О(пара) = -2003,8 + 4.44,01 = -1827,76.
5. Низшая теплота сгорания топлива (МДж/кг топлива):
QH = ∆НоН/(M.10-3) = -1827,76/(60.10-3) = 30,46.
Теоретически необходимое количество воздуха для полного сгорания 1 кг топлива (кг воздуха/кг топлива):
Lовозд. = (n + m/4 — r/2) • [М(O2) + 3,75M(N2)]/Мтоплива, где
М(O2), M(N2)], Мтоплива – масса моля кислорода, азота и топлива соответственно, г/моль.
Тогда
Lовозд. = 4,5(32 + 3,75. 28)]/60 = 10,275
7. Количество топливовоздушной смеси (М1, моль):
М1 = 1 моль топлива + 4,5(1 + 3,75) = 22,375 моль.
8. Низшая теплота сгорания топливовоздушной смеси (qН, кДж/м3), она же калорийность стехиометрической смеси топлива с воздухом:
qH = ∆НоН/[M1.22,4.10-3)] = -1827,76/[22,375 . 22,4.10-3)] = 3817,37 кДж/м3.
Выводы:
1) Судя по калорийности стехиометрической смеси изопропилового спирта с воздухом, его вполне можно применять как альтернативное топливо.
Задача 51.
На основании зависимости эксплуатационных свойств и от физико-химических характеристик и термодинамических расчетов рассмотреть возможность использования метана в качестве альтернативного топлива или добавки к традиционным видам топлив.
Решение:
М(СН4) = 16 г/моль;
∆Носгор.(СН4) = –890,31 кДж/моль;
1. Реакция горения в воздухе:
СН4(г) + 2(O2 + 3,75N2)(г) = CO2(г) + 2H2O(ж) + 7,5N2(г).
2. Табличное значение стандартной энтальпии сгорания метана ΔНосгор. = –890,31 кДж/моль.
Следовательно, высшая энтальпия сгорания топлива (ΔНоВ = ∆Носгор.топлива = –890,31 кДж/моль С3Н7ОН.
3. Высшая теплота сгорания топлива QВ:
QB = 890,31/(16.10-3) = 55,64 МДж/кг СН4.
4. Низшая энтальпия сгорания (∆НоН, кДж /моль топлива) отличается от высшей на величину энтальпии конденсации водяного пара
∆Ноконд.Н2О(пара) = –44,01 кДж/моль. Поэтому
∆НоН = ∆Носгор.топлива — ∆Ноконд.Н2О(пара) = –890,31 + 2.44,01 = -802,29 кДж/моль.
5. Низшая теплота сгорания топлива (МДж/кг топлива):
QH = ∆НоН/(M.10-3) = -802,29/(16.10-3) = 50,14.
Теоретически необходимое количество воздуха для полного сгорания 1 кг топлива (кг воздуха/кг топлива):
Lовозд. = (n + m/4 — r/2) * [М(O2) + 3,75M(N2)]/Мтоплива, где
М(O2), M(N2)], Мтоплива – масса моля кислорода, азота и топлива соответственно, г/моль.
Тогда
Lовозд. = 2(32 + 3,75 . 28)]/16 = 17,125
7. Количество топливовоздушной смеси (М1, моль):
М1 = 1 мольтоплива + 2(1 + 3,75) = 10,5 моль.
8. Низшая теплота сгорания топливовоздушной смеси (qН, кДж/м3), она же калорийность стехиометрической смеси топлива с воздухом:
qH = -∆НоН/[M1. 22,4.10-3)] = 802,29/[10,5 . 22,4.10-3)] = 3411 кДж/м3.
Выводы:
1) Судя по калорийности стехиометрической смеси метана с воздухом, его вполне можно применять как альтернативное топливо.
Расчет теплотворной способности газзобразного топлива
Задача 52.
В печи сожгли смесь, в которой было 25% измельчённого угля, остальное – отходы древесины. Какова была теплотворная способность этой смеси?
Решение:
q1(уголь) = 30,0 мДж/кг;
q2(отходы древесины) = 10,0 мДж/кг.
Q = q1 . w%(уголь) + q2 . w%(дерево) = (30 . 0,25) + (10 . 0,75) = 15 мДж/кг = 15 000 000 Дж/кг, где
Q — теплотворная способность топлива;
q1 -удельная теплота сгорания угля;
q2 -удельная теплота сгорания древесных отходов;
w%(уголь) и w%(дерево) — соответственно, массовые доли угля и древесины в смеси для сжигания.
Как правильно рассчиать массу заправленного в бак топлива
Задача 53.
В топливный бак залили при температуре 15 оС 30 л бензина АИ-95 (р420 = 0,7650 г/мл). Исходя из уравнения Д.И. Менделеева (температурную поправку найти по таблице), рассчитайте массу заправленного в этих условиях бензина.
Решение:
Для рассчета используем формулу Менделеева:
р4(t) = p4(20) — a(t — 20), где
р4(t) — относительная плотность нефти (нефтепродукта) при температуре испытания t, оС;
p4(20) — плотность нефтепродукта при стандартных условиях (у нас 0,7650 г/мл = или 765 кг/м3;
а — средняя температурная поправка плотности (ее мы найдем по таблице, получим: 0,000818);
t — температура испытания, оС ( у нас 15 оС).
Тогда
р4(15) = p4(20) — a(t — 20) = 0,7650 — 0,000818(5 — 20) = 0,7650 — 0,0127 = 0,77727 г/л.
По формуле: m = р•V, рассчитаем массу бензина, получим:
mтоплива = р•V = р4(5) . V = 0,77727 г/л . 30 л = 23,3 кг.
Ответ: mтоплива = 23,3 кг.
Определение потери тепла с уходящими газами
Задача 54.
Определить по формуле: q2 = 0,01(t — tВ)Z,% потерю тепла с уходящими газами если СО2 = 9%, СО = 0,2%, СН4 = 0,1%, Н2 = 0,3%, О2 = 4,4%, N2 = 86% температура уходящих газов равна 320 °С, температура воздуха равна 20 °С, Z = 5,05.
Решение:
Таким образом, при снижении температуры продуктов сгорания с 300 до 20 °С экономия топлива в результате снижения потерь тепла составит:
q2 = 0,01(t — tВ)Z% = 0,01(320 °С — 20 °С)5,05% = 15,15%, где
q2 — потеря тепла с продуктами сгорания;
t — температура продуктов сгорания (уходящих газов), оС;
tВ — температура воздуха поступающего к горелкам, оС;
Z – табличная величина, зависящая от содержания СО2 в продуктах сгорания и их температуры, определяется по таблице Равича;
Теперь по формуле Д.И. Менделеева рассчитаем низшую теплотворность смеси газов, получим:
q1 = 0,126(CO) + 0,358(CH4) + 0,108(H2) = (0,126 . 0,2) + (0,358 . 0,1) + (0,108 . 0,3) = 0,0934 МДж/м3.
Тогда потеря теплоты составит:
Qпотери = (q2 . q1)/100% = (15,15% . 0,0934 МДж/м3)/100% = 0,01415 МДж/м3.
Таким образом, потеря тепла будет составлять 0,01415 МДж/м3.
Химические реакции сопровождаются поглощением или выделением энергии, в частности тепла. реакции, сопровождающиеся поглощением тепла, а также образующиеся при этом соединения называются эндотермическими. При эндотермических реакциях нагрев реагирующих веществ необходим не только для возникновения реакции, но и в течение всего времени их протекания. Без нагревания извне эндотермическая реакция прекращается.
реакции, сопровождающиеся выделением тепла, а также образующиеся при этом соединения называются экзотермическими. Все реакции горения относятся к экзотермическим. Вследствие выделения тепла они, возникнув в одной точке, способны распространяться на всю массу реагирующих веществ.
Количество тепла, выделяемое при полном сгорании вещества и отнесенное к одному молю, единице массы (кг, г) или объема (м3) горючего вещества называется теплотой сгорания. Теплоту сгорания можно вычислить по табличным данным, пользуясь законом Гесса. Русский химик Г.Г. Гесс в 1840 г. открыл закон, который является частным случаем закона сохранения энергии. Закон Гесса состоит в следующем: тепловой эффект химического превращения не зависит от пути, по которому реакция протекает, а зависит лишь от начального и конечного состояний системы при условии, что температура и давление (или объем) в начале и в конце реакции одинаковы.
Рассмотрим это на примере вычисления теплоты сгорания метана. Метан можно получить из 1 моля углерода и 2 молей водорода. При сжигании метана получаются 2 моля воды и 1 моля диоксида углерода.
С + 2Н2 = СН4 + 74,8 кДж (Q1).
СН4 + 2О2 = СО2 + 2Н2О + Qгор.
Те же продукты образуются при сгорании водорода и углерода. При этих реакциях общее количество выделяющегося тепла равно 963,5 кДж.
2Н2 + О2 = 2Н2О + 570,6 кДж
С + О2 = СО2 + 392,9 кДж.
963,5 кДж
Поскольку начальные и конечные продукты в обоих случаях одинаковы, их общие тепловые эффекты должны быть равны согласно закону Гесса, т.е.
Q1 + Qгор = Q,
откуда
Qгор = Q — Q1. (1.11)
Следовательно, теплота сгорания метана будет равна
Qгор = 963,5 — 74,8 = 888,7 кДж/моль.
Таким образом, теплота сгорания химического соединения (или их смеси) равна разности между суммой теплот образования продуктов сгорания и теплотой образования сгоревшего химического соединения (или веществ, составляющих горючую смесь). Следовательно, для определения теплоты сгорания химических соединений необходимо знать теплоту их образования и теплоту образования продуктов, получающихся после сгорания.
Ниже приведены значения теплот образования некоторых химических соединений:
|
Оксид алюминия Al2O3……… |
1631,6 |
Метан СН4 …………………… |
75,0 |
|
Оксид железа Fe2O3 ………… |
822,5 |
Этан С2Н6 …………………… |
88,4 |
|
Оксид углерода CO …………. |
110,6 |
Ацетилен С2Н2 ……………… |
224,6 |
|
Диоксид углерода CO2 ……… |
396,9 |
Бензол С6Н6 ………………… |
34,8 |
|
Вода H2O ……………………. |
286,6 |
Этилен С2Н4 ………………… |
48,6 |
|
Водяной пар H2O …………… |
242,2 |
Толуол С6Н5СН3 ……………. |
4,19 |
Пример 1.5.Определить температуру сгорания этана, если теплота его образования Q1 = 88,4 кДж. Напишем уравнение горения этана.
С2Н6 + 3,5O2 = 2CO2 + 3 H2O + Qгор.
Для определения Qгор необходимо знать теплоты образования продуктов сгорания. теплота образования диоксида углерода 396,9 кДж, а воды 286,6 кДж. Следовательно, Q будет равно
Q = 2×396,9 + 3×286,6 = 1653,6 кДж,
а теплота сгорания этана
Qгор = Q — Q1 = 1653,6 — 88,4 = 1565,2 кДж.
Теплоту сгорания экспериментально определяют в калориметрической бомбе и газовом калориметре. Различают высшую и низшую теплоты сгорания. Высшей теплотой сгорания Qв называют количество тепла, выделяемое при полном сгорании 1 кг или 1 м3 горючего вещества при условии, что содержащийся в нем водород сгорает с образованием жидкой воды. Низшей теплотой сгорания Qн называют количество тепла, выделяемое при полном сгорании 1 кг или 1 м3 горючего вещества при условии сгорания водорода до образования водяного пара и испарении влаги горючего вещества.
Высшую и низшую теплоты сгорания твердых и жидких горючих веществ можно определить по формулам Д.И. Менделеева:
; (1.12)
, (1.13)
где Qв, Qн — высшая и низшая теплоты сгорания, кДж/кг; W – содержание в горючем веществе углерода, водорода, кислорода, горючей серы и влаги, %.
Пример 1.6. Определить низшую температуру сгорания сернистого мазута, состоящего из 82,5 % С, 10,65 % Н, 3,1 % S и 0,5 % О; А (зола) = 0,25 %, W = 3 %. Используя уравнение Д.И. Менделеева (1.13), получаем
=38622,7 кДж/кг
Низшую теплоту сгорания 1 м3 сухих газов можно определить по уравнению
кДж/м3.
Низшая теплота сгорания некоторых горючих газов и жидкостей, полученная экспериментально, приведена ниже:
|
кДж/кг |
кДж/м3 |
кДж/моль |
|
|
Углеводороды: метан ……………………….. |
50004,0 |
35874,8 |
803,6 |
|
этан ………………………… |
47569,0 |
63838,8 |
1430,4 |
|
пропан ……………………… |
46441,9 |
91350,4 |
2047,6 |
|
Спирты: метиловый …………………. |
22374,6 |
— |
716,0 |
|
этиловый …………………… |
29874,7 |
— |
1374,3 |
|
пропиловый ………………… |
33658,3 |
— |
2019,5 |
Низшая теплота сгорания некоторых горючих материалов, рассчитанная по их элементному составу, имеет следующие значения:
|
Бензин …………………… |
43157,0-43785,5 |
Каучук синтетический |
37710,0 |
|
Бумага …………………… |
13408,0 |
Керосин ……………… |
42109,5-42947,5 |
|
Древесина |
Органическое стекло .. |
25140,0 |
|
|
воздушно-сухая ……….. |
12570-14665,0 |
Резина ……………….. |
33520,0 |
|
в конструкциях зданий… |
16760-17070,0 |
Торф (W = 20 %) ……. |
15125,9 |
Существует нижний предел теплоты сгорания, ниже которого вещества становятся не способными к горению в атмосфере воздуха.
Эксперименты показывают, что вещества являются негорючими, если они не относятся к взрывоопасным и если их низшая теплота сгорания в воздухе не превышает 2100 кДж/кг. Следовательно, теплота сгорания может служить для ориентировочной оценки горючести веществ. Однако следует отметить, что горючесть твердых веществ и материалов в значительной степени зависит и от их состояния. Так, лист бумаги, легко воспламеняющийся от пламени спички, будучи нанесенным на гладкую поверхность металлической плиты или бетонной стены, становится трудногорючим. Следовательно, горючесть веществ зависит также от скорости отвода тепла из зоны горения.
Практически в процессе горения, особенно на пожарах, указанная в таблицах теплота сгорания полностью не выделяется, так как горение сопровождается недожогом. Известно, что нефтепродукты, а также бензол, толуол, ацетилен, т.е. вещества, богатые
углеродом, горят на пожарах с образованием значительного количества сажи. Сажа (углерод) способна гореть и выделять тепло. Если при горении она образуется, то, следовательно, горючее вещество выделяет тепла меньше того количества, которое указано в таблицах. Для веществ, богатых углеродом, коэффициент недожога h составляет 0,8 — 0,9. Следовательно, на пожарах при горении 1 кг резины может выделиться не 33520 кДж, а только 33520´0,8 = 26816 кДж.
Размер пожара обычно характеризуется площадью пожара. Количество тепла, выделяющееся с единицы площади пожара в единицу времени, называют теплотой пожара Qп
Qп = Qн υм h ,
где υм – массовая скорость выгорания, кг/(м2×с).
Удельная теплота пожара при внутренних пожарах характеризует тепловую нагрузку на конструкции зданий и сооружений и используется для расчета температуры пожара.
1.6. Температура горения
Выделяющееся в зоне горения тепло воспринимается продуктами сгорания, поэтому они нагреваются до высокой температуры. Та температура, до которой в процессе горения нагреваются продукты сгорания, называется температурой горения. Различают калориметрическую, теоретическую и действительную температуры горения. Действительная температура горения для условий пожара называется температурой пожара.
Под калориметрической температурой горения понимают ту температуру, до которой нагреваются продукты полного сгорания при следующих условиях:
1) всё выделяющееся при горении тепло расходуется на нагревание продуктов сгорания (потери тепла равны нулю);
2) начальные температуры воздуха и горючего вещества равны 0 0С;
3) количество воздуха равно теоретически необходимому (a = 1);
4) происходит полное сгорание.
Калориметрическая температура горения зависит только от состава горючего вещества и не зависит от его количества.
Теоретическая температура, в отличие от калориметрической, характеризует горение с учетом эндотермического процесса диссоциации продуктов сгорания при высокой температуре
2СО2 2СО + О2 — 566,5 кДж.
2Н2О2Н2 + О2 — 478,5 кДж.
Практически диссоциацию продуктов сгорания необходимо учитывать только при температуре выше 1700 0С. При диффузионном горении веществ в условиях пожара действительные температуры горения не достигают таких значений, поэтому для оценки условий пожара используют только калориметрическую температуру горения и температуру пожара. Различают температуру внутреннего и наружного пожара. Температура внутреннего пожара – это средняя температура дыма в помещении, где происходит пожар. Температура наружного пожара – температура пламени.
При расчете калориметрической температуры горения и температуры внутреннего пожара исходят из того, что низшая теплота сгорания Qн горючего вещества равна энергии qг, необходимой для нагревания продуктов сгорания от 0 0С до калориметрической температуры горения
Qн = qг.
Величину qг назовем условно теплосодержанием продуктов сгорания
qг = ,
где — объем продуктов сгорания, м3/кг, С/ — средняя объемная теплоемкость продуктов сгорания, кДж/(м3?К), tг – температура горения, 0С.
Поскольку продукты сгорания состоят из нескольких газообразных веществ, теплоемкость которых различна, суммарное теплосодержание их может быть выражено следующим образом:
,
где ,
,
— объем компонентов продуктов сгорания
, м3/кг;
,
,
— теплоемкость компонентов продуктов сгорания (теплоемкость СО2 принимается для смеси СО2 и SО2), кДж/(м3?К).
В действительности не вся теплота, выделяющаяся при горении в условиях пожара, расходуется на нагревание продуктов сгорания. Большая часть её расходуется на нагревание конструкций, подготовку горючих веществ к горению, нагревание избыточного воздуха и др. Поэтому температура внутреннего пожара значительно ниже калориметрической. Методика расчета температуры горения предполагает, что весь объем продуктов сгорания нагрет до одной и той же температуры. В действительности температура в различных точках очага горения неодинакова. Наиболее высокой является температура в области пространства, где протекает реакция горения, т.е. в зоне горения (пламени). Значительно ниже температура в местах, где находятся горючие пары и газы, выделившиеся из горящего вещества и продуктов сгорания, смешавшихся с избытком воздуха.
Чтобы судить о характере изменения температуры при пожаре в зависимости от различных условий горения, введено понятие среднеобъемной температуры пожара, под которой понимают среднее значение из величины температур, измеренных термометрами в различных точках внутреннего пожара. Эта температура определяется из опыта.
8.1. РЕАКЦИИ ГОРЕНИЯ
Г о р е н и е — быстропротекающая химическая реакция соединения горючих компонентов с кислородом, сопровождающаяся интенсивным выделением теплоты и резким повышением температуры продуктов сгорания. Реакции горения описываются т.н. стехиометрическими уравнениями, характеризующими качественно и количественно вступающие в реакцию и образующиеся в результате ее вещества (Стехиометрический состав горючей смеси (от греч. stoicheion — основа, элемент и греч. metreo — измеряю) — состав смеси, в которой окислителя ровно столько, сколько необходимо для полного окисления
топлива). Общее уравнение реакции горения любого углеводорода
CmHn + (m + n/4) O2 = mCO2 + (n/2) Н2O + Q(8.1)
где m, n — число атомов углерода и водорода в молекуле; Q — тепловой эффект реакции, или теплота сгорания.
Реакции горения некоторых газов приведены в табл. 8.1. Эти уравнения являются балансовыми, и по ним нельзя судить ни о скорости реакций, ни о механизме химических превращений.
Таблица 8.1. Реакции горения и теплота сгорания сухих газов (при 0°С и 101,3 кПа)
| Газ | Реакция горения | Теплота сгорания | |||||
|---|---|---|---|---|---|---|---|
| Молярная, кДж/кмоль | Массовая, кДж/кг | Объемная, кДж/м3 | |||||
| высшая | низшая | высшая | низшая | высшая | низшая | ||
| Водород | H2 + 0,5O2 = H20 | 286,06 | 242,90 | 141 900 | 120 080 | 12 750 | 10 790 |
| Оксид углерода | CO + 0,5O2 = CO2 | 283,17 | 283,17 | 10 090 | 10 090 | 12 640 | 12 640 |
| Метан | CH4 + 2O2 = CO2 + 2H2O | 880,90 | 800,90 | 55 546 | 49 933 | 39 820 | 35 880 |
| Этан | C2H6 + 0,5O2 = 2CO2 + 3H2O | 1560,90 | 1425,70 | 52 019 | 47 415 | 70 310 | 64 360 |
| Пропан | C3H8 + 5H2O = 3CO2 +4H2O | 2221,40 | 2041,40 | 50 385 | 46 302 | 101 210 | 93 180 |
| н-бутан | C4H10 + 6,5O2 = 4CO2 + 5H2O | 2880,40 | 2655,00 | 51 344 | 47 327 | 133 800 | 123 570 |
| Изобутан | C4H10 + 6,5O2 = 4CO2 + 5H2O | 2873,50 | 2648,30 | 51 222 | 47 208 | 132 960 | 122 780 |
| н-Пентан | C5H12 +  2 = 5CO2 + 6H2O 2 = 5CO2 + 6H2O |
3539,10 | 3274,40 | 49 052 | 45 383 | 169 270 | 156 630 |
| Этилен | C2H4 + 3O2 = 2CO2 + 2H2O | 1412,00 | 1333,50 | 50 341 | 47 540 | 63 039 | 59 532 |
| Пропилен | C3H6 + 4,5O2 = 3CO2 + 3H2O | 2059,50 | 1937,40 | 48 944 | 46 042 | 91 945 | 88 493 |
| Бутилен | C4H8 + 6O2 = 4CO2 + 4H2O | 2720,00 | 2549,70 | 48 487 | 45 450 | 121 434 | 113 830 |
Т е п л о в о й э ф ф е к т (теплота сгорания) Q — количество теплоты, выделяющееся при полном сгорании 1 кмоля, 1 кг или 1 м3 газа при нормальных физических условиях. Различают высшую Qв и низшую Qн теплоту сгорания: высшая теплота сгорания включает в себя теплоту конденсации водяных паров в процессе горения (в реальности при сжигании газа водяные пары не конденсируются, а удаляются вместе с другими продуктами сгорания). Обычно технические расчеты обычно ведут по низшей теплоте сгорания, без учета теплоты конденсации водяных паров (≈2400 кДж/кг).
КПД, рассчитанный по низшей теплоте сгорания, формально выше, но теплота конденсации водяных паров достаточно велика, и ее использование более чем целесообразно. Подтверждение этому — активное применение в отопительной технике контактных теплообменников, весьма разнообразных по конструкции.
Для смеси горючих газов высшая (и низшая) теплота сгорания газов определяется по соотношению
Q = r1Q1 + r2Q2 + … + rnQn(8.2)
где r1, r2, …, rn — объемные (молярные, массовые) доли компонентов, входящих в смесь; Q1, Q2, …, Qn — теплота сгорания компонентов.
Воспользовавшись табл. 8.1, высшую и низшую теплоту сгорания, кДж/м3, сложного газа можно определять по следующим формулам:
Qв = 127,5 Н2 + 126,4 СО + 398 СН4 + 703 С2Н6 + 1012 С8Н8 + 1338 C4H10 + 1329 C4H10 +
+ 1693 С5Н12 + 630 С2Н4 + 919 С3Н6 +1214 C4H8(8.3)
Qн = 107,9 H2 + 126,4 CO + 358,8 CH4 + 643 C2H6 + 931,8 C8H8 + 1235 C4H10 + 1227 C4H10 +
+ 1566 C5H12 + 595 C2H4 + 884 C8H6 + 1138 C4H8(8.4)
где H2, CO, CH4 и т.д. — содержание отдельных составляющих в газовом топливе, об. %.
Процесс горения протекает гораздо сложнее, чем по формуле (8.1), так как наряду с разветвлением цепей происходит их обрыв за счет образования промежуточных стабильных соединений, которые при высокой температуре претерпевают дальнейшие преобразования. При достаточной концентрации кислорода образуются конечные продукты: водяной пар Н2О и двуокись углерода СО2. При недостатке окислителя, а также при охлаждении зоны реакции, промежуточные соединения могут стабилизироваться и попадать в окружающую среду.
Интенсивность тепловыделения и рост температуры приводят к увеличению в реагирующей системе активных частиц. Такая взаимосвязь цепного реагирования и температуры, свойственная практически всем процессам горения, привела к введению понятия цепочечно-теплового взрыва — сами химические реакции горения имеют цепной характер, а их ускорение происходит за счет выделения теплоты и роста температуры в реагирующей системе.
Скорость химической реакции в однородной смеси пропорциональна произведению концентраций реагирующих веществ:
w = kС1С2(8.5)
где С1 и С2 — концентрации реагирующих компонентов, кмоль/м3; k — константа скорости реакции, зависящая от природы реагирующих веществ и температуры.
При сжигании газа концентрации реагирующих веществ можно условно считать неизменными, так как в зоне горения происходит непрерывный приток свежих компонентов однозначного состава.
Константа скорости реакции (по уравнению Аррениуса):
К = К0е-Е/RT(8.6)
где К0 — предэкспоненциальный множитель, принимаемый для биометрических гомогенных смесей, ≈1,0; Е — энергия активации, кДж/кмоль; R — универсальная газовая постоянная, Дж/(кг•К); Т — абсолютная температура, К (°С); е — основание натуральных логарифмов.
Предэкспоненциальный множитель К0 можно истолковать как константу, отражающую полноту столкновения молекул, а Е — как минимальную энергию разрыва связей молекул и образования активных частиц, обеспечивающих эффективность столкновений. Для распространенных горючих смесей она укладывается в пределах (80÷150)•103 кДж/кмоль.
Уравнение (8.6) показывает, что скорость химических реакций резко возрастает с увеличением температуры: например, повышение температуры с 500 до 1000 К влечет повышение скорости реакции горения в 2•104÷5•108 раз (в зависимости от энергии активации).
На скорость реакций горения влияет их цепной характер. Первоначально генерируемый реакцией атомы и радикалы вступают в соединения с исходными веществами и между собой, образуя конечные продукты и новые частицы, повторяющие ту же цепь реакций. Нарастающее генерирование таких частиц приводит к «разгону» химических реакций — фактически взрыву всей смеси.
Высокотемпературное горение углеводородов имеет сложный характер и связано с образованием активных частиц в виде атомов и радикалов, а также промежуточных молекулярных соединений. В качестве примера приводятся реакции горения простейшего углеводорода — метана:
- Н + О2 —› ОН + О
СН4 + ОН —› СН3 + Н2О
СН4 + О —› СН2 + Н2О - СН3 + О2 —› НСНО + ОН
СН2 + О2 —› НСНО + О - НСНО + ОН —› НСО + Н2О
НСНО + О —› СО + Н2О
НСО + О2 —› СО + О + ОН - СО + О —› СО2
СО + ОН —› СО2 + Н
Итог единичного цикла:
2СН4 + 4О2 —› 2СО2 + 4Н2О
8.2. РАСЧЕТЫ ГОРЕНИЯ
Кислород для горения поступает из воздуха как его составная часть. Для расчетов принимается, что объемный состав сухого воздуха следующий:
кислород — 21,0%, азот — 79,0%.
Согласно приведенным сведениям, 1 м3 кислорода содержится в 100/21 = 4,76 м3 воздуха, или на 1 м3 кислорода приходится 79/21 = 3,76 м3 азота. Учитывая, что 1 кмоль газа при нормальных условиях занимает объем 22,4 л, реакцию горения (см. уравнение 8.1) любого углеводорода в воздухе можно записать в обобщенном виде:
CmHn + (т + n/4) (O2 + 3,76N2) = тСO2 + (n/2) Н2O + (т +n/4) 3,76N2
Потребности в кислороде и воздухе при горении различных газов, подсчитанные по приведенным реакциям горения, представлены в табл. 8.2.
Таблица 8.2. Теоретическая потребность в сухом кислороде и воздухе, м3, и объем продуктов сгорания газа при сжигании 1 м3 газа
| Газ | Теоретическая потребность | Продукты сгорания | ||||
|---|---|---|---|---|---|---|
| кислорода | воздуха | диоксид углерода | водяной пар | азот | всего | |
| Водород H2 | 0,5 | 2,38 | – | 1,0 | 1,88 | 2,88 |
| Оксид углерода CO | 0,5 | 2,38 | 1,0 | – | 1,88 | 2,88 |
| Метан CH4 | 2,0 | 9,52 | 1,0 | 2,0 | 7,52 | 10,52 |
| Этан C2H6 | 3,5 | 16,66 | 2,0 | 3,0 | 13,16 | 18,16 |
| Пропан C3H8 | 5,0 | 23,80 | 3,0 | 4,0 | 18,80 | 25,80 |
| Бутан C4H10 | 6,5 | 30,94 | 4,0 | 5,0 | 24,44 | 33,44 |
| Пентан C5H12 | 8,0 | 38,08 | 5,0 | 6,0 | 30,08 | 41,08 |
| Этилен C2H4 | 3,0 | 14,28 | 2,0 | 2,0 | 11,28 | 15,28 |
| Пропилен C3H6 | 4,5 | 21,42 | 3,0 | 3,0 | 16,92 | 22,92 |
| Бутилен C4H8 | 6,0 | 28,56 | 4,0 | 4,0 | 22,56 | 30,56 |
| Пентилен C5H10 | 7,5 | 35,70 | 5,0 | 5,0 | 28,20 | 38,20 |
| Ацетилен C2H2 | 2,5 | 11,90 | 2,0 | 1,0 | 9,40 | 12,40 |
Для сложного газа расход сухого воздуха Vc, м3/м3, подсчитывается по формуле, учитывающей потребность в кислороде отдельных компонентов смеси:
Vc=4,76/100 (0,5Н2+0,5СО+2СН4+3,5С2Н6+5С3H8+6,5С4Н10+3С2Н4+4,5С3Н6+6C4H8-О2)(8.7)
Теоретический расход влажного воздуха Vвл, м3/м3, больше определяемого по формуле (8.7) на объем содержащихся водяных паров:
Vвл = Vс + 0,001244dв Vс(8.8)
где dв — влажность воздуха, г/м3.
При неизвестном химическом составе газов, но известной низшей теплоте сгорания Qн, кДж/м3, теоретический расход воздуха Vт , м3/м3,
Vт ≈ Qн /3770(8.9)
Реальный расход воздуха Vдв, м3/м3, принимается всегда несколько большим:
Vдв = Vтα(8.10)
где α — коэффициент избытка воздуха, соответствующий требованиям ГОСТ. Для полного сгорания топлива значение α должно быть больше 1. Состав и объем продуктов сгорания, подсчитанный по реакциям горения некоторых газов в сухом воздухе, приведен в табл. 8.2.
8.3. ТЕМПЕРАТУРА ГОРЕНИЯ
В теплотехнике различаются следующие температуры горения газов: жаропроизводительность, калориметрическую, теоретическую и действительную (расчетную). Жаропроизводительность tж — максимальная температура продуктов полного сгорания газа в адиабатических условиях с коэффициентом избытка воздуха α = 1,0 и при температуре газа и воздуха, равной 0°C:
tж = Qн /(∑Vcp)(8.11)
где Qн — низшая теплота сгорания газа, кДж/м3; ∑Vcp — сумма произведений объемов диоксида углерода, водяного пара и азота, образовавшихся при сгорании 1 м3 газа (м3/м3), и их средних объемных теплоемкостей при постоянном давлении в пределах температур от 0°С до tж (кДж/(м3o°С).
В силу непостоянства теплоемкости газов жаропроизводительность определяется методом последовательных приближений. В качестве начального параметра берется ее значение для природного газа (≈2000°С), при α = 1,0 определяются объемы компонентов продуктов сгорания, по табл. 8.3 находится их средняя теплоемкость и затем по формуле (8.11) считается жаропроизводительность газа. Если в результате подсчета она окажется ниже или выше принятой, то задается другая температура и расчет повторяется.
Таблица 8.3. Средняя объемная теплоемкость газов, кДж/(м3•°С)
|
Температура, °С |
CO2 | N2 | O2 | CO | CH4 | H2 | H2O (водяные пары) | воздух | |
|---|---|---|---|---|---|---|---|---|---|
| сухой | влажный на 1 м3 сухого газа |
||||||||
| 0 | 1,5981 | 1,2970 | 1,3087 | 1,3062 | 1,5708 | 1,2852 | 1,4990 | 1,2991 | 1,3230 |
| 100 | 1,7186 | 1,2991 | 1,3209 | 1,3062 | 1,6590 | 1,2978 | 1,5103 | 1,3045 | 1,3285 |
| 200 | 1,8018 | 1,3045 | 1,3398 | 1,3146 | 1,7724 | 1,3020 | 1,5267 | 1,3142 | 1,3360 |
| 300 | 1,8770 | 1,3112 | 1,3608 | 1,3230 | 1,8984 | 1,3062 | 1,5473 | 1,3217 | 1,3465 |
| 400 | 1,9858 | 1,3213 | 1,3822 | 1,3356 | 2,0286 | 1,3104 | 1,5704 | 1,3335 | 1,3587 |
| 500 | 2,0030 | 1,3327 | 1,4024 | 1,3482 | 2,1504 | 1,3104 | 1,5943 | 1,3469 | 1,3787 |
| 600 | 2,0559 | 1,3453 | 1,4217 | 1,3650 | 2,2764 | 1,3146 | 1,6195 | 1,3612 | 1,3873 |
| 700 | 2,1034 | 1,3587 | 1,3549 | 1,3776 | 2,3898 | 1,3188 | 1,6464 | 1,3755 | 1,4020 |
| 800 | 2,1462 | 1,3717 | 1,4549 | 1,3944 | 2,5032 | 1,3230 | 1,6737 | 1,3889 | 1,4158 |
| 900 | 2,1857 | 1,3857 | 1,4692 | 1,4070 | 2,6040 | 1,3314 | 1,7010 | 1,4020 | 1,4293 |
| 1000 | 2,2210 | 1,3965 | 1,4822 | 1,4196 | 2,7048 | 1,3356 | 1,7283 | 1,4141 | 1,4419 |
| 1100 | 2,2525 | 1,4087 | 1,4902 | 1,4322 | 2,7930 | 1,3398 | 1,7556 | 1,4263 | 1,4545 |
| 1200 | 2,2819 | 1,4196 | 1,5063 | 1,4448 | 2,8812 | 1,3482 | 1,7825 | 1,4372 | 1,4658 |
| 1300 | 2,3079 | 1,4305 | 1,5154 | 1,4532 | – | 1,3566 | 1,8085 | 1,4482 | 1,4771 |
| 1400 | 2,3323 | 1,4406 | 1,5250 | 1,4658 | – | 1,3650 | 1,8341 | 1,4582 | 1,4876 |
| 1500 | 2,3545 | 1,4503 | 1,5343 | 1,4742 | – | 1,3818 | 1,8585 | 1,4675 | 1,4973 |
| 1600 | 2,3751 | 1,4587 | 1,5427 | – | – | – | 1,8824 | 1,4763 | 1,5065 |
| 1700 | 2,3944 | 1,4671 | 1,5511 | – | – | – | 1,9055 | 1,4843 | 1,5149 |
| 1800 | 2,4125 | 1,4746 | 1,5590 | – | – | – | 1,9278 | 1,4918 | 1,5225 |
| 1900 | 2,4289 | 1,4822 | 1,5666 | – | – | – | 1,9698 | 1,4994 | 1,5305 |
| 2000 | 2,4494 | 1,4889 | 1,5737 | 1,5078 | – | – | 1,9694 | 1,5376 | 1,5376 |
| 2100 | 2,4591 | 1,4952 | 1,5809 | – | – | – | 1,9891 | – | – |
| 2200 | 2,4725 | 1,5011 | 1,5943 | – | – | – | 2,0252 | – | – |
| 2300 | 2,4860 | 1,5070 | 1,5943 | – | – | – | 2,0252 | – | – |
| 2400 | 2,4977 | 1,5166 | 1,6002 | – | – | – | 2,0389 | – | – |
| 2500 | 2,5091 | 1,5175 | 1,6045 | – | – | – | 2,0593 | – | – |
Жаропроизводительность распространенных простых и сложных газов при их горении в сухом воздухе приведена в табл. 8.4. При сжигании газа в атмосферном воздухе, содержащем около 1 вес. % влаги, жаропроизводительность снижается на 25–30°С.
Таблица 8.4. Жаропроизводительность газов в сухом воздухе
| Простой газ | Жаропроизводительность, °С | Сложный газ усредненного состава |
Приближенная жаропроизводительность, °С |
|---|---|---|---|
| Водород | 2235 |
Природный газовых месторождений |
2040 |
| Оксид углерода | 2370 |
Природный нефтяных месторождений |
2080 |
| Метан | 2043 |
Коксовый |
2120 |
| Этан | 2097 |
Высокотемпературной перегонки сланцев |
1980 |
| Пропан | 2110 |
Парокислородного дутья под давлением |
2050 |
| Бутан | 2118 |
Генераторный из жирных углей |
1750 |
| Пентан | 2119 |
Генераторный паровоздушного дутья из тощих топлив |
1670 |
| Этилен | 2284 |
Сжиженный (50% С3Н4+50% С4Н10) |
2115 |
| Ацетилен | 2620 |
Водяной |
2210 |
Калориметрическая температура горения tк — температура, определяемая без учета диссоциации водяных паров и диоксида углерода, но с учетом фактической начальной температуры газа и воздуха. Она отличается от жаропроизводительности tж тем, что температура газа и воздуха, а также коэффициент избытка воздуха α принимаются по их действительным значениям. Определить tк можно по формуле:
tк = (Qн + qфиз)/(ΣVcp)(8.12)
где qфиз — теплосодержание (физическая теплота) газа и воздуха, отсчитываемое от 0°С, кДж/м3.
Природные и сжиженные углеводородные газы перед сжиганием обычно не нагревают, и их объем по сравнению с объемом воздуха, идущего на горение, невелик. Поэтому при определении калориметрической температуры теплосодержание газов можно не учитывать. При сжигании газов с низкой теплотой сгорания (генераторные, доменные и др.) их теплосодержание (в особенности нагретых до сжигания) оказывает весьма существенное влияние на калориметрическую температуру.
Зависимость калориметрической температуры природного газа среднего состава в воздухе с температурой 0°С и влажностью 1% от коэффициента избытка воздуха α приведена в табл. 8.5, для сжиженного углеводородного газа при его сжигании в сухом воздухе — в табл. 8.7. Данными табл. 8.5–8.7 можно с достаточной точностью руководствоваться при установлении калориметрической температуры горения других природных газов, сравнительно близких по составу, и углеводородных газов практически любого состава. При необходимости получить высокую температуру при сжигании газов с малыми коэффициентами избытка воздуха, а также для повышения КПД печей, на практике подогревают воздух, что приводит к росту калориметрической температуры (см. табл. 8.6).
Таблица 8.5. Калориметрическая и теоретическая температуры горения природного газа в воздухе с t = 0°С и влажностью 1% в зависимости от коэффициента избытка воздуха α
| Коэффициент избытка воздуха α | Калориметрическая температура горения tк, °С | Теоретическая температура горения tт, °С | Коэффициент избытка воздуха α | Калориметрическая температура горения tк, °С |
|---|---|---|---|---|
| 1,0 | 2010 | 1920 | 1,33 | 1620 |
| 1,02 | 1990 | 1900 | 1,36 | 1600 |
| 1,03 | 1970 | 1880 | 1,40 | 1570 |
| 1,05 | 1940 | 1870 | 1,43 | 1540 |
| 1,06 | 1920 | 1860 | 1,46 | 1510 |
| 1,08 | 1900 | 1850 | 1,50 | 1470 |
| 1,10 | 1880 | 1840 | 1,53 | 1440 |
| 1,12 | 1850 | 1820 | 1,57 | 1410 |
| 1,14 | 1820 | 1790 | 1,61 | 1380 |
| 1,16 | 1800 | 1770 | 1,66 | 1350 |
| 1,18 | 1780 | 1760 | 1,71 | 1320 |
| 1,20 | 1760 | 1750 | 1,76 | 1290 |
| 1,22 | 1730 | – | 1,82 | 1260 |
| 1,25 | 1700 | – | 1,87 | 1230 |
| 1,28 | 1670 | – | 1,94 | 1200 |
| 1,30 | 1650 | – | 2,00 | 1170 |
Таблица 8.6. Калориметрическая температура горения природного газа tк, °С, в зависимости от коэффициента избытка сухого воздуха и его температуры (округленные значения)
| Коэффициент избытка воздуха α | Температура сухого воздуха, °С | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 20 | 100 | 200 | 300 | 400 | 500 | 600 | 700 | 800 | |
| 0,5 | 1380 | 1430 | 1500 | 1545 | 1680 | 1680 | 1740 | 1810 | 1860 |
| 0,6 | 1610 | 1650 | 1715 | 1780 | 1840 | 1900 | 1960 | 2015 | 2150 |
| 0,7 | 1730 | 1780 | 1840 | 1915 | 1970 | 2040 | 2100 | 2200 | 2250 |
| 0,8 | 1880 | 1940 | 2010 | 2060 | 2130 | 2200 | 2260 | 2330 | 2390 |
| 0,9 | 1980 | 2030 | 2090 | 2150 | 2220 | 2290 | 2360 | 2420 | 2500 |
| 1,0 | 2050 | 2120 | 2200 | 2250 | 2320 | 2385 | 2450 | 2510 | 2560 |
| 1,2 | 1810 | 1860 | 1930 | 2000 | 2070 | 2140 | 2200 | 2280 | 2350 |
| 1,4 | 1610 | 1660 | 1740 | 1800 | 2870 | 1950 | 2030 | 2100 | 2160 |
| 1,6 | 1450 | 1510 | 1560 | 1640 | 1730 | 1800 | 1860 | 1950 | 2030 |
| 1,8 | 1320 | 1370 | 1460 | 1520 | 1590 | 1670 | 1740 | 1830 | 1920 |
| 2,0 | 1220 | 1270 | 1360 | 1420 | 1490 | 1570 | 1640 | 1720 | 1820 |
Таблица 8.7. Калориметрическая температура горения tк технического пропана в сухом воздухе с t = 0°С в зависимости от коэффициента избытка воздуха α
| Коэффициент избытка воздуха α | Калориметрическая температура горения tк, °С | Коэффициент избытка воздуха α | Калориметрическая температура горения tк, °С |
|---|---|---|---|
| 1,0 | 2110 | 1,45 | 1580 |
| 1,02 | 2080 | 1,48 | 1560 |
| 1,04 | 2050 | 1,50 | 1540 |
| 1,05 | 2030 | 1,55 | 1500 |
| 1,07 | 2010 | 1,60 | 1470 |
| 1,10 | 1970 | 1,65 | 1430 |
| 1,12 | 1950 | 1,70 | 1390 |
| 1,15 | 1910 | 1,75 | 1360 |
| 1,20 | 1840 | 1,80 | 1340 |
| 1,25 | 1780 | 1,85 | 1300 |
| 1,27 | 1750 | 1,90 | 1270 |
| 1,30 | 1730 | 1,95 | 1240 |
| 1,35 | 1670 | 2,00 | 1210 |
| 1,40 | 1630 | 2,10 | 1170 |
Теоретическая температура горения tT — максимальная температура, определяемая аналогично калориметрической tк, но с поправкой на эндотермические (требующие теплоты) реакции диссоциации диоксида углерода и водяного пара, идущие с увеличением объема:
СО2 ‹–› СО + 0,5О2 — 283 мДж/моль(8.13)
Н2О ‹–› Н2 + 0,5О2 — 242 мДж/моль(8.14)
При высоких температурах диссоциация может привести к образованию атомарного водорода, кислорода и гидроксильных групп ОН. Кроме того, при сжигании газа всегда образуется некоторое количество оксида азота. Все эти реакции эндотермичны и приводят к снижению температуры горения.
Теоретическая температура горения может быть определена по следующей формуле:
tT = (Qн + qфиз – qдис)/(ΣVcp)(8.15)
где qдис — суммарные затраты теплоты на диссоциацию СО2 и Н2О в продуктах сгорания, кДж/м3; ΣVcp — сумма произведения объема и средней теплоемкости продуктов сгорания с учетом диссоциации на 1 м3 газа.
Таблица 8.8. Степень диссоциации водяного пара H2O и диоксида углерода CO2 в зависимости от парциального давления
| Температура, °С | Парциальное давление, МПа | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0,004 | 0,006 | 0,008 | 0,010 | 0,012 | 0,014 | 0,016 | 0,018 | 0,020 | 0,025 | 0,030 | 0,040 | |
| Водяной пар H2O | ||||||||||||
| 1600 | 0,85 | 0,75 | 0,65 | 0,60 | 0,58 | 0,56 | 0,54 | 0,52 | 0,50 | 0,48 | 0,46 | 0,42 |
| 1700 | 1,45 | 1,27 | 1,16 | 1,08 | 1,02 | 0,95 | 0,90 | 0,85 | 0,8 | 0,76 | 0,73 | 0,67 |
| 1800 | 2,40 | 2,10 | 1,90 | 1,80 | 1,70 | 1,60 | 1,53 | 1,46 | 1,40 | 1,30 | 1,25 | 1,15 |
| 1900 | 4,05 | 3,60 | 3,25 | 3,0 | 2,85 | 2,70 | 2,65 | 2,50 | 2,40 | 2,20 | 2,10 | 1,9 |
| 2000 | 5,75 | 5,05 | 4,60 | 4,30 | 4,0 | 3,80 | 3,55 | 3,50 | 3,40 | 3,15 | 2,95 | 2,65 |
| 2100 | 8,55 | 7,50 | 6,80 | 6,35 | 6,0 | 5,70 | 5,45 | 5,25 | 5,10 | 4,80 | 4,55 | 4,10 |
| 2200 | 12,3 | 10,8 | 9,90 | 9,90 | 8,80 | 8,35 | 7,95 | 7,65 | 7,40 | 6,90 | 6,50 | 5,90 |
| 2300 | 16,0 | 15,0 | 13,7 | 12,9 | 12,2 | 11,6 | 11,1 | 10,7 | 10,4 | 9,6 | 9,1 | 8,4 |
| 2400 | 22,5 | 20,0 | 18,4 | 17,2 | 16,3 | 15,6 | 15,0 | 14,4 | 13,9 | 13,0 | 12,2 | 11,2 |
| 2500 | 28,5 | 25,6 | 23,5 | 22,1 | 20,9 | 20,0 | 19,3 | 18,6 | 18,0 | 16,8 | 15,9 | 14,6 |
| 3000 | 70,6 | 66,7 | 63,8 | 61,6 | 59,6 | 58,0 | 56,5 | 55,4 | 54,3 | 51,9 | 50,0 | 47,0 |
| Диоксид углерода CO2 | ||||||||||||
| 1500 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,4 | 0,4 | 0,4 | 0,4 | 0,4 | – |
| 1600 | 2,0 | 1,8 | 1,6 | 1,5 | 1,45 | 1,4 | 1,35 | 1,3 | 1,25 | 1,2 | 1,1 | |
| 1700 | 3,8 | 3,3 | 3,0 | 2,8 | 2,6 | 2,5 | 2,4 | 2,3 | 2,2 | 2,0 | 1,9 | |
| 1800 | 6,3 | 5,5 | 5,0 | 4,6 | 4,4 | 4,2 | 4,0 | 3,8 | 3,7 | 3,5 | 3,3 | |
| 1900 | 10,1 | 8,9 | 8,1 | 7,6 | 7,2 | 6,8 | 6,5 | 6,3 | 6,1 | 5,6 | 5,3 | |
| 2000 | 16,5 | 14,6 | 13,4 | 12,5 | 11,8 | 11,2 | 10,8 | 10,4 | 10,0 | 9,4 | 8,8 | |
| 2100 | 23,9 | 21,3 | 19,6 | 18,3 | 17,3 | 16,5 | 15,9 | 15,3 | 14,9 | 13,9 | 13,1 | |
| 2200 | 35,1 | 31,5 | 29,2 | 27,5 | 26,1 | 25,0 | 24,1 | 23,3 | 22,6 | 21,2 | 20,1 | |
| 2300 | 44,7 | 40,7 | 37,9 | 35,9 | 34,3 | 32,9 | 31,8 | 30,9 | 30,0 | 28,2 | 26,9 | |
| 2400 | 56,0 | 51,8 | 48,8 | 46,5 | 44,6 | 43,1 | 41,8 | 40,6 | 39,6 | 37,5 | 35,8 | |
| 2500 | 66,3 | 62,2 | 59,3 | 56,9 | 55,0 | 53,4 | 52,0 | 50,7 | 49,7 | 47,3 | 45,4 | |
| 3000 | 94,9 | 93,9 | 93,1 | 92,3 | 91,7 | 90,6 | 90,1 | 89,6 | 88,5 | 87,6 | 86,8 |
Как видно из табл. 8.8, при температуре до 1600°С степень диссоциации может не учитываться, и теоретическую температуру горения может принять равной калориметрической. При более высокой температуре степень диссоциации может существенно снижать температуру в рабочем пространстве. На практике особой необходимости в этом нет, теоретическую температуру горения необходимо определять только для высокотемпературных печей, работающих на предварительно нагретом воздухе (например, мартеновских). Для котельных установок в этом нужды нет.
Таблица 8.9. Максимальные
температуры, возникающие
в свободном пламени, °С
|
Газ |
Газовоздушная смесь, |
Газоксилородная |
|---|---|---|
| H2 | 2045 | 2660 |
| CO | 2100 | 2920 |
| CH4 | 1870 | 2740 |
| C2H6 | 1890 | – |
| C3H8 | 1920 | 2780 |
| C4H10 | 1890 | – |
| C2H2 | 2320 | 3000 |
Действительная (расчетная) температура продуктов сгорания tд — температура, которая достигается в реальных условиях в самой горячей точке факела. Она ниже теоретической и зависит от потерь теплоты в окружающую среду, степени отдачи теплоты из зоны горения излучением, растянутости процесса горения во времени и др. Действительные усредненные температуры в топках печей и котлов определяются по тепловому балансу или приближенно по теоретической или калориметрической температуре горения в зависимости от температуры в топках с введением в них экспериментально установленных поправочных коэффициентов:
tд = tтη(8.16)
где η— т.н. пирометрический коэффициент, укладывающийся в пределах:
- для качественно выполненных термических и нагревательных печей с теплоизоляцией — 0,75–0,85;
- для герметичных печей без теплоизоляции — 0,70–0,75;
- для экранированных топок котлов — 0,60–0,75.
В практике надо знать не только приведенные выше адиабатные температуры горения, но и максимальные температуры, возникающие в пламени. Их приближенные значения обычно устанавливают экспериментально методами спектрографии. Максимальные температуры, возникающие в свободном пламени на расстоянии 5–10 мм от вершины конусного фронта горения, приведены в табл. 8.9. Анализ приведенных данных показывает, что максимальные температуры в пламени меньше жаропроизводительности (за счет затрат тепла на диссоциацию Н2О и СО2 и отвода теплоты из пламенной зоны).
8.4. ТЕМПЕРАТУРА САМОВОСПЛАМЕНЕНИЯ
Для инициирования реакций горения нужны условия воспламенения смеси топлива с окислителем. Воспламенение может быть самопроизвольным и вынужденным (зажигание).
Температура самовоспламенения — минимальная температура, при которой в нагретой газовоздушной смеси начинается самопроизвольный (т.е. без внешнего подвода теплоты) процесс горения, за счет выделения теплоты горящими частицами газа.
Температура самовоспламенения не является фиксированной для данного газа и зависит от многих параметров: его содержания в газовоздушной смеси, степени однородности смеси, формы и размеров сосуда, в котором смесь нагревается, быстроты и способа ее нагрева, каталитического влияния стенок сосуда, давления, под которым находится смесь. Точный учет перечисленных факторов весьма сложен, поэтому на практике, например, при оценке взрывоопасности, пользуются экспериментальными данными (см. табл. 8.10).
Таблица 8.10. Наименьшие измеренные температуры самовоспламенения некоторых газов и паров в смеси с воздухом при атмосферном давлении
| Газ | Температура самовоспламенения, °С | Газ | Температура самовоспламенения, °С |
|---|---|---|---|
| Водород | 530 |
Этилен |
455 |
| Оксид углерода | 610 |
Пропилен |
455 |
| Метан | 650 |
Бутилен |
455 |
| Этан | 510 |
Ацетилен |
335 |
| Пропан | 500 |
Сероводород |
290 |
| Бутан | 429 |
Коксовый газ |
560 |
Температуры самовоспламенения горючих газов в кислороде несколько ниже, чем в воздухе. Введение в состав газов балластных примесей (азота и диоксида углерода) приводит к увеличению температуры самовоспламенения. Присутствие в сложных газах компонентов с низкой температурой самовоспламенения приводит к снижению температуры самовоспламенения смеси.
Вынужденное воспламенение (зажигание) осуществляется поджиганием смеси в одной или в ряде точек высокотемпературным источником — открытым пламенем или электрической искрой в точке вылета газа из огневых каналов горелок в топочный объем. Зажигание отличается от самовоспламенения тем, что горючую смесь доводят до появления пламени не во всем объеме, а только в небольшой части его. Теплоотвод из нагреваемой зоны требует, чтобы интенсивность тепловыделения источника зажигания превышала этот отвод теплоты. После воспламенения источник зажигания удаляется, и горение происходит за счет распространения фронта пламени.
8.5. ПРЕДЕЛЫ ВОСПЛАМЕНЯЕМОСТИ И ВЗРЫВАЕМОСТИ
Газовоздушные смеси могут воспламеняться (взрываться) только тогда, когда содержание газа в смеси находится в определенных (для каждого газа) пределах. В связи с этим различают нижний и верхний концентрационные пределы воспламеняемости. Нижний предел соответствует минимальному, а верхний — максимальному количеству газа в смеси, при котором происходят их воспламенение (при зажигании) и самопроизвольное (без притока тепла извне) распространение пламени (самовоспламенение). Эти же пределы соответствуют и условиям взрываемости газовоздушных смесей.
Если содержание газа в газовоздушной смеси меньше нижнего предела воспламеняемости, такая смесь гореть и взрываться не может, поскольку выделяющейся вблизи источника зажигания теплоты для подогрева смеси до температуры воспламенения недостаточно. Если содержание газа в смеси находится между нижним и верхним пределами воспламеняемости, подожженная смесь воспламеняется и горит как вблизи источника зажигания, так и при удалении его. Такая смесь является взрывоопасной. Чем шире будет диапазон пределов воспламеняемости (называемых также пределами взрываемости) и ниже нижний предел, тем более взрывоопасен газ. И наконец, если содержание газа в смеси превышает верхний предел воспламеняемости, то количества воздуха в смеси недостаточно для полного сгорания газа.
Существование пределов воспламеняемости вызывается тепловыми потерями при горении. При разбавлении горючей смеси воздухом, кислородом или газом тепловые потери возрастают, скорость распространения пламени уменьшается, и горение прекращается после удаления источника зажигания.
Таблица 8.11. Пределы воспламеняемости газов в смеси с воздухом (при t = 20°C и p = 101,3 кПа)
| Газ | Содержание газа в газовоздушной смеси, об. % |
Максимальное |
Коэффициент избытка воздуха α при пределах воспламенения | ||||
|---|---|---|---|---|---|---|---|
| При пределах воспламеняемости | При стехиометрическом составе смеси | При составе смеси, дающем максимальное давление взрыва | |||||
| нижнем | верхнем | нижнем | верхнем | ||||
| Водород | 4,0 | 75,0 | 29,5 | 32,3 | 0,739 | 9,8 | 0,15 |
| Оксид углерода | 12,5 | 74,0 | 29,5 | – | – | 2,9 | 0,15 |
| Метан | 5,0 | 15,0 | 9,5 | 9,8 | 0,717 | 1,8 | 0,65 |
| Этан | 3,2 | 12,5 | 5,68 | 6,28 | 0,725 | 1,9 | 0,42 |
| Пропан | 2,3 | 9,5 | 4,04 | 4,60 | 0,858 | 1,7 | 0,40 |
| н-Бутан | 1,7 | 8,5 | 3,14 | 3,6 | 0,858 | 1,7 | 0,35 |
| Изобутан | 1,8 | 8,4 | 3,14 | – | – | ~1,8 | 0,35 |
| н-Пентан | 1,4 | 7,8 | 2,56 | 3,0 | 0,865 | 1,8 | 0,31 |
| Этилен | 3,0 | 16,0 | 6,5 | 8,0 | 0,886 | 2,2 | 0,17 |
| Пропилен | 2,4 | 10,0 | 4,5 | ~5,1 | ~0,89 | 1,9 | 0,37 |
| Бутилен | 1,7 | 9,0 | 3,4 | ~4,0 | ~0,88 | 1,7 | 0,35 |
| Ацетилен | 2,5 | 80,0 | 7,75 | 14,5 | 1,03 | 3,3 | 0,019 |
Таблица 8.12. Пределы воспламеняемости газов в смеси с кислородом (при t = 20°C и p = 101,3 кПа)
| Газ | Содержание газа в газокислородной смеси, об. %, при пределах воспламеняемости | |
|---|---|---|
| нижнем | верхнем | |
| Водород | 4,0 | 94,0 |
| Оксид углерода | 12,5 | 94,0 |
| Метан | 5,0 | 6,0 |
| Этан | 3,0 | 56,0 |
| Пропан | 2,2 | 55,0 |
| н-Бутан | 1,7 | 49,0 |
| Изобутан | 1,7 | 49,0 |
| Этилен | 3,0 | 80,0 |
| Пропилен | 2,0 | 53,0 |
| Бутилен | 1,47 | 50,0 |
| Ацетилен | 2,5 | 89,0 |
Пределы воспламеняемости для распространенных газов в смесях с воздухом и кислородом приведены в табл. 8.11–8.12. С увеличением температуры смеси пределы воспламеняемости расширяются, а при температуре, превышающей температуру самовоспламенения, смеси газа с воздухом или кислородом горят при любом объемном соотношении.
Пределы воспламеняемости зависят не только от видов горючих газов, но и от условий проведения экспериментов (вместимости сосуда, тепловой мощности источника зажигания, температуры смеси, распространения пламени вверх, вниз, горизонтально и др.). Этим объясняются несколько отличающиеся друг от друга значения этих пределов в различных литературных источниках. В табл. 8.11–8.12 приведены сравнительно достоверные данные, полученные при комнатной температуре и атмосферном давлении при распространении пламени снизу вверх в трубке диаметром 50 мм и более. При распространении пламени сверху вниз или горизонтально нижние пределы несколько возрастают, а верхние снижаются. Пределы воспламеняемости сложных горючих газов, не содержащих балластных примесей, определяются по правилу аддитивности:
Lг = (r1 + r2+ … + rn)/(r1/l1 + r2/l2+ … + rn/ln)(8.17)
где Lг — нижний или верхний предел воспламеняемости сложного газа в газовоздушной или газокислородной смеси, об. %; r1, r2, …, rn — содержание отдельных компонентов в сложном газе, об. %; r1 + r2 + … + rn = 100%; l1, l2, …, ln — нижние или верхние пределы воспламеняемости отдельных компонентов в газовоздушной или газокислородной смеси по данным табл. 8.11 или 8.12, об. %.
При наличии в газе балластных примесей пределы воспламеняемости могут быть определены по формуле:
Lб = Lг[1 + Б/(1 – Б)o100]/[100 + LгБ/(1 – Б)](8.18)
где Lб — верхний и нижний пределы воспламеняемости смеси с балластными примесями, об. %; Lг — верхний и нижний пределы воспламеняемости горючей смеси, об. %; Б — количество балластных примесей, доли единицы.
При расчетах часто необходимо знать коэффициент избытка воздуха α при разных пределах воспламеняемости (см. табл. 8.11), а также давление, возникающее при взрыве газовоздушной смеси. Коэффициент избытка воздуха, соответствующий верхнему или нижнему пределам воспламеняемости, можно определить по формуле
α = (100/L – 1) (1/VT)(8.19)
Давление, возникающее при взрыве газовоздушных смесей, можно определить с достаточным приближением по следующим формулам:
для стехиометрического соотношения простого газа с воздухом:
Рвз = Рн(1 + βtк) (m/n)(8.20)
для любого соотношения сложного газа с воздухом:
Рвз = Рн(1 + βtк) Vвлпс /(1 + αVm)(8.21)
где Рвз — давление, возникающее при взрыве, МПа; рн — начальное давление (до взрыва), МПа; β — коэффициент объемного расширения газов, численно равный коэффициенту давления (1/273); tK — калориметрическая температура горения, °С; m — число молей после взрыва, определяемое по реакции горения газа в воздухе; п — число молей до взрыва, участвующих в реакции горения; Vвлпс — объем влажных продуктов сгорания на 1 м3 газа, м3; Vт — теоретический расход воздуха, м3/м3.
Таблица 8.13. Давление, возникающее при взрыве пропанововоздушной смеси, в зависимости от коэффициента сброса kсб и вида защитного устройства
| Вид защитного устройства | Коэффициент сброса kсб, м2/м3 | ||
|---|---|---|---|
| 0,063 | 0,033 | 0,019 | |
| Одинарное глухое остекление с наружным креплением стекла толщиной 3 мм | 0,005 | 0,009 | 0,019 |
| Двойное глухое остекление с наружным креплением стекла толщиной 3 мм | 0,007 | 0,015 | 0,029 |
| Поворотный одинарный оконный переплет с большим шарниром и пружинным замком на нагрузку 5 МПа/м2 | 0,002 | – | – |
| Поворотный одинарный оконный переплет с верхним шарниром и пружинным замком на нагрузку 5 МПа/м2 | 0,003 | – | – |
| Свободно лежащие на перекрытии плиты массой, кг/ м2: | |||
|
50 |
0,023 | ||
|
100 |
0,005 | ||
|
200 |
0,018 |
Давления взрыва, приведенные в табл. 8.13 или определенные по формулам, могут возникнуть только в том случае, если происходит полное сгорание газа внутри емкости и ее стенки рассчитаны на эти давления. В противном случае они ограничены прочностью стенок или их наиболее легко разрушающихся частей — импульсы давления распространяются по невоспламененному объему смеси со скоростью звука и достигают ограждения гораздо быстрее, чем фронт пламени.
Эта особенность — различие скоростей распространения пламени и импульсов давления (ударной волны) — широко используется на практике для защиты газовых устройств и помещений от разрушения при взрыве. Для этого в проемах стен и перекрытий устанавливаются легко открывающиеся или разрушающиеся фрамуги, рамы, панели, клапаны и т.д. Возникающее при взрыве давление зависит от особенностей конструкции устройств защиты и коэффициента сброса kсб, представляющего собой отношение площади защитных устройств к объему помещения.
8.6. ГОРЕНИЕ В НЕПОДВИЖНОЙ СРЕДЕ
Перемещение пламенной зоны — фронта пламени, — области, отделяющей невступившую в реакцию горючую смесь от продуктов горения, вызвано тем, что холодная горючая смесь перед ним нагревается до температуры воспламенения за счет теплопроводности и диффузии раскаленных продуктов горения в холодную смесь. Линейная скорость, с которой перемещается фронт пламени по однородной горючей смеси, называется равномерной скоростью распространения пламени, зависящей как от вида газа, так и от его содержания в газовоздушной смеси. Минимальная скорость для всех видов горючих газов соответствует нижнему и верхнему пределам воспламенения, а максимальная — соотношению газов и воздуха.
Рис. 8.1. Кривые равномерных скоростей
распространения пламени uн, определенные
в трубке диаметром 25,4 мм
1-водород; 2-водяной газ; 3-оксид углерода;
4-этилен; 5-коксовый газ; 6-этан; 7-метан;
8-генераторный газ паровоздушного дутья
Рис. 8.2. Влияние диаметра dтр и концентрации
метана в смеси с воздухом на изменение
равномерной скорости распространения пламени uн
Экспериментами установлено, что скорость распространения пламени зависит от диаметра цилиндрической трубки, по которой оно распространяется: чем больше диаметр, тем выше скорость распространения. Увеличение диаметра трубки снижает влияние стенок на процесс горения и перемещающийся фронт пламени и способствует усилению конвекции (рис. 8.2). Анализ данных графика указывает, что при очень малых размерах трубок распространение пламени вообще невозможно (из-за сильного относительного теплоотвода). Размеры трубок, каналов и щелей, при которых пламя не распространяется, называются критическими.
Они различны для разных газов:
- холодная смесь метана с воздухом — 3 мм;
- водородно-воздушная смесь — 0,9 мм;
- разогретая смесь метана с воздухом — 1,2 мм.
Угасание в каналах малого сечения используются на практике для создания огнепреградителей: пламегасящих сеток, керамических пористых дисков, дисков из прессованных металлических шариков, сосудов, заполняемых мелкозернистыми материалами и др.); огневых каналов в конструкции горелок, работающих на газовоздушных смесях.
Для сравнительной характеристики горючих свойств газов (независимо от размеров трубок) введено понятие «нормальная скорость распространения пламени» — это скорость, отнесенная к холодной (еще невоспламенившейся) смеси, с которой пламя перемещается по нормали к ее поверхности. Фронт пламени принимается плоским и равным диаметру трубки:
uн = wpπr2/S(8.22)
где uн — нормальная скорость распространения пламени, м/с; wp — измеренная равномерная скорость распространения пламени, м/с; r — радиус трубки, м; S — площадь поверхности фронта пламени, м2.
Таблица 8.14. Скорости распространения пламени в различных газовоздушных смесях (при t=20°C и p=103,3кПа),м/с
| Газ | Смесь с максимальной нормальной скоростью распространения пламени |
Стехиометрическая смесь | ||||
|---|---|---|---|---|---|---|
| Содержание в смеси, об. % | Максимальная нормальная скорость распространения |
Содержание в смеси, об. % | Нормальная скорость распространения пламени |
|||
| газа | воздуха | газа | воздуха | |||
| Водород | 42,0 | 58,0 | 2,67 | 29,5 | 70,5 | 1,6 |
| Оксид углерода | 43,0 | 57,0 | 0,42 | 29,5 | 70,5 | 0,30 |
| Метан | 10,5 | 89,0 | 0,37 | 9,5 | 90,5 | 0,28 |
| Этан | 6,3 | 93,7 | 0,40 | 5,7 | 94,3 | 0,32 |
| Пропан | 4,3 | 95,7 | 0,38 | 4,04 | 95,96 | 0,31 |
| н-Бутан | 3,3 | 96,7 | 0,37 | 3,14 | 96,86 | 0,30 |
| Этилен | 7,0 | 93,0 | 0,63 | 6,5 | 93,5 | 0,5 |
| Пропилен | 4,8 | 95,2 | 0,44 | 4,5 | 95,5 | 0,37 |
| Бутилен | 3,7 | 96,3 | 0,43 | 3,4 | 96,6 | 0,38 |
| Ацетилен | 10,0 | 90,0 | 1,35 | 7,75 | 92,25 | 1,0 |
Как видно из данных табл. 8.14, максимальная скорость распространения пламени соответствует смесям газа и воздуха с недостатком окислителя (не стехиометрическим). При избытке горючего повышается эффективность столкновения реагирующих частиц и скорость химических реакций возрастает.
Скорости распространения пламени для газокислородных смесей на порядок выше, чем для газовоздушных. Так, максимальная нормальная скорость распространения пламени метано-кислородной смеси — 3,3 м/с, а для смеси пропана и бутана с кислородом — 3,5–3,6 м/с.
Максимальная нормальная скорость распространения пламени в смеси сложного газа с воздухом, м/с, определяется по формуле:
uн max = (r1u1 + r2u2 + … + rnun)/(r1 + r2 + … +rn)(8.23)
где r1, r2,…rn — содержание отдельных компонентов в сложном газе, об. %; u1, u2,…un — максимальные нормальные скорости распространения пламени компонентов сложного газа в смеси с воздухом, м/с.
Приведенные соотношения пригодны для газов, обладающих близкими нормальными скоростями распространения пламени, например, для природных и сжиженных углеводородных газов. Для смесей газов, обладающих резко различными скоростями распространения пламени (например, для смесей природных и искусственных газов, смесей с высоким содержанием водорода), они дают только приближенные значения.
Если же в смеси присутствуют балластные примеси (азот и диоксид углерода), то для приближенного расчета скорости распространения пламени следует воспользоваться формулой:
uб = uн max (1 – 0,01N2 – 0,012СО2)(8.24)
Значительно повышает скорость распространения пламени подогрев газовоздушной смеси:
и‘н = ин (Т‘/Т)(8.25)
где и‘н — скорости распространения пламени в нагретой смеси с абсолютной температурой Т‘, К; ин — то же, в холодной смеси с температурой Т, К.
Предварительный нагрев смеси изменяет ее плотность обратно пропорционально абсолютной температуре, поэтому и скорости распространения пламени растут пропорционально этой температуре. Этот факт надо учитывать при расчетах, особенно в тех случаях, когда огневые каналы горелок располагаются в нагретой кладке или когда на них воздействует излучение топки, раскаленных газов и т.п.
Равномерность распространения пламени возможна при выполнении следующих условий:
- огневая трубка имеет небольшую длину;
- горение распространяется при постоянном давлении, близком к атмосферному.
Если длина трубки значительна, то равномерное распространение пламени для некоторых смесей может перейти в вибрационное, а затем — и в детонационное со сверхзвуковой скоростью горения (2000 м/с и более), когда воспламенение смеси происходит за счет ударной волны, нагревающей смесь до температур, превышающих температуру самовоспламенения. Детонация возникает в смесях, обладающих высокими скоростями распространения пламени. Пределы концентрации детонации уже пределов воспламеняемости газовоздушных и газокислородных смесей, об. %: пропан — 3,2–37, изобутан — 2,8–31, водород — 15–90. Давление, возникающее при детонационном горении, может превышать начальное в десятки раз и приводить к разрушению труб и других сосудов, рассчитанных на высокие давления.
8.7. ГОРЕНИЕ В ЛАМИНАРНОМ И турбулентном ПОТОКах
Рис. 8.3. Фронт горения
газовоздушной смеси в
ламинарном режиме движения
Фронт пламени может быть остановлен, если создать встречное движение горючей смеси со скоростью, равной нормальной скорости распространения пламени. Наглядный пример — поверхность внутреннего конуса бунзеновской горелки. За счет регулирования состава газовоздушной смеси, вытекающей из горелки при ламинарном режиме движения, можно добиться появления устойчивого и резко очерченного конуса горения (рис. 8.3). Боковая поверхность конуса (фронт пламени), неподвижная относительно огневой кромки канала горелки, движется по направлению к вытекающей газовоздушной смеси, а пламя в этом случае распространяется по нормали к поверхности воспламенения в каждой ее точке. На поверхности конусного фронта пламени сохраняется равенство скоростей — проекции скорости потока газовоздушной смеси на нормаль wн к образующей конуса и нормальной скорости распространения пламени uн подчиняются закону Михельсона:
wн = wпот cosφ = uн(8.26)
где φ — угол между направлением потока и нормалью к поверхности конусного фронта пламени; wпот — средняя скорость потока газовоздушной смеси, проходящей через горелку за единицу времени, м/с.
Постоянство нормальной скорости распространения пламени справедливо только для основной части боковой поверхности конусного фронта пламени. В вершине конуса скорость увеличивается благодаря прогреву газовоздушной смеси близко расположенными участками конусной поверхности фронта пламени, а у основания конуса — снижается за счет охлаждающего воздействия торцевой части огневого канала горелки.
Для практических расчетов обычно пренебрегают этой разницей и принимают скорость прохождения смеси через фронт пламени постоянной по всей поверхности конуса и равной uн.
Усредненная нормальная скорость распространения пламени равна
uн = Vсм /S (8.27)
где Vсм — объем проходящей через горелку газовоздушной смеси, S — площадь поверхности конусного фронта пламени.
На практике конусный фронт пламени не имеет правильной геометрической формы, поэтому для точного определения S пламя фотографируют, фронт пламени разбивается на ряд усеченных конусов. Сумма боковых поверхностей и есть общая поверхность конусного фронта пламени. Значения нормальных скоростей распространения пламени, определенные как методом бунзеновской горелки, так и другими методами, одинаковы и равны нормальным скоростям, приведенным в табл. 8.14.
Высота конусного фронта пламени зависит в основном от размера огневого канала горелки. Уменьшение высоты пламени может достигаться дроблением крупных огневых каналов на несколько мелких. Для одинаковых по составу газовоздушных смесей высота конусных фронтов пламени малых каналов h может быть приближенно определена по высоте фронта пламени одиночного канала Н:
h = Н/ √n(8.28)
где n — число малых каналов.
Для горелок с высокой тепловой мощностью (горелки промышленных котлов, печей и т.п.) горение, как правило, происходит в турбулентном потоке — гладкий конусный фронт пламени из-за вихревого движения и пульсаций размывается и теряет четкие конусные очертания. При этом наблюдаются два характерных вида горения, соответствующие мелкои крупномасштабной турбулентности.
При масштабах турбулентности, не превышающих толщину зоны ламинарного горения, конусный фронт пламени сохраняет свою форму и остается гладким, хотя зона горения увеличивается. Если же масштаб турбулентности превышает толщину зоны нормального горения, поверхность конусного фронта пламени становится неровной. Это ведет к увеличению суммарной поверхности фронта горения и сжиганию большего количества горючей смеси на единицу поперечного сечения потока.
При крупномасштабной турбулентности, значительно превышающей толщину зоны ламинарного горения, волнение поверхности фронта пламени приводит к отрыву отдельных частиц горячей смеси, дробящихся последующими пульсациями. Фронт пламени теряет свою целостность и превращается в систему отдельных очагов горения в виде равных, расчленяющихся и сгорающих в потоке частиц горючей смеси.
Рис. 8.4. Изменение относительной скорости
распространения пламени коксового газа
в смеси с воздухом в зависимости от числа
Рейнольдса и режима движения смеси
При крупномасштабной турбулентности поверхность фронта пламени, слагаясь из поверхностей всех горящих частиц, увеличивается, приводя к резкому росту скорости распространения пламени (рис. 8.4). В этом случае может происходить не только фронтовое горение, распространяющееся с нормальной скоростью vn, но и объемное, возникающее за счет турбулентных пульсаций раскаленных продуктов горения в свежую смесь. Следовательно, суммарная скорость распространения пламени при крупномасштабной турбулентности определяется тем или иным сочетанием элементов фронтового и объемного горения.
При отсутствии пульсаций турбулентная скорость горения становится равной нормальной скорости распространения пламени. Наоборот, если пульсационная скорость значительно превышает нормальную, турбулентная скорость горения становится мало зависящей от физико-химических свойств горючей смеси. Эксперименты показали малую зависимость скорости сгорания различных гомогенных газовоздушных смесей с α>1 в промышленных топках от нормальной скорости распространения пламени.
8.8. УСТОЙЧИВОСТЬ ГОРЕНИЯ
Рис. 8.5. Схема прямой компенсации
uн=wпот при ламинарном движении
газовоздушной смеси
1 – стенка горелки;
2 – фронт пламени
Основные факторы, влияющие на устойчивость горения, — скорости истечения газовоздушной смеси и распространения пламени. При горении газовоздушных смесей в ламинарном потоке устойчивой частью конусного фронта пламени является его нижняя часть. В этом месте фронт пламени за счет расширения вытекающей в атмосферу газовоздушной смеси и тормозящего действия стенки канала развернут на горизонталь и приподнят над кромкой канала на толщину фронта пламени (рис. 8.5).
На данном участке фронта происходит полная компенсация скорости газовоздушного потока скоростью распространения пламени uн = wпот. На всем остальном конусном участке фронта пламени компенсация имеет частичный характер и осуществляется только в направлении, нормальном к фронту горения: uн = wпот cosφ. Cоставляющая wпот sinφ остается неуравновешенной и сносит точку воспламенения от основания конуса к его вершине. Cтабильность конусного фронта пламени объясняется тем, кольцевой пояс у основания служит источником зажигания, без которого остальная часть фронта была бы снесена потоком газовоздушной смеси.
Если скорость истечения смеси превышает скорость распространения пламени, ширина зажигающего пояска уменьшается, пока не станет ничтожно малой. В этом случае устойчивость фронта пламени нарушается, и происходит отрыв от горелки. Если же скорость распространения пламени в кольцевой пристенной области (не на стенке) превысит скорость истечения газовоздушной смеси, пламя втягивается внутрь смесителя горелки (проскок).
При отрыве наблюдаются:
- срыв пламени с горелки и его погасание;
- отрыв от кромки огневого канала, когда пламя достигает нового достаточно устойчивого положения в потоке над горелкой;
- срыв поднятого пламени и его погасание;
- отброс приподнятого факела к кромке огневого канала горелки;
- создание взвешенного пламени при поджигании струи на некотором расстоянии от горелки.
Все эти явления недопустимы, так как приводят к накоплению в окружающей атмосфере или в топке несгоревшего газа.
Рис. 8.6. Зависимость скорости отрыва одиночного
пламени в открытой атмосфере смесей природного
газа с воздухом от размера огневого канала и
содержания первичного воздуха.
а – схема горелки; б – кривые отрыва пламени
Рис. 8.7. Зависимость скорости отрыва
многофакельного пламени в открытой атмосфере
смесей природного газа с воздухом от размера
огневого канала и содержания первичного воздуха.
а – схема горелки; б – кривые отрыва пламени
На рис. 8.6 показаны экспериментальные кривые отрыва пламени от кромок огневых каналов инжекционных однофакельных горелок, работающих на смеси холодного газа с воздухом. На границе и выше указанных кривых начинается отрыв пламени, а ниже кривых — устойчивое горение.
В практике широко распространены многофакельные инжекционные горелки с огневыми каналами диаметром 2–6 мм (рис. 8.7). Установление скоростей отрыва пламени wотр для таких горелок может производиться по следующей формуле:
wотр = 3,5•10-3 dkT2 (1 + Vт)/(1 + α1Vт)(8.29)
где dk — диаметр огневых каналов, м; α1 — коэффициент избытка первичного воздуха; T — абсолютная температура газовоздушной смеси, К.
По формуле видно, что стабильность горения растет с увеличением диаметров огневых каналов и температуры и снижается с увеличением коэффициента избытка первичного воздуха. Стабильность горения повышается также за счет взаимного влияния пламени.
Отрыв пламени от огневых каналов может происходить и в силу других причин. При неправильном расположении горелки и каналов отвода продуктов сгорания они могут попасть в инжектор горелки и привести к отрыву пламени (за счет снижения скорости распространения пламени в газовоздушной смеси, разбавленной инертными газами). Также причиной отрыва может быть высокая скорость вторичного воздуха, сдувающего пламя с огневых каналов.
Таблица 8.15. Скорость гомогенной смеси природного
газа с воздухом, при которой происходит проскок
пламени, м/с (температура смеси 20°С)
| Диаметры огневых каналов |
Коэффициент избытка первичного воздуха | |||||
|---|---|---|---|---|---|---|
| 0,6 | 0,7 | 0,8 | 0,9 | 1,0 | 1,1 | |
| 3,5 | 0,05 | 0,10 | 0,18 | 0,22 | 0,23 | 0,21 |
| 4,0 | 0,08 | 0,12 | 0,22 | 0,25 | 0,26 | 0,20 |
| 5,0 | 0,09 | 0,16 | 0,27 | 0,31 | 0,31 | 2,23 |
| 6,0 | 0,11 | 0,18 | 0,32 | 0,38 | 0,39 | 0,26 |
| 7,0 | 0,13 | 0,22 | 0,38 | 0,44 | 0,45 | 0,30 |
| 8,0 | 0,15 | 0,25 | 0,43 | 0,50 | 0,52 | 0,35 |
| 9,0 | 0,17 | 0,28 | 0,48 | 0,57 | 0,58 | 0,39 |
| 10,0 | 0,20 | 0,30 | 0,54 | 0,64 | 0,65 | 0,43 |
Недопустим также и проскок пламени внутрь смесителя горелки, обычно сопровождающийся хлопком. Проскок приводит либо к погасанию пламени и выбросу несгоревшей смеси в помещение или топку, либо к горению смеси внутри горелки. Тенденция пламени к проскоку зависит от вида газа, нормальной скорости распространения пламени, содержания первично го воздуха в газовоздушной смеси, размеров огневых каналов, температур смеси или стенок каналов. Влияние на проскок пламени оказывают также коэффициент теплопроводности материалов, из которых выполнены огневые каналы, их форма, глубина и качество изготовления, наличие заусениц, обломов краев и т. п.
Приведенные в табл. 8.15 значения скоростей гомогенных смесей природных газов с воздухом, при которых происходит проскок, можно использовать и для других газов с учетом поправок:
w’пр = wпр u’н/uн(8.30)
где w‘пр — скорость проскока пламени для другого газа, м/с; wпр — скорость проскока для природного газа (по табл. 8.15), м/с; u‘н — нормальная скорость распространения пламени для другого газа, м/с; uн — скорость распространения пламени в метане, м/с.
Максимальная же скорость проскока может быть рассчитана по приближенной формуле:
wпр = 0,73•10-3dkT2(8.31)
Этой же формулой с достаточным для практики приближением можно руководствоваться и для других газов с введением поправки на изменение нормальной скорости pacпpocтранения пламени. На основании многочисленных экспериментов можно сделать следующий вывод: пределы устойчивой работы горелок ограничены скоростями отрыва и проскока пламени.
Рис. 8.8. Зависимость скорости газовоздушной смеси, при которой происходит отрыв и проскок пламени, от коэффициента избытка первичного воздуха
I – отрыв пламени; II – проскок пламени; III – желтые края пламени;
1–3 диаметры огневых каналов горелок, мм: 1 – 25, 2 – 25, 3 – 32
На рис. 8.8 приведены кривые, характеризующие скорости потока смеси природного газа с воздухом, при которых происходят отрыв и проскок пламени. Характер кривых свидетельствует о резком снижении устойчивости пламени по мере увеличения содержания в смеси первичного воздуха. Повышение устойчивости пламени происходит при снижении содержания первичного воздуха и достигает максимума при его уменьшении до нуля (диффузионное горение). Однако такое сжигание углеводородных газов во многих случаях недопустимо, так как приводит к появлению желтых язычков пламени, характеризующих появление в нем сажистых частиц.
Рис. 8.9. Распространенные стабилизаторы горения
а – цилиндрический туннель с внезапным расширением сечения;
б – то же, при закрученом потоке;
в – конический туннель при закрученном потоке;
г – стабилизатор в виде конического тела;
д – то же, в виде круглого стержня;
е – то же, в виде устойчивого кольцевого пламени
1 – огневой насадок горелки; 2 – туннель; 3 – боковое отверстие;
4 – кольцевой канал; 5 – кольцевое пламя;
6 – пламя основного потока газовоздушной смеси
В практике для расширения диапазона устойчивости горения любых горючих газовоздушных смесей скорость потока принимается в несколько раз большей, чем скорость отрыва. Предотвращение отрыва пламени достигается применением стабилизаторов горения (рис. 8.9).
Для стабилизации пламени инжекционных и других горелок, выдающих осесимметричные газовоздушные струи, применяются огнеупорные цилиндрические туннели с внезапным расширением их сечения. Действие такого туннеля основано на периферийной циркуляции части раскаленных продуктов горения, возникающей за счет создаваемого струей разрежения.
Для стабилизации пламени горелок, выдающих закрученную газовоздушную смесь, применяются как цилиндрические, так и конические туннели с углом раскрытия 30–60°. При закрученном потоке на периферии туннеля возникает большее давление, чем в его центральной части. Это приводит к приосевой рециркуляции части раскаленных продуктов горения и поджиганию втекающей в туннель холодной газовоздушной смеси изнутри.
Когда установка туннелей невозможна, для стабилизации пламени применяют тела плохо обтекаемой формы, размещаемые в потоке газовоздушной смеси на выходе ее из огневого канала горелки. Воспламенение смеси при этом происходит на периферии стабилизатора, за которым возникает частичная рециркуляция раскаленных газов, поджигающих горючую смесь изнутри. Стабилизирующее действие таких устройств ниже, чем туннелей.
В инжекционных однои многофакельных горелках широко используются стабилизаторы горения в виде специальной огневой насадки. Стабилизирующее действие этого устройства основано на предотвращении разбавления основного потока в корне факела избыточным воздухом, сужающим пределы его устойчивости, а также на подогреве и поджигании кольцевым пламенем основного потока по всей его периферии. Устойчивость кольцевого пламени при отрыве достигается за счет такого соотношения сечений огневого кольца и боковых отверстий, при котором скорость газовоздушной смеси в кольцевой полости не превышает нормальной скорости распространения пламени. Для предотвращения проскока пламени в смеситель горелки размеры боковых отверстий, формирующих кольцевое пламя, принимаются меньшими критических.
8.9. СХЕМЫ ОГНЕПРЕГРАДИТЕЛЕЙ
Воздух или кислород, попав в газопровод, может образовать взрывчатую смесь, поэтому необходимо обязательно предохранять трубопроводы от проникновения в него воздуха или кислорода. На всех взрывоопасных производствах должны быть созданы условия, исключающие возможность возникновения поджигающих импульсов. Источниками воспламенения, приводящими газовоздушные смеси к взрыву, являются:
- открытое пламя;
- электрические разряды действующего электрооборудования;
- короткое замыкание в электрических проводах;
- искрение в электрических приборах;
- перегорание открытых предохранителей;
- разряды статического электричества.
Взрывобезопасность обеспечивается различными огнепреградителями. устанавливаемыми в трубопроводах, на резервуарах, на продувочных газопроводах, свечах и других системах, где существует опасность взрыва.
Погасание пламени в канале, заполненном горючей смесью, происходит лишь при минимальном диаметре канала, зависящем от химического состава и давления смеси, и объясняется потерями теплоты из зоны реакции к стенкам канала. При уменьшении диаметра канала увеличивается его поверхность на единицу массы реагирующей смеси, т.е. возрастают теплопотери. Когда они достигают критического значения, скорость реакции горения уменьшается настолько, что дальнейшее распространение пламени становится невозможным.
Пламегасящая способность огнепреградителя зависит в основном от диаметра гасящих каналов и гораздо меньше — от их длины, а возможность проникновения пламени через гасящие каналы зависит в основном от свойств и состава горючей смеси и давления. Нормальная скорость распространения пламени является основной величиной, определяющей размер гасящих каналов и выбор типа огнепреградителя: чем она больше, тем меньшего размера канал требуется для гашения пламени. Также размеры гасящих каналов зависят от начального давления горючей смеси. Для оценки пламегасящей способности огнепреградителей применяется т.н. критерий Пекле Ре:
Ре = wcmdcpp/(RT0λ0)(8.32)
В пределе гашения пламени формула критерий Пекле принимает вид:
Рекр = wсмdкрcppкр/(RT0λ0)(8.33)
где wсм— нормальная скорость распространения пламени; d — диаметр гасящего канала; dкp — критический диаметр гасящего канала; ср — удельная теплоемкость газа при 0°С и постоянном давлении; р — давление газа; ркр — критическое давление газа; R — универсальная газовая постоянная; Т0 — абсолютная температура газа; λ0 — теплопроводность исходной смеси.
Таким образом, для расчета пламегасящей способности огнепреградителей необходимы следующие исходные данные:
- нормальные скорости распространения пламени горючих газовых смесей;
- фактический размер максимальных гасящих каналов данного огнепреградителя.
Если полученное значение больше Рекр = 65, огнепреградитель не задержит распространения пламени данной горючей смеси, и наоборот, если Ре< 65, огнепреградитель задержит распространение пламени. Запас надежности огнепреградителя, который находят из отношения Рекр к вычисленному значению Ре, должен составлять не менее 2:
П = Рекр/Ре = 65/Ре > 2,0(8.34)
Использовав факт постоянства Рекр на пределе гашения пламени, можно вычислить ориентировочный критический диаметр каналов для любой горючей смеси, если известны скорость распространения пламени, а также теплоемкость и теплопроводность газовой системы. Рекомендуются следующие критические диаметры гасящего канала, мм:
- при сжигании газовоздушной смеси — 2,9 для метана и 2,2 для пропана и этана;
- при сжигании кислородных смесей в трубах (при абсолютном давлении 0,1 МПа в условиях свободного расширения продуктов сгорания) — 1,66 для метана и 0,39 для пропана и этана.
Рис. 8.10. Типы огнепреградителей:
а – насадочный; б – кассетный; в – пластинчатый; г – сетчатый; д – металлокерамический
Конструктивно огнепреградители делятся на четыре типа (рис. 8.10):
- с насадкой из гранулированных материалов;
- с прямыми каналами;
- из металлокерамики или металловолокна;
- сетчатые.
По способу установки — на три типа: на трубах для выброса газов в атмосферу или на факел; на коммуникациях; перед газогорелочными устройствами.
В корпусе насадочного огнепреградителя между решетками находится насадка с наполнителем (стеклянные или фарфоровые шарики, гравий, корунд и другие гранулы из прочного материала). Кассетный огнепреградитель представляет собой корпус, в который вмонтирована огнепреграждающая кассета из гофрированной и плоской металлических лент, плотно свитых в рулон. В корпусе пластинчатого огнепреградителя — пакет из плоскопараллельных металлических пластин со строго определенным расстоянием между ними. У сетчатого огнепреградителя в корпусе размещен пакет из плотно сжатых металлических сеток. Металлокерамический огнепреградитель представляет собой корпус, внутри которого установлена пористая металлокерамическая пластина в виде плоского диска или трубки.
Чаще всего применяются сетчатые огнепреградители (их начали устанавливать еще в начале XIX века в шахтерских лампах (лампах Деви) для предотвращения взрывов рудничного газа). Эти огнепреградители рекомендуются для защиты установок, в которых сжигается газовое топливо. Огнепреграждающий элемент состоит из нескольких слоев латунной сетки с размером ячеек 0,25 мм, зажатых между двумя перфорированными пластинами. Пакет сеток укреплен в съемной обойме.
Корпус огнепреградителя изготовлен из чугунного или алюминиевого сплава и состоит из двух одинаковых частей, соединенных болтами с расположенной между ними съемной обоймой. Кроме рассмотренных сухих огнепреградителей, широко применяются жидкостные предохранительные затворы, предохраняющие газопроводы от попадания взрывной волны и пламени при газопламенной обработке металлов, а также трубопроводы и аппараты, заполненные газом, от проникновения в них кислорода и воздуха.
Жидкостные затворы должны:
- препятствовать распространению взрывной волны при обратных ударах и при воспламенении газов;
- предохранять газопровод от попадания в него кислорода и воздуха;
- обеспечивать минимальное гидравлическое сопротивление прохождению потока газа. Кроме того, жидкость из затвора не должна уноситься в виде капель в заметных количествах.
8.10. ПРИНЦИПЫ СЖИГАНИЯ
В основе процессов сжигания газа — принципы, условно называемые кинетическим и диффузионным. При к и н е т и ч е с к о м принципе до начала горения создается однородная смесь с некоторым избытком воздуха. Сгорание такой смеси происходит в коротком прозрачном факеле без образования в пламени частиц сажи. Для сжигания газа по кинетическому принципу применяются специальные смесители или инжекционные горелки, подготавливающие гомогенную газовоздушную смесь с коэффициентом избытка первичного воздуха α1 = 1,02:1,05.
При меньшем содержании первичного воздуха по кинетическому принципу протекает только начальная стадия горения, до использования кислорода, находящегося в смеси с газом. Оставшиеся газы и продукты неполного сгорания сжигают за счет внешней диффузии кислорода (вторичного воздуха), т.е. по д и ф ф у з и о н н о м у принципу. При α1 < 1 у факела есть два видимых фронта горения: внутренний, возникающий за счет первичного воздуха, и наружный, образующийся за счет диффузии кислорода из окружающей среды. Общая высота пламени при таком горении возрастает, а температура — несколько снижается. Устойчивость пламени и его прозрачность зависят от содержания первичного воздуха в смеси: чем оно выше, тем ниже устойчивость пламени, больше его прозрачность, и наоборот.
Принцип сжигания газа с α1 < 1,0 является п р о м е ж у т о ч н ы м (между кинетическим и диффузионным). С учетом этого принципа конструируются все газовые аппараты с инжекционными горелками. В таких горелках содержание первичного воздуха в смеси принимается в зависимости от вида газа таким, чтобы:
- в пламени отсутствовали сажистые частицы;
- обеспечивалась стабильность горения при изменений тепловой мощности в любых необходимых в практике пределах.
При диффузионном принципе (α1 = 0) процессы горения и смешения развиваются параллельно. Так как процессы смешения протекают значительно медленнее процессов горения, то скорость и полнота сгорания определяются скоростью и полнотой смешения газа и воздуха. Смешение газа с воздухом при этом может происходить путем диффузии (либо медленной молекулярной, либо турбулентной, включающей в себя и молекулярную как конечную стадию). Соответственно этому различаются скорость горения и структура диффузионного пламени.
Особенности такого сжигания:
- устойчивость пламени при изменении тепловой мощности от нуля до максимально возможных по условиям отрыва;
- постоянство температур по всей высоте пламени;
- возможность распределения его по большим произвольным поверхностям;
- компактность горелок и простота их изготовления;
- значительная высота пламени и неизбежность пиролитических процессов, приводящих к образованию яркого сажистого пламени.
Рис. 8.11. Структура свободных пламен:
а – ламинарное пламя; б – турбулентное пламя
Диффузионное горение может быть переведено в кинетическое или промежуточное, если смешение будет опережать процессы горения. На практике этого можно добиться принудительной подачей воздуха, приводящей к образованию квазигомогенной газовоздушной смеси с α1 > 1,0, сгорающей в прозрачном факеле.
Для иллюстрации принципов сжигания на рис. 8.11. приведены схемы свободных факелов: ламинарного и турбулентного. Ламинарный факел возникает за счет взаимной молекулярной диффузии газа и воздуха. Внутри конусного ядра 1 — чистый газ, вытекающий из трубки при ламинарном режиме течения. В зоне 2 — смесь из газа и продуктов сгорания, в зоне 3 — смесь из продуктов сгорания и воздуха. Граница 4 представляет собой гладкий конусный фронт пламени, к которому снаружи диффундируют молекулы воздуха, а изнутри — молекулы газа. Продукты сгорания частично диффундируют навстречу газу, интенсивно нагревая его в предпламенной зоне. Это приводит к пиролизу углеводородов и образованию сажистых частиц, придающих пламени яркую светимость.
Интенсифицировать горение можно за счет турбулизации смешивающихся потоков. У турбулентного факела нет четкого конусного фронта горения, он «размыт» и раздроблен пульсациями на отдельные частицы.
Структура пламени состоит из ядра чистого газа 1, зоны сравнительно медленного горения 2, размытой зоны наиболее интенсивного горения 3 с высоким содержанием продуктов сгорания и зоны горения 4 с преобладанием в ней воздуха. Четко выраженных границ между зонами нет, они непрерывно смещаются в зависимости от степени турбулизации потока. Особенностями турбулентного факела являются:
- протекание процесса горения почти по всему объему;
- повышение интенсивности горения;
- большая прозрачность пламени;
- меньшая его устойчивость по отношению к отрыву.
Турбулентное сжигание газа широко используется в топках различных котлов и печей. Для интенсификации процесса горения применяют как естественную (за счет повышения скоростей), так и искусственную, турбулизацию потоков, например, закруткой воздушного потока и подачей в него под различными углами тонких струй газа.
8.11. УСЛОВИЯ ОБРАЗОВАНИЯ ПРОДУКТОВ НЕПОЛНОГО СГОРАНИЯ И СНИЖЕНИЕ В НИХ КОНЦЕНТРАЦИИ ВРЕДНЫХ ВЕЩЕСТВ
При сжигании горючих газов в продуктах сгорания могут содержаться компоненты как полного (диоксид углерода и водяной пар), так и неполного сгорания (оксид углерода, водород, ненасыщенные, насыщенные, ароматические углеводороды и сажистые частицы). Кроме того, в продуктах сгорания всегда обнаруживаются и оксиды азота. Наличие продуктов неполного сгорания в значительных концентрациях недопустимо, так как приводит к загрязнению атмосферы токсическими веществами и к снижению КПД установок, работающих на газовом топливе.
Основные причины их большого содержания:
- сжигание газов с недостаточным количеством воздуха;
- плохое смешение горючих газов и воздуха до и в процессе горения;
- чрезмерное охлаждение пламени до завершения реакций горения.
Для метана реакции горения (в зависимости от концентрации кислорода в реагирующей смеси) могут быть описаны следующими уравнениями:
СН4 + 2О2 = СО2 + 2Н2О + 800,9 МДж/моль
при стехиометрическом соотношении или при избытке окислителя;
СН4 + О2 = СО + Н2 + Н2О + Q и СН4 + 0,5О2 = СО + 2Н2О + Q
при недостатке окислителя.
Рис. 8.12. Промежуточные продукты сгорания
Рис. 8.13. Содержание первичного воздуха,
при котором предотвращается образование
желтых языков в пламени
Газ: 1 – коксовый;
2 – природный газовых месторождений;
3 – нефтяных месторождений;
4 – пропан; 5 – бутан
На рис. 8.12 показан приближенный усредненный состав некоторых промежуточных соединений — водорода, оксида углерода, этилена, ацетилена и сравнительно небольшое число насыщенных и простейших ароматических соединений — и диоксида углерода, возникающих в пламени при диффузионном горении природного газа (97%). Сжигание газа производилось в ламинарном факеле, газ вытекал из трубки диаметром 12 мм. Общая высота пламени 130–140 мм.
Максимальная концентрация водорода и ацетилена достигается примерно на одной высоте пламени, они исчезают почти одновременно в вершине светящейся зоны пламени. Из всех образующихся в пламени промежуточных соединений (исключая сажистые частицы) оксид углерода исчезает последним. Это дает основание судить по его индексу о полноте сгорания газа. В продуктах сгорания всегда присутствуют оксиды азота, максимальная концентрация которых возникает в зонах интенсивного выгорания оксида углерода и водорода.
Горение углеводородных газов с недостатком окислителя приводит к образованию частиц сажи, придающих пламени желтую окраску. Процесс выгорания сажи протекает стадийно и сравнительно медленно. Иногда выгорание образовавшихся частиц сажи затягивается и может прекратиться полностью при входе в низкотемпературную область факела или при омывании пламенем теплообменных поверхностей. Таким образом, наличие светящегося пламени всегда свидетельствует о протекании пиролитических процессов и о возможности химической неполноты сгорания, в особенности в малогабаритных экранированных топках котлов.
Предотвращение образования сажистых частиц достигается предварительным смешением углеводородных газов с достаточным количеством окислителя. Содержание первичного воздуха в смеси, при котором возникает прозрачное пламя, зависит не только от вида углеводородов, но и от условий смешения с вторичным воздухом (диаметра огневых каналов горелок) (рис. 8.13). На границе и выше кривых пламя прозрачно, а ниже кривых имеет желтые язычки. Кривые показывают, что содержание первичного воздуха в смеси возрастает при увеличении числа углеродных атомов в молекуле и диаметра огневых каналов горелок. Коэффициент избытка первичного воздуха α1 в смеси, при котором исчезают желтые язычки пламени, в зависимости от указанных факторов может быть определен для малых огневых каналов горелок:
α1 = 0,12 (m + n/4)0,5 (dk/d0)0,25(8.35)
где m и n — число углеродных и водородных атомов в молекуле или среднее их число для сложного газа; dk — диаметр огневых каналов горелки, мм; d0 — эталонный диаметр канала горелки (1 мм).
Обеспечение полноты сгорания в практических условиях — задача достаточно сложная, зависящая не только от принципа сжигания газа, но и от условий развития пламени в топочном объеме. Наиболее высокие требования по полноте сгорания предъявляются к бытовым аппаратам и другим установкам, сбрасывающим продукты сгорания в атмосферу. Сгорание газа в таких установках является наиболее трудным, так как связано с омыванием пламенем холодных теплообменных поверхностей. Для сжигания газа в бытовых плитах применяют инжекционные многофакельные горелки, образующие гомогенную смесь с коэффициентом избытка первичного воздуха α1 < 1. Недостающий для сгорания газа воздух поступает за счет диффузии из окружающей атмосферы.
Рис. 8.14. Концентрация оксида углерода
в продуктах сгорания в газовой плите
а – горелка с периферийной подачей вторичного воздуха;
б – с центральной и периферийной подачей вторичного воздуха
1 – природный газ, горелка с периферийным подводом
вторичного воздуха, расстояние до дна посуды 25 мм;
2–4 – природный газ, горелка с перифейрийным и
центральным подводом вторичного воздуха, расстояние
до дна посуды, мм: 2 – 25, 3 – 18, 4 – 10;
5 – сжиженный газ, горелка с центральным и периферийным
подводом вторичного воздуха, расстояние до дна посуды 25 мм;
6 – сжиженный газ, горелка с периферийным подводом
На рис. 8.14 приведены схемы 2-конфорочных горелок для бытовых газовых плит и усредненная концентрация оксида углерода СО в продуктах сгорания природного метана (95 об. %) и пропана (93 об. %) при работе горелок с номинальной тепловой мощностью. Различие горелок заключается в том, что к одной из них вторичный воздух подводится только с периферии, а к другой — как с периферии, так и из центрального канала.
Полнота сгорания газа зависит от коэффициента избытка первичного воздуха в смеси, расстояния от огневых каналов горелки до дна посуды, вида горючего газа, способа подвода вторичного воздуха. При этом увеличение содержания первичного воздуха в смеси, а также увеличение расстояния от горелки до дна посуды приводят к снижению концентрации оксида углерода в продуктах сгорания. Минимальная концентрация оксида углерода соответствует коэффициенту избытка первичного воздуха α1 = 0,6 и выше и расстоянию от горелки до дна посуды 25 мм, а максимальная — α1 = 0,3 и ниже и расстоянию от горелки до дна посуды 10 мм. Кроме того, увеличение тепловой мощности горелок на 15–20% за счет повышения давления газа приводит к росту концентрации оксида углерода в продук тах сгорания в 1,2–1,3 раза, а за счет теплоты сгорания газа — в 1,5–2 раза.
На появление в процессе горения ароматических соединений — бензола, полициклических бензпирена, безантрацена и др. — следует обратить особое внимание, так как некоторые из них канцерогенны. Процесс их образования весьма сложен и протекает стадийно. На первом этапе появляется ацетилен и его производные. В пламенной зоне эти вещества претерпевают процессы удлинения цепи с перестройкой тройных углеродных связей на двойные. В результате циклизации и дегидратации приводят к появлению различных ароматических соединений, включая полициклические.
Таблица 8.16. Средняя концентрация в продуктах сгорания оксида углерода и бенз(а)пирена в зависимости от вида газа, типа горелки и коэффициента избытка первичного воздуха (тепловая нагрузка горелки — 1600 ккал/ч, расстояние от горелки до дна посуды — 24–26 мм)
| Тип горелки | Средняя концентрация | |
|---|---|---|
| оксида углерода, мг/л (в пересчете на α = 1,0) |
бенз(а)пирена, мкг/100 м3 |
|
| Природный газ | ||
| Горелка с периферийным подводом вторичного воздуха: | ||
|
при αi = 0,60 ÷ 0,70 |
0,10 | Не обнаружен |
|
при αi = 0,30 ÷ 0,35 |
1,20 | Следы |
| Горелка с центральным и периферийным подводом вторичного воздуха: | ||
|
при αi = 0,60 ÷ 0,70 |
0,50 | Не обнаружен |
|
при αi = 0,30 ÷ 0,35 |
0,12 | Не обнаружен |
| Сжиженный углеводородный газ | ||
| Горелка с периферийным подводом вторичного воздуха: | ||
|
при αi = 0,60 ÷ 0,70 |
0,30 | 0,03 |
|
при αi = 0,30 ÷ 0,35 |
1,20 | 1,10 |
| Горелка с центральным и периферийным подводом вторичного воздуха: | ||
|
при αi = 0,60 ÷ 0,70 |
0,07 | 0,02 |
|
при αi = 0,30 ÷ 0,35 |
1,00 | 0,045 |
Данные табл. 8.16 показывают, что при сжигании природных газов с коэффициентом избытка первичного воздуха α1 = 0,6 и выше на обоих типах горелок концентрация оксида углерода продуктах сгорания отвечает требованиям ГОСТ 5542–87.
Таблица 8.17. Расстояние между кромками огневых каналов инжекционных однорядных горелок в зависимости от их размеров и коэффициента избытка первичного воздуха
| Диаметры огневых каналов, мм | Расстояния между кромками каналов, мм при разных значениях коэффициента избытка первичного воздуха α1 | ||||
|---|---|---|---|---|---|
| 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | |
| 2,0 | 11 | 8 | 6 | 5 | 4 |
| 3,0 | 15 | 12 | 9 | 7 | 5 |
| 4,0 | 16 | 14 | 11 | 9 | 7 |
| 5,0 | 18 | 15 | 14 | 12 | 10 |
| 6,0 | 20 | 18 | 16 | 14 | 12 |
Исследования показали, что расстояния между кромками огневых каналов, обеспечивающие быстрое распространение пламени, предотвращающие их слияние, зависят от их размера и содержания первичного воздуха в смеси, уменьшаясь с его увеличением. Оптимальные расстояния между кромками каналов, обеспечивающие достаточную полноту сгорания газа и быстрое распространение пламени, приведены в табл. 8.17. При расположении огневых каналов в два ряда в шахматном порядке расстояния между кромками могут приниматься по этой же таблице. Расстояния между рядами при этом должны быть в 2–3 раза больше расстояний между каналами.
Рис. 8.15. Концентрация оксида углерода, ацетилена,
этана, этилена и бенз(а)пирена в продуктах сгорания
газа среднего давления в инжекционной горелке
Обобщение многочисленных экспериментальных данных позволило получить усредненные кривые концентрации в продуктах сгорания различных компонентов, качественно и количественно характеризующих процесс горения (рис. 8.15). Полное сгорание гомогенной газовоздушной смеси достигается только при коэффициенте избытка первичного воздуха α = 1,05 и выше. При уменьшении содержания воздуха в смеси, в особенности при α < 1,0, возрастает концентрация оксида углерода СО, ацетилена С2Н2, этилена С2Н4, пропилена С3Н6 и пропана С3Н8, а также бенз(а)-пирена С20Н9. Также возрастает концентрация и других компонентов — водорода, бензола и др.
Кроме рассмотренных продуктов незавершенного горения, при сжигании газа всегда возникает некоторое количество оксидов азота, образование которых происходит в зонах высоких температур как после завершения основных реакций горения, так и в процессе горения. Максимальная концентрация NOх возникает на конечных стадиях, соответствующих выгоранию газа и интенсивному горению промежуточных продуктов в виде водорода и оксида углерода.
Первичное соединение при горении газовоздушных смесей — оксид азота. Начало цепной реакции связано с атомарным кислородом, возникающим в зонах высоких температур за счет диссоциации молекулярного кислорода:
О2 –› 2О — 490 кДж/моль(8.36)
О + N2 –› NO + N — 300 кДж/моль(8.37)
N + О2 –› 2NO + 145 кДж/моль(8.38)
Балансовая реакция
N2 + О2 –› 2NO — 177 кДж/моль(8.39)
Образование атомарного кислорода происходит и при частичной диссоциации продуктов сгорания: при снижении температуры и наличии кислорода часть образовавшегося оксида азота (1–3 об. %) окисляется до диоксида азота NO2. Наиболее интенсивно реакция протекает после выхода оксида азота в атмосферу. Основные влияющие факторы:
- температура в реакционных зонах;
- коэффициент избытка воздуха и время контакта реагирующих компонентов.
Температура пламени зависит от химического состава газа, содержания воздуха в газовоздушной смеси, степени ее однородности и теплоотвода из реакционной зоны. Максимально возможная при данной температуре концентрация оксида азота, об. %, может быть подсчитана по формуле
NOp = 4,6е-2150/(RT)/√О2N2(8.40)
где NOp — равновесная концентрация оксида азота, об. %; R — универсальная газовая постоянная; Т — абсолютная температура, К; O2 и N2 — концентрация, об. %, соответственно кислорода и азота.
Высокая концентрация оксида азота, соизмеримая с равновесной, возникает при сжигании газа в топках мощных парогенераторов и в высокотемпературных мартеновских, коксовых и аналогичных печах. В котлах малой и средней мощности, в небольших нагревательных и термических печах со значительным теплоотводом и малым временем пребывания компонентов в высокотемпературных зонах выход оксида азота на порядок меньше. Кроме того, чем короче время пребывания реагирующих компонентов в зоне высоких температур, тем меньше оксида азота в продуктах сгорания.
Эффективно также сжигание газа в излучающих горелках и в псевдоожиженном слое: в этих случаях происходит микрофакельное горение гомогенной газовоздушной смеси с коэффициентом избытка воздуха α= 1,05 при весьма интенсивном отводе теплоты из реакционной зоны. Концентрация оксидов азота при сжигании газа в излучающих горелках составляет около 40, а в псевдоожиженном слое — 80–100 мг/м3. Уменьшение размеров огневых каналов излучающих горелок и огнеупорных зерен в псевдоожиженном слое способствует снижению выхода оксидов азота.
Накопленные данные позволили внести ряд изменений в конструкцию котельно-отопительного оборудования, обеспечивающих не только высокий КПД и низкую концентрацию продуктов неполного сгорания, но и сниженный сброс в атмосферу оксидов азота. К этим изменениям относятся:
- сокращение длины высокотемпературных туннелей и перемещение горения из них в топки;
- применение взамен керамических туннелей стабилизаторов горения в виде тел плохообтекаемой формы или кольцевого пламени;
- организация плоского факела пламени с увеличенной поверхностью теплоотдачи;
- рассредоточение пламени за счет увеличения числа горелок или использования блочных горелок;
- ступенчатый подвод воздуха в реакционную зону;
- равномерное распределение тепловых потоков в топке, экранирование топок и их разделение на отсеки экранами;
- применение диффузионного принципа сжигания газа (диффузионное горение допустимо только в тех случаях, когда может быть обеспечено свободное развитие пламени без омывания теплообменных поверхностей).
Наиболее эффективное снижение выхода оксидов азота достигается при одновременном использовании нескольких способов.
Теплотехника
Теплотехника — это наука о преобразовании энергии в различных процессах, происходящих с макроскопическими телами, и о наиболее общих физических свойствах макроскопических систем.
Если что-то непонятно — вы всегда можете написать мне в WhatsApp и я вам помогу!
Макроскопические тела (системы) — это тела (системы), состоящие из очень большого количества микрочастиц (атомов или молекул). Однако поведение большого количества микрочастиц отличается от поведения каждой отдельной частицы.
Энергия является общим мерилом различных форм движения материи. В то же время, различные формы движения, присущие материальному телу (или системе тел), характеризуются различными видами энергии — механической, тепловой, электрической, химической, магнитной и т. д. — которые являются частью материального тела. При взаимодействии тел происходит как исчезновение той или иной формы энергии (формы движения), так и появление новых форм движения (форм энергии). Опыт показывает, что соотношение числа взаимно преобразованных типов энергии (форм движения, каждая из которых выражается в своих единицах) всегда остается неизменным. Именно этот факт привел к появлению понятия энергии как общей количественной меры движения материи.
Решение задач на тему: Состав топлива
Твердые и жидкие топлива состоят из горючих (углерода — С, водорода — Н, летучей серы — 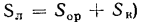
Газообразные топлива состоят из горючих 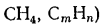
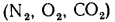
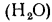
Возможно эта страница вам будет полезна:
При изучении характеристик твердых и жидких топлив и их состава различают рабочую, горючую и сухую массу. Состав рабочей, горючей и сухой массы обозначается соответственно индексами «р», «г» и «с» и выражается следующими равенствами:
В формулах (1.1), (1.2), (1.3) содержание элементов дано в процентах на 1 кг топлива. Коэффициенты пересчета состава топлива из одной массы в другую приведены в табл. 1.1.
Для сланцев состава 
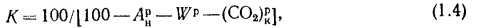
где 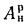
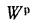
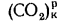
Истинная зольность рабочей массы определяется по формуле
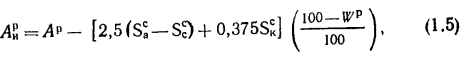

где 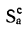
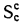
Величина 12,5 (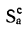
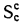
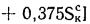
Пересчет состава (%) рабочей массы топлива при изменении влажности производится по формулам

где 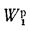
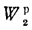
Средний состав (%) смеси двух твердых или жидких топлив, заданных массовыми долями, — первого 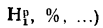
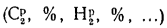
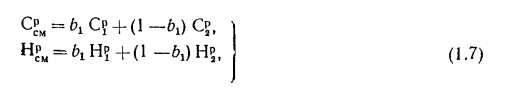
где массовая доля 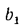

Здесь 
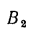
Задача №1
Определить состав рабочей массы челябинского угля марки БЗ, если состав его горючей массы: 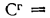
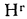
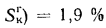
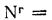
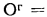
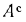
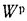
Решение: Пользуясь коэффициентами пересчета из табл. 1.1, определяем зольность рабочей массы топлива
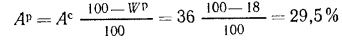
и находим состав рабочей массы топлива:

Для проверки точности вычислений найдем сумму составляющих элементов рабочей массы топлива:
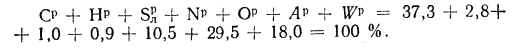
Решение задач на тему: Характеристики топлива
Теплота сгорания топлива. Теплотой сгорания топлива называют количество теплоты в кДж, выделяемой при полном сгорании 1 кг твердого (жидкого) или 1 
Для твердого и жидкого топлива различают теплоту его рания высшую 
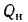
Величины высшей и низшей теплоты сгорания рабочей, горючей и сухой массы твердого (жидкого) топлива связаны выражениями:
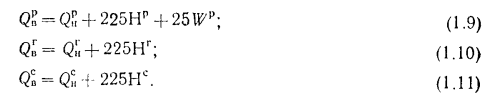
Тепловые расчеты котлов выполняют, пользуясь низшей теплотой сгорания рабочей массы топлива:
- низшая теплота сгорания (кДж/кг) рабочей массы твердого и жидкого топлива
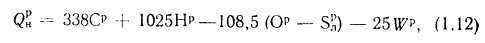
где 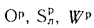
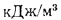
где 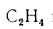
При пересчете низшей теплоты сгорания пользуются следующими формулами: с горючей массы на рабочую и обратно
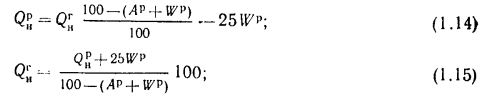
с сухой массы на рабочую и обратно
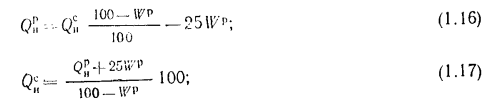
для горючих сланцев — с горючей массы на рабочую и обратно
при изменении влажности
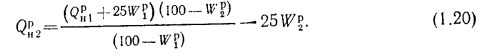
Для смеси двух твердых, жидких или газообразных топлив низшая теплота сгорания определяется по формуле
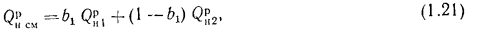
где 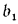
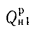
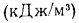
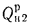
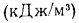
Для сравнения тепловой ценности различных видов топлива пользуются понятием условного топлива.
Условным топливом называют такое топливо, теплота сгорания которого равна 29 300 кДж/кг.
Пересчет расхода натурального топлива на условное осуществляется по формуле

где 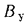
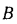

Зольность, влажность и сернистость топлива. При рассмотрении условий работы котлов на различных видах топлива пользуются приведенными величинами зольности 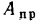
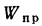
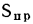

приведенная влажность топлива, (1.25)

приведенная сернистость топлива,

Задача №2
Определить низшую и высшую теплоту сгорания рабочей массы кузнецкого угля марки Д, если состав его горючей массы: 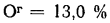
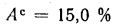
Решение: Пользуясь коэффициентами пересчета из табл. 1.1, определяем зольность рабочей массы топлива
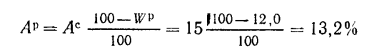
и состав рабочей массы:

Низшую теплоту сгорания рабочей массы топлива определяем по формуле (1 12):
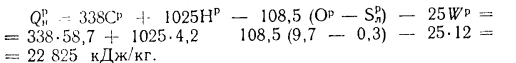
Высшую теплоту сгорания — по формуле (1.9):
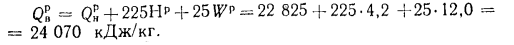
Задача №3
Определить низшую и высшую теплоту сгорания горючей массы высокосернистого мазута, если известны следующие величины: 
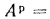
Решение: Содержание водорода в горючей массе определяем, пользуясь коэффициентом пересчета из табл.1.1:
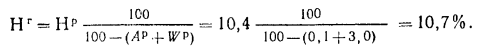
Низшую теплоту сгорания горючей массы топлива находим по формуле (1.15):
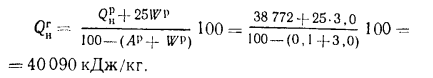
Высшую теплоту сгорания — по формуле (1.10):
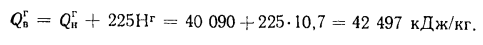
Решение задач на тему: Объем воздуха. Объем и масса продуктов сгорания
Объем воздуха, объем и масса продуктов сгорания определяются на 1 кг твердого, жидкого или на 1 
Объем воздуха, необходимый для сгорания топлива. Теоретический (при коэффициенте избытка воздуха в топке 
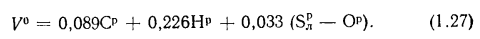
Теоретический объем воздуха 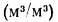
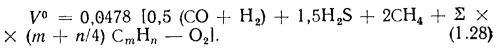
В формуле (1.27) содержание элементов топлива выражается в процентах на 1 кг массы топлива, а в (1.28) содержание горючих газов 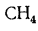
Для сгорания смеси двух твердых, жидких или газообразных топлив теоретический объем сухого воздуха определяется по формуле

где 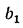
Действительный объем воздуха (

где 
Состав и объем продуктов сгорания топлива. При полном сгорании топлива продукты сгорания содержат газы: 
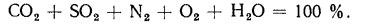
Полный объем продуктов сгорания 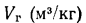

при этом
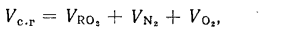
где 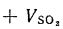
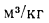
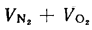
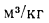
Для твердых (кроме сланцев) и жидких топлив теоретические объемы 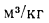

объем двухатомных газов

объем трехатомных газов
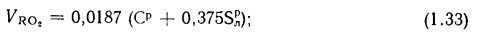
объем сухих газов
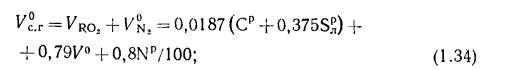
объем водяных паров
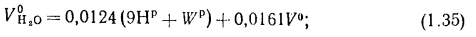
полный объем продуктов сгорания
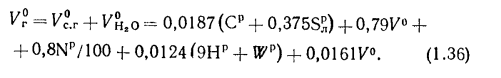
Для сланцев объем трехатомных газов определяется по формуле
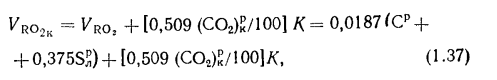
где К — коэффициент разложения карбонатов: при слоевом сжигании К = 0,7, при камерном — 1,0.
Для газообразного топлива теоретические объемы продуктов сгорания 

объем двухатомных газов

объем трехатомных газов
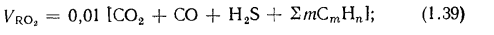
объем сухих газов

объем водяных паров
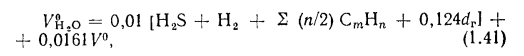
где 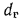
полный объем продуктов сгорания

Для твердых (кроме сланцев), жидких и газообразных топлив объемы продуктов полного сгорания (

объем сухих газов
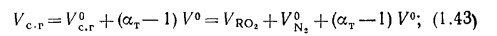
объем водяных паров

полный объем продуктов сгорания определяется по (1.31).
Для сланцев полный объем продуктов сгорания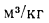

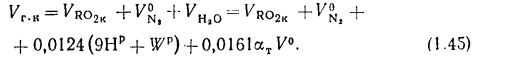
Содержание (%) 
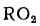

Максимальное содержание (%) трехатомных газов 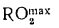

где 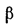
для твердого и жидкого
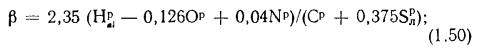
для газообразного
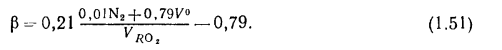
Содержание (%) азота 

Масса продуктов сгорания:
для твердого (кроме сланцев) и жидкого топлива (кг/кг)
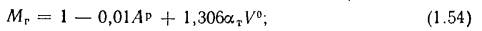
для газообразного топлива
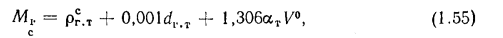
где 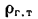
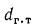
для сланцев (кг/кг)
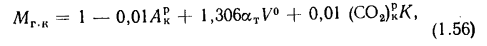
где 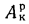
Расчетное содержание (%) золы в топливе с учетом неразложившихся карбонатов

Для твердых топлив концентрация золы в продуктах сгорания определяется по формуле

где 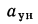
Коэффициент избытка воздуха в топке. При полном сгорании топлива коэффициент избытка воздуха в топке определяется по формуле

где 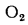
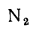
Возможно эта страница вам будет полезна:
Задача №4
Определить объем продуктов полного сгорания на выходе из топки, а также теоретический и действительный объемы воздуха, необходимые для сгорания 1 
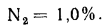

Решение: Теоретический объем воздуха, необходимый для полного сгорания 1 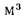
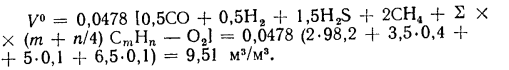
Действительный объем воздуха — по формуле (1.30):
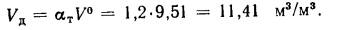
Объем сухих газов при 
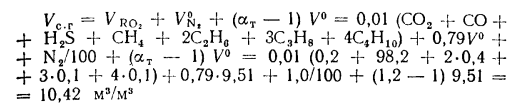
Объем водяных паров при 
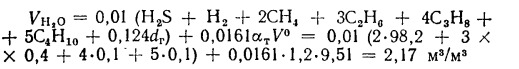
Объем продуктов полного сгорания — по формуле (1.31):
Задача №5
Определить на выходе из топки объем продуктов полного сгорания 1 кг карагандинского угля марки К состава: 

Решение: Теоретический объем воздуха, необходимый для полного сгорания 1 кг топлива, определяем по формуле (1.27):
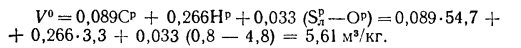
Объем сухих газов при 
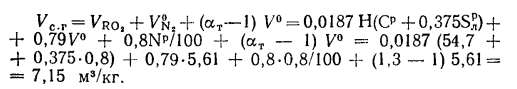
Объем водяных паров при 
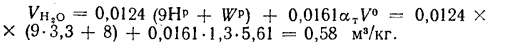
Объем продуктов полного сгорания находим по формуле (1.31):
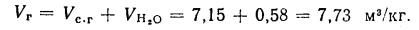
Примеры решения задач по всем темам теплотехники
Теплотехника — это наука, изучающая преобразование различных видов энергии друг в друга.
В настоящее время теплотехника разделена на три части:
- Общая термодинамика (физическая) — изучает преобразование энергии в твердые, жидкие и газообразные тела, излучение различных тел, магнитные и электрические явления, а также устанавливает математическую связь между термодинамическими значениями.
- Химическая термодинамика — исследования, основанные на законах общей термодинамики, химических, тепловых, физических и химических процессов, равновесия и влияния внешних факторов на равновесие.
- Техническая термодинамика — изучение закономерностей преобразования тепла в работу.
Энтальпия продуктов сгорания (
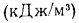
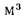

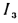
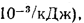
Энтальпия продуктов сгорания (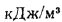
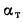
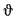
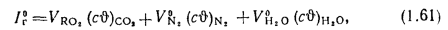
где 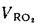
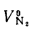
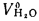
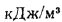
Энтальпия воздуха (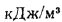
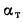

где 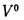
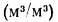
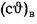
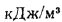

где 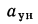
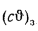
Значения энтальпий продуктов полного сгорания топлива, воздуха и золы приведены в табл. 1 (см. Приложение}.
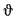
Задача №1
Определить энтальпию продуктов сгорания на выходе из топки, получаемых при полном сгорании 1 кг карагандинского угля марки К состава:
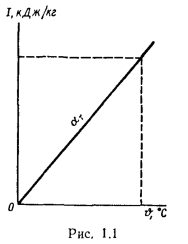
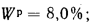
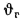
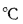
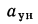
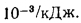
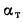
Решение: Теоретически необходимый объем воздуха определяем но формуле (1.27):
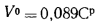
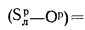
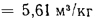
Объем трехатомных газов находим по формуле (1.33):
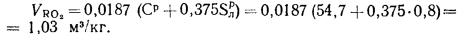
Теоретический объем азота определяем по формуле (1.32):
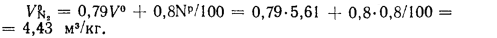
Теоретический объем водяных паров находим по формуле (1.35):
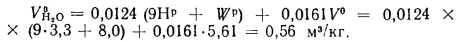
Энтальпию продуктов сгорания при 
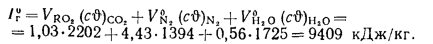
Значения 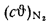
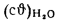
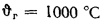
Энтальпию золы 1 кг угля при 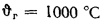
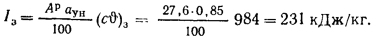
Значение 
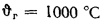
Энтальпию воздуха при 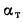
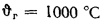
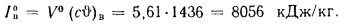
Значение 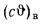
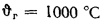
Энтальпию продуктов полного сгорания 1 кг угля при 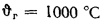
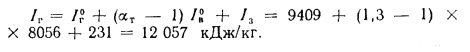
Задача №2
В топке котла сжигается 1 кг карагандинского угля марки К состава: 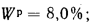
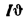
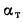
Решение: Теоретически необходимый объем воздуха определяем по формуле (1.27):
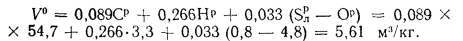
Объем трехатомных газов находим по формуле (1.33):
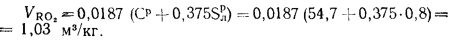
Теоретический объем азота определяем по формуле (1.32):
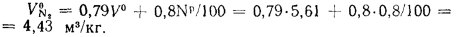
Теоретический объем водяных паров находим по формуле (1.35):
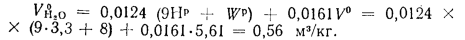
Энтальпию продуктов сгорания 1 кг угля при 
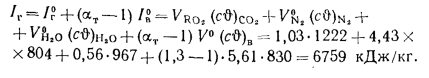
Значения 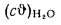
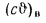
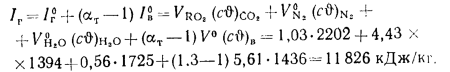
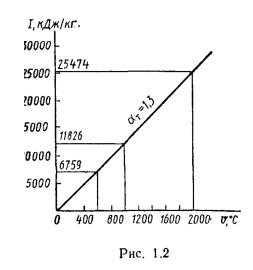
Значения 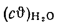
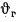
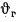
По найденным значениям энтальпий продуктов сгорании троим 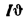
Полезное тепловыделение в топке (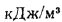
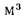
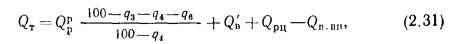
где 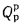
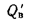
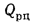
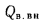
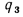
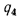
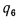
Теплота, вносимая в топку с поступающим холодным или горячим воздухом:
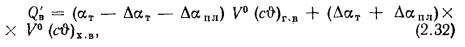
где 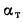
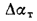
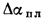
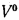
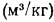
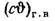
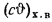
Теплота рециркулнрующнх газов

где 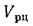
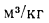
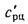
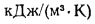
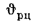
Теплота, вносимая в топку воздухом, подогретым вне котлоагрегата, 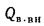
Коэффициент сохранения теплоты

где 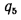
Теоретическая температура горения топлива в топке 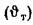
Зная полезное тепловыделение 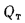
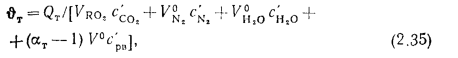
где 
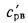
В формуле (2.35) неизвестны значения 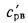
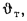
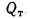
Температура газов (°С) на выходе из топки
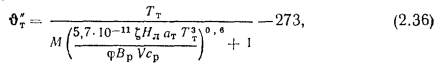
где 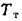
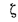
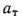
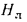
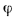
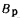
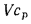
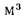
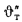
Лучевоспринимающая поверхность 
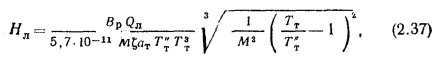
Возможно эта страница вам будет полезна:
Задача №3
Определить теоретическую температуру горения топлива в топке котельного агрегата, работающего: на донецком угле марки Д состава: 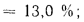
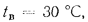
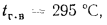
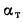
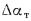
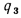
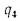
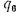
Решение: Низшую теплоту сгорания рабочей массы топлива определяем но формуле (112):
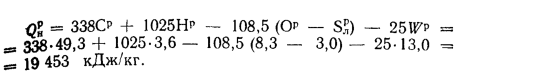
Теоретически необходимый объем воздуха находим по (1.27):
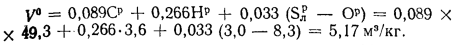
Теплоту, вносимую в топку воздухом, подогретым вне котлоагрегата, определяем по формуле (2.7):
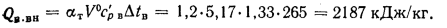
Располагаемую теплоту находим по формуле (2.3):
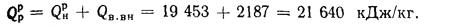
Теплоту, вносимую в топку с воздухом, определяем по (2.32):
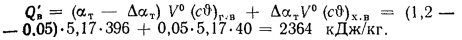
Значения энтальпий 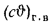
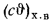
Полезное тепловыделение в топке находим по формуле (2.31):
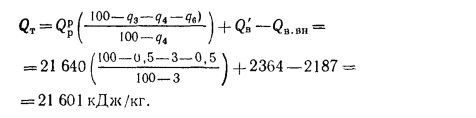
Зная полезное тепловыделение в топке, определяем теоретическую температуру горения с помощью 
Объем трехатомных газов определяем по формуле (1.33):
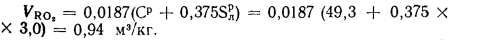
Теоретический объем азота находим по формуле (1.32):
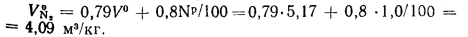
Теоретический объем водяных паров определяем по формуле (1.35):
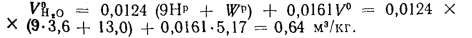
Энтальпию продуктов сгорания при 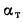
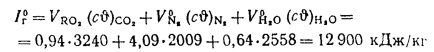
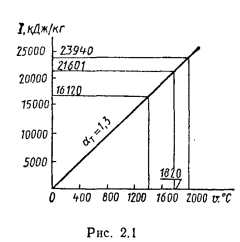
Значения энтальпий 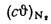
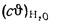
Энтальпию воздуха при 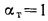
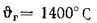
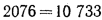
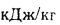
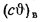
при
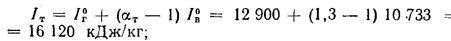
при
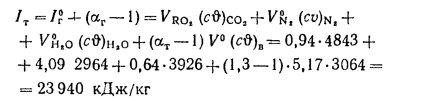
По найденным значениям энтальпий продуктов сгорания строим 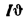
С помощью диаграммы по полезному тепловыделению в топке 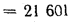
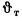
Задача №4
Определить, на сколько изменится теоретическая температура горения в топке котельного агрегата за счет подачи к горелкам предварительно подогретого воздуха, если известны температура воздуха в котельной 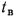
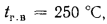
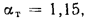
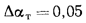
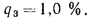
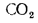
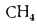
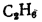
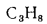
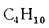
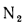
Решение: Низшую теплоту сгорания рабочей массы определяем по формуле (1.13):
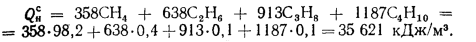
Теоретически необходимый объем воздуха находим по (1.28):
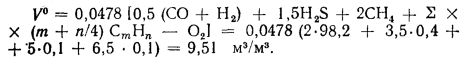
Теплоту, вносимую в топку воздухом, подогретым вне котлоагрегата, определяем по формуле (2.7):
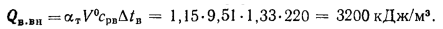
Располагаемую теплоту находим по формуле (2.3):
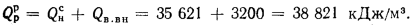
Теплоту, вносимую в топку с воздухом, — по формуле (2.32):
Значения энтальпий 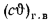
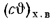
Полезное тепловыделение в топке при подаче к горелкам подогретого воздуха находим по формуле (2.31):
Полезное тепловыделение в топке при подаче к горелкам воздуха без предварительного подогрева определяем, пользуясь формулой (2.31):
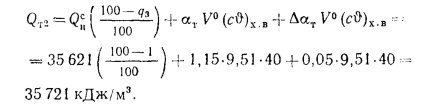
Зная полезные тепловыделения в топке, находим теоретические температуры горения с помощью
-диаграммы.
Для этого задаем два значения температуры газов (1400 и 2000 °С) и вычисляем для них энтальпии продуктов сгорания.
Объем трехатомных газов находим по формуле (1.39):
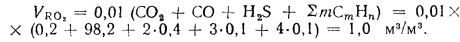
Теоретический объем азота определяем по формуле (1.38):
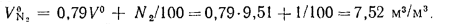
Теоретический объем водяных паров находим по формуле (1.41):
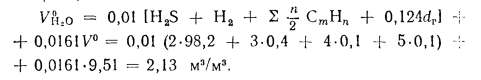
Энтальпию продуктов сгорания при aT — 1 и 0Г —= 1400 °С определяем по формуле (1.61):
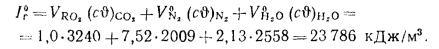
Энтальпию воздуха при 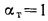
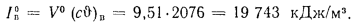
Энтальпию продуктов сгорания находим по формуле (1.60):
при 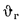
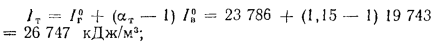
при
По найденным значениям энтальпий продуктов сгорания строим 
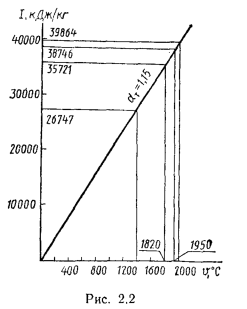
С помощью диаграммы полезным тепловыделениям в топке 

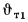
Теоретическая температура горения в топке котлоагрегата за счет подачи к горелкам подогретого воздуха изменится на
Задача №5
Расчет конвективных поверхностей нагрева котельного агрегата
Пароперегреватели. Количество теплоты (кДж/кг), воспринятой паром в пароперегревателе, определяется по формуле
где 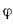
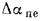
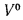
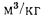
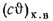
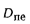
Конвективная поверхность 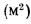

где 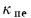
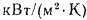
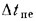
Температурный напор как для прямотока, так и для противотока определяется как среднелогарифмическая разность температур:

где 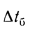
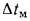
Если 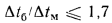

Экономайзеры. Количество теплоты (кДж/кг), воспринятой водой в экономайзере, определяется по формуле
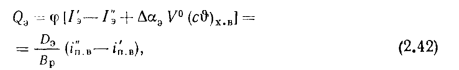
где 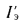
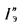
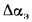
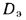
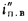
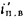
Расход воды через экономайзер

где Р — величина непрерывной продувки, %.
Энтальпия воды на выходе из экономайзера

Конвективная поверхность 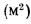

где 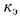
Воздухоподогреватели. Количество теплоты (кДж/кг), воспринятой воздухом в воздухоподогревателе, определяется по формуле
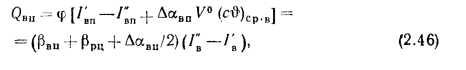
где 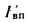
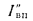
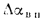
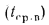
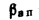
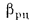
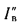
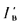

где 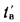
Отношение объема воздуха на выходе из воздухоподогревателя к теоретически необходимому

где 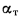
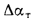
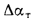
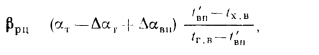
где 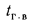
Конвективная поверхность (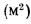

где 
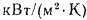
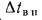
Задача №6
Определить энтальпию продуктов сгорания на выходе из пароперегревателя котельного агрегата пар»-производительностью D = 3,89 кг/с, работающего на природном газе Саратовского месторождения с низшей теплотой сгорания 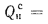
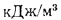
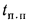
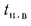
Вличина, непрерывной продувки P 4 %, к.п.д. котлоагрегата (брутто) 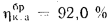
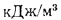
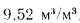
Решение: Расчетный расход топлива определяем по формуле (2.25):
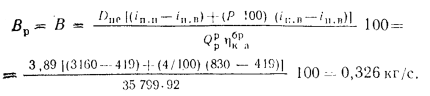
Количество теплоты, воспринятой паром в пароперегревателе, находим по формуле (2.38):
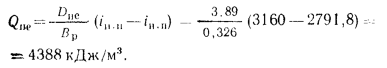
Энтальпию насыщенного пара при давлении 
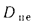
Коэффициент сохранения теплоты определяем по формуле (2.31):
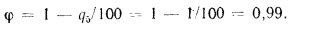
Энтальпию продуктов сгорания на выходе из пароперегревателя находим из формулы (2.38):
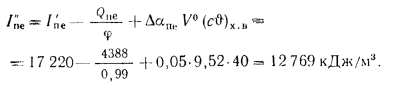
Задача №7
Определить количество теплоты, воспринятой. водой, конвективную поверхность нагрева экономайзера котельного агрегата паропроизводительностью D = 5,45 кг/с работающего на донецком каменном угле марки Т с низшей теплотой сгорания 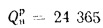
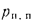
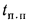
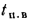
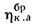
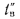
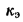
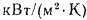
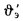
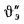
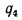
Решение: Натуральный расход топлива определяем по формуле (2.25):
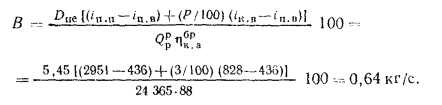
0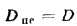
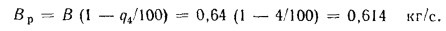
Расход воды через экономайзер определяем по формуле (2.43):
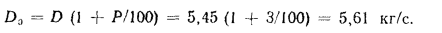
Количество теплоты, воспринятой водой в экономайзере, находим по формуле (2.42):

Температурный напор в экономайзере определяем по формуле (2.40):
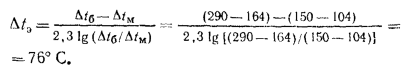
инвективную поверхность нагрева экономайзера по формуле (2.45):
Задача №8
Определить максимально допустимый зотовый износ стенки углеродистой трубы воздухоподогревателя котельного агрегата и температуру точки росы продуктов сгорания, если известны коэффициент, учитывающий абразивные свойства золы, 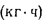
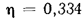

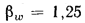
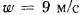
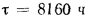
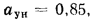
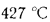
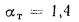
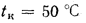
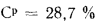
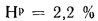
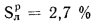
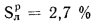
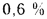
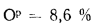
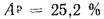
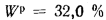
Решение: Низшую теплоту сгорания рабочей массы топлива определяем по формуле (I.I2):
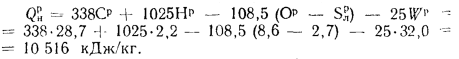
Теоретический объем воздуха, необходимый для полного сгорания 1 кг топлива, определяем по формуле (1.27):
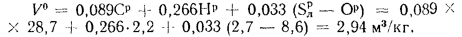
Объем сухих газов при 
Объем водяных паров при 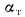
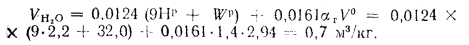
Объем продуктов полного сгорания находим по формуле (1.31):
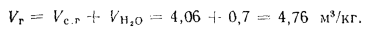
Концентрацию золы в продуктах сгорания определяем (2.51):
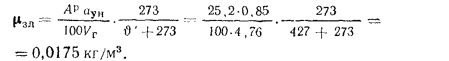
Изл
Приведенную зольность топлива находим по формуле (1 .24):
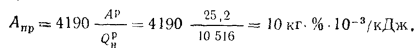
Приведенную сернистость топлива — по формуле (1.26):
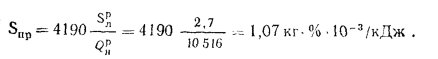
Максимально допустимый золовый износ стенки трубы находим по формуле (2.50):
Температуру точки росы продуктов сгорания определим формуле (2.52):
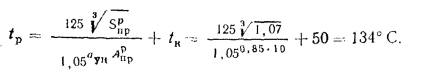
Расчет дымовой трубы на рассеивание в атмосфере загрязняющих веществ состоит в проверке высоты трубы на рассеивание в атмосфере золы, оксидов азота и диоксида серы 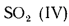
При котором их концентрация у поверхности земли будет меньше предельно допускаемой санитарными нормами.
Предельно допускаемая концентрация (п. д. к.) не должна превышать для золы и диоксида серы значения 
Концентрация загрязняющих веществ 
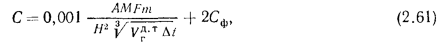
где А — коэффициент стратификации атмосферы, 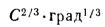
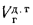
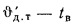
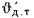
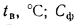
Масса золы (кг/с), выбрасываемой в атмосферу из дымовой трубы

где n — число котлоагрегатов, подсоединенных к трубе; 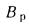
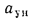
Масса диоксида серы (кг/с), выбрасываемого в атмосферу из дымовой трубы:

где 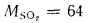
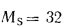
Задача №9
Определить концентрацию диоксида серы у поверхности земли для котельной, в которой установлены два одинаковых котлоагрегата. Работающих на высокосернистом мазуте состава: 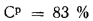
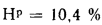
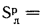
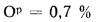
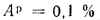
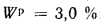
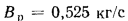
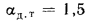
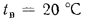
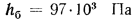
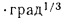
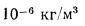
Решение: Теоретически необходимый объем воздуха определяем по формуле (1.27):
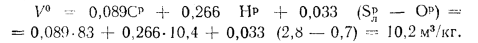
Теоретический объем продуктов полного сгорания находим по формуле (1.36):

Объем дымовых газов проходящих через дымовую трубу, определяем по формуле (2.57):
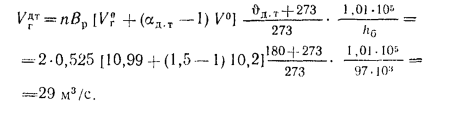
Массу диоксида серы, выбрасываемого в атмосферу из дымовой трубы, находим по формуле (2.63):
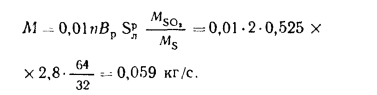
Концентрацию оксида серы у поверхности земли определяем по формуле (2.61):