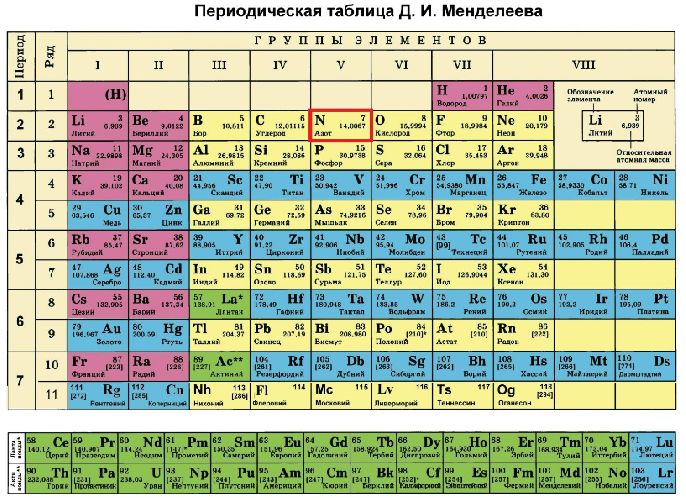
Азот в таблице менделеева занимает 7 место, в 2 периоде.
| Символ | N |
| Номер | 7 |
| Атомный вес | 14.0064300 |
| Латинское название | Nitrogenium |
| Русское название | Азот |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема азота
N: 1s2 2s2 2p3
Короткая запись:
N: [He]2s2 2p3
Одинаковую электронную конфигурацию имеют
атом азота и
C-1, O+1
Порядок заполнения оболочек атома азота (N) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Азот имеет 7 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
3 электрона на 2p-подуровне
Степень окисления азота
Атомы азота в соединениях имеют степени окисления 5, 4, 3, 2, 1, 0, -1, -2, -3.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы азота
Валентность N
Атомы азота в соединениях проявляют валентность V, IV, III, II, I.
Валентность азота характеризует способность атома N к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа N
Квантовые числа определяются последним электроном в конфигурации,
для атома N эти числа имеют значение N = 2, L = 1, Ml = 1, Ms = +½
Видео заполнения электронной конфигурации (gif):
Результат:
Соединения азота
| Тип | Формула | Название |
|---|---|---|
| Кислота | HNO3 | Азотная кислота |
| HNO2 | Азотистая кислота | |
| Основание | NH3 | Аммиак |
| Оксид | N2O | Оксид азота (I) |
| NO | Монооксид азота | |
| N2O3 | Азотистый ангидрид | |
| NO2 | Диоксид азота | |
| N2O5 | Азотный ангидрид |
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации N:
Eo = 1402 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где N в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Строение атома азота

4.7
Средняя оценка: 4.7
Всего получено оценок: 208.
4.7
Средняя оценка: 4.7
Всего получено оценок: 208.
Азот (N) – газ, содержание которого в атмосфере составляет около 78 %. Азот входит в состав аминокислот и нуклеотидов. Строение атома азота определяет физические и химические свойства элемента.
Строение
Азот – седьмой элемент периодической таблицы, расположенный в пятой группе и втором периоде. Относительная атомная масса равна 14. В природных условиях встречаются два изотопа азота – 14N и 15N.
Азот состоит из ядра с зарядом +7 и семи электронов, распределённых по двум энергетическим уровням. Нахождение элемента в пятой группе указывает на количество электронов на внешнем уровне и высшую валентность. В невозбуждённом состоянии на внешнем энергетическом уровне находится три электрона, поэтому азот может проявлять две валентности – III и V.
Запись электронного строения атома азота – 1s22s22p3 или +7 N)2)5.
Физические свойства
Азот – двухатомный (N2) газ без запаха и вкуса, плохо растворимый в воде. Азот может находиться в газообразном, жидком и твёрдом состояниях. В сжиженной форме азот имеет температуру кипения -196°С. При -209,86°C азот становится твёрдым. Под влиянием разных температур кристаллическая решётка твёрдого азота может изменяться, создавая модификации элемента.
Химические свойства
Атомы азота соединены тройной связью (N ≡ N), что обеспечивает максимальную прочность. Даже при нагревании азота до 3000°C наблюдается незначительное разложение молекул (до 0,1 % от взятого количества газа). Именно поэтому азот – химически малоактивный элемент. В соединениях при нагревании азот легко расстаётся с другими элементами.
Основные химические свойства азота приведены в таблице.
|
Взаимодействие |
Продукт реакции |
Пример |
|
С металлами (реагирует с сильными восстановителями) |
Соль |
6Li + N2 → 2Li3N |
|
Окисление под действием электрического тока |
Оксид азота |
O2 + N2 → 2NO |
|
С водородом в присутствии катализатора (Fe), под действием температуры (400 °С) и давления (200 атм) |
Аммиак |
3H2 + N2 → 2NH3 |
|
С неметаллами при высоких температурах |
Соль |
2B + N2 → 2BN |
Соединения азота с металлами и неметаллами называются нитридами.
Азот не реагирует с кислотами, водой и основаниями. Невозможно непосредственное взаимодействие молекул азота с серой и галогенами. Более активно с этими веществами при нормальных условиях реагирует атомарный азот.
Применение
Несмотря на пассивность азота, элемент широко применяется в промышленности. Кроме того, азот входит в состав клеток, без него невозможно построение белка и ДНК.
Азот используется при производстве:
- удобрений;
- взрывчатых веществ;
- медикаментов;
- красителей;
- пластмассы;
- искусственных волокон;
- аммиака.
Жидкий азот используется для охлаждения, заморозки, а также для окисления двигателей ракет. Оксид азота применяется в качестве наркоза и для производства аэрозолей.
Что мы узнали?
Рассмотрели схему строения азота, его физические, химические свойства, применение. Азот состоит из положительно заряженного ядра и двух электронных оболочек, на которых находится семь электронов. Азот – малоактивный газ. Молекула азота состоит из двух атомов элемента, соединённых тройной связью. Азот может находиться в трёх агрегатных состояниях. Элемент реагирует с некоторыми металлами, неметаллами и кислородом. Азот используется в промышленности, медицине, сельском хозяйстве. Кроме того, азот входит в состав живых организмов.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Котков
5/5
-
Александр Котков
5/5
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 208.
А какая ваша оценка?
Вася Иванов
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.
Загрузить PDF
Загрузить PDF
Электрон является частицей с отрицательным зарядом и входит в состав атома. Все основные элементы состоят из электронов, протонов и нейтронов. В химии важно уметь определять, сколько электронов содержит атом. Это можно сделать с помощью периодической системы химических элементов (таблицы Менделеева). Также необходимо знать, как найти число нейтронов и валентных электронов (электронов на внешней оболочке атома).
-
1
Возьмите таблицу Менделеева. Это цветная таблица, в которой все известные элементы упорядочены согласно их атомной структуре. Каждый элемент обозначается символом в виде одной, двух или трех латинских букв, наряду с атомным весом и атомным номером элемента.[1]
- Таблицу Менделеева можно найти в учебниках по химии или в интернете.
-
2
Найдите нужный элемент в таблице Менделеева. Элементы упорядочены по атомному номеру и разделены на три основные группы: металлы, неметаллы и металлоиды (полуметаллы). Некоторые группы носят несистематические названия, такие как щелочные металлы, галогены и благородные газы.[2]
. Каждый столбец таблицы называется группой, а каждая строка — периодом.- Если вы знаете, в какой группе или периоде находится нужный элемент, вам будет легче найти его.
- Если вы знаете только символ элемента, просто просмотрите таблицу и найдите в ней этот символ.
-
3
Выясните атомный номер элемента. Атомный номер указывается в верхнем левом углу (над символом элемента). Атомный номер равен количеству протонов в атоме элемента.[3]
Протоны являются частицами с положительным зарядом. Так как электроны — это частицы с отрицательным зарядом, нейтральный атом включает равное количество протонов и электронов.- Например, атомный номер бора (B) равен 5, то есть в атоме бора 5 протонов и 5 электронов.
Реклама
-
1
Выясните атомный номер элемента. Атомный номер указывается в верхнем левом углу (над символом элемента). Атомный номер равен количеству протонов в атоме элемента.[4]
Протоны являются частицами с положительным зарядом. Так как электроны — это частицы с отрицательным зарядом, то нейтральный атом включает равное количество протонов и электронов.- Например, атомный номер бора (B) равен 5, то есть в атоме бора 5 протонов и 5 электронов.
-
2
Выясните заряд иона. Если добавить или удалить электрон из атома, элемент не поменяется на другой, но зато изменится его заряд. В этом случае получится ион, такой как K+, Ca2+ или N3-. Обычно заряд указывается сверху справа от символа элемента.
- Электрон — это частица с отрицательным зарядом, поэтому если в атом добавить электрон, получится ион с отрицательным зарядом.
- Если из атома удалить электрон, получится ион с положительным зарядом.
- Например, заряд N3- равен -3, а заряд Ca2+ равен +2.
-
3
Если дан ион с положительным зарядом, вычтите заряд из атомного номера. Если ион имеет положительный заряд, атом потерял электроны. Чтобы определить оставшееся количество электронов, вычтите заряд из атомного номера. У иона с положительным зарядом протонов больше, чем электронов.
- Например, заряд Ca2+ равен +2, то есть у этого иона на 2 электрона меньше, чем у нейтрального атома кальция. Атомный номер кальция равен 20, поэтому у этого иона 18 электронов.
-
4
Если дан ион с отрицательным зарядом, прибавьте заряд к атомному номеру. Если ион имеет отрицательный заряд, атом получил дополнительные электроны. Чтобы определить получившееся количество электронов, прибавьте заряд к атомному номеру. У иона с отрицательным зарядом протонов меньше, чем электронов.
- Например, заряд N3- равен -3, то есть у этого иона на 3 электрона больше, чем у нейтрального атома азота. Атомный номер азота равен 7, поэтому у этого иона 10 электронов.
Реклама
Об этой статье
Эту страницу просматривали 46 912 раз.
Была ли эта статья полезной?
Характеристика азота
Положение в ПСХЭ
Азот (N) располагается во 2 периоде, в V группе, главной подгруппе, имеет порядковый номер 7.
Атомные числа
A (массовое число) = 14
P (число протонов) = 7
N (число нейтронов) = A — Z = 14 — 7 = 7
ē (число электронов) = 7
Электронное строение атома
N
+7
2
5
7N 1s2 2s2 2p3
Валентные электроны
| 7N | ↑↓ | ↑ | ↑ | ↑ | ||
| 2s | 2p |
Степени окисления
минимальная: -3
максимальная: +5
Свойства простого вещества
Азот – p-элемент, неметалл.
Высший оксид
N2O5 – оксид азота (V).
Проявляет кислотные свойства:
N2O5 + 2NaOH ⟶ 2NaNO3 + H2O
Высший гидроксид
HNO3 – азотная кислота.
Проявляет кислотные свойства:
HNO3 + NaOH ⟶ NaNO3 + H2O
Водородное соединение
NH3