Перейти к содержанию
Формальное определение заряда в химии
На чтение 2 мин. Просмотров 112 Опубликовано 27.05.2021
Формальный заряд FC – это разница между числом валентных электронов каждого атома и числом электронов, с которыми связан атом. Формальный заряд предполагает, что любые общие электроны поровну распределяются между двумя связанными атомами.
Формальный заряд рассчитывается по формуле:
- FC = e V – e N – e B /2
где
- e V = количество валентных электронов атома, как если бы он был изолирован от молекулы
- e N = количество несвязанных валентных электронов на атоме в молекуле
- e B = количество электронов, разделяемых связями с другими атомами в молекула
Пример расчета формального заряда
Например, диоксид углерода или CO 2 – нейтральная молекула, имеющая 16 валентных электронов. Существует три различных способа нарисовать структуру Льюиса для молекулы, чтобы определить формальный заряд:
- Атом углерода может быть присоединен к обоим атомам кислорода. атом через двойные связи (углерод = 0, кислород = 0, формальный заряд = 0)
- Атом углерода может иметь одинарную связь с одним атомом кислорода и двойную связь с другим атомом кислорода (углерод = +1, кислород-двойной = 0, кислород-одиночный = -1, формальный заряд = 0)
- Атом углерода может быть присоединен к каждому атому кислорода одинарными связями (углерод = +2, oxygens = -1 каждый, формальный заряд = 0)
Каждая возможность приводит к формальному обвинению в ноль, но первый вариант – лучший один, потому что он предсказывает отсутствие заряда в молекуле. Это более стабильно и, следовательно, наиболее вероятно.
Ключевые выводы по формальному заряду
- Официальный заряд (FC ) представляет собой электрический заряд атома в молекуле.
- Он рассчитывается как количество валентных электронов минус половина количества электронов, совместно используемых в связи, минус количество электронов, не связанных в молекуле .
- Формальный заряд используется для оценки распределения электрического заряда в молекуле.
Как определить заряд иона
В силу определенных причин атомы и молекулы могут либо приобретать, либо терять свои электроны. В этом случае образуется ион. Таким образом, ион — это одноатомная или многоатомная заряженная частица. Очевидно, важнейшей характеристикой иона будет его заряд.

Вам понадобится
- Таблица химических элементов Д.И. Менделеева
Инструкция
Атом любого вещества состоит из электронной оболочки и ядра. Ядро состоит из двух типов частиц — нейтронов и протонов. Нейтроны не имеют электрического заряда, то есть электрический заряд нейтронов равен нулю. Протоны являются положительно заряженными частицами и имеют электрический заряд, равный +1. Количество протонов характеризует атомный номер данного атома.
Электронная оболочка атома состоит из электронных орбиталей, на которых расположено разное количество электронов. Электрон — отрицательно заряженная элементарная частица. Ее электрический заряд равен -1.
При помощи связей атомы могут также соединяться в молекулы.
В нейтральном атоме количество протонов равно количеству электронов. Поэтому его заряд равен нулю.
Чтобы определить заряд иона, необходимо знать его структуру, а именно количество протонов в ядре и количество электронов на электронных орбиталях.
Суммарный заряд иона получается в результате алгебраического суммирования зарядов входящих в него протонов и электронов. Число электронов в ионе может превышать число протонов, и тогда ион будет отрицательным. Если число электронов меньше числа протонов, то ион будет положительным.
Зная химический элемент, по таблице Менделеева мы можем определить его атомный номер, который равен количеству протонов в ядре атома этого элемента (например 11 у натрия). Если один из электронов покинул атом натрия, то у атома натрия будет уже не 11, а 10 электронов. Атом натрия станет положительно заряженным ионом с зарядом Z = 11+(-10) = +1.
Обозначаться такой ион будет символом Na с плюсом сверху, в случае заряда +2 — двумя плюсами и.т.д. Соответственно для отрицательного иона используется знак «минус».
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
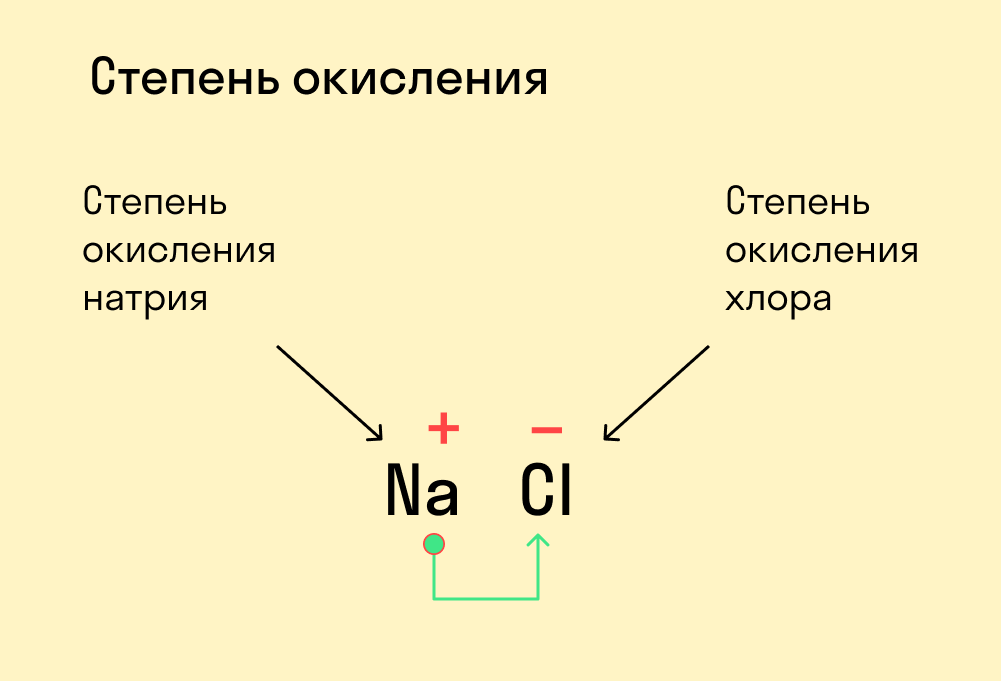
Степень окисления элемента
О чем эта статья:
Что такое степень окисления
Для начала давайте вспомним, как проходят химические связи в молекуле вещества. Взаимодействуя между собой, атомы могут притягивать или отдавать электроны для образования общей электронной пары. Атом с более высокой электроотрицательностью (ЭО) притягивает электроны и приобретает отрицательный заряд, а атом с меньшей ЭО, напротив, отдает электроны и обретает положительный заряд.
Степень окисления — это условный заряд, который предположительно обретет атом после перемещения электронов. Он вычисляется из предположения, что все свободные электроны полностью перемещаются от одного атома к другому и все образованные связи — ионные.
Почему в определении степени окисления мы говорим об условном заряде? Потому что в реальности он может быть другим, а химические связи атома в соединении не обязательно будут ионными. Но мы предполагаем, что все именно так, чтобы немного упростить расчеты. Это помогает в составлении формул и классификаций.
Запомните:
Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому.
У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления.
У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
Простые вещества, такие как Cl2, O2 и т. д., имеют степень окисления, равную 0, поскольку смещения электронов в данном случае не происходит.
Как рассчитать степень окисления
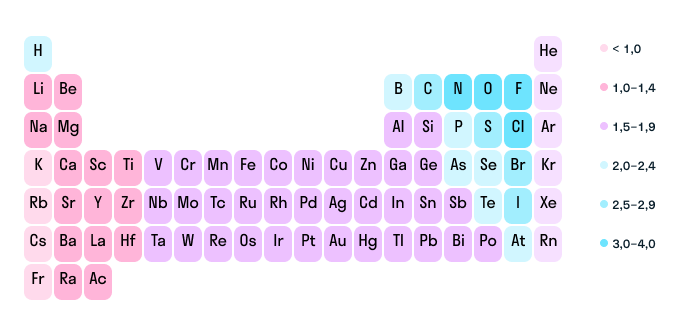
Как мы уже выяснили выше, определить степень окисления элемента (иначе говоря, окислительное число) помогает электроотрицательность. Значения ЭО легко узнать, пользуясь таблицей Менделеева или шкалой относительной электроотрицательности. Сравните, у какого химического элемента в соединении ЭО выше — этот элемент будет притягивать электроны и приобретет отрицательный заряд.
Шкала относительной электроотрицательности
Это правило поможет составить уравнение и посчитать степень окисления любого химического элемента в соединении, если известны данные по остальным элементам. Еще больше облегчат расчеты следующие закономерности:
у водорода в гидридах окислительное число −1, а во всех остальных веществах оно равно +1;
у кислорода степень окисления в оксидах равна −2, в пероксидах −1, в соединениях с фтором +2;
у неметаллов в соединениях с водородом и металлами окислительное число всегда отрицательное;
у металлов степень окисления всегда положительная.
Также есть элементы, которые во всех соединениях отдают или принимают одинаковое количество электронов, поэтому их окислительное число — постоянная величина.
Алгоритм действий
Итак, мы знаем основные закономерности. Давайте разберемся, как находить степени окисления на примерах. Предлагаем следующий алгоритм действий.
Посмотрите, является ли вещество элементарным. Если да — значит, оно находится в химически несвязанном состоянии и окислительное число равно 0. Это правило подходит как для веществ, образованных из отдельных атомов, так и для тех, что включают многоатомные молекулы одного и того же элемента.
Пример
Если это соединение, определите, состоит ли оно из ионов. В многоатомном ионе сумма всех степеней окисления равна его заряду. Узнайте эту сумму из таблицы растворимости и составьте уравнение с известными окислительными числами.
Пример
Допустим, нужно определить заряд азота в ионе аммония.
Согласно таблице растворимости заряд иона аммония NH4 + равен +1. Это значит, что сумма степеней окисления в этом соединении тоже будет равна +1.
Также известно, что водород всюду, кроме гидридов, имеет заряд +1. В данном случае есть 4 атома водорода, т. е. +1 × 4.
Составим формулу: х + (+1) × 4 = +1. Значит х = −3.
Окислительное число азота в ионе аммония равно −3, т. е. N -3 H4 +1 .
Если соединение — нейтральная молекула, составьте уравнение, учитывая, что все окислительные числа в сумме равны 0.
Пример
Допустим, нужно определить степень окисления серы в соединении Na2SO4.
Мы знаем, что у щелочного металла Na постоянное окислительное число +1. Кислород, согласно вышеизложенным правилам, в оксидах имеет заряд −2.
Составим уравнение: (+1) × 2 + х + (−2) × 4 = 0. Значит х = −6.
Степень окисления серы равна −6, т. е. Na2 +1 S -6 O4 -2 .
Как узнать степень окисления нескольких элементов
А как быть, если неизвестны окислительные числа двух и более элементов в соединении? В математике уравнения с двумя неизвестными не всегда имеют решение. Но в химии есть выход: можно разделить химическую формулу на несколько частей, которые имеют постоянные заряды.
Пример
Как вычислить степень окисления в сложном веществе (NH4)2SO4? Посмотрим на него как на соединение двух ионов с известными зарядами: NH4 + и SO4 2- .
Поскольку мы знаем окислительные числа водорода и кислорода, найти заряды азота и серы в каждом ионе не составит труда.
В ионе NH4 + формула для определения заряда азота будет следующей: х + (+1) × 4 = 1. Понятно, что х = −3, т. е. степень окисления азота −3.
В ионе SO4 2- формула для серы х + (−2) × 4 = −2. Следовательно, х = 6, т. е. заряд серы равен +6.
Как определить высшую и низшую степень окисления
Выделяют высшую (или максимально положительную) и низшую (максимально отрицательную) степени окисления. В диапазоне между ними располагаются окислительные числа, которые могут принадлежать данному химическому элементу в различных соединениях. Для четных групп характерны четные числа в диапазоне, а для нечетных групп — нечетные.
Высшая степень окисления совпадает с номером группы элемента (для элементов в главной подгруппе) в короткой форме периодической системы.
Низшая степень окисления равна числу, которое получится, если от номера группы элемента отнять 8.
Исключения: фтор, железо, кобальт, родий, подгруппа никеля, кислород, благородные газы (помимо ксенона).
Проиллюстрируем на примере, как найти высшую и низшую степень окисления.
Хлор (Cl), согласно короткой периодической таблице, принадлежит к группе VII. Значит, его максимальное окислительное число будет +7. Такой условный заряд элемент приобретает в оксиде хлора Cl2O7 и хлорной кислоте HClO4. Минимальное число получаем следующим образом: 7 − 8 = −1 (характерно для хлороводорода HCl).
По степени окисления можно понять, как поведет себя вещество в окислительно-восстановительных реакциях. Если в соединении главный действующий элемент имеет высшую степень окисления, оно является окислителем, а если он имеет низшую степень окисления — восстановителем.
Например, серная кислота является окислителем, поскольку у серы в данном случае заряд +6. А вот в сернистой кислоте у серы заряд всего +4, поэтому она может проявлять и окислительную способность, и восстановительную. В сероводороде заряд серы равен −2, и это минимальная степень окисления, а значит, данное вещество — восстановитель.
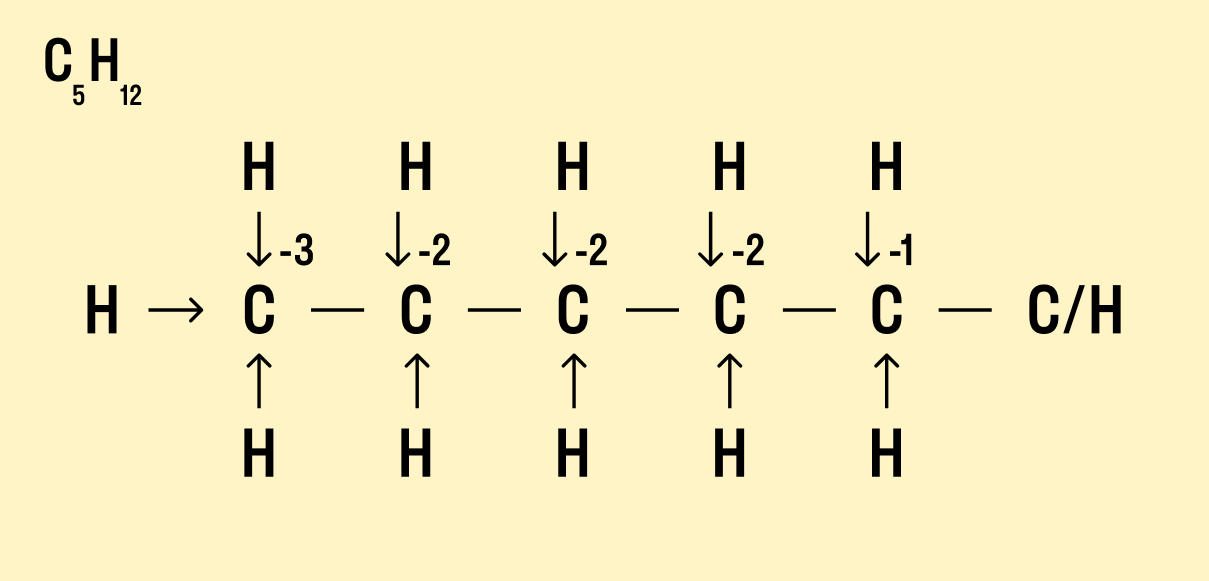
Как найти степень окисления в органическом соединении
В органической химии определять окислительные числа элементов немного сложнее, поскольку все органические вещества включают углерод, известный большим количеством неполярных связей. Если у нас всего один атом углерода, можно использовать стандартный способ.
Пример
Рассчитайте степень окисления углерода в метаноле H3C−OH.
Мы знаем, что водород Н имеет окислительное число +1, а у кислорода в данном случае оно равно −2. Составим уравнение:
х + (+1) × 4 + (+2) × 1 = 0
Заряд углерода равен −2, т. е. C -2 H4 +1 O -2 .
Но что делать, если атомов углерода больше? Придется анализировать структурную формулу, чтобы понять, какие химические связи есть между элементами и сколько электронов они теряют/приобретают в результате. Такой вариант нахождения окислительного числа называют графическим.
Графический метод
Нарисуйте структурную формулу соединения.
Изобразите стрелками химические связи и смещение атомов (все связи между атомами углерода С−С считайте неполярными).
Посчитайте, сколько стрелок ведет к атому (это «−») и сколько от него (это «+»), а затем суммируйте «+» и «−», чтобы узнать степень окисления.
Валентность и степень окисления: в чем разница?
Школьники, которые только начали изучать данные разделы химии, нередко путают степень окисления и валентность. Численно эти показатели могут совпадать (но далеко не всегда), а вот по смыслу они в корне различаются.
Между этими двумя понятиями есть следующие отличия:
валентность не имеет знака, в то время как у окислительного числа он есть («+» или «−»);
валентность равна нулю только в том случае, если атом не имеет связей с другими частицами, а степень окисления может быть равна нулю и при наличии таких связей;
вычисляя степень окисления, мы предполагаем, что в соединении ионные связи, хотя на самым деле это может быть не так, а валентность всегда имеет реальный смысл.
Поэтому отождествлять эти два понятия ни в коем случае не стоит. Более того, не нужно ориентироваться на валентность, пытаясь определить окислительное число.
Вопросы для самопроверки
Почему степень окисления называют формальным зарядом, условным?
Что отражает численная величина степени окисления?
Чему равна сумма всех окислительных чисел в ионе?
Как определить низшую степень окисления?
Как найти две неизвестных степени окисления в одном веществе?
Как определять степени окисления в органических веществах?
Как определить степень окисления?
Степень окисления — это формальный заряд атома. Слово «формальный» означает, что этого заряда у атома в действительности может и не быть, вернее, он может оказаться немного другим. Однако по разным причинам эти условные заряды удобны и химики всего мира пользуются понятием «степень окисления».
Отметим, что степень окисления указывается в верхнем правом углу атома в формате или , где – целое число. Например:
Существуют определённые правила нахождения степени окисления.
- Степень окисления простых веществ равна нулю. Напомню, что простыми называют вещества, состоящие из одного вида атомов. Примеры:
- Некоторые атомы в сложных соединениях проявляют только одну степень окисления. Такие степени окисления называются постоянными.
— Исключения у водорода соединения , в которых у водорода степень окисления
— Исключения у кислорода
- Сумма степеней окисления всех атомов сложного соединения должна быть равна нулю. Пользуясь именно эти правилом, мы будем расставлять степени окисления в сложных соединениях.
Как именно?
Пример 1: расставьте степени окисления в соединении .
Мы знаем степень окисления тогда мы можем найти, что общее количество «плюсов» у четырех атомов . Чтобы в сумме был ноль, у трех атомов заряд должен быть , значит у каждого атома
Пример 2: Найдите степени окисления всех атомов в соединении
Сначала подпишем постоянные степени окисления
Посчитаем общее количество плюсов и минусов
Для того, чтобы плюсов и минусов было одинаковое количество у двух хромов в сумме должно быть , а значит, у каждого атома
Пример 3: Найдите степени окисления всех атомов в соединении
Для начала заметим, что для нахождения степени окисления удобно «раскрыть скобки» и представить соединение как и тогда задание выполняется аналогично заданию из примера 2.
Ответ:
- В некоторых устоявшихся группах атомов в составе веществ (кислотные остатки и ион аммония) степени окисления атомов неизменны и их тоже стоит запомнить.
Пользуясь этими правилами, можно расставить степени окисления практически во всех соединений, встречающихся на ЕГЭ по химии.
Как расставлять и как определить степень окисления элементов
В химических процессах главную роль играют атомы и молекулы, свойства которых определяют исход химических реакций. Одной из важных характеристик атома является окислительное число, которое упрощает метод учета переноса электронов в частице. Как определить степень окисления или формальный заряд частицы и какие правила необходимо знать для этого?
Определение

Термин окисление (оксидация) в химии означает реакцию, в ходе которой группа атомов или один из них теряют электроны или приобретают, в случае приобретения реакцию называют «восстановлением».
Степень окисления – это величина, которая измеряется количественно и характеризует перераспределяемые электроны в ходе реакции. Т.е. в процессе оксидации электроны в атоме уменьшаются или увеличиваются, перераспределяясь между другими взаимодействующими частицами, и уровень оксидации показывает, как именно они реорганизуются. Данное понятие тесно связано с электроотрицательностью частиц – их умением притягивать и отталкивать от себя свободные ионы.
Это интересно! Что такое алканы: строение и химические свойства
Определение уровня оксидации зависит от характеристик и свойств конкретного вещества, поэтому нельзя однозначно назвать процедуру вычисления легкой или сложной, но ее результаты помогают условно записать процессы окислительно-восстановительных реакций. Следует понимать, что полученный результат вычислений является результатом учета переноса электронов и не имеет физического смысла, а также не является истинным зарядом ядра.
Важно знать! Неорганическая химия часто использует термин валентности вместо степени окисления элементов, это не является ошибкой, но следует учитывать, что второе понятие более универсальное.
Понятия и правила вычислений движения электронов являются основой для классификации химических веществ (номенклатура), описания их свойств и составления формул связи. Но наиболее часто данное понятие используется для описания и работы с окислительно-восстановительными реакциями.
Правила определения степени окисления
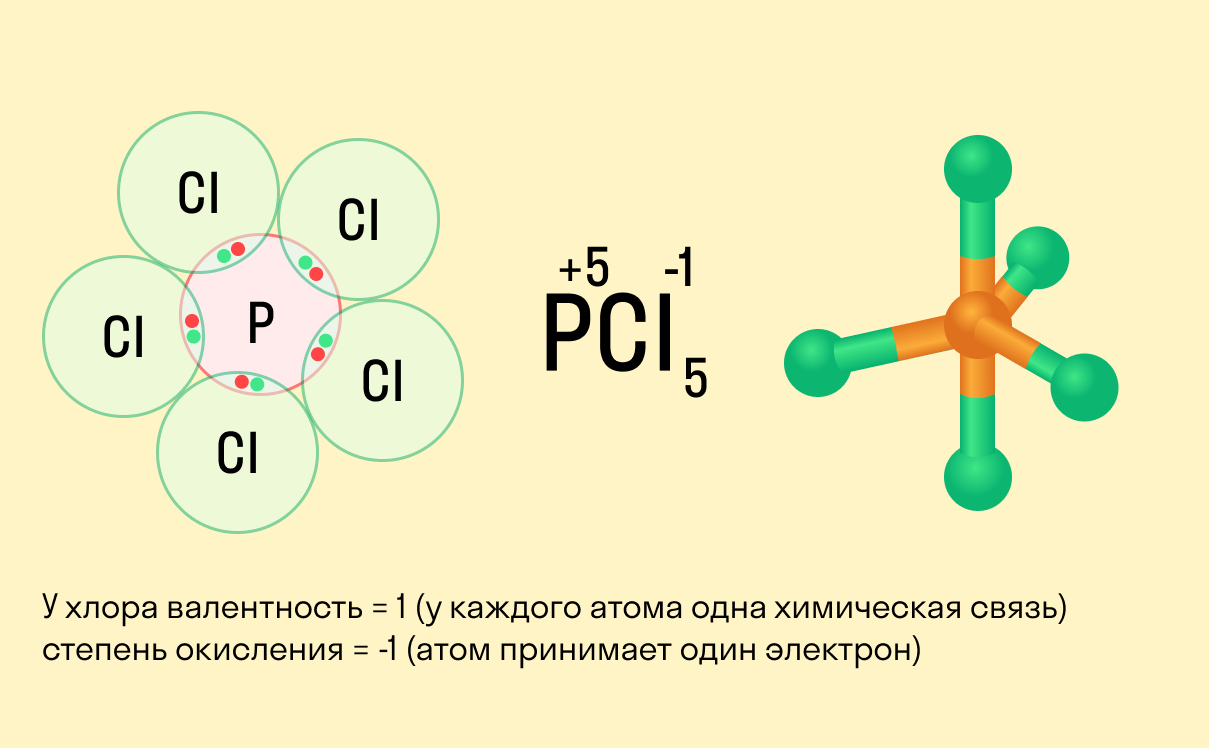
Как узнать степень окисления? При работе с окислительно-восстановительными реакциями важно знать, что формальный заряд частицы всегда будет равен величине электрона, выраженного в числовом значении. Эта особенность связана с тем предположением, что электронные пары, образующие связь, всегда полностью смещаются в сторону более отрицательных частиц. Следует понимать, что речь идет об ионных связях, а в случае реакции при ковалентной связи электроны будут делиться поровну между одинаковыми частицами.
Окислительное число может иметь как положительные, так и отрицательные значения. Все дело в том, что в процессе реакции атом должен стать нейтральным, а для этого нужно либо присоединить к иону некое количество электронов, если он положительный, либо отнять их, если он отрицательный. Для обозначения данного понятия при записи формулы обычно прописывают над обозначением элемента арабскую цифру с соответствующим знаком. Например, 

Следует знать, что формальный заряд металлов всегда будет положительным, а в большинстве 
- У простых элементов всегда равна нулю:
или
.
- У фтора всегда будет равна -1.
- Как и у металлов, у элементов из групп IA, IIA и IIIA групп всегда одинаковая – это номер группы, в которой они расположены.
- У кислорода в любой связи равна -2, кроме связей с пероксидами (Н2О2), когда значение равно -1 и оксидом фтора (O+2F2-1, O2+1F2-1), когда она равна +2.
- У водорода всегда +1, кроме его взаимодействия с гидридами (Na+H- и связями по типу C+4H4-1).
- У простого вещества без связей с другими элементами всегда равна нулю.
- У простого иона с одним атомом равна числу его электрона (Na+, Ca+2).
- Если рассматривается связь двух веществ различной природы (металл и неметалл), то отрицательное окислительное число будет наблюдаться у вещества, которое обладает большей электроотрицательностью (H+F-, Cu+Br-), а положительное, соответственно, у элемента с электроотрицательностью больше нуля.
- У щелочных металлов, таких как литий, натрий, калий и прочих, всегда +1.
- У металлов из главной подгруппы II (магний, барий, кальций и стронций) равна +2.
- У алюминия всегда одинаковое значение — +3.
Запомнив эти особенности, достаточно просто будет определять окислительное число у элементов, независимо от сложности и количества уровней атомов.
Полезное видео: определение степени окисления
Как определить степень окисления
Периодическая таблица Менделеева содержит почти всю необходимую информацию для работы с химическими элементами. Например, школьники используют только ее для описания химических реакций. Так, чтобы определить максимальные положительные и отрицательные значения окислительного числа необходимо свериться с обозначением химического элемента в таблице:
- Максимально положительное – это номер группы, в которой находится элемент.
- Максимально отрицательная степень окисления – это разница между максимально положительной границей и числом 8.
Таким образом, достаточно просто узнать крайние границы формального заряда того или иного элемента. Такое действие можно совершить с помощью вычислений на основе таблицы Менделеева.
Важно знать! У одного элемента могут быть одновременно несколько различных показателей оксидации.
Различают два основных способа определения уровня оксидации, примеры которых представлены ниже. Первый из них – это способ, который требует знаний и умений применять законы химии. Как расставлять степени окисления с помощью этого способа?
Для этого необходимо:
- Определить, является ли данное вещество элементарным и находится ли оно вне связи. Если да, то его окислительное число будет равно 0, независимо от состава вещества (отдельные атомы или многоуровневые атомные соединения).
- Определить, состоит ли рассматриваемое вещество из ионов. Если да, то степень оксидации будет равна их заряду.
- Если рассматриваемое вещество металл, то посмотреть на показатели других веществ в формуле и вычислить показания металла путем арифметических действий.
- Если все соединение имеет один заряд (по сути это сумма всех частиц представленных элементов), то достаточно определить показатели простых веществ, затем вычесть их от общей суммы и получить данные металла.
- Если связь нейтральная, то общая сумма должна быть равна нулю.
Это интересно! Уроки химии: что это такое галогены
Для примера можно рассмотреть объединение 
Этот способ весьма хорош, поскольку правильность решения всегда можно проверить, если сложить все уровни оксидации вместе.
Второй метод можно применять без знания химических законов:
- Найти данные частиц, по отношению к которым нет строгих правил и точное количество их электронов неизвестно (можно путем исключения).
- Выяснить показатели всех прочих частиц и после из общей суммы путем вычитания найти нужную частицу.
Рассмотрим второй метод на примере вещества Na2SO4, в котором не определен атом серы S, известно лишь, что он отличен от нуля.
Это интересно! Уроки химии: катионы и анионы – что это такое
Чтобы найти, чему равны все степени окисления необходимо:
- Найти известные элементы, помня о традиционных правилах и исключениях.
- Ион Na = +1, а каждый кислород = -2.
- Умножить количество частиц каждого вещества на их электроны и получить степени оксидации всех атомов, кроме одного.
- В Na2SO4 состоят 2 натрия и 4 кислорода, при умножении получается: 2 X +1 = 2 – это окислительное число всех частиц натрия и 4 X -2 = -8 – кислородов.
- Сложить полученные результаты 2+(-8) =-6 – это общий заряд соединения без частицы серы.
- Представить химическую запись в виде уравнения: сумма известных данных + неизвестное число = общий заряд.
- Na2SO4 представлено следующим образом: -6 + S = 0, S = 0 + 6, S = 6.
Таким образом, чтобы использовать второй метод, достаточно знать простые законы арифметики.
Таблица оксидации
Для простоты работы и вычисления показателей оксидации для каждого химического вещества используют специальные таблицы, где прописаны все данные.
Она выглядит следующим образом:
Полезное видео: учимся определять степень окисления по формулам
Вывод
Нахождение степени окисления для химического вещества – это простое действие, которое требует лишь внимательности и знания основных правил и исключений. Зная исключения и пользуясь специальными таблицами, это действие не будет занимать много времени.
http://ege-study.ru/ru/ege/materialy/himiya/kak-opredelit-stepen-okisleniya/
http://znaniya.guru/himiya/kak-rasstavlyat-i-kak-opredelit-stepen-okisleniya-elementov.html
Он имеет рейтинг е. Любой электрический заряд кратен элементарному заряду. Пример: заряд одного моля электронов равен q = NA × qe = 6,02.1023 × (–1,6.10–19) = 96 320 С.
С одной стороны, как рассчитать q в электричестве? мы рассчитанный Количествоэлектричество используя отношение: Q = Я*т Q в Кулонах, I в Амперах, t в секундах. Если t выражено в часах, Q получается в ампер-часах.
С другой стороны, каково значение Q?
После эксперимента Милликена в 1909 г. что электрический заряд является квантованный: любая нагрузка Q любой является целое число, кратное элементарному заряду, обозначаемому e, что соответствует Valeur абсолютного заряда электрона, при e ≈ 1,602 × 10—19 C.
Что такое Q в физике? Электрический заряд – это величина, которая обозначается буквой q (иногда с большой буквы Q).
Итак, как рассчитать заряд Q сердечника? Таким образом, для атома, обозначенного как ZAX, содержащего Z протонов и Z электронов, общий заряд его ядра равен Q ядра = Z × e, а общий заряд его электронного облака равен Q облака = Z × − e. Имеем Q ядра + Q облака = 0, атом электрически нейтрален.
Как рассчитать заряд атома?
Теперь, поскольку атомы обычно имеют такое же количество протонов, как и электронов, говорят, что атом имеет нулевой заряд («0»). Положительные и отрицательные заряды компенсируют друг друга. Чтобы найти полный заряд атома, прибавьте положительные заряды к отрицательным зарядам.
Какой заряд имеет ядро атома?
Определение. Атом состоит из ядра, заряженного положительно, и электронов, заряженных отрицательно, которые тяготеют вокруг этого ядра.
Как рассчитать заряд в кулонах?
Согласно «закону Кулона», изложенному сегодня в школьных учебниках, сила, действующая между двумя точечными зарядами Q и q, находящимися на расстоянии d, равна: F = k Qq/d2 где k — коэффициент, зависящий от системы единиц.
Как рассчитать to и Z атома?
Определите его атомный номер Z и число электронов.
- д = Zxe.
- Z = д/е.
- Z = 17,6×10 – 19 / 1,6 × 10 – 19 = 11.
- Атом содержит столько же протонов, сколько электронов, он содержит 11 электронов.
- m = Axm (нуклон)
- Количество нейтронов:
- АЗ = 24 – 11 = 13.
Каков заряд атомного ядра?
Атом состоит из ядра, заряженного положительно, и электронов, заряженных отрицательно, которые тяготеют вокруг этого ядра.
Как рассчитать заряд в кулонах?
Согласно «закону Кулона», изложенному сегодня в школьных учебниках, сила, действующая между двумя точечными зарядами Q и q, находящимися на расстоянии d, равна: F = k Qq/d2 где k — коэффициент, зависящий от системы единиц. Точка B расположена на расстоянии R + 2r от центра (C’).
Каков электрический заряд ядра?
Действительно, атомное ядро имеет положительный электрический заряд благодаря протонам, а электроны имеют отрицательный электрический заряд.
Чему равен электрический заряд нейтрона?
Нейтрон в 1,001 раза массивнее протона. Его электрический заряд равен нулю. Как и протон, нейтрон является нуклоном и может быть связан с другими нуклонами ядерной силой внутри атомного ядра.
Каков знак полного электрического заряда атома от его ядра до его электронного отростка или облака?
Ядро атома заряжено положительно, а электроны заряжены отрицательно. Однако с электрической точки зрения атом глобально нейтрален, потому что общий заряд электронов в точности компенсирует заряд ядра.
Как перевести в кулоны?
Кулон — это электрический заряд (количество электричества), пересекающий сечение проводника, по которому проходит ток силой один ампер в течение одной секунды (1 Кл = 1 А·с). Он равен 6,241×509.18 элементарные заряды.
Как рассчитать заряд молекулы?
Сумма формальных нагрузок всегда равна общей нагрузке (z) здания. Nv = число электронов на валентной оболочке атома, рассматриваемого в его изолированном основном состоянии. Nl = количество связей, образованных рассматриваемым атомом в исследуемой молекуле.
Что такое единица кулон?
кулон. СИ единица количества электричества и электрического заряда (обозначение С), эквивалентная количеству электричества, переносимому за 1 секунду током в 1 ампер.
Что такое атомный номер Z?
Атомный номер (Z) представляет в химии и физике количество протонов в атоме. Последнее может быть схематизировано в первом подходе компактным скоплением (атомным ядром) протонов (p+) и нейтроны (n), вокруг которых циркулируют электроны (e—).
Как найти n атома?
Теперь вы знаете, что атомный номер равен количеству протонов, а массовое число равно количеству протонов и нейтронов. Чтобы найти количество нейтронов в элементе, вычтите атомный номер из массового числа.
Как рассчитать количество атомов в молекуле?
Таким образом, один моль атомов, молекул или ионов содержит 6,02 × 1023 атомы, молекулы или ионы. Это число является константой Авогадро, отмеченной: NA = 6,02 × 1023 моль–1.
Какие частицы входят в состав ядра и как они заряжены?
В ядре атома находятся протоны (положительно заряженные) и нейтроны (незаряженные), а электроны (отрицательно заряженные) расположены вокруг ядра.
Смотрите также
Каков заряд атома кислорода?
Символ ядра углерода с 6 протонами и 8 нейтронами: 14С. Ядро атома кислорода имеет массу, равную 2,672·10-26 кг, и электрический заряд, равный 1,28·10-18 Кл.
Чему равен электрический заряд атома?
Заряд атома. Заряд частицы: протон и электрон несут равные по абсолютной величине электрические заряды (1,602·10–19), но протон заряжен положительно, а электрон отрицательно.
Чему равен полный электрический заряд ядра атома азота?
→ Таблица Менделеева говорит нам, что: – для азота: Z = 7, поэтому на атом азота приходится 7 зарядов +. – для кислорода: Z = 8, поэтому на атом кислорода приходится 8 + зарядов.
Какова роль нейтрона?
Re: роль нейтрона
Их роль для обоих состоит в том, чтобы обеспечить сцепление ядра: они подвержены сильному ядерному взаимодействию, которое противостоит электромагнитному взаимодействию, которое должно их разделить (в частности, отталкивание между протонами).
Что такое протон и нейтрон?
Протон и нейтрон — это адроны, объекты, состоящие из кварков, то есть элементарных частиц. Упрощая, протон состоит из двух верхних кварков и одного нижнего кварка, а нейтрон содержит два нижних кварка и один верхний кварк.
Что такое нейтрон?
Нейтрон — нейтральная частица, входящая в состав ядра атомов вместе с протонами. По этой причине его также называют, как и протон, нуклоном. Он был открыт в 1932 году Джеймсом Чедвиком.
Каков знак полного электрического заряда атома?
Атом в нормальном состоянии имеет столько же протонов, сколько и электронов. Таким образом, его общий заряд равен нулю. Говорят, что атом электрически нейтрален.
Чему равен полный электрический заряд атома?
Заряд атома. Заряд частицы: протон и электрон несут равные по абсолютной величине электрические заряды (1,602·10–19), но протон заряжен положительно, а электрон отрицательно.
Каков знак электрического заряда каждой из частей, составляющих атом?
Атом состоит из центрального ядра, положительно заряженного, вокруг которого тяготеют отрицательно заряженные электроны. Атом имеет нейтральный общий заряд, так как число протонов всегда равно числу электронов.
Не забудьте поделиться статьей!
При определении формального заряда молекулы, такой как CoCl2 (газ фосген), необходимо знать число валентных электронов для каждого атома и структуру молекулы Льюиса.
Валентный номер электрона
Посмотрите на каждый атом в периодической таблице элементов, чтобы определить количество валентных электронов.
Помните, что два электрона входят в первую s-оболочку, два электрона — во вторую s-оболочку, шесть электронов — в первую p-оболочку и т. Д. В качестве напоминания: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6)
Отрегулируйте для заряда. Если молекула представляет собой ион, добавьте или вычтите один или несколько электронов в целом, чтобы учесть окончательный заряд.
Для CoCl2 (газообразный фосген): C = 4; О = 6; Cl = 7. Молекула не ионизирована и имеет нейтральный заряд. Следовательно, общее количество валентных электронов равно 4 + 6 + (7×2) = 24.
Структура Льюиса
См. Диаграмму для структуры Льюиса CoCl2 (газ фосген). Структура Льюиса представляет собой наиболее стабильную и вероятную структуру для молекулы. Атомы нарисованы с парными валентными электронами; связи образуются между одинокими электронами для удовлетворения правила октета.
Нарисуйте каждый атом и его валентные электроны, затем сформируйте связи по мере необходимости.
Атомы хлорида имеют одинарные связи с молекулой углерода, в то время как атом кислорода образует двойную связь с углеродом. Каждый атом в конечной структуре удовлетворяет правилу октета и имеет восемь валентных электронов, обеспечивающих молекулярную стабильность.
Официальный заряд каждого атома
-
Расчет формального заряда для молекул, содержащих переходные металлы, может быть сложным. Число валентных электронов для переходных металлов будет таким, которое находится вне ядра, подобного благородному газу.
Подсчитайте одиночные пары каждого атома в структуре Льюиса. Назначьте каждому атому по одному электрону от каждой связи, в которой он участвует. Добавьте эти числа вместе. В CoCl2: C = 0 неподключенных пар плюс 4 электрона из связей = 4 электрона. O = 4 электрона от одиноких пар плюс 2 электрона от связей = 6 электронов. Cl = 6 электронов от одиноких пар плюс 1 электрон от связи с C = 7 электронами.
Вычтите сумму из числа валентных электронов в несвязанном атоме. Результатом является формальный заряд для этого атома. В CoCl2: C = 4 валентных электрона (ve) в несвязанном атоме минус 4 назначенных электрона в структуре Льюиса (Ls) = 0 формальный заряд O = 6 ve — 6 Ls = 0 формальный заряд Cl = 7 ve — 7 Ls = 0 формальный заряд
Запишите эти заряды рядом с атомами в структуре Льюиса. Если общая молекула имеет заряд, заключите в квадратные скобки структуру Льюиса с зарядом, записанным вне скобок в верхнем правом углу.