Строение атома серы

4.6
Средняя оценка: 4.6
Всего получено оценок: 272.
4.6
Средняя оценка: 4.6
Всего получено оценок: 272.
Сера (S) – неметалл, относящийся к группе халькогенов. Строение атома серы легко определить, обратившись к периодической таблице Менделеева.
Строение
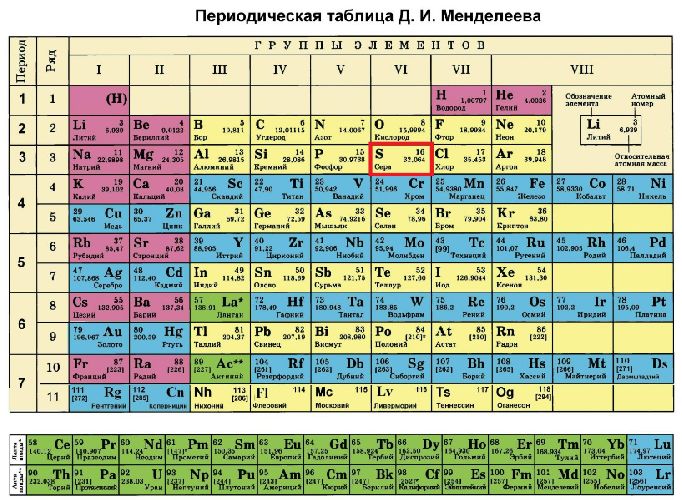
Сера в периодической таблице находится под 16 номером в третьем периоде, VI группе. Относительная атомная масса элемента – 32.
Природная сера имеет несколько изотопов:
- 32S;
- 33S;
- 34S;
- 36S.
Кроме этого, искусственно получено 20 радиоактивных изотопов.
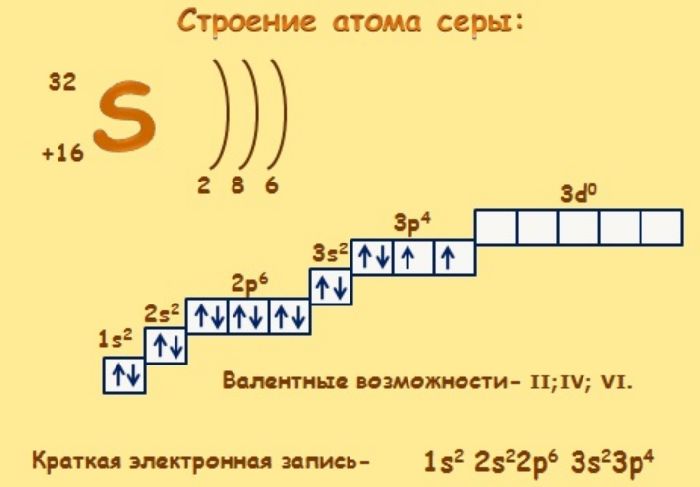
Сера – элемент р-семейства. Атом серы включает ядро с положительным зарядом +16 (16 протонов, 16 нейронов) и 16 электронов, расположенных на трёх электронных оболочках. На внешнем энергетическом уровне находится 6 электронов, которые определяют валентность элемента. До завершения внешнего р-уровня не хватает двух электронов, что определяет степень окисления серы как -2.
Атом серы может переходить в возбуждённое состояние за счёт вакантных 3d-орбиталей (всего пять d-орбиталей). Поэтому атом может проявлять степень окисления +4 и +6.
Отрицательную степень окисления сера проявляет в составе солей – Al2S3, SiS2, Na2S. Четвёртая степень окисления проявляется в реакциях с галогенами (SCl4, SBr4, SF4) и при взаимодействии с кислородом (SO2). Наивысшая степень окисления (+6) проявляется с наиболее электроотрицательными элементами – H2SO4, SF6, SO3.
Электронное строение атома серы – 1s22s22p63s23p4 или +16 S)2)8)6.
Физические свойства
Сера – кристаллическое соединение, которое при нагревании приобретает пластичную форму. Цвет неметалла варьирует от ярко-жёлтого до коричневого. Модификации серы зависят от количества атомов серы в молекуле.
Сера – слабый проводник тепла и электрического тока. Не взаимодействует с водой, но хорошо растворяется в органических растворителях – феноле, бензоле, аммиаке, сероуглероде.
В природе сера встречается в виде самородков и в составе руд, минералов, горных пород. Сера находится в сульфидах, сульфатах, каменном угле, нефти, газе. Серу накапливают бактерии, перерабатывающие сероводород.
Химические свойства
Сера – активный элемент, реагирующий при нагревании практически со всеми элементами, кроме инертных газов и N2, I2, Au, Pt. Сера не взаимодействует с соляной кислотой. Основные реакции серы с элементами описаны в таблице.
|
Взаимодействие |
Продукты реакции |
Пример |
|
С металлами |
Сульфиды |
Cu + S → CuS |
|
С кислородом при 280°С |
Оксид серы |
– S + O2 → SO2; – 2S + 3O2 → 2SO3 |
|
С водородом при нагревании |
Сероводород |
H2 + S → H2S |
|
С фосфором при нагревании в отсутствии воздуха |
Сульфид фосфора |
2P + 3S → P2S3 |
|
С фтором |
Фторид серы |
S + 3F2 → SF6 |
|
С углеродом |
Сероуглерод |
2S + C → CS2 |
|
С кислотами |
Кислота |
S + 2HNO3 → 2NO + H2SO4 |
|
Со щёлочью |
Сульфиды и сульфиты |
3S + 6KOH → K2SO3 + 2K2S + 3H2O |
Сера входит в состав белков. Большое количество серы накапливается в волосах.
Что мы узнали?
Сера – кристаллический неметалл жёлтого цвета. Схема строения атома – +16 S)2)8)6. Проявляет три степени окисления: -2, +4, +6. Известно 24 изотопа серы. Это активный элемент, вступающий в реакцию с металлами и неметаллами. Образует соли – сульфиты и сульфиды, а также серную кислоту. Сера нерастворима в воде и соляной кислоте. Входит в состав живых организмов. В природе находится в свободном и связанном виде.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Котков
5/5
-
Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 272.
А какая ваша оценка?
Сера – элемент VI группы главной подгруппы, 3 периода периодической системы химических элементов Д.И. Менделеева, называемые халькогенами. Рассмотрим особенности строения атома серы. Заряд ядра серы + 16. Так как она находится в третьем периоде, то у нее содержится три энергетических уровня. На первом уровне 2 электрона, на втором 8, на третьем 6. Электронная формула 1s2, 2s2, 2p6, 3s2, 3p4. Как видно из электронно-графической схемы у атома серы до заполнения подуровня не хватает двух электронов, следовательно, она может их принимать, проявляя окислительные свойства. Ввиду того, что у атома серы имеется пустой d-подуровень, то в возбужденном состоянии электроны с s и p подуровня могут переходить на d-подуровень. В таком состоянии сера может отдавать другим атомам либо 4, либо 6 электронов, проявляя восстановительные свойства.
Для серы характерно явление аллотропии. Аллотропные модификации серы – кристаллическая сера: твердое вещество желтого цвета и пластическая сера. При нагревании кристаллическая сера, молекулы которой представляют собой восьмичленные кольца, сначала превращается в легкоподвижную жидкость, затем густеет и при 444 ºС закипает. Если кипящую серу вылить в воду – она превращается в пластическую серу, которая, в свою очередь, при хранении на воздухе превращается назад в кристаллическую.
Сера может проявлять как окислительные, так и восстановительные свойства. Окислительные свойства серы выражены слабее, чем у кислорода. Как окислитель сера взаимодействует с металлами, образуя сульфиды. Например, при взаимодействии серы с натрием образуется сульфид натрия. Сера принимает два электрона от атомов серы, переходя в степень окисления -2. Также сера проявляет окислительные свойства при взаимодействии с водородом. Реакция протекает при нагревании, образуется сероводород. Окислительные свойства серы, а именно её способность взаимодействовать при комнатной температуре с ртутью, применяется для обезвреживания разлитой ртути.
Восстановительные свойства сера проявляет в реакциях кислородом, галогенами и некоторыми сложными веществами. Например, при взаимодействии серы с кислородом образуется оксид серы четыре, а при взаимодействии серы с фтором образуется фторид серы шесть. Из сложных веществ сера может, например, реагировать с концентрированной серной кислотой, переходя в оксид серы четыре. Восстановительные свойства серы применяются в изготовлении пороха, производстве спичек, производстве серной кислоты.
В природе сера находится в идее сульфидов, в самородном виде в виде сульфатов.
Водородное соединение серы – сероводород- бесцветный, ядовитый газ с запахом тухлых яиц. В низких концентрациях используется в медицинских целях. В лабораторных условиях можно получать путем взаимодействия сульфидов с разбавленными кислотами, например, при реакции сульфида цинка с разбавленной соляной кислотой
Так как сера в сероводороде находится в минимальной степени окисления, то сероводород проявляет восстановительные свойства. Например, сероводород горит на воздухе, причем в избытке кислорода образуется оксид серы четыре, а при недостатке кислорода – сера. Также сероводород может взаимодействовать с галогенами, например, с бромом.
Водный раствор сероводорода обладает кислотными свойствами. Поэтому сероводород может взаимодействовать с щелочами, образуя средние соли – сульфиды или кислые соли – гидросульфиды. Качественная реакция на сульфид-ионы – это реакция с нитратом меди (II) или нитратом свинца (II) при этом выпадает осадок черного цвета.
Сера, свойства атома, химические и физические свойства.
S 16 Сера
32,059-32,076 1s2 2s2 2p6 3s2 3p4
Сера — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 16. Расположен в 16-й группе (по старой классификации — главной подгруппе шестой группы), третьем периоде периодической системы.
Атом и молекула серы. Формула серы. Строение атома серы
Изотопы и модификации серы
Свойства серы (таблица): температура, плотность, давление и пр.
Физические свойства серы
Химические свойства серы. Взаимодействие серы. Химические реакции с серой
Получение серы
Применение серы
Таблица химических элементов Д.И. Менделеева
Атом и молекула серы. Формула серы. Строение атома серы:
Сера (лат. Sulfur, из старославянского «сѣра» — «сера, смола», вообще «горючее вещество, жир») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением S и атомным номером 16. Расположен в 16-й группе (по старой классификации – главной подгруппе шестой группы), третьем периоде периодической системы.
Сера – неметалл. Относится к группе халькогенов.
Сера обозначается символом S.
Как простое вещество сера при нормальных условиях представляет собой светло-жёлтое порошкообразное вещество или лимонно-жёлтые кристаллы.
Молекула серы. Сера отличается способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями.
Химическая формула серы чаще всего записывается просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами.
Электронная конфигурация атома серы 1s2 2s2 2p6 3s2 3p4. Потенциал ионизации (первый электрон) атома серы равен 999,59 кДж/моль (10,36001 эВ).
Строение атома серы. Атом серы состоит из положительно заряженного ядра (+16), вокруг которого по четырем оболочкам движутся 16 электрона. При этом 10 электронов находятся на внутреннем уровне, а 6 электронов – на внешнем. Поскольку сера расположена в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома серы на 3s-орбитали находятся два спаренных электрона, на 3p-орбитали – два спаренных и два неспаренных электрона. В свою очередь ядро атома серы состоит из 16 протонов и 16 нейтронов. Сера относится к элементам p-семейства.
Радиус атома серы (вычисленный) составляет 88 пм.
Атомная масса атома серы составляет 32,059-32,076 а. е. м.
Изотопы и модификации серы:
Свойства серы (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Сера |
| 102 | Прежнее название | |
| 103 | Латинское название | Sulfur |
| 104 | Английское название | Sulfur |
| 105 | Символ | S |
| 106 | Атомный номер (номер в таблице) | 16 |
| 107 | Тип | Неметалл |
| 108 | Группа | Халькоген |
| 109 | Открыт | Известна с глубокой древности |
| 110 | Год открытия | 2000 лет до н.э. |
| 111 | Внешний вид и пр. | Светло-жёлтое, порошкообразное вещество или лимонно-жёлтые кристаллы |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | более 30 аллотропных модификаций серы. Из них наиболее известны:
– ромбическая сера (α-сера или α-форма серы) с простой орторомбической кристаллической решёткой, – моноклинная сера (β-сера или β-форма серы) с простой моноклинной кристаллической решёткой, – аморфная сера (пластическая сера), – ромбоэдрическая сера |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,042 % |
| 120 | Содержание в морях и океанах (по массе) | 0,093 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,05 % |
| 122 | Содержание в Солнце (по массе) | 0,04 % |
| 123 | Содержание в метеоритах (по массе) | 4,0 % |
| 124 | Содержание в организме человека (по массе) | 0,2 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 32,059-32,076 а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p4 |
| 203 | Электронная оболочка | K2 L8 M6 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 88 пм |
| 205 | Эмпирический радиус атома* | 100 пм |
| 206 | Ковалентный радиус* | 102,5 пм |
| 207 | Радиус иона (кристаллический) | S2-
170 (6) пм, S4+ 51 (6) пм, S6+ 43 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 180 пм |
| 209 | Электроны, Протоны, Нейтроны | 16 электронов, 16 протонов, 16 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 16-ая группа (по старой классификации – главная подгруппа 6-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -2 , -1, 0 , +1 , +2 , +3, +4 , +5, +6 |
| 302 | Валентность | II, IV, VI |
| 303 | Электроотрицательность | 2,58 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 999,59 кДж/моль (10,36001 эВ) |
| 305 | Электродный потенциал | S22- + 2e– → 2S2-, Eo = -0,524 В,
S + 2e– → S2-, Eo = -0,48 В, 2S + 2e– → S22-, Eo = -0,476 В, 5S + 2e– → S52-, Eo = -0,34 В |
| 306 | Энергия сродства атома к электрону | 200,4101(1) кДж/моль (2,0771042(6) эВ) – сера 32S,
200,4101(2) кДж/моль (2,0771045(12) эВ) – 34S |
| 400 | Физические свойства | |
| 401 | Плотность | 1,92 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – аморфная сера, а также моноклинная сера (β-сера),
2,07 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – ромбическая сера (α-сера), 2,209 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – ромбоэдрическая сера, 1,7988 г/см3 (при 125 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 115,21 °C (388,36 K, 239,38 °F) – ромбическая сера (α-сера),
119,3 °C (392,45 K, 246,74 °F) – моноклинная сера (β-сера) |
| 403 | Температура кипения | 444,6 °C (717,8 K, 832,3 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 1,727 кДж/моль – моноклинная сера (β-сера) |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 45 кДж/моль – моноклинная сера (β-сера) |
| 409 | Удельная теплоемкость при постоянном давлении | 0,708 Дж/г·K (при 25 °C) – ромбическая сера (α-сера),
0,736 (при 25 °C) – моноклинная сера (β-сера) |
| 410 | Молярная теплоёмкость* | 22,75 Дж/(K·моль) |
| 411 | Молярный объём | 16,35969 см³/моль |
| 412 | Теплопроводность | 0,205 Вт/(м·К) (при стандартных условиях) – аморфная сера,
0,27 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | Ромбическая сера (α-сера) |
| 512 | Структура решётки | Простая орторомбическая
|
| 513 | Параметры решётки | a = 10,437 Å, b = 12,845 Å, c = 24,369 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Fddd |
| 517 | Номер пространственной группы симметрии | 70 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7704-34-9 |
Примечание:
201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
205* Эмпирический радиус атома серы согласно [3] составляет 127 пм.
206* Ковалентный радиус серы согласно [1] и [3] составляет 105±3 пм и 102 пм соответственно.
402* Температура плавления ромбической серы (α-серы) согласно [3] и [4] составляет 112,85 °C (386 K, 235,13 °F) и 112,8 °C (385,95 K, 235,04 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) моноклинной серы (β-сера) согласно [4] составляет 1,72 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) моноклинной серы (β-сера) согласно [4] составляет 9,2 кДж/моль.
410* Молярная теплоемкость серы согласно [3] составляет 22,61 Дж/(K·моль).
Физические свойства серы:
Химические свойства серы. Взаимодействие серы. Химические реакции с серой:
Получение серы:
Применение серы:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Sulfur
- https://de.wikipedia.org/wiki/Schwefel
- https://ru.wikipedia.org/wiki/Сера
- http://chemister.ru/Database/properties.php?dbid=1&id=226, http://chemister.ru/Database/properties.php?dbid=1&id=1112
- https://chemicalstudy.ru/sera-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
сера атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле серы
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
2 277
Вася Иванов
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.
Не уверен в ответе?
Найди верный ответ на вопрос ✅ «Посчитать заряд ядра серы. Подробно …» по предмету 📙 Физика, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы