Ionization energy can be defined as the minimum amount of energy required to remove the valence electron i.e. the most loosely bound electron from an isolated gaseous atom or ion. It is important to note the term isolated gaseous atom as if the atom is not isolated, then the energy required may be more due to the interatomic forces.
Let’s learn about Ionization Energy in detail in this article.
What is Ionization Energy?
Ionization Energy is defined as the difficulty in removing the electron from an atom or ion.
X + Δ ⟶ X+ + e−
Ionization is an endothermic process as the energy needs to be supplied in order to remove the electron. The ionization energy increases as the removal of electrons takes place due to the fact that the atom now gains a +ve charge and the electrons are held more tightly. Thus it is difficult to remove an electron from a cation.
Ionization energy or ionization potential is measured in electronvolts (eV) or KJ/mol. eV is a preferred unit in physics while kJ/mol is a preferred unit in chemistry as chemistry generally deals with 1 mole of an atom.
Factors Affecting Ionization Energy
Factors that affect the Ionization Energy of any atom and molecule are:
- If an atom or ion is positively charged then the electrons are more tightly held by the nucleus, so the ionization energy is high.
- If the number of shells is less i.e. the electrons are near to the nucleus then the IE is high and vice versa.
- It is difficult to remove the inner electrons as compared to the outer electrons due to this reason.
- The IE is less when there is more than 1 electron in a shell due to the interelectronic repulsions.
- An atom with lower IE acts as a good reducing agent while those with high IE act as a good oxidizing agent.
Ionization Energy using Bohr’s Atomic Model
According to Bohr’s model of the atom, electrons can exist only in fixed paths called orbits. The electrons revolve around the nucleus in these fixed orbits due to the attraction of the nucleus. Each orbit has its own fixed energy. The electron in a particular orbit is said to possess the energy of the same orbit. If an electron gains energy equal to the energy difference between two orbits then it can jump to the higher orbit whose energy it possesses. This is called the excitation of the electron. If an electron gains enough energy, then it can overcome the attractive force of the nucleus and finally come out of the atom. Such an atom is said to be ionized.
The image given below shows the Ionization energy of the electron.
Ionization Energy Formula
Thus the ionization energy is the energy difference between the energy of the electron in the initial orbit and the energy of the electron outside the atom (infinite orbit in this case).
According to Bohr, the energy of an electron in the nth orbit is given by:
where,
m is mass of one electron,
e is charge on one electron,
h is Planck’s constant,
Z is atomic number,
n is the orbit from which electron is removedThis formula can be rewritten as,
En =−R × n2 / Z2
En = −13.6 × n2 / Z2 eV / atom
This is the energy of the atom in the nth orbit. Now we said that the ionization energy is the energy difference between the energy of the electron in the initial orbit and the energy of the electron in the infinite orbit. Thus we can consider the initial orbit as n1 = n and the final orbit as n2 = ∞.
IE = En2 − En1 = ΔE
As
This formula is known as the ionization energy formula. Note that the IE is the same as the energy of the electron in the nth orbit but positive in sign. This is due to the fact that the energy is supplied to remove the electron and thus it has a positive sign.
How to Determine the Ionization Energy of an Element?
The Ionization Energy of an Element of an element is calculated using the steps given below,
Step 1: First write the atomic number of the atom for which the Ionization energy has to be found.
Step 2: Determine ‘n’ the value of the orbit for which ionization energy is to be found.
Step 3: Use the formula for finding the Ionization Energy. En = −13.6 × n2 / Z2 eV / atom
Step 4: Substitute all the values in the above formula and simplify to get Ionization Energy in electron volts.
Successive Ionization Energies
An atom can have any number of ionization energies depending on the number of electrons it has.
First Ionization Energy
Energy required to remove the first outermost electron from a neutral atom is known as the first IE. The first IE is equal to the energy of the electron in that particular orbit.
Second Ionization Energy
The energy required to remove the second electron from an atom with +1 charge is called second IE and so on. The second Ionization energy is always higher than the first IE as it is difficult to remove the electron from a positively charged ion.
X + ΔH1 ⟶ X+ + e−
where ΔH1 = First IE
X+ + ΔH2 ⟶ X+2 + e−
where ΔH2 = Second IE
The IE keeps on increasing as the charge on the atom increases. Thus the third IE is higher than the second and the second IE is higher than the first IE.
ΔH1 < ΔH2 < ΔH3 …… < ΔHn
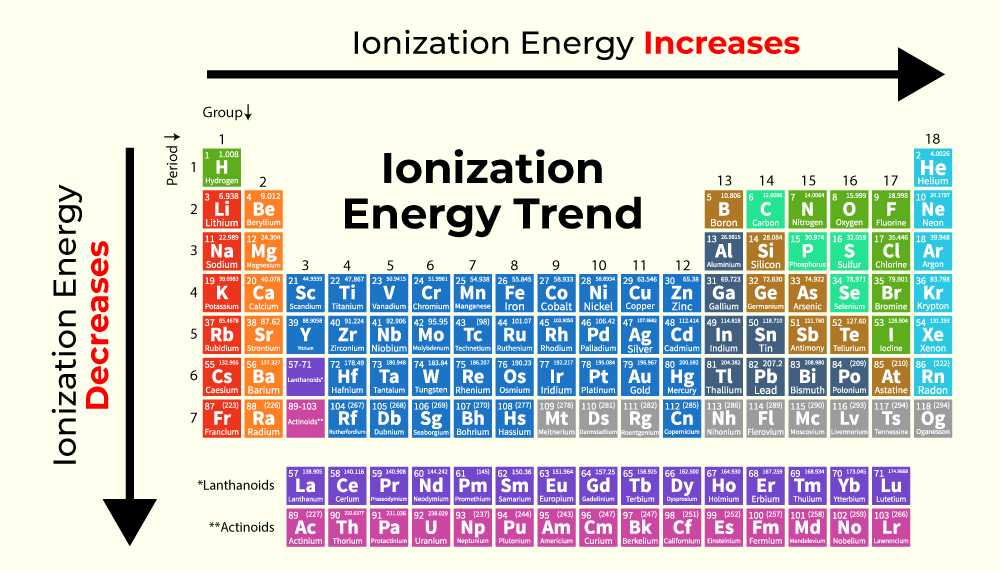
Ionization Energy Trends in Periodic Table
Ionization Energy follows a specific trend while moving from Left to Right and Top to Bottom in the periodic table.
The image given below shows the trend of variation of Ionization Energy while moving left to right and top to bottom in the periodic table.
Left to Right in a Period
As we move from left to right in a period in the periodic table the atomic radius decreases. It is due to the reason that the elements start gaining near noble gas configuration as we move across the period. Due to this interelectronic repulsion is reduced and the atomic radius decreases. Hence the electrons are more tightly held by the nucleus. Hence a higher amount of energy is required to remove the electrons. Thus IE increases as we move across a period.
Top to Bottom in a Group
As we move from top to bottom in a group, new shells are added up and the electrons start to occupy higher orbitals and shells. Thus the atomic radius also increases. The electrons are now far away from the nucleus. So lesser amount of energy is required to remove the electron. Thus IE decreases as moves down a group.
Read More,
- Nuclear Binding Energy
- Molecules and Compounds
- Gram Atomic and Gram Molecular Mass
Solved Example on Ionization Energy
Example 1: Calculate the ionization energy of the Hydrogen atom if the electron is in the second orbit.
Solution:
For hydrogen given, Z = 1, n = 2
Thus,
ΔE = 13.6 × n2 / Z2
= 13.6 × 1/4
= 3.4 eV
Example 2: Find the IE required to remove the outermost electron from the Sodium atom.
Solution:
For Sodium, Z=11 and n=3 for outermost electron
Thus,
ΔE = 13.6 × n2 / Z2
= 13.6 × 121/9
= 182.844 eV
Example 3: Calculate the wavelength of radiation required to ionize the Na atom if it is known that the ionization energy of Na is 496 kJ/mol.
Solution:
Given,
ΔE = 496 kJ/mol,
λ = ?
We know that E = hc / λ
496 = (6.6 × 10−34 × 3 × 108) / λ
λ = 3.99 ×10−28 ms−1
Example 4: The first, second, and third ionization energies of Aluminium are 578, 1817, and 2745 kJ/mol. Calculate the ionization energy required to convert Al ion to Al3+.
Given,
ΔH1 = 578, ΔH2 = 1817, ΔH3 = 2745
Al + ΔE ⟶ Al3+
ΔE = ΔH1 + ΔH2 + ΔH3
ΔE = 578+1817+2745
= 5140 kJ/mol
FAQs on Ionization Energy
Q1: What is Ionization Energy?
Answer:
Ionization energy can be defined as the minimum amount of energy required to remove the valence electron i.e. the most loosely bound electron from an isolated gaseous atom or ion.
Q2: What factors govern Ionization Energy?
Answer:
Factors governing ionization energy are,
- If an atom or ion is positively charged then the electrons are more tightly held by the nucleus, so the ionization energy is high.
- If the number of shells are less i.e. the electrons are near to the nucleus then the IE is high and vice versa.
- The IE is less when there are more than 1 electrons in a shell due to the inter electronic repulsions.
Q3: Why does the ionization energy increase with the increase in charge?
Answer:
As the charge on the atom increases, the inter electronic repulsions become less. Thus the electrons are more closer to the nucleus and held more tightly. Thus it becomes difficult to remove the electron and hence the ionization energy increases with the increase in charge of the atom.
Q4: Which has the highest ionization energy between nitrogen and oxygen?
Answer:
Nitrogen has the highest ionization energy between nitrogen and oxygen as nitrogen has half-filled electronic configuration so it requires more energy to extract electrons from the Nitrogen’s orbit.
Q5: Which of the following element has the highest first ionization energy He+, Li+2, Be+3
Answer:
As we can see that all these ions have one electron each. So we will compare their nuclear charge because higher the nuclear charge, higher is the IE because electrons are more tightly held by the nucleus.
Thus, Be+3 has ionization Energy.
Энергия ионизации — это количество энергии, которое изолированный атом в основном электронном состоянии должен поглотить для освобождения электрона, в результате чего образуется ион.
Эта величина обычно выражается в кДж/моль или количество, необходимое для того, чтобы потерять один электрон.
Образование ионов
Ионы — это атомы, которые получили или потеряли электроны. Образуется ионизирующее излучение со своими положительными и отрицательными особенностями для человека.
Чем больше отрицательно заряженных элементарных частиц потеряно, тем более положительным будет этот ион, тем труднее отделить другие электроны от этого атома.
В общем, чем дальше электрон от ядра, тем легче его изгнать. Другими словами, энергия ионизации является функцией атомного радиуса: чем больше радиус, тем меньше количество работы, необходимой для удаления электрона с внешней орбитали. Например, было бы гораздо легче забрать электроны от более крупного элемента Ca (кальция), чем от того, где они крепче удерживаются к ядру как Cl (хлор).
В химической реакции, понимание энергии ионизации важно для того, чтобы понять поведение различных атомов при связях друг с другом.
Например, энергия ионизации натрия (щелочного металла) составляет 496 кДж/моль, тогда как хлора — 1251,1 кДж/моль.
Элементы, находящиеся близко друг к другу в периодической таблице, или элементы, не имеющие большой разницы в энергии ионизации, образуют полярные ковалентные или ковалентные связи. Например, углерод и кислород делают СО2 (углекислый газ) находящиеся близко один к другому на периодической таблице. Они поэтому формируют ковалентное скрепление. Углерод и хлор образуют CCl4 (четыреххлористый углерод) другой молекулой, которая ковалентно связана.
Периодическая таблица и тренд ионизации
Энергия ионизации зависит от атомного радиуса. Так как идя справа налево по периодической таблице, атомный радиус увеличивается, а энергия ионизации уменьшается слева направо в периодах и вниз по группам.
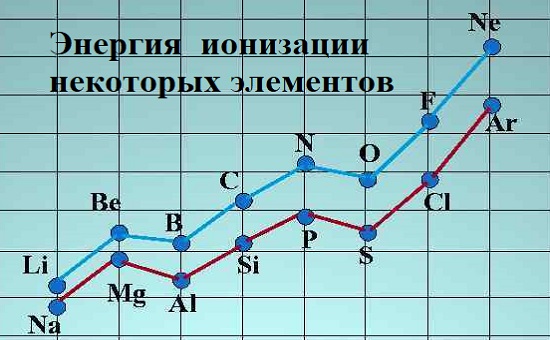
Объяснение шаблона в первых нескольких элементах
Водород имеет электронную структуру 1s1. Это очень маленький атом, и электрон приближается к ядру и, следовательно, притягивает. Нет электронов, экранирующих его от ядра, поэтому энергия ионизации высока 1310 кДж моль-1.
Гелий имеет структуру 1s2. Электрон удаляется с той же орбиты, что и в случае с водородом он близок к ядру. Значение 2370 кДж моль-1 намного выше, чем у водорода, потому что ядро теперь имеет 2 протона, притягивающие их вместо 1.
Литий — 1s22s1. Свой внешний электрон находится на втором энергетическом уровне, гораздо более удаленнее от ядра. Можно утверждать, что это было бы компенсировано дополнительным протоном в ядре, но электрон не чувствует полной тяги ядра — он экранируется.
Если сравнить литий с водородом (а не с гелием), электрон водорода также чувствует тягу 1+ от ядра, но расстояние намного больше с литием. Первая энергия ионизации лития падает до 519 кДж моль-1, тогда как водород составляет 1310 кДж моль-1.
Исключения из этой тенденции наблюдаются для щелочноземельных металлов (группа 2: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra), унбинилий (Ubn) и элементов группы азота (группа 5: азот (N); фосфор (P); мышьяк (As); сурьма (Sb); висмут (Bi)). Группы 2 и 5 имеют полностью и наполовину заполненную электронную конфигурацию соответственно, поэтому для удаления отрицательно заряженных элементарных частиц из полностью заполненных орбиталей требуется больше работы, чем из неполнозаполненных.
Щелочные металлы (группа I) обладают малой энергией ионизации, особенно по сравнению с галогенами или группой VII.
В дополнение к радиусу (расстоянию между ядром и электронами на самой внешней орбите), количество электронов между ядром, в самой внешней оболочке, также влияет на энергию ионизации.
Этот эффект, при котором полный положительный заряд ядра не ощущается внешними электронами из-за отрицательных зарядов внутренних, частично отменяющих положительный заряд, называется экранированием.
Чем больше электронов защищает внешнюю электронную оболочку от ядра, тем меньше работы требуется для вытеснения отрицательно заряженной элементарной частицы из указанного атома.
Чем выше эффект экранирования требуется меньше приложить работы. Из-за экранирующего эффекта энергия ионизации уменьшается сверху вниз в группе. Из таблицы Менделеева видно что Цезий имеет низкую, а фтор самую высокую энергию ионизации (за исключением гелия и неона).
Для чего необходимо знать про эту величину
Падение энергии ионизации при движении вниз таблицы приводит к снижению энергии активации и, следовательно, к более быстрым реакциям.
Энергия ионизации являются одним из наиболее важных факторов, которые необходимо учитывать при оценке прочности химических связей и прогнозировании того, как химические вещества будут связываться друг с другом. Но это не свободная энергия.
Энергия ионизации
Энергия,
необходимая для удаления одного моля
электронов от одного моля атомов какого
либо элемента, называется первой энергией
ионизации.
В результате ионизации атомы превращаются
в положительно заряженные ионы. Энергию
ионизации выражают либо в кДж/моль, либо
эВ.
Энергия
ионизации характеризует восстановительную
способность элемента. Первая энергия
ионизации определяется электронным
строением элементов и ее изменение
имеет периодический характер. Энергия
ионизации возрастает по периоду.
Наименьшие значения энергии ионизации
имеют щелочные элементы, находящиеся в
начале периода, наибольшими значениями
энергии ионизации характеризуются
благородные газы, находящиеся в конце
периода.
В
одной и той же группе энергия ионизации
несколько уменьшается с увеличением
порядкового номера элемента, что
обусловлено увеличением размеров атомов
и расстояния внешних подоболочек от
ядра.
Энергетический
эффект присоединения моля электронов
к молю нейтральных атомов называется
сродством к электрону.
Для
характеристики способности атомов в
соединениях притягивать к себе электроны
введено понятие электроотрицательности
(ЭО). Учитывая, что эта способность атомов
зависит от типа соединений, валентного
состояния элементов, эта характеристика
имеет условный характер. Однако ее
использование полезно для объяснения
типа химических связей и свойств
соединений.
СРОДСТВО
К ЭЛЕКТРОНУ —
свойство атомов или молекул образовывать
прочную связь с электроном, т.
е. отрицательный
ион.
Характеристикой такой связи является
энергия сродства атомов или молекул к
электрону — энергия
связи электрона
в соответствующем отрицат. ионе, к-рая
обычно обозначается ЕА (electron affinity). Эта
энергия равна разности энергии
нейтрального атома (молекулы) восновном
состоянии и
энергии осн. состояния образовавшегося
отрицат. иона. У большинства атомов С.
к э. связано с тем, что их внеш. электронные
оболочки не заполнены (см. Атом ).В
табл. приводятся значения энергии С. к
э. атомов в осн. состоянии. Осн. и наиб.
точная часть этой информации получена
при исследовании фотораспада отрицат.
ионов. В одном варианте этого метода
отрицат. ионы разрушаются под действием
лазерного излучения данной длины волны,
энергия связи электрона устанавливается
по измерениям энергии освободившихся
электронов. В др. варианте данного метода
для фоторазрушения отрицат. ионов
используется излучение перестраиваемого
лазера, что позволяет определить
положение порога фотораспада отрицат.
иона, а по нему и энергию связи электрона.
Фотоэлектронный и лазерный методы
определения энергии связи электрона в
отрицат. ионе являются главными и при
исследовании молекулярных отрицат.
ионов. В табл. указан класс точности
определения энергии С. к э.: О означает
точность лучше 0,1%, 1 -лучше 1%; 2 — лучше
3%; 3 — выше 10%; 4 — хуже 10%. Отрицат. ион Не
построен на метастабильном атоме Не.
«Нет» в табл. означает, что стабильный
отрицат. ион данного элемента не
образуется.
Электpоoтрицательность
χ (греч. хи) — способность атома
удерживать внешние (валентные) электроны.
Она определяется степенью притяжения
этих электронов к положительно заряженному
ядру. Это свойство проявляется в
химических связях как смещение
электронов связи в сторону более
электроотрицательного атома.
Электpоотрицательность атомов, участвующих
в образовании химической связи, – один
из главных факторов, который определяет
не только ТИП, но и СВОЙСТВА этой связи,
и тем самым влияет на характер
взаимодействия между атомами при
протекании химической реакции.
В шкале относительных
электроотрицательностей
элементов Л. Полинга (составленной
на основе энергий связей двухатомных
молекул) металлы и элементы-органогены
располагаются в следующий ряд:
|
Элемент |
K |
Na |
Li |
Mg |
H |
S |
C |
I |
Br |
Cl |
N |
O |
F |
|
χ |
0.8 |
0.9 |
1.0 |
1.2 |
2.1 |
2.5 |
2.5 |
2.5 |
2.8 |
3.0 |
3.0 |
3.5 |
4.0 |
Элeктроотрицательность
элементов подчиняется периодическому
закону: она растет слева направо в
периодах и снизу вверх в главных
подгруппах Периодической системы
элементов Д.И. Менделеева.
Электроотрицательность
не является абсолютной
константой элемента. Она зависит от
эффективного заряда ядра атома, который
может изменяться под влиянием соседних
атомов или групп атомов, типа атомных
орбиталей и характера их гибридизации.
А́ТОМНЫЕ
РА́ДИУСЫ,
характеристики, позволяющие приближенно
оценивать межатомные (межъядерные)
расстояния в молекулах и кристаллах.
Под эффективным радиусом атома или иона
понимается радиус сферы его действия,
причем атом (ион) считается несжимаемым
шаром. Используя планетарную модель
атома, его представляют как ядро, вокруг
которого по орбиталям вращаются
электроны. Последовательность элементов
в Периодической системе Менделеева
соответствует последовательности
заполнения электронных оболочек.
Эффективный радиус иона зависит от
заполненности электронных оболочек,
но он не равен радиусу наружной орбиты.
Для определения эффективного радиуса
представляют атомы (ионы) в структуре
кристалла как соприкасающиеся жесткие
шары, так что расстояние между их центрами
равно сумме радиусов. Атомные и ионные
радиусы определены экспериментально
по рентгеновским измерениям межатомных
расстояний и вычислены теоретически
на основе квантово-механических
представлений.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
В этой статье обсуждается график энергии ионизации. Ионизация, как следует из названия, связана с ионами или электронами.
Нам нужно некоторое количество энергии, чтобы удалить из атома свободно упакованные электроны. Эта энергия называется энергией ионизации. Подробнее об этой энергии мы поговорим в этой статье. Мы даже обсудим разные графики ионизации для разных атомов.
- График ионизации фосфора
- График ионизации натрия
- График ионизации магниевый
- График ионизации Бор
- График ионизации углерод
- График ионизации алюминий
- График ионизации Сера
Что такое энергия ионизации?
Как обсуждалось в предыдущем разделе, количество энергии, необходимое для удаления наиболее слабо упакованного электрона атома, называется энергией ионизации этого атома. Предположим, электрон находится вблизи ядра.
Сила ядерного притяжения для этого электрона очень велика. Поэтому потребуется больше энергии, чтобы вырвать этот электрон из-под влияния ядра. Следовательно, для удаления этого электрона потребуется больше энергии ионизации. Это связано с тем, что сила притяжения ядра очень высока, и для того, чтобы приблизиться к нему, потребуется больше энергии, чтобы вырваться из его поля притяжения. Мы увидим больше о графиках энергии ионизации различных атомов в следующих разделах.
Что такое атомный номер?
Атомная структура имеет определенное количество протонов и определенное количество электронов. Однако количество электронов можно легко изменить. Следовательно, атомный номер рассматривается как общее количество протонов, присутствующих внутри атома. Это отпечаток этого химического элемента. Обозначается буквой Z.
Атомный номер является важной величиной, поскольку он помогает идентифицировать элемент, а также используется для определения массового числа атома. Атомный номер можно рассматривать как отпечаток пальца атома, поскольку каждый химический элемент имеет уникальный атомный номер.
Что такое массовое число?
Массовое число или атомное массовое число можно определить как сумму атомного номера Z и количества нейтронов N. Массовое число обозначается буквой А.
Массовое число почти равно атомной массе элемента. Хотя массовое число различно для разных изотопов элемента. Мы обсудим изотопы в следующих разделах этой статьи.
Что такое изотопы?
Изотопы имеют одинаковое количество протонов, но разные массы, что указывает на то, что у них разное количество нейтронов.
Мы знаем, что атомный номер уникален для химического элемента. Следовательно, можно сказать, что изотопы принадлежат к одному и тому же семейству элементов. Поскольку массовое число различно, атомные массы этих изотопов отличаются друг от друга. Есть еще один термин, называемый изомерами, которые имеют одинаковое количество атомов, но разные по свойствам.
Сравнение энергий ионизации атомов в периодической таблице
Энергии ионизации разных атомов в периодической таблице различны. Эти энергетические тенденции приведены в разделе ниже:
- Значение энергии ионизации увеличивается по мере продвижения слева направо по таблице Менделеева.
- Значение энергии ионизации уменьшается по мере продвижения сверху вниз по периодической таблице.
Типы энергии ионизации
По мере удаления электрона из атома энергия ионизации продолжает увеличиваться. Различные типы энергии ионизации в зависимости от количества удаляемых электронов приведены в разделе ниже.
- 1st энергия ионизации– Энергия, необходимая для отрыва первого электрона от атома.
- 2nd энергия ионизации– Когда один электрон уже удален, а другой электрон должен быть удален, то энергия, необходимая для удаления этого электрона, называется 2nd энергия ионизации.
- 3rd энергия ионизации– Когда у атома уже не хватает двух электронов и нужно убрать третий электрон. Тогда энергия, необходимая для удаления этого третьего электрона, называется третьей энергией ионизации.
Факторы, влияющие на энергию ионизации
Энергия ионизации не является самостоятельной величиной. Его значение зависит от многих факторов. Эти факторы указаны в разделе, приведенном ниже:
- Конфигурация электронов – Энергия ионизации большинства электронов определяется конфигурацией электронов, поскольку конфигурация в основном определяет характеристики атома.
- Ядерный заряд– Нам хорошо известно влияние заряда ядра на энергию ионизации электрона. При большем влиянии заряда ядра на электроны энергия ионизации, необходимая для удаления электрона, будет больше, и наоборот, также верно, то есть при меньшем влиянии заряда ядра на электроны будет меньше энергия ионизации, необходимая для отрыва электрона. атома.
- Количество электронных оболочек – Количество электронных оболочек напрямую говорит нам о радиусе атома. Чем больше радиус атома, тем дальше будет самый удаленный от ядра электрон. Следовательно, электрону, находящемуся в атоме с большим количеством оболочек, будет легче вырваться. Если количество оболочек меньше, значит радиус мал и электрон ближе к ядру, значит, потребуется больше силы, чтобы вывести электрон из-под влияния ядра.
- Эффективный заряд ядра– Чем больше тенденция к проникновению электронов и чем больше значение электронного экранирования, тем меньше суммарное влияние заряда ядра на электрон. Следовательно, потребуется меньшая энергия ионизации, чтобы вырвать электрон из этого атома. Точно так же, если чистый эффективный заряд ядра больше, чем количество энергии ионизации, необходимой для удаления электрона из атома, также будет больше.
- Стабильность – Каждый атом находит способ быть в максимально стабильном состоянии. Если атом стабилен, то потребуется очень большая энергия ионизации, чтобы вырвать электрон из атома. Это происходит так, что в благородных газах удаление электрона сделает атом очень нестабильным. Следовательно, атом будет пытаться сопротивляться захвату электрона.
График энергии первой ионизации
График первой ионизации строится с использованием значений энергии первой ионизации и атомных номеров различных химических элементов. Этот график показывает тенденции в периодической таблице энергии первой ионизации.
Ниже приведены некоторые важные моменты, касающиеся первого энергия ионизации график-
- Важно отметить, что первая энергия ионизации увеличивается по мере продвижения слева направо в периодической таблице и достигает своего пика в благородных газах. Это потому, что электроны добавляются в одну и ту же оболочку. Радиус атома продолжает уменьшаться, делая электроны восприимчивыми к действию ядерного заряда.
- По мере продвижения вниз первое значение ионизации немного уменьшается по сравнению с предыдущим элементом, расположенным прямо над текущим элементом. Это происходит потому, что при движении вниз добавляется дополнительная электронная оболочка. Это увеличивает атомный радиус и уменьшает влияние заряда ядра на электроны.
- Затем он снова увеличивается с увеличением атомного номера, пока не появится следующий благородный газ. Благородные газы имеют самую высокую энергию ионизации из-за их более высокой стабильности.

Изображение кредита: Двойной диез, Первые блоки энергии ионизации, CC BY-SA 4.0
График второй энергии ионизации
График второй энергии ионизации построен с использованием значений второй энергии ионизации и атомных номеров.
Тенденция второй энергии ионизации такая же, как у первой энергии ионизации, с той лишь разницей, что значение второй энергии ионизации несколько выше, чем первая энергия ионизации. Тенденции следующие:
- Значение второй энергии ионизации увеличивается по мере продвижения слева направо в таблице Менделеева.
- Значение достигает своего максимума для благородного газа.
- При движении вниз значение второй энергии ионизации уменьшается, затем при движении вправо начинает увеличиваться.
Третий график энергии ионизации
Когда атому уже не хватает двух электронов и нам нужно вырвать третий электрон, тогда мы можем получить энергию, необходимую для удаления этого электрона, которая называется третьей энергией ионизации. График третьей энергии ионизации построен с использованием значений третьей энергии ионизации и атомного номера.
Тенденции, за которыми следуют первая и вторая энергии ионизации, такие же, как и для третьей энергии ионизации. Разница лишь в том, что третья энергия ионизации самая высокая среди всех. Тенденции следующие:
- Третья энергия ионизации будет увеличиваться, если мы будем двигаться вправо в таблице Менделеева.
- Значение третьей энергии ионизации уменьшается, если мы движемся к нижней части таблицы Менделеева.
- Значение третьей энергии ионизации становится максимальным для благородных газов.
График энергии ионизации фосфора
Атомный номер фосфора равен 15. Это означает, что общее количество электронов в его атоме равно 15. Значения десяти энергий ионизации фосфора приведены ниже:
- Энергия первой ионизации — 1011.81
- 2nd энергия ионизации- 1907
- Третья энергия ионизации- 2914
- Энергия четвертой ионизации — 4963.6
- Пятая энергия ионизации — 6273
- Шестая энергия ионизации — 21,267 XNUMX
- Седьмая энергия ионизации — 25,341 XNUMX
- Восьмая энергия ионизации — 29,872 XNUMX
- Девятая энергия ионизации — 35,905 XNUMX
- Десятая энергия ионизации — 40,950 XNUMX
График энергии ионизации натрия
Атомный номер натрия 11. Натрий представлен как Na. Это один из самых летучих элементов в периодической таблице. Ниже приведены значения десяти энергий ионизации натрия.
- Энергия первой ионизации — 496
- 2nd энергия ионизации- 4562
- Третья энергия ионизации- 6910
- Энергия четвертой ионизации — 9542
- Пятая энергия ионизации — 13354
- Шестая энергия ионизации — 16613 XNUMX
- Седьмая энергия ионизации-20117
- Восьмая энергия ионизации — 25496 XNUMX
- Девятая энергия ионизации — 28392 XNUMX
- Десятая энергия ионизации — 141362 XNUMX
График энергии ионизации магния
Атомный номер магния равен 12. Значения первых десяти энергий ионизации магния приведены ниже:
- Энергия первой ионизации — 737
- 2nd энергия ионизации- 1450
- Третья энергия ионизации- 7732
- Энергия четвертой ионизации — 10542
- Пятая энергия ионизации — 13630
- Шестая энергия ионизации — 18020 XNUMX
- Седьмая энергия ионизации — 21711 XNUMX
- Восьмая энергия ионизации — 25661 XNUMX
- Девятая энергия ионизации — 31653 XNUMX
- Десятая энергия ионизации — 35458 XNUMX
График энергии ионизации бора
Атомный номер бора равен 5. Следовательно, у него есть только пять электронов, которые могут быть взяты из атома. Первые пять энергий ионизации бора приведены ниже:
- Энергия первой ионизации — 800
- Вторая энергия ионизации — 2427
- Третья энергия ионизации — 3659
- Четвертая энергия ионизации — 25025
- Пятая энергия ионизации — 32826
График энергии ионизации углерода
Атомный номер углерода равен 6. Это означает, что у него есть только шесть электронов, которые можно удалить из атома. Ниже приведены первые шесть энергий ионизации углерода.
- Энергия первой ионизации — 1086
- Вторая энергия ионизации — 2352
- Третья энергия ионизации- 4620
- Энергия четвертой ионизации — 6222
- Пятая энергия ионизации — 37831
- Шестая энергия ионизации — 47277 XNUMX
График энергии ионизации алюминия
Атомный номер алюминия — 13. У него есть 13 электронов в атоме, которые можно удалить. Первые десять энергий ионизации алюминия приведены ниже:
- Энергия первой ионизации — 577
- 2nd энергия ионизации- 1816
- Третья энергия ионизации- 2744
- Энергия четвертой ионизации — 11577
- Пятая энергия ионизации — 14842
- Шестая энергия ионизации — 18379 XNUMX
- Седьмая энергия ионизации — 23326 XNUMX
- Восьмая энергия ионизации — 27465 XNUMX
- Девятая энергия ионизации — 31853 XNUMX
- Десятая энергия ионизации — 38473 XNUMX
График энергии ионизации серы
Атомный номер серы равен 16. Первые десять энергий ионизации серы приведены ниже:
- Энергия первой ионизации — 999
- 2nd энергия ионизации- 2252
- Третья энергия ионизации- 3357
- Энергия четвертой ионизации — 4556
- Пятая энергия ионизации — 7004.3
- Шестая энергия ионизации — 8495 XNUMX
- Седьмая энергия ионизации — 27107 XNUMX
- Восьмая энергия ионизации — 31709 XNUMX
- Девятая энергия ионизации — 36621 XNUMX
- Десятая энергия ионизации — 43177 XNUMX
График последовательной энергии ионизации
Последовательные графики ионизации элемента относятся к графику, построенному с использованием различных значений энергии ионизации (1ул, 2nd и т.д.).
Значение энергии последовательной ионизации увеличивается по мере того, как следующий электрон всегда находится ближе к ядру, и, следовательно, для удаления этого электрона требуется больше энергии. По мере того, как мы продолжаем удалять электроны, энергия ионизации продолжает увеличиваться в газе, влияние ядра становится сильнее и сильнее.
График зависимости атомного номера от энергии ионизации
Сам график энергии ионизации представляет собой график, построенный с использованием значений энергии ионизации и атомного числа элементов.
Атомные номера написаны на горизонтальной оси, которая является осью X. Энергия ионизации отложена по вертикальной оси, то есть по оси Y. По мере того, как мы идем вправо в таблице Менделеева, нам требуется более высокая энергия ионизации, чтобы удалить электрон из атома, поэтому энергия ионизации увеличивается, когда мы идем вправо. Он достигает максимального значения для инертных газов и уменьшается по мере продвижения вниз по таблице Менделеева.
|
|
Эта статья поднимает множество проблем. Пожалуйста помоги Улучши это или обсудите эти вопросы на страница обсуждения. (Узнайте, как и когда удалить эти сообщения-шаблоны)
(Узнайте, как и когда удалить этот шаблон сообщения) |
Периодические тренды энергии ионизации в зависимости от атомный номер. В каждом из семи периодов энергия ионизации минимальна для первого столбца периодической таблицы ( щелочных металлов ) и увеличивается до максимума для последнего столбца ( благородные газы ). Максимальная энергия ионизации уменьшается от первой до последней строки в данном столбце из-за увеличения расстояния внешней электронной оболочки от ядра по мере добавления внутренних оболочек.
В физика и химия, энергия ионизации (Американский английский орфография) или энергия ионизации (Британский английский орфография) — это минимальное количество энергии, необходимое для удаления наиболее слабо связанного электрон изолированного нейтрального газообразного атом или молекула.[1] Количественно это выражается как
- X (г) + энергия ⟶ X+(г) + е−
где X — любой атом или молекула, X+ — ион с удаленным одним электроном, а e− удаленный электрон.[2] Обычно это эндотермический процесс. Как правило, чем ближе крайние электроны к ядро атома, тем выше энергия ионизации атома.
Физические и химические науки используют разные единицы для энергии ионизации.[3] В физике единицей измерения является количество энергии, необходимое для удаления одного электрона из отдельного атома или молекулы, выраженное как электронвольт. В химии единицей измерения является количество энергии, необходимое для всех атомов в моль вещества потерять по одному электрону каждый: молярная энергия ионизации или приблизительно энтальпия, выраженный как килоджоули на моль (кДж / моль) или килокалории на моль (ккал / моль).[4]
Сравнение энергий ионизации атомов в периодическая таблица показывает два периодические тенденции которые следуют правилам Кулоновское притяжение:[5]
- энергия ионизации обычно увеличивается слева направо в пределах заданного период (то есть ряд).
- энергия ионизации обычно уменьшается сверху вниз в данном группа (то есть столбец).
Последняя тенденция является следствием внешнего электронная оболочка постепенно удаляясь от ядра, с добавлением одной внутренней оболочки в ряд по мере движения вниз по столбцу.
В пэнергия ионизации относится к количеству энергии, необходимому для удаления электрона из частиц, имеющих заряд (п-1). Например, первые три энергии ионизации определяются следующим образом:
- 1-я энергия ионизации — это энергия, при которой происходит реакция X ⟶ X+ + е−
- 2-я энергия ионизации — это энергия, которая обеспечивает реакцию X+ ⟶ X2+ + е−
- Третья энергия ионизации — это энергия, при которой происходит реакция X2+ ⟶ X3+ + е−
Период, термин потенциал ионизации это старое название энергии ионизации,[6] поскольку самый старый метод измерения энергии ионизации был основан на ионизации образца и ускорении удаляемого электрона с помощью электростатический потенциал. Однако сейчас этот термин считается устаревшим.[7]
Наиболее заметные факторы, влияющие на энергию ионизации, включают:
- Электронная конфигурация: это составляет IE большинства элементов, так как все их химические и физические характеристики могут быть установлены просто путем определения их соответствующей электронной конфигурации.
- Ядерный заряд: если ядерный заряд (атомный номер ) больше, электроны более плотно удерживаются ядром и, следовательно, энергия ионизации будет больше.
- Количество электронные оболочки: если размер атома больше из-за наличия большего количества оболочек, электроны удерживаются ядром менее плотно и энергия ионизации будет меньше.
- Эффективный ядерный заряд (Zэфф): если величина электрона защита и проникновение больше, электроны менее плотно удерживаются ядром, Zэфф электрона и энергия ионизации меньше.[8]
- Тип орбитальный ионизированный: атом, имеющий более стабильный электронная конфигурация имеет меньшую тенденцию к потере электронов и, следовательно, имеет более высокую энергию ионизации.
- Электронная занятость: если занята самая высокая орбитальный вдвойне занята, то легче удалить электрон.
Другие второстепенные факторы включают:
- Релятивистские эффекты: более тяжелые элементы (особенно те, чьи атомный номер больше 70), так как их электроны приближаются к скорости света и, следовательно, имеют меньший атомный радиус / более высокий IE.
- Сокращение лантаноидов и актинидов (и сжатие скандидов): беспрецедентное сжатие элементов влияет на энергию ионизации, поскольку чистый заряд ядра ощущается сильнее.
- Энергии электронных пар и обменять энергию: они будут учитывать только полностью заполненные и наполовину заполненные орбитали. Распространенное заблуждение состоит в том, что «симметрия» играет роль; хотя до сих пор никто не завершил свои доказательства.
Определение энергии ионизации
Аппарат для измерения энергии ионизации.
Энергия ионизации атомов, обозначенная Eя, измеряется[9] найдя минимальную энергию световых квантов (фотоны ) или электроны, ускоренные до известной энергии, которая выбьет наименее связанные атомные электроны. Измерение проводится в газовой фазе на отдельных атомах. В то время как только благородные газы встречаются в виде одноатомных газов, другие газы можно разделить на отдельные атомы.[нужна цитата ] Кроме того, многие твердые элементы можно нагреть и испарить до отдельных атомов. Одноатомный пар содержится в предварительно откачанной трубке, которая имеет два параллельных электрода, подключенных к источнику напряжения. Ионизирующее возбуждение вводится через стенки трубки или создается внутри.
Когда используется ультрафиолетовый свет, длина волны снижается до ультрафиолетового диапазона. При определенной длине волны (λ) и частоте света (ν = c / λ, где c — скорость света) световые кванты, энергия которых пропорциональна частоте, будут иметь энергию, достаточно высокую, чтобы вытеснить наименее связанные электроны. . Эти электроны будут притягиваться к положительному электроду, а положительные ионы, оставшиеся после фотоионизация будут притягиваться к отрицательно заряженному электроду. Эти электроны и ионы создают ток через трубку. Энергия ионизации будет энергией фотонов hνя (час это Постоянная Планка ), что вызвало резкое повышение тока: Eя=hνя.
Когда для ионизации атомов используются высокоскоростные электроны, они производятся электронная пушка внутри аналогичной откачанной трубки. Энергией электронного пучка можно управлять с помощью ускоряющих напряжений. Энергия этих электронов, которая вызывает резкое возникновение тока ионов и освобождаемых электронов через трубку, будет соответствовать энергии ионизации атомов.
Ценности и тенденции
Как правило, (п+1) энергия ионизации конкретного элемента больше, чем пэнергия ионизации. Когда следующая энергия ионизации включает удаление электрона из той же электронной оболочки, увеличение энергии ионизации в первую очередь связано с увеличением суммарного заряда иона, из которого удаляется электрон. Электроны, удаленные от более заряженных ионов, испытывают большие силы электростатического притяжения; таким образом, для их удаления требуется больше энергии. Вдобавок, когда следующая энергия ионизации включает удаление электрона из нижней электронной оболочки, значительно уменьшенное расстояние между ядром и электроном также увеличивает как электростатическую силу, так и расстояние, на котором эта сила должна быть преодолена, чтобы удалить электрон. Оба эти фактора дополнительно увеличивают энергию ионизации.
Некоторые значения элементов третьего периода приведены в следующей таблице:
| Элемент | Первый | Второй | В третьих | Четвертый | Пятый | Шестой | Седьмой |
|---|---|---|---|---|---|---|---|
| Na | 496 | 4,560 | |||||
| Mg | 738 | 1,450 | 7,730 | ||||
| Al | 577 | 1,816 | 2,881 | 11,600 | |||
| Si | 786 | 1,577 | 3,228 | 4,354 | 16,100 | ||
| п | 1,060 | 1,890 | 2,905 | 4,950 | 6,270 | 21,200 | |
| S | 1,000 | 2,295 | 3,375 | 4,565 | 6,950 | 8,490 | 27,107 |
| Cl | 1,256 | 2,260 | 3,850 | 5,160 | 6,560 | 9,360 | 11,000 |
| Ar | 1,520 | 2,665 | 3,945 | 5,770 | 7,230 | 8,780 | 12,000 |
Большие скачки последовательных молярных энергий ионизации происходят при прохождении благородный газ конфигурации. Например, как можно увидеть в таблице выше, первые две молярные энергии ионизации магния (отрыв двух 3s-электронов от атома магния) намного меньше, чем третья, что требует оторвать 2p-электрон от атома магния. неон конфигурация Mg2+. Этот электрон гораздо ближе к ядру, чем 3s-электрон, удаленный ранее.
Пик энергии ионизации благородных газов приходится на конец каждого периода в периодической таблице элементов и, как правило, падает, когда начинается заполнение новой орбитали.
Энергия ионизации также периодическая тенденция в периодической таблице. Перемещение слева направо внутри период, или вверх в пределах группа, первая энергия ионизации обычно увеличивается,[10] за исключениями, такими как алюминий и сера, указанные в таблице выше. Поскольку ядерный заряд ядра увеличивается через период, электронная защита остается постоянным, поэтому радиус атома уменьшается, и электронное облако становится ближе к ядру[11] потому что электроны, особенно самые дальние из них, удерживаются более сильным зарядом ядра. Точно так же при движении вверх внутри данной группы электроны удерживаются на орбиталях с более низкой энергией, ближе к ядру и, следовательно, более тесно связаны.[12]
Исключения по энергии ионизации
Есть исключения из общей тенденции повышения энергии ионизации в течение определенного периода. Например, значение уменьшается с бериллий (
4Быть
: 9,3 эВ) до бор (
5B
: 8,3 эВ), а от азот (
7N
: 14,5 эВ) до кислород (
8О
: 13,6 эВ). Эти провалы можно объяснить с точки зрения электронных конфигураций.[13]
Последний электрон бора находится на 2p-орбитали, электронная плотность которой в среднем находится дальше от ядра, чем 2s-электроны в той же оболочке. Затем 2s-электроны в некоторой степени экранируют 2p-электрон от ядра, и легче удалить 2p-электрон из бора, чем 2s-электрон из бериллия, что приводит к более низкой энергии ионизации B.[2]
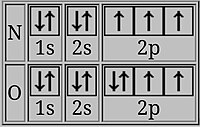
Эти электронные конфигурации не показывают полных наполовину заполненных орбиталей. Посмотрим на следующее изображение.
Здесь добавленный электрон явно имеет спин, противоположный другим 2p-электронам, что снижает энергию ионизации кислорода.
В кислороде последний электрон делит дважды занятую p-орбиталь с электроном противоположной вращение. Два электрона на одной орбитали в среднем ближе друг к другу, чем два электрона на разных орбиталях, поэтому они более эффективно экранируют друг друга, и один из них легче удалить, что приводит к более низкой энергии ионизации.[2][14]
Кроме того, после каждого элемента благородного газа энергия ионизации резко падает. Это происходит потому, что внешний электрон в щелочных металлов требует гораздо меньшего количества энергии для удаления из атома, чем внутренние оболочки. Это также приводит к низкому электроотрицательность значения для щелочных металлов.[15][16][17]
Из-за одного p-орбитального электрона в галлий конфигурации, делает общую структуру менее устойчивой, следовательно, падение значений энергии ионизации[18]
Актиний Электронная конфигурация России предопределяет, что для удаления этого единственного f-орбитального электрона потребуется меньше энергии, следовательно, даже если он имеет больший EC, радий все еще имеет более высокий IE[19]
Тенденции и исключения резюмируются в следующих подразделах:
Энергия ионизации уменьшается при:
- Переход к новому периоду: щелочной металл легко теряет один электрон, чтобы оставить октет или псевдо-конфигурация благородного газа, поэтому эти элементы имеют только небольшие значения для IE.
- Переход от s-блока к p-блоку: p-орбиталь легче теряет электрон. Пример — бериллий в бор с электронной конфигурацией 1s2 2 с2 2p1. 2s-электроны защищают 2p-электрон с более высокой энергией от ядра, облегчая его удаление. Это также происходит в магний к алюминий.[20]
- Занимая p-подоболочку с ее первый электрон со спином, противоположным другим электронам: например, в азоте (
7N
: 14,5 эВ) в кислород (
8О
: 13,6 эВ), а также фосфор (
15п
: 10,48 эВ) до сера (
16S
: 10,36 эВ). Причина этого в том, что кислород, сера и селен имеют падающую энергию ионизации из-за эффектов экранирования.[21] Однако это прекращается, начиная с теллур где экранирование слишком мало, чтобы образовать провал. - Переход от d-блока к p-блоку: как и в случае с цинк (
30Zn
: 9,4 эВ) до галлий (
31Ga
: 6,0 эВ)
- Частный случай: уменьшение с вести (
82Pb
: 7,42 эВ) до висмут (
83Би
: 7,29 эВ). Это не связано с размерами (разница минимальная: свинец имеет ковалентный радиус 146 вечера в то время как висмут сейчас 148 часов[22]). Это также нельзя отнести к релятивистской стабилизации орбитали 6s, поскольку этот фактор очень похож в двух соседних элементах. Другие факторы предполагают вопреки факту, что висмут должен иметь более высокий IE из-за его наполовину заполненной орбитали (добавление стабилизации), позиция в периодической таблице (Bi правее, поэтому он должен быть менее металлическим, чем Pb), и у него есть еще один протон (вносит вклад в [эффективный] заряд ядра).[23]
- Частный случай: уменьшение с радий (
88Ра
: 5,27 эВ) до актиний (
89Ac
: 5,17 эВ), который является переключением с p-орбитали на f-орбиталь. Однако аналогичный переход от барий (
56Ба
: 5,2 эВ) до лантан (
57Ла
: 5,6 эВ) не показывает изменения в сторону уменьшения.
- Лютеций (
71Лу
) и лоуренсий (
103Lr
) оба имеют энергию ионизации ниже, чем предыдущие элементы. В обоих случаях добавлен последний электрон. запускает новую подоболочку: 5d для Lu с электронной конфигурацией [Xe] 4f14 5d1 6 с2, и 7p для Lr с конфигурацией [Rn] 5f4 7 с2 7p1. Эти провалы в энергии ионизации с тех пор использовались в качестве доказательства в продолжающихся дебатах о том, следует ли помещать Lu и Lr в группу 3 периодической таблицы вместо лантан (La) и актиний (Ас).[24][25][26]
Энергия ионизации увеличивается, когда:
- Достижение элементов группы 18 благородных газов: это связано с их полными электронными подоболочками,[27] так что этим элементам требуется большое количество энергии для удаления одного электрона.
- Группа 12: Элементы здесь, цинк (
30Zn
: 9,4 эВ), кадмий (
48Компакт диск
: 9,0 эВ) и Меркурий (
80Hg
: 10,4 эВ) все регистрируют внезапное возрастание значений IE по сравнению с их предыдущими элементами: медь (
29Cu
: 7,7 эВ), Серебряный (
47Ag
: 7,6 эВ) и золото (
79Au
: 9,2 эВ) соответственно. Для ртути можно экстраполировать, что релятивистский стабилизация 6s-электронов увеличивает энергию ионизации в дополнение к плохому экранированию 4f-электронами, что увеличивает эффективный ядерный заряд на внешних валентных электронах. Кроме того, электронные конфигурации замкнутых подоболочек: [Ar] 3d10 4 с2, [Kr] 4d105 с2 и [Xe] 4f14 5d10 6 с2 обеспечивают повышенную устойчивость. - Особый случай: сдвиг с родий (
45Rh
: 7,5 эВ) до палладий (
46Pd
: 8,3 эВ). В отличие от других элементов группы 10, палладий имеет более высокую энергию ионизации, чем предыдущий атом, из-за его электронной конфигурации. В отличие от никель [Ar] 3d8 4 с2, и платина s [Xe] 4f14 5d9 6 с1, электронная конфигурация палладия [Kr] 4d10 5 с0 (хотя Правило Маделунга предсказывает [Kr] 4d8 5 с2). В заключение, Серебряный нижний IE (
47Ag
: 7,6 эВ) дополнительно подчеркивает высокую ценность палладия; единственный добавленный s-электрон удаляется с более низкой энергией ионизации, чем палладий,[28] что подчеркивает высокий IE палладия (как показано в приведенных выше значениях IE в линейной таблице) - ИП гадолиний (
64Б-г
: 6.15 эВ) несколько выше, чем оба предыдущих (
62См
: 5,64 эВ), (
63ЕС
: 5.67 эВ) и следующие элементы (
65Tb
: 5,86 эВ), (
66Dy
: 5,94 эВ). Эту аномалию можно отнести к полузаполненному 4f7 орбитальный.
- Переход к элементам d-блока: элементы Sc с 3d1 электронная конфигурация имеет выше IP (
21Sc
: 6.56 эВ), чем предыдущий элемент (
20Ca
: 6,11 эВ), в отличие от уменьшения при переходе на s-блочные и p-блочные элементы. Электроны 4s и 3d обладают схожей защитной способностью: 3d-орбиталь образует часть оболочки n = 3, среднее положение которой ближе к ядру, чем 4s-орбиталь и оболочка n = 4, но электроны на s-орбиталях испытывают большее проникновение в оболочку ядра, чем электроны на d-орбиталях. Таким образом, взаимное экранирование 3d- и 4s-электронов является слабым, а эффективный заряд ядра, действующий на ионизированный электрон, относительно велик. Иттрий (
39Y
) аналогично имеет более высокое IP (6,22 эВ), чем
38Sr
: 5,69 эВ. Последние два д1 элементы (
57Ла
: 5.18 эВ) и (
89Ac
: 5,17 эВ) имеют лишь немного более низкие IP, чем их предыдущие элементы (
56Ба
: 5.21 эВ) и (
88Ра
: 5,18 эВ).
- Переход к элементам f-блока; Как видно на приведенном выше графике энергий ионизации, резкий рост значений IE от (
55CS
) к (
57Ла
) сопровождается небольшим почти линейным увеличением по мере добавления f-электронов. Это связано с сокращение лантаноидов (для лантаноидов).[29][30][31] Это уменьшение ионного радиуса связано с увеличением энергии ионизации, в свою очередь, увеличивается, поскольку два свойства соотносятся друг с другом.[10] Что касается элементов d-блока, электроны добавляются во внутреннюю оболочку, так что новые оболочки не образуются. Форма добавленных орбиталей не позволяет им проникнуть в ядро, поэтому занимающие их электроны обладают меньшей защитной способностью.
Аномалии энергии ионизации в группах
Значения энергии ионизации имеют тенденцию уменьшаться при переходе к более тяжелым элементам в группе.[32] поскольку защита обеспечивается большим количеством электронов, и в целом валентные оболочки испытывают более слабое притяжение со стороны ядра.[12](приписывается большему ковалентному радиусу, который увеличивается при спуске по группе[33]) Тем не менее, это не всегда так. В качестве единственного исключения палладий Группы 10 (
46Pd
: 8,34 эВ) имеет более высокую энергию ионизации, чем никель (
28Ni
: 7,64 эВ), в отличие от общего уменьшения для элементов из технеция
43Tc
к ксенону
54Xe
. Ниже приводится краткое описание таких аномалий:
- Группа 1:
- Водород Энергия ионизации очень высока (13,59844 эВ) по сравнению с щелочными металлами. Это связано с его единственным электроном (и, следовательно, очень маленьким электронное облако ), которое близко к ядру. Точно так же, поскольку нет других электронов, которые могли бы вызвать экранирование, этот единственный электрон испытывает полный положительный заряд ядра.[34]
- Франций энергия ионизации выше, чем у предыдущего щелочной металл, цезий. Это связано с его (и радием) малым ионным радиусом из-за релятивистских эффектов. Из-за их большой массы и размера это означает, что его электроны движутся с чрезвычайно высокими скоростями, в результате чего электроны становятся ближе к ядру, чем ожидалось, и, следовательно, их труднее удалить (более высокий IE).[35]
- Группа 2: Радий энергия ионизации, превышающая предыдущую щелочноземельный металл барий, как и франций, также возникает из-за релятивистских эффектов. Электроны, особенно 1s-электроны, испытывают очень высокоэффективные ядерные заряды. Чтобы избежать падения в ядро, 1s-электроны должны вращаться с очень высокими скоростями, что приводит к тому, что специальные релятивистские поправки существенно превышают приблизительные классические импульсы. Посредством принцип неопределенности, это вызывает релятивистское сжатие 1s-орбитали (и других орбиталей с электронной плотностью, близкой к ядру, особенно ns- и np-орбиталей). Следовательно, это вызывает каскад электронных изменений, который в конечном итоге приводит к сужению внешних электронных оболочек и их приближению к ядру.
- Группа 14:Свинец s (
82Pb
: 7,4 эВ) необычайно высокая энергия ионизации из-за включения не только 5d-электронов, но и 4f-электронов ( лантаноиды ). 4f-электроны довольно неэффективно экранируют ядро от 6p-электронов, в результате чего эффективный заряд ядра оказывается достаточно высоким, до такой степени, что энергия ионизации для свинца на самом деле немного выше, чем у банка.[36] - Группа 4:
- Гафний почти схожесть в IE, чем цирконий. Эффекты сокращения лантаноидов все еще ощущаются после лантаноидов.[30] Это видно по меньшим атомным радиусам первого (что противоречит наблюдаемая периодическая тенденция ) в 159 часов вечера[37] (эмпирическая ценность ), который отличается от 155 вечера последнего.[38] Это, в свою очередь, увеличивает его энергию ионизации на 18 ± кДж / моль.−1.
- Титан IE, который меньше, чем у гафния и циркония. Энергия ионизации гафния подобна цирконию из-за сжатия лантаноида. Однако, почему энергия ионизации циркония выше, чем у предшествующего ему элемента, остается закрытым; мы не можем управлять атомными радиусами, так как на самом деле для циркония и гафния он выше на 15 мкм.[39] Мы также не можем управлять конденсированный энергия ионизации, поскольку они более или менее одинаковы ([Ar] 3d² 4s² для титана, тогда как [Kr] 4d² 5s² для циркония). Кроме того, мы не можем сравнивать наполовину заполненные или полностью заполненные орбитали. Следовательно, мы можем исключить только циркониевые полный электронная конфигурация: 1s²2s²2p⁶3s²3p⁶3d¹⁰4s²4p⁶4d²5s².[40] Как видим, у него есть полноценный 3-й подуровень. Отсюда можно вывести, что полный подуровень 3d-блока мощь имеют гораздо большую эффективность экранирования по сравнению с элементами 4d-блока (которые состоят только из двух электронов).[41]
- Гафний почти схожесть в IE, чем цирконий. Эффекты сокращения лантаноидов все еще ощущаются после лантаноидов.[30] Это видно по меньшим атомным радиусам первого (что противоречит наблюдаемая периодическая тенденция ) в 159 часов вечера[37] (эмпирическая ценность ), который отличается от 155 вечера последнего.[38] Это, в свою очередь, увеличивает его энергию ионизации на 18 ± кДж / моль.−1.
- Группа 5: сродни группе 4, ниобий и тантал аналогичны друг другу из-за их электронной конфигурации и сжатия лантаноида, влияющего на последний элемент.[42] Ipso facto, их значительный рост ИЭ по сравнению с ведущим элементом в группе, ванадий, могут быть объяснены наличием у них полного d-блока электронов в дополнение к их электронной конфигурации. Другая интригующая идея — это наполовину заполненная 5s орбиталь ниобия; за счет отталкивания и обмена энергии (другими словами, «расходы» для помещения электрона на низкоэнергетический подуровень, чтобы полностью заполнить его вместо помещения электрона на высокоэнергетический), преодолевая энергетический зазор между s- и d- (или f) блокирующими электронами, EC не следует принципу Маделунга правило.
- Группа 6: как и ее предшественники групп 4 и 5, группа 6 также показывает высокие значения при движении вниз. Вольфрам еще раз похож на молибден из-за их электронной конфигурации.[43] Точно так же он также относится к полной 3d-орбитали в своей электронной конфигурации. Другой причиной является наполовину заполненная 4d орбиталь молибдена из-за парных энергий электронов, нарушающих принцип ауфбау.
- Группы 7-12 элементы 6 периода (рений, осмий, иридий, платина, золото и Меркурий ): Все эти элементы имеют чрезвычайно высокую энергию ионизации, чем предшествующий им элемент в соответствующих группах. Суть этого связана с влиянием сокращения лантаноидов на пост-лантаноиды в дополнение к релятивистской стабилизации орбитали 6s.
- Группа 13:
- IE галлия выше, чем у алюминия. Это опять-таки связано с d-орбиталями, в дополнение к сжатию скандидов, которые обеспечивают слабую защиту и, следовательно, увеличивают эффективные ядерные заряды.
- ИЭ таллия из-за плохой защиты 4f-электронов[44] в дополнение к сокращению лантаноидов, вызывает усиление его ИЭ по сравнению с его предшественником индий.
- Группа 14: свинец с более высоким IE по сравнению с банка. Это связано, как и таллий группы IIIA, с плохой защитой от форбитального сокращения и сокращения лантаноидов.[44]
Электростатическое объяснение
Энергию ионизации атома можно предсказать путем анализа с использованием электростатический потенциал и Модель Бора атома следующим образом (обратите внимание, что вывод использует Гауссовские единицы ).
Рассмотрим электрон с зарядом -е и атомное ядро с зарядом + Ze, где Z — количество протонов в ядре. Согласно модели Бора, если электрон приблизится к атому и соединится с ним, он остановится на определенном радиусе а. Электростатический потенциал V на расстоянии а от ионного ядра, привязанного к бесконечно удаленной точке, составляет:
Поскольку электрон заряжен отрицательно, положительный электростатический потенциал втягивает его внутрь. Энергия, необходимая электрону, чтобы «вылезти» и покинуть атом, равна:
Этот анализ неполный, так как он оставляет расстояние а как неизвестная переменная. Его можно сделать более строгим, присвоив каждому электрону каждого химического элемента характерное расстояние, выбранное таким образом, чтобы это соотношение согласовывалось с экспериментальными данными.
Эту модель можно значительно расширить, применив полуклассический подход, в котором импульс квантован. Этот подход очень хорошо работает для атома водорода, у которого есть только один электрон. Величина углового момента для круговой орбиты равна:
Полная энергия атома складывается из кинетической и потенциальной энергий, то есть:
Скорость можно исключить из члена кинетической энергии, установив кулоновское притяжение равным центростремительной силе, давая:
Решение углового момента для v и подставив это в выражение для кинетической энергии, мы имеем:
Это устанавливает зависимость радиуса от п. Это:
Теперь энергию можно найти в терминах Z, е, и р. Используя новое значение кинетической энергии в приведенном выше уравнении полной энергии, было обнаружено, что:
При наименьшем значении п равно 1 и р это Радиус Бора а0 что равно 
Квантово-механическое объяснение
|
|
В этом разделе несколько вопросов. Пожалуйста помоги Улучши это или обсудите эти вопросы на страница обсуждения. (Узнайте, как и когда удалить эти сообщения-шаблоны)
(Узнайте, как и когда удалить этот шаблон сообщения) |
Согласно более полной теории квантовая механика, расположение электрона лучше всего описать как распределение вероятностей в пределах электронное облако, т.е. атомная орбиталь.[45][46]Энергию можно рассчитать интегрированием по этому облаку. Математическое представление облака — это волновая функция который построен из Детерминанты Слейтера состоящий из молекулярных спиновых орбиталей. Они связаны Принцип исключения Паули к антисимметричным продуктам атомарного или молекулярные орбитали.
Существует два основных способа расчета энергии ионизации. В общем, расчет для пэнергия ионизации требует расчета энергий 


Энергия вертикальной и адиабатической ионизации в молекулах
Рисунок 1. Энергетическая диаграмма принципа Франка – Кондона. Для ионизации двухатомной молекулы единственной ядерной координатой является длина связи. Нижняя кривая — это кривая потенциальной энергии нейтральной молекулы, а верхняя кривая — для положительного иона с большей длиной связи. Синяя стрелка — вертикальная ионизация, здесь от основного состояния молекулы до уровня v = 2 иона.
Ионизация молекул часто приводит к изменению молекулярная геометрия, и определены два типа (первых) энергии ионизации — адиабатический и вертикальный.[48]
Энергия адиабатической ионизации
В адиабатический энергия ионизации молекулы — это минимум количество энергии, необходимое для удаления электрона из нейтральной молекулы, то есть разница между энергией колебательный основное состояние нейтральных частиц (уровень v «= 0) и положительного иона (v ‘= 0). Конкретная геометрия равновесия каждой частицы не влияет на это значение.
Энергия вертикальной ионизации
Из-за возможных изменений в геометрии молекул, которые могут возникнуть в результате ионизации, могут существовать дополнительные переходы между основным колебательным состоянием нейтральных частиц и колебательный возбужденные состояния положительного иона. Другими словами, ионизация сопровождается колебательное возбуждение. Интенсивность таких переходов объясняется Принцип Франка – Кондона, который предсказывает, что наиболее вероятный и интенсивный переход соответствует колебательно-возбужденному состоянию положительного иона, имеющего ту же геометрию, что и нейтральная молекула. Этот переход называется «вертикальной» энергией ионизации, поскольку он представлен полностью вертикальной линией на диаграмме потенциальной энергии (см. Рисунок).
Для двухатомной молекулы геометрия определяется длиной одного связь. Удаление электрона из связи молекулярная орбиталь ослабляет связь и увеличивает длину связи. На рисунке 1 нижний кривая потенциальной энергии для нейтральной молекулы, а верхняя поверхность для положительного иона. Обе кривые изображают потенциальную энергию как функцию длины связи. Горизонтальные линии соответствуют колебательные уровни с их связанными колебательные волновые функции. Поскольку ион имеет более слабую связь, у него будет более длинная связь. Этот эффект представлен смещением минимума кривой потенциальной энергии вправо от нейтральных частиц. Адиабатическая ионизация — это диагональный переход в основное колебательное состояние иона. Вертикальная ионизация может включать колебательное возбуждение ионного состояния и, следовательно, требует большей энергии.
Во многих случаях адиабатическая энергия ионизации часто является более интересной физической величиной, поскольку она описывает разницу в энергии между двумя поверхностями потенциальной энергии. Однако из-за экспериментальных ограничений часто трудно определить энергию адиабатической ионизации, тогда как энергию вертикального отрыва легко идентифицировать и измерить.
Аналоги энергии ионизации для других систем
В то время как термин энергия ионизации в основном используется только для газообразных атомных или молекулярных частиц, существует ряд аналогичных величин, которые учитывают количество энергии, требуемой для удаления электрона из других физических систем.
Энергия связи электрона
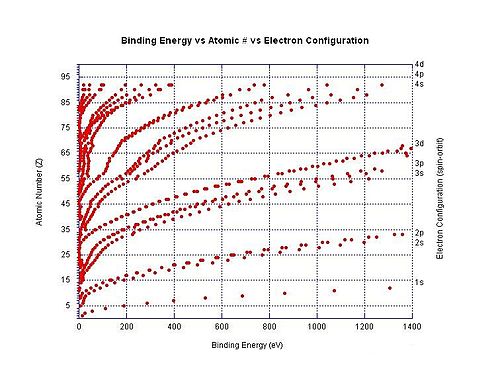
Энергии связи конкретных атомных орбиталей в зависимости от атомного номера. Из-за увеличения числа протонов электроны, занимающие одну и ту же орбиталь, более тесно связаны в более тяжелых элементах.
Электрон энергия связи — общий термин для обозначения минимальной энергии, необходимой для удаления электрона из определенного электронная оболочка для атома или иона, из-за того, что эти отрицательно заряженные электроны удерживаются на месте электростатическим притяжением положительно заряженного ядра.[49] Например, энергия связи электрона для удаления 3p3/2 Электрон от иона хлора — это минимальное количество энергии, необходимое для удаления электрона от атома хлора, когда он имеет заряд -1. В этом конкретном примере энергия связи электрона имеет ту же величину, что и электронное сродство для нейтрального атома хлора. В другом примере энергия связи электрона относится к минимальному количеству энергии, необходимому для удаления электрона из дианиона дикарбоксилата. −О2C (CH2)8CO−
2.
На графике справа показана энергия связи для электронов в различных оболочках нейтральных атомов. Энергия ионизации — это самая низкая энергия связи для конкретного атома (хотя не все они показаны на графике).
Рабочая функция
Рабочая функция — минимальное количество энергии, необходимое для удаления электрона с твердой поверхности, где работа выхода W для данной поверхности определяется разностью[50]
где −е это ответственность электрон, ϕ это электростатический потенциал в вакууме у поверхности, и EF это Уровень Ферми (электрохимический потенциал электронов) внутри материала.
Смотрите также
- Уравнение Ридберга — расчет, который может определить энергии ионизации водород и водородоподобный элементы. Это дополнительно уточняется в этом сайт.
- Электронное сродство — тесно связанное понятие, описывающее энергию, выделяемую добавление электрон к нейтральному атому или молекуле.
- Энергия решетки — мера выделяемой энергии при ионы объединяются в соединение.
- Электроотрицательность это число, которое имеет некоторое сходство с энергией ионизации.
- Теорема Купманса, относительно прогнозируемых энергий ионизации в Хартри – Фок теория.
- Тетра ди-вольфрама (hpp) имеет самую низкую зарегистрированную энергию ионизации для стабильной химическое соединение.
использованная литература
- ^ «Периодические тенденции». Химия LibreTexts. 2013-10-02. Получено 2020-09-13.
- ^ а б c Мисслер, Гэри Л .; Тарр, Дональд А. (1999). Неорганическая химия (2-е изд.). Прентис Холл. п. 41. ISBN 0-13-841891-8.
- ^ Редакторы Encyclopædia Britannica (29 мая 2020 г.). «Энергия ионизации». britannica.com. Британская энциклопедия. Получено 3 ноября, 2020.
- ^ «Энергия ионизации». ChemWiki. Калифорнийский университет в Дэвисе. 2013-10-02.
- ^ «Глава 9: Квантовая механика». faculty.chem.queesu.ca. 15 января 2018 г.. Получено 31 октября, 2020.
- ^ Коттон, Ф. Альберт; Уилкинсон, Джеффри (1988). Продвинутая неорганическая химия (5-е изд.). Джон Вили. п. 1381. ISBN 0-471-84997-9.
- ^ «ИЮПАК — потенциал ионизации (I03208)». goldbook.iupac.org. Получено 2020-09-13.
- ^ Ланг, Питер Ф .; Смит, Барри С. (2003). «Энергии ионизации атомов и атомных ионов». Журнал химического образования. 80 (8): 938. Bibcode:2003JChEd..80..938L. Дои:10.1021 / ed080p938.
- ^ Махан, Брюс Х. (1962). «Энергия ионизации». Химический колледж Калифорнийского университета в Беркли. Получено 2020-09-13.
- ^ а б Стоун, Эрл Г. «Структура атома: периодические тенденции».
- ^ «Аномальные тенденции в энергии ионизации». Обмен стеками химии. Получено 2020-09-20.
- ^ а б «Энергия ионизации | Введение в химию». course.lumenlearning.com. Получено 2020-09-13.
- ^ «Тенденции в области ионизации энергии | Grandinetti Group». www.grandinetti.org. Получено 2020-09-13.
- ^ https://www.kentchemistry.com/links/PT/PTIonE.htm
- ^ «Группа ИА». chemed.chem.purdue.edu. Получено 2020-09-20.
- ^ «Щелочных металлов». hyperphysics.phy-astr.gsu.edu. Получено 2020-09-13.
- ^ «Щелочные металлы | Введение в химию». course.lumenlearning.com. Получено 2020-09-13.
- ^ J. Chem. Educ. 2003, 80, 8, 938 Дата публикации: 1 августа 2003 г.https://doi.org/10.1021/ed080p938
- ^ https://www.lenntech.com/periodic-chart-elements/ionization-energy.htm
- ^ «Части Периодической таблицы». www.angelo.edu. Получено 2020-09-20.
- ^ «18.10: Элементы Группы 6А». Химия LibreTexts. 2014-07-02. Получено 2020-09-20.
- ^ «Ковалентный радиус для всех элементов периодической таблицы». periodictable.com. Получено 2020-09-13.
- ^ https://chemistry.stackexchange.com/questions/41706/why-is-ionisation-energy-of-bismuth-lower-than-lead
- ^ Ball2017-04-21T07: 45: 00 + 01: 00, Филипп. «Дилемма группы 3». Мир химии. Получено 2020-09-13.
- ^ «Измерение первого ионизационного потенциала лоуренсия вновь вызывает споры о периодической таблице». Phys.org. Получено 2020-09-13.
- ^ https://www.ionicviper.org/system/files/Scerri%20Parsons%20March%204th%202017%20%2B%20new%20part_0.docx
- ^ Сингх, Джасвиндер. Стерлинговый словарь физики. Нью-Дели, Индия: Стерлинг, 2007. 122.
- ^ Greenwood, N. N .; Эрншоу, А. (2012-12-02). Химия элементов. Эльзевир. ISBN 978-0-08-050109-3.
- ^ Housecroft, C.E .; Шарп, А. Г. (2004). Неорганическая химия (2-е изд.). Прентис Холл. С. 536, 649, 743. ISBN 978-0-13-039913-7.
- ^ а б Коттон, Ф. Альберт; Уилкинсон, Джеффри (1988), Продвинутая неорганическая химия (5-е изд.), Нью-Йорк: Wiley-Interscience, стр. 776, 955, ISBN 0-471-84997-9
- ^ Джолли, Уильям Л. Современная неорганическая химия, Макгроу-Хилл 1984, стр. 22
- ^ https://www.grandinetti.org/ionization-energy-trends
- ^ «Закономерности и тенденции в периодической таблице — Периодичность — Высшая версия химии». BBC Bitesize. Получено 2020-09-20.
- ^ «Энергии ионизации». Химия LibreTexts. 2013-10-03. Получено 2020-09-20.
- ^ «IYPT 2019 Elements 087: Франций: не самый реактивный элемент Группы 1». Сложный процент. 2019-11-06. Получено 2020-09-20.
- ^ «Группа 14 элементов». Химия Nexus. 2015-12-02. Получено 2020-09-13.
- ^ https://www.gordonengland.co.uk/elements/hf.htm
- ^ https://pubchem.ncbi.nlm.nih.gov/element/Zirconium
- ^ «Периодическая таблица WebElements» Титан »радиусы атомов и ионов». www.webelements.com. Получено 2020-09-20.
- ^ «Периодическая таблица элементов: цирконий — электронная конфигурация». www.tabulka.cz. Получено 2020-09-20.
- ^ Тем не менее, необходимы дальнейшие исследования, чтобы подтвердить этот простой вывод.
- ^ «Тантал | химический элемент». Энциклопедия Британника. Получено 2020-09-20.
- ^ Лангард, Сверре (2015), «Хром, молибден и вольфрам», Токсикология Пэтти, Американское онкологическое общество, Дои:10.1002 / 0471435139.tox038, ISBN 978-0-471-12547-1, получено 2020-09-20
- ^ а б Ланг, Питер Ф .; Смит, Барри С. (август 2003 г.). «Энергии ионизации атомов и атомных ионов» (PDF). Журнал химического образования. 80 (8): 938. Bibcode:2003JChEd..80..938L. Дои:10.1021 / ed080p938. ISSN 0021-9584.
- ^ «Орбитали, электронные облака, вероятности и энергии». chem.libretexts.org. UC Davis ChemWiki. 23 мая, 2019. Получено 2 ноября, 2020.
- ^ «Квантовые числа и орбитали — квантово-механическая модель атома». Ханская академия. Получено 2 ноября, 2020.
- ^ «Справочная информация по энергии ионизации». shodor.org. Фонд образования Shodor, Inc. 2000 г.. Получено 15 ноября, 2020.
… Второй метод называется теорией Купмана. Этот метод включает в себя HOMO.
- ^ «Разница между энергией вертикальной ионизации и энергией адиабатической ионизации». Сравнительная и контрольная база данных по вычислительной химии. Национальный институт стандартов и технологий.
- ^ https://radiopaedia.org/articles/electron-binding-energy#:~:text=The%20electron%20binding%20energy%20is,1.6%20x%2010-19%20J.
- ^ Киттель, Чарльз. Введение в физику твердого тела (7-е изд.). Вайли.