История открытия меди 16.05.2021 13:12

Медь – один из самых известных и самых полезных для человечества металлов. Пусть с точки зрения эстетов, он и не входит в самую известную тройку «благородных» (золото, серебро, бронза), зато очень много хорошего об этом полезном ископаемом могут рассказать представители самых разных профессий: металлурги, ювелиры, физики, химики, фармацевты и многие другие специалисты.
Сфера использования меди чрезвычайно обширна. Ее применение в разных областях тяжелой и легкой промышленности и отдельных отраслях современной науки, весьма разнообразно. Более того – количество ситуаций, когда медь незаменима, растёт наперегонки с техническим прогрессом, а вот способы медедобычи остаются неизменными на протяжении множества веков. Возможности меди (и все ее свойства, включая целебное) были открыты нашими предками еще в античный период. С тех пор в нашем мире изменилось практически все, начиная от мировоззрения людей и заканчивая социально-экономическим строем, а медь как приносила людям пользу, так и продолжает ее приносить.
Латинское название этого металла — Cuprum — имеет очень красивую историю, берущую своё начало в древнегреческой мифологии. Согласно верованиям древних греков, люди получили этот металл от Афродиты, богини любви и плодородия. Легенда гласит, что Афродита, родившаяся в пене прибрежных волн, вышла на берег острова Кипр, который она немедленно взяла под свое покровительство, показав его жителям залежи столь необходимого для них металла. Разумеется, в этом красивом сказании есть определенная доля истины — именно Кипр, где в древности был расположен один из самых известных алтарей поклонения Венере, издревле был богат залежами меди. Так что древние киприоты и впрямь обогащались на добыче этого металла, а имя острова дало научное название этому элементу — купрум.
Конечно же, на самом деле медь начали применять задолго до того, как в ареале Эгейского моря сложилась древнегреческая цивилизация. Эпоха открытия и применения меди — это примерно VI–IV тысячелетие до нашей эры, обширный период, который археологи и историки считают промежуточным звеном между «каменным веком» и «бронзовым». Согласно исследованиям ученых, наши далекие предки сначала применяли слитки меди, которые были ими ошибочно приняты за камни. Изначально медные самородки обрабатывались так же, как простые камни — по ним ударяли другими камнями, дабы изменить их форму и размер. Медные слитки отказывались раскалываться на части, но отлично деформировались. Этот метод обработки, получивший название «холодная ковка», был достаточно энергозатратным, но весьма распространенным. В отличие от «горячей ковки», то есть, нагревания меди, делавшей металл пластичным, но впоследствии хрупким, медные изделия, созданные путем холодной ковки, выдерживали очень многое. Этим же и объясняется преимущество медного оружия перед каменным: металлическое оружие можно было починить, в то время как каменное не подлежало ремонту и реставрации. Более того: как только люди выяснили, что медным орудием рубить деревья куда удобнее, чем деревянным, вместе с добычей меди произошел резкий скачок и в развитии деревообрабатывающей промышленности.
Чуть позже медь начали использовать не только в тогдашней оружейной и сельскохозяйственной промышленности. Из меди начали изготавливать и посуду, и украшения, и прочие столь необходимые в хозяйстве предметы. Любопытный факт: ученым-археологам удалось реконструировать один из способов изготовления медной посуды, бытовавший примерно в V тысячелетии до нашей эры. Для того, чтобы изготовить из слитка меди таз, древним мастерам нужно было стучать огромным молотом по медному диску, размещенному на специально приготовленных для этого деревянных блоках определенной формы.
Раскопки ученых-историков на территории Анатолии (ныне — Анталия, средиземноморское побережье Турции), Египта, Ирана, Месопотамии принесли новые сведения как о применении меди, так и о способах ее обработки, бытовавших в те далекие времена. Как оказалось, нашим далеким предкам пришлось довольно долго экспериментировать для того, чтобы обработанная путем горячей ковки медь не теряла своих качеств и не становилась хрупкой. Способы обработки меди, состоящие из разных сочетаний литья и ковки, варьировались и шлифовались на протяжении веков. Разумеется, за этот период возросло мастерство специалистов, которые начали не только изготовлять из меди оружие, посуду и украшения, но и освоили метод чеканки.
Известно, что медь высоко ценилась жителями Древнего Египта. После расшифровки множества клинописных папирусов стал известен способ обработки меди в эпоху правления Рамзеса II. (1300–1200 гг. до н. э.) Древние египтяне загоняли воздух в плавильные печи с помощью мехов, а древесный уголь добывали из акации и финиковой пальмы. Это создавало внутри печей идеальную температуру для обработки медных слитков и их очищения от посторонних примесей.
Чем выше был спрос на медь, тем больше росла популярность горячей ковки. Для борьбы с коварной хрупкостью полученных таким способом медных изделий, мастера начали добавлять в раскаленную медь иные металлы, образуя различные сплавы. В какой-то момент в плавильной печи произошло случайное соединение меди и олова. Получившийся сплав обладал куда более полезными качествами и требовал совсем иной, менее затратной обработки. Это вещество, получившее название «бронза», дало толчок для начала следующей эпохи, так называемого «бронзового века», начавшегося примерно в III тысячелетии до нашей эры. В этот период изделия из бронзы частично вытеснили медь в определенных сферах тогдашней тяжелой промышленности, но рост добычи меди (столь необходимой для изготовления бронзы) резко увеличился.
Особой популярностью медь пользовалась у древних греков. К примеру, жители знаменитой Трои, воспетой в «Илиаде» Гомера, превратили свой город в крупнейший центр развития тогдашней металлургии, причем на благородных свойствах этого металла росло состояние как ремесленников, так и купцов.
Разумеется, в эпоху древнегреческой цивилизации (и красивого мифа о дарах Афродиты) медь использовали как оружейники и ювелиры, так и врачи. В медицинских трактатах эпохи античности много говорится о целебном влиянии медных изделий на человеческий организм. В частности, о том, что воины, облаченные в медные доспехи, куда меньше устают, а их боевые раны заживают быстрее, нежели у их коллег, облаченных в бронзу.
Другие античные источники были посвящены влиянию медных изделий на различные достоинства мужского организма. Специальные медные украшения, предназначенные специально для укрепления «мужского духа» пользовались большой популярностью у самых разных слоев древнегреческого населения. Известно, что знаменитейшая царица Клеопатра, хорошо разбиравшаяся в тогдашних новейших медицинских открытиях, предпочитала медные браслеты любым украшениям из золота и серебра, а философ и драматург Аристотель, заявлявший об общеукрепляющем действии меди на организм, часто засыпал с медным шариком в руке.
Металл, принесший столько пользы древним грекам, в том числе и жителям Кипра, окрестившим его «купрумом», не остался без внимания и на других этапах развития нашей цивилизации. И в Средние века, и в эпоху Возрождения медь объемы добычи меди неуклонно росли, а лучшие умы тех времен открывали все новые способы ее применения. Самое удивительное, что техника добычи и обработки меди потом стала использоваться и при работе с другими материалами, в частности, с железом и сталью. Сейчас спрос на медь особенно высок среди компаний, специализирующихся на изготовлении различных приборов бытового и электротехнического назначения. Поэтому можно выгодно сдать медь в наших приёмных пунктах.
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Copper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Appearance | Red-orange metallic luster | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Cu) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Copper in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 29 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 11 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 3d10 4s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1357.77 K (1084.62 °C, 1984.32 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 2835 K (2562 °C, 4643 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 8.96 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 8.02 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 13.26 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 300.4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 24.440 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −2, 0,[2] +1, +2, +3, +4 (a mildly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.90 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 128 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 132±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of copper |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered cubic (fcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | (annealed) 3810 m/s (at r.t.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 16.5 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 401 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 16.78 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −5.46×10−6 cm3/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 110–128 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 48 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 140 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 3.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers hardness | 343–369 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 235–878 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-50-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Naming | after Cyprus, principal mining place in Roman era (Cyprium) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Middle East (9000 BC) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symbol | «Cu»: from Latin cuprum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Isotopes of copper
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Copper is a chemical element with the symbol Cu (from Latin: cuprum) and atomic number 29. It is a soft, malleable, and ductile metal with very high thermal and electrical conductivity. A freshly exposed surface of pure copper has a pinkish-orange color. Copper is used as a conductor of heat and electricity, as a building material, and as a constituent of various metal alloys, such as sterling silver used in jewelry, cupronickel used to make marine hardware and coins, and constantan used in strain gauges and thermocouples for temperature measurement.
Copper is one of the few metals that can occur in nature in a directly usable metallic form (native metals). This led to very early human use in several regions, from c. 8000 BC. Thousands of years later, it was the first metal to be smelted from sulfide ores, c. 5000 BC; the first metal to be cast into a shape in a mold, c. 4000 BC; and the first metal to be purposely alloyed with another metal, tin, to create bronze, c. 3500 BC.[6]
In the Roman era, copper was mined principally on Cyprus, the origin of the name of the metal, from aes cyprium (metal of Cyprus), later corrupted to cuprum (Latin). Coper (Old English) and copper were derived from this, the later spelling first used around 1530.[7]
Commonly encountered compounds are copper(II) salts, which often impart blue or green colors to such minerals as azurite, malachite, and turquoise, and have been used widely and historically as pigments.
Copper used in buildings, usually for roofing, oxidizes to form a green patina of compounds called verdigris. Copper is sometimes used in decorative art, both in its elemental metal form and in compounds as pigments. Copper compounds are used as bacteriostatic agents, fungicides, and wood preservatives.
Copper is essential to all living organisms as a trace dietary mineral because it is a key constituent of the respiratory enzyme complex cytochrome c oxidase. In molluscs and crustaceans, copper is a constituent of the blood pigment hemocyanin, replaced by the iron-complexed hemoglobin in fish and other vertebrates. In humans, copper is found mainly in the liver, muscle, and bone.[8] The adult body contains between 1.4 and 2.1 mg of copper per kilogram of body weight.[9]
Characteristics
Physical
Copper just above its melting point keeps its pink luster color when enough light outshines the orange incandescence color
Copper, silver, and gold are in group 11 of the periodic table; these three metals have one s-orbital electron on top of a filled d-electron shell and are characterized by high ductility, and electrical and thermal conductivity. The filled d-shells in these elements contribute little to interatomic interactions, which are dominated by the s-electrons through metallic bonds. Unlike metals with incomplete d-shells, metallic bonds in copper are lacking a covalent character and are relatively weak. This observation explains the low hardness and high ductility of single crystals of copper.[10] At the macroscopic scale, introduction of extended defects to the crystal lattice, such as grain boundaries, hinders flow of the material under applied stress, thereby increasing its hardness. For this reason, copper is usually supplied in a fine-grained polycrystalline form, which has greater strength than monocrystalline forms.[11]
The softness of copper partly explains its high electrical conductivity (59.6×106 S/m) and high thermal conductivity, second highest (second only to silver) among pure metals at room temperature.[12] This is because the resistivity to electron transport in metals at room temperature originates primarily from scattering of electrons on thermal vibrations of the lattice, which are relatively weak in a soft metal.[10] The maximum permissible current density of copper in open air is approximately 3.1×106 A/m2 of cross-sectional area, above which it begins to heat excessively.[13]
Copper is one of a few metallic elements with a natural color other than gray or silver.[14] Pure copper is orange-red and acquires a reddish tarnish when exposed to air. This is due to the low plasma frequency of the metal, which lies in the red part of the visible spectrum, causing it to absorb the higher-frequency green and blue colors.[15]
As with other metals, if copper is put in contact with another metal, galvanic corrosion will occur.[16]
Chemical
Unoxidized copper wire (left) and oxidized copper wire (right)
The East Tower of the Royal Observatory, Edinburgh, showing the contrast between the refurbished copper installed in 2010 and the green color of the original 1894 copper.
Copper does not react with water, but it does slowly react with atmospheric oxygen to form a layer of brown-black copper oxide which, unlike the rust that forms on iron in moist air, protects the underlying metal from further corrosion (passivation). A green layer of verdigris (copper carbonate) can often be seen on old copper structures, such as the roofing of many older buildings[17] and the Statue of Liberty.[18] Copper tarnishes when exposed to some sulfur compounds, with which it reacts to form various copper sulfides.[19]
Isotopes
There are 29 isotopes of copper. 63
Cu
and 65
Cu
are stable, with 63
Cu
comprising approximately 69% of naturally occurring copper; both have a spin of 3⁄2.[20] The other isotopes are radioactive, with the most stable being 67
Cu
with a half-life of 61.83 hours.[20] Seven metastable isotopes have been characterized; 68m
Cu
is the longest-lived with a half-life of 3.8 minutes. Isotopes with a mass number above 64 decay by β−, whereas those with a mass number below 64 decay by β+. 64
Cu
, which has a half-life of 12.7 hours, decays both ways.[21]
62
Cu
and 64
Cu
have significant applications. 62
Cu
is used in 62
Cu
Cu-PTSM as a radioactive tracer for positron emission tomography.[22]
Occurrence
Native copper from the Keweenaw Peninsula, Michigan, about 2.5 inches (6.4 cm) long
Copper is produced in massive stars[23] and is present in the Earth’s crust in a proportion of about 50 parts per million (ppm).[24] In nature, copper occurs in a variety of minerals, including native copper, copper sulfides such as chalcopyrite, bornite, digenite, covellite, and chalcocite, copper sulfosalts such as tetrahedite-tennantite, and enargite, copper carbonates such as azurite and malachite, and as copper(I) or copper(II) oxides such as cuprite and tenorite, respectively.[12] The largest mass of elemental copper discovered weighed 420 tonnes and was found in 1857 on the Keweenaw Peninsula in Michigan, US.[24] Native copper is a polycrystal, with the largest single crystal ever described measuring 4.4 × 3.2 × 3.2 cm.[25] Copper is the 25th most abundant element in Earth’s crust, representing 50 ppm compared with 75 ppm for zinc, and 14 ppm for lead.[26]
Typical background concentrations of copper do not exceed 1 ng/m3 in the atmosphere; 150 mg/kg in soil; 30 mg/kg in vegetation; 2 μg/L in freshwater and 0.5 μg/L in seawater.[27]
Production
Most copper is mined or extracted as copper sulfides from large open pit mines in porphyry copper deposits that contain 0.4 to 1.0% copper. Sites include Chuquicamata, in Chile, Bingham Canyon Mine, in Utah, United States, and El Chino Mine, in New Mexico, United States. According to the British Geological Survey, in 2005, Chile was the top producer of copper with at least one-third of the world share followed by the United States, Indonesia and Peru.[12] Copper can also be recovered through the in-situ leach process. Several sites in the state of Arizona are considered prime candidates for this method.[28] The amount of copper in use is increasing and the quantity available is barely sufficient to allow all countries to reach developed world levels of usage.[29] An alternative source of copper for collection currently being researched are polymetallic nodules, which are located at the depths of the Pacific Ocean approximately 3000–6500 meters below sea level. These nodules contain other valuable metals such as cobalt and nickel.[30]
Reserves and prices
Price of Copper 1959-2022
Copper has been in use at least 10,000 years, but more than 95% of all copper ever mined and smelted has been extracted since 1900.[31] As with many natural resources, the total amount of copper on Earth is vast, with around 1014 tons in the top kilometer of Earth’s crust, which is about 5 million years’ worth at the current rate of extraction. However, only a tiny fraction of these reserves is economically viable with present-day prices and technologies. Estimates of copper reserves available for mining vary from 25 to 60 years, depending on core assumptions such as the growth rate.[32] Recycling is a major source of copper in the modern world.[31] Because of these and other factors, the future of copper production and supply is the subject of much debate, including the concept of peak copper, analogous to peak oil.[citation needed]
The price of copper has historically been unstable,[33] and its price increased from the 60-year low of US$0.60/lb (US$1.32/kg) in June 1999 to $3.75 per pound ($8.27/kg) in May 2006. It dropped to $2.40/lb ($5.29/kg) in February 2007, then rebounded to $3.50/lb ($7.71/kg) in April 2007.[34][better source needed] In February 2009, weakening global demand and a steep fall in commodity prices since the previous year’s highs left copper prices at $1.51/lb ($3.32/kg).[35] Between September 2010 and February 2011, the price of copper rose from £5,000 a metric ton to £6,250 a metric ton.[36]
Methods
Scheme of flash smelting process
The concentration of copper in ores averages only 0.6%, and most commercial ores are sulfides, especially chalcopyrite (CuFeS2), bornite (Cu5FeS4) and, to a lesser extent, covellite (CuS) and chalcocite (Cu2S).[37] Conversely, the average concentration of copper in polymetallic nodules is estimated at 1.3%. The methods of extracting copper as well as other metals found in these nodules include sulfuric leaching, smelting and an application of the Cuprion process.[38][39] For minerals found in land ores, they are concentrated from crushed ores to the level of 10–15% copper by froth flotation or bioleaching.[40] Heating this material with silica in flash smelting removes much of the iron as slag. The process exploits the greater ease of converting iron sulfides into oxides, which in turn react with the silica to form the silicate slag that floats on top of the heated mass. The resulting copper matte, consisting of Cu2S, is roasted to convert the sulfides into oxides:[41]
- 2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2
The cuprous oxide reacts with cuprous sulfide to converted to blister copper upon heating:
- 2 Cu2O + Cu2S → 6 Cu + 2 SO2
The Sudbury matte process converted only half the sulfide to oxide and then used this oxide to remove the rest of the sulfur as oxide. It was then electrolytically refined and the anode mud exploited for the platinum and gold it contained. This step exploits the relatively easy reduction of copper oxides to copper metal. Natural gas is blown across the blister to remove most of the remaining oxygen and electrorefining is performed on the resulting material to produce pure copper:[42]
- Cu2+ + 2 e− → Cu

Recycling
Like aluminium, copper is recyclable without any loss of quality, both from raw state and from manufactured products.[43] In volume, copper is the third most recycled metal after iron and aluminium.[44] An estimated 80% of all copper ever mined is still in use today.[45] According to the International Resource Panel’s Metal Stocks in Society report, the global per capita stock of copper in use in society is 35–55 kg. Much of this is in more-developed countries (140–300 kg per capita) rather than less-developed countries (30–40 kg per capita).
The process of recycling copper is roughly the same as is used to extract copper but requires fewer steps. High-purity scrap copper is melted in a furnace and then reduced and cast into billets and ingots; lower-purity scrap is refined by electroplating in a bath of sulfuric acid.[46]
Alloys
Copper alloys are widely used in the production of coinage; seen here are two examples — post-1964 American dimes, which are composed of the alloy cupronickel[47] and a pre-1968 Canadian dime, which is composed of an alloy of 80 percent silver and 20 percent copper.[48]
Numerous copper alloys have been formulated, many with important uses. Brass is an alloy of copper and zinc. Bronze usually refers to copper-tin alloys, but can refer to any alloy of copper such as aluminium bronze. Copper is one of the most important constituents of silver and karat gold solders used in the jewelry industry, modifying the color, hardness and melting point of the resulting alloys.[49] Some lead-free solders consist of tin alloyed with a small proportion of copper and other metals.[50]
The alloy of copper and nickel, called cupronickel, is used in low-denomination coins, often for the outer cladding. The US five-cent coin (currently called a nickel) consists of 75% copper and 25% nickel in homogeneous composition. Prior to the introduction of cupronickel, which was widely adopted by countries in the latter half of the 20th century,[51] alloys of copper and silver were also used, with the United States using an alloy of 90% silver and 10% copper until 1965, when circulating silver was removed from all coins with the exception of the Half dollar — these were debased to an alloy of 40% silver and 60% copper between 1965 and 1970.[52] The alloy of 90% copper and 10% nickel, remarkable for its resistance to corrosion, is used for various objects exposed to seawater, though it is vulnerable to the sulfides sometimes found in polluted harbors and estuaries.[53] Alloys of copper with aluminium (about 7%) have a golden color and are used in decorations.[24] Shakudō is a Japanese decorative alloy of copper containing a low percentage of gold, typically 4–10%, that can be patinated to a dark blue or black color.[54]
Compounds
Copper forms a rich variety of compounds, usually with oxidation states +1 and +2, which are often called cuprous and cupric, respectively.[55] Copper compounds, whether organic complexes or organometallics, promote or catalyse numerous chemical and biological processes.[56]
Binary compounds
As with other elements, the simplest compounds of copper are binary compounds, i.e. those containing only two elements, the principal examples being oxides, sulfides, and halides. Both cuprous and cupric oxides are known. Among the numerous copper sulfides,[57] important examples include copper(I) sulfide (Cu2S) and copper monosulfide (CuS).[58]
Cuprous halides with fluorine, chlorine, bromine, and iodine are known, as are cupric halides with fluorine, chlorine, and bromine. Attempts to prepare copper(II) iodide yield only copper(I) iodide and iodine.[55]
- 2 Cu2+ + 4 I− → 2 CuI + I2
Coordination chemistry
Copper forms coordination complexes with ligands. In aqueous solution, copper(II) exists as [Cu(H
2O)
6]2+
. This complex exhibits the fastest water exchange rate (speed of water ligands attaching and detaching) for any transition metal aquo complex. Adding aqueous sodium hydroxide causes the precipitation of light blue solid copper(II) hydroxide. A simplified equation is:
Pourbaix diagram for copper in uncomplexed media (anions other than OH- not considered). Ion concentration 0.001 m (mol/kg water). Temperature 25 °C.
- Cu2+ + 2 OH− → Cu(OH)2
Aqueous ammonia results in the same precipitate. Upon adding excess ammonia, the precipitate dissolves, forming tetraamminecopper(II):
- Cu(H
2O)
4(OH)
2 + 4 NH3 → [Cu(H
2O)
2(NH
3)
4]2+
+ 2 H2O + 2 OH−
Many other oxyanions form complexes; these include copper(II) acetate, copper(II) nitrate, and copper(II) carbonate. Copper(II) sulfate forms a blue crystalline pentahydrate, the most familiar copper compound in the laboratory. It is used in a fungicide called the Bordeaux mixture.[59]
Polyols, compounds containing more than one alcohol functional group, generally interact with cupric salts. For example, copper salts are used to test for reducing sugars. Specifically, using Benedict’s reagent and Fehling’s solution the presence of the sugar is signaled by a color change from blue Cu(II) to reddish copper(I) oxide.[60] Schweizer’s reagent and related complexes with ethylenediamine and other amines dissolve cellulose.[61] Amino acids such as cystine form very stable chelate complexes with copper(II)[62][63][64] including in the form of metal-organic biohybrids (MOBs). Many wet-chemical tests for copper ions exist, one involving potassium ferricyanide, which gives a brilliant blue precipitate with copper(II) salts.[65]
Organocopper chemistry
Compounds that contain a carbon-copper bond are known as organocopper compounds. They are very reactive towards oxygen to form copper(I) oxide and have many uses in chemistry. They are synthesized by treating copper(I) compounds with Grignard reagents, terminal alkynes or organolithium reagents;[66] in particular, the last reaction described produces a Gilman reagent. These can undergo substitution with alkyl halides to form coupling products; as such, they are important in the field of organic synthesis. Copper(I) acetylide is highly shock-sensitive but is an intermediate in reactions such as the Cadiot-Chodkiewicz coupling[67] and the Sonogashira coupling.[68] Conjugate addition to enones[69] and carbocupration of alkynes[70] can also be achieved with organocopper compounds. Copper(I) forms a variety of weak complexes with alkenes and carbon monoxide, especially in the presence of amine ligands.[71]
Copper(III) and copper(IV)
Copper(III) is most often found in oxides. A simple example is potassium cuprate, KCuO2, a blue-black solid.[72] The most extensively studied copper(III) compounds are the cuprate superconductors. Yttrium barium copper oxide (YBa2Cu3O7) consists of both Cu(II) and Cu(III) centres. Like oxide, fluoride is a highly basic anion[73] and is known to stabilize metal ions in high oxidation states. Both copper(III) and even copper(IV) fluorides are known, K3CuF6 and Cs2CuF6, respectively.[55]
Some copper proteins form oxo complexes, which also feature copper(III).[74] With tetrapeptides, purple-colored copper(III) complexes are stabilized by the deprotonated amide ligands.[75]
Complexes of copper(III) are also found as intermediates in reactions of organocopper compounds [76][77][78] for example, in the Kharasch–Sosnovsky reaction.
History
A timeline of copper illustrates how this metal has advanced human civilization for the past 11,000 years.[79]
Prehistoric
Copper Age
A corroded copper ingot from Zakros, Crete, shaped in the form of an animal skin (oxhide) typical in that era.
Many tools during the Chalcolithic Era included copper, such as the blade of this replica of Ötzi’s axe
Copper occurs naturally as native metallic copper and was known to some of the oldest civilizations on record. The history of copper use dates to 9000 BC in the Middle East;[80] a copper pendant was found in northern Iraq that dates to 8700 BC.[81] Evidence suggests that gold and meteoric iron (but not smelted iron) were the only metals used by humans before copper.[82] The history of copper metallurgy is thought to follow this sequence: First, cold working of native copper, then annealing, smelting, and, finally, lost-wax casting. In southeastern Anatolia, all four of these techniques appear more or less simultaneously at the beginning of the Neolithic c. 7500 BC.[83]
Copper smelting was independently invented in different places. It was probably discovered in China before 2800 BC, in Central America around 600 AD, and in West Africa about the 9th or 10th century AD.[84] The earliest evidence of lost-wax casting copper comes from an amulet found in Mehrgarh, Pakistan and is dated to 4000 BC.[85] Investment casting was invented in 4500–4000 BC in Southeast Asia[80] and carbon dating has established mining at Alderley Edge in Cheshire, UK, at 2280 to 1890 BC.[86]
Ötzi the Iceman, a male dated from 3300 to 3200 BC, was found with an axe with a copper head 99.7% pure; high levels of arsenic in his hair suggest an involvement in copper smelting.[87] Experience with copper has assisted the development of other metals; in particular, copper smelting led to the discovery of iron smelting.[87]
Copper artifacts from the Old Copper Complex of North America, which may have existed from approximately 9500-5400 years before present.
Production in the Old Copper Complex in Michigan and Wisconsin is dated between 6500 and 3000 BC.[88][89][90] A copper spearpoint found in Wisconsin has been dated to 6500 BC.[88] Copper usage by the indigenous peoples of the Old Copper Complex from the Great Lakes region of North America has been radiometrically dated to as far back as 7500 BC.[88][91][92] Indigenous peoples of North America around the Great Lakes may have also been mining copper during this time, making it one of the oldest known examples of copper extraction in the world.[93] There is evidence from prehistoric lead pollution from lakes in Michigan that people in the region began mining copper c. 6000 BC.[93][88] Evidence suggests that utilitarian copper objects fell increasingly out of use in the Old Copper Complex of North America during the Bronze Age and a shift towards an increased production of ornamental copper objects occurred.[94]
Bronze Age
Natural bronze, a type of copper made from ores rich in silicon, arsenic, and (rarely) tin, came into general use in the Balkans around 5500 BC.[95] Alloying copper with tin to make bronze was first practiced about 4000 years after the discovery of copper smelting, and about 2000 years after «natural bronze» had come into general use.[96] Bronze artifacts from the Vinča culture date to 4500 BC.[97] Sumerian and Egyptian artifacts of copper and bronze alloys date to 3000 BC.[98] Egyptian Blue, or cuprorivaite (calcium copper silicate) is a synthetic pigment that contains copper and started being used in ancient Egypt around 3250 BC.[99] The manufacturing process of Egyptian blue was known to the Romans, but by the fourth century AD the pigment fell out of use and the secret to its manufacturing process became lost. The Romans said the blue pigment was made from copper, silica, lime and natron and was known to them as caeruleum.
The Bronze Age began in Southeastern Europe around 3700–3300 BC, in Northwestern Europe about 2500 BC. It ended with the beginning of the Iron Age, 2000–1000 BC in the Near East, and 600 BC in Northern Europe. The transition between the Neolithic period and the Bronze Age was formerly termed the Chalcolithic period (copper-stone), when copper tools were used with stone tools. The term has gradually fallen out of favor because in some parts of the world, the Chalcolithic and Neolithic are coterminous at both ends. Brass, an alloy of copper and zinc, is of much more recent origin. It was known to the Greeks, but became a significant supplement to bronze during the Roman Empire.[98]
Ancient and post-classical
In alchemy the symbol for copper was also the symbol for the goddess and planet Venus.
In Greece, copper was known by the name chalkos (χαλκός). It was an important resource for the Romans, Greeks and other ancient peoples. In Roman times, it was known as aes Cyprium, aes being the generic Latin term for copper alloys and Cyprium from Cyprus, where much copper was mined. The phrase was simplified to cuprum, hence the English copper. Aphrodite (Venus in Rome) represented copper in mythology and alchemy because of its lustrous beauty and its ancient use in producing mirrors; Cyprus, the source of copper, was sacred to the goddess. The seven heavenly bodies known to the ancients were associated with the seven metals known in antiquity, and Venus was assigned to copper, both because of the connection to the goddess and because Venus was the brightest heavenly body after the Sun and Moon and so corresponded to the most lustrous and desirable metal after gold and silver.[100]
Copper was first mined in ancient Britain as early as 2100 BC. Mining at the largest of these mines, the Great Orme, continued into the late Bronze Age. Mining seems to have been largely restricted to supergene ores, which were easier to smelt. The rich copper deposits of Cornwall seem to have been largely untouched, in spite of extensive tin mining in the region, for reasons likely social and political rather than technological.[101]
In North America, native copper is known to have been extracted from sites on Isle Royale with primitive stone tools between 800 and 1600 AD.[102] Copper annealing was being performed in the North American city of Cahokia around 1000-1300 AD.[103] There are several exquisite copper plates, known as the Mississippian copper plates that have been found in North America in the area around Cahokia dating from this time period (1000-1300 AD).[103] The copper plates were thought to have been manufactured at Cahokia before ending up elsewhere in the Midwest and southeastern United States like the Wulfing cache and Etowah plates.
In South America a copper mask dated to 1000 BC found in the Argentinian Andes is the oldest known copper artifact discovered in the Andes.[104] Peru has been considered the origin for early copper Metallurgy in pre-Columbian America, but the copper mask from Argentina suggests that the Cajon valley of the southern Andes was another important center for early copper workings in South America.[104] Copper metallurgy was flourishing in South America, particularly in Peru around 1000 AD. Copper burial ornamentals from the 15th century have been uncovered, but the metal’s commercial production did not start until the early 20th century.[citation needed]
The cultural role of copper has been important, particularly in currency. Romans in the 6th through 3rd centuries BC used copper lumps as money. At first, the copper itself was valued, but gradually the shape and look of the copper became more important. Julius Caesar had his own coins made from brass, while Octavianus Augustus Caesar’s coins were made from Cu-Pb-Sn alloys. With an estimated annual output of around 15,000 t, Roman copper mining and smelting activities reached a scale unsurpassed until the time of the Industrial Revolution; the provinces most intensely mined were those of Hispania, Cyprus and in Central Europe.[105][106]
The gates of the Temple of Jerusalem used Corinthian bronze treated with depletion gilding.[clarification needed][citation needed] The process was most prevalent in Alexandria, where alchemy is thought to have begun.[107] In ancient India, copper was used in the holistic medical science Ayurveda for surgical instruments and other medical equipment. Ancient Egyptians (~2400 BC) used copper for sterilizing wounds and drinking water, and later to treat headaches, burns, and itching.[citation needed]
Modern
18th-century copper kettle from Norway made from Swedish copper
The Great Copper Mountain was a mine in Falun, Sweden, that operated from the 10th century to 1992. It satisfied two-thirds of Europe’s copper consumption in the 17th century and helped fund many of Sweden’s wars during that time.[108] It was referred to as the nation’s treasury; Sweden had a copper backed currency.[109]
Chalcography of the city of Vyborg at the turn of the 17th and 18th centuries. The year 1709 carved on the printing plate.
Copper is used in roofing,[17] currency, and for photographic technology known as the daguerreotype. Copper was used in Renaissance sculpture, and was used to construct the Statue of Liberty; copper continues to be used in construction of various types. Copper plating and copper sheathing were widely used to protect the under-water hulls of ships, a technique pioneered by the British Admiralty in the 18th century.[110] The Norddeutsche Affinerie in Hamburg was the first modern electroplating plant, starting its production in 1876.[111] The German scientist Gottfried Osann invented powder metallurgy in 1830 while determining the metal’s atomic mass; around then it was discovered that the amount and type of alloying element (e.g., tin) to copper would affect bell tones.[citation needed]
During the rise in demand for copper for the Age of Electricity, from the 1880s until the Great Depression of the 1930s, the United States produced one third to half the world’s newly mined copper.[112] Major districts included the Keweenaw district of northern Michigan, primarily native copper deposits, which was eclipsed by the vast sulphide deposits of Butte, Montana in the late 1880s, which itself was eclipsed by porphyry deposits of the Southwest United States, especially at Bingham Canyon, Utah and Morenci, Arizona. Introduction of open pit steam shovel mining and innovations in smelting, refining, flotation concentration and other processing steps led to mass production. Early in the twentieth century, Arizona ranked first, followed by Montana, then Utah and Michigan.[113]
Flash smelting was developed by Outokumpu in Finland and first applied at Harjavalta in 1949; the energy-efficient process accounts for 50% of the world’s primary copper production.[114]
The Intergovernmental Council of Copper Exporting Countries, formed in 1967 by Chile, Peru, Zaire and Zambia, operated in the copper market as OPEC does in oil, though it never achieved the same influence, particularly because the second-largest producer, the United States, was never a member; it was dissolved in 1988.[115]
Applications
Copper fittings for soldered plumbing joints
The major applications of copper are electrical wire (60%), roofing and plumbing (20%), and industrial machinery (15%). Copper is used mostly as a pure metal, but when greater hardness is required, it is put into such alloys as brass and bronze (5% of total use).[24] For more than two centuries, copper paint has been used on boat hulls to control the growth of plants and shellfish.[116] A small part of the copper supply is used for nutritional supplements and fungicides in agriculture.[59][117] Machining of copper is possible, although alloys are preferred for good machinability in creating intricate parts.
Wire and cable
Despite competition from other materials, copper remains the preferred electrical conductor in nearly all categories of electrical wiring except overhead electric power transmission where aluminium is often preferred.[118][119] Copper wire is used in power generation, power transmission, power distribution, telecommunications, electronics circuitry, and countless types of electrical equipment.[120] Electrical wiring is the most important market for the copper industry.[121] This includes structural power wiring, power distribution cable, appliance wire, communications cable, automotive wire and cable, and magnet wire. Roughly half of all copper mined is used for electrical wire and cable conductors.[122] Many electrical devices rely on copper wiring because of its multitude of inherent beneficial properties, such as its high electrical conductivity, tensile strength, ductility, creep (deformation) resistance, corrosion resistance, low thermal expansion, high thermal conductivity, ease of soldering, malleability, and ease of installation.
For a short period from the late 1960s to the late 1970s, copper wiring was replaced by aluminium wiring in many housing construction projects in America. The new wiring was implicated in a number of house fires and the industry returned to copper.[123]
Electronics and related devices
Copper electrical busbars distributing power to a large building
Integrated circuits and printed circuit boards increasingly feature copper in place of aluminium because of its superior electrical conductivity; heat sinks and heat exchangers use copper because of its superior heat dissipation properties. Electromagnets, vacuum tubes, cathode ray tubes, and magnetrons in microwave ovens use copper, as do waveguides for microwave radiation.[124]
Electric motors
Copper’s superior conductivity enhances the efficiency of electrical motors.[125] This is important because motors and motor-driven systems account for 43%–46% of all global electricity consumption and 69% of all electricity used by industry.[126] Increasing the mass and cross section of copper in a coil increases the efficiency of the motor. Copper motor rotors, a new technology designed for motor applications where energy savings are prime design objectives,[127][128] are enabling general-purpose induction motors to meet and exceed National Electrical Manufacturers Association (NEMA) premium efficiency standards.[129]
Renewable energy production
Renewable energy sources such as solar, wind, tidal, hydro, biomass, and geothermal have become significant sectors of the energy market.[130][131] The rapid growth of these sources in the 21st century has been prompted by increasing costs of fossil fuels as well as their environmental impact issues that significantly lowered their use.
Copper plays an important role in these renewable energy systems.[132][133][134][135][136] Copper usage averages up to five times more in renewable energy systems than in traditional power generation, such as fossil fuel and nuclear power plants.[137] Since copper is an excellent thermal and electrical conductor among engineering metals (second only to silver),[138] electrical systems that utilize copper generate and transmit energy with high efficiency and with minimum environmental impacts.
When choosing electrical conductors, facility planners and engineers factor capital investment costs of materials against operational savings due to their electrical energy efficiencies over their useful lives, plus maintenance costs. Copper often fares well in these calculations. A factor called «copper usage intensity,” is a measure of the quantity of copper necessary to install one megawatt of new power-generating capacity.
Copper wires for recycling
When planning for a new renewable power facility, engineers and product specifiers seek to avoid supply shortages of selected materials. According to the United States Geological Survey, in-ground copper reserves have increased more than 700% since 1950, from almost 100 million tonnes to 720 million tonnes in 2017, despite the fact that world refined usage has more than tripled in the last 50 years.[139] Copper resources are estimated to exceed 5,000 million tonnes.[140][141]
Bolstering the supply from copper extraction is the fact that more than 30 percent of copper installed during the last decade came from recycled sources.[142] Its recycling rate is higher than any other metal.[143]
This article discusses the role of copper in various renewable energy generation systems.
Architecture
Old copper utensils in a Jerusalem restaurant
Copper has been used since ancient times as a durable, corrosion resistant, and weatherproof architectural material.[144][145][146][147] Roofs, flashings, rain gutters, downspouts, domes, spires, vaults, and doors have been made from copper for hundreds or thousands of years. Copper’s architectural use has been expanded in modern times to include interior and exterior wall cladding, building expansion joints, radio frequency shielding, and antimicrobial and decorative indoor products such as attractive handrails, bathroom fixtures, and counter tops. Some of copper’s other important benefits as an architectural material include low thermal movement, light weight, lightning protection, and recyclability
The metal’s distinctive natural green patina has long been coveted by architects and designers. The final patina is a particularly durable layer that is highly resistant to atmospheric corrosion, thereby protecting the underlying metal against further weathering.[148][149][150] It can be a mixture of carbonate and sulfate compounds in various amounts, depending upon environmental conditions such as sulfur-containing acid rain.[151][152][153][154] Architectural copper and its alloys can also be ‘finished’ to take on a particular look, feel, or color. Finishes include mechanical surface treatments, chemical coloring, and coatings.[155]
Copper has excellent brazing and soldering properties and can be welded; the best results are obtained with gas metal arc welding.[156]
Antibiofouling
Copper is biostatic, meaning bacteria and many other forms of life will not grow on it. For this reason it has long been used to line parts of ships to protect against barnacles and mussels. It was originally used pure, but has since been superseded by Muntz metal and copper-based paint. Similarly, as discussed in copper alloys in aquaculture, copper alloys have become important netting materials in the aquaculture industry because they are antimicrobial and prevent biofouling, even in extreme conditions[157] and have strong structural and corrosion-resistant[158] properties in marine environments.
Antimicrobial
Copper-alloy touch surfaces have natural properties that destroy a wide range of microorganisms (e.g., E. coli O157:H7, methicillin-resistant Staphylococcus aureus (MRSA), Staphylococcus, Clostridium difficile, influenza A virus, adenovirus, SARS-Cov-2, and fungi).[159][160] Indians have been using copper vessels since ancient times for storing water, even before modern science realized its antimicrobial properties.[161] Some copper alloys were proven to kill more than 99.9% of disease-causing bacteria within just two hours when cleaned regularly.[162] The United States Environmental Protection Agency (EPA) has approved the registrations of these copper alloys as «antimicrobial materials with public health benefits»;[162] that approval allows manufacturers to make legal claims to the public health benefits of products made of registered alloys. In addition, the EPA has approved a long list of antimicrobial copper products made from these alloys, such as bedrails, handrails, over-bed tables, sinks, faucets, door knobs, toilet hardware, computer keyboards, health club equipment, and shopping cart handles (for a comprehensive list, see: Antimicrobial copper-alloy touch surfaces#Approved products). Copper doorknobs are used by hospitals to reduce the transfer of disease, and Legionnaires’ disease is suppressed by copper tubing in plumbing systems.[163] Antimicrobial copper alloy products are now being installed in healthcare facilities in the U.K., Ireland, Japan, Korea, France, Denmark, and Brazil, as well as being called for in the US,[164] and in the subway transit system in Santiago, Chile, where copper-zinc alloy handrails were installed in some 30 stations between 2011 and 2014.[165][166][167]
Textile fibers can be blended with copper to create antimicrobial protective fabrics.[168][unreliable source?]
Speculative investing
Copper may be used as a speculative investment due to the predicted increase in use from worldwide infrastructure growth, and the important role it has in producing wind turbines, solar panels, and other renewable energy sources.[169][170] Another reason predicted demand increases is the fact that electric cars contain an average of 3.6 times as much copper as conventional cars, although the effect of electric cars on copper demand is debated.[171][172] Some people invest in copper through copper mining stocks, ETFs, and futures. Others store physical copper in the form of copper bars or rounds although these tend to carry a higher premium in comparison to precious metals.[173] Those who want to avoid the premiums of copper bullion alternatively store old copper wire, copper tubing or American pennies made before 1982.[174]
Folk medicine
Copper is commonly used in jewelry, and according to some folklore, copper bracelets relieve arthritis symptoms.[175] In one trial for osteoarthritis and one trial for rheumatoid arthritis, no differences were found between copper bracelet and control (non-copper) bracelet.[176][177] No evidence shows that copper can be absorbed through the skin. If it were, it might lead to copper poisoning.[178]
Compression clothing
Recently, some compression clothing with inter-woven copper has been marketed with health claims similar to the folk medicine claims. Because compression clothing is a valid treatment for some ailments, the clothing may have that benefit, but the added copper may have no benefit beyond a placebo effect.[179]
Degradation
Chromobacterium violaceum and Pseudomonas fluorescens can both mobilize solid copper as a cyanide compound.[180] The ericoid mycorrhizal fungi associated with Calluna, Erica and Vaccinium can grow in metalliferous soils containing copper.[180] The ectomycorrhizal fungus Suillus luteus protects young pine trees from copper toxicity. A sample of the fungus Aspergillus niger was found growing from gold mining solution and was found to contain cyano complexes of such metals as gold, silver, copper, iron, and zinc. The fungus also plays a role in the solubilization of heavy metal sulfides.[181]
Biological role
Rich sources of copper include oysters, beef and lamb liver, Brazil nuts, blackstrap molasses, cocoa, and black pepper. Good sources include lobster, nuts and sunflower seeds, green olives, avocados, and wheat bran.
Biochemistry
Copper proteins have diverse roles in biological electron transport and oxygen transportation, processes that exploit the easy interconversion of Cu(I) and Cu(II).[182] Copper is essential in the aerobic respiration of all eukaryotes. In mitochondria, it is found in cytochrome c oxidase, which is the last protein in oxidative phosphorylation. Cytochrome c oxidase is the protein that binds the O2 between a copper and an iron; the protein transfers 8 electrons to the O2 molecule to reduce it to two molecules of water. Copper is also found in many superoxide dismutases, proteins that catalyze the decomposition of superoxides by converting it (by disproportionation) to oxygen and hydrogen peroxide:
- Cu2+-SOD + O2− → Cu+-SOD + O2 (reduction of copper; oxidation of superoxide)
- Cu+-SOD + O2− + 2H+ → Cu2+-SOD + H2O2 (oxidation of copper; reduction of superoxide)
The protein hemocyanin is the oxygen carrier in most mollusks and some arthropods such as the horseshoe crab (Limulus polyphemus).[183] Because hemocyanin is blue, these organisms have blue blood rather than the red blood of iron-based hemoglobin. Structurally related to hemocyanin are the laccases and tyrosinases. Instead of reversibly binding oxygen, these proteins hydroxylate substrates, illustrated by their role in the formation of lacquers.[184] The biological role for copper commenced with the appearance of oxygen in earth’s atmosphere.[185] Several copper proteins, such as the «blue copper proteins», do not interact directly with substrates; hence they are not enzymes. These proteins relay electrons by the process called electron transfer.[184]
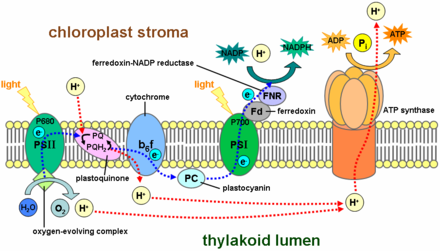
Photosynthesis functions by an elaborate electron transport chain within the thylakoid membrane. A central link in this chain is plastocyanin, a blue copper protein.
A unique tetranuclear copper center has been found in nitrous-oxide reductase.[186]
Chemical compounds which were developed for treatment of Wilson’s disease have been investigated for use in cancer therapy.[187]
Nutrition
Copper is an essential trace element in plants and animals, but not all microorganisms. The human body contains copper at a level of about 1.4 to 2.1 mg per kg of body mass.[188]
Absorption
Copper is absorbed in the gut, then transported to the liver bound to albumin.[189] After processing in the liver, copper is distributed to other tissues in a second phase, which involves the protein ceruloplasmin, carrying the majority of copper in blood. Ceruloplasmin also carries the copper that is excreted in milk, and is particularly well-absorbed as a copper source.[190] Copper in the body normally undergoes enterohepatic circulation (about 5 mg a day, vs. about 1 mg per day absorbed in the diet and excreted from the body), and the body is able to excrete some excess copper, if needed, via bile, which carries some copper out of the liver that is not then reabsorbed by the intestine.[191][192]
Dietary recommendations
The U.S. Institute of Medicine (IOM) updated the estimated average requirements (EARs) and recommended dietary allowances (RDAs) for copper in 2001. If there is not sufficient information to establish EARs and RDAs, an estimate designated Adequate Intake (AI) is used instead. The AIs for copper are: 200 μg of copper for 0–6-month-old males and females, and 220 μg of copper for 7–12-month-old males and females. For both sexes, the RDAs for copper are: 340 μg of copper for 1–3 years old, 440 μg of copper for 4–8 years old, 700 μg of copper for 9–13 years old, 890 μg of copper for 14–18 years old and 900 μg of copper for ages 19 years and older. For pregnancy, 1,000 μg. For lactation, 1,300 μg.[193] As for safety, the IOM also sets tolerable upper intake levels (ULs) for vitamins and minerals when evidence is sufficient. In the case of copper the UL is set at 10 mg/day. Collectively the EARs, RDAs, AIs and ULs are referred to as Dietary Reference Intakes.[194]
The European Food Safety Authority (EFSA) refers to the collective set of information as Dietary Reference Values, with Population Reference Intake (PRI) instead of RDA, and Average Requirement instead of EAR. AI and UL defined the same as in United States. For women and men ages 18 and older the AIs are set at 1.3 and 1.6 mg/day, respectively. AIs for pregnancy and lactation is 1.5 mg/day. For children ages 1–17 years the AIs increase with age from 0.7 to 1.3 mg/day. These AIs are higher than the U.S. RDAs.[195] The European Food Safety Authority reviewed the same safety question and set its UL at 5 mg/day, which is half the U.S. value.[196]
For U.S. food and dietary supplement labeling purposes the amount in a serving is expressed as a percent of Daily Value (%DV). For copper labeling purposes 100% of the Daily Value was 2.0 mg, but as of May 27, 2016 it was revised to 0.9 mg to bring it into agreement with the RDA.[197][198] A table of the old and new adult daily values is provided at Reference Daily Intake.
Deficiency
Because of its role in facilitating iron uptake, copper deficiency can produce anemia-like symptoms, neutropenia, bone abnormalities, hypopigmentation, impaired growth, increased incidence of infections, osteoporosis, hyperthyroidism, and abnormalities in glucose and cholesterol metabolism. Conversely, Wilson’s disease causes an accumulation of copper in body tissues.
Severe deficiency can be found by testing for low plasma or serum copper levels, low ceruloplasmin, and low red blood cell superoxide dismutase levels; these are not sensitive to marginal copper status. The «cytochrome c oxidase activity of leucocytes and platelets» has been stated as another factor in deficiency, but the results have not been confirmed by replication.[199]
Toxicity
Gram quantities of various copper salts have been taken in suicide attempts and produced acute copper toxicity in humans, possibly due to redox cycling and the generation of reactive oxygen species that damage DNA.[200][201] Corresponding amounts of copper salts (30 mg/kg) are toxic in animals.[202] A minimum dietary value for healthy growth in rabbits has been reported to be at least 3 ppm in the diet.[203] However, higher concentrations of copper (100 ppm, 200 ppm, or 500 ppm) in the diet of rabbits may favorably influence feed conversion efficiency, growth rates, and carcass dressing percentages.[204]
Chronic copper toxicity does not normally occur in humans because of transport systems that regulate absorption and excretion. Autosomal recessive mutations in copper transport proteins can disable these systems, leading to Wilson’s disease with copper accumulation and cirrhosis of the liver in persons who have inherited two defective genes.[188]
Elevated copper levels have also been linked to worsening symptoms of Alzheimer’s disease.[205][206]
Human exposure
In the US, the Occupational Safety and Health Administration (OSHA) has designated a permissible exposure limit (PEL) for copper dust and fumes in the workplace as a time-weighted average (TWA) of 1 mg/m3.[207] The National Institute for Occupational Safety and Health (NIOSH) has set a recommended exposure limit (REL) of 1 mg/m3, time-weighted average. The IDLH (immediately dangerous to life and health) value is 100 mg/m3.[208]
Copper is a constituent of tobacco smoke.[209][210] The tobacco plant readily absorbs and accumulates heavy metals, such as copper from the surrounding soil into its leaves. These are readily absorbed into the user’s body following smoke inhalation.[211] The health implications are not clear.[212]
See also
- Copper in renewable energy
- Copper nanoparticle
- Erosion corrosion of copper water tubes
- Cold water pitting of copper tube
- List of countries by copper production
- Metal theft
- Operation Tremor
- Anaconda Copper
- Antofagasta PLC
- Codelco
- El Boleo mine
- Grasberg mine
References
- ^ «Standard Atomic Weights: Copper». CIAAW. 1969.
- ^ Moret, Marc-Etienne; Zhang, Limei; Peters, Jonas C. (2013). «A Polar Copper–Boron One-Electron σ-Bond». J. Am. Chem. Soc. 135 (10): 3792–3795. doi:10.1021/ja4006578. PMID 23418750.
- ^ Lide, D. R., ed. (2005). «Magnetic susceptibility of the elements and inorganic compounds». CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5. Archived from the original (PDF) on 3 March 2011.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). «The NUBASE2020 evaluation of nuclear properties» (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ Robert McHenry, ed. (1992). «Bronze». The New Encyclopædia Britannica. Vol. 3 (15 ed.). Chicago: Encyclopædia Britannica, Incorporated. p. 612. ISBN 978-0-85229-553-3. OCLC 25228234.
- ^ «Copper». Merriam-Webster Dictionary. 2018. Retrieved 22 August 2018.
- ^ Johnson, MD PhD, Larry E., ed. (2008). «Copper». Merck Manual Home Health Handbook. Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc. Archived from the original on 7 March 2016. Retrieved 7 April 2013.
- ^ «Copper in human health».
- ^ a b Trigg, George L.; Immergut, Edmund H. (1992). Encyclopedia of Applied Physics. Vol. 4: Combustion to Diamagnetism. VCH. pp. 267–272. ISBN 978-3-527-28126-8. Retrieved 2 May 2011.
- ^ Smith, William F. & Hashemi, Javad (2003). Foundations of Materials Science and Engineering. McGraw-Hill Professional. p. 223. ISBN 978-0-07-292194-6.
- ^ a b c Hammond, C. R. (2004). The Elements, in Handbook of Chemistry and Physics (81st ed.). CRC Press. ISBN 978-0-8493-0485-9.
- ^ Resistance Welding Manufacturing Alliance (2003). Resistance Welding Manual (4th ed.). Resistance Welding Manufacturing Alliance. pp. 18–12. ISBN 978-0-9624382-0-2.
- ^ Chambers, William; Chambers, Robert (1884). Chambers’s Information for the People. Vol. L (5th ed.). W. & R. Chambers. p. 312. ISBN 978-0-665-46912-1.
- ^ Ramachandran, Harishankar (14 March 2007). «Why is Copper Red?» (PDF). IIT Madras. Retrieved 27 December 2022.
- ^ «Galvanic Corrosion». Corrosion Doctors. Retrieved 29 April 2011.
- ^ a b Grieken, Rene van; Janssens, Koen (2005). Cultural Heritage Conservation and Environmental Impact Assessment by Non-Destructive Testing and Micro-Analysis. CRC Press. p. 197. ISBN 978-0-203-97078-2.
- ^ «Copper.org: Education: Statue of Liberty: Reclothing the First Lady of Metals – Repair Concerns». Copper.org. Retrieved 11 April 2011.
- ^ Rickett, B. I.; Payer, J. H. (1995). «Composition of Copper Tarnish Products Formed in Moist Air with Trace Levels of Pollutant Gas: Hydrogen Sulfide and Sulfur Dioxide/Hydrogen Sulfide». Journal of the Electrochemical Society. 142 (11): 3723–3728. Bibcode:1995JElS..142.3723R. doi:10.1149/1.2048404.
- ^ a b Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729….3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ «Interactive Chart of Nuclides». National Nuclear Data Center. Archived from the original on 25 August 2013. Retrieved 8 April 2011.
- ^ Okazawad, Hidehiko; Yonekura, Yoshiharu; Fujibayashi, Yasuhisa; Nishizawa, Sadahiko; Magata, Yasuhiro; Ishizu, Koichi; Tanaka, Fumiko; Tsuchida, Tatsuro; Tamaki, Nagara; Konishi, Junji (1994). «Clinical Application and Quantitative Evaluation of Generator-Produced Copper-62-PTSM as a Brain Perfusion Tracer for PET» (PDF). Journal of Nuclear Medicine. 35 (12): 1910–1915. PMID 7989968.
- ^ Romano, Donatella; Matteucci, Fransesca (2007). «Contrasting copper evolution in ω Centauri and the Milky Way». Monthly Notices of the Royal Astronomical Society: Letters. 378 (1): L59–L63. arXiv:astro-ph/0703760. Bibcode:2007MNRAS.378L..59R. doi:10.1111/j.1745-3933.2007.00320.x. S2CID 14595800.
- ^ a b c d Emsley, John (2003). Nature’s building blocks: an A–Z guide to the elements. Oxford University Press. pp. 121–125. ISBN 978-0-19-850340-8. Retrieved 2 May 2011.
- ^ Rickwood, P. C. (1981). «The largest crystals» (PDF). American Mineralogist. 66: 885.
- ^ Emsley, John (2003). Nature’s building blocks: an A–Z guide to the elements. Oxford University Press. pp. 124, 231, 449, 503. ISBN 978-0-19-850340-8. Retrieved 2 May 2011.
- ^ Rieuwerts, John (2015). The Elements of Environmental Pollution. London and New York: Earthscan Routledge. p. 207. ISBN 978-0-415-85919-6. OCLC 886492996.
- ^ Randazzo, Ryan (19 June 2011). «A new method to harvest copper». Azcentral.com. Retrieved 25 April 2014.
- ^ Gordon, R.B.; Bertram, M.; Graedel, T.E. (2006). «Metal stocks and sustainability». Proceedings of the National Academy of Sciences. 103 (5): 1209–1214. Bibcode:2006PNAS..103.1209G. doi:10.1073/pnas.0509498103. PMC 1360560. PMID 16432205.
- ^ Beaudoin, Yannick C.; Baker, Elaine (December 2013). Deep Sea Minerals: Manganese Nodules, a physical, biological, environmental and technical review. Secretariat of the Pacific Community. pp. 7–18. ISBN 978-82-7701-119-6. Retrieved 8 February 2021.
- ^ a b Leonard, Andrew (3 March 2006). «Peak copper?». Salon. Retrieved 8 March 2022.
- ^ Brown, Lester (2006). Plan B 2.0: Rescuing a Planet Under Stress and a Civilization in Trouble. New York: W.W. Norton. p. 109. ISBN 978-0-393-32831-8.
- ^ Schmitz, Christopher (1986). «The Rise of Big Business in the World, Copper Industry 1870–1930». Economic History Review. 2. 39 (3): 392–410. doi:10.1111/j.1468-0289.1986.tb00411.x. JSTOR 2596347.
- ^ «Copper Trends: Live Metal Spot Prices». Archived from the original on 1 May 2012.
- ^ Ackerman, R. (2 April 2009). «A Bottom in Sight For Copper». Forbes. Archived from the original on 8 December 2012.
- ^ Employment Appeal Tribunal, AEI Cables Ltd. v GMB and others, 5 April 2013, accessed 5 February 2021
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Su, Kun; Ma, Xiaodong; Parianos, John; Zhao, Baojun (2020). «Thermodynamic and Experimental Study on Efficient Extraction of Valuable Metals from Polymetallic Nodules». Minerals. 10 (4): 360. Bibcode:2020Mine…10..360S. doi:10.3390/min10040360.
- ^ International Seabed Authority. «Polymetallic Nodules» (PDF). International Seabed Authority. Retrieved 8 February 2021.
- ^ Watling, H.R. (2006). «The bioleaching of sulphide minerals with emphasis on copper sulphides – A review» (PDF). Hydrometallurgy. 84 (1): 81–108. Bibcode:2006HydMe..84…81W. doi:10.1016/j.hydromet.2006.05.001. Archived from the original (PDF) on 18 August 2011.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 1174–1175. ISBN 978-0-08-037941-8.
- ^ Samans, Carl (1949). Engineering metals and their alloys. New York: Macmillan. OCLC 716492542.
- ^ Bahadir, Ali Mufit; Duca, Gheorghe (2009). The Role of Ecological Chemistry in Pollution Research and Sustainable Development. Springer. ISBN 978-90-481-2903-4.
- ^ Green, Dan (2016). The Periodic Table in Minutes. Quercus. ISBN 978-1-68144-329-4.
- ^ «International Copper Association». Archived from the original on 5 March 2012. Retrieved 22 July 2009.
- ^ «Overview of Recycled Copper» Copper.org. (25 August 2010). Retrieved on 8 November 2011.
- ^ «Dime». US Mint. Retrieved 9 July 2019.[permanent dead link]
- ^ «Pride and skill – the 10-cent coin». Royal Canadian Mint. Retrieved 9 July 2019.
- ^ «Gold Jewellery Alloys». World Gold Council. Archived from the original on 14 April 2009. Retrieved 6 June 2009.
- ^ Balver Zinn Solder Sn97Cu3 Archived 7 July 2011 at the Wayback Machine. (PDF) . balverzinn.com. Retrieved on 8 November 2011.
- ^ Deane, D. V. «Modern Coinage Systems» (PDF). British Numismatic Society. Retrieved 1 July 2019.
- ^ «What is 90% Silver?». American Precious Metals Exchange (APMEX). Archived from the original on 28 July 2020. Retrieved 1 July 2019.
- ^ Corrosion Tests and Standards. ASTM International. 2005. p. 368.
- ^ Oguchi, Hachiro (1983). «Japanese Shakudō: its history, properties and production from gold-containing alloys». Gold Bulletin. 16 (4): 125–132. doi:10.1007/BF03214636.
- ^ a b c Holleman, A.F.; Wiberg, N. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ Trammell, Rachel; Rajabimoghadam, Khashayar; Garcia-Bosch, Isaac (30 January 2019). «Copper-Promoted Functionalization of Organic Molecules: from Biologically Relevant Cu/O2 Model Systems to Organometallic Transformations». Chemical Reviews. 119 (4): 2954–3031. doi:10.1021/acs.chemrev.8b00368. PMC 6571019. PMID 30698952.
- ^ Wells, A. F. (1984). Structural Inorganic Chemistry (5th ed.). Oxford University Press. pp. 1142–1145. ISBN 978-0-19-965763-6.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 1181. ISBN 978-0-08-037941-8.
- ^ a b Wiley-Vch (2 April 2007). «Nonsystematic (Contact) Fungicides». Ullmann’s Agrochemicals. p. 623. ISBN 978-3-527-31604-5.
- ^ Ralph L. Shriner, Christine K.F. Hermann, Terence C. Morrill, David Y. Curtin, Reynold C. Fuson «The Systematic Identification of Organic Compounds» 8th edition, J. Wiley, Hoboken. ISBN 0-471-21503-1
- ^ Saalwächter, Kay; Burchard, Walther; Klüfers, Peter; Kettenbach, G.; Mayer, Peter; Klemm, Dieter; Dugarmaa, Saran (2000). «Cellulose Solutions in Water Containing Metal Complexes». Macromolecules. 33 (11): 4094–4107. Bibcode:2000MaMol..33.4094S. CiteSeerX 10.1.1.951.5219. doi:10.1021/ma991893m.
- ^ Deodhar, S., Huckaby, J., Delahoussaye, M. and DeCoster, M.A., 2014, August. High-aspect ratio bio-metallic nanocomposites for cellular interactions. In IOP Conference Series: Materials Science and Engineering (Vol. 64, No. 1, p. 012014). https://iopscience.iop.org/article/10.1088/1757-899X/64/1/012014/meta.
- ^ Kelly, K.C., Wasserman, J.R., Deodhar, S., Huckaby, J. and DeCoster, M.A., 2015. Generation of scalable, metallic high-aspect ratio nanocomposites in a biological liquid medium. Journal of Visualized Experiments, (101), p.e52901. https://www.jove.com/t/52901/generation-scalable-metallic-high-aspect-ratio-nanocomposites.
- ^ Karan, A., Darder, M., Kansakar, U., Norcross, Z. and DeCoster, M.A., 2018. Integration of a Copper-Containing Biohybrid (CuHARS) with Cellulose for Subsequent Degradation and Biomedical Control. International journal of environmental research and public health, 15(5), p.844. https://www.mdpi.com/1660-4601/15/5/844
- ^ Birk, James (3 April 2018). «Characteristic Reactions of Iron (Fe³⁺)». LibreText Chemistry. LibreText. Retrieved 3 May 2023.
- ^ «Modern Organocopper Chemistry» Norbert Krause, Ed., Wiley-VCH, Weinheim, 2002. ISBN 978-3-527-29773-3.
- ^ Berná, José; Goldup, Stephen; Lee, Ai-Lan; Leigh, David; Symes, Mark; Teobaldi, Gilberto; Zerbetto, Fransesco (26 May 2008). «Cadiot–Chodkiewicz Active Template Synthesis of Rotaxanes and Switchable Molecular Shuttles with Weak Intercomponent Interactions». Angewandte Chemie. 120 (23): 4464–4468. Bibcode:2008AngCh.120.4464B. doi:10.1002/ange.200800891.
- ^ Rafael Chinchilla & Carmen Nájera (2007). «The Sonogashira Reaction: A Booming Methodology in Synthetic Organic Chemistry». Chemical Reviews. 107 (3): 874–922. doi:10.1021/cr050992x. PMID 17305399.
- ^ «An Addition of an Ethylcopper Complex to 1-Octyne: (E)-5-Ethyl-1,4-Undecadiene» (PDF). Organic Syntheses. 64: 1. 1986. doi:10.15227/orgsyn.064.0001. Archived from the original (PDF) on 19 June 2012.
- ^ Kharasch, M.S.; Tawney, P.O. (1941). «Factors Determining the Course and Mechanisms of Grignard Reactions. II. The Effect of Metallic Compounds on the Reaction between Isophorone and Methylmagnesium Bromide». Journal of the American Chemical Society. 63 (9): 2308–2316. doi:10.1021/ja01854a005.
- ^ Imai, Sadako; Fujisawa, Kiyoshi; Kobayashi, Takako; Shirasawa, Nobuhiko; Fujii, Hiroshi; Yoshimura, Tetsuhiko; Kitajima, Nobumasa; Moro-oka, Yoshihiko (1998). «63Cu NMR Study of Copper(I) Carbonyl Complexes with Various Hydrotris(pyrazolyl)borates: Correlation between 63Cu Chemical Shifts and CO Stretching Vibrations». Inorganic Chemistry. 37 (12): 3066–3070. doi:10.1021/ic970138r.
- ^ G. Brauer, ed. (1963). «Potassium Cuprate (III)». Handbook of Preparative Inorganic Chemistry. Vol. 1 (2nd ed.). NY: Academic Press. p. 1015.
- ^ Schwesinger, Reinhard; Link, Reinhard; Wenzl, Peter; Kossek, Sebastian (2006). «Anhydrous phosphazenium fluorides as sources for extremely reactive fluoride ions in solution». Chemistry: A European Journal. 12 (2): 438–45. doi:10.1002/chem.200500838. PMID 16196062.
- ^ Lewis, E.A.; Tolman, W.B. (2004). «Reactivity of Dioxygen-Copper Systems». Chemical Reviews. 104 (2): 1047–1076. doi:10.1021/cr020633r. PMID 14871149.
- ^ McDonald, M.R.; Fredericks, F.C.; Margerum, D.W. (1997). «Characterization of Copper(III)–Tetrapeptide Complexes with Histidine as the Third Residue». Inorganic Chemistry. 36 (14): 3119–3124. doi:10.1021/ic9608713. PMID 11669966.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 1187. ISBN 978-0-08-037941-8.
- ^ Hickman, A.; Sanford, M. (2012). «High-valent organometallic copper and palladium in catalysis». Nature. 484 (7393): 177–185. Bibcode:2012Natur.484..177H. doi:10.1038/nature11008. PMC 4384170. PMID 22498623.
- ^ Liu, He; Shen, Qilong (2021). «Well-defined organometallic Copper(III) complexes: Preparation, characterization and reactivity». Coord. Chem. Rev. 442: 213923. doi:10.1016/j.ccr.2021.213923.
- ^ A Timeline of Copper Technologies, Copper Development Association, https://www.copper.org/education/history/timeline/
- ^ a b «CSA – Discovery Guides, A Brief History of Copper». Csa.com. Archived from the original on 3 February 2015. Retrieved 12 September 2008.
- ^ Rayner W. Hesse (2007). Jewelrymaking through History: an Encyclopedia. Greenwood Publishing Group. p. 56. ISBN 978-0-313-33507-5.No primary source is given in that book.
- ^ «Copper». Elements.vanderkrogt.net. Retrieved 12 September 2008.
- ^ Renfrew, Colin (1990). Before civilization: the radiocarbon revolution and prehistoric Europe. Penguin. ISBN 978-0-14-013642-5. Retrieved 21 December 2011.
- ^ Cowen, R. «Essays on Geology, History, and People: Chapter 3: Fire and Metals». Retrieved 7 July 2009.
- ^ Thoury, M.; Mille, B.; Séverin-Fabiani, T.; Robbiola, L.; Réfrégiers, M.; Jarrige, J.-F.; Bertrand, L. (15 November 2016). «High spatial dynamics-photoluminescence imaging reveals the metallurgy of the earliest lost-wax cast object». Nature Communications. 7: 13356. Bibcode:2016NatCo…713356T. doi:10.1038/ncomms13356. ISSN 2041-1723. PMC 5116070. PMID 27843139.
- ^ Timberlake, S. & Prag A.J.N.W. (2005). The Archaeology of Alderley Edge: Survey, excavation and experiment in an ancient mining landscape. Oxford: John and Erica Hedges Ltd. p. 396. doi:10.30861/9781841717159. ISBN 9781841717159.
- ^ a b «CSA – Discovery Guides, A Brief History of Copper». CSA Discovery Guides. Archived from the original on 3 February 2015. Retrieved 29 April 2011.
- ^ a b c d Pompeani, David P; Steinman, Byron A; Abbott, Mark B; Pompeani, Katherine M; Reardon, William; DePasqual, Seth; Mueller, Robin H (April 2021). «On the Timing of the Old Copper Complex in North America: A Comparison of Radiocarbon Dates from Different Archaeological Contexts». Radiocarbon. 63 (2): 513–531. Bibcode:2021Radcb..63..513P. doi:10.1017/RDC.2021.7. ISSN 0033-8222. S2CID 233029733.
- ^ Pleger, Thomas C. «A Brief Introduction to the Old Copper Complex of the Western Great Lakes: 4000–1000 BC», Proceedings of the Twenty-Seventh Annual Meeting of the Forest History Association of Wisconsin, Oconto, Wisconsin, 5 October 2002, pp. 10–18.
- ^ Emerson, Thomas E. and McElrath, Dale L. Archaic Societies: Diversity and Complexity Across the Midcontinent, SUNY Press, 2009 ISBN 1-4384-2701-8.
- ^ Bebber, Michelle R.; Buchanan, Briggs; Holland-Lulewicz, Jacob (26 April 2022). «Refining the chronology of North America’s copper using traditions: A macroscalar approach via Bayesian modeling». PLOS ONE. 17 (4): e0266908. Bibcode:2022PLoSO..1766908B. doi:10.1371/journal.pone.0266908. ISSN 1932-6203. PMC 9041870. PMID 35472064.
- ^ Malakoff, David (19 March 2021). «Ancient Native Americans were among the world’s first coppersmiths». Science. doi:10.1126/science.abi6135. ISSN 0036-8075. S2CID 233663403.
- ^ a b Pompeani, David P.; Abbott, Mark B.; Steinman, Byron A.; Bain, Daniel J. (14 May 2013). «Lake Sediments Record Prehistoric Lead Pollution Related to Early Copper Production in North America». Environmental Science & Technology. 47 (11): 5545–5552. Bibcode:2013EnST…47.5545P. doi:10.1021/es304499c. ISSN 0013-936X. PMID 23621800.
- ^ Bebber, Michelle R.; Eren, Metin I. (1 October 2018). «Toward a functional understanding of the North American Old Copper Culture «technomic devolution»«. Journal of Archaeological Science. 98: 34–44. Bibcode:2018JArSc..98…34B. doi:10.1016/j.jas.2018.08.001. ISSN 0305-4403. S2CID 134060339.
- ^ Dainian, Fan. Chinese Studies in the History and Philosophy of Science and Technology. p. 228.
- ^ Wallach, Joel. Epigenetics: The Death of the Genetic Theory of Disease Transmission.
- ^ Radivojević, Miljana; Rehren, Thilo (December 2013). «Tainted ores and the rise of tin bronzes in Eurasia, c. 6500 years ago». Antiquity Publications Ltd.
- ^ a b McNeil, Ian (2002). Encyclopaedia of the History of Technology. London; New York: Routledge. pp. 13, 48–66. ISBN 978-0-203-19211-5.
- ^ Eastaugh, Nicholas; Walsh, Valentine; Chaplin, Tracey; Siddall, Ruth (17 June 2013). Pigment Compendium: Optical Microscopy of Historical Pigments. doi:10.4324/9780080454573. ISBN 9781136373794.
- ^ Rickard, T.A. (1932). «The Nomenclature of Copper and its Alloys». Journal of the Royal Anthropological Institute. 62: 281–290. doi:10.2307/2843960. JSTOR 2843960.
- ^ Timberlake, Simon (11 June 2017). «New ideas on the exploitation of copper, tin, gold, and lead ores in Bronze Age Britain: The mining, smelting, and movement of metal». Materials and Manufacturing Processes. 32 (7–8): 709–727. doi:10.1080/10426914.2016.1221113. S2CID 138178474.
- ^ Martin, Susan R. (1995). «The State of Our Knowledge About Ancient Copper Mining in Michigan». The Michigan Archaeologist. 41 (2–3): 119. Archived from the original on 7 February 2016.
- ^ a b Chastain, Matthew L.; Deymier-Black, Alix C.; Kelly, John E.; Brown, James A.; Dunand, David C. (1 July 2011). «Metallurgical analysis of copper artifacts from Cahokia». Journal of Archaeological Science. 38 (7): 1727–1736. Bibcode:2011JArSc..38.1727C. doi:10.1016/j.jas.2011.03.004. ISSN 0305-4403.
- ^ a b Cortés, Leticia Inés; Scattolin, María Cristina (June 2017). «Ancient metalworking in South America: a 3000-year-old copper mask from the Argentinian Andes». Antiquity. 91 (357): 688–700. doi:10.15184/aqy.2017.28. ISSN 0003-598X. S2CID 53068689.
- ^ Hong, S.; Candelone, J.-P.; Patterson, C.C.; Boutron, C.F. (1996). «History of Ancient Copper Smelting Pollution During Roman and Medieval Times Recorded in Greenland Ice». Science. 272 (5259): 246–249 (247f.). Bibcode:1996Sci…272..246H. doi:10.1126/science.272.5259.246. S2CID 176767223.
- ^ de Callataÿ, François (2005). «The Graeco-Roman Economy in the Super Long-Run: Lead, Copper, and Shipwrecks». Journal of Roman Archaeology. 18: 361–372 (366–369). doi:10.1017/S104775940000742X. S2CID 232346123.
- ^ Savenije, Tom J.; Warman, John M.; Barentsen, Helma M.; van Dijk, Marinus; Zuilhof, Han; Sudhölter, Ernst J.R. (2000). «Corinthian Bronze and the Gold of the Alchemists» (PDF). Macromolecules. 33 (2): 60–66. Bibcode:2000MaMol..33…60S. doi:10.1021/ma9904870. Archived from the original (PDF) on 29 September 2007.
- ^ Lynch, Martin (2004). Mining in World History. p. 60. ISBN 978-1-86189-173-0.
- ^ «Gold: prices, facts, figures and research: A brief history of money». Retrieved 22 April 2011.
- ^ «Copper and Brass in Ships». Retrieved 6 September 2016.
- ^ Stelter, M.; Bombach, H. (2004). «Process Optimization in Copper Electrorefining». Advanced Engineering Materials. 6 (7): 558–562. doi:10.1002/adem.200400403. S2CID 138550311.
- ^ Gardner, E. D.; et al. (1938). Copper Mining in North America. Washington, D. C.: U. S. Bureau of Mines. Retrieved 19 March 2019.
- ^ Hyde, Charles (1998). Copper for America, the United States Copper Industry from Colonial Times to the 1990s. Tucson, Arizona: University of Arizona Press. p. passim. ISBN 0-8165-1817-3.
- ^ «Outokumpu Flash Smelting» (PDF). Outokumpu. p. 2. Archived from the original (PDF) on 24 July 2011.
- ^ Karen A. Mingst (1976). «Cooperation or illusion: an examination of the intergovernmental council of copper exporting countries». International Organization. 30 (2): 263–287. doi:10.1017/S0020818300018270. S2CID 154183817.
- ^ Ryck Lydecker. «Is Copper Bottom Paint Sinking?». BoatUS Magazine. Retrieved 3 June 2016.
- ^ «Copper». American Elements. 2008. Archived from the original on 8 June 2008. Retrieved 12 July 2008.
- ^ Pops, Horace, 2008, «Processing of wire from antiquity to the future», Wire Journal International, June, pp. 58–66
- ^ The Metallurgy of Copper Wire, http://www.litz-wire.com/pdf%20files/Metallurgy_Copper_Wire.pdf Archived 1 September 2013 at the Wayback Machine
- ^ Joseph, Günter, 1999, Copper: Its Trade, Manufacture, Use, and Environmental Status, edited by Kundig, Konrad J.A., ASM International, pp. 141–192 and pp. 331–375.
- ^ «Copper, Chemical Element – Overview, Discovery and naming, Physical properties, Chemical properties, Occurrence in nature, Isotopes». Chemistryexplained.com. Retrieved 16 October 2012.
- ^ Joseph, Günter, 1999, Copper: Its Trade, Manufacture, Use, and Environmental Status, edited by Kundig, Konrad J.A., ASM International, p.348
- ^ «Aluminum Wiring Hazards and Pre-Purchase Inspections». www.heimer.com. Archived from the original on 28 May 2016. Retrieved 3 June 2016.
- ^ «Accelerator: Waveguides (SLAC VVC)». SLAC Virtual Visitor Center. Retrieved 29 April 2011.
- ^ IE3 energy-saving motors, Engineer Live, http://www.engineerlive.com/Design-Engineer/Motors_and_Drives/IE3_energy-saving_motors/22687/
- ^ Energy‐efficiency policy opportunities for electric motor‐driven systems, International Energy Agency, 2011 Working Paper in the Energy Efficiency Series, by Paul Waide and Conrad U. Brunner, OECD/IEA 2011
- ^ Fuchsloch, J. and E.F. Brush, (2007), «Systematic Design Approach for a New Series of Ultra‐NEMA Premium Copper Rotor Motors», in EEMODS 2007 Conference Proceedings, 10–15 June, Beijing.
- ^ Copper motor rotor project; Copper Development Association; «Copper.org: Copper Motor Rotor Project». Archived from the original on 13 March 2012. Retrieved 7 November 2012.
- ^ NEMA Premium Motors, The Association of Electrical Equipment and Medical Imaging Manufacturers; «NEMA — NEMA Premium Motors». Archived from the original on 2 April 2010. Retrieved 12 October 2009.
- ^ IEA (2022), Renewables 2022, IEA, Paris https://www.iea.org/reports/renewables-2022, License: CC BY 4.0
- ^ Global trends in renewable energy investment 2012, by REN21 (Renewable Energy Policy Network for the 21st Century); http://www.ren21.net/gsr
- ^ Will the Transition to Renewable Energy Be Paved in Copper?, Renewable Energy World; Jan 15, 2016; https://www.renewableenergyworld.com/articles/2016/01/will-the-transition-to-renewable-energy-be-paved-in-copper.html Archived 2018-06-22 at the Wayback Machine
- ^ García-Olivares, Antonio, Joaquim Ballabrera-Poy, Emili García-Ladona, and Antonio Turiel. A global renewable mix with proven technologies and common materials, Energy Policy, 41 (2012): 561-57, http://imedea.uib-csic.es/master/cambioglobal/Modulo_I_cod101601/Ballabrera_Diciembre_2011/Articulos/Garcia-Olivares.2011.pdf
- ^ A kilo more of copper increases environmental performance by 100 to 1,000 times; Renewable Energy Magazine; April 14, 2011; http://www.renewableenergymagazine.com/article/a-kilo-more-of-copper-increases-environmental
- ^ Copper at the core of renewable energies; European Copper Institute; European Copper Institute; 18 pages; http://www.eurocopper.org/files/presskit/press_kit_copper_in_renewables_final_29_10_2008.pdf Archived 2012-05-23 at the Wayback Machine
- ^ Copper in energy systems; Copper Development Association Inc.; http://www.copper.org/environment/green/energy.html
- ^ The Rise Of Solar: A Unique Opportunity For Copper; Solar Industry Magazine; April 2017; Zolaika Strong; https://issues.solarindustrymag.com/article/rise-solar-unique-opportunity-copper
- ^ Pops, Horace, 1995. Physical Metallurgy of Electrical Conductors, in Nonferrous Wire Handbook, Volume 3: Principles and Practice, The Wire Association International
- ^ The World Copper Factbook, 2017; http://www.icsg.org/index.php/component/jdownloads/finish/170/2462
- ^ Copper Mineral Commodity Summary (USGS, 2017) https://minerals.usgs.gov/minerals/pubs/commodity/copper/ mcs-2017-coppe.pdf
- ^ Global Mineral Resource Assessment (USGS, 2014) http://pubs.usgs.gov/fs/2014/3004/pdf/fs2014-3004.pdf
- ^ Long-Term Availability of Copper; International Copper Association; http://copperalliance.org/wordpress/wp-content/uploads/2018/02/ICA-long-term-availability-201802-A4-HR.pdf Archived 2018-06-29 at the Wayback Machine
- ^ Will the Transition to Renewable Energy Be Paved in Copper?, Renewable Energy World; Jan 15, 2016; by Zolaikha Strong; https://www.renewableenergyworld.com/articles/2016/01/will-the-transition-to-renewable-energy-be-paved-in-copper.html Archived 2018-06-22 at the Wayback Machine
- ^ Seale, Wayne (2007). The role of copper, brass, and bronze in architecture and design; Metal Architecture, May 2007
- ^ Copper roofing in detail; Copper in Architecture; Copper Development Association, U.K., www.cda.org.uk/arch
- ^ Architecture, European Copper Institute; http://eurocopper.org/copper/copper-architecture.html Archived 9 October 2012 at the Wayback Machine
- ^ Kronborg completed; Agency for Palaces and Cultural Properties, København, «Kronborg completed — Agency for Palaces and Cultural Properties». Archived from the original on 24 October 2012. Retrieved 12 September 2012.
- ^ Berg, Jan. «Why did we paint the library’s roof?». Archived from the original on 25 June 2007. Retrieved 20 September 2007.
- ^ Architectural considerations; Copper in Architecture Design Handbook, http://www.copper.org/applications/architecture/arch_dhb/fundamentals/arch_considerations.htm[permanent dead link]
- ^ Peters, Larry E. (2004). Preventing corrosion on copper roofing systems; Professional Roofing, October 2004, http://www.professionalroofing.net
- ^ Wu, Chun. «Oxidation reaction: Why is the Statue of Liberty blue-green? How does rust work?» (PDF). wepanknowledgecenter.org. Engage Engineering. Archived from the original (PDF) on 25 October 2013. Retrieved 25 October 2013.
- ^ Fitzgerald, K.P.; Nairn, J.; Atrens, A. (1998). «The chemistry of copper patination». Corrosion Science. 40 (12): 2029–50. doi:10.1016/S0010-938X(98)00093-6.
- ^ Application Areas: Architecture – Finishes – patina; http://www.copper.org/applications/architecture/finishes.html
- ^ Glossary of copper terms, Copper Development Association (UK): «Glossary of copper terms». Archived from the original on 20 August 2012. Retrieved 14 September 2012.
- ^ Finishes – natural weathering; Copper in Architecture Design Handbook, Copper Development Association Inc., «Copper.org: Architecture Design Handbook: Finishes». Archived from the original on 16 October 2012. Retrieved 12 September 2012.
- ^ Davis, Joseph R. (2001). Copper and Copper Alloys. ASM International. pp. 3–6, 266. ISBN 978-0-87170-726-0.
- ^ Edding, Mario E., Flores, Hector, and Miranda, Claudio, (1995), Experimental Usage of Copper-Nickel Alloy Mesh in Mariculture. Part 1: Feasibility of usage in a temperate zone; Part 2: Demonstration of usage in a cold zone; Final report to the International Copper Association Ltd.
- ^ Corrosion Behaviour of Copper Alloys used in Marine Aquaculture Archived 24 September 2013 at the Wayback Machine. (PDF) . copper.org. Retrieved on 8 November 2011.
- ^ Copper Touch Surfaces Archived 23 July 2012 at the Wayback Machine. Copper Touch Surfaces. Retrieved on 8 November 2011.
- ^ «EPA Registers Copper Surfaces for Residual Use Against Coronavirus». United States Environmental Protection Agency. 10 February 2021. Retrieved 11 October 2021.
- ^ Montero, David A.; Arellano, Carolina; Pardo, Mirka; Vera, Rosa; Gálvez, Ricardo; Cifuentes, Marcela; Berasain, María A.; Gómez, Marisol; Ramírez, Claudio; Vidal, Roberto M. (5 January 2019). «Antimicrobial properties of a novel copper-based composite coating with potential for use in healthcare facilities». Antimicrobial Resistance and Infection Control. 8 (1): 3. doi:10.1186/s13756-018-0456-4. ISSN 2047-2994. PMC 6321648. PMID 30627427.
- ^ a b «EPA registers copper-containing alloy products». United States Environmental Protection Agency. May 2008. Archived from the original on 29 September 2015.
- ^ Biurrun, Amaya; Caballero, Luis; Pelaz, Carmen; León, Elena; Gago, Alberto (1999). «Treatment of a Legionella pneumophila‐Colonized Water Distribution System Using Copper‐Silver Ionization and Continuous Chlorination» (PDF). Infection Control and Hospital Epidemiology. 20 (6): 426–428. doi:10.1086/501645. JSTOR 30141645. PMID 10395146. S2CID 32388649. Archived from the original (PDF) on 17 February 2019.
- ^ Zaleski, Andrew, As hospitals look to prevent infections, a chorus of researchers make a case for copper surfaces, STAT, 24 September 2020
- ^ Chilean subway protected with Antimicrobial Copper – Rail News from Archived 24 July 2012 at the Wayback Machine. rail.co. Retrieved on 8 November 2011.
- ^ Codelco to provide antimicrobial copper for new metro lines (Chile)[dead link]. Construpages.com.ve. Retrieved on 8 November 2011.
- ^ PR 811 Chilean Subway Installs Antimicrobial Copper Archived 23 November 2011 at the Wayback Machine. (PDF). antimicrobialcopper.com. Retrieved on 8 November 2011.
- ^ «Copper and Cupron». Cupron.
- ^ «Global copper market under supplied, demand on the rise – report». Mining.com. 6 January 2019. Retrieved 13 January 2019.
- ^ «Will the Transition to Renewable Energy Be Paved in Copper?». www.renewableenergyworld.com. 15 January 2015. Archived from the original on 22 June 2018. Retrieved 13 January 2019.
- ^ «Copper and cars: Boom goes beyond electric vehicles». MINING.com. 18 June 2018. Retrieved 13 January 2019.
- ^ «Impact of electric cars in medium-term copper demand ‘overrated’, experts say». MINING.com. 12 April 2018. Retrieved 13 January 2019.
- ^ «Why are Premiums for Copper Bullion So High?». Provident Metals. 20 August 2012. Retrieved 23 January 2019.
- ^ Chace, Zoe. «Penny Hoarders Hope for the Day The Penny Dies». NPR.org. NPR. Retrieved 23 January 2019.
- ^ Walker, W.R.; Keats, D.M. (1976). «An investigation of the therapeutic value of the ‘copper bracelet’-dermal assimilation of copper in arthritic/rheumatoid conditions». Agents and Actions. 6 (4): 454–459. PMID 961545.
- ^ Richmond SJ, Gunadasa S, Bland M, Macpherson H (2013). «Copper bracelets and magnetic wrist straps for rheumatoid arthritis – analgesic and anti-inflammatory effects: a randomised double-blind placebo controlled crossover trial». PLOS ONE. 8 (9): e71529. Bibcode:2013PLoSO…871529R. doi:10.1371/journal.pone.0071529. PMC 3774818. PMID 24066023.
- ^ Richmond, Stewart J.; Brown, Sally R.; Campion, Peter D.; Porter, Amanda J.L.; Moffett, Jennifer A. Klaber; Jackson, David A.; Featherstone, Valerie A.; Taylor, Andrew J. (2009). «Therapeutic effects of magnetic and copper bracelets in osteoarthritis: A randomised placebo-controlled crossover trial». Complementary Therapies in Medicine. 17 (5–6): 249–256. doi:10.1016/j.ctim.2009.07.002. ISSN 0965-2299. PMID 19942103.
- ^ University of Arkansas for Medical Sciences:
Find the Truth Behind Medical Myths Archived 6 January 2014 at the Wayback MachineWhile it’s never been proven that copper can be absorbed through the skin by wearing a bracelet, research has shown that excessive copper can result in poisoning, causing vomiting and, in severe cases, liver damage.
- ^
Truth in Advertising
Tommie Copper - ^ a b Geoffrey Michael Gadd (March 2010). «Metals, minerals and microbes: geomicrobiology and bioremediation». Microbiology. 156 (3): 609–643. doi:10.1099/mic.0.037143-0. PMID 20019082.
- ^ Harbhajan Singh (2006). Mycoremediation: Fungal Bioremediation. p. 509. ISBN 978-0-470-05058-3.
- ^ Vest, Katherine E.; Hashemi, Hayaa F.; Cobine, Paul A. (2013). «Chapter 13 The Copper Metallome in Eukaryotic Cells». In Banci, Lucia (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. pp. 451–78. doi:10.1007/978-94-007-5561-1_13. ISBN 978-94-007-5560-4. PMID 23595680. electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402
- ^ «Fun facts». Horseshoe crab. University of Delaware. Archived from the original on 22 October 2008. Retrieved 13 July 2008.
- ^ a b S.J. Lippard, J.M. Berg «Principles of bioinorganic chemistry» University Science Books: Mill Valley, CA; 1994. ISBN 0-935702-73-3.
- ^ Decker, H. & Terwilliger, N. (2000). «COPs and Robbers: Putative evolution of copper oxygen-binding proteins». Journal of Experimental Biology. 203 (Pt 12): 1777–1782. doi:10.1242/jeb.203.12.1777. PMID 10821735.
- ^
Schneider, Lisa K.; Wüst, Anja; Pomowski, Anja; Zhang, Lin; Einsle, Oliver (2014). «Chapter 8. No Laughing Matter: The Unmaking of the Greenhouse Gas Dinitrogen Monoxide by Nitrous Oxide Reductase«. In Peter M.H. Kroneck; Martha E. Sosa Torres (eds.). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. Vol. 14. Springer. pp. 177–210. doi:10.1007/978-94-017-9269-1_8. ISBN 978-94-017-9268-4. PMID 25416395. - ^ Denoyer, Delphine; Clatworthy, Sharnel A.S.; Cater, Michael A. (2018). «Chapter 16. Copper Complexes in Cancer Therapy». In Sigel, Astrid; Sigel, Helmut; Freisinger, Eva; Sigel, Roland K.O. (eds.). Metallo-Drugs: Development and Action of Anticancer Agents. Metal Ions in Life Sciences. Vol. 18. Berlin: de Gruyter GmbH. pp. 469–506. doi:10.1515/9783110470734-022. ISBN 978-3-11-047073-4. PMID 29394035.
- ^ a b «Amount of copper in the normal human body, and other nutritional copper facts». Archived from the original on 10 April 2009. Retrieved 3 April 2009.
- ^ Adelstein, S. J.; Vallee, B. L. (1961). «Copper metabolism in man». New England Journal of Medicine. 265 (18): 892–897. doi:10.1056/NEJM196111022651806. PMID 13859394.
- ^ M.C. Linder; Wooten, L.; Cerveza, P.; Cotton, S.; Shulze, R.; Lomeli, N. (1 May 1998). «Copper transport». The American Journal of Clinical Nutrition. 67 (5): 965S–971S. doi:10.1093/ajcn/67.5.965S. PMID 9587137.
- ^ Frieden, E.; Hsieh, H.S. (1976). Ceruloplasmin: The copper transport protein with essential oxidase activity. Advances in Enzymology – and Related Areas of Molecular Biology. Vol. 44. pp. 187–236. doi:10.1002/9780470122891.ch6. ISBN 978-0-470-12289-1. JSTOR 20170553. PMID 775938.
- ^ S.S. Percival; Harris, E.D. (1 January 1990). «Copper transport from ceruloplasmin: Characterization of the cellular uptake mechanism». American Journal of Physiology. Cell Physiology. 258 (1): C140–C146. doi:10.1152/ajpcell.1990.258.1.c140. PMID 2301561.
- ^ Dietary Reference Intakes: RDA and AI for Vitamins and Elements Archived 13 November 2018 at the Wayback Machine Food and Nutrition Board, Institute of Medicine, National Academies Press, 2011. Retrieved 18 April 2018.
- ^ Copper. IN: Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Copper. National Academy Press. 2001, PP. 224–257.
- ^ «Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies» (PDF). 2017.
- ^ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF), European Food Safety Authority, 2006
- ^ «Federal Register May 27, 2016 Food Labeling: Revision of the Nutrition and Supplement Facts Labels. FR p. 33982» (PDF).
- ^ «Daily Value Reference of the Dietary Supplement Label Database (DSLD)». Dietary Supplement Label Database (DSLD). Archived from the original on 7 April 2020. Retrieved 16 May 2020.
- ^ Bonham, Maxine; O’Connor, Jacqueline M.; Hannigan, Bernadette M.; Strain, J.J. (2002). «The immune system as a physiological indicator of marginal copper status?». British Journal of Nutrition. 87 (5): 393–403. doi:10.1079/BJN2002558. PMID 12010579.
- ^ Li, Yunbo; Trush, Michael; Yager, James (1994). «DNA damage caused by reactive oxygen species originating from a copper-dependent oxidation of the 2-hydroxy catechol of estradiol». Carcinogenesis. 15 (7): 1421–1427. doi:10.1093/carcin/15.7.1421. PMID 8033320.
- ^ Gordon, Starkebaum; John, M. Harlan (April 1986). «Endothelial cell injury due to copper-catalyzed hydrogen peroxide generation from homocysteine». J. Clin. Invest. 77 (4): 1370–6. doi:10.1172/JCI112442. PMC 424498. PMID 3514679.
- ^ «Pesticide Information Profile for Copper Sulfate». Cornell University. Retrieved 10 July 2008.
- ^ Hunt, Charles E. & William W. Carlton (1965). «Cardiovascular Lesions Associated with Experimental Copper Deficiency in the Rabbit». Journal of Nutrition. 87 (4): 385–394. doi:10.1093/jn/87.4.385. PMID 5841854.
- ^ Ayyat M.S.; Marai I.F.M.; Alazab A.M. (1995). «Copper-Protein Nutrition of New Zealand White Rabbits under Egyptian Conditions». World Rabbit Science. 3 (3): 113–118. doi:10.4995/wrs.1995.249.
- ^ Brewer GJ (March 2012). «Copper excess, zinc deficiency, and cognition loss in Alzheimer’s disease». BioFactors (Review). 38 (2): 107–113. doi:10.1002/biof.1005. hdl:2027.42/90519. PMID 22438177. S2CID 16989047.
- ^ «Copper: Alzheimer’s Disease». Examine.com. Retrieved 21 June 2015.
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0151». National Institute for Occupational Safety and Health (NIOSH).
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0150». National Institute for Occupational Safety and Health (NIOSH).
- ^ OEHHA Copper
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). «Hazardous Compounds in Tobacco Smoke». International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. ISSN 1660-4601. PMC 3084482. PMID 21556207.
- ^ Pourkhabbaz, A.; Pourkhabbaz, H. (2012). «Investigation of Toxic Metals in the Tobacco of Different Iranian Cigarette Brands and Related Health Issues». Iranian Journal of Basic Medical Sciences. 15 (1): 636–644. PMC 3586865. PMID 23493960.
- ^ Bernhard, David; Rossmann, Andrea; Wick, Georg (2005). «Metals in cigarette smoke». IUBMB Life. 57 (12): 805–809. doi:10.1080/15216540500459667. PMID 16393783. S2CID 35694266.
Notes
|
|
|
|
|
| in pure water, or acidic or alkali conditions. Copper in neutral water is more noble than hydrogen. | in water containing sulfide | in 10 M ammonia solution | in a chloride solution |
Further reading
- Massaro, Edward J., ed. (2002). Handbook of Copper Pharmacology and Toxicology. Humana Press. ISBN 978-0-89603-943-8.
- «Copper: Technology & Competitiveness (Summary) Chapter 6: Copper Production Technology» (PDF). Office of Technology Assessment. 2005.
- Current Medicinal Chemistry, Volume 12, Number 10, May 2005, pp. 1161–1208(48) Metals, Toxicity and Oxidative Stress
- William D. Callister (2003). Materials Science and Engineering: an Introduction (6th ed.). Wiley, New York. Table 6.1, p. 137. ISBN 978-0-471-73696-7.
- Material: Copper (Cu), bulk, MEMS and Nanotechnology Clearinghouse.
- Kim BE; Nevitt T; Thiele DJ (2008). «Mechanisms for copper acquisition, distribution and regulation». Nat. Chem. Biol. 4 (3): 176–85. doi:10.1038/nchembio.72. PMID 18277979.
External links
Wikiquote has quotations related to Copper.
Wikimedia Commons has media related to Copper.
Look up copper in Wiktionary, the free dictionary.
Wikisource has original text related to this article:
- Copper at The Periodic Table of Videos (University of Nottingham)
- Copper and compounds fact sheet from the National Pollutant Inventory of Australia
- Copper.org – official website of the Copper Development Association with an extensive site of properties and uses of copper
- Price history of copper, according to the IMF
Автор Б. Вебстер Смит
История меди и ее основных сплавов, бронзы и латуни, фактически является хроникой человеческих усилий с тех пор, как человек вышел из каменного века. Повсеместное распространение медных металлов и их вклад в развитие каждой цивилизации со времен Шумера и додинастического Египта дает им уникальное место в истории технологий.
Этот обзор основан на книге Б. Вебстера Смита « Шестьдесят веков меди », которая была опубликована Британской ассоциацией развития меди в 1965 году. Основанная на другой публикации британского CDA, « Медь сквозь века , шестьдесят веков меди» предназначена для читателей, интересующихся общая история добычи меди, развитие процессов обработки металлов и использования меди за последние шесть тысяч лет.Объем предмета настолько огромен, что некоторые разделы были рассмотрены лишь вкратце, но чувствуется, что книга станет полезным вводным руководством для студентов, изучающих историю, особенно с учетом того, что преподавание истории было расширено, чтобы охватить истоки прикладной науки. наука. Он также должен помочь металлургам, архитекторам, промышленным дизайнерам, инженерам и другим технологам оценить роль медных металлов в прошлом и признать их потенциальный вклад в будущие достижения цивилизации. В книге прослеживаются связи между ранним использованием меди человеком и ее применением сегодня, и, таким образом, излагается непрерывный отчет об удовлетворительном обслуживании, в котором новые применения меди находили практически в каждом столетии.
Оглавление
- Вступление
- Сырье
- Медь в древности
- Медь и бронза в Древней Греции и Риме
- Медь в средние века
- Индустриальный век
- Медь в электротехнике
- Медь в наше время
Вступление
Медь была первым металлом, который использовал человек в любом количестве.Первые мастера, работавшие с медью, вскоре обнаружили, что ее можно легко расколоть на листы, и эти листы, в свою очередь, превращались в формы, которые становились все более сложными по мере роста их навыков. После введения бронзы стало возможным также изготовление широкого спектра отливок. Многие иллюстрации на этом сайте служат для демонстрации прогресса человека как слесаря, кульминацией которого являются бесценное наследие мастеров эпохи Возрождения. Но медь и ее основные сплавы, бронза и латунь, всегда были чем-то большим, чем просто декоративным украшением. Хотя железо стало основным металлом каждой западной цивилизации, начиная с Рима, именно медь использовалась, когда требовалось сочетание прочности и долговечности. Способность противостоять коррозии гарантировала, что медь, бронза и латунь оставались такими же функциональными, как и декоративные материалы, в средние века и последующие столетия в период промышленной революции и до наших дней.
Паровые двигатели Уатта, которые возвестили в современном мире, во многом зависят от железа и угль, с медью и ее сплавы делают меньшую еще значительный вклад, но с последующим развитием электрической мощности меди оказались металл попреимуществу . В первые десятилетия XIX века началась эпоха электротехники, после чего спрос на медь резко возрос. Британия была основным производителем на протяжении большей части XIX века, но новые рудники открывались в США, Чили, а затем и в Африке, пока в 1911 году мировое производство плавленой меди впервые не превысило миллиона тонн в год. С ростом всех отраслей человеческой деятельности, последовавшим за промышленной революцией, были найдены новые важные применения меди, а достижения в области металлургических знаний привели к появлению многих новых медных сплавов.
Сегодня ежегодно производится более 5 миллионов тонн меди, и металлическая медь играет все более важную роль во многих отраслях современной технологии.Пластичность меди, которая привела к ее использованию для водопровода в Древнем Египте, иллюстрируется бесчисленными тысячами миль медных труб в современных водопроводных и отопительных системах: коррозионная стойкость меди, которая побудила римлян использовать ее для обшивки крыша Пантеона сегодня подтверждается тысячами медных крыш современных больших и малых зданий; а электропроводность меди, которую использовал Майкл Фарадей в своих эпохальных экспериментах, остается ключом к современному производству электроэнергии.
Это всего лишь три примера, представленных на этом сайте, где нынешние применения неразрывно связаны с прошлым, но медь также является важным материалом будущего.Солнечное отопление, крупномасштабное опреснение воды, линейный двигатель — все это инновации, в которых медь будет играть все более важную роль. Известные запасы медной руды достаточны для всех предусмотренных требований, и непрерывные металлургические исследования обещают предоставить новые сплавы, обладающие даже превосходными свойствами, чтобы удовлетворить взыскательные требования технологий 21 века.
Человек становится металлическим
В Новом каменном веке люди впервые научились мирно жить вместе в скотоводческих и сельскохозяйственных общинах, из которых возникли постоянные поселения, задолго до того, как они стали сознательно относиться к металлу. Они занимались сельским хозяйством, имели многочисленные домашние орудия и были искусными гончарами, художниками и ремесленниками по кости и, конечно же, по дереву, когда где-то их привлекли сияющие частицы свободного золота в мелководных руслах рек. Похоже, они быстро обнаружили, что этот замечательный камень, в их понимании, можно разбивать на тонкие пластины и даже делать булавки; и, возможно, эти открытия положили начало пытливому поиску, который привел их к обнаружению сначала любопытных кусков самородной меди, хотя она, вероятно, всегда была в дефиците, а затем гораздо более обильного ярко-зеленого «каменного» малахита и близкого к нему голубого связующего азурита. Оба эти карбоната меди не только бросаются в глаза, но и легко отделяются от земли. Несомненно, люди также рано научились отличать «золото дураков» * ярко-желтый железный колчедан и очень похожую желтую медную руду, медный колчедан *, от настоящего золота, с которым они, возможно, сначала легко могли принять его за это. Наши знания о самом раннем интересе человека к металлам на заре доисторических времен никогда не будут более чем гипотетическими, но можно с большей уверенностью утверждать, что, что касается меди, эти события произошли в пятом тысячелетии до нашей эры; следовательно, человеческие знания о меди должны датироваться не менее шести тысяч лет.
В тот период две великие реки, Евфрат и Нил, питали значительную цивилизацию у своего устья. Первый, вероятно, был более древним, так как он, помимо прочего, способствовал развитию искусства производства кирпича, которое изначально было неизвестно в Египте. На нижнем Ниле было два царства, Верхний и Нижний Египет. В общих чертах, дата ранней шумерской цивилизации, которая сгруппировалась вокруг Ура и других городов, может быть установлена от 3500 до 4000 до н.э., а додинастический Египет охватывал тот же период или, возможно, немного позже. Царь Менес, от правления которого взята вся египетская хронология *, завоевал Нижний Египет и объединил две части народа Нила в одну нацию около 3200 г. до н.э.
Целый ряд других, но менее важных центров ранней цивилизации на Ближнем и Среднем Востоке был обнаружен археологами в течение последних десятилетий, но они, безусловно, моложе, а их даты чрезвычайно гипотетичны.
Два других крупных центра человечества находились подальше, в Индостане и Китае.Обладая огромным населением и обильными сельскохозяйственными ресурсами, эти цивилизации также уходят корнями в далекое прошлое; но китайские записи не могут быть точно датированы третьим тысячелетием до нашей эры, и цивилизация Индии, вероятно, впервые начала процветать в этот период. Ни тот, ни другой, похоже, не заимствовали многого от шумеров или египтян, поскольку географические барьеры, особенно в случае Китая, препятствовали любому обмену культурами.
Именно на этом историческом фоне нужно попытаться разгадать самую раннюю историю меди.
* В этой публикации используется хронология, принятая в настоящее время Британским музеем.
Первоначальные источники поставок
Шумеры, вероятно, черпали свои первые запасы меди из этой сокровищницы металлических месторождений, горной страны вокруг озера Ван в Армении. Там же было найдено ручное олово, из которого можно было сделать бронзу путем смешивания оловянной и медной руды; но похоже, что на протяжении многих веков он не использовался преднамеренно. Теперь очевидно, что сначала наступил очень отчетливый медный век, и это в равной степени имело место в Египте и других местах.
Египет, вероятно, черпал свои первые запасы меди из самородного металла и из обильного малахита на холмах Красного моря в Восточной пустыне, поскольку старые рудники лежат почти на естественном торговом пути к Красному морю. Египтяне так же высоко ценили бирюзу и изумруды, как и серебро; и во времена ранней династии они получали эти драгоценные камни из странной горной пустыни Магара на юго-западе Синая. Этот источник стал достаточно известным для Снефера, около 2800 г. до н.э., чтобы послать армию специально для завоевания этого места. Экспедиция прошла успешно, и, кроме того, она вернула немного малахита, видимо, по ошибке; потому что он был назван египтянами «ложным изумрудом».
Примерно в то же время на Кипр поступали медные предметы из Египта и подобные предметы с клинописными надписями из Шумера, вероятно, отправленные обычным пустынным путем через Сирию в Средиземное море. Тогда или позже Кипр разработал свои собственные медные рудники, получившие известность во всем Восточном Средиземноморье.
Похоже, что это были три основных источника металла в древние времена.
Название «Медь»
В своих рисунках египтяне использовали знак анк для меди. Соответственно, это также был символ Вечной Жизни; и поскольку это по-прежнему остается одной из основных характеристик меди, сегодня она повсеместно используется для изготовления металла.Спустя долгое время Гомер, следуя греческой практике около 1000 г. до н.э., назвал металл Халкосом; следовательно, медный век также известен как энеолит. Наконец, по прошествии еще тысячи лет, слова «aes Cyprium» появляются в римских писаниях раннехристианской эры, потому что большая часть металла пришла с Кипра. «Медь» — это английская версия этой латинской фразы.
Испанские рудники
В 13 веке до нашей эры финикийцы, тогда предприимчивая и быстро растущая нация торговцев и мореплавателей, отправились в Атлантику и основали Кадис (1240 год до нашей эры). Вскоре они распространились на небольшое расстояние вглубь страны до Уэльвы, где они обнаружили и начали разработку огромной массы медистого пирита, который до сих пор является крупнейшим в мире пиритом такого типа, хотя сейчас он рассматривается в первую очередь как источник серы. Впоследствии месторождения Рио-Тинто и соседнего Фарсиса стали одним из важнейших источников меди; и после того, как римляне завоевали Карфаген в Первой Пунической войне, они заняли всю Испанию и захватили рудники.
Первоначально большинство рудников, содержащих металл, были просто открытыми траншеями или небольшими выемками на склонах холмов. Затем следовали наклонные туннели или штольни, которые обеспечивали как вход для горняков, так и выход продукта, помимо простого средства борьбы с постоянно присутствующей опасностью шахтных вод. Римляне с их гением инженерии значительно усовершенствовали эти методы, особенно в Испании, где они превратили холм, пропитанный медной рудой, в долину. Их метод дробления пород заключался в нагревании их огнем, а затем в обливании их холодной водой, чтобы вызвать разрушение путем быстрого охлаждения.Были вырыты глубокие шахты, стены которых были облицованы деревом, а водяные колеса использовались для дренажа; несколько десятков этих колес до сих пор сохранились. Узор колеса был по существу таким же, как египтяне уже более двух тысяч лет использовали для забора оросительной воды из Нила. Римские шахты, по крайней мере тридцать из этих деревянных колес, которые вращались на бронзовых шпинделях, изготовленные из сплава 91 1 /2 процентов меди, 6 1 /4 процентов олова и 1 3 /4 процента свинца. Ведра были помещены на крючки на конце каждой спицы. Обычное количество в большинстве случаев было двадцать четыре на колесо. Рабы работали с колесом, как на беговой дорожке, и каждый поднимал воду примерно на 10 футов.Шахтеры спускались в яму по вбитым в стену ступенькам, ямы для которых сохранились.
Римлянам действительно удалось опустить одну выработку на тысячу футов ниже поверхности, причем некоторые шахты имели подъем на 40 градусов. Внизу свет давали масляные лампы со специальными фитилями. Утверждается, что своими подземными разработками эти замечательные люди обнаружили около сотни линз руды.
Другие римские источники снабжения
До создания Империи римляне также добывали медь в Мадженпеке в Югославии, а также на рудниках в Малой Азии. На самом деле они были заядлыми искателями металлов, но особенно золота, серебра, меди, олова и свинца, а позднее и железа.Помимо огромных залежей медной желтой руды в Испании, основной медной рудой был малахит после того, как была исчерпана гораздо менее распространенная самородная медь. Римляне, возможно, также использовали очень заметную зеленовато-синюю хризоколлу (силикат меди) и, возможно, немного очень богатой руды халькоцита, который часто бывает серым или черным, а иногда мягким и сажистым (взгляд меди). Великой базой римских поставок была Испания. Сульфид меди, обнаруженный в испанских рудниках, представляет собой ярко-желтый халькопирит; он содержит почти равные части меди, серы и железа. Его необходимо плавить, тогда как другие можно легко, хотя и медленно, выщелачивать из их каменной матрицы. Таким образом, довольно давно старые металлурги, должно быть, столкнулись с некоторыми серьезными проблемами; но в данном случае замечательная чистота испанских шлаков, огромные количества которых еще остались, свидетельствует об их успехе.
Начало бронзы
Самая ранняя точная дата, обычно приписываемая настоящему бронзовому литью, — это около 2500 г. до н.э., то есть через 700 или более лет после того, как стало известно, что использовалась медь; тем не менее многочисленные анализы показывают, что медные артефакты, датируемые примерно 3000 г. до н.э., иногда содержат небольшое и переменное процентное содержание олова. Их можно рассматривать как «случайные бронзы».
Одна из первых вещей, которую должен был усвоить первый медник, заключалась в том, что, когда он ковал медь, он укреплял ее и, наоборот, нагревая объект, он мог снова размягчить или отжечь его. Таким образом, нелегированный металл можно было изготавливать и резать множеством различных способов. Но когда какой-то неизвестный изобретатель задумал намеренно добавлять в расплав фиксированное количество оловянной руды, он произвел настоящую бронзу и тем самым положил начало бронзовому веку. Поскольку бронза была более твердой, почти такой же прочной и решительно более легкой в литье, чем медь, хотя она гораздо более склонна к разрушению, если не была сделана должным образом, ее использование быстро распространилось. В странах Средиземноморья бронзу не вытесняли более 2000 лет, а в северо-западной Европе, где методы добычи и обработки железа были медленнее, чем методы Хальштадта и Рима, она просуществовала на много веков дольше. Между тем и бронза, и медь шли бок о бок. Нельзя доверять музейным этикеткам на экспонатах, если не был проведен анализ, и только в последние годы он стал систематически проводиться.
Древнее олово почти всегда было ручным оловом, самородки руды были найдены в гравии ручья, возможно, в поисках золота. В Армении встречается оловянная руда, но повсюду в мире она намного реже меди. Основные европейские месторождения находятся в Саксонии и Корнуолле. Британское олово было широко известно, возможно, еще в 1000 г. до н.э. ибо, как хорошо известно, иммиграция из Испании через Ирландию проходила круговыми путями, по крайней мере, за несколько сотен лет до того, как кто-то сможет навести порядок в Англии. Несомненно, Галл и Кент тоже должны были поддерживать связь, но между Кентом и Корнуоллом лежал обширный сплошной лес.Добыча британского олова очень рано превратилась в довольно организованную отрасль. Металл был отлит на месте в слитки, и один из возможных плавильных заводов находился на горе Святого Михаила, где были обнаружены обильные горные шлаки из шлака, и где также находился порт Иктис, откуда торговцы переходили в Галлию и так далее. к Средиземному морю. (1)
- Бромхед, Практическая геология CEN в Древней Британии. Pt. I: Металлы. Proc.Геол.Ass., Lond.(1947).
Ранняя добыча меди в Великобритании
Из-за ее тесной связи с оловом в рудниках медь почти наверняка была обнаружена в Корнуолле в ту же дату, но насколько далеко она была экспортирована, если вообще была экспортирована, неизвестно. Римлянам, например, это могло быть мало нужно, поскольку они обладали обильными и более доступными припасами с Кипра и Испании;в то время как ирландцы разрабатывали, по-видимому, задолго до христианской эры, свои собственные месторождения меди в Авоке, в горах Уиклоу. Никаких современных записей не существует, и большая часть данных была получена только на основе умозаключений, но, тем не менее, совершенно очевидно, что кельтские народы Британии обладали хорошими, хотя, без сомнения, элементарными знаниями в области металлургии обоих металлов, и большая часть их старых работ была сделана раньше. римское нашествие. Главные британские медные рудники находились в Олдерли-Эдж в Чешире, где легко обрабатываемый малахит был в изобилии. Были и другие в Амлуче, в Англси, а также в Северном Уэльсе, Шропшире, Конистоне и на юго-западе Шотландии.Согласно «Бромхеду», все это были выработки на поверхности, обычные траншеи и круглые ямы, некоторые из которых когда-то были богаты силикатом меди (хризоколла).Попыток загнать галереи не было. Вероятно, туземцы продолжали обрабатывать месторождения под бдительным взором римских надзирателей; для захватчиков больше интересовал свинец, добыча которого была имперским заповедником.
В Лландидно было несколько небольших римских медных рудников, где в карьере на Грейт-Орм-Хед была добыта монета Аврелиана (270 г. н.э.), а в отвальных отвалах было найдено множество более поздних рудников. Эта руда была карбонатом меди. Был большой римский рудник в Llanymynech и другой в Machynlleth, первый состоял из большого количества конусообразных ям и большой открытой траншеи с серией галерей, ведущих в камеры. Здесь были найдены монеты Антонина и Фаустины (138 г. н.э.). Из шотландских источников происходит торт, похожий на те, что найдены в Уэльсе (см. Ниже). В Марасионе, Корнуолл, где дорога ведет к горе Святого Михаила, в 1825 году в болоте был найден сосуд из чистой меди; в нем было несколько тысяч медных монет примерно 260 г. н.э.
Практика ранней плавки
Практически вся руда, используемая древними, отбиралась вручную, из них брали только самый ценный материал. Первоначально его, вероятно, выплавляли шумеры в неглубоких ямах, используя древесный уголь в качестве топлива. Как они впервые получили необходимую тягу для повышения температуры, достаточной для плавления руды, все еще остается предметом предположений, но, возможно, это было сделано путем наклона печи глиной и оставления отверстия, направленного навстречу преобладающему ветру. Сильфоны, безусловно, были известны примерно к 2500 г. до н.э., и некоторые формы мехов, должно быть, использовались еще раньше, чтобы объяснить более древнюю бронзу. Только в 2000 году до нашей эры или позже эти улучшения достигли Египта, где иероглифы того периода показывают, что воздух вдувается в печь по прямой трубе. Чуть позже сильфонные попали в Египет.
Спустя долгое время плавильные печи приобрели форму, которую они сохраняли вплоть до викторианской эпохи Суонси, то есть небольшая каменная или кирпичная камера с некоторыми средствами разливки или выливания расплавленного металла, очаг внизу и кирпичный дымоход, обычно низкий и коренастый. , который создавал восходящий поток и позволял отходящим газам выходить. Состояние атмосферы вокруг таких печей можно представить, но и жизнь, и рабочая сила были дешевыми. Римляне усовершенствовали ранние примитивные методы, но не изменили основного принципа; и, как уже упоминалось, они успешно выплавляли сульфидные руды, которые бросили бы вызов более древним металлургам.
В Британии на Англси было найдено несколько круглых медных лепешек, отлитых в римские времена. Эти торты были от 11 до 13 в. В диаметре, от 2 до 2 1 /2. Глубоко, и весил от 30 до 50 фунтов за штуку. Они были сформированы путем выливания металла в неглубокий лоток. Сравнительно гладкая полоса, которая всегда находится на верхней поверхности непосредственно по периметру, связана с более быстрым охлаждением металла в том месте, где он касался холодного лотка. Центральная часть показывает заметный подъем из-за выделения сернистой кислоты и доказывает, что в то время выплавлялись сульфидные руды. Металл должен быть разлит из печи, а не выпускаться.Один прибыл из Амлуча; он весит 42 фунта. и проштамповано «ИВЛС». На другом написано «СОЦИО РОМАЕ». (2)
(2) Там же, с. 352
Средневековые источники английской меди
После того, как римляне покинули Британию, о саксонской металлургии почти ничего не известно; но во времена царей Плантагенетов в Британию, безусловно, поставлялась медь с континента, в основном из Германии. В течение 13-го века в Мансфельде разрабатывалась ценная и очень обширная медная руда, и в Фалуне, Швеция, примерно в 10 милях к северо-западу от Стокгольма действовал не менее известный рудник. Лишь во времена Тюдоров началась добыча меди в Англии, когда начались раскопки в Камберленде, а затем и в Корнуолле; Немецкие горняки были импортированы специально для этой цели. Эти местные события привели к созданию Королевских шахт в Суонси (стр. 44). Промышленность, которая также включала производство латуни из каламина, обнаруженного на холмах Мендип, сосредоточилась в этом регионе; Суонси оставался главным центром выплавки и рафинирования меди со всего мира до середины викторианского периода.
Годы пика добычи меди в Великобритании
Расцвет британской добычи меди пришелся на начало XIX века, когда Великобритания производила более половины мировой добычи, большая часть которой приходилась на Корнуолл. Промышленные потребности также быстро росли, так что большие объемы металла все еще приходилось импортировать из-за границы, особенно из России, которая в то время была очень важным производителем, и из Чили. К концу столетия, однако, большие, легкодоступные объемы добычи, добытые за границей, в сочетании с растущим истощением корнуоллских рудников и серьезными проблемами и расходами из-за наличия воды в выработках, снизили добычу. руды Корнуолла с 18 300 тонн в год практически до нуля. Но к 1933 году предполагаемый объем производства на плавильных заводах в мире вырос с 291 000 тонн в 1852 году до примерно трех миллионов тонн в год. Самой большой единственной причиной этого большого расширения был огромный рост электротехнической промышленности (см. Главу 6).
В середине 18 века количество проданной британской меди превышало 700 000 тонн; а с 1771 по 1838 год всего в этой стране было произведено около 5 миллионов тонн.Рудник Пэрис в Англси в прошлом был важным производителем. Добыча меди была возобновлена здесь в 1757 году после перерыва в несколько столетий, и в течение многих лет этот рудник регулярно производил от 2000 до 3000 тонн меди в год, причем выработки постепенно опускались до глубины 1030 футов. Руда Париса представляет собой сложный сульфид. Из-за той непоследовательности, которая была уделом стольких рудников, предложение снова упало, но оно снова возродилось в середине викторианской эпохи.
В настоящее время из британских руд практически не добывают медь.
Старые источники металла за рубежом
В ряде континентальных стран есть месторождения меди, но ни одна из них не может сравниться с колоссальной добычей на рудниках Америки, Канады, Замбии и других африканских стран. Некоторые австрийские медные рудники, в основном в Миттсберге и Китцбюле, имеют долгую историю, которая, как утверждается, восходит к бронзовому веку; но здесь, как и везде в Европе, великие времена добычи меди приходились на период между 15 и 17 веками.
Знаменитые рудники Мансфельда на юге Германии и меньшие рудники Раммельсберга также разрабатывались веками; действительно, история Мансфельда насчитывает как минимум 750 лет.
Знаменитая шведская шахта Фалун работает непрерывно с 13 века; Производство было на пике в 16-17 веках, когда дым от плавильных печей фактически уничтожил всю растительность в окрестностях, и такое положение продолжалось много лет. В этой связи есть хорошо известная история, которая вполне может оказаться правдой. В 1670 году на шахте случайно погиб молодой шахтер по имени Исраэльсон, который был помолвлен. Его тело было обнаружено лишь сорок девять лет спустя, в 1719 году, когда оно было настолько хорошо сохранено парами медного купороса, что его бывшая возлюбленная, тогда еще старуха, все еще могла его узнать.
В Норвегии много мелких месторождений меди. Один из самых важных, в Конгсберге, эксплуатировался 1490 г., а другие — в Телемарке к 1540 г.
Финляндия, производившая в XIX веке умеренное количество металла, в настоящее время является крупным производителем, несмотря на то, что некоторые крупные и потенциально очень ценные месторождения медно-никелевого сплава в Петсамо были захвачены Советской Россией вскоре после последней войны. Важные медные рудники русских, разбросанные вдоль Уральских гор, начали работать в 1700 году. Советский Союз также обнаружил очень ценные месторождения в 1930-х годах в Казахстане, недалеко от южной оконечности озера Байкал; потеря территории в 1941-1942 годах, когда большая часть европейской части России была оккупирована немцами, вызвала замечательную промышленную трансформацию в том, что до этого было малонаселенной полупустынной дикой природой.
На Востоке небольшие индийские рудники эксплуатировались на протяжении многих веков. Японские медные записи восходят по крайней мере к 700 году нашей эры, когда местный медный слиток был подарен Императору. В настоящее время на главном острове разрабатывается довольно много месторождений различной важности. В Китае тоже есть многочисленные медные рудники.
Великое расширение добычи меди в Америке
Основными современными источниками металла были две Америки, а также Центральная и Южная Африка.
Две великие цепи Анд с высоким плато Перу между ними необычайно богаты металлами — оловом в Боливии и серебром, медью и золотом в Перу и Чили, а также рядом других важных экономических минералов. Некоторые из этих рудников разрабатывались инками, другие разрабатывались испанскими конкистадорами, но именно во второй половине XIX века горная промышленность стала действительно крупной отраслью.Развитие идет непрерывно, и сегодня открываются новые рудники: известные названия — Серро-де-Паско, Чукикамата, Браден, Корокоро и т. Д. Серро-де-Паско, расположенный на высоте 18 000 футов, является одним из самых высоких рудников в мир. В Чукикамате был выкопан огромный карьер, который является одним из крупнейших в мире: добыча в серьезных масштабах началась там только в 1879 году по инициативе Великобритании. Сначала чилийская руда экспортировалась в Суонси, но это прекратилось после постройки местных плавильных заводов. Стоит запись , что в среднем за год между двумя мировыми войнами — скажем, 1927 — 7 1 были вырыты / 2 миллиона тонн медной руды на только Chuquicamata, которая давала 123.000 тонн меди.
Рудник Браден в Эль-Тениенте, недалеко от Ранкагуа, Чили, довольно уникален. Он занимает сильно минерализованное ядро или пробку потухшего вулкана.
Многочисленные крупные медные рудники Соединенных Штатов, которые сейчас производят около миллиона тонн меди в год, начали эксплуатироваться в основном в 1850-х годах. Разработка рудников Канады началась в основном на рубеже веков, а шахт Замбии — вскоре после Первой мировой войны. Многие названия рудников стали нарицательными как в отрасли, так и среди инвесторов, например, Роан Антилопа, Муфулира, Н’Чанга, Анаконда, Кеннекотт, Чино, Майами, Садбери, Норанда.
Каким бы ни был металл, срок службы каждого отдельного рудника обычно ограничен, но некоторые месторождения меди настолько обширны, что им еще предстоит долгая жизнь. Другие теперь просто известные имена. Оригинальный рудник Кеннекотт, который находился на Аляске, является тому примером. Одним из самых долгоживущих из великих медных рудников были Калумет и Хекла с их сказочно богатыми месторождениями самородной меди на полуострове Кевино в Мичигане. Производство началось в 1865 году и с тех пор ведется непрерывно, хотя в последние годы большая часть меди была получена путем рекультивации. К 1930 году общий годовой объем производства меди на этом одном руднике все еще был рядом с крупнейшим в Соединенных Штатах, а общий объем на тот момент составлял лишь 1 3/4 миллиона тонн рафинированной меди.
О большом вкладе в мировые поставки меди, который в наше время внесли Канада и Замбия, см. Стр. 76-78.
В Австралии и Тасмании также есть ценные медные рудники.
История меди
Добрый день, уважаемый читатель, в данной статье хочу рассказать о меди и её свойствах. Что такое медь? Ответ на этот вопрос знают почти все. Она имеет обозначение Cu (произносится купрум) в таблице В. И. Менделеева находится под атомным номером 29. Медь – химический элемент, представляет собой металл. Название меди Cuprum является латинским и происходит от названия острова Кипр.
Данный металл широко применяется человеком уже долгие годы. Имеются достоверные факты о том, что индейцы, жившие в Эквадоре уже в XV веке умели добывать и использовать медь. Из неё они изготовляли монеты в виде топориков.
Данная монета очень продолжительное время являлась единственным денежным знаком, который существовал на побережье Южной Америки. Эта монета даже использовалась в торговле с инками. На острове Кипр, в III веке до нашей эры уже были открыты медные рудники. Известен интересный факт, что древние алхимики называли медь — венера (Venus).
Происхождение меди
Медь в природе встречается либо в самородках, либо в соединениях. Особое значение в промышленности имеют халькозин, борнит и медный колчедан. Однако и такие популярные в ювелирном деле поделочные самоцветы, как лазурит и малахит практически на сто процентов состоят из меди.
Медь имеет золотисто – розовую окраску. На воздухе этот металл очень быстро окисляется и покрывается оксидной плёнкой, которая называется патина. Именно из-за патины медь приобретает желтовато – красный цвет. Этот металл входит в состав очень многих сплавов, которые широко используются в промышленности.
Распространённые сплавы меди
Самым известным сплавом является дюралюминий, который состоит из сплава меди и алюминия. Медь в дюралюминии играет главную роль. Мельхиор также содержит медь в соединении с никелем, бронза – соединение олова и меди, латунь – сплав меди с цинком.
Медь обладает довольно высокой тепло и электропроводностью. По сравнению с другими металлами, она занимает второе место после серебра по электропроводности. В ювелирном производстве часто используют сплавы золота с медью. Медь в данном сплаве нужна для увеличения прочности ювелирных украшений к деформациям и истиранию.
В давние времена был известен сплав меди с оловом и цинком, который назывался пушечный металл. Как вы уже, наверно, догадались, что из данного сплава изготавливали пушечные ядра, но с развитием новых технологий, пушки перестали использовать и выпускать, однако данный сплав по сей день используется в производстве оружейных гильз.
Медь имеет бактерицидные свойства и поэтому она широко применяется в медицине, которые очень часто применяются в медицине. Данный факт доказан научными экспериментами и исследованиями. Особенно хорошо медь противостоит золотистому стафилококку. Этот микроб вызывает большое количество гнойных заболеваний кожи.
Токсичность меди
В тоже время известны факты того, что медь бывает очень токсичной. На планете Земля существует озеро Беркли Пит, оно находится в США в штате Монтана. Так вот это озеро считается самым токсичным в мире. Причиной тому является медный рудник, на месте которого образовалось озеро.
Вода в озере очень токсична, в ней почти нет живых организмов, а глубина озера составляет более 0,5 километра. Сильную токсичность воды доказывает один пример, который произошёл однажды на озере. Стая диких гусей, состоявшая из 35 взрослых особей, опустилась на водную гладь озера, а через 2,5 часа все птицы были найдены погибшими.
Однако, совсем недавно, на дне озера были обнаружены совсем новые микроорганизмы и водоросли, которые не встречались ранее в природе. В результате мутаций, данные жители хорошо себя чувствуют в токсичной воде озера.
|
Медь / Cuprum (Cu) |
|
|---|---|
| Атомный номер |
29 |
| Внешний вид простого вещества | пластичный металл золотисто-розового цвета
|
| Свойства атома | |
| Атомная масса (молярная масса) |
63,546 а. е. м. (г/моль) |
| Радиус атома |
128 пм |
| Энергия ионизации (первый электрон) |
745,0 (7,72) кДж/моль (эВ) |
| Электронная конфигурация |
[Ar] 3d10 4s1 |
| Химические свойства | |
| Ковалентный радиус |
117 пм |
| Радиус иона |
(+2e) 72 (+1e) 96 пм |
| Электроотрицательность (по Полингу) |
1,90 |
| Электродный потенциал |
+0,337 В/ +0,521 В |
| Степени окисления |
2, 1 |
| Термодинамические свойства простого вещества | |
| Плотность |
8,96 г/см³ |
| Удельная теплоёмкость |
24,465 Дж/(K·моль) |
| Теплопроводность |
401 Вт/(м·K) |
| Температура плавления |
1356,6 K |
| Теплота плавления |
13,01 кДж/моль |
| Температура кипения |
2840 K |
| Теплота испарения |
304,6 кДж/моль |
| Молярный объём |
7,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая гранецентрированая |
| Период решётки |
3,615 Å |
| Отношение c/a |
n/a |
| Температура Дебая |
315,00 K |
Медь — химический элемент с атомным номером 29 в периодической системе, обозначается символом Cu (лат. Cuprum от названия острова Кипр где добывали медь), красновато-золотистого цвета (розовый при отсутствии оксидной пленки). Простое вещество медь — это пластичный переходный металл, с давних пор широко применяемый человеком.
Содержание
- 1 История и происхождение названия
- 2 Нахождение в природе
- 3 Физические свойства
- 4 Химические свойства
- 4.1 Соединения
- 4.2 Соединения меди(I)
- 4.3 Аналитическая химия меди
- 5 Применение
- 5.1 В электротехнике
- 5.2 Теплообмен
- 5.3 Для производства труб
- 5.4 Наиболее распространённые сплавы — бронза и латунь
- 5.5 Ювелирные сплавы
- 5.6 Соединения меди
- 5.7 Другие сферы применения
- 6 Биологическая роль
- 6.1 Токсичность
- 6.2 Бактерицидность
- 6.3 Органолептические свойства
- 7 Производство, добыча и запасы меди
- 8 Ссылки
- 9 Примечания
История и происхождение названия
Схема атома меди
Из-за сравнительной доступности для получения из руды и малой температуры плавления медь — один из первых металлов, широко освоенных человеком. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
Нахождение в природе
Самородная медь
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Читинской области, Джезказган в Казахстане, Меденосный пояс Центральной Африки и Мансфельд в Германии.
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,4 до 1,0 %.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра). Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два различных варианта распада с различными продуктами.
Плотность — 8,94*10³ кг/м³
Удельная теплоёмкость при 20 °С — 390 Дж/кг*К
Удельное электрическое сопротивление при 20-100 °С — 1,78·10-8 Ом·м
Существует ряд сплавов меди: латунь — сплав меди с цинком, бронза — сплав меди с оловом, мельхиор — сплав меди и никеля, и некоторые другие.
Химические свойства
Хорошо проводит тепло. На воздухе покрывается оксидной плёнкой.
Соединения
Медный купорос
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu+ и намного более стабильную Cu2+, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23-, полученных в 1994 году.
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Соединения меди(I)
Многие соединения меди(I) имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди(I) все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu20 имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию:
2Cu+(водн.) → Cu2+(водн.) + Cu(тв.)
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]— устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
CuCl(тв.) + Cl—(водн.) → [CuCl]— (водн.)
Хлорид меди(I) — белое нерастворимое твердое вещество. Как и другие галогениды меди(I), он имеет ковалентный характер и более устойчив, чем галогенид меди (II). Хлорид меди(I) можно получить при сильном нагревании хлорида меди(II):
CuCl2(тв.) → 2CuCl(тв.) + Cl2(г.)
Другой способ его получения заключается в кипячении смеси хлорида меди(II) с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение — комплексный дихлорокупрат(I)-ион [CuCl2]—. При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I). Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(NH3)2]+. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
Аналитическая химия меди
- Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода.
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов.
Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления. В России производство водопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 [3], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Наиболее распространённые сплавы — бронза и латунь
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широкораспространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, куда помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз. Медноникелевые сплавы используются для чеканки разменной монеты. Медноникелиевые сплавы, в том числе т. н. «адмиралтейский» сплав широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов, и батарей.
Другие сферы применения
Медь самый широкоупотребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди применять для транспортировки ацетилена можно только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в кровельном деле. Кровли из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006 [4]
Прогнозируемым новым массовым применением меди обещает стать ее применение в качестве бактерицидных поверхностей в лечебных учереждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Биологическая роль
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от ее избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта [5].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[1]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде. Общее число лиц, поражённых заболеванием, например, в США, составляет ок. 35 000 человек, то есть 0,01 % от общего числа водопользователей.
Бактерицидность
Бактерицидные свойства меди и ее сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) [6] официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью [7]. Особено выраженно бактерицидное действие поверхностей медных (и сплавов меди) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, извесного как «супермикроб» MRSA [8]:
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2-10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приема внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т., a в 2004 году — около 14 млн т. [2][3]. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т., из них 687 млн т. подтверждённые запасы [2], на долю России приходилось 3.2 % общих и 3.1 % подтверждённых мировых запасов [2]. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 1,009 тыс. тонн, потребление — 714 тыс. тонн[4]. Основными производителями меди в России являются:
| Компания | тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 % |
| Уралэлектромедь | 351 | 37 % |
| Русская медная компания | 166 | 18 % |
Как добывают медь Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Нашли однажды самородок, который весил 420 т. Наверняка медь была первым металлом, с которым познакомились древние люди. Первые свои орудия делали они из кремниевой и железной руды, из меди, и уже потом научились изготовлять их из бронзы и железа. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н.э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало ее пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. Добычу меди называют прабабушкой металлургии. Ее добыча и выплавка были налажены еще в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н.э.). Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н.э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. О нем напоминает теперешняя Пушечная улица в Москве. Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно мед-ные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды сравнительно недавно обнаружено на севере Читинской области.
Большая часть добываемой меди используется в электротехнике, потому что медь обладает высокой электропроводностью, уступая в этом только серебру, которое, конечно, намного дороже. Миллионы километров проводов опутали земной шар, и большинство из них медные. Медь нужна для производства двигателей, телевизоров, телефонных аппаратов, различных электроприборов, автомобилей, электровозов, холодильников и даже музыкальных инструментов. Ее используют в химической промышленности для борьбы с вредителями садов и огородов, для подкормки растений и животных. Всюду нужна медь. По объему мирового производства и потребления медь занимает третье место после железа и алюминия.
Ссылки
- Медь на Webelements
- Медь в Популярной библиотеке химических элементов
- Медь в месторождениях
- Российский Центр Меди
- Некоммерческий ресурс о меди (eng)
- Химия в действии, М. Фримантл, том 2, изд. «Мир», М. 1991
Примечания
- ↑ [1]
- ↑ 1 2 3 http://www.ecsocman.edu.ru/db/msg/142462.html
- ↑ http://www.metalinfo.ru/ru/news/12150
- ↑ Минпромэнерго РФ, «Стратегия развития металлургической промышленности Российской Федерации на период до 2015 года» [2]
Wikimedia Foundation.
2010.