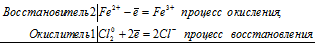Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
Решение 1
Решение 2, 3
Fe -> FeCl3 -> Fe(OH)3 -> FeO3 -> Fe -> FeSO4 -> Fe(OH)2 -> FeO -> Fe -> FeCl2 -> AgCl -> Ag.
Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
Решение 1
Запишите уравнения в ионном виде: 1) Fe + H2SO4 -> FeSO4 + H2; 2) 2Fe + 3Cl -> 2FeCl3; 3) 3Fe + 4H2O -> Fe3O4 + 4H2.
Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
Решение 1
Вместо вопросительного знака написать формулу, уровнять реакции, расставив коэффициенты, и определить их тип: Fe(OH)3 -> Fe2O3 + ?; Zn + ? -> Cu + ZnCl2; ? + HCl -> ZnCl2 + ?.
Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
Решение 1
Допишите схемы реакций: 1) FeCl3 + H2S -> FeCl2 + S + ..; 2) H2S + Cl2 + H2O -> H2SO4 + ..; 3) NH3 + O2 -> N2 + ..; 4) Fe + Al -> .. + .. .
Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
Решение 1
С помощью химических реакций осуществить преобразования: Fe(SO4) -> Fe(OH)2 -> FeO -> Fe -> FeO -> FeCl2
Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
Решение 1, 2
Закончите уравнение реакции. Напишите уравнение реакции в молекулярной, полной и сокращённой ионной форме. Fe(OH)2 + HCl -> .. .
Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
Решение 1, 2
Запишите уравнение реакции, позволяющих осуществить следующие превращение: FeCl2 <- FeO -> FeSO4 -> FeO -> FeSO4
Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
Решение 1
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить превращения: FeCl3 -> X -> Fe(OH)2 -> FeO.
Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
Решение 1
Осуществите превращение, докажите наличие ионов железа +2 в солях с помощью качественных реакций: Fe-> FeCl2-> Fe(OH)2-> Fe(OH)3-> FeCl3
Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
Решение 1
Решить уравнения: 1) Fe(OH)3 + HNO3 -> ..; 2) KOH + HPO3 -> ..; 3) Fe(OH)2 (при нагревании) -> ..; 4) Fe(OH)3 (при нагревании) -> .. .
Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
Решение 1
Fe2(SO4)3 -> Fe -> Fe3O4 -> FeO -> FeCl2.
Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
Решение 1
Расставить коэффициенты: H2 + O2 -> N2O5; Cu + S -> Cu2s; Fe + HCl -> FeCl2+H2; Al + O2 -> Al2O3; K + H2O -> K(OH)2 + H2.
Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
Решение 1, 2
Расставить коэффициенты: Al2O3 + HNO3 -> Al(NO3)3 + H2O; Fe(OH)3 + H2SO4 -> H2O + Fe(SO4)3.
Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
Решение 1
Составьте уравнения в соответствии со схемой: а) Al -> Al2O3 -> Al(NO3)3; б) FeCl2 -> Fe(OH)2 -> FeCl2; в) KOH -> K2CO3 -> CO2.
Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
Решение 1
Fe2(SO4)3 -> Fe -> Fe3O4 -> FeO -> FeCl2.
Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
Решение 1, 2
Окислительно-восстановительные реакции. Напишите уравнения: CaO + H2O -> Сa(OH)2; H3PO4 + Ca(OH)2 -> Ca3PO4 + H2O; Fe + HCl -> FeCl2 + H2.
Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
Решение 1
Железо Fe: химические свойства, способы получения железа, взаимодействие с простыми веществами (кислород, сера) и со сложными веществами (кислоты, вода, сильные окислители). Оксид железа (II) FeO, оксид железа (III) Fe2O3, железная окалина (Fe3O4) — способы получения и химические свойства. Гидроксид железа (II) Fe(OH)2, гидроксид железа (III) Fe(OH)3 — способы получения и химические свойства.
Положение железа в периодической системе химических элементов
Электронное строение железа
Физические свойства
Нахождение в природе
Способы получения
Качественные реакции
Химические свойства
1. Взаимодействие с простыми веществами
1.1. Взаимодействие с галогенами
1.2. Взаимодействие с серой
1.3. Взаимодействие с фосфором
1.4. Взаимодействие с азотом
1.5. Взаимодействие с углеродом
1.6. Горение
2. Взаимодействие со сложными веществами
2.1. Взаимодействие с водой
2.2. Взаимодействие с минеральными кислотами
2.3. Взаимодействие с серной кислотой
2.4. Взаимодействие с азотной кислотой
2.5. Взаимодействие с сильными окислителями
2.6. Взаимодействие с оксидами и солями
Оксид железа (II)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами
2. Взаимодействие с кислотами
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Взаимодействие с кислотами
6. Взаимодействие с восстановителями
Оксид железа (III)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами и кислотами
2. Взаимодействие с щелочами и основными оксидами
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Окислительные свойства оксида железа (III)
6. Взаимодействие с солями более летучих кислот
Оксид железа (II, III)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами и кислотами
2. Взаимодействие с сильными кислотами-окислителями
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Окислительные свойства оксида железа (II, III)
Гидроксид железа (II)
Способы получения
Химические свойства
1. Взаимодействие с кислотами
2. Взаимодействие с кислотными оксидами
3. Восстановительные свойства
4. Разложение при нагревании
Гидроксид железа (III)
Способы получения
Химические свойства
1. Взаимодействие с кислотами
2. Взаимодействие с кислотными оксидами
3. Взаимодействие с щелочами
4. Разложение при нагревании
Соли железа
Железо
Положение в периодической системе химических элементов
Элемент железо расположен в побочной подгруппе VIII группы (или в 8 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома железа
Электронная конфигурация железа в основном состоянии:
+26Fe 1s22s22p63s23p64s23d6
Железо проявляет ярко выраженные магнитные свойства.
Физические свойства
Железо – металл серебристо-белого цвета, с высокой химической активностью и высокой ковкостью. Обладает высокой тепло- и электропроводностью.

Температура плавления 1538оС, температура кипения 2861оС.
Нахождение в природе
Железо довольно распространено в земной коре (порядка 4% массы земной коры). По распространенности на Земле железо занимает 4-ое место среди всех элементов и 2-ое место среди металлов. Содержание в земной коре — около 8%.
В природе железо в основном встречается в виде соединений:
Красный железняк Fe2O3 (гематит).

Магнитный железняк Fe3O4 или FeO·Fe2O3 (магнетит).
(изображение с портала emchi-med.ru)
В природе также широко распространены сульфиды железа, например, пирит FeS2.

Встречаются и другие минералы, содержащие железо.
Способы получения
Железо в промышленности получают из железной руды, гематита Fe2O3 или магнетита (Fe3O4или FeO·Fe2O3).
1. Один из основных способов производства железа – доменный процесс. Доменный процесс основан на восстановлении железа из оксида углеродом в доменной печи.
В печь загружают руду, кокс и флюсы.
Шихта – смесь исходных материалов, а в некоторых случаях и топлива в определённой пропорции, которую обрабатывают в печи.
Каменноугольный кокс – это твёрдый пористый продукт серого цвета, получаемый путем коксования каменного угля при температурах 950—1100 °С без доступа воздуха. Содержит 96—98 % углерода.
Флюсы – это неорганические вещества, которые добавляют к руде при выплавке металлов, чтобы снизить температуру плавления и легче отделить металл от пустой породы.
Шлак – расплав (а после затвердевания – стекловидная масса), покрывающий поверхность жидкого металла. Шлак состоит из всплывших продуктов пустой породы с флюсами и предохраняет металл от вредного воздействия газовой среды печи, удаляет примеси.
В печи кокс окисляется до оксида углерода (II):
2C + O2 → 2CO
Затем нагретый угарный газ восстанавливает оксид железа (III):
3CO + Fe2O3 → 3CO2 + 2Fe
Процесс получения железа – многоэтапный и зависит от температуры.
Наверху, где температура обычно находится в диапазоне между 200 °C и 700 °C, протекает следующая реакция:
3Fe2O3 + CO → 2Fe3O4 + CO2
Ниже в печи, при температурах приблизительно 850 °C, протекает восстановление смешанного оксида железа (II, III) до оксида железа (II):
Fe3O4 + CO → 3FeO + CO2
Встречные потоки газов разогревают шихту, и происходит разложение известняка:
CaCO3 → CaO + CO2
Оксид железа (II) опускается в область с более высоких температур (до 1200oC), где протекает следующая реакция:
FeO + CO → Fe + CO2
Углекислый газ поднимается вверх и реагирует с коксом, образуя угарный газ:
CO2 + C → 2CO

2. Также железо получают прямым восстановлением из оксида водородом:
Fe2O3 + 3H2 → 2Fe + 3H2O
При этом получается более чистое железо, т.к. получаемое железо не загрязнено серой и фосфором, которые являются примесями в каменном угле.
3. Еще один способ получения железа в промышленности – электролиз растворов солей железа.
Качественные реакции
Качественные реакции на ионы железа +2.
– взаимодействие солей железа (II) с щелочами. При этом образуется серо-зеленый студенистый осадок гидроксида железа (II).
Например, хлорид железа (II) реагирует с гидроксидом натрия:
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Видеоопыт взаимодействия раствора сульфата железа (II) с раствором гидроксида натрия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Гидроксид железа (II) на воздухе буреет, так как окисляется до гидроксида железа (III):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
– ионы железа +2 окрашивают раствор в светлый желто-зеленый цвет.
– взаимодействие с красной кровяной солью K3[Fe(CN)6] – также качественная реакция на ионы железа +2. При этом образуется синий осадок «турнбулева синь».
Видеоопыт взаимодействия раствора хлорида железа (II) с раствором гексацианоферрата (III) калия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Качественные реакции на ионы железа +3
– взаимодействие солей железа (III) с щелочами. При этом образуется бурый осадок гидроксида железа (III).

Например, хлорид железа (III) реагирует с гидроксидом натрия:
3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гидроксида натрия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
– ионы железа +3 окрашивают раствор в светлый желто-оранжевый цвет.
– взаимодействие с желтой кровяной солью K4[Fe(CN)6] ионы железа +3. При этом образуется синий осадок «берлинская лазурь».
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гексацианоферрата (II) калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
В последнее время получены данные, которые свидетельствуют, что молекулы берлинской лазури идентичны по строению молекулам турнбулевой сини. Состав молекул обоих этих веществ можно выразить формулой Fe4[Fe2(CN)6]3.
– при взаимодействии солей железа (III) с роданидами раствор окрашивается в кроваво-красный цвет.
Например, хлорид железа (III) взаимодействует с роданидом натрия:
FeCl3 + 3NaCNS → Fe(CNS)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором роданида калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
Химические свойства
1. При обычных условиях железо малоактивно, но при нагревании, в особенности в мелкораздробленном состоянии, оно становится активным и реагирует почти со всеми неметаллами.
1.1. Железо реагирует с галогенами с образованием галогенидов. При этом активные неметаллы (фтор, хлор и бром) окисляют железо до степени окисления +3:
2Fe + 3Cl2 → 2FeCl3
Менее активный йод окисляет железо до степени окисления +2:
Fe + I2 → FeI2
1.2. Железо реагирует с серой с образованием сульфида железа (II):
Fe + S → FeS
1.3. Железо реагирует с фосфором. При этом образуется бинарное соединения – фосфид железа:
Fe + P → FeP
1.4. С азотом железо реагирует в специфических условиях.
1.5. Железо реагирует с углеродом и кремнием с образованием карбида и силицида.
1.6. При взаимодействии с кислородом железо образует окалину – двойной оксид железа (II, III):
3Fe + 2O2 → Fe3O4
При пропускании кислорода через расплавленное железо возможно образование оксида железа (II):
2Fe + O2 → 2FeO
2. Железо взаимодействует со сложными веществами.
2.1. При обычных условиях железо с водой практически не реагирует. Раскаленное железо может вступать в реакцию при температуре 700-900оС с водяным паром:
3Fe0 + 4H2+O → Fe+33O4 + 4H20
В воде в присутствии кислорода или во влажном воздухе железо медленно окисляется (корродирует):
4Fe + 3O2 + 6H2O → 4Fe(OH)3
2.2. Железо взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль железа со степенью окисления +2 и водород.
Например, железо бурно реагирует с соляной кислотой:
Fe + 2HCl → FeCl2 + H2↑
2.3. При обычных условиях железо не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат железа (III) и вода:
2Fe + 6H2SO4(конц.) → Fe2(SO4)3 + 3SO2 + 6H2O
2.4. Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации. При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2↑ + 3H2O
С разбавленной азотной кислотой железо реагирует с образованием оксида азота (II):
Fe + 4HNO3(разб.гор.) → Fe(NO3)3 + NO + 2H2O
При взаимодействии железа с очень разбавленной азотной кислотой образуется нитрат аммония:
8Fe + 30HNO3(оч. разб.) → 8Fe(NO3)3 + 3NH4NO3 + 9H2O
2.5. Железо может реагировать с щелочными растворами или расплавами сильных окислителей. При этом железо окисляет до степени окисления +6, образуя соль (феррат).
Например, при взаимодействии железа с расплавом нитрата калия в присутствии гидроксида калия железо окисляется до феррата калия, а азот восстанавливается либо до нитрита калия, либо до аммиака:
Fe + 2KOH + 3KNO3 → 3KNO2 + K2FeO4 + H2O
2.6. Железо восстанавливает менее активные металлы из оксидов и солей.
Например, железо вытесняет медь из сульфата меди (II). Реакция экзотермическая:
Fe + CuSO4 → FeSO4 + Cu
Еще пример: простое вещество железо восстанавливает железо до степени окисления +2 при взаимодействии с соединениями железа +3:
2Fe(NO3)3 + Fe → 3Fe(NO3)2
2FeCl3 + Fe → 3FeCl2
Fe2(SO4)3 + Fe → 3FeSO4
Оксид железа (II)
Оксид железа (II) – это твердое, нерастворимое в воде вещество черного цвета.
Способы получения
Оксид железа (II) можно получить различными методами:
1. Частичным восстановлением оксида железа (III).
Например, частичным восстановлением оксида железа (III) водородом:
Fe2O3 + H2 → 2FeO + H2O
Или частичным восстановлением оксида железа (III) угарным газом:
Fe2O3 + CO → 2FeO + CO2
Еще один пример: восстановление оксида железа (III) железом:
Fe2O3 + Fe → 3FeO
2. Разложение гидроксида железа (II) при нагревании:
Fe(OH)2 → FeO + H2O
Химические свойства
Оксид железа (II) — типичный основный оксид.
1. При взаимодействии оксида железа (II) с кислотными оксидами образуются соли.
Например, оксид железа (II) взаимодействует с оксидом серы (VI):
FeO + SO3 → FeSO4
2. Оксид железа (II) взаимодействует с растворимыми кислотами. При этом также образуются соответствующие соли.
Например, оксид железа (II) взаимодействует с соляной кислотой:
FeO + 2HCl → FeCl2 + H2O
3. Оксид железа (II) не взаимодействует с водой.
4. Оксид железа (II) малоустойчив, и легко окисляется до соединений железа (III).
Например, при взаимодействии с концентрированной азотной кислотой образуются нитрат железа (III), оксид азота (IV) и вода:
FeO + 4HNO3(конц.) → NO2 + Fe(NO3)3 + 2H2O
При взаимодействии с разбавленной азотной кислотой образуется оксид азота (II). Реакция идет при нагревании:
3FeO + 10HNO3(разб.) → 3Fe(NO3)3 + NO + 5H2O
5. Оксид железа (II) проявляет слабые окислительные свойства.
Например, оксид железа (II) реагирует с угарным газом при нагревании:
FeO + CO → Fe + CO2
Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.
Способы получения
Оксид железа (III) можно получить различными методами:
1. Окисление оксида железа (II) кислородом.
4FeO + O2 → 2Fe2O3
2. Разложение гидроксида железа (III) при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Химические свойства
Оксид железа (III) – амфотерный.
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
Например, оксид железа (III) взаимодействует с азотной кислотой:
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
2. Оксид железа (III) взаимодействует с щелочами и основными оксидами. Реакция протекает в расплаве, при этом образуется соответствующая соль (феррит).
Например, оксид железа (III) взаимодействует с гидроксидом натрия:
Fe2O3 + 2NaOH → 2NaFeO2 + H2O
3. Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Например, хлорат калия в щелочной среде окисляет оксид железа (III) до феррата:
Fe2O3 + KClO3 + 4KOH → 2K2FeO4 + KCl + 2H2O
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
Fe2O3 + 3KNO3 + 4KOH → 2K2FeO4 + 3KNO2 + 2H2O
5. Оксид железа (III) проявляет окислительные свойства.
Например, оксид железа (III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II) или железной окалины:
Fe2O3 + 3СO → 2Fe + 3CO2
Также оксид железа (III) восстанавливается водородом:
Fe2O3 + 3Н2 → 2Fe + 3H2O
Железом можно восстановить оксид железа только до оксида железа (II):
Fe2O3 + Fe → 3FeO
Оксид железа (III) реагирует с более активными металлами.
Например, с алюминием (алюмотермия):
Fe2O3 + 2Al → 2Fe + Al2O3
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Например, с гидридом натрия:
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната натрия:
Fe2O3 + Na2CO3 → 2NaFeO2 + CO2
Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.
Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами:
1. Горение железа на воздухе:
3Fe + 2O2 → Fe3O4
2. Частичное восстановление оксида железа (III) водородом или угарным газом:
3Fe2O3 + Н2 → 2Fe3O4 + H2O
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
3Fe + 4H2O(пар) → Fe3O4 + 4H2
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Например, оксид железа (II, III) взаимодействует с соляной кислотой. При это образуются две соли – хлорид железа (II) и хлорид железа (III):
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Еще пример: оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
Fe3O4 + 4H2SO4(разб.) → Fe2(SO4)3 + FeSO4 + 4Н2О
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Например, железная окалина окисляется концентрированной азотной кислотой:
Fe3O4 + 10HNO3(конц.) → NO2↑ + 3Fe(NO3)3 + 5H2O
Разбавленной азотной кислотой окалина окисляется при нагревании:
3Fe3O4 + 28HNO3(разб.) → 9Fe(NO3)3 + NO + 14H2O
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
2Fe3O4 + 10H2SO4(конц.) → 3Fe2(SO4)3 + SO2 + 10H2O
Также окалина окисляется кислородом воздуха:
4Fe3O4 + O2(воздух) → 6Fe2O3
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см. выше).
5. Железная окалина проявляет окислительные свойства.
Например, оксид железа (II, III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Fe3O4 + 4CO → 3Fe + 4CO2
Также железная окалина восстанавливается водородом:
Fe3O4 + 4H2 → 3Fe + 4H2O
Оксид железа (II, III) реагирует с более активными металлами.
Например, с алюминием (алюмотермия):
3Fe3O4 + 8Al → 9Fe + 4Al2O3
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Например, с йодоводородом:
Fe3O4 + 8HI → 3FeI2 + I2 + 4H2O
Гидроксид железа (II)
Способы получения
1. Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Например, хлорид железа (II) реагирует с водным раствором аммиака с образованием гидроксида железа (II) и хлорида аммония:
FeCl2 + 2NH3 + 2H2O → Fe(OH)2 + 2NH4Cl
2. Гидроксид железа (II) можно получить действием щелочи на соли железа (II).
Например, хлорид железа (II) реагирует с гидроксидом калия с образованием гидроксида железа (II) и хлорида калия:
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид железа (II) проявляется основные свойства, а именно реагирует с кислотами. При этом образуются соответствующие соли.
Например, гидроксид железа (II) взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
Fe(OH)2 + 2HBr → FeBr2 + 2H2O
2. Гидроксид железа (II) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (II) взаимодействует с оксидом серы (VI) с образованием сульфата железа (II):
Fe(OH)2 + SO3 → FeSO4 + 2H2O
3. Гидроксид железа (II) проявляет сильные восстановительные свойства, и реагирует с окислителями. При этом образуются соединения железа (III).
Например, гидроксид железа (II) взаимодействует с кислородом в присутствии воды:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
Гидроксид железа (II) взаимодействует с пероксидом водорода:
2Fe(OH)2 + H2O2 → 2Fe(OH)3
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
2Fe(OH)2 + 4H2SO4(конц.) → Fe2(SO4)3 + SO2 + 6H2O
4. Гидроксид железа (II) разлагается при нагревании:
Fe(OH)2 → FeO + H2O
Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Например, хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида железа (III) и хлорида аммония:
FeCl3 + 3NH3 + 3H2O = Fe(OH)3 + 3NH4Cl
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
2Fe(OH)2 + H2O2 → 2Fe(OH)3
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Например, хлорид железа (III) реагирует с раствором гидроксида калия с образованием гидроксида железа (III) и хлорида калия:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.
4. Также гидроксид железа (III) образуется при взаимодействии растворимых солей железа (III) с растворами карбонатов и сульфитов. Карбонаты и сульфиты железа (III) необратимо гидролизуются в водном растворе.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
2FeBr3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + CO2↑ + 6NaBr
Но есть исключение! Взаимодействие солей железа (III) с сульфитами в ЕГЭ по химии — окислительно-восстановительная реакция. Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
2FeCl3 + Na2SO3 + H2O = 2FeCl2 + Na2SO4 + 2HCl
Также допустима такая запись:
2FeCl3 + Na2SO3 + H2O = FeSO4 + 2NaCl + FeCl2 + 2HCl
Химические свойства
1. Гидроксид железа (III) проявляет слабовыраженные амфотерные свойства, с преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами.
Например, гидроксид железа (III) взаимодействует с азотной кислотой с образованием нитрата железа (III):
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3HBr → FeBr3 + 3H2O
2. Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (III) взаимодействует с оксидом серы (VI) с образованием сульфата железа (III):
2Fe(OH)3 + 3SO3 → Fe2(SO4)3 + 3H2O
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Например, гидроксид железа (III) взаимодействует с гидроксидом калия в расплаве с образованием феррита калия и воды:
KOH + Fe(OH)3 → KFeO2 + 2H2O
4. Гидроксид железа (III) разлагается при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
Соли железа
Нитраты железа
Нитрат железа (II) при нагревании разлагается на оксид железа (III), оксид азота (IV) и кислород:
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Нитрат железа (III) при нагревании разлагается также на оксид железа (III), оксид азота (IV) и кислород:
4Fe(NO3)3 → 2Fe2O3 + 12NO2 + 3O2
Гидролиз солей железа
Растворимые соли железа, образованные кислотными остатками сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. частично:
I ступень: Fe3+ + H2O ↔ FeOH2+ + H+
II ступень: FeOH2+ + H2O ↔ Fe(OH)2+ + H+
III ступень: Fe(OH)2+ + H2O ↔ Fe(OH)3 + H+
Однако сульфиты и карбонаты железа (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Fe2(SO4)3 + 6NaHSO3 → 2Fe(OH)3 + 6SO2 + 3Na2SO4
2FeBr3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + CO2↑ + 6NaBr
2Fe(NO3)3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaNO3 + 3CO2↑
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaCl + 3CO2↑
Fe2(SO4)3 + 3K2CO3 + 3H2O → 2Fe(OH)3↓ + 3CO2↑ + 3K2SO4
При взаимодействии соединений железа (III) с сульфидами протекает ОВР:
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Окислительные свойства железа (III)
Соли железа (III) под проявляют довольно сильные окислительные свойств. Так, при взаимодействии соединений железа (III) с сульфидами протекает окислительно-восстановительная реакция.
Например: хлорид железа (III) взаимодействует с сульфидом натрия. При этом образуется сера, хлорид натрия и либо черный осадок сульфида железа (II) (в избытке сульфида натрия), либо хлорид железа (II) (в избытке хлорида железа (III)):
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
2FeCl3 + Na2S → 2FeCl2 + S + 2NaCl
По такому же принципу соли железа (III) реагируют с сероводородом:
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
Соли железа (III) также вступают в окислительно-восстановительные реакции с йодидами.
Например, хлорид железа (III) взаимодействует с йодидом калия. При этом образуются хлорид железа (II), молекулярный йод и хлорид калия:
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
Интерес представляют также реакции солей железа (III) с металлами. Мы знаем, что более активные металлы вытесняют из солей менее активные металлы. Иначе говоря, металлы, которые стоят в электрохимическом ряду левее, могут взаимодействовать с солями металлов, которые расположены в этом ряду правее. Исходя из этого правила, соли железа могут взаимодействовать только с металлами, которые расположены до железа. И они взаимодействуют.
Однако, соли железа со степенью окисления +3 в этом ряду являются небольшим исключением. Ведь для железа характерны две степени окисления: +2 и +3. И железо со степенью окисления +3 является более сильным окислителем. Таким образом, условно говоря, железо со степенью окисления +3 расположено в ряду активности после меди. И соли железа (III) могут реагировать еще и с металлами, которые расположены правее железа! Но до меди, включительно. Вот такой парадокс.
И еще один момент. Соединения железа (III) с этими металлами реагировать будут, а вот соединения железа (II) с ними реагировать не будут. Таким образом, металлы, расположенные в ряду активности между железом и медью (включая медь) при взаимодействии с солями железа (III) восстанавливают железо до степени окисления +2. А вот металлы, расположенные до железа в ряду активности, могут восстановить железо и до простого вещества.
Например, хлорид железа (III) взаимодействует с медью. При этом образуются хлорид железа (II) и хлорид меди (II):
2FeCl3 + Cu → 2FeCl2 + CuCl2
А вот реакция нитрата железа (III) с цинком протекает уже по привычному механизму. И железо восстанавливается до простого вещества:
2Fe(NO3)3 + 3Zn → 2Fe + 3Zn(NO3)2
Схемы превращений веществ. Составление уравнений реакций превращений железа
Задание 237.
Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe → FeSO4 → Fe(OH)2 → Fe(OH)3 → FeCl3
Решение:
Уравнения реакций, которые надо провести для осуществления следующих превращений:
Задание 429 (ш)
Составьте молекулярные и ионно-молекулярные уравнения реакций, которые надо провести для осуществления превращений:
Fe → FeCl2 → Fe(CN)2 → К4[Fe(CN)6] → К3[Fe(CN)6]
К окислительно-восстановительным реакциям составьте электронные уравнения.
Решение:
Молекулярные и ионно-молекулярные уравнения реакций, которые надо провести для осуществления превращений: Fe → FeCl2 → Fe(CN)2 → К4[Fe(CN)6] → К3[Fe(CN)6]
а) Fe + 2HCl = FeCl2 + H2↑ (молекулярная форма);
Fe + 2H + = Fe 2+ + H2 0 (ионно-молекулярная форма).
б) FeCl2 + 2KCN = Fe(CN)2↓ + 2KCl (молекулярная форма);
Fe 2+ + 2CN — = Fe(CN)2↓ (ионно-молекулярная форма).
в) В избытке цианида калия осадок Fe(CN)2 растворяется вследствие образования комплексного соединения К4[Fe(CN)6]:
Fe(CN)2 + 4KCN → К4[Fe(CN)6] (молекулярная форма);
Fe(CN)2 + 4CN — → [Fe(CN)6] 4- (ионно-молекулярная форма).
г) При действии хлора или брома на раствор жёлтой кровяной соли анион [Fe(CN)6] 4- превращается в анион [Fe(CN)6] 3- :
Данная реакция является окислительно-восстановительной, так как атом железа увеличивает свою степень окисления от +2 до +3, т. е. проявляет свойства восстановителя; атомы хлора уменьшают свою степень окисления от 0 до -1, т. е. проявляют свойства окислителя:
Уравнение превращения с железом в химии
Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ:
а) Железо ⟶ Хлорид железа (II) ⟶ Гидроксид железа (II) ⟶ Гидроксид железа (III) ⟶ Оксид железа (III) ⟶ Железо;
б) Железо ⟶ Хлорид железа (III) ⟶ Гидроксид железо (III) ⟶ Сульфат железа (III) ⟶ Железа ⟶ Оксид дижелеза(III)-железа(II) ⟶ Железо ⟶ Карбид трижелеза;
в) Нитрат железа (III) ⟶ Оксид железа (III) ⟶ Оксид железа (II) ⟶ Железо ⟶ Сульфид железа (II) ⟶ Оксид железа (III) ⟶ Хлорид железа (III) ⟶ Роданид железа (III);
г) Железо ⟶ Сульфид железа (II) ⟶ Хлорид железа (II) ⟶ Хлорид железа (III) ⟶ Гексацианоферрат (II) железа (III);
д) Дисульфид железа (II) ⟶ Оксид железа (III) ⟶ Железо ⟶ Хлорид железа (III) ⟶ Хлорид железа (II) ⟶ Гексацианоферрат (III) железа (II);
е) Оксид железа (II) ⟶ Диоксоферрат (III) натрия ⟶ Хлорид железа (III) ⟶ Гидроксид железа (III) ⟶ Феррат калия ⟶ Сульфат железа (III) ⟶ Оксид железа (III) ⟶ Сульфат железа (III) ⟶ Гексационоферрат (II) железа(III)-калия.
Для реакций, протекающих в растворе с участием ионов, составьте ионные уравнения. К уравнениям всех окислительно-восстановительных реакций составьте схему электронного баланса или покажите переход электронов стрелкой.
| Fe + 2HCl = FeCl2 + H2↑ | ||||
| Fe 0 — 2ē ⟶ Fe +2 | 2 | 2 | 1 | восстановитель (окисление) |
| 2H + + 2ē ⟶ H2 0 | 2 | 1 | окислитель (восстановление) |
FeCl2 + 2NaOH = 2NaCl + Fe(OH)2↓
Fe 2+ + 2Cl — + 2Na + + 2OH — = 2Na + + 2Cl — + Fe(OH)2↓
Fe 2+ + 2OH — = Fe(OH)2↓
| 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 | ||||
| Fe +2 — 1ē ⟶ Fe +3 | 1 | 4 | 4 | восстановитель (окисление) |
| O2 0 + 4ē ⟶ 2O -2 | 4 | 1 | окислитель (восстановление) |
| Fe2O3 + 3CO `overset(t)(=)` 2Fe + 3CO2 | ||||
| C +2 — 2ē ⟶ C +4 | 2 | 6 | 3 | восстановитель (окисление) |
| Fe +3 + 3ē ⟶ Fe 0 | 3 | 2 | окислитель (восстановление) |
| 2Fe + 3Cl2 = 2FeCl3 | ||||
| Fe 0 — 3ē ⟶ Fe +3 | 3 | 6 | 2 | восстановитель (окисление) |
| Cl2 0 + 2ē ⟶ 2Cl — | 2 | 3 | окислитель (восстановление) |
FeCl3 + 3NaOH = 3NaCl + Fe(OH)3↓
Fe 3+ + 3Cl — + 3Na + + 3OH — = 3Na + + 3Cl — + Fe(OH)3↓
Fe 3+ + 3OH — = Fe(OH)3↓
| 3Zn + Fe2(SO4)3 = 3ZnSO4 + 2Fe | ||||
| Zn 0 — 2ē ⟶ Zn +2 | 2 | 6 | 3 | восстановитель (окисление) |
| Fe +3 + 3ē ⟶ Fe 0 | 3 | 2 | окислитель (восстановление) |
| 3Fe + 2O2 = FeO∙Fe2O3 | ||||
| Fe 0 — 2ē ⟶ Fe +2 | 8 | 8 | 1 | восстановитель (окисление) |
| 2Fe 0 — 6ē ⟶ 2Fe +3 | ||||
| O2 0 + 4ē ⟶ 2O -2 | 4 | 2 | окислитель (восстановление) |
| FeO∙Fe2O3 + 4CO `overset(t)(=)` 3Fe + 4CO2 | ||||
| C +2 — 2ē ⟶ C +4 | 2 | 8 | 4 | восстановитель (окисление) |
| Fe +2 + 2ē ⟶ Fe 0 | 8 | 1 | окислитель (восстановление) | |
| 2Fe +3 + 6ē ⟶ Fe 0 |
| 4Fe + 3C `overset(t)(=)` Fe4C3 | ||||
| Fe 0 — 3ē ⟶ Fe +3 | 3 | 12 | 4 | восстановитель (окисление) |
| C 0 + 4ē ⟶ C +4 | 4 | 3 | окислитель (восстановление) |
| 4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2↑ | ||||
| 2O -2 — 4ē ⟶ O2 0 | 4 | 4 | 1 | восстановитель (окисление) |
| N +5 + 1ē ⟶ N +4 | 1 | 4 | окислитель (восстановление) |
| Fe2O3 + CO `overset(t)(=)` 2FeO + CO2 | ||||
| C +2 — 2ē ⟶ C +4 | 2 | 2 | 1 | восстановитель (окисление) |
| Fe +3 + 1ē ⟶ Fe +2 | 1 | 2 | окислитель (восстановление) |
| FeO + CO `overset(t)(=)` Fe + CO2 | ||||
| C +2 — 2ē ⟶ C +4 | 2 | 2 | 1 | восстановитель (окисление) |
| Fe +2 + 2ē ⟶ Fe 0 | 2 | 1 | окислитель (восстановление) |
| Fe + S = FeS | ||||
| Fe 0 — 2ē ⟶ Fe +2 | 2 | 2 | 1 | восстановитель (окисление) |
| S 0 + 2ē ⟶ S -2 | 2 | 1 | окислитель (восстановление) |
| 4FeS + 7O2 = 2Fe2O3 + 4SO2↑ | ||||
| Fe +2 — 1ē ⟶ Fe +3 | 7 | 28 | 4 | восстановитель (окисление) |
| S -2 — 6ē ⟶ S +4 | ||||
| O2 0 + 4ē ⟶ 2O -2 | 4 | 7 | окислитель (восстановление) |
FeCl3 + 3KSCN = 3KCl + Fe(SCN)3
Fe 3+ + 3Cl — + 3K + + 3SCN — = 3K + + 3Cl — + Fe(SCN)3
Fe 3+ + 3SCN — = Fe(SCN)3
| Fe + S = FeS | ||||
| Fe 0 — 2ē ⟶ Fe +2 | 2 | 2 | 1 | восстановитель (окисление) |
| S 0 + 2ē ⟶ S -2 | 2 | 1 | окислитель (восстановление) |
FeS + 2HCl = FeCl2 + H2S↑
FeS + 2H + + 2Cl — = Fe 2+ + 2Cl — + H2S↑
FeS + 2H + = Fe 2+ + H2S↑
| 2FeCl2 + Cl2 = 2FeCl3 | ||||
| Fe +2 — 1ē ⟶ Fe +3 | 1 | 2 | 2 | восстановитель (окисление) |
| Cl2 0 + 2ē ⟶ 2Cl — | 2 | 1 | окислитель (восстановление) |
| 4FeS2 + 11O2 `overset(t)(=)` 2Fe2O3 + 8SO2↑ | ||||
| Fe +2 — 1ē ⟶ Fe +3 | 11 | 44 | 4 | восстановитель (окисление) |
| 2S — — 10ē ⟶ 2S +4 | ||||
| O2 0 + 4ē ⟶ 2O -2 | 4 | 11 | окислитель (восстановление) |
| Fe2O3 + 3CO `overset(t)(=)` 2Fe + 3CO2 | ||||
| C +2 — 2ē ⟶ C +4 | 2 | 6 | 3 | восстановитель (окисление) |
| Fe +3 + 3ē ⟶ Fe 0 | 3 | 2 | окислитель (восстановление) |
| 2Fe + 3Cl2 = 2FeCl3 | ||||
| Fe 0 — 3ē ⟶ Fe +3 | 3 | 6 | 2 | восстановитель (окисление) |
| Cl2 0 + 2ē ⟶ 2Cl — | 2 | 3 | окислитель (восстановление) |
| 2FeCl3 `overset(t)(=)` 2FeCl2 + Cl2↑ | ||||
| 2Cl — — 2ē ⟶ Cl2 0 | 2 | 2 | 1 | восстановитель (окисление) |
| Fe +3 + 1ē ⟶ Fe +2 | 1 | 2 | окислитель (восстановление) |
| 4FeO + 2Na2O + O2 `overset(t)(=)` 4NaFeO2 | ||||
| Fe +2 — 1ē ⟶ Fe +3 | 1 | 4 | 4 | восстановитель (окисление) |
| O2 0 + 4ē ⟶ 2O -2 | 4 | 1 | окислитель (восстановление) |
NaFeO2 + 4HCl = NaCl + FeCl3 + 2H2O
NaFeO2 + 4H + + 4Cl — = Na + + Cl — + Fe 3+ + 3Cl — + 2H2O
NaFeO2 + 4H + = Na + + Fe 3+ + 2H2O
FeCl3 + 3NaOH = 3NaCl + Fe(OH)3↓
Fe 3+ + 3Cl — + 3Na + + 3OH — = 3Na + + 3Cl — + Fe(OH)3↓
Fe 3+ + 3OH — = Fe(OH)3↓
Железо. Свойства железа и его соединений
Железо Fe: химические свойства, способы получения железа, взаимодействие с простыми веществами (кислород, сера) и со сложными веществами (кислоты, вода, сильные окислители). Оксид железа (II) FeO, оксид железа (III) Fe2O3, железная окалина (Fe3O4) — способы получения и химические свойства. Гидроксид железа (II) Fe(OH)2, гидроксид железа (III) Fe(OH)3 — способы получения и химические свойства.
Железо
Положение в периодической системе химических элементов
Элемент железо расположен в побочной подгруппе VIII группы (или в 8 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома железа
Электронная конфигурация железа в основном состоянии :
+26Fe 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6
Железо проявляет ярко выраженные магнитные свойства.
Физические свойства
Железо – металл серебристо-белого цвета, с высокой химической активностью и высокой ковкостью. Обладает высокой тепло- и электропроводностью.
(изображение с портала vchemraznica.ru)
Температура плавления 1538 о С, температура кипения 2861 о С.
Нахождение в природе
Железо довольно распространено в земной коре (порядка 4% массы земной коры). По распространенности на Земле железо занимает 4-ое место среди всех элементов и 2-ое место среди металлов. Содержание в земной коре — около 8%.
В природе железо в основном встречается в виде соединений:
(изображение с портала karatto.ru)
Магнитный железняк Fe3O4 или FeO·Fe2O3 (магнетит).
(изображение с портала emchi-med.ru)
В природе также широко распространены сульфиды железа, например, пирит FeS2.
(изображение с портала livemaster.ru)
Встречаются и другие минералы, содержащие железо.
Способы получения
Железо в промышленности получают из железной руды, гематита Fe2O3 или магнетита (Fe3O4или FeO·Fe2O3).
1. Один из основных способов производства железа – доменный процесс . Доменный процесс основан на восстановлении железа из оксида углеродом в доменной печи.
В печь загружают руду, кокс и флюсы.
Шихта – смесь исходных материалов, а в некоторых случаях и топлива в определённой пропорции, которую обрабатывают в печи.
Каменноугольный кокс – это твёрдый пористый продукт серого цвета, получаемый путем коксования каменного угля при температурах 950—1100 °С без доступа воздуха. Содержит 96—98 % углерода.
Флюсы – это неорганические вещества, которые добавляют к руде при выплавке металлов, чтобы снизить температуру плавления и легче отделить металл от пустой породы.
Шлак – расплав (а после затвердевания – стекловидная масса), покрывающий поверхность жидкого металла. Шлак состоит из всплывших продуктов пустой породы с флюсами и предохраняет металл от вредного воздействия газовой среды печи, удаляет примеси.
В печи кокс окисляется до оксида углерода (II):
2C + O2 → 2CO
Затем нагретый угарный газ восстанавливает оксид железа (III):
Процесс получения железа – многоэтапный и зависит от температуры.
Наверху, где температура обычно находится в диапазоне между 200 °C и 700 °C, протекает следующая реакция:
Ниже в печи, при температурах приблизительно 850 °C, протекает восстановление смешанного оксида железа (II, III) до оксида железа (II):
Встречные потоки газов разогревают шихту, и происходит разложение известняка:
Оксид железа (II) опускается в область с более высоких температур (до 1200 o C), где протекает следующая реакция:
FeO + CO → Fe + CO2
Углекислый газ поднимается вверх и реагирует с коксом, образуя угарный газ:
CO2 + C → 2CO
(изображение с портала 900igr.net)
2. Также железо получают прямым восстановлением из оксида водородом:
При этом получается более чистое железо, т.к. получаемое железо не загрязнено серой и фосфором, которые являются примесями в каменном угле.
3. Еще один способ получения железа в промышленности – электролиз растворов солей железа.
Качественные реакции
Качественные реакции на ионы железа +2.
– взаимодействие солей железа (II) с щелочами . При этом образуется серо-зеленый студенистый осадок гидроксида железа (II).
Например , хлорид железа (II) реагирует с гидроксидом натрия:
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Видеоопыт взаимодействия раствора сульфата железа (II) с раствором гидроксида натрия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Гидроксид железа (II) на воздухе буреет, так как окисляется до гидроксида железа (III):
– ионы железа +2 окрашивают раствор в светлый желто-зеленый цвет.
– взаимодействие с красной кровяной солью K3[Fe(CN)6] – также качественная реакция на ионы железа +2. При этом образуется синий осадок «турнбулева синь».
Видеоопыт взаимодействия раствора хлорида железа (II) с раствором гексацианоферрата (III) калия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Качественные реакции на ионы железа +3
– взаимодействие солей железа (III) с щелочами . При этом образуется бурый осадок гидроксида железа (III).
Например , хлорид железа (III) реагирует с гидроксидом натрия:
3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гидроксида натрия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
– ионы железа +3 окрашивают раствор в светлый желто-оранжевый цвет.
– взаимодействие с желтой кровяной солью K4[Fe(CN)6] ионы железа +3. При этом образуется синий осадок «берлинская лазурь».
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гексацианоферрата (II) калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
В последнее время получены данные, которые свидетельствуют, что молекулы берлинской лазури идентичны по строению молекулам турнбулевой сини. Состав молекул обоих этих веществ можно выразить формулой Fe4[Fe2(CN)6]3.
– при взаимодействии солей железа (III) с роданидами раствор окрашивается в кроваво-красный цвет.
Например , хлорид железа (III) взаимодействует с роданидом натрия:
FeCl3 + 3NaCNS → Fe(CNS)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором роданида калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
Химические свойства
1. При обычных условиях железо малоактивно , но при нагревании, в особенности в мелкораздробленном состоянии, оно становится активным и реагирует почти со всеми неметаллами .
1.1. Железо реагирует с галогенами с образованием галогенидов. При этом активные неметаллы (фтор, хлор и бром) окисляют железо до степени окисления +3:
2Fe + 3Cl2 → 2FeCl3
Менее активный йод окисляет железо до степени окисления +2:
1.2. Железо реагирует с серой с образованием сульфида железа (II):
Fe + S → FeS
1.3. Железо реагирует с фосфором . При этом образуется бинарное соединения – фосфид железа:
Fe + P → FeP
1.4. С азотом железо реагирует в специфических условиях.
1.5. Железо реагирует с углеродом и кремнием с образованием карбида и силицида.
1.6. При взаимодействии с кислородом железо образует окалину – двойной оксид железа (II, III):
При пропускании кислорода через расплавленное железо возможно образование оксида железа (II):
2Fe + O2 → 2FeO
2. Железо взаимодействует со сложными веществами.
2.1. При обычных условиях железо с водой практически не реагирует. Раскаленное железо может вступать в реакцию при температуре 700-900 о С с водяным паром:
3 Fe 0 + 4 H2 + O → Fe +3 3O4 + 4 H2 0
В воде в присутствии кислорода или во влажном воздухе железо медленно окисляется (корродирует):
2.2. Железо взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль железа со степенью окисления +2 и водород.
Например , железо бурно реагирует с соляной кислотой :
Fe + 2HCl → FeCl2 + H2↑
2.3. При обычных условиях железо не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат железа (III) и вода:
2.4. Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации. При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
С разбавленной азотной кислотой железо реагирует с образованием оксида азота (II):
При взаимодействии железа с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Железо может реагировать с щелочными растворами или расплавами сильных окислителей . При этом железо окисляет до степени окисления +6, образуя соль (феррат).
Например , при взаимодействии железа с расплавом нитрата калия в присутствии гидроксида калия железо окисляется до феррата калия, а азот восстанавливается либо до нитрита калия, либо до аммиака:
2.6. Железо восстанавливает менее активные металлы из оксидов и солей .
Например , железо вытесняет медь из сульфата меди (II). Реакция экзотермическая:
Fe + CuSO4 → FeSO4 + Cu
Еще пример : простое вещество железо восстанавливает железо до степени окисления +2 при взаимодействии с соединениями железа +3:
2FeCl3 + Fe → 3FeCl2
Оксид железа (II)
Оксид железа (II) – это твердое, нерастворимое в воде вещество черного цвета.
Способы получения
Оксид железа (II) можно получить различными методами :
1. Частичным в осстановлением оксида железа (III).
Например , частичным восстановлением оксида железа (III) водородом:
Или частичным восстановлением оксида железа (III) угарным газом:
Еще один пример : восстановление оксида железа (III) железом:
2. Разложение гидроксида железа (II) при нагревании :
Химические свойства
Оксид железа (II) — типичный основный оксид .
1. При взаимодействии оксида железа (II) с кислотными оксидами образуются соли.
Например , оксид железа (II) взаимодействует с оксидом серы (VI):
FeO + SO3 → FeSO4
2. Оксид железа (II) взаимодействует с растворимыми кислотами. При этом также образуются соответствующие соли .
Например , оксид железа (II) взаимодействует с соляной кислотой:
FeO + 2HCl → FeCl2 + H2O
3. Оксид железа (II) не взаимодействует с водой.
4. Оксид железа (II) малоустойчив, и легко окисляется до соединений железа (III).
Например , при взаимодействии с концентрированной азотной кислотой образуются нитрат железа (III), оксид азота (IV) и вода:
При взаимодействии с разбавленной азотной кислотой образуется оксид азота (II). Реакция идет при нагревании:
5. Оксид железа (II) проявляет слабые окислительные свойства .
Например , оксид железа (II) реагирует с угарным газом при нагревании:
FeO + CO → Fe + CO2
Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.
Способы получения
Оксид железа (III) можно получить различными методами :
1. Окисление оксида железа (II) кислородом.
2. Разложение гидроксида железа (III) при нагревании :
Химические свойства
Оксид железа (III) – амфотерный .
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
Например , оксид железа (III) взаимодействует с азотной кислотой:
2. Оксид железа (III) взаимодействует с щелочами и основными оксидами. Реакция протекает в расплаве, при этом образуется соответствующая соль (феррит) .
Например , оксид железа (III) взаимодействует с гидроксидом натрия:
3. Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Например , хлорат калия в щелочной среде окисляет оксид железа (III) до феррата:
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
5. Оксид железа (III) проявляет окислительные свойства .
Например , оксид железа (III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II) или железной окалины:
Также оксид железа (III) восстанавливается водородом:
Железом можно восстановить оксид железа только до оксида железа (II):
Оксид железа (III) реагирует с более активными металлами .
Например , с алюминием (алюмотермия):
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Например , с гидридом натрия:
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната натрия:
Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.
Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами :
1. Горение железа на воздухе:
2. Частичное восстановление оксида железа (III) водородом или угарным газом :
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Например , оксид железа (II, III) взаимодействует с соляной кислотой. При это образуются две соли – хлорид железа (II) и хлорид железа (III):
Еще пример : оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Например , железная окалина окисляется концентрированной азотной кислотой:
Разбавленной азотной кислотой окалина окисляется при нагревании:
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
Также окалина окисляется кислородом воздуха :
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см. выше).
5. Железная окалина проявляет окислительные свойства .
Например , оксид железа (II, III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Также железная окалина восстанавливается водородом:
Оксид железа (II, III) реагирует с более активными металлами .
Например , с алюминием (алюмотермия):
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Например , с йодоводородом:
Гидроксид железа (II)
Способы получения
1. Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Например , хлорид железа (II) реагирует с водным раствором аммиака с образованием гидроксида железа (II) и хлорида аммония:
2. Гидроксид железа (II) можно получить действием щелочи на соли железа (II).
Например , хлорид железа (II) реагирует с гидроксидом калия с образованием гидроксида железа (II) и хлорида калия:
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид железа (II) проявляется основные свойства , а именно реагирует с кислотами . При этом образуются соответствующие соли.
Например , гидроксид железа (II) взаимодействует с соляной кислотой с образованием хлорида железа (II):
2. Гидроксид железа (II) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид железа (II) взаимодействует с оксидом серы (VI) с образованием сульфата железа (II):
3. Гидроксид железа (II) проявляет сильные восстановительные свойства , и реагирует с окислителями. При этом образуются соединения железа (III) .
Например , гидроксид железа (II) взаимодействует с кислородом в присутствии воды:
Гидроксид железа (II) взаимодействует с пероксидом водорода:
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
4. Г идроксид железа (II) разлагается при нагревании :
Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Например , хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида железа (III) и хлорида аммония:
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Например , хлорид железа (III) реагирует с раствором гидроксида калия с образованием гидроксида железа (III) и хлорида калия:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.
4. Также гидроксид железа (III) образуется при взаимодействии растворимых солей железа (III) с растворами карбонатов и сульфитов . Карбонаты и сульфиты железа (III) необратимо гидролизуются в водном растворе.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
Но есть исключение ! Взаимодействие солей железа (III) с сульфитами в ЕГЭ по химии — окислительно-восстановительная реакция. Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
Также допустима такая запись:
Химические свойства
1. Гидроксид железа (III) проявляет слабовыраженные амфотерные свойства, с преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами .
Например , гидроксид железа (III) взаимодействует с азотной кислотой с образованием нитрата железа (III):
2. Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид железа (III) взаимодействует с оксидом серы (VI) с образованием сульфата железа (III):
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Например , гидроксид железа (III) взаимодействует с гидроксидом калия в расплаве с образованием феррита калия и воды:
4. Г идроксид железа (III) разлагается при нагревании :
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
Соли железа
Нитраты железа
Нитрат железа (II) при нагревании разлагается на оксид железа (III), оксид азота (IV) и кислород:
Нитрат железа (III) при нагревании разлагается также на оксид железа (III), оксид азота (IV) и кислород:
Гидролиз солей железа
Растворимые соли железа, образованные кислотными остатками сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. частично:
I ступень: Fe 3+ + H2O ↔ FeOH 2+ + H +
II ступень: FeOH 2+ + H2O ↔ Fe(OH )2 + + H +
Однако сульфиты и карбонаты железа (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
При взаимодействии соединений железа (III) с сульфидами протекает ОВР:
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Окислительные свойства железа (III)
Соли железа (III) под проявляют довольно сильные окислительные свойств. Так, при взаимодействии соединений железа (III) с сульфидами протекает окислительно-восстановительная реакция.
Например : хлорид железа (III) взаимодействует с сульфидом натрия. При этом образуется сера, хлорид натрия и либо черный осадок сульфида железа (II) (в избытке сульфида натрия), либо хлорид железа (II) (в избытке хлорида железа (III)):
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
2FeCl3 + Na2S → 2FeCl2 + S + 2NaCl
По такому же принципу соли железа (III) реагируют с сероводородом:
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
Соли железа (III) также вступают в окислительно-восстановительные реакции с йодидами .
Например , хлорид железа (III) взаимодействует с йодидом калия. При этом образуются хлорид железа (II), молекулярный йод и хлорид калия:
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
Интерес представляют также реакции солей железа (III) с металлами. Мы знаем, что более активные металлы вытесняют из солей менее активные металлы . Иначе говоря, металлы, которые стоят в электрохимическом ряду левее, могут взаимодействовать с солями металлов, которые расположены в этом ряду правее . Исходя из этого правила, соли железа могут взаимодействовать только с металлами, которые расположены до железа. И они взаимодействуют.
Однако, соли железа со степенью окисления +3 в этом ряду являются небольшим исключением. Ведь для железа характерны две степени окисления: +2 и +3. И железо со степенью окисления +3 является более сильным окислителем. Таким образом, условно говоря, железо со степенью окисления +3 расположено в ряду активности после меди. И соли железа (III) могут реагировать еще и с металлами, которые расположены правее железа! Но до меди, включительно. Вот такой парадокс.
И еще один момент. Соединения железа (III) с этими металлами реагировать будут, а вот соединения железа (II) с ними реагировать не будут. Таким образом, металлы, расположенные в ряду активности между железом и медью (включая медь) при взаимодействии с солями железа (III) восстанавливают железо до степени окисления +2. А вот металлы, расположенные до железа в ряду активности, могут восстановить железо и до простого вещества.
Например , хлорид железа (III) взаимодействует с медью. При этом образуются хлорид железа (II) и хлорид меди (II):
А вот реакция нитрата железа (III) с цинком протекает уже по привычному механизму. И железо восстанавливается до простого вещества:
http://gomolog.ru/reshebniki/9-klass/zadachnik-kuznecova-2020/8-114.html
http://chemege.ru/iron/
Схемы превращений веществ. Составление уравнений реакций превращений железа
Задание 237.
Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe → FeSO4 → Fe(OH)2 → Fe(OH)3 → FeCl3
Решение:
Уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe → FeSO4 → Fe(OH)2 → Fe(OH)3 → FeCl3
а) Fe + H2SO4 (разб.) —> FeSO4 + H2↑;
б) FeSO4 + 2NaOH —> Fe(OH)2↓ + Na2SO4;
в) 4Fe(OH)2↓ + О2 + 2Н2О —> 4Fe(OH)3↓;
зелёный буро-красный
осадок осадок
г) Fe(OH)3 + 3HCl —> FeCl3 + 3H2O
Задание 429 (ш)
Составьте молекулярные и ионно-молекулярные уравнения реакций, которые надо провести для осуществления превращений:
Fe → FeCl2 → Fe(CN)2 → К4[Fe(CN)6] → К3[Fe(CN)6]
К окислительно-восстановительным реакциям составьте электронные уравнения.
Решение:
Молекулярные и ионно-молекулярные уравнения реакций, которые надо провести для осуществления превращений:Fe → FeCl2 → Fe(CN)2 → К4[Fe(CN)6] → К3[Fe(CN)6]
а) Fe + 2HCl = FeCl2 + H2↑ (молекулярная форма);
Fe + 2H+ = Fe2+ + H20 (ионно-молекулярная форма).
б) FeCl2 + 2KCN = Fe(CN)2↓ + 2KCl (молекулярная форма);
Fe2++ 2CN— = Fe(CN)2↓ (ионно-молекулярная форма).
в) В избытке цианида калия осадок Fe(CN)2 растворяется вследствие образования комплексного соединения К4[Fe(CN)6]:
Fe(CN)2 + 4KCN → К4[Fe(CN)6] (молекулярная форма);
Fe(CN)2 + 4CN— → [Fe(CN)6]4- (ионно-молекулярная форма).
г) При действии хлора или брома на раствор жёлтой кровяной соли анион [Fe(CN)6]4- превращается в анион [Fe(CN)6]3-:
2К4[Fe(CN)6] + Cl2 → 2К3[Fe(CN)6] + 2KCl (молекулярная форма);
2[Fe(CN)6]4- + Cl2→ 2[Fe(CN)6]2- + 2Cl— (ионно-молекулярная форма).
Данная реакция является окислительно-восстановительной, так как атом железа увеличивает свою степень окисления от +2 до +3, т. е. проявляет свойства восстановителя; атомы хлора уменьшают свою степень окисления от 0 до -1, т. е. проявляют свойства окислителя:
Уравнения электронного баланса:
Ионно-молекулярное уравнение:
2Fe2+ + Cl20= Fe3+ + 2Cl—
Молекулярная форма:
2К4[Fe(CN)6] + Cl2 → 2К3[Fe(CN)6] + 2KCl.
Цепочка превращений
Уравнения химических реакций, с помощью которых можно осуществить цепочку превращений:
Fe → FeCl3 → Fe(OH)3 → Fe2O3 → Fe.
2Fe + 3Cl2 = 2FeCl3
FeCl3 → Fe(OH)3
FeCl3 + 3NaOH = 3NaCl + Fe(OH)3↓
FeCl3 + 3KOH = 3KCl + Fe(OH)3↓
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3↓
2FeCl3 + 3Ca(OH)2 = 3CaCl2 + 2Fe(OH)3↓
FeCl3 + 3LiOH = 3LiCl + Fe(OH)3↓
Fe(OH)3 → Fe2O3
2Fe(OH)3 `overset(t)(=)` Fe2O3 + 3H2O
Fe2O3 → Fe
Fe2O3 + 3CO `overset(t)(=)` 2Fe + 3CO2
Fe2O3 + 3H2 `overset(t)(=)` 2Fe + 3H2O
Fe2O3 + 2Al = Al2O3 + 2Fe