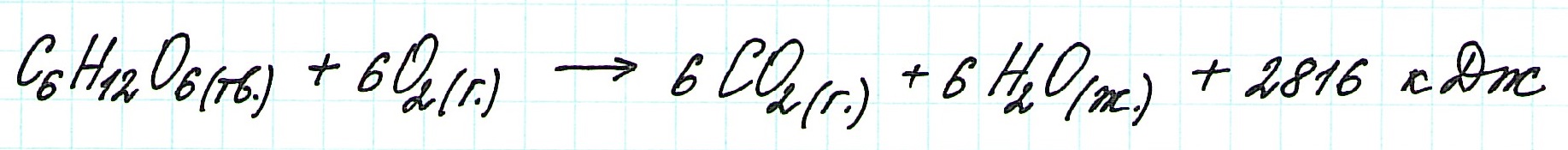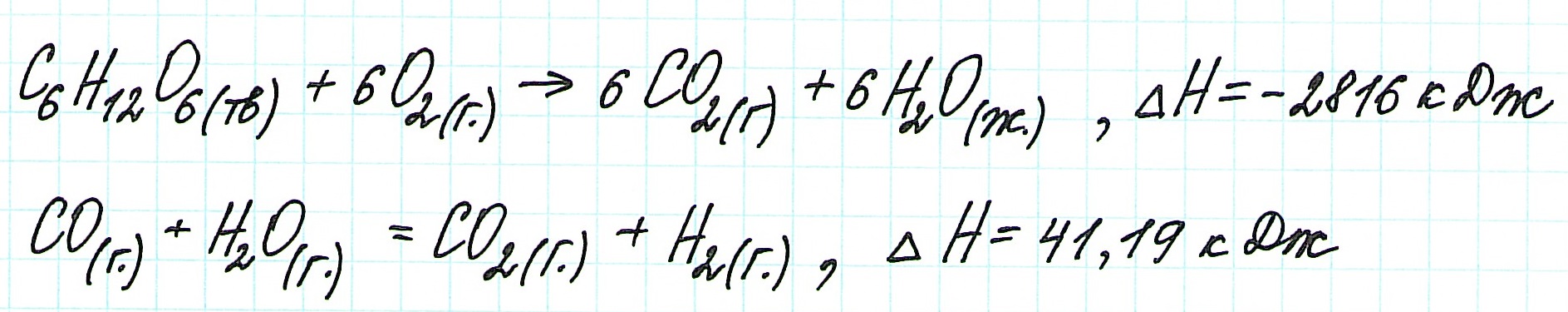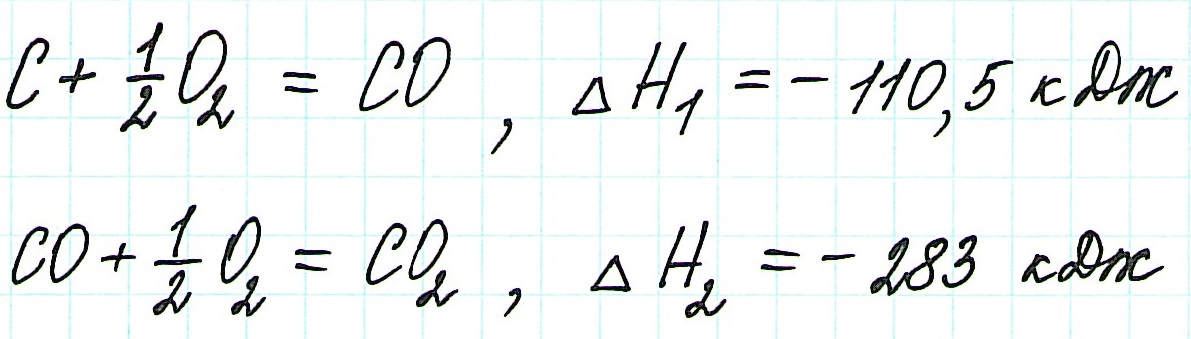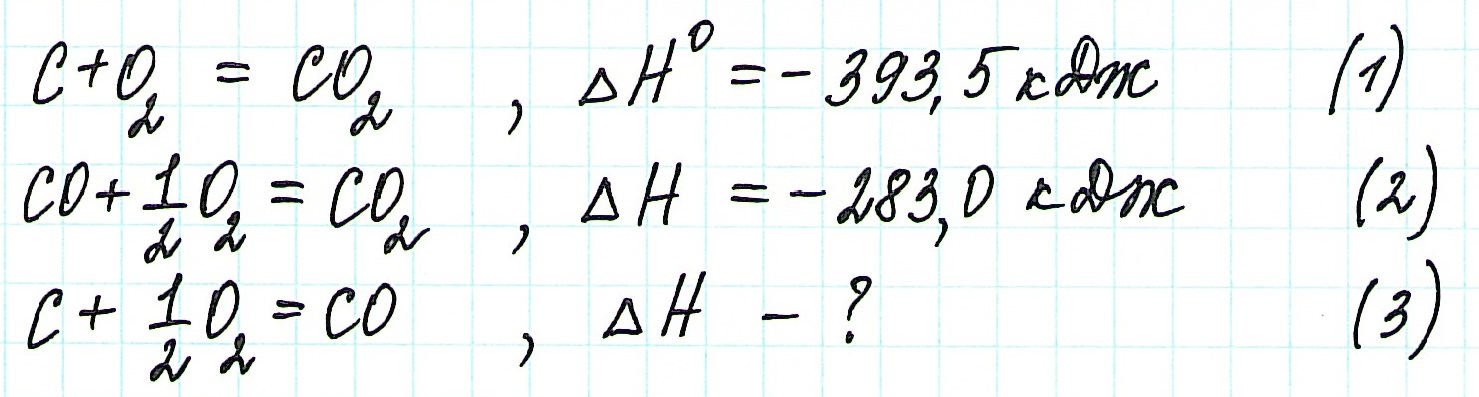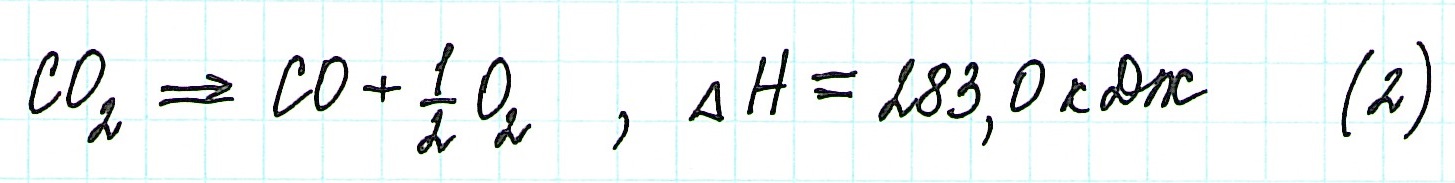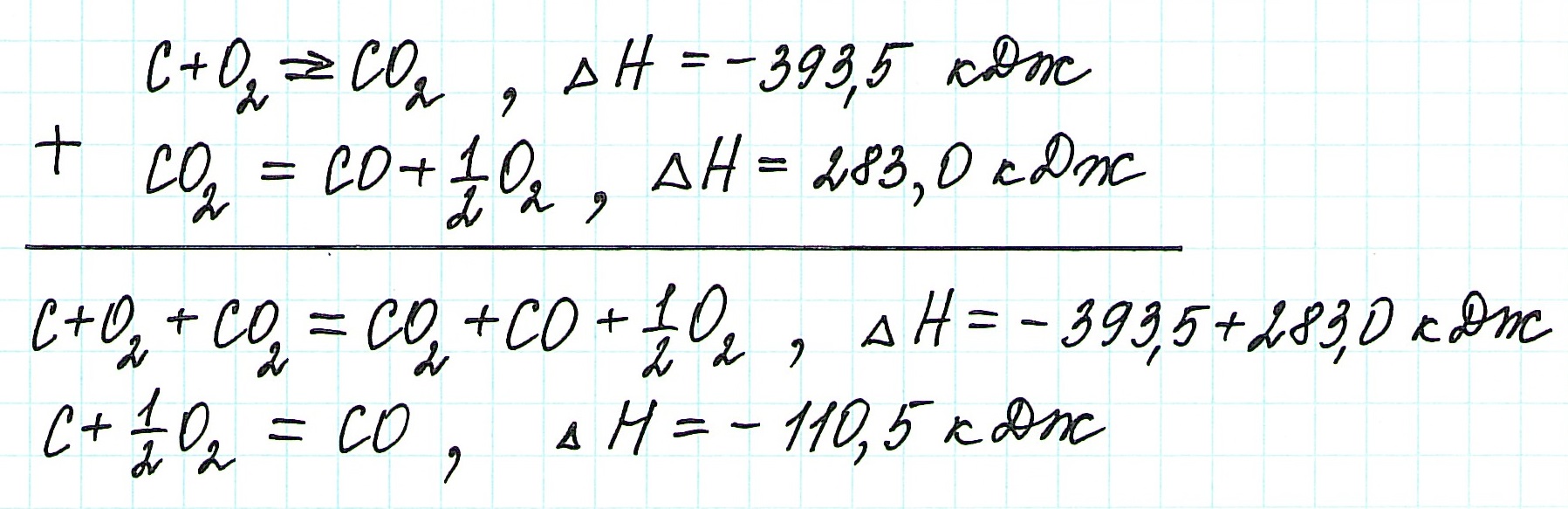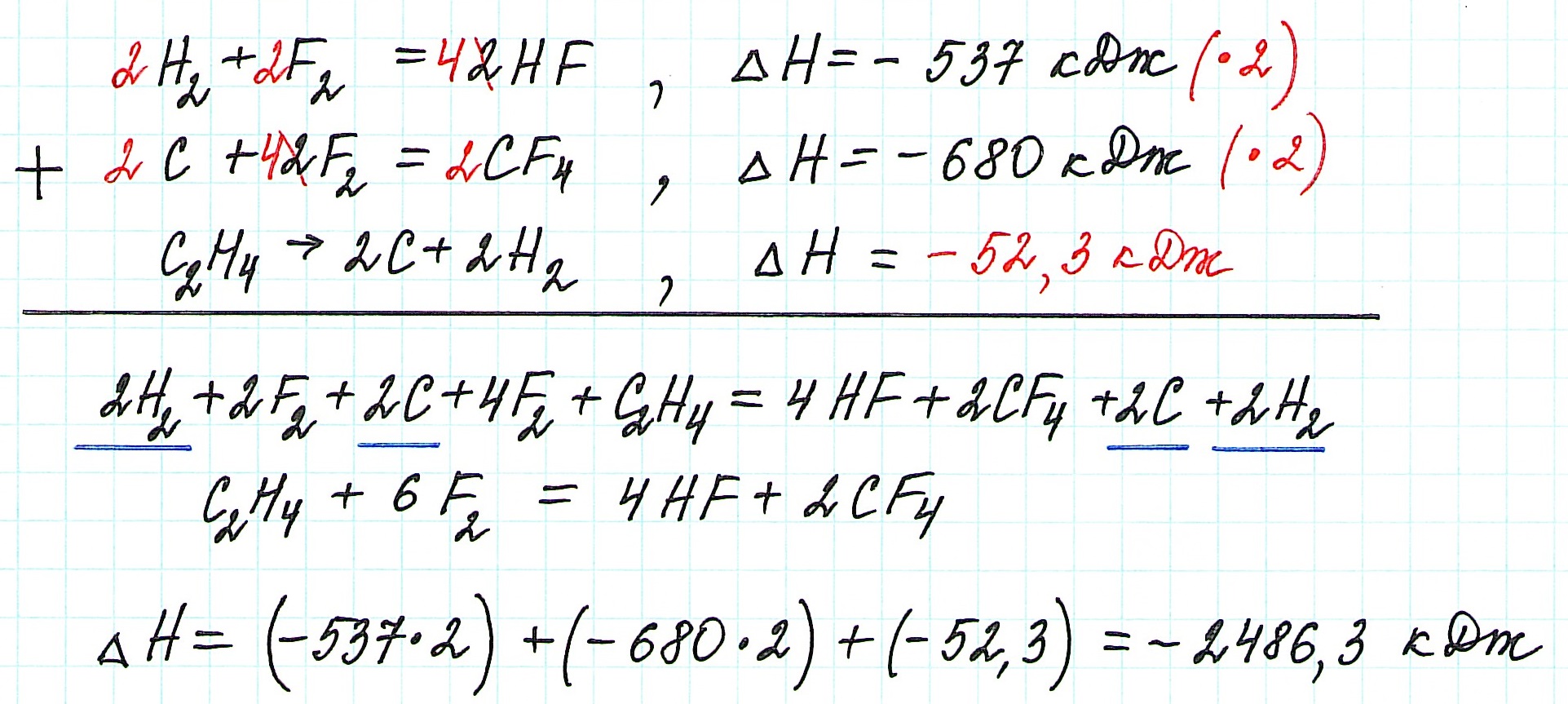Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Тепловой эффект процесса
Термохимические уравнения
Закон Гесса
Следствия из закона Гесса
Стандартные термодинамические величины
Стандартные энтальпии образования и сгорания
Примеры решения задач
Задачи для самостоятельного решения
Тепловой эффект процесса
Количество выделенной (или поглощенной) теплоты Q в данном процессе называют тепловым эффектом процесса. Экзотермической является реакция, протекающая с выделением теплоты, а эндотермической – с поглощением теплоты из окружающей среды.
Для лабораторных и промышленных процессов наиболее типичен изобарный режим (Р=const). Поэтому обычно рассматривают тепловой эффект при Р,Т = const, т.е. изменение энтальпии процесса ΔН.
Следует отметить, что абсолютные значения энтальпии Н определить не представляется возможным, так как не известна абсолютная величина внутренней энергии.
Для экзотермической реакции (Q > 0) ΔН < 0, а в эндотермическом процессе (Q < 0) ΔН > 0.
Термохимические уравнения
Химические уравнения, в которых дополнительно указывается величина изменения энтальпии реакции, а также агрегатное состояние веществ и температура, называются термохимическими уравнениями.
В термохимических уравнениях отмечают фазовое состояние и аллотропные модификации реагентов и образующихся веществ: г – газообразное, ж – жидкое, к – кристаллическое; S(ромб), S(монокл), С(графит), С(алмаз) и т.д.
Важно подчеркнуть, что с термохимическими уравнениями можно проводить алгебраические операции сложения, вычитания, деления, умножения.
Закон Гесса
Изменение энтальпии (внутренней энергии) химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса.
Следствия из закона Гесса
- Изменение энтальпии реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов).
- Изменение энтальпии реакции равно сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции (суммирование проводится с учетом стехиометрических коэффициентов).
Стандартные термодинамические величины
Стандартные термодинамические величины – это такие величины, которые относятся к процессам, все ингредиенты которых находятся в стандартных состояниях.
Стандартным состоянием вещества, находящегося в конденсированной фазе (кристаллической или жидкой), является реальное состояние вещества, находящегося при данной температуре и давлении 1 атм.
Следует подчеркнуть, что стандартное состояние может иметь место при любой температуре.
Обычно тепловой эффект (изменение энтальпии) реакции приводится для температуры 25оС (298,15 К) и давления 101,325 кПа (1 атм), т.е. указывается стандартная энтальпия ΔНо298.
Стандартные энтальпии образования и сгорания
Стандартная энтальпия образования ΔНоf,298 (или ΔНообр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Например, ΔНof,298(Н2О(ж)) = — 285,83 кДж/моль соответствует изменению энтальпии в процессе
Н2(г) + ½O2(г) = Н2О(ж)
при Т = 298,15 К и Р = 1 атм.
Стандартная энтальпия образования простых веществ равна нулю по определению (для наиболее устойчивых их модификаций при данной температуре).
Стандартной энтальпией сгорания ΔНoсгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии.
Примеры решения задач
Задача 1. Используя справочные термодинамические данные вычислить ΔНo298 реакции:
2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(ж); ΔНoх.р.,298 = ?
Решение. Решим задачу, используя оба следствия из закона Гесса. Ниже для исходных веществ и продуктов реакции приведены значения энтальпий образования и сгорания в кДж/моль (энтальпия сгорания сероводорода до SO2(г) и H2O(ж)):
| Вещество | H2S(г) | O2(г) | SO2(г) | H2O(ж) |
| ΔНof,298 | -20,60 | 0 | -296,90 | -285,83 |
| ΔНoсгор,298 | -562,10 | 0 | 0 | 0 |
Cогласно первому следствию закона Гесса энтальпия этой реакции ΔНох.р. равна:
ΔНох.р.,298 = 2ΔНоf,298(SO2(г)) + 2ΔНоf,298(H2O(ж)) — 2ΔНоf,298(H2S(г)) — 3ΔНоf,298(O2(г)) = 2(- 296,90) + 2(- 285,83) — 2(- 20,60) = — 1124,21 кДж.
В соответствии со вторым следствием закона Гесса получаем:
ΔНох.р.,298 = 2ΔНосгор,298(H2S(г)) = 2(-562,10) = — 1124,20 кДж.
Задача 2. Вычислите ΔНо298 реакции N2(г) + 3H2(г) = 2NH3(г), используя следующие данные:
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж); ΔНо1 = -1531,22 кДж;
2H2O(ж) = O2(г) + 2H2(г); ΔНо2= 571,66 кДж.
Определите стандартную энтальпию образования NH3(г).
Решение. Поскольку с термохимическими уравнениями можно производить все алгебраические действия, то искомое уравнение получится, если:
-
-
- разделить на два тепловой эффект первого уравнения и изменить его знак на противоположный, т.е:
-
N2(г) + 3H2O(ж) = 2NH3(г) + 3/2O2(г); ΔНо = 765,61 кДж;
-
-
- умножить на 3/2 второе уравнение и соответствующую ему величину δНo , изменив ее знак на противоположный:
-
3/2O2(г) + 3H2(г) = 3H2O(ж); ΔНо = -857,49 кДж;
-
-
- сложить полученные первое и второе уравнения.
-
Таким образом, тепловой эффект реакции N2(г) + 3H2(г) = 2NH3(г) равен:
Δ Но298 = (- ΔНо1/2) + (- 3/2·ΔНо2) = 765,61 + (- 857,49) = — 91,88 кДж.
Поскольку в рассматриваемой реакции образуется 2 моль NH3(г), то
ΔНоf,298(NH3(г)) = — 91,88/2 = — 45,94 кДж/моль.
Задача 3. Определите энтальпию процесса
CuSO4(к) + 5H2O(ж) = CuSO4·5H2O(к)
если при 298,15 К энтальпия растворения CuSO4(к) в n моль Н2О с образованием раствора CuSO4(р-р, nH2O) равна –40, а энтальпия растворения CuSO4·5H2O(к) с образованием раствора той же концентрации равна +10,5 кДж/моль.
Решение. Составляем цикл Гесса:
ΔНо1 = ΔНо2 + ΔНох (по закону Гесса). Отсюда получаем:
ΔНох = ΔНо1 – ΔНо2 = – 40,0 – 10,5 = -50,5 кДж.
Другой вариант решения.
CuSO4(к) + (n H2O) = CuSO4(р-р, n H2O); ΔНо1 = – 40,0 кДж; (1)
CuSO4(к) + 5H2O(ж) = CuSO4·5H2O(к); ΔНох = Но2; (2)
CuSO4·5H2O(к) + (n – 5)H2O = CuSO4(р-р, nH2O); ΔНо3 = 10,5 кДж. (3)
По закону Гесса: ΔНо1 = ΔНох+ ΔНо3, т.е. при сложении уравнений (2) и (3) получим уравнение (1).
Задача 4. Вычислите энтальпию образования химической связи С= С в молекуле этилена, если его стандартная энтальпия образования равна 52,3 кДж/моль, энтальпия возгонки графита составляет 716,7 кДж/моль, энтальпия атомизации водорода равна +436,0 кДж/моль, энтальпия образования связи С–Н равна –414,0 кДж/моль.
Решение. Составляем цикл Гесса:
ΔНоf,298(С2Н4(г)) = 2ΔНовозг(С(графит)) + 2ΔНоатом (H2(г)) + ΔНо(С= С) + 4ΔНо(С–Н).
ΔНо(С = С) = 52,3 — 2·716,7 — 2·436,0 + 4·414,0 = — 597,1 кДж/моль.
Задачи для самостоятельного решения
1. Составьте уравнение реакции, для которой ΔНо соответствует стандартной энтальпии образования ВaCl2·2H2O(к).
2. Определить ΔНо298 реакции:
CH3CНO(ж) + H2(г) = CH3CH2OH(ж),
если ΔНосгор,298(CH3CНO(ж)) = — 1193,07 кДж/моль; ΔНосгор,298(CH3CH2OH(ж)) = — 1370,68 кДж/моль; ΔНоf,298(Н2О(ж)) = — 285,83 кДж/моль.
10.3. Энтальпии растворения BaCl2(к) и BaCl2·2H2O(к) с образованием раствора хлорида бария (с мольным отношением BaCl2: H2O = 1: 500) соответственно равны –11,18 и 18,74 кДж/моль.
Определить величину ΔНо присоединения воды к BaCl2(к) с образованием BaCl2·2H2O(к).
10.4. Рассчитать энтальпию связи в молекуле NO на основании следующих термохимических уравнений:
N2(г) + O2(г) = 2NO(г); ΔНо298 = +182,52 кДж;
2O(г) = O2(г); ΔНо298 = — 498,34 кДж;
N2(г) = 2N(г); ΔНо298 = +945,42 кДж.
10.5. Вычислить ΔНо298 реакции 2C(г) + 2H2(г) = C2H4(г), используя следующие термохимические уравнения:
С(графит) = С(г) ; ΔНо298 = +716,67 кДж;
С2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(г); ΔНо298 = — 1322,94 кДж;
C(графит) + O2(г) = CO2(г); ΔНо298 = — 393,51 кДж;
H2(г) + 1/2O2(г) = H2O(г); ΔНо298 = — 241,81 кДж.
10.6. Определите стандартную энтальпию реакции взаимодействия метана с оксидом углерода (IV), если стандартные энтальпии образования метана, оксида углерода (IV) и оксида углерода (II) при 298 К равны соответственно: -75; -393 и -111 кДж/моль.
7. Определите стандартную энтальпию образования С2Н5ОН(ж), если стандартные энтальпии сгорания углерода, водорода и этанола при 298 К равны соответственно: -393; -286 и -1366 кДж/моль.
8. Вычислите энтальпию химической реакции 4KClO3(к)=KCl(к)+3KClO4(к) по следующим данным:
2KClO3(к)=2KCl(к)+3O2(г); ΔНо298 = — 95 кДж;
4KClO4(к)=KCl(к)+2O2(г); ΔНо298 = 9 кДж/моль.
9. Вычислите среднюю энтальпию связи P-Cl в молекуле PCl5, используя следующие термохимические уравнения:
P(к, бел.)+5/2Cl2(г)=PCl5(г); ΔНо1 = — 374,8 кДж;
P(к, бел.)=P(г); ΔНо2 = — 17,4 кДж;
Cl2(г)=2Cl(г); ΔНо3 = 242,6 кДж.
10. Вычислите среднюю энтальпию связи N-H в молекуле NH3, используя следующие термохимические уравнения:
1/2N2(г)+3/2H2(г)=NH3(г); ΔНо1 = — 46,2 кДж;
N2(г)=2N(г); ΔНо2 = 945,4 кДж;
H2(г)=2H(г); ΔНо3 = 436,0 кДж.
ЗАКОН ГЕССА И ЕГО СЛЕДСТВИЯ: РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ
Закон Гесса (1840 г.) представляет собой частный случай закона сохранения энергии. Он позволяет определить тепловой эффект химического взаимодействия, используя данные о состояниях веществ только в начале и в конце процесса. Для этого применяется так называемая формула закона Гесса, оформленная в виде формулировки следствия из него.
Итак, что же из себя представляет закон, о котором идет речь? Как, пользуясь им, можно проводить вычисления?
Экзотермические и эндотермические реакции
Основной категорией химического процесса, с которой закон Гесса имеет дело, является тепловой эффект – главный объект термохимии.
Тепловым эффектом Q считают теплоту, либо подающуюся в систему, либо выделяющуюся из нее в ходе химического взаимодействия.
Так, если теплота подается в систему (то есть поглощается из внешней среды), то процесс является эндотермическим. Если теплота, наоборот, уходит из системы в окружающую среду, то процесс является экзотермическим.
Каждая реакция отображается с помощью уравнения. Если в уравнении указан тепловой эффект химического процесса, то такое уравнение называется термохимическим. В нем обязательно записываются либо агрегатные состояния веществ, определяющие общее состояние системы, либо их аллотропные модификации (в случае простых веществ).
Обозначения агрегатных состояний записываются нижним индексом в скобках рядом с химической формулой вещества.
Например, для экзотермического процесса:
И для эндотермического процесса:
Состояния:
— (тв.) – твердое, или (к.) – кристаллическое;
Тепловой эффект Q реакции и изменение энтальпии ΔН имеют одинаковые численные значения, а по знаку противоположны:
В связи с этим приведенные выше уравнения можно записать так:
Закон Гесса как основной закон термохимии и примеры расчетов с его использованием
Закон Гесса констатирует:Рассмотрим классический пример.
При экзотермическом взаимодействии углерода (графита) и кислорода образуется углекислый газ. У этого процесса есть два возможных пути: напрямую или через промежуточную стадию, идущую с образованием угарного газа (оксида углерода (II)):
При прямом процессе, идущем непосредственно с образованием углекислого газа, выделяется 393,5 кДж энергии:
Если процесс взаимодействия графита с кислородом идет в две стадии, то каждая из них также сопровождается выделением энергии:
Просуммируем эти два уравнения:
Получаем то же, что и в первом случае (то есть при прямом взаимодействии графита с кислородом): выделяется 393,5 кДж энергии.
Таким образом, результат реакции совершенно не зависит как от пройденного пути, так и от количества промежуточных стадий. Важными оказываются состояния веществ: начальное и конечное.
Прежде, чем рассмотреть примеры расчетов, в которых используется формула закона Гесса, необходимо сделать некоторые уточнения:
1) результаты термохимических расчетов (и измерений) всегда относят к одному молю вещества, которое образуется в ходе реакции;
2) теплота образования – это количество теплоты, выделяющееся при реакции простых веществ с образованием 1 моля продукта;
3) теплоты образования простых веществ принимают за ноль;
4) если прямой процесс является экзотермическим, то обратный будет эндотермическим, и наоборот.
Пример 1.
Запишем термохимические уравнения реакций, о которых идет речь:
Представим уравнение (2) так, чтобы СО стал конечным продуктом реакции, а не исходным веществом. Для этого запишем уравнение в обратном виде. Теплота сгорания по знаку в таком случае станет противоположной:
Для получения ответа на вопрос задачи (по закону Гесса) просуммируем уравнения (1) и (2):
Таким образом, при сгорании углерода с образованием угарного газа выделяется 110,5 кДж энергии.
Пример 2.
В реакции, для которой требуется вычислить теплоту:
- участвуют 1 молекула этилена и 6 молекул фтора;
- образуются 2 молекулы тетрафторуглерода и 4 молекулы фтороводорода.
— в первой из данных по условию реакций все коэффициенты и теплоту реакции умножим на 2, чтобы получить 4 молекулы фтороводорода;
— во второй реакции также все коэффициенты и теплоту реакции умножим на 2, чтобы получить 2 молекулы тетрафторуглерода;
— уравнение третьей реакции запишем в обратном виде, чтобы этилен стал исходным веществом, а не продуктом реакции;
— изменим знак теплоты третьей реакции на противоположный, так как ее уравнение записываем в обратном виде.
Просуммируем все уравнения:
Таким образом, теплота реакции этилена с фтором ΔН= -2486,3 кДж.
Следствие из закона Гесса: вычисление энтальпии реакции
Чаще всего в вычислениях применяется не сам закон Гесса, а следствие из него. Оно позволяет вычислить как изменение энтальпии реакции, так и энтальпию образования любого из участников химического взаимодействия.
Следствие утверждает, что
В самом общем виде расчетная формула выглядит так:
А если учесть коэффициенты, то так:
Для вычислений обычно применяют стандартные энтальпии образования, так как именно в стандартных состояниях вещества наиболее устойчивы:
Стандартные теплоты (энтальпии) образования являются табличными величинами.
Задача 1. Используя данные таблицы стандартных термодинамических величин , вычислите изменение энтальпии для реакции:
Решение:
Задача 2.
Решение:
Задача 3. Решение:
Тепловой эффект в термодинамическом уравнении относят к 1 молю образующегося вещества. С учетом этого запишем уравнение реакции следующим образом:
Следовательно, для данной реакции термохимическое уравнение будет выглядеть так:
В дополнение ко всему сказанному отметим, что некоторые тепловые эффекты реакций, идущих при стандартном давлении, меняются с температурой. Однако эти изменения незначительны. Поэтому при выполнении термодинамических вычислений для нестандартных условий можно использовать стандартные величины теплот образования. Появится в итоге небольшая ошибка, что вполне допускается.
Таким образом, закон Гесса, а также следствие из него позволяют проводить расчеты, в основе которых лежат тепловые явления химических процессов.
Далее будут рассмотрены случаи, в которых используется формула закона Гесса для расчета таких термодинамических величин, как энтропия и энергия Гиббса.
Энергетика химических процессов. Закон Гесса
Материалы портала onx.distant.ru
Тепловой эффект процесса
Количество выделенной (или поглощенной) теплоты Q в данном процессе называют тепловым эффектом процесса. Экзотермической является реакция, протекающая с выделением теплоты, а эндотермической – с поглощением теплоты из окружающей среды.
Для лабораторных и промышленных процессов наиболее типичен изобарный режим (Р=const). Поэтому обычно рассматривают тепловой эффект при Р,Т = const, т.е. изменение энтальпии процесса ΔН.
Следует отметить, что абсолютные значения энтальпии Н определить не представляется возможным, так как не известна абсолютная величина внутренней энергии.
Для экзотермической реакции (Q > 0) ΔН 0.
Термохимические уравнения
Химические уравнения, в которых дополнительно указывается величина изменения энтальпии реакции, а также агрегатное состояние веществ и температура, называются термохимическими уравнениями.
В термохимических уравнениях отмечают фазовое состояние и аллотропные модификации реагентов и образующихся веществ: г – газообразное, ж – жидкое, к – кристаллическое; S(ромб), S(монокл), С(графит), С(алмаз) и т.д.
Важно подчеркнуть, что с термохимическими уравнениями можно проводить алгебраические операции сложения, вычитания, деления, умножения.
Закон Гесса
Изменение энтальпии (внутренней энергии) химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса.
Следствия из закона Гесса
- Изменение энтальпии реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов).
- Изменение энтальпии реакции равно сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции (суммирование проводится с учетом стехиометрических коэффициентов).
Стандартные термодинамические величины
Стандартные термодинамические величины – это такие величины, которые относятся к процессам, все ингредиенты которых находятся в стандартных состояниях.
Стандартным состоянием вещества, находящегося в конденсированной фазе (кристаллической или жидкой), является реальное состояние вещества, находящегося при данной температуре и давлении 1 атм.
Следует подчеркнуть, что стандартное состояние может иметь место при любой температуре.
Обычно тепловой эффект (изменение энтальпии) реакции приводится для температуры 25 о С (298,15 К) и давления 101,325 кПа (1 атм), т.е. указывается стандартная энтальпия ΔН о 298.
Стандартные энтальпии образования и сгорания
Стандартная энтальпия образования ΔН о f,298 (или ΔН о обр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Например , ΔН o f,298(Н2О(ж)) = — 285,83 кДж/моль соответствует изменению энтальпии в процессе
при Т = 298,15 К и Р = 1 атм.
Стандартная энтальпия образования простых веществ равна нулю по определению (для наиболее устойчивых их модификаций при данной температуре).
Стандартной энтальпией сгорания ΔН o сгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии.
Примеры решения задач
Задача 1. Используя справочные термодинамические данные вычислить ΔН o 298 реакции:
Решение. Решим задачу, используя оба следствия из закона Гесса. Ниже для исходных веществ и продуктов реакции приведены значения энтальпий образования и сгорания в кДж/моль (энтальпия сгорания сероводорода до SO2(г) и H2O(ж)):
| Вещество | H2S(г) | O2(г) | SO2(г) | H2O(ж) |
| ΔН o f,298 | -20,60 | 0 | -296,90 | -285,83 |
| ΔН o сгор,298 | -562,10 | 0 | 0 | 0 |
Cогласно первому следствию закона Гесса энтальпия этой реакции ΔН о х.р. равна:
В соответствии со вторым следствием закона Гесса получаем:
ΔН о х.р.,298 = 2ΔН о сгор,298(H2S(г)) = 2(-562,10) = — 1124,20 кДж.
Задача 2. Вычислите ΔН о 298 реакции N2(г) + 3H2(г) = 2NH3(г), используя следующие данные:
Определите стандартную энтальпию образования NH3(г).
Решение. Поскольку с термохимическими уравнениями можно производить все алгебраические действия, то искомое уравнение получится, если:
-
-
- разделить на два тепловой эффект первого уравнения и изменить его знак на противоположный, т.е:
-
-
-
- умножить на 3/2 второе уравнение и соответствующую ему величину δН o , изменив ее знак на противоположный:
-
Таким образом, тепловой эффект реакции N2(г) + 3H2(г) = 2NH3(г) равен:
Δ Н о 298 = (- ΔН о 1/2) + (- 3/2·ΔН о 2) = 765,61 + (- 857,49) = — 91,88 кДж.
Поскольку в рассматриваемой реакции образуется 2 моль NH3(г), то
ΔН о f,298(NH3(г)) = — 91,88/2 = — 45,94 кДж/моль.
Задача 3. Определите энтальпию процесса
если при 298,15 К энтальпия растворения CuSO4(к) в n моль Н2О с образованием раствора CuSO4(р-р, nH2O) равна –40, а энтальпия растворения CuSO4·5H2O(к) с образованием раствора той же концентрации равна +10,5 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о 1 = ΔН о 2 + ΔН о х (по закону Гесса). Отсюда получаем:
ΔН о х = ΔН о 1 – ΔН о 2 = – 40,0 – 10,5 = -50,5 кДж.
Другой вариант решения.
По закону Гесса: ΔН о 1 = ΔН о х+ ΔН о 3, т.е. при сложении уравнений (2) и (3) получим уравнение (1).
Задача 4. Вычислите энтальпию образования химической связи С= С в молекуле этилена, если его стандартная энтальпия образования равна 52,3 кДж/моль, энтальпия возгонки графита составляет 716,7 кДж/моль, энтальпия атомизации водорода равна +436,0 кДж/моль, энтальпия образования связи С–Н равна –414,0 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о (С = С) = 52,3 — 2·716,7 — 2·436,0 + 4·414,0 = — 597,1 кДж/моль.
Задачи для самостоятельного решения
1. Составьте уравнение реакции, для которой ΔН о соответствует стандартной энтальпии образования ВaCl2·2H2O(к).
Решение задач на закон Гесса
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Развитие управляющих функций мозга ребёнка: полезные советы и упражнения для педагогов
Сертификат и скидка на обучение каждому участнику
Практическая работа №5
Тема: «Решение задач на закон Гесса»
Цель работы: Практически научиться вычислять тепловой эффект химической реакции, теплоту образования веществ.
Тепловой эффект химической реакции- это теплота выделяемая или поглощаемая системой в результате химической реакции, или фазового превращения. При этом должны соблюдаться следующее условия:
Процесс протекает термодинамически — необратимо.
Давление и объём — постоянные.
Не совершается никакой работы, кроме работы расширения, при постоянном давлении.
Температура продуктов реакции равна температуре исходных веществ.
Тепловой эффект превращения зависит только от начального и конечного состояния системы и не зависит от её промежуточных состояний и путей перехода.
В термохимии при написании уравнения химической реакции принято указывать агрегатное состояние вещества и тепловой эффект химической реакции.
Закон Гесса позволяет обращаться с термохимическим уравнением, как с алгебраическим, если только тепловые эффекты относятся к одинаковым условиям.
Закон Гесса позволяет определить тепловые эффекты реакций, которые невозможно изменить экспериментально.
Вычислите тепловой эффект химической реакции восстановления FeO (║) исходя из следующих уравнений:
CO+ 

H 2 + 








г = FeO + CO + H 2 + 




Ответ: 
Вычислите теплоту образования гидроксида кальция ( CaO ), исход из следующих уравнений реакций:
Ca + 

H 2 + 

CaO+ H 2 O ( ж ) →Ca (OH) 2 ; 







Ca + 


Ca + O 2 + H 2 →Ca(OH) 2 ; 
Ответ: 
Вывод: проделав эту работу, я практически научилась вычислять тепловой эффект химической реакции, теплоту образования веществ.
http://infourok.ru/material.html?mid=45972
Обновлено: 24.05.2023
Закон Гесса — основной закон термохимии, который формулируется следующим образом:
- Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе (при p,T = const или V,T = const), всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы. Иными словами, закон Гесса есть утверждение о том, что тепловой эффект реакции (Qp = ΔHp,T или QV=ΔUV,T) является функцией состояния. Тепловой эффект реакции (который определён только для изобарно-изотермического или для изохорно-изотермического процессов) нельзя путать с теплотой (Q), выделяемой или поглощаемой в ходе процесса или реакции. В общем случае теплота не является функцией состояния и не описывается законом Гесса.
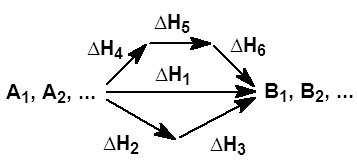
На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
Закон открыт русским химиком Г. И. Гессом в 1841 году; он является частным случаем первого начала термодинамики применительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него.
Этот закон был открыт Гессом в 1840 г. на основании обобщения множества экспериментальных данных.
Формулировка закона Гесса:
Тепловой эффект реакции, протекающей при постоянном давлении (Qp = DН) или при постоянном объеме (QV = DU) и постоянной температуре, определяется только природой и состоянием исходных веществ и продуктов реакции и не зависит от пути перехода от исходных веществ к продуктам реакции (т.е. реакцию можно проводить в одну, две, три и т.д. стадии).
Закон Гесса основан на том, что Qp и QV – функции состояния (в отличие от Q).
QP = H, p = const (20)
Рассмотрим процесс перехода от исходных веществ к продуктам реакции при р = const, Т = const. Тогда Qp = DН. Составим так называемый термохимический цикл. Пусть от исходных веществ к продуктам реакции можно перейти тремя различными путями — в одну, две или три стадии:
Следствия из закона Гесса.
Первое следствие из закона Гесса .
Тепловой эффект реакции равен разности между суммой теплот образования из простых веществ (DfH) продуктов реакции и суммой теплот образования из простых веществ исходных веществ (с учетом стехиометрических коэффициентов).
Математическое выражение для первого следствия из закона Гесса можно записать в следующем виде:
Теплота образования ?fН — это тепловой эффект реакции образования 1 моль соединения из простых веществ.
Стандартное состояние характеризуется и давлением р = 1 атм = 1·10 5 Па.
Тепловые эффекты, отнесённые к этим условиям, называются стандартными тепловыми эффектами.
Стандартная энтальпия (теплота) образования соединения из простых веществ (DfH 0 298) –это есть тепловой эффект реакции образования 1 моль данного соединения из соответствующих количеств простых веществ при стандартных условиях .
Простые вещества — это химические элементы или вещества , взятые в тех агрегатных состояниях или кристаллических модификациях, в которых они устойчивы при стандартном состоянии.
Принято, что для простых веществ DfH 0 298 = 0.
Второе следствие из закона Гесса .
Тепловой эффект реакции равен разности между суммой теплот сгорания (DcH) исходных веществ и суммой теплот сгорания продуктов реакции (с учетом стехиометрических коэффициентов).
Математическое выражение для вторго следствия из закона Гесса можно записать в следующем виде:
Стандартная энтальпия (теплота) сгорания соединения (обозначаемая как DcH 0 298) – это есть тепловой эффект реакции окисления 1 моль данного сединения газообразным молекулярным кислородом при стандартном условиях с образованием соответствующих количеств следующих веществ (если не указано иначе): СО2, газ, Н2Ожидк., N2, газ,. Hhal,(Cl,Br), SO2 газ. и др.
Единицы измерения [DfН] и [DсН] равны кДж/моль, [n] = моль, [DНреакции] = кДж!
Пример 1.1 Рассчитать тепловые эффекты двух следующих реакций:
если известны стандартные теплоты образования всех компонентов данных реакций.
Решение. Выполним расчеты для 25 0 С и давления 1 атм, приняв условие постоянства давления в ходе реакций. В этом случае тепловой эффект должен быть равен изменению энтальпии системы:
Пример 1.2 Рассчитать тепловой эффект полиморфного превращения 1 моль графита в алмаз при стандартных условиях, если известны стандартные теплоты сгорания графита и алмаза при Т = 298,15 К и Р = 1атм.
Решение. Запишем реакцию полиморфного превращения графита в алмаз:
Расчет показывает, что
Следовательно, процесс превращения графита в алмаз при стандартных условиях (если бы он имел место) должен был бы происходить с поглощением небольшого количества тепла.
Связь между Qp и QV для химических реакций.
Рассмотрим реакцию, протекающую при постоянном давлении p. По определению:
Н º U + pV; тогда
Если в реакции участвуют газообразные вещества, то, считая их идеальными газами, с учетом уравнения Менделеева-Клапейрона:
можно получить выражения:
DH = DU + DnгазRT или
где Dnгаз – изменение числа молей газообразных веществ в результате одного пробега реакции,
Иногда пишут вместо Dnгаз символы Dnгаз.
Один пробег реакции означает, что в реакцию вступило такое количество молей каждого из веществ, которое соответствует их стехиометрическим коэффициентам в уравнении реакции.
Этот закон был открыт Гессом в 1840 г. на основании обобщения множества экспериментальных данных.
Формулировка закона Гесса:
Тепловой эффект реакции, протекающей при постоянном давлении (Qp = DН) или при постоянном объеме (QV = DU) и постоянной температуре, определяется только природой и состоянием исходных веществ и продуктов реакции и не зависит от пути перехода от исходных веществ к продуктам реакции (т.е. реакцию можно проводить в одну, две, три и т.д. стадии).
Закон Гесса основан на том, что Qp и QV – функции состояния (в отличие от Q).
QP = H, p = const (20)
Рассмотрим процесс перехода от исходных веществ к продуктам реакции при р = const, Т = const. Тогда Qp = DН. Составим так называемый термохимический цикл. Пусть от исходных веществ к продуктам реакции можно перейти тремя различными путями — в одну, две или три стадии:
Следствия из закона Гесса.
Первое следствие из закона Гесса .
Тепловой эффект реакции равен разности между суммой теплот образования из простых веществ (DfH) продуктов реакции и суммой теплот образования из простых веществ исходных веществ (с учетом стехиометрических коэффициентов).
Математическое выражение для первого следствия из закона Гесса можно записать в следующем виде:
Теплота образования ?fН — это тепловой эффект реакции образования 1 моль соединения из простых веществ.
Стандартное состояние характеризуется и давлением р = 1 атм = 1·10 5 Па.
Тепловые эффекты, отнесённые к этим условиям, называются стандартными тепловыми эффектами.
Стандартная энтальпия (теплота) образования соединения из простых веществ (DfH 0 298) –это есть тепловой эффект реакции образования 1 моль данного соединения из соответствующих количеств простых веществ при стандартных условиях .
Простые вещества — это химические элементы или вещества , взятые в тех агрегатных состояниях или кристаллических модификациях, в которых они устойчивы при стандартном состоянии.
Принято, что для простых веществ DfH 0 298 = 0.
Второе следствие из закона Гесса .
Тепловой эффект реакции равен разности между суммой теплот сгорания (DcH) исходных веществ и суммой теплот сгорания продуктов реакции (с учетом стехиометрических коэффициентов).
Математическое выражение для вторго следствия из закона Гесса можно записать в следующем виде:
Стандартная энтальпия (теплота) сгорания соединения (обозначаемая как DcH 0 298) – это есть тепловой эффект реакции окисления 1 моль данного сединения газообразным молекулярным кислородом при стандартном условиях с образованием соответствующих количеств следующих веществ (если не указано иначе): СО2, газ, Н2Ожидк., N2, газ,. Hhal,(Cl,Br), SO2 газ. и др.
Единицы измерения [DfН] и [DсН] равны кДж/моль, [n] = моль, [DНреакции] = кДж!
Пример 1.1 Рассчитать тепловые эффекты двух следующих реакций:
если известны стандартные теплоты образования всех компонентов данных реакций.
Решение. Выполним расчеты для 25 0 С и давления 1 атм, приняв условие постоянства давления в ходе реакций. В этом случае тепловой эффект должен быть равен изменению энтальпии системы:
Пример 1.2 Рассчитать тепловой эффект полиморфного превращения 1 моль графита в алмаз при стандартных условиях, если известны стандартные теплоты сгорания графита и алмаза при Т = 298,15 К и Р = 1атм.
Решение. Запишем реакцию полиморфного превращения графита в алмаз:
Расчет показывает, что
Следовательно, процесс превращения графита в алмаз при стандартных условиях (если бы он имел место) должен был бы происходить с поглощением небольшого количества тепла.
Связь между Qp и QV для химических реакций.
Рассмотрим реакцию, протекающую при постоянном давлении p. По определению:
Н º U + pV; тогда
Если в реакции участвуют газообразные вещества, то, считая их идеальными газами, с учетом уравнения Менделеева-Клапейрона:
можно получить выражения:
DH = DU + DnгазRT или
где Dnгаз – изменение числа молей газообразных веществ в результате одного пробега реакции,
Иногда пишут вместо Dnгаз символы Dnгаз.
Один пробег реакции означает, что в реакцию вступило такое количество молей каждого из веществ, которое соответствует их стехиометрическим коэффициентам в уравнении реакции.
Количество выделенной (или поглощенной) теплоты Q в данном процессе называют тепловым эффектом процесса. Экзотермической является реакция, протекающая с выделением теплоты, а эндотермической – с поглощением теплоты из окружающей среды.
Для лабораторных и промышленных процессов наиболее типичен изобарный режим (Р=const). Поэтому обычно рассматривают тепловой эффект при Р,Т = const, т.е. изменение энтальпии процесса ΔН.
Следует отметить, что абсолютные значения энтальпии Н определить не представляется возможным, так как не известна абсолютная величина внутренней энергии.
Для экзотермической реакции (Q > 0) ΔН 0.
Химические уравнения, в которых дополнительно указывается величина изменения энтальпии реакции, а также агрегатное состояние веществ и температура, называются термохимическими уравнениями.
В термохимических уравнениях отмечают фазовое состояние и аллотропные модификации реагентов и образующихся веществ: г – газообразное, ж – жидкое, к – кристаллическое; S(ромб), S(монокл), С(графит), С(алмаз) и т.д.
Важно подчеркнуть, что с термохимическими уравнениями можно проводить алгебраические операции сложения, вычитания, деления, умножения.
Изменение энтальпии (внутренней энергии) химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса.
- Изменение энтальпии реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов).
- Изменение энтальпии реакции равно сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции (суммирование проводится с учетом стехиометрических коэффициентов).
Стандартные термодинамические величины – это такие величины, которые относятся к процессам, все ингредиенты которых находятся в стандартных состояниях.
Стандартным состоянием вещества, находящегося в конденсированной фазе (кристаллической или жидкой), является реальное состояние вещества, находящегося при данной температуре и давлении 1 атм.
Следует подчеркнуть, что стандартное состояние может иметь место при любой температуре.
Обычно тепловой эффект (изменение энтальпии) реакции приводится для температуры 25 о С (298,15 К) и давления 101,325 кПа (1 атм), т.е. указывается стандартная энтальпия ΔН о 298.
Стандартная энтальпия образования ΔН о f,298 (или ΔН о обр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Например , ΔН o f,298(Н2О(ж)) = — 285,83 кДж/моль соответствует изменению энтальпии в процессе
при Т = 298,15 К и Р = 1 атм.
Стандартная энтальпия образования простых веществ равна нулю по определению (для наиболее устойчивых их модификаций при данной температуре).
Стандартной энтальпией сгорания ΔН o сгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии.
Задача 1. Используя справочные термодинамические данные вычислить ΔН o 298 реакции:
Решение. Решим задачу, используя оба следствия из закона Гесса. Ниже для исходных веществ и продуктов реакции приведены значения энтальпий образования и сгорания в кДж/моль (энтальпия сгорания сероводорода до SO2(г) и H2O(ж)):
| Вещество | H2S(г) | O2(г) | SO2(г) | H2O(ж) |
| ΔН o f,298 | -20,60 | 0 | -296,90 | -285,83 |
| ΔН o сгор,298 | -562,10 | 0 | 0 | 0 |
Cогласно первому следствию закона Гесса энтальпия этой реакции ΔН о х.р. равна:
В соответствии со вторым следствием закона Гесса получаем:
ΔН о х.р.,298 = 2ΔН о сгор,298(H2S(г)) = 2(-562,10) = — 1124,20 кДж.
Задача 2. Вычислите ΔН о 298 реакции N2(г) + 3H2(г) = 2NH3(г), используя следующие данные:
Определите стандартную энтальпию образования NH3(г).
Решение. Поскольку с термохимическими уравнениями можно производить все алгебраические действия, то искомое уравнение получится, если:
-
-
- разделить на два тепловой эффект первого уравнения и изменить его знак на противоположный, т.е:
-
-
- умножить на 3/2 второе уравнение и соответствующую ему величину δН o , изменив ее знак на противоположный:
-
-
- сложить полученные первое и второе уравнения.
Таким образом, тепловой эффект реакции N2(г) + 3H2(г) = 2NH3(г) равен:
Δ Н о 298 = (- ΔН о 1/2) + (- 3/2·ΔН о 2) = 765,61 + (- 857,49) = — 91,88 кДж.
Поскольку в рассматриваемой реакции образуется 2 моль NH3(г), то
ΔН о f,298(NH3(г)) = — 91,88/2 = — 45,94 кДж/моль.
Задача 3. Определите энтальпию процесса
если при 298,15 К энтальпия растворения CuSO4(к) в n моль Н2О с образованием раствора CuSO4(р-р, nH2O) равна –40, а энтальпия растворения CuSO4·5H2O(к) с образованием раствора той же концентрации равна +10,5 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о 1 = ΔН о 2 + ΔН о х (по закону Гесса). Отсюда получаем:
ΔН о х = ΔН о 1 – ΔН о 2 = – 40,0 – 10,5 = -50,5 кДж.
Другой вариант решения.
По закону Гесса: ΔН о 1 = ΔН о х+ ΔН о 3, т.е. при сложении уравнений (2) и (3) получим уравнение (1).
Задача 4. Вычислите энтальпию образования химической связи С= С в молекуле этилена, если его стандартная энтальпия образования равна 52,3 кДж/моль, энтальпия возгонки графита составляет 716,7 кДж/моль, энтальпия атомизации водорода равна +436,0 кДж/моль, энтальпия образования связи С–Н равна –414,0 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о (С = С) = 52,3 — 2·716,7 — 2·436,0 + 4·414,0 = — 597,1 кДж/моль.
1. Составьте уравнение реакции, для которой ΔН о соответствует стандартной энтальпии образования ВaCl2·2H2O(к).
При изобарных и изохорных условиях теплота является функцией состояния.
Современная формулировка закона Гесса – общие приращения энтальпии при переходе начальных веществ в продукты реакции не зависят от того, через какие промежуточные стадии прошла реакция.
Закон Гесса позволяет рассчитать тепловые эффекты или приращение энтальпии только при стандартных условиях (р = 1 атм = 10 5 Па, Т = 273 К + 25 = 298 К).
Теплоты при стандартных условиях сведены в таблицу (справочник под редакцией Нищенко). Для индивидуальных веществ: С, Н2, Fe и др. – ?Н = 0.
Следствия из закона Гесса:
1) энтальпия образования 1 моля соединения из простых веществ не зависит от способа получения;
где f – формация.
Пример 1. Рассчитать тепловой эффект реакции этерификации спирта.
Пример 2. Рассчитать тепловой эффект реакции, протекающей по уравнению:
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРес
Красота — физический закон?
Красота — физический закон? Теория суперструн дает нам убедительную формулировку теории Вселенной, но не решает фундаментальную проблему: экспериментальная проверка теории при нынешнем уровне развития техники и технологии невозможна. Теория предполагает возможность
Закон всемирного тяготения
Закон инерции
Закон инерции Из принципа относительности движения вытекает, что тело, на которое не действует никакая внешняя сила, может находиться не только в состоянии покоя, но и в состоянии прямолинейного равномерного движения. Это положение в физике называется законом
7. Закон Генри
7. Закон Генри Фугитивность растворителя в разбавленном растворе не зависит от природы растворенного вещества и вычисляется по закону Рауля, то есть: Так как фугитивность жидкости или твердого раствора равна фугитивности насыщенного пара, когда растворитель в
Закон красного смещения
Закон красного смещения Эта история началась с замечательного открытия, сделанного в 1908 году Генриеттой Ливитт, которая тогда не была еще астрономом. Она смотрела не вверх, в звездное небо, а вниз — на фотопластинки, сделанные в Гарвардской обсерватории за много лет. В те
Закон Ньютона
Закон Ньютона Закон всемирного тяготения после обсуждения в третьем чтении был отправлен на доработку… Фольклор Проверка закона Ньютона. Осмысление закона Ньютона до сих пор играет очень важную роль для осмысления представлений о гравитации вообще. Как можно
Закон Мэрфи
Закон Мэрфи Дональд МИЧИ Я думаю, что самое глубокое и прочное впечатление в своей жизни каждый научный работник получает от того, как неожиданно, как несправедливо, как удручающе трудно хоть что-нибудь открыть или доказать. Многих осложнений и разочарований можно было
Закон сохранения массы
Закон сохранения массы Если растворить сахар в воде, то масса раствора будет строго равна сумме масс сахара и воды.Этот и бесчисленное количество подобных опытов показывают, что масса тела есть неизменное свойство. При любом дроблении и при растворении масса остается
Закон инерции
Закон инерции Не приходится спорить – инерциальная система отсчета удобна и обладает неоценимыми преимуществами.Но единственная ли это система или, может быть, существует много инерциальных систем? Древние греки, например, стояли на первой точке зрения. В их сочинениях
Закон Архимеда
Закон Авогадро
Закон Авогадро Пусть вещество представляет собой смесь различных молекул. Нет ли такой физической величины, характеризующей движение, которая была бы одинакова для всех этих молекул, например для водорода и кислорода, находящихся при одинаковой температуре?Механика
Закон преломления
Закон преломления В работе Dioptrique Декарт излагает свою теорию света, основанную на вихрях, и обсуждает законы отражения и преломления, впервые выразив принцип, что отношение углов падения и преломления зависит от среды, через которую проходит свет.Уже греки знали, что
Закон Рэлея
Закон Рэлея К концу 1899 г. были проведены более точные измерения в области более длинных волн, которые показали, что в этой области закон Вина уже несправедлив. В июне того же года лорд Рэлей (который был при рождении Джоном Вильямом Стрэтгом (1842-1919)) опубликовал вывод закона
Закон Планка
Закон Планка Теоретическая ситуация, как описывают, была следующей. Когда в воскресенье 7 октября 1900 г. X. Рубенс со своей женой посетил Планков, он рассказал Планку об измерениях на длинах волн до 50 мкм, которые он произвел вместе с Ф. Курлбаумом в Берлинском институте. Эти
Закон Гесса (1840 г.) представляет собой частный случай закона сохранения энергии. Он позволяет определить тепловой эффект химического взаимодействия, используя данные о состояниях веществ только в начале и в конце процесса. Для этого применяется так называемая формула закона Гесса, оформленная в виде формулировки следствия из него.
Итак, что же из себя представляет закон, о котором идет речь? Как, пользуясь им, можно проводить вычисления?
Экзотермические и эндотермические реакции
Основной категорией химического процесса, с которой закон Гесса имеет дело, является тепловой эффект – главный объект термохимии.
Тепловым эффектом Q считают теплоту, либо подающуюся в систему, либо выделяющуюся из нее в ходе химического взаимодействия.
Так, если теплота подается в систему (то есть поглощается из внешней среды), то процесс является эндотермическим. Если теплота, наоборот, уходит из системы в окружающую среду, то процесс является экзотермическим.
Каждая реакция отображается с помощью уравнения. Если в уравнении указан тепловой эффект химического процесса, то такое уравнение называется термохимическим. В нем обязательно записываются либо агрегатные состояния веществ, определяющие общее состояние системы, либо их аллотропные модификации (в случае простых веществ).
Обозначения агрегатных состояний записываются нижним индексом в скобках рядом с химической формулой вещества.
Например, для экзотермического процесса:
И для эндотермического процесса:
Состояния:
— (тв.) – твердое, или (к.) – кристаллическое;
Тепловой эффект Q реакции и изменение энтальпии ΔН имеют одинаковые численные значения, а по знаку противоположны:
В связи с этим приведенные выше уравнения можно записать так:
Закон Гесса как основной закон термохимии и примеры расчетов с его использованием
Закон Гесса констатирует:Рассмотрим классический пример.
При экзотермическом взаимодействии углерода (графита) и кислорода образуется углекислый газ. У этого процесса есть два возможных пути: напрямую или через промежуточную стадию, идущую с образованием угарного газа (оксида углерода (II)):
При прямом процессе, идущем непосредственно с образованием углекислого газа, выделяется 393,5 кДж энергии:
Если процесс взаимодействия графита с кислородом идет в две стадии, то каждая из них также сопровождается выделением энергии:
Просуммируем эти два уравнения:
Получаем то же, что и в первом случае (то есть при прямом взаимодействии графита с кислородом): выделяется 393,5 кДж энергии.
Таким образом, результат реакции совершенно не зависит как от пройденного пути, так и от количества промежуточных стадий. Важными оказываются состояния веществ: начальное и конечное.
Прежде, чем рассмотреть примеры расчетов, в которых используется формула закона Гесса, необходимо сделать некоторые уточнения:
1) результаты термохимических расчетов (и измерений) всегда относят к одному молю вещества, которое образуется в ходе реакции;
2) теплота образования – это количество теплоты, выделяющееся при реакции простых веществ с образованием 1 моля продукта;
3) теплоты образования простых веществ принимают за ноль;
4) если прямой процесс является экзотермическим, то обратный будет эндотермическим, и наоборот.
Пример 1.
Запишем термохимические уравнения реакций, о которых идет речь:
Представим уравнение (2) так, чтобы СО стал конечным продуктом реакции, а не исходным веществом. Для этого запишем уравнение в обратном виде. Теплота сгорания по знаку в таком случае станет противоположной:
Для получения ответа на вопрос задачи (по закону Гесса) просуммируем уравнения (1) и (2):
Таким образом, при сгорании углерода с образованием угарного газа выделяется 110,5 кДж энергии.
Пример 2.
В реакции, для которой требуется вычислить теплоту:
- участвуют 1 молекула этилена и 6 молекул фтора;
- образуются 2 молекулы тетрафторуглерода и 4 молекулы фтороводорода.
— в первой из данных по условию реакций все коэффициенты и теплоту реакции умножим на 2, чтобы получить 4 молекулы фтороводорода;
— во второй реакции также все коэффициенты и теплоту реакции умножим на 2, чтобы получить 2 молекулы тетрафторуглерода;
— уравнение третьей реакции запишем в обратном виде, чтобы этилен стал исходным веществом, а не продуктом реакции;
— изменим знак теплоты третьей реакции на противоположный, так как ее уравнение записываем в обратном виде.
Просуммируем все уравнения:
Таким образом, теплота реакции этилена с фтором ΔН= -2486,3 кДж.
Следствие из закона Гесса: вычисление энтальпии реакции
Чаще всего в вычислениях применяется не сам закон Гесса, а следствие из него. Оно позволяет вычислить как изменение энтальпии реакции, так и энтальпию образования любого из участников химического взаимодействия.
Следствие утверждает, что
В самом общем виде расчетная формула выглядит так:
А если учесть коэффициенты, то так:
Для вычислений обычно применяют стандартные энтальпии образования, так как именно в стандартных состояниях вещества наиболее устойчивы:
Стандартные теплоты (энтальпии) образования являются табличными величинами.
Задача 1. Используя данные таблицы стандартных термодинамических величин , вычислите изменение энтальпии для реакции:
Решение:
Задача 2.
Решение:
Задача 3. Решение:
Тепловой эффект в термодинамическом уравнении относят к 1 молю образующегося вещества. С учетом этого запишем уравнение реакции следующим образом:
Следовательно, для данной реакции термохимическое уравнение будет выглядеть так:
В дополнение ко всему сказанному отметим, что некоторые тепловые эффекты реакций, идущих при стандартном давлении, меняются с температурой. Однако эти изменения незначительны. Поэтому при выполнении термодинамических вычислений для нестандартных условий можно использовать стандартные величины теплот образования. Появится в итоге небольшая ошибка, что вполне допускается.
Таким образом, закон Гесса, а также следствие из него позволяют проводить расчеты, в основе которых лежат тепловые явления химических процессов.
Далее будут рассмотрены случаи, в которых используется формула закона Гесса для расчета таких термодинамических величин, как энтропия и энергия Гиббса.
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Читайте также:
- Работа секретарем в школе без опыта
- Программа районного методического объединения в доу
- Требования к проведению консультации в школе
- Г и колесникова лучшие психологические тесты для школьного психолога практическое пособие
- Средства обучения и их характеристика в педагогике кратко
-
-
-
Добавил:
Вуз:
Предмет:
Файл:
random / books / Зенин Г.С., Привалова Т.А., Пенкина Н.В. — Физическая химия. Часть 1. Химическая термодинамика_ Текст лекций (2001, СЗТУ).pdf
Скачиваний:
33
Добавлен:
10.02.2020
Размер:
886.45 Кб
Скачать

Химическая термодинамика
Низшей теплотой сгорания называется теплота, выделившаяся при сгорании органического вещества, если образовавшаяся при этом вода находится в парообразном состоянии. Высшей теплотой сгорания называется сумма теплоты, выделившейся при сгорании органического вещества, и теплоты конденсации образовавшихся при этом паров воды.
В справочниках теплоты сгорания относятся к стандартным условиям (∆Hсг0 .,298 ).
Контрольные вопросы.
1. Сформулируйте закон Гесса. Рассчитайте на основании этого закона количество тепла, выделяющегося при переходе H2Oпар → H2Oлед и
H2Oж. → H2Oлед .
2.Что такое теплота образования и теплота сгорания?
3.Дайте определение энтальпии.
эффектов
Способы расчета тепловых эффектов основаны на законе Гесса и применении термохимического цикла.
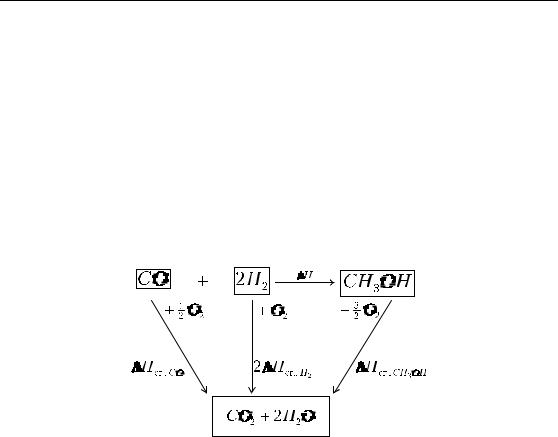
Расчет тепловых эффектов с помощью теплот образования Определим тепловой эффект гомогенной газовой реакции син-
теза метанола
COг. + 2H2,г. =CH3OHг.; ∆H =?
Эту реакцию мысленно можно осуществить, получая метанол взаимодействием простых веществ: графита, кислорода и водорода.
Составим термодинамический цикл, включающий получение метанола из простых веществ (H2 – простое вещество).
Согласно закону Гесса,
∆H f , CO + 2∆H f , H2 + ∆H = ∆H f , CH3OH ,
15
Химическая термодинамика
∆H = ∆H f , CH3OH +(∆H f , CO + 2∆H f , H2 ).
В общем случае для любой реакции:
|
∆H = ∑(ν j∆H f , j ) |
кон. |
−∑(νi∆H f , i ) |
, |
|
j |
i |
нач. |
|
где νi и ν j — стехиометрические коэффициенты для конечных и ис-
ходных веществ.
Расчет тепловых эффектов с помощью теплот сгорания Составим цикл, включающий стадии сгорания исходных ве-
ществ и продуктов, для реакции синтеза метанола:
Согласно закону Гесса,
∆Hсг., CO + 2∆Hсг., H2 = ∆H + ∆Hсг., CH3OH ,
∆H =(∆Hсг., CO + 2∆Hсг., H2 )−∆Hсг., CH3OH .
В общем случае для любой реакции:
|
∆H = ∑(νi∆Hсг.,i ) |
нач. |
−∑(ν j∆Hсг.,j ) |
. |
|
i |
j |
нач. |
|
Расчет теплоты нейтрализации сильных и слабых кислот Определим теплоту нейтрализации сильной кислоты щелочью
в водном растворе при стандартных условиях.
HCl + NaOH = NaCl + H2O
или в ионной форме:
H + +OH − = H2O; ∆H =?
Очевидно, что при нейтрализации эквивалентных количеств любых сильных кислот сильными основаниями тепловой эффект будет одинаков.
16

Химическая термодинамика
Из справочника находим теплоты образования для ионов H+ и OH − , участвующих в этой реакции:
|
Теплоты образования веществ |
Таблица 1.1 |
|||||
|
Вещества |
0 |
кДж |
∑(ν∆H of , 298 ) |
|||
|
∆H f , 298 |
моль |
|||||
|
Конечные |
H2Oж. |
–285,83 |
–285,83 |
|||
|
Исходные |
H + |
0 |
–230,02 |
|||
|
OH − |
–230,02 |
|||||
|
На реакцию |
–55,81 |
Определим теплоту нейтрализации слабой кислоты щелочью в водном растворе при стандартных условиях.
CH3COOH + NaOH =CH3COONa + H2O; ∆H =?
или в ионной форме
CH3COOH +OH − =CH3COO− + H2O; ∆H =?
Из справочника находим теплоты образования для молекул H2O и CH3COOH, а также ионов CH3COO− и OH − , участвующих в этой реакции:
Таблица 1.2
Теплоты образования компонентов реакции
|
Вещества |
0 |
кДж |
∑(∆H 0f ,298 ) |
|
|
∆H f , 298 |
моль |
|||
|
конечные |
H2Oж |
–285,83 |
–771,47 |
|
|
CH3COO− |
–485,64 |
|||
|
исходные |
СH3COOH |
–484,84 |
–714,86 |
|
|
OH − |
–230,02 |
|||
|
На реакцию |
–56,61 |
В этом случае теплота нейтрализации будет зависеть от аниона кислоты.
17
Химическая термодинамика
Определение тепловых эффектов с помощью теплот растворения Рассмотрим этот метод на примере расчета теплоты образования неорганической соли ZnCl 2. Составим цикл, включающий стадии образования и растворения хлорида водорода и
цинка:
|
2∆H f , HCl + ∆H1 |
+ ∆H2 = ∆H f , ZnCl |
+ ∆H3 |
||
|
2 |
||||
|
∆H f , ZnCl = 2∆H f , HCl + ∆H1 + ∆H2 |
−∆H3 |
|||
|
2 |
||||
|
Значком aq обозначается бесконечно большое количество во- |
||||
|
ды и, следовательно, ∆H1 и ∆H3 — изменения энтальпии при рас- |
||||
|
творении HClг. и ZnCl2,кр. соответственно в бесконечно большом ко- |
||||
|
личестве растворителя (т.е. при |
||||
|
образовании |
бесконечно |
разбав- |
||
|
ленного раствора). Эти величины |
||||
|
(так называемые первые теплоты |
||||
|
растворения) определяются экст- |
||||
|
раполяцией концентрационных за- |
||||
|
висимостей интегральных теплот |
||||
|
растворения к концентрации рас- |
||||
|
Рис. 1.5. Зависимость теплот |
твора, равной нулю. |
|||
|
Интегральной |
теплотой |
|||
|
растворения от концентрации |
растворения ( ∆Hm ) называется те- |
|||
|
пловой эффект при растворении одного моля вещества в таком ко- |
||||
|
личестве растворителя, чтобы получить раствор заданной концен- |
||||
|
трации. Чаще всего используют моляльные концентрации (m), т. е. |
||||
|
число молей растворенного вещества на 1 кг растворителя. Инте- |
||||
|
гральная теплота растворения зависит от природы растворяемого |
||||
|
вещества, растворителя и концентрации раствора (при T=const). |
||||
|
Первая теплота растворения (∆H0 ) (рис. 1.5) равна алгеб- |
||||
|
раической сумме теплот разрушения решетки и сольватации обра- |
||||
|
зующихся частиц. Так как при разрушении кристаллической решет- |
18

Химическая термодинамика
ки тепло поглощается, а при сольватации — выделяется, ∆H0 (и ∆Hm ) может быть как положительной, так и отрицательной величиной. Экстраполяция зависимости ∆Hm = f (m) к концентрации насыщенного раствора (ms) позволяет получить последнюю теплоту растворения (∆Hg ), равную теплоте растворения 1 моля вещества в та-
ком количестве растворителя, чтобы образовался насыщенный раствор.
Упражнение 1.1
1.1.1. Найти тепловой эффект реакции между оксидом углерода (CO) и оксидом серы (SO2) по теплотам образования веществ.
4COг. +2SO2 = S2 ,г. +4CO2 ,г. .
Для нахождения теплот образования веществ используем справочные величины в кДж/моль (1 кал = 4,184 Дж):
|
Таблица 1.3 |
|||||||||||
|
Теплоты образования веществ |
|||||||||||
|
Вещества |
o |
кДж |
∑(ν∆H of , 298 ) |
||||||||
|
∆H f , 298 моль |
|||||||||||
|
конечные |
S2 ,г. |
7,14 |
|||||||||
|
–82,78 |
|||||||||||
|
4CO2,г. |
4·(–22,48) |
||||||||||
|
исходные |
4COг. |
4·(–31,30) |
–159,20 |
||||||||
|
2SO2,г. |
2·(–17,00) |
||||||||||
|
На реакцию |
76,42 |
||||||||||
|
1.1.2. По теплоте сгорания газообразного пентана найти тепло- |
|||||||||||
|
ту его образования. |
|||||||||||
|
C H |
12,г. |
+8O =5CO +6H O |
; |
∆H 0 |
=? |
||||||
|
5 |
2 |
2 |
2 г. |
f ,C H |
12 |
||||||
|
5 |
19

Химическая термодинамика
|
Таблица 1.4 |
||||||||||||||||
|
Теплоты образования веществ |
||||||||||||||||
|
Вещества |
0 |
кДж |
∑(ν∆H 0f ,298 ) |
|||||||||||||
|
∆H f ,298 |
моль |
|||||||||||||||
|
Конечные |
5СO2 |
5·(–393,51) |
–3682,53 |
|||||||||||||
|
6H2Oж. |
6·(–285,83) |
|||||||||||||||
|
Исходные |
С5H12, г. |
∆Hf,Co |
H |
12 |
||||||||||||
|
5 |
||||||||||||||||
|
8O2 |
0 |
∆Hx0 = ∆H 0f ,C H |
12 |
|||||||||||||
|
5 |
||||||||||||||||
|
На реакцию ( ∆Hсг.,C H |
) |
–3536,15 |
||||||||||||||
|
5 |
12 |
|||||||||||||||
|
5∆Hсг.,CO +6∆H 0f ,H O −∆Hx |
= −368,53 −∆Hxo = −3536,15 |
кДж |
; |
|||||||||||||
|
моль K |
||||||||||||||||
|
2 |
2 |
|||||||||||||||
|
∆H of ,C H |
= −3536,15 |
+3682,53 = −146,44 |
кДж |
. |
||||||||||||
|
5 |
2 |
моль K |
||||||||||||||
Контрольные вопросы.
1. Составьте цикл и рассчитайте тепловой эффект реакции
2Al + Fe2O3 = 2Fe + Al2O3 .
2. Составьте цикл и рассчитайте тепловой эффект реакции
NH4OH + HCl = NH4Cl + H2O .
3. Что такое интегральная теплота растворения?
1.2.5. Теплоемкость: изохорная и изобарная, истинная и средняя. Связь между ними
Тепловые эффекты процессов зависят от температуры, при которой они проводятся, поэтому для их вычисления при произвольных температурах необходимо знать зависимость теплоемкостей реагирующих веществ от температуры. Теплоемкость вещества — это количество теплоты, необходимое для нагревания определенного количества вещества на один кельвин. Если теплоемкость отно-
сится к 1 молю вещества, она называется молярной и измеряется в
Дж/(моль·К), а если к 1 кг – удельной и измеряется в Дж/(кг·К).
Теплоемкостью системы называется отношение количества сообщенной ей теплоты к вызванному этим повышению температуры.
Различают истинную и среднюю теплоемкость.
20
Химическая термодинамика
Истинной теплоемкостью называют теплоемкость системы, соответствующую бесконечно малому изменению температуры:
C = lim C = δQ .
∆T →0 dT
Рис. 1.6. Взаимосвязь величин средней и истинной теплоемкостей
Поскольку dQv = dU , а dQp = dH , истинная теплоемкость при постоянном объеме:
|
∂U |
||||||||||||||
|
Cv |
= |
, |
(1.8) |
|||||||||||
|
∂T v |
||||||||||||||
|
а при постоянном давлении: |
||||||||||||||
|
∂ H |
||||||||||||||
|
Cp |
= |
. |
(1.9) |
|||||||||||
|
∂T p |
||||||||||||||
|
Средней теплоемкостью называют теплоемкость системы, со- |
||||||||||||||
|
ответствующую конечному изменению температуры: |
||||||||||||||
|
= |
Q |
. |
||||||||||||
|
C |
||||||||||||||
|
∆T |
||||||||||||||
|
Средняя теплоемкость при постоянном объеме: |
||||||||||||||
|
= |
∆U |
, |
(1.10) |
|||||||||||
|
C |
||||||||||||||
|
v |
∆T |
|||||||||||||
|
а при постоянном давлении: |
||||||||||||||
|
= |
∆H |
. |
(1.11) |
|||||||||||
|
C |
p |
|||||||||||||
|
∆T |
Для 1 моля идеального газа, для которого при p=const, согласно уравнениям (1.7) и (1.1), ∂H =∂U + p∂v и p∂v = R∂T ,
21
Химическая термодинамика
|
C |
p |
= |
∂ H |
= |
∂U + p∂v |
= |
∂U |
+ |
R∂T |
=C |
+ R . |
|
|
∂T |
∂T |
∂T |
∂T |
|||||||||
|
v |
На рис. 1.6 показана зависимость теплоемкости вещества от
Cp, Дж/(моль·K)
|
60 |
||||||
|
40 |
тв. |
ж. |
газ |
|||
|
20 |
||||||
|
0 |
100 |
200 |
300 |
400 |
500 T, K |
Рис. 1.7. Зависимость теплоемкости от температуры с учетом фазовых переходов хлора
температуры (кривая AB). Аналитически эту зависимость обычно представляют в виде интерполяционных уравнений типа:
|
Cp = a +bT +cT 2 + dT 3 |
(1.12) |
|||
|
или |
||||
|
Cp = a +bT + |
c′ |
, |
(1.13) |
|
|
T 2 |
||||
где a, b, c, d и c′ — эмпирические коэффициенты, пригодные только для того интервала температур, в котором они получены.
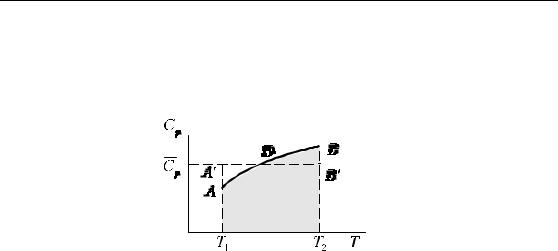
Теплота, полученная системой при нагревании ее от T1 до T2, равна площади заштрихованной фигуры T1ABT2 и, в соответствии с уравнением (1.9),
∆H = ∫TT12 dH =∫TT12 CpdT .
Для упрощения расчетов часто используют не истинную, а среднюю теплоемкостьCp , величина которой в данном интервале
температур ( ∆T =T2 −T1 ) считается постоянной и выбирается таким образом, чтобы площадь прямоугольника T1 A′B′T2 (равная теплоте,
22

Химическая термодинамика
полученной системой, ∆H =Cp∆T ) была равновеликой площади фигуры T1ABT2:
|
p (T2 −T1 )= ∫TT2 CpdT , |
||||||||||||||||||||||||||||||
|
C |
||||||||||||||||||||||||||||||
|
откуда |
1 |
|||||||||||||||||||||||||||||
|
1 |
||||||||||||||||||||||||||||||
|
p = |
T2 CpdT |
|||||||||||||||||||||||||||||
|
C |
||||||||||||||||||||||||||||||
|
T |
−T |
|||||||||||||||||||||||||||||
|
∫T1 |
||||||||||||||||||||||||||||||
|
2 |
1 |
|||||||||||||||||||||||||||||
|
или, в соответствии с уравнениями (1.12) и (1.13), |
||||||||||||||||||||||||||||||
|
1 |
T2 |
(a +bT +cT 2 + dT 3 ) |
dT = a + b (T +T )+ |
|||||||||||||||||||||||||||
|
C |
= |
|||||||||||||||||||||||||||||
|
p |
∫T |
|||||||||||||||||||||||||||||
|
T2 |
−T1 |
2 |
1 |
2 |
||||||||||||||||||||||||||
|
1 |
(1.14) |
|||||||||||||||||||||||||||||
|
+c |
(T 2 |
+T 2 )+ d |
(T |
+T ) |
(T 2 |
+T 2 ) |
||||||||||||||||||||||||
|
+TT |
||||||||||||||||||||||||||||||
|
3 |
1 |
1 |
2 |
2 |
4 |
1 |
2 |
1 |
2 |
|||||||||||||||||||||
|
или |
||||||||||||||||||||||||||||||
|
1 |
T2 a +bT + |
c′ |
dT = a + b (T |
+T )− |
c′ |
. (1.15) |
||||||||||||||||||||||||
|
C |
p |
= |
||||||||||||||||||||||||||||
|
T −T |
T |
2 |
2 |
1 |
2 |
TT |
||||||||||||||||||||||||
|
∫T1 |
||||||||||||||||||||||||||||||
|
2 |
1 |
1 |
2 |
Для определения количества теплоты, необходимого для нагревания вещества в широком интервале температур, следует учитывать различия в теплоемкостях твердого, жидкого и газообразного состояний этого вещества, а также принимать во внимание теплоты агрегатных превращений ( ∆Hпл. . и ∆Hисп. .). На рис. 1.7 показана зависимость теплоемкости хлора от температуры в диапазоне от 0 до 500 K. При температуре фазовых переходов Tпл. и Tкип. наблюдается скачкообразное изменение теплоемкости. Количество тепла, необходимое для нагревания 1 моля хлора от температуры 100 до 500 K, может быть рассчитано следующим образом:
|
∆H100→500 = ∫100Tпл. Cp0 |
,тв.dT + ∆Hпл0 |
. + ∫TTкип. Cp0 |
,ж.dT + ∆Hкип0 |
. + ∫T500 Cpo,г.dT . |
|
пл. |
кип. |
Контрольные вопросы.
1.Дайте определение средней и истинной теплоемкостей.
2.Определите истинную и среднюю теплоемкости 1 моля Fe2O3 при 1000 K.
3.Определите количество теплоты, необходимое для нагревания 1 моля воды от
200до 500 K.
23

Химическая термодинамика
1.2.6. Классическая теория теплоемкости идеальных газов
Теплоемкость при постоянном объеме идеального газа может быть разбита на три слагаемых, соответствующих поступательному (Cп.), вращательному (Cв.) и колебательному (Cк.) движениям.
|
Cv =Cп. +Cвр. +Cк. |
(1.16) |
Согласно молекулярно-кинетической теории, теплоемкость, приходящаяся на одну степень свободы поступательного или вращательного движения, одинакова и равна для одного моля газа
|
Cv′ |
∂U |
R |
Дж |
|||||
|
= |
T |
= |
≈ 4,153 |
(1.17) |
||||
|
2 |
моль K |
|||||||
|
∂T |
Под степенью свободы в молекулярно-кинетической теории понимается число независимых видов движения, на которые может быть разложено сложное движение молекулы.
Молекулы газа имеют три поступательные степени свободы в соответствии с тремя направлениями по трем осям координат, по которым может быть разложено поступательное движение молекулы. Поэтому часть молярной теплоемкости газа, связанная с поступательным движением молекул, равна 3R/2.
Нелинейные многоатомные молекулы имеют, кроме трех поступательных, еще три вращательные степени свободы. Вращательное движение молекулы также может быть разложено на три составляющих по трем осям координат. Поэтому часть молярной теплоемкости газа, связанная с вращательным движением, для такого типа молекул равна 3R/2.
Двухатомные и линейные трехатомные молекулы имеют лишь две вращательные степени свободы, так как момент инерции вращения молекулы вокруг оси, проходящей через центры атомов, незначителен и им можно пренебречь. Поэтому для газа, состоящего из линейных молекул, часть теплоемкости, обусловленная вращательным движением, равна 2R/2.
Общее число степеней свободы любой молекулы, состоящей из n атомов, равно 3n. Число колебательных степеней свободы определяется как разность между 3n и суммой числа поступательных и вращательных степеней свободы (табл. 1.5). Но при температурах, близких к 298 К, энергия колебательного движения значительно меньше, чем энергия поступательного и вращательного движений, и поэтому в классической теории теплоемкости газов не учитывается.
24
Соседние файлы в папке books
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Закон Гесса – основной закон термохимии, который формулируется следующим образом:
- Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе (при p,T = const или V,T = const), всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы. Иными словами, закон Гесса есть утверждение о том, что тепловой эффект реакции (Qp = ΔHp,T или QV=ΔUV,T) является функцией состояния. Тепловой эффект реакции (который определён только для изобарно-изотермического или для изохорно-изотермического процессов) нельзя путать с теплотой (Q), выделяемой или поглощаемой в ходе процесса или реакции. В общем случае теплота не является функцией состояния и не описывается законом Гесса.
На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
Закон открыт русским химиком Г. И. Гессом в 1841 году; он является частным случаем первого начала термодинамики применительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него.
Следствия из закона Гесса[править | править код]
- Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье – Лапласа).
- Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
- Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т. н. стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры
- Если начальное и конечное состояния химической реакции (реакций) совпадают, то их тепловой эффект равен нулю.
Примеры применения[править | править код]
Пример 1.
Вопрос:
- Найти энергию кристаллической решётки хлорида калия.
Дано:
- ΔHf, 298(KCl) = -435,56 kJ/mol
- ΔH298 атомизации(K (s)) = 128,74 kJ/mol
- ΔH298 ионизации(K (g)) = 418 kJ/mol
- ΔH298 диссоциации(Cl2 (g)) = 238,26 kJ/mol
Сродство хлора к электрону = -363,66 kJ/mol
По определению, каждая из указанных величин – точно так же, как изменения энтальпий реакций образования веществ (которые кратко на химическом профессиональном жаргоне называют “энтальпии веществ” или “энтальпии образования веществ”) и точно так же, как изменения энтальпий реакций сгорания веществ (на профессиональном жаргоне “энтальпии сгорания”) – точно так же и эти тепловые эффекты характеризуют каждый определённую реакцию. Для начала, выписываем эти реакции, закреплённые за названиями тепловых эффектов (для удобства реакции ниже будут пронумерованы):
ΔHf, 298(KCl) характеризует реакцию (№1) образования KCl из простых веществ, устойчивых при данных p, T:
- K (s) + 0,5Cl2 (g) → KCl (s)
ΔH298 атомизации(K (s)) характеризует реакцию (№2):
- K (s) → K (g)
ΔH298 ионизации(K (g)) характеризует реакцию (№3):
- K (g) → K+ + e-(g)
ΔH298 диссоциации(Cl2 (g)) характеризует реакцию (№4):
- Cl2 (g) → 2Cl (g)
Сродство хлора к электрону характеризует реакцию (№5):
- Cl (g) + e-(g) → Cl-(g)
Задача заключается в том, чтобы из этих уравнений реакций сложить заданное уравнение реакции – энергия кристаллической решётки KCl характеризует реакцию (№6):
- K+ + Cl-(g) → KCl (s)
Для этого возьмём реакции в такой комбинации: №6 = №1 + (-0,5)№4 + (-1)№5 + (-1)№2 + (-1)№3 = №1 – 0,5№4 – №5 – №2 – №3. При сложении уравнений реакций тепловые эффекты складываются (с теми же коэффициентами, на которые умножали реакции). То есть ΔH6 = ΔH1 – 0,5ΔH4 – ΔH5 – ΔH2 – ΔH3
- K (s) + 0,5Cl2 (g) → KCl (s)
- (K (s) → K (g))⋅(-1) = (K (g) → K (s))
- K+ + e-(g) →K (g)
- Cl-(g) → Cl (g) + e-(g)
- Cl (g) → 0,5Cl2 (g)
Сумма этих реакций:
- K (s) + Cl2 (g) + K (g) + K+ + e-(g) + Cl-(g) + Cl (g) → 0,5Cl2 (g) + Cl (g) + e-(g) + K (g) + K (s) + KCl (s)
После сокращения получаем:
- K+ + Cl-(g) → KCl (s)
Что и требовалось – значит, суммирование реакций произведено верно и полученный суммарный тепловой эффект характеризует именно искомую реакцию.
Пример 2.
Дано:
- B2O3 (s) + 3H2O (g) → 3O2 (g) + B2H6 (g) (ΔH = 2035 kJ/mol)
- H2O (l) → H2O (g) (ΔH = 44 kJ/mol)
- H2 (g) + (1/2)O2 (g) → H2O (l) (ΔH = -286 kJ/mol)
- 2B (s) + 3H2 (g) → B2H6 (g) (ΔH = 36 kJ/mol)
Найти ΔHf реакции:
- 2B (s) + (3/2) O2 (g) → B2O3 (s)
После умножения реакций на числа (в том числе на -1, то есть обращения реакций), а соответственно – и умножения на те же числа изменений энтальпии этих реакций, получаем:
- B2H6 (g) + 3O2 (g) → B2O3 (s) + 3H2O (g) (ΔH = -2035 kJ/mol)
- 3H2O (g) → 3H2O (l) (ΔH = -132 kJ/mol)
- 3H2O (l) → 3H2 (g) + (3/2) O2 (g) (ΔH = 858 kJ/mol)
- 2B (s) + 3H2 (g) → B2H6 (g) (ΔH = 36 kJ/mol)
После сложения этих уравнений реакций и приведения подобных членов получившегося уравнения, получаем:
- 2B (s) + (3/2) O2 (g) → B2O3 (s) (ΔH = -1273 kJ/mol)
Литература[править | править код]
- Карапетьянц М. Х. Введение в теорию химических процессов. – М.: Высшая школа, 1981. 304 с.
- Стромберг А. Г., Семченко Д. П. Физическая химия – М.: Высшая школа, 1999. 527 с.
- Даниэльс Ф., Олберти Р. Физическая химия – М.: Мир, 1978. 645 с.
- Пригожин И., Кондепуди Д. Современная термодинамика. От тепловых двигателей до диссипативных структур. – М.: Мир, 2002. 461 с.
- Борисов И. М. Основы электрохимии: учеб. пособие. -Уфа: Изд-во БГПУ, 2009.- 115 с.
Ссылки[править | править код]
- Открытый колледж. Химия – Закон Гесса
- Лекции по физхимии (ЮФУ) – Закон Гесса
Источник
Материалы портала onx.distant.ru
Тепловой эффект процесса
Термохимические уравнения
Закон Гесса
Следствия из закона Гесса
Стандартные термодинамические величины
Стандартные энтальпии образования и сгорания
Примеры решения задач
Задачи для самостоятельного решения
Количество выделенной (или поглощенной) теплоты Q в данном процессе называют тепловым эффектом процесса. Экзотермической является реакция, протекающая с выделением теплоты, а эндотермической – с поглощением теплоты из окружающей среды.
Для лабораторных и промышленных процессов наиболее типичен изобарный режим (Р=const). Поэтому обычно рассматривают тепловой эффект при Р,Т = const, т.е. изменение энтальпии процесса ΔН.
Следует отметить, что абсолютные значения энтальпии Н определить не представляется возможным, так как не известна абсолютная величина внутренней энергии.
Для экзотермической реакции (Q > 0) ΔН < 0, а в эндотермическом процессе (Q < 0) ΔН > 0.
Химические уравнения, в которых дополнительно указывается величина изменения энтальпии реакции, а также агрегатное состояние веществ и температура, называются термохимическими уравнениями.
В термохимических уравнениях отмечают фазовое состояние и аллотропные модификации реагентов и образующихся веществ: г – газообразное, ж – жидкое, к – кристаллическое; S(ромб), S(монокл), С(графит), С(алмаз) и т.д.
Важно подчеркнуть, что с термохимическими уравнениями можно проводить алгебраические операции сложения, вычитания, деления, умножения.
Изменение энтальпии (внутренней энергии) химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса.
- Изменение энтальпии реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов).
- Изменение энтальпии реакции равно сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции (суммирование проводится с учетом стехиометрических коэффициентов).
Стандартные термодинамические величины – это такие величины, которые относятся к процессам, все ингредиенты которых находятся в стандартных состояниях.
Стандартным состоянием вещества, находящегося в конденсированной фазе (кристаллической или жидкой), является реальное состояние вещества, находящегося при данной температуре и давлении 1 атм.
Следует подчеркнуть, что стандартное состояние может иметь место при любой температуре.
Обычно тепловой эффект (изменение энтальпии) реакции приводится для температуры 25оС (298,15 К) и давления 101,325 кПа (1 атм), т.е. указывается стандартная энтальпия ΔНо298.
Стандартная энтальпия образования ΔНоf,298 (или ΔНообр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Например, ΔНof,298(Н2О(ж)) = – 285,83 кДж/моль соответствует изменению энтальпии в процессе
Н2(г) + ½O2(г) = Н2О(ж)
при Т = 298,15 К и Р = 1 атм.
Стандартная энтальпия образования простых веществ равна нулю по определению (для наиболее устойчивых их модификаций при данной температуре).
Стандартной энтальпией сгорания ΔНoсгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии.
Задача 1. Используя справочные термодинамические данные вычислить ΔНo298 реакции:
2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(ж); ΔНoх.р.,298 = ?
Решение. Решим задачу, используя оба следствия из закона Гесса. Ниже для исходных веществ и продуктов реакции приведены значения энтальпий образования и сгорания в кДж/моль (энтальпия сгорания сероводорода до SO2(г) и H2O(ж)):
| Вещество | H2S(г) | O2(г) | SO2(г) | H2O(ж) |
| ΔНof,298 | -20,60 | -296,90 | -285,83 | |
| ΔНoсгор,298 | -562,10 |
Cогласно первому следствию закона Гесса энтальпия этой реакции ΔНох.р. равна:
ΔНох.р.,298 = 2ΔНоf,298(SO2(г)) + 2ΔНоf,298(H2O(ж)) – 2ΔНоf,298(H2S(г)) – 3ΔНоf,298(O2(г)) = 2(- 296,90) + 2(- 285,83) – 2(- 20,60) = – 1124,21 кДж.
В соответствии со вторым следствием закона Гесса получаем:
ΔНох.р.,298 = 2ΔНосгор,298(H2S(г)) = 2(-562,10) = – 1124,20 кДж.
Задача 2. Вычислите ΔНо298 реакции N2(г) + 3H2(г) = 2NH3(г), используя следующие данные:
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж); ΔНо1 = -1531,22 кДж;
2H2O(ж) = O2(г) + 2H2(г); ΔНо2= 571,66 кДж.
Определите стандартную энтальпию образования NH3(г).
Решение. Поскольку с термохимическими уравнениями можно производить все алгебраические действия, то искомое уравнение получится, если:
- разделить на два тепловой эффект первого уравнения и изменить его знак на противоположный, т.е:
N2(г) + 3H2O(ж) = 2NH3(г) + 3/2O2(г); ΔНо = 765,61 кДж;
- умножить на 3/2 второе уравнение и соответствующую ему величину δНo , изменив ее знак на противоположный:
3/2O2(г) + 3H2(г) = 3H2O(ж); ΔНо = -857,49 кДж;
- сложить полученные первое и второе уравнения.
Таким образом, тепловой эффект реакции N2(г) + 3H2(г) = 2NH3(г) равен:
Δ Но298 = (- ΔНо1/2) + (- 3/2·ΔНо2) = 765,61 + (- 857,49) = – 91,88 кДж.
Поскольку в рассматриваемой реакции образуется 2 моль NH3(г), то
ΔНоf,298(NH3(г)) = – 91,88/2 = – 45,94 кДж/моль.
Задача 3. Определите энтальпию процесса
CuSO4(к) + 5H2O(ж) = CuSO4·5H2O(к)
если при 298,15 К энтальпия растворения CuSO4(к) в n моль Н2О с образованием раствора CuSO4(р-р, nH2O) равна -40, а энтальпия растворения CuSO4·5H2O(к) с образованием раствора той же концентрации равна +10,5 кДж/моль.
Решение. Составляем цикл Гесса:
ΔНо1 = ΔНо2 + ΔНох (по закону Гесса). Отсюда получаем:
ΔНох = ΔНо1 – ΔНо2 = – 40,0 – 10,5 = -50,5 кДж.
Другой вариант решения.
CuSO4(к) + (n H2O) = CuSO4(р-р, n H2O); ΔНо1 = – 40,0 кДж; (1)
CuSO4(к) + 5H2O(ж) = CuSO4·5H2O(к); ΔНох = Но2; (2)
CuSO4·5H2O(к) + (n – 5)H2O = CuSO4(р-р, nH2O); ΔНо3 = 10,5 кДж. (3)
По закону Гесса: ΔНо1 = ΔНох+ ΔНо3, т.е. при сложении уравнений (2) и (3) получим уравнение (1).
Задача 4. Вычислите энтальпию образования химической связи С= С в молекуле этилена, если его стандартная энтальпия образования равна 52,3 кДж/моль, энтальпия возгонки графита составляет 716,7 кДж/моль, энтальпия атомизации водорода равна +436,0 кДж/моль, энтальпия образования связи С-Н равна -414,0 кДж/моль.
Решение. Составляем цикл Гесса:
ΔНоf,298(С2Н4(г)) = 2ΔНовозг(С(графит)) + 2ΔНоатом (H2(г)) + ΔНо(С= С) + 4ΔНо(С-Н).
ΔНо(С = С) = 52,3 – 2·716,7 – 2·436,0 + 4·414,0 = – 597,1 кДж/моль.
1. Составьте уравнение реакции, для которой ΔНо соответствует стандартной энтальпии образования ВaCl2·2H2O(к).
2. Определить ΔНо298 реакции:
CH3CНO(ж) + H2(г) = CH3CH2OH(ж),
если ΔНосгор,298(CH3CНO(ж)) = – 1193,07 кДж/моль; ΔНосгор,298(CH3CH2OH(ж)) = – 1370,68 кДж/моль; ΔНоf,298(Н2О(ж)) = – 285,83 кДж/моль.
10.3. Энтальпии растворения BaCl2(к) и BaCl2·2H2O(к) с образованием раствора хлорида бария (с мольным отношением BaCl2: H2O = 1: 500) соответственно равны -11,18 и 18,74 кДж/моль.
Определить величину ΔНо присоединения воды к BaCl2(к) с образованием BaCl2·2H2O(к).
10.4. Рассчитать энтальпию связи в молекуле NO на основании следующих термохимических уравнений:
N2(г) + O2(г) = 2NO(г); ΔНо298 = +182,52 кДж;
2O(г) = O2(г); ΔНо298 = – 498,34 кДж;
N2(г) = 2N(г); ΔНо298 = +945,42 кДж.
10.5. Вычислить ΔНо298 реакции 2C(г) + 2H2(г) = C2H4(г), используя следующие термохимические уравнения:
С(графит) = С(г) ; ΔНо298 = +716,67 кДж;
С2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(г); ΔНо298 = – 1322,94 кДж;
C(графит) + O2(г) = CO2(г); ΔНо298 = – 393,51 кДж;
H2(г) + 1/2O2(г) = H2O(г); ΔНо298 = – 241,81 кДж.
10.6. Определите стандартную энтальпию реакции взаимодействия метана с оксидом углерода (IV), если стандартные энтальпии образования метана, оксида углерода (IV) и оксида углерода (II) при 298 К равны соответственно: -75; -393 и -111 кДж/моль.
7. Определите стандартную энтальпию образования С2Н5ОН(ж), если стандартные энтальпии сгорания углерода, водорода и этанола при 298 К равны соответственно: -393; -286 и -1366 кДж/моль.
8. Вычислите энтальпию химической реакции 4KClO3(к)=KCl(к)+3KClO4(к) по следующим данным:
2KClO3(к)=2KCl(к)+3O2(г); ΔНо298 = – 95 кДж;
4KClO4(к)=KCl(к)+2O2(г); ΔНо298 = 9 кДж/моль.
9. Вычислите среднюю энтальпию связи P-Cl в молекуле PCl5, используя следующие термохимические уравнения:
P(к, бел.)+5/2Cl2(г)=PCl5(г); ΔНо1 = – 374,8 кДж;
P(к, бел.)=P(г); ΔНо2 = – 17,4 кДж;
Cl2(г)=2Cl(г); ΔНо3 = 242,6 кДж.
10. Вычислите среднюю энтальпию связи N-H в молекуле NH3, используя следующие термохимические уравнения:
1/2N2(г)+3/2H2(г)=NH3(г); ΔНо1 = – 46,2 кДж;
N2(г)=2N(г); ΔНо2 = 945,4 кДж;
H2(г)=2H(г); ΔНо3 = 436,0 кДж.
Источник
Закон Гесса – основной закон термохимии, который формулируется следующим образом:
- Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе (при p,T = const или V,T = const), всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы. Иными словами, закон Гесса есть утверждение о том, что тепловой эффект реакции (Qp = ΔHp,T или QV=ΔUV,T) является функцией состояния. Тепловой эффект реакции (который определён только для изобарно-изотермического или для изохорно-изотермического процессов) нельзя путать с теплотой (Q), выделяемой или поглощаемой в ходе процесса или реакции. В общем случае теплота не является функцией состояния и не описывается законом Гесса.
На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
Закон открыт русским химиком Г. И. Гессом в 1841 году; он является частным случаем первого начала термодинамики применительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него.
Следствия из закона Гесса
- Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье – Лапласа).
- Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
- Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т. н. стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры
- Если начальное и конечное состояния химической реакции (реакций) совпадают, то их тепловой эффект равен нулю.
Примеры применения
Пример 1.
Вопрос:
- Найти энергию кристаллической решётки хлорида калия.
Дано:
- ΔHf, 298(KCl) = -435,56 kJ/mol
- ΔH298 атомизации(K (s)) = 128,74 kJ/mol
- ΔH298 ионизации(K (g)) = 418 kJ/mol
- ΔH298 диссоциации(Cl2 (g)) = 238,26 kJ/mol
Сродство хлора к электрону = -363,66 kJ/mol
По определению, каждая из указанных величин – точно так же, как изменения энтальпий реакций образования веществ (которые кратко на химическом профессиональном жаргоне называют “энтальпии веществ” или “энтальпии образования веществ”) и точно так же, как изменения энтальпий реакций сгорания веществ (на профессиональном жаргоне “энтальпии сгорания”) – точно так же и эти тепловые эффекты характеризуют каждый определённую реакцию. Для начала, выписываем эти реакции, закреплённые за названиями тепловых эффектов (для удобства реакции ниже будут пронумерованы):
ΔHf, 298(KCl) характеризует реакцию (№1) образования KCl из простых веществ, устойчивых при данных p, T:
- K (s) + 0,5Cl2 (g) → KCl (s)
ΔH298 атомизации(K (s)) характеризует реакцию (№2):
- K (s) → K (g)
ΔH298 ионизации(K (g)) характеризует реакцию (№3):
- K (g) → K+ + e-(g)
ΔH298 диссоциации(Cl2 (g)) характеризует реакцию (№4):
- Cl2 (g) → 2Cl (g)
Сродство хлора к электрону характеризует реакцию (№5):
- Cl (g) + e-(g) → Cl-(g)
Задача заключается в том, чтобы из этих уравнений реакций сложить заданное уравнение реакции – энергия кристаллической решётки KCl характеризует реакцию (№6):
- K+ + Cl-(g) → KCl (s)
Для этого возьмём реакции в такой комбинации: №6 = №1 + (-0,5)№4 + (-1)№5 + (-1)№2 + (-1)№3 = №1 – 0,5№4 – №5 – №2 – №3. При сложении уравнений реакций тепловые эффекты складываются (с теми же коэффициентами, на которые умножали реакции). То есть ΔH6 = ΔH1 – 0,5ΔH4 – ΔH5 – ΔH2 – ΔH3
- K (s) + 0,5Cl2 (g) → KCl (s)
- (K (s) → K (g))⋅(-1) = (K (g) → K (s))
- K+ + e-(g) →K (g)
- Cl-(g) → Cl (g) + e-(g)
- Cl (g) → 0,5Cl2 (g)
Сумма этих реакций:
- K (s) + Cl2 (g) + K (g) + K+ + e-(g) + Cl-(g) + Cl (g) → 0,5Cl2 (g) + Cl (g) + e-(g) + K (g) + K (s) + KCl (s)
После сокращения получаем:
- K+ + Cl-(g) → KCl (s)
Что и требовалось – значит, суммирование реакций произведено верно и полученный суммарный тепловой эффект характеризует именно искомую реакцию.
Пример 2.
Дано:
- B2O3 (s) + 3H2O (g) → 3O2 (g) + B2H6 (g) (ΔH = 2035 kJ/mol)
- H2O (l) → H2O (g) (ΔH = 44 kJ/mol)
- H2 (g) + (1/2)O2 (g) → H2O (l) (ΔH = -286 kJ/mol)
- 2B (s) + 3H2 (g) → B2H6 (g) (ΔH = 36 kJ/mol)
Найти ΔHf реакции:
- 2B (s) + (3/2) O2 (g) → B2O3 (s)
После умножения реакций на числа (в том числе на -1, то есть обращения реакций), а соответственно – и умножения на те же числа изменений энтальпии этих реакций, получаем:
- B2H6 (g) + 3O2 (g) → B2O3 (s) + 3H2O (g) (ΔH = -2035 kJ/mol)
- 3H2O (g) → 3H2O (l) (ΔH = -132 kJ/mol)
- 3H2O (l) → 3H2 (g) + (3/2) O2 (g) (ΔH = 858 kJ/mol)
- 2B (s) + 3H2 (g) → B2H6 (g) (ΔH = 36 kJ/mol)
После сложения этих уравнений реакций и приведения подобных членов получившегося уравнения, получаем:
- 2B (s) + (3/2) O2 (g) → B2O3 (s) (ΔH = -1273 kJ/mol)
Литература
- Карапетьянц М. Х. Введение в теорию химических процессов. – М.: Высшая школа, 1981. 304 с.
- Стромберг А. Г., Семченко Д. П. Физическая химия – М.: Высшая школа, 1999. 527 с.
- Даниэльс Ф., Олберти Р. Физическая химия – М.: Мир, 1978. 645 с.
- Пригожин И., Кондепуди Д. Современная термодинамика. От тепловых двигателей до диссипативных структур. – М.: Мир, 2002. 461 с.
- Борисов И. М. Основы электрохимии: учеб. пособие. -Уфа: Изд-во БГПУ, 2009.- 115 с.
Ссылки
- Открытый колледж. Химия - Закон Гесса
- Лекции по физхимии (ЮФУ) - Закон Гесса
Эта страница в последний раз была отредактирована 8 июля 2021 в 12:35.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
Источник