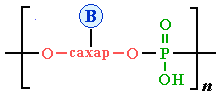Сложные эфиры: способы получения, химические и физические свойства, строение.
Сложные эфиры – это органические вещества, в молекулах которых углеводородные радикалы соединены через карбоксильную группу -СОО-, а именно R1-COOH-R2.
Общая формула предельных сложных эфиров: СnH2nO2
Классификация сложных эфиров
По числу карбоксильных групп:
- сложные эфиры одноосновных карбоновых кислот — содержат одну карбоксильную группу -СОО-. Общая формула CnH2nO2.
H-COO-CH3
- сложные эфиры многоатомных спиртов — содержат две и более карбоксильные группы -СОО-.
Например, тристеарат глицерина
- Сложные эфиры многоосновных органических кислот.
Например, общая формула сложных эфиров двухосновных карбоновых кислот CnH2n-2O4
Номенклатура сложных эфиров
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты (-овая кислота) на суффикс -оат.
| Название сложного эфира | Тривиальное название | Формула эфира |
| Метилметаноат | Метилформиат | HCOOCH3 |
| Этилметаноат | Этилформиат | HCOOC2H5 |
| Метилэтаноат | Метилацетат | CH3COOCH3 |
| Этилэтаноат | Этилацетат | CH3COOC2H5 |
| Пропилэтаноат | Пропилацетат | CH3COOCH2CH2CH3 |
Химические свойства сложных эфиров
.1. Гидролиз
Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей.
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
Например, при гидролизе метилацетата образуются уксусная кислота и метанол.
При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
Например, при щелочном гидролизе этилформиата образуются этанол и формиат натрия:
При щелочном гидролизе этилацетата образуются ацетат и этанол:
Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла. Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
2. Переэтерификация
Переэтерификация — это реакция превращения одного сложного эфира в другой под действием соответствующих спиртов в присутствии катализатора (кислоты или основания)
R-COO-CH3 + R’-OH = R-COOR’ + CH3-OH
3.Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи С-О карбоксильной группы. При этом образуется смесь спиртов.
Например, этилбензоат восстанавливается литийалюминийгидридом до бензилового спирта и этанола
C6H5-COO-C2H5 + [H] = C6H5-CH2OH + C2H5-OH
Получение сложных эфиров
1. Этерификация карбоновых кислот спиртами
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):
2. Соли карбоновых кислот с галогеналканами
При взаимодействии солей карбоновых кислот с галогеналканами образуются сложные эфиры.
Например, при взаимодействии ацетата натрия с хлорметаном образуется метилацетат.
CH3-COONa + CH3-Cl = CH3-COOCH3 + NaCl
Например, при взаимодействии формиата натрия с хлорэтаном образуется этилформиат.
H-COONa + C2H5-Cl = H-COOC2H5 + NaCl
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
…
Сложные эфиры карбоновых кислот: Получение
Сложные эфиры карбоновых кислот можно получить следующими способами:
- Этерификация карбоновых кислот:
- Этерификация амидов и нитрилов карбоновых кислот:
- Алкилирование солей карбоновых кислот:
- Ацилирование спиртов и алкоголятов галогенангидридами и ангидридами карбоновых кислот:
- Получение эфиров по Байеру-Виллигеру:
Сложные эфиры карбоновых кислот: Физические свойства
Сложные эфиры, образованные низшими карбоновыми кислотами и спиртами являются летучими жидкостями. Многие из них имеют приятный запах цветов или фруктов.
В воде они практически нерастворимы. По сравнению с изомерными карбоновыми кислотами сложные эфиры имеют более низкие температуры кипения, т.к. их молекулы не связаны межмолекулярными водородными связями.
Сложные эфиры, образованные высшими жирными кислотами и спиртами имеют воскоподобную структуру. Это вещества не имеют запаха, нерастворимы в воде, но хорошо растворимы в органических растворителях.
Сложные эфиры карбоновых кислот: Химические свойства
- Гидролиз (омыление) сложных эфиров. Кислотный гидролиз протекает обратимо, в то время как щелочной гидролиз необратим:
- Переэтерификация сложных эфиров
- Взаимодействие с аммиаком:
- Восстановление сложных эфиров. Гидрирование сложных эфиров приводит к образованию спиртов:
- Горение сложных эфиров происходит с образованием углекислого газа и воды:
- Присоединение галогенов может происходить при наличии в молекуле сложного эфира двойной связи. См. Химические свойства алкенов.
ПОЛУЧЕНИЕ СЛОЖНЫХ ЭФИРОВ И ПРИГОТОВЛЕНИЕ ДУХОВ В ЛАБОРАТОРНЫХ УСЛОВИЯХ
- Авторы
- Руководители
- Файлы работы
- Наградные документы
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
Введение
Сложные эфиры — это органические соединения на основе кислородосодержащих органических карбоновых или неорганических кислот.
Сложные эфиры широко распространены в природе и играют большую роль в жизни человека. Мы сталкиваемся с ними, когда нюхаем цветок, обязанный ароматом простейшим сложным эфирам. Мы моемся, моем и стираем средствами, которые получают с помощью переработки жиров, то есть сложных эфиров. Они используются в самых разных областях производства: с их помощью делают лекарства, краски и лаки, смазки, полимеры, синтетические волокна, используют в ароматерапии и получении духов.
Актуальность: Эта тема актуальна, так как сложные эфиры применяются в пищевой и парфюмерно-косметической промышленности, входят в состав эфирных масел, которые составляют основу любого запаха, используются в ароматерапии и производстве духов.
Проблема: Тема «Сложные эфиры» не изучается подробно в школьном курсе органической химии, и не всегда возможно в условиях школьной лаборатории получить сложные эфиры с разными запахами из-за недостатка оборудования и химических реагентов.
Мне стало интересно, могу ли я получить сложные эфиры в школьной лаборатории и самостоятельно создать свои запахи. Эта идея и легла в основу данной работы.
Цель: получить сложные эфиры в школьной лаборатории и создать парфюмерные композиции.
Задачи:
1. Изучить литературу по данной теме;
2. Получить сложные эфиры: этиловый эфир уксусной кислоты, изоамиловый эфир уксусной кислоты и этиловый эфир масляной кислоты;
3. Создать парфюмерные композиции на основе эфирных масел.
Гипотеза: В лабораторных условиях возможно самостоятельно получить сложные эфиры и собственные ароматы.
Методы исследования:
1) Изучение литературы;
2) Наблюдение;
3) Эксперимент.
1. Теоретическая часть
1.1.1. Сложные эфиры. Классификация и состав
Сложные эфиры — класс органических соединений, производные карбоновых или минеральных кислот, в которых гидроксильная группа -OH кислотной функции заменена на спиртовой остаток. Отличаются от простых эфиров, в которых два углеводородных радикала соединены атомом кислорода (R1-O-R2).
Классификация и состав сложных эфиров.Среди изученных и широко применяемых сложных эфиров большинство представляют соединения, полученные на основе карбоновых кислот. Сложные эфиры на основе минеральных (неорганических) кислот не столь разнообразны, т.к. класс минеральных кислот менее многочисленен, чем карбоновых.
Когда число атомов углерода в исходных карбоновой кислоте и спирте не превышает 6–8, соответствующие сложные эфиры представляют собой бесцветные маслянистые жидкости, чаще всего с фруктовым запахом. Они составляют группу фруктовых эфиров. Если в образовании сложного эфира участвует ароматический спирт (содержащий ароматическое ядро), то такие соединения обладают, как правило, не фруктовым, а цветочным запахом. Все соединения этой группы практически нерастворимы в воде, но легко растворимы в большинстве органических растворителей. Интересны эти соединения широким спектром приятных ароматов, некоторые из них вначале были выделены из растений, а позже синтезированы искусственно.
|
Аромат. Структурная формула. |
Название сложного эфира |
|
Яблоко |
Этиловый эфир 2-метилбутановой кислоты |
|
Вишня |
Амиловый эфир муравьиной кислоты |
|
Груша |
Изоамиловый эфир уксусной кислоты |
|
Ананас |
Этиловый эфир масляной кислоты (этилбутират) |
|
Банан |
Изобутиловый эфир уксусной кислоты (у изоамилацетата так же напоминает запах банана) |
|
Жасмин |
Бензиловый эфир уксусной (бензилацетат) |
При увеличении размеров органических групп, входящих в состав сложных эфиров, до С15–30 соединения приобретают консистенцию пластичных, легко размягчающихся веществ. Эту группу называют восками, они, как правило, не обладают запахом. Пчелиный воск содержит смесь различных сложных эфиров. Один из компонентов воска, который удалось выделить и определить его состав, представляет собой мирициловый эфир пальмитиновой кислоты С15Н31СООС31Н63. Китайский воск (продукт выделения кошенили – насекомых Восточной Азии) содержит цериловый эфир церотиновой кислоты С25Н51СООС26Н53. Кроме того, воски содержат и свободные карбоновые кислоты и спирты, включающие большие органические группы. Воски не смачиваются водой, растворимы в бензине, хлороформе, бензоле.
Третья группа – жиры. В отличие от предыдущих двух групп на основе одноатомных спиртов ROH, все жиры представляют собой сложные эфиры, спирта глицерина НОСН2–СН(ОН)–СН2ОН. Карбоновые кислоты, входящие в состав жиров, как правило, имеют углеводородную цепь с 9–19 атомами углерода. Животные жиры (коровье масло, баранье, свиное сало) – пластичные легкоплавкие вещества. Они, в основном, состоят из смеси глицеридов стеариновой и пальмитиновой кислоты. Растительные жиры (оливковое, хлопковое, подсолнечное масло) – вязкие жидкости. Растительные масла содержат глицериды кислот с несколько меньшей длиной углеродной цепи: лауриновой С11Н23СООН и миристиновой С13Н27СООН. Такие масла могут долго храниться на воздухе, не меняя своей консистенции, и потому называются невысыхающими. В отличие от них, льняное масло содержит глицерид ненасыщенной линолевой кислоты. При нанесении тонким слоем на поверхность такое масло под действием кислорода воздуха высыхает в ходе полимеризации по двойным связям, при этом образуется эластичная пленка, не растворимая в воде и органических растворителях. На основе льняного масла изготавливают натуральную олифу.
(Глицериды стеариновой и пальмитиновой кислоты (А и Б)– компоненты животного жира. Глицерид линолевой кислоты (В) – компонент льняного масла)
Сложные эфиры минеральных кислот (алкилсульфаты, алкилбораты, содержащие фрагменты низших спиртов С1–8) – маслянистые жидкости, эфиры высших спиртов (начиная с С9) – твердые соединения.
1.1.2. Получение и применение сложных эфиров
-
Основной способ получения – взаимодействие карбоновой кислоты и спирта (реакция этерификации), катализируемое кислотой и сопровождаемое выделением воды.
Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
RCOOR’ + H2O (H+) ↔ RCOOH + R’OH
Применение
Сложные эфиры широко распространены в природе. Они находят применение в технике и различных отраслях промышленности как хорошие растворители органических веществ, пластификаторы, ароматизаторы.
-
Этилформиат и этилацетат используются как растворители целлюлозных лаков (на основе нитроцеллюлозы и ацетилцеллюлозы).
-
Сложные эфиры на основе низших спиртов и кислот используют в пищевой промышленности при создании фруктовых эссенций, а сложные эфиры на основе ароматических спиртов – в парфюмерной промышленности.
-
Из восков изготавливают политуры, смазки, пропиточные составы для бумаги (вощеная бумага) и кожи, они входят и в состав косметических кремов и лекарственных мазей.
-
Жиры вместе с углеводами входят в состав всех растительных и животных клеток, накапливаясь в организме, играют роль энергетического запаса.
-
Животные и растительные жиры представляют собой сырье для получения высших карбоновых кислот, моющих средств и глицерина, используемого в косметической промышленности и как компонент различных смазок.
-
Эфиры серной кислоты используют в органическом синтезе как алкилирующие (вводящие в соединение алкильную группу) реагенты, а эфиры фосфорной кислоты – как инсектициды, а также добавки к смазочным маслам.
-
Являются основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время вытесненный более эффективными средствами.
1.2.1. Из чего сделаны духи
Слово «парфюмерия» происходит от латинского «perfumum» — через дым (в древности помещения окуривали дымом благовоний). История парфюмерии уходит вглубь веков. Первым изготовителем духов (а по совместительству и первым в мире химиком) считается женщина по имени Тапутти, ее имя упоминается на глиняной клинописной табличке из Древнего Вавилона. Вместе со своей помощницей Нину она получала ароматические масла из цветов и других частей растений и смешивала их.
Древние люди приписывали ароматам божественную и магическую силу. Египтяне изготавливали благовонные мази и ароматные масла, которыми сопровождали различные обряды и дополняли женские туалеты. Греки, прославившиеся, как любознательные путешественники, привозили из своих странствий новые и экзотические ароматы. В древнем Риме запахам приписывалась целебная сила.
Современная парфюмерия использует огромный ассортимент душистых веществ, как из древнего, так и современного арсенала. В композицию одного парфюма может входить более трехсот различных компонентов. В распоряжении парфюмера сотни натуральных продуктов: веществ растительного и животного происхождения и тысячи химических, полученных путем синтеза (число последних постоянно увеличивается).
Основой современной парфюмерии являются многочисленные душистые вещества растительного происхождения. Извлеченные из растений сильно пахучие концентрированные вещества носят общее название эфирных масел. Их извлекают из свежих или высушенных эфиромасличных растений.Наибольшее применение нашли следующие способы получения эфирных масел:
-
Механический способ — выжимание масел прессованием кожуры и цедры цитрусовых плодов и фруктов (апельсиновое, мандариновое, лимонное масла).
-
Дистилляция — отгонка эфирных масел с водяным паром (например розовое, гераниевое, мятное или кориандровое масла).
-
Извлечение эфирных масел летучими и нелетучими растворителями (в частности масел розы, жасмина, иланг-иланга и т. д.).
Способ получения эфирных масел летучими растворителями называется экстракцией. После отгонки растворителя из экстрактового масла получают смесь эфирного масла, восков, смол и жиров. Из нее обработкой спиртом и дальнейшей отгонкой спирта получают абсолютное масло.
Получение масел с помощью нелетучих растворителей называется мацерацией (настаиванием). Этот способ применяется для извлечения масел из цветов растений, содержащих незначительное количество масел (фиалка, жасмин, ландыш, резеда и др.).
-
Извлечение эфирных масел методом анфлеража и динамической сорбции. Этот способ основан на способности эфирных масел, выделяемых растениями, переходить в газовое состояние, а затем абсорбироваться жирами или твердыми сорбентами (селикагелем или активированным углем) с последующей экстракцией сорбентов серным эфиром.
Кроме указанных видов растительного сырья применяются также душистые ве- щества, называемые смолами и бальзамами. Это сложные смеси органических соединений, содержащиеся во многих растениях. Они используются в парфю- мери в виде настоев и растворов и являются своего рода фиксаторами запаха, способствующим увеличению продолжительности сохранения запаха духов. К ним относятся бензойная смола, стиракс, бальзам, а также смолы, выделяемые из цветов розы, ладанника и других смолистых веществ.Сырье животного происхождения — это мускус, амбра и бобровая струя. В противоположность большинству растительных веществ, они источают запахи, которые нельзя квалифицировать как «приятные» ароматы. Достаточно раз ощущтить мускус, и отшатнуться, зажимая ноздри до удушья, чтобы понять, что животные компоненты духов, если они и необходимы, должны быть дозированными. СИНТЕТИЧЕСКИЕ АРОМАТИЧЕСКИЕ ВЕЩЕСТВА — это большая груп- па органических соединений, получаемых химическими или физико-химичес- кими методами из продуктов растительного происхождения или синтезируемых из разнообразного химического сырья. Индивидуальные ароматические вещес- тва, полученные путем химического синтеза, обычно называются синтетически- ми душистыми веществами. Они отдельными нотами вплетаются в ткань ком- позиции душистых веществ и усиливают ее стойкость.
Теплота и цвет природного сырья, стойкость и оригинальность сырья химического — самый желанный союз, для того чтобы парфюмерия развивалась в верном направлении.
1.2.2. Классификация ароматов и структура композиции
Сегодня есть несколько моделей классификации ароматов: каждый парфюмер пытается усовершенствовать старые модели или изобрести что-то своё. Некоторые категории в каждой из существующих классификаций совпадают, а что-то существенно разнится. Одной из самых популярных является классификация ароматов французского сообщества парфюмеров.
КЛАССИФИКАЦИЯ АРОМАТОВ ФРАНЦУЗСКОГО СООБЩЕСТВА ПАРФЮМЕРОВ
В 1990 году во Франции собирался целый Парфюмерный комитет (Comite Francais De Parfum). Итогом их собрания стала классификация, которая получила большую популярность и используется сейчас многими парфюмерными домами и знатоками запахов.
Французы распределили группы ароматов следующим образом.
Цитрусовые: основу составляют эфирные масла, извлечённые из цитрусовых — лимона, апельсина, мандарина, бергамота, помело, грейпфрута, танжерина, юзу и цитрона).
Цветочные: ароматы цветов — жасмин, нарцисс, сирень, роза, ландыш, фиалка, тубероза.
Древесные: ароматы тёплых оттенков — пачули, кедр, сандал, ветивер.
Восточные: амбре, а также ароматы с ладаника-лабданума, пудровыми, ванильными и животными акцентами.
Кожа: ароматов этой семьи мало, они отличаются сухостью и своеобразными кожными запахами с примесью цветочных.
Шипры: духи, созданные в 1917 году Франсуа Коти, объединяют под своим началом целое семейство; здесь можно уловить ноты дубового мха, бергамота, пачули.
Фужерные: ноты дубового и древесного мха, лаванды, бергамота, кумарина.
Принцип разделения ароматов на семьи понятен: их объединяют тождественные нотки, которые смешаны в разных пропорциях
Структура парфюмерной композиции
Каждая композиция состоит из трех постепенно раскрывающихся нот аромата. Начальную ноту парфюмеры называют головной. Средняя нота называется нотой сердца или центральной нотой. Конечная нота – это базовая или основная нота, еще ее именуют фондом. Все три ноты раскрываются в различное время, этот процесс называется периодом жизни парфюмерной ноты.
Начальные ноты аромата
Первоначальный запах духов держится недолго, не дольше 20 минут — верхние ноты аромата испаряются первыми. Их задача – создать настроение, поэтому они звучат легко и наполнены оттенками свежести и зелени. Именно вершину мы слышим первой, ее ноты нас интригуют, подготавливают к основному запаху.
Сердечные ноты
Яркие и легкие начальные ноты постепенно переходят в сердечные. Именно сердце запаха определяет характер аромата и его узнаваемость. При создании парфюмерной композиции, вначале сочиняется сердечная нота сердца, на которую потом нанизываются остальные компоненты.
Сердце аромата может быть любым – фруктовым, цветочным, амбровым, ориентальным, древесным, мускусным и т.д. Порой используются синтетические материалы, которые создают запахи, не существующие в природе.
Шлейфовые ноты
Сердечные аккорды со временем угасают и переходят в теплое и бархатистое звучание шлейфовых оттенков. Они ощущаются дольше всего, от них зависит сила и стойкость аромата, его тембр и насыщенность.
Шлейф уже не изменится, он исчезнет вместе с ароматом. Базовая нота содержит вещества, которые долго остаются на коже и имеют самый низкий уровень испарения. Шерстяная одежда, на которую попали духи, может сохранять запах духов месяцами. Очень хорошо конечные нотки аромата держатся на волосах, поэтому надо с осторожностью наносить на голову «тяжелые» пряные запахи.
Как правило, в качестве материалов для шлейфа используют приторные или маслянисто-сладкие запахи – сандал, восточные пряности, ваниль, пачули, кедр. Часто используются мускус и амбра, которые помогают аромату духов органично сливаться с запахом кожи человека. Шлейф духов «округляет» звучание парфюмерной композиции и придает ей чувственность.
2. Практическая часть
2.1. Получение сложных эфиров
1. Получение уксусноэтилового эфира (этилацетата).
Оборудование: прибор для получения галоидоалканов, штатив, спиртовка, мерный цилиндр, мерная пробирка.
Проведем реакцию этерификации в приборе для получения галоидоалканов и сложных эфиров. В реакционную колбу поместим этиловый спирт, уксусную кислоту в отношении 1:1 и концентрированную серную кислоту. Серная кислота используется как водоотнимающее средство. Так как реакция этерификации обратима, необходимо удалять воду. В холодильник нальем насыщенный раствор поваренной соли. В этом растворе растворимость эфира минимальна. При нагревании смеси образуется летучий уксусноэтиловый эфир. Он конденсируется в холодильнике. Он легче воды и раствора соли, поэтому образует верхний слой жидкости.
СН3СООН + С2Н5ОН = H2О + CH3COOС2Н5
1 — двугорлая колба-реактор
2 — воздушный холодильник
3 — приемник холодильника с суженной нижней частью
4 — газоотводная трубка
5 – колпачок
2. Получение изоамилового эфира уксусной кислоты (изоамилацетата) и этилового эфира масляной кислоты (этилбутирата).
Чтобы получить сложные эфиры в малых количествах, используем простой прибор. 1. В широкую пробирку вставим узкую пробирку таким образом, чтобы одна треть широкой пробирки в ее нижней части оставалась незаполненной. Проще всего можно укрепить узкую пробирку с помощью нескольких кусочков резины, вырезанной из шланга или пробки. При этом необходимо учесть, что вокруг узкой пробирки обязательно нужно оставить зазор величиной не менее 1,5—2 мм, чтобы исключить избыточное давление при нагревании.
2. Теперь нальем в широкую пробирку 0,5—2 мл спирта и приблизительно столько же карбоновой кислоты, при тщательном охлаждении добавим 5—10 капель концентрированной серной кислоты.
3. Вставим внутреннюю пробирку, заполним ее снегом и укрепим собранный прибор в штативе. Прибор нужно поставить подальше от себя и не наклоняться над отверстием пробирки, потому что при неосторожном нагревании возможно разбрызгивание кислоты. Затем на самом малом огне спиртовки будем кипятить смесь не менее 15 минут.
Чем дольше нагревание, тем лучше выход. Внутренняя пробирка, заполненная снегом, служит обратным холодильником. По мере таяния снега нужно заменять пробирки на новые со свежим снегом и продолжать нагревание.
Уже до завершения опыта мы можем почувствовать приятный запах полученного сложного эфира, на который все же накладывается едкий запах хлористого водорода. После охлаждения реакционную смесь нейтрализуем разбавленным раствором соды и разделяем с помощью делительной воронки. По этой методике мы получили:
1) изоамиловый эфир уксусной кислоты (с запахом груши);
2) этиловый эфир масляной кислоты (с запахом ананаса).
2.2. Составление парфюмерных композиций
Первоначально в исследовательской части была заложена идея получения сложных эфиров из различных карбоновых кислот и спиртов имеющихся в школьной лаборатории. Затем эти эфиры следовало комбинировать в разные композиции. Но синтез эфиров оказался достаточно сложным, поэтому я попробовала получить хотя бы один сложный эфир, чтобы приобрести навык работы с лабораторным оборудованием, а духи решила комбинировать из эфирных масел, которые продаются в аптеках и магазинах.
Мне потребовалось:
1. Две основы (спирт и масло);
2. Несколько эфирных масел;
3. Бумажные полоски для проведения проб;
4. Закупоривающиеся сосуды;
5. Пипетки.
Создание своей формулы
На полоске бумаги я смешивала верхнюю, среднюю и базовую ноты. Слушала его звучание и продолжала экспериментировать до тех пор, пока не получила понравившийся мне аромат.
Затем нужно смешать верхнюю, сердечную и базовую ноты, перелить во флакончик и оставить на 15 минут.
Далее выбираем основу – спирт с водой или растительное масло. Спиртовая основа создаст парфюм очень стойкий, но его надо выдержать почти месяц. А на основе масла аромат будет мягче, несколько слабее и быстрее улетучится. Зато духи на масляной основе можно не выдерживать месяц, а пользоваться сразу.
-
Масляная основа
В качестве масляной основы я брала вещество, широко используемое в парфюмерии, полисорбат-20, который может растворять как воду, так и масло.
После выбора подходящих сочетаний, я смешивала масла в пробирке, затем добавляла полисорбат-20. Количество основы должно быть равным смеси парфюмерных масел. После этого добавляла в пробирку чистую воду. Количество воды должно составлять не менее 50% от объема основы с масляной смесью.
Духи почти готовы, осталось только перелить их во флакон и поставить в темное прохладное место на два-три дня. По прошествии времени запах духов станет значительно насыщеннее и богаче.
На масляной основе я получила 2 аромата:
№1.Лаванда – 2 к.
Роза – 2 к.
Пачули – 2 к.
№2. Пачули – 3 к.
Нероли – 2 к.
Бергамот – 1 к.
-
Спиртовая основа
Методика со спиртовой основой такая же, единственное отличие в пропорциях. Если вы берёте за основу масло, то соотношение «масляная основа – эфирные масла» должно быть 1:1. Если спиртовая основа, то соотношение таково: спирт-70%, вода -5%, эфирные масла -25%.Затем все перемешать и дать настояться 3-4 недели в темном месте.
На спиртовой основе я получила 3 аромата:
№3. Жасмин – 3 к.
Нероли – 3 к.
Мандарин – 4 к.
№4. Мелисса – 3 к.
Лаванда – 3 к.
Бергамот – 2 к.
Мандарин – 6 к.
№5. Лаванда – 2 к.
Бергамот – 1 к.
Кедр – 3к.
Мандарин – 1 к.
Заключение
Выводы и результаты
В результате исследовательской работы были получены сложные эфиры: этилацетат, этилбутират с запахом ананаса, изоамилацетат с запахом груши, а так же 5 различных ароматных композиций, две из которых на масляной основе, и три на спирту. Мне захотелось иметь духи, которые есть только у меня, и это оказалось очень даже возможно. Таким образом, подтвердилась гипотеза, выдвинутая мной в начале работы.
Приготовить чудесный аромат из эфирных масел, оказывается, не так уж и сложно. Начинать, конечно, надо с самого главного — теоретических знаний, которые я почерпнула из различных учебников и сайтов в интернете. Понятно, что для полного успеха необходимо приобрести определенный опыт, но, во всяком случае, теперь у меня собралась небольшая «коллекция» ароматов, которые мне нравятся.
Я поняла, что в ходе работы мне удалось приобрести два важнейших инструмента: знания и навыки по данной теме и теперь я могу делать подарки своим друзьям и близким в виде духов, предназначенных специально для них. Я буду творить и создавать новые ароматы!
Список использованной литературы и Интернет-ресурсов
-
http://www.izuminki.com/
-
http://www.krugosvet.ru/
-
http://orpheusmusic.ru/
-
https://ru.wikipedia.org/
-
http://www.himhelp.ru/
-
О. С. Габриелян, Химия. Профильный уровень. 10 класс, 11 класс.
Просмотров работы: 20911
Образование сложных эфиров
Спирты взаимодействуют с органическими и неорганическимиHO–NO2, (HO)2SO2, (HO)3P=O и т.п. гидроксилсодержащими кислотами, образуя сложные эфиры. Этот процесс называется реакцией этерификации (от древ.греч. αἰθήρ — эфир и лат. facio — делаю).
В реакции с органической кислотой спирт выступает как нуклеофил,Нуклеофил (любящий ядро) — реагент, имеющий неподелённую пару электронов на внешнем электронном уровне и способный предоставить эту пару для образования новой химической связи. отдавая неподелённую электронную пару атома кислорода на связь с электронодефицитным атомом углерода Сδ+ в молекуле кислоты.
Катализатор – сильная кислота (например, конц. H2SO4).
Аналогично происходит нуклеофильная атака молекулами спирта электронодефицитных атомов (N, S, P) в молекулах неорганических кислот
Реакционная способность спиртов при этерификации убывает с увеличением числа и размеров углеводородных радикалов. Первичные спирты активнее вторичных. Третичные и многие вторичные спирты в условиях кислотного катализа вступают в реакции элиминирования (отщепления H2O) с образованием алкенов.
Взаимодействие кислот и спиртов протекает обратимоДля смещения равновесия реакции в сторону образования эфира используют водоотнимающие средства и/или отгоняют образующийся эфир (т.кип. эфира ниже, чем у исходных спирта и кислоты из-за отсутствия ассоциирующих водородных связей). (обратный процесс – гидролиз сложных эфиров).
При использовании вместо кислот их более реакционноспособных производных – галогенангидридовГалогенангидриды — производные кислот, в которых гидроксильные группы заменены атомами галогена. или ангидридовАнгидриды органических кислот RCOOH – продукты (RCO)2O, образующие-ся при отщеплении одной молекулы воды от двух молекул кислоты.
Ангидриды неорганических кислот – кислотные оксиды, которые, присоединив воду, превращаются в кислоту. – реакция образования сложных эфиров практически необратима (пример
Некоторые сложные эфиры, в особенности сложные эфиры третичных спиртов, получают действием хлорангидридов или ангидридов на алкоголяты.
Название сложного эфира строится по названию углеводородного радикала в молекуле спирта (метил, этил и т.д.) с добавлением названия анионного остатка кислоты (ацетат, нитрат, сульфат, фосфат, карбонат и т.п.).
Часто сложные эфиры называют как спиртовые производные кислот, используя тривиальные названия последних. Например:
CH3O–СOCH3 – метиловый эфир уксусной кислоты (метилацетат),
C2H5O–NO2 – этиловый эфир азотной кислоты (этилнитрат) и т.п.
- Сложные эфиры органических кислот подробнее представлены в разделе «Карбоновые кислоты».
- Среди сложных эфиров неорганических кислот важное значение имеют нитраты, сульфаты, фосфаты и карбонаты.
Нитраты получают действием на спирты азотной кислотой или нитрующей смесьюНитрующая смесь — смесь концентрированных азотной и серной кислот, при взаимодействии которых образуется активная нитрующая частица NO2+ (катион нитрония):
2H2SO4 + HNO3 → NO2+ + H3O+ + 2HSO4–..
Эфиры азотной кислоты являются взрывчатыми веществами (BB). На этом основано их использование во взрывотехнике, в производстве компонентов твёрдого ракетного топлива и бездымного пороха. Препараты из группы органических нитратов применяются в медицине как сосудорасширяющие средства при ишемической болезни сердца и стенокардии.
Наибольшее значение в производстве ВВ имеют нитраты многоатомных спиртов – глицерина, целлюлозы, пентаэритрита и т.п.
- Глицерин, в зависимости от условий проведения реакции и соотношения реагентов, может вступать в реакцию с азотной кислотой одной, двумя или тремя ОН-группами и образовывать моно-, ди- и тринитраты.
- Нитраты целлюлозы и пентаэритрита
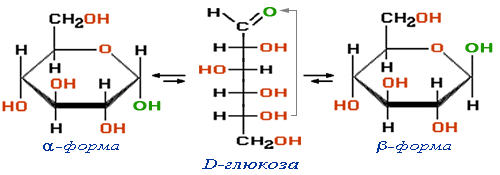
Целлюлоза (клетчатка) – полимер β-глюкозы
Спиртовые группы ОН выделены красным цветом
(зелёным отмечен полуацетальный гидроксил)., в каждом звене которого содержится 3 ОН-группы, при действии нитрующей смесью (HNO3+H2SO4) образует нитроцеллюлозу:В зависимости от условий проведения реакции и соотношения реагентов могут быть получены мононитрат, динитрат или тринитрат целлюлозы.
Нитроцеллюлоза — крупнотоннажный продукт в производстве бездымного пороха, ранее применялась для получения целлулоида и нитроэмалей.
Пентаэритрит (четырёхатомный спирт) при действии 5-ти кратным избытком 93-99% азотной кислоты, свободной от оксидов азота, образует тетранитрат пентаэритрита (пентаэритриттетранитрат, ТЭН).
Пентаэритриттетранитрат (ТЭН) используется в качестве инициирующего (детонирующие шнуры, детонаторы) и бризантного (в кумулятивных снарядах) взрывчатого вещества

Тривиальное название «нитроглицерин» даёт неверное представление о строении этого вещества, так как приставка «нитро» используется в названиях нитросоединений R-NO2 (например, CH3NO2 — нитрометан, C6H5NO2 — нитробензол).
Для устранения опасности самопроизвольного взрыва тринитрат глицерина наносится на твёрдый мелкопористый инертный носитель. Таким способом получают динамит. Создателем и основателем производства этого взрывчатого вещества был знаменитый шведский инженер-химик А.Нобель.
Сульфаты. Серная кислота
, являясь двухосновной, образует со спиртами сложные эфиры двух типов: кислыеКислые эфиры, сохраняющие кислотные функции (группу О-Н), называют также соответствующими кислотами. – алкилсульфаты (алкилсерные кислоты) и средние – диалкилсульфаты.
Алкилсульфаты малостабильны и существуют в виде равновесной смеси:
Равновесие смещается вправо путём отгонки диалкилсульфата.
Сульфаты образуют прежде всего первичные спирты. Для вторичных и третичных спиртов более характерны реакции дегидратации с образованием алкенов.
Для получения сульфатов вместо серной кислоты обычно используют более активные её производные: SO3 (серный ангидрид), SO2Cl2 (хлорангидрид серной кислоты, сульфурилхлорид), HSO3Cl (монохлорангидрид серной кислоты, хлорсульфоновая кислота).
Алкилсульфаты применяются в органическом синтезе как алкилирующие агенты (для введения алкильной группы).
Практическое значение имеют соли высших алкилгидросульфатов (алкилсерных кислот) в качестве поверхностно-активных веществ (ПАВ) различного назначения: моющие средства, эмульгаторы при полимеризации, смачиватели в производстве целлюлозы, мягчители шелка, антистатики полимеров и т.п. Один из наиболее известных представителей ПАВ — лаурилсульфат натрия
(додецилДодецил -С12Н25 — радикал алкана додекан С12Н26 (от греч.числительного додека — 12). В названии радикала заменяется глухая согласная «к» на «ц». сульфат натрия) CH3(CH2)11OSO3Na, который входит в состав большинства моющих средств, шампуней, зубных паст и др. Это соль лаурилсерной кислоты, образованной взаимодействием лаурилового спирта (додеканола-1) и хлорсульфоновой кислоты (монохлорангидрида серной кислоты):
С12Н25ОН + HSO3Cl → C12H25OSO2OH + HCl
Природные органические сульфаты входят в группу биополимеров соединительных тканей животных. К ним относятся сульфаты полисахаридовПолисахариды — высокомолекулярные углеводы, полимеры моносахаридов (например, полисахарид целлюлоза состо-ит из звеньев моносахарида глюкозы).: хиндроитинсульфаты (например, хондроитин-6-сульфат
гепарин
Фосфаты — сложные эфиры трёхосновной фосфорной кислоты H3PO4 трёх видов: кислые RОРО(OН)2, (RО)2РО(OН) и полные (RО)3РО.
Cинтез фосфатов основан на реакции хлорангидрида фосфорной кислоты POCl3 со спиртами или фенолами:
3ROH + POCl3 
Атомы Cl в POCl3 можно последовательно замещать на различные группы RO. Образующиеся первоначально хлорфосфаты при гидролизе превращаются в кислые фосфаты.
Многоатомные спирты способны вступать в реакцию поликонденсации и образовывать сложные полиэфиры фосфорной кислоты (фосфорорганические полимеры):
Применение. Органические фосфаты широко используются в качестве добавок для модификации пластмасс: пластификаторы, антипирены (для повышения огнестойкости) и др.; применяются как экстрагенты радиоактивных элементов из отработанного ядерного горючего и редко-земельных элементов из минерального сырья, флотореагенты, биологически безвредные ингибиторы коррозии металлов, лекарственные средства, пестициды и др. Некоторые фосфаты токсичны, а такие из них как зарин
Роль в природе. Исключительно важное значение имеют фосфаты углеводов (сахаров), являющихся многоатомными спиртами. Фосфаты сахаров содержатся во всех растительных и животных организмах. Они участвуют в биохимических процессах фотосинтеза и обмена веществ. Универсальным источником энергии для реакций, протекающих в живых системах, служит аденозинтрифосфат (АТФ)
АТФ — аккумулятор и переносчик химической энергии в живых клетках..
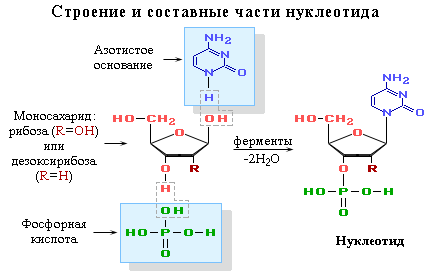
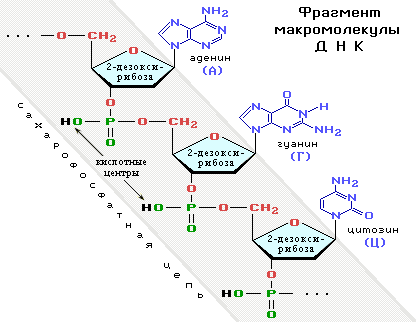
Фосфаты рибозы и дезоксирибозы
Нуклеотиды — мономерные звенья и промежуточные продукты
биосинтеза нуклеиновых кислот (ДНК, РНК) и нуклеотидкоферментов., которые при участии ферментов путём поликонденсации образуют полинуклеотиды (нуклеиновые кислоты
ДНК и РНКДНК — дезоксирибонуклеиновая кислота,
РНК — рибонуклеиновая кислота.). При этом взаимодействуют спиртовая ОН-группа одного нуклеотида с фосфатной группой другого. В результате образуется сахарофосфатная цепь макромолекул ДНК и РНК, состоящая из чередующихся остатков фосфорной кислоты и углевода (рибозы в РНК и дезоксирибозы в ДНК). Таким образом, все макромолекулы нуклеиновых кислот имеют единый сахарофосфатный остов,
а уникальность структур и функций этих биополимеров определяется набором и последовательностью
азотистых оснований
Азотистые основания — N-содержащие гетероциклические соединения: аденин, гуанин, цитозин, входящие в состав ДНК и РНК; тимин содержится только в ДНК, а урацил — только в РНК (подробнее см. Часть IV, «Гетероцикличес-кие соединения»). — боковых заместителей в главной цепи
(схема).
Схематически структуру макромолекул нуклеиновых кислот можно представить формулой:

О-сахар-О — остаток рибозы в РНК или дезоксирибозы в ДНК.
В живых клетках при рН≈7 фосфатные группы ионизированы.
Карбонаты — сложные эфиры угольной кислоты — образуются при взаимодействии фосгена COCl2 (полного хлорангидрида угольной кислоты) со спиртами или фенолами при повышенных температурах.
2ROH + COCl2 → RO–CO–OR + 2HCl
Практическое значение имеет производство поликарбонатовПоликарбонаты — сложные полиэфиры угольной кислоты и двухатомных фенолов или спиртов с общей формулой (-O-R-O-CO-)n., получаемых
при поликонденсации бисфенола АСистематическое название бисфенола А:
2,2-бис(4-гидроксифенил)пропан.
Часто употребляется техническое название – дифенилолпропан. (дианаДиан – название бисфенола А, данное в честь русского химика Александра Дианина, впервые получившего это соединение (1891 г.).) и фосгена:
Поликарбонат отличается высокой светопроницаемостью, ударопрочностью и термостойкостью. Благодаря сочетанию этих свойств, данный полимерный материал нашел широкое применение в строительстве и других отраслях народного хозяйства

Поликарбонат — инновационный материал, который, благодаря своим исключительным характеристикам, (высокая светопроницаемость, ударопрочность и термостойкость), нашел широкое применение в строительной сфере, в производстве светотехнических и оптических изделий и т.п.
Наиболее популярный в России формат применения — листовой поликарбонат: ячеистый (сотовый поликарбонат)


Разнообразность применения листового поликарбоната связана с уникальным комплексом свойств: прозрачность, легкость, прочность, долговечность (при наличии УФ защитного слоя).
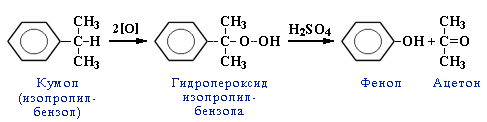
Благодаря высокой прочности и ударной вязкости (250-500 кдж/м2), поликарбонат применяется в качестве конструкционного материала в различных отраслях промышленности, используется при изготовлении защитных шлемов для экстремальных дисциплин вело- и мотоспорта. При этом для улучшения механических свойств применяются и наполненные стекловолокном композиции.
Важным фактором является экономичность и технологичность производства поликарбоната на основе диана, получаемого из доступных исходных веществ — фенола и ацетона — продуктов кумольного метода.